واکنش آلی در شیمی – از صفر تا صد
اگر به کتابهای شیمی و به طور ویژه به کتابهای شیمی آلی نگاه کرده باشید، با تعداد بسیار زیادی از واکنشهای مختلف روبرو خواهید شد. این واکنشها در حقیقت، ابزار کار یک شیمیدان به شمار میآیند و بمنظور بکارگیری مناسب این ابزار، باید آنها را با روشی مناسب، سازماندهی کنیم. به همین منظور در این مطلب، الگوهای مختلف واکنش پذیری را در واکنش آلی بررسی میکنیم تا بتوانیم نتایج حاصل از این نوع واکنش را پیشبینی کنیم.


واکنش آلی معمولا در محلهای ویژهای موسوم به گروههای عاملی اتفاق میافتند و به کمک این گروهها میتوانیم سازماندهی مناسبی را برای واکنشها و میزان واکنشپذیری در نظر بگیریم. در حقیقت، بهترین روش برای تسلط بر شیمی آلی، فهم دقیق نحوه انجام واکنشها و عوامل موثر بر آنها است. برای این کار نیز باید با مکانیسم واکنشهای شیمیایی و مسیرهای واکنش، آشنا باشیم.
مقدمه
شیمی آلی شامل واکنشهای بسیار زیادی است که با شناخت ترکیبهای اصلی این واکنشها، به تعریفی مفهومی از این علم خواهیم رسید. قبل از شروع بهتر است تا با برخی عبارات و اصطلاحات در شیمی آشنا شویم.
- واکنش شیمیایی: فرآیند تبدیلی که در نتیجه تغییر یک ترکیب یا آرایش مواد واکنشدهنده (سوبسترا) شکل میگیرد.
- واکنشدهنده (سوبسترا): ترکیبات آلی که در یک واکنش شیمیایی، دچار تغییر میشوند. در بیشتر موارد، واکنشدهنده، مولکول بزرگتر و پیچیدهتری است.
- ریجنت: ریجنت، ماده یا ترکیبی است که به سیستم اضافه میکنند تا یک واکنش شیمیایی انجام شود یا از آن برای آزمون انجام یک واکنش بهره میگیرند. عبارات واکنشدهنده و ریجنت به طور معمول به جای یکدیگر در شیمی مورد استفاده قرار میگیرند اما با این وجود، یک واکنشدهنده، به مادهای میگویند که در طول یک واکنش شیمیایی، به مصرف برسد.
- فرآورده: شکل نهایی که در اثر انجام واکنش در واکنشدهندهها بوجود میآید، موسوم به فرآورده است.
- شرایط واکنش: شرایط انجام بهینه واکنش همچون دما، فشار، کاتالیزور و حلال، شرایط واکنش نام دارد.
طبقه بندی واکنش های شیمیایی بر اساس تغییر ساختارها
در ابتدا، چهار دسته از واکنشها را بر اساس «تغییرات ساختاری» (Structural Change) مشخص میکنیم که این تغییرات در مولکولهای واکنشدهنده رخ میدهند.
به هنگام بررسی واکنش پذیری و همچنین واکنشهای شیمیایی، از حرف R کمک میگیرند که بیانگر گروههای «جانشین» (Substituents) یا استخلافی همچون یا یا گروههای پیچیدهتر متشکل از اتمهای کربن و سایر عناصر هستند.
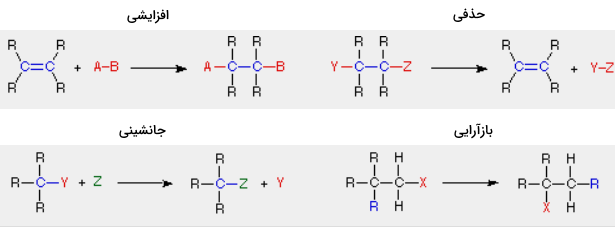
در یک «واکنش افزایشی» (Addition Reaction)، تعداد پیوندهای سیگما در مولکول سوبسترا (واکنشدهنده) افزایش پیدا میکند. عکس این حالت در «واکنشهای حذفی» (Elimination Reactions) روی میدهد به این معنی که تعداد پیوندهای سیگما در واکنشدهنده کاهش پیدا میکنند و معمولا پیوندهای جدید پای تشکیل میشوند.
واکنشهای جانشینی، همانطور که از نامشان پیداست شامل جانشینی یک اتم یا گروه (Y) با اتم یا گروه دیگری (Z) هستند. جدا از این گروهها، تعداد پیوندها تغییری نمیکنند. یک واکنش بازآرایی (نوآرایی)، به تولید یک ایزومر منجر میشود و در اینجا نیز تعداد پیوندها تغییری نمیکنند.
مثالهایی که در بالا نشان داده شدهاند، شامل سیستمهای ساده آلکیل و آلکن هستند اما این نوع از واکنشها در بیشتر گروههای عاملی شامل پیوندهای دوگانه کربن-اکسیژن و پیوندهای دوگانه و سهگانه کربن-نیتروژن، صدق میکنند. برخی از واکنشها ممکن است ترکیبی از واکنشهای بالا باشند. در تصویر زیر، واکنش یک استر با آمونیاک برای تشکیل یک آمید نشان داده شده است. این واکنش در حقیقت، شامل یک واکنش افزایشی و به دنبال آن، واکنشی حذفی خواهد بود.
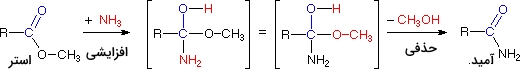
اضافه کردن آب به یک نیتریل، هیچکدام از انواع واکنش بالا را در بر نمیگیرد اما در حقیقت، واکنش افزایشی آهسته و در پی آن، واکنش بازآرایی سریع خواهیم داشت. به این نوع از واکنش های بازآرایی سریع، «توتومریزاسیون» (Tautomerization) میگویند.
طبقه بندی واکنش های شیمیایی بر اساس نوع واکنش
به هنگام بررسی واکنش پذیری شیمیایی بهتر است تا توضیح مختصر و کوتاهی در خصوص واکنشهای معمول و پرتکرار در شیمی داشته باشیم.
خاصیت اسیدی و بازی
در ابتدا، توضیحی در خصوص نظریه اسید و باز در شیمی و واکنشهای آن خواهیم داشت. واکنشهای اسید و باز جزو سادهترین و قابل فهمترین واکنشهای شیمیایی به شمار میآیند. در بررسی واکنش پذیری شیمیایی، برخی از ترکیبات را میتوان از منظر اسیدی یا بازی بودن مورد بررسی قرار داد.
همچنین، بسیاری از واکنشهای آلی به کمک اسیدها یا بازها کاتالیز میشوند. برای فهم بهتر خاصیتهای اسیدی و بازی باید با نظریه اسید و باز برونستد و لوویس آشنا شویم.
نظریه برونستد
بر اساس نظریه برونستد، اسید یک دهنده پروتون و باز یک گیرنده پروتون به شمار میآید. در یک واکنش اسید-باز، در هر قسمت از واکنش تعادلی، یک اسید و یک باز به عنوان واکنش دهنده یا فرآورده داریم که میتوانند به صورت ذرات خنثی یا یون باشند.
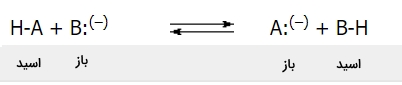
به صورت ساختاری، جفتهای اسید-باز همچون و $$A \: ^ {(-)}$$
قدرت نسبی گروهی از اسیدها یا بازها را میتوان با سنجش میزان شرکت در واکنش بررسی کرد. در چنین واکنشهایی، آب را میتوان به عنوان باز یا اسید بکار برد. در نتیجه، قدرت یک اسید، به میزان شرکتپذیری آن در واکنش با آب (به عنوان یک باز) بستگی دارد. این مفهوم به کمک ثابت تعادل بیان میشود.
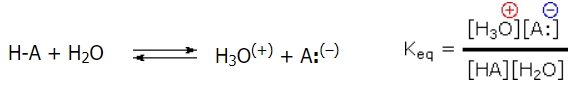
در رابطه بالا، با توجه به اینکه غلظتها به طور معمول به صورت رقیق بیان میشوند، غلظت مولی آب ثابت فرض خواهد شد و آنرا از مخرج حذف میکنند. مقدار حاصل، موسوم به «ثابت اسید» (Acidity Constant) یا ثابت تفکیک است که به نشان میدهند. اسیدهای قوی، نسبت به اسیدهای ضعیف، بزرگتری دارند. از آنجایی که به طور معمول، این عدد، مقدار بزرگی دارد، از لگاریتم آن (بر پایه ۱۰) بمنظور بیان قدرت اسید استفاده میکنند و آنرا با نشان میدهند. اسیدهای قوی، مقدار کوچکتر یا منفیتری دارند.
از آنجایی که بسیاری از واکنشهای آلی در محیطهای «آبی» (Aqueous) انجام میگیرند، بررسی تعادل جفتهای اسید و باز به صورت تعادلی و تغییر آنها با pH باید در نظر گرفته شود. به همین منظور، از رابطهای به نام رابطه «هندرسون-هاسلباخ» (Henderson - Hasselbach) استفاده میکنیم.
زمانیکه pH یک محلول آبی یا مخلوط، برابر با یک جزء اسیدی باشد، غلظت اسید و باز مزدوج آن باید برابر باشند. اگر مقدار pH به میزان یک یا دو واحد کاهش پیدا کند، غلظت باز مزدوج آن بیش از ۹۹ درصد افزایش پیدا خواهد کرد.
خاصیت بازی
خاصیت بازی ترکیبات یا یونهای اکسیژن، نیتروژن، گوگرد و فسفر را میتوان به روشی مشابه بررسی کرد. به این ترتیب، تعادل باز-اسید را با و تعریف میکنیم. همچنین، در خصوص اسیدها و بازها، قانون زیر صدق میکند:
با وجود اینکه در سیستمهای معمول حلال میتوان مقادیر تعریف کرد اما این کار با محدودیتهایی نیز برای اسیدهای بسیار قوی و بسیار ضعیف مواجه است. اسیدهایی که قویتر از کاتیون هیدرونیوم () و اسیدهای ضعیفی که باز مزدوجی قویتر از آنیون هیدروکسید داشته باشند را نمیتوان به طور مستقیم در محلول آبی اندازهگیری کرد. محلولهایی همچون استیک اسید، استونیتریل و نیترومتان به طور معمول برای مطالعه اسیدهای بسیار قوی در نظر گرفته میشوند.
به طور مشابه نیز از محلولهای بسیار ضعیف اسیدی همچون «DMSO»، استونیتریل، تولوئن، آمینها و آمونیاک برای مطالعه واکنش پذیری و خاصیت اسیدی در اسیدهای بسیار ضعیف استفاده میشود.
نظریه لوییس
بر اساس نظریه لوویس، اسید به پذیرنده جفتالکترون و باز به دهنده جفتالکترون میگویند. بازهای لوییس همچنین بازهای برونستد نیز به شمار میآیند. با این وجود، بسیاری از اسیدهای لوییس همچون ، و ، اسید برونستد نیستند. فرآورده واکنش اسیدباز لوویس میتواند یک کمپلکس خنثی، دوقطبی یا باردار باشد که به طور معمول، مولکولی کووالانسیِ پایداری است. دو نمونه از واکنشهای تعادلی اسید-باز لوییس در تصویر زیر نشان داده شدهاند:
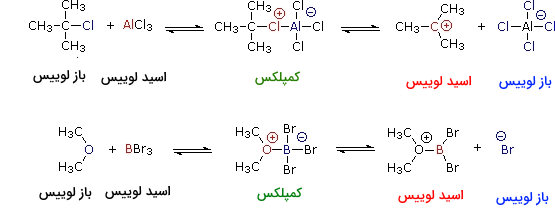
در مثال اول، آلومینیوم فقیر از الکترون، با اشتراکگذاری یکی از جفتالکترونهای ناپیوندی، با اتم کلر پیوند کووالانسی تشکیل میدهد و به آرایش الکترونی مشابه با گاز نجیب آرگون میرسد و قاعده اکتت را تکمیل میکند. از آنجایی که در این واکنش، اتم کلر، هر دو الکترون را تامین میکند، الکترون و آلومینیوم، هردو دارای بار قراردادی هستند. اگر در این کمپلکس، پیوند کربن-کربن شکسته شود و الکترونهای پیوندی نزد اتم الکترونگاتیوترِ کلر باشند، فرض میشود که اتم کربن، بار مثبت داشته باشد. به این نوع از کربنها، کربوکاتیون میگوییم. کربوکاتیونها همچنین، اسیدهای لوییس به شمار میآیند.
بسیاری از کربوکاتیونها میتوانند در نقش اسید برونستد نیز ظاهر شوند. تصویر زیر ، نمونهای از این رفتار دوگانه را نشان میدهد. محل اسید لوییس با رنگ قرمز و سه هیدروژن از ۹ هیدروژن اسیدی نیز با رنگ آبی نشان داده شدهاند. زمانیکه کربوکاتیون، نقش اسید برونستد داشته باشد، یک پروتون به باز (آنیون هیدروکسید) میدهد و به مولکول خنثی تبدیل میشود که پیوند دوگانه کربن-کربن دارد.
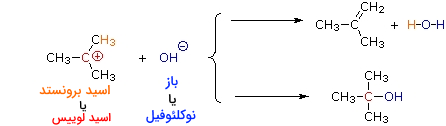
در شیمی آلی، به جای اسید و بازهای لوییس، به ترتیب از واژههای «الکتروندوست» (Electrophile) و «هستهدوست» (Nucleophile) استفاده میشود.
واکنش های اکسایش و کاهش (ردوکس)
روشی موازی و مجزا برای بررسی واکنش آلی را باید در واکنشهای ردوکس جستجو کرد. اتمهای کربن، بسته به گروههای جانشین آنها، عدد اکسایشی از تا را شامل میشوند. خوشبختانه نیازی نیست تا مقدار مطلق عدد اکسایش هر اتم کربن در مولکول را تعیین کنیم بلکه تنها تغییرات عدد اکسایش کربنهای شرکت کننده در واکنش را در نظر میگیریم.
برای اینکه ببینیم اتم کربنی در یک واکنش ردوکس شرکت کرده است یا نه، تغییرات تعداد پیوندها به هیدروژن و تعداد پیوندها به اتمهای الکترونگاتیوتر همچون اکسیژن، نیتروژن، فلوئور، برم، ید و گوگرد را در نظر میگیریم. پیوند به سایر اتمهای کربن، در نظر گرفته نمیشود. این محاسبات باید برای اتم کربنِ تغییر کرده در طول واکنش، به شکل زیر لحاظ شوند:
- اگر تعداد اتمهای هیدروژن متصل به کربن، افزایش یا اگر تعداد پیوندها به اتم الکترونگاتیوتر کاهش پیدا کنند، کربن مورد نظر، کاهش پیدا کرده که یعنی عدد اکسایش آن کمتر شده است.
- اگر تعداد اتمهای هیدروژن متصل به کربن کاهش یا تعداد پیوندها به اتم الکترونگاتیوتر افزایش پیدا کنند، کربن مورد نظر، دچار اکسایش شده است. که یعنی عدد اکسایش بالاتری به آن اختصاص پیدا میکند.
- درصورتیکه هیچ تغییری در تعداد پیوندها رخ ندهد، در نتیجه، تغییری در عدد اکسایش کربن انجام نشده است.
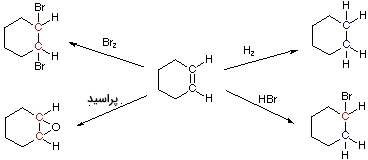
در تصویر زیر، چهار واکنش افزایشی حاصل از واکنشدهنده سیکلوهگزان، نمایش داده شده است. اتمهای کربن آبیرنگ، کاهش و کربنهای قرمزرنگ، اکسایش پیدا کردهاند. زمانی که هیدروژن اضافه میکنیم، هر دو اتم کربن، کاهش مییابند و واکنش کلی به صورت یک واکنش کاهشی خواهد بود. اپوکسیداسیون پراسید و اضافه کردن برم، هر دو اتم کربن را اکسید میکنند و در نتیجه، به آنها واکنشهای اکسایش میگویند. اضافه کردن ، یکی از اتمهای کربن با پیوند دوگانه را کاهش میدهد و دیگری را اکسید میکند. در نتیجه، هیچ تغییر اکسایش و کاهشی در مولکول مورد نظر نخواهیم داشت.
در بررسی واکنش آلی از آنجایی که فلزاتی همچون لیتیوم و منیزیم، الکترونگاتیوی کمتری نسبت به هیدروژن دارند، پیوند کووالانسی آنها با کربن به گونهای قطبیده میشود که کربن، منفی و فلز، مثبت باشد.
طبقه بندی واکنش پذیری بر اساس گروه عاملی
در بررسی واکنش آلی و همچنین واکنش پذیری شیمیایی، میتوان دستهبندیهای مختلفی را بر اساس گروههای عاملی انجام داد. یک گروه عاملی خاص، همواره رفتار شیمیایی مشخصی را در یک ترکیب از خود نشان میدهد. به همین دلیل، برای سازماندهی واکنش آلی از گروههای عاملی بهره میگیرند. جدول زیر، خلاصهای از رفتار شیمیایی گروههای عاملی معمول در ترکیبات آلی را نشان میدهد.
| نوع ترکیب | فرمول | واکنشهای اصلی |
| آلکانها | واکنشهای جانشینی به کمک کلر و برم
واکنشهای سوختن | |
| آلکنها | واکنشهای افزایشی و جانشینی | |
| آلکینها | واکنشهای افزایشی و جانشینی | |
| آلکیل هالیدها | واکنشهای جانشینی و حذفی | |
| الکلها | واکنشهای جانشینی، حذفی و اکسایش | |
| اترها | واکنشهای جانشینی | |
| آمینها | واکنشهای جانشینی، افزایشی و اکسایش | |
| حلقه بنزنی | واکنش جانشینی | |
| آلدهیدها | واکنشهای افزایشی و جانشینی | |
| کتونها | واکنشهای افزایشی و جانشینی | |
| کربوکسیلیک اسیدها | واکنشهای جانشینی و افزایشی |
موارد متغیر در واکنش آلی
در بررسی نحوه انجام واکنشهای مختلف در گروههای عاملی، دانشمندان متوجه نحوه برهمکنش مولکولها و یونهای مختلف با یکدیگر شدند. به همین دلیل، باید خواص و مشخصههای مختلف واکنشهای آلی را به هنگام پیشرفت واکنش، در نظر گرفت که در ادامه سعی داریم به بیان این مشخصهها بپردازیم.
واکنشدهندهها و ریجنتها
از جمله موارد متغیر در واکنش آلی را باید در ساختار واکنشدهندهها و مشخصههای ریجنتها جستجو کرد.
ساختار واکنشدهنده
تغییرات در ساختار واکنشدهنده، حتی اگر نوع گروه عاملی تغییر نکند، ممکن است تاثیر بسیاری در انجام واکنش داشته باشد. بنابراین، واکنش ۱-بروموپروپان با سدیم سیانید، پیشرفت آرامی دارد تا بوتیرونیتریل تولید شود، درحالیکه ۱-برمو-۲و۲و-دیمتیل پروپان، هیچ ترکیبی بدست نمیدهد. در مقابل، هر دو ساختار آلکیل برمید، در واکنش با منیزیم، واکنشگر گرینیارد را تولید میکنند.

مشخصههای ریجنت
تغییر کمی در ریجنت میتواند تغییرات بسیاری را در پیشرفت واکنش ایجاد کند. به طور مثال، ۲-برمو پروپان با سدیم متیل تیولات، واکنش جانشینی بدست میدهد اما با سدیم متوکسید، واکنش حذفی خواهیم داشت.
گزینش پذیری فرآورده
مورد دیگری که باید به هنگام بررسی واکنش آلی در نظر گرفت، «گزینشپذیری» (Selectivity) است. در این خصوص باید به توضیح مواردی همچون «جهتگزینی» (Regioselectivity)، «فضاگزینی» (Stereoselectivity) و «فضاویژگی» (Stereospecificity) پرداخت.
جهتگزینی
در بیشتر موارد، واکنشهای افزایشی و حذفی، بیش از یک فرآورده تولید میکنند. به همین دلیل، با افزودن به ۱-بوتن، بسته به اینکه کدام اتم کربن در پیوند دوگانه، هیدروژن و کدامیک، برم را میپذیرند، ۱-برمو بوتان یا ۲-برمو بوتان خواهیم داشت. اگر یکی از فرآوردهها نسبت به دیگری، با میزان بیشتری تولید شود، میگوییم واکنش دارای جهتگزینی است.

واکنشهای جانشینی ساده را نمیتوان جهتگزین در نظر گرفت چراکه طبق تعریف، تنها یک فرآورده خواهیم داشت. با این وجود، در برخی واکنشها، بازآرایی خواهیم داشت.
فضاگزینی
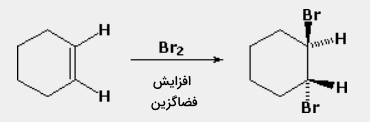
اگر فرآوردههای واکنش به گونهای باشند که ایزومرهای فضایی داشته باشیم، واکنشی که در آن، ترجیحا یک ایزومر نسبت به دیگری بیشتر تولید شود موسوم به فضاگزین است. به طور مثال، در زمان افزودن برم به سیکلوهگزان، ایزومرهای سیس و ترانس ۱و۲-دیبرموسیکلوهگزان، هر دو جزو فرآوردههای محتمل به شمار میآیند. از آنجایی که تنها، ایزومر ترانس تولید میشود، این واکنش را فضاگزین مینامیم.
فضاویژگی
این واژه در شرایطی استفاده میشود که واکنشدهندهها به صورت ایزومرهای فضایی باشند و رفتار متفاوتی در واکنش از خود نشان دهند. به طور مثال، دو واکنش زیر را در نظر بگیرید:

در واکنشهای بالا، واکنشدهنده R، فرآورده S بدست میدهد واکنشدهنده S، فرآورده R تولید میکند.
مشخصههای واکنش آلی
در ادامه متن، به هنگام بررسی واکنش پذیری در واکنش آلی به مشخصههای یک واکنش از جمله سرعت واکنش و مواد واسط خواهیم پرداخت:
سرعت واکنش
برخی از واکنشها به سرعت پیش میروند و برخی دیگر آنقدر آهسته هستند که روند انجام آنها قابل مشاهده نیست. متغیرهایی که بر سرعت واکنش تاثیر میگذارند عبارتند از:
- دما
- نوع حلال
- غلظتهای حلال و حلشونده
این موارد در بحثهای سینتیک شیمیایی و سرعت واکنش اهمیت پیدا میکنند.
مواد واسط
بسیاری از واکنشها به صورت مرحلهای پیشروی میکنند. در هر مرحله، فرآوردههایی تولید میشوند که نقش واکنشدهنده برای مرحله بعد را دارند. برخی از این مواد واسط، ترکیبات پایداری هستند. با این وجود، واکنشپذیری برخی دیگر آنقدر زیاد است که نمیتوان این مواد واسط را به طور جداگانه مورد بررسی قرار داد. با اینحال، وجود این مواد را از راههای دیگری همچون طیفسنجی یا تفسیر سینتیک واکنش بررسی میکنند.
عوامل تاثیرگذار بر واکنش
برای آشنایی با واکنش آلی بهتر است تا با برخی از ویژگیهای آزمایش، آشنا باشیم. برخی از عوامل تاثیرگذار بر واکنش در زیر آورده شدهاند.
- انرژی واکنش: انرژی پتانسیل یک سیستم، به هنگام پیشرفت واکنش، تغییر میکند. این تغییرات کلی میتواند به صورت «گرماگیر» (Endothermic) یا «گرماده» (Exothermic) باشد. همچنین، همواره برای راهاندازی واکنش آلی به یک حداقل انرژی موسوم به انرژی اکتیواسیون (فعالسازی) نیاز داریم. به طور معمول از جداول انرژی پیوند برای تخمین میزان انرژی در یک واکنش بهره میگیرند. به طور کلی، ترکیباتی که شامل پیوندهای قوی کووالانسی باشند، پایداری بیشتری نسبت به سایر ترکیبات با یک یا چند پیوند ضعیفتر دارند.
- تاثیر الکترونی: توزیع الکترونها در محل انجام واکنش (گروههای عاملی)، از جمله موارد مهم در بررسی واکنش پذیری و واکنش آلی به شمار میآید. گروهها یا ذرات فقیر از الکترون، به گروههای غنی از الکترون جذب میشوند. به این نوع از گروهها، الکتروندوست (الکتروفیل) و هستهدوست (نوکلئوفیل) میگوییم. توزیع بار در یک مولکول به طور معمول به کمک دو اثر برهمکنشی توصیف میشود:
-
- «اثر القایی» (Inductive Effect): این اثر، تابعی از اختلاف الکترونگاتیوی بین اتمها و گروهها است.
- «اثر رزونانس» (Resonance Effect): در این حالت، الکترونها با الگوهایی غیر معمول بین بخشهای مختلف یک مولکول در حرکت هستند.
- «اثر فضایی» (Steric Effect): اتمها، فضا اشغال میکنند. زمانیکه این اتمها در کنار یکدیگر جمع شوند، نیروهای دافعه واندروالس سبب ایجاد «ممانعت فضایی» (Steric Hindrance) خواهند شد. ممانعت فضایی بر «تعادل کانفورماسیونی» (Conformational Equilibria) نیز تاثیرگذار است و همچنین موجب ناپایداری حالت گذار واکنش میشود.
- «اثر استریوالکترونی» (Stereoelectronic Effect) یا اثر فضاالکترونی: در بسیاری از واکنشها، اوربیتالهای مولکولی یا اتمی به گونهای با یکدیگر واکنش میدهند که کنفیگراسیون (آرایش) بهینه یا ترازبندی هندسی مناسبی داشته باشند. در صورت فقدان این شرایط، انجام واکنش، ممکن نخواهد بود.
- اثر حلال: بسیاری از واکنشها در محلول انجام میشوند. حلالی که برای انجام واکنش انتخاب میشود، تاثیر بسیار زیادی در پیشرفت واکنش دارد.
مکانیسم واکنش آلی
توصیف دقیق تغییرات در ساختار و پیوندها به هنگام انجام واکنش، در مبحثی به نام مکانیسم واکنش بررسی میشود. مکانیسم واکنش باید شامل نمایشی منطقی از صورت جدید الکترونی به همراه تعیین مواد واسط تشکیل شده به هنگام پیشرفت واکنش باشد. این ویژگیها را در ادامه متن مورد بررسی قرار میدهیم.
فلشها در بیان مکانیسم واکنش
از آنجایی که واکنشهای شیمیایی شامل تشکیل و شکست پیوندها هستند، باید حرکت الکترونهای ظرفیت پیوندی و ناپیوندی را در طول واکنش، مد نظر قرار داد. حرکت الکترونها را به طور معمول از طریق فلشهای خمیده نشان میدهند. به توالی معادلات شیمیایی نشاندهنده این تحرکات الکترونی، مکانیسم میگویند. به طور کلی، از دو نوع فلش خمیده برای نمایش مکانیسم واکنش استفاده میشود:
- «فلش کامل» (Full Head): نشاندهنده جابجایی یا حرکت یک جفت الکترون است.
- «قلاب» (Fishhook): نشاندهنده جابجایی یک الکترون تنها است.
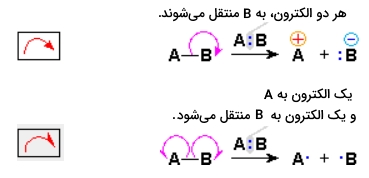
نحوه بکارگیری این نمادها برای نشان دادن تشکیل و شکست پیوندها، در تصویر زیر آورده شده است. اگر پیوند کووالانسی یگانه به گونهای شکسته شود که به هر «پیشماده» (Fragment)، یک الکترون اختصاص پیدا کند، به این نوع از شکست پیوند، «همکافت» (Homolysis) میگویند. اگر شکست پیوند به شکلی باشد که الکترونهای پیوندی در یک اتم باقی بمانند، به این شکست، «ناهمکافت» (Heterolysis) میگویند.
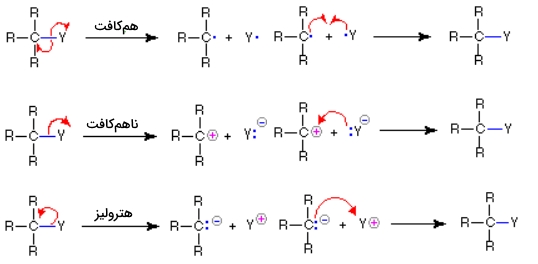
مواد واسط واکنش
فرآوردههایی که در طول شکست پیوند ایجاد میشوند، به طور معمول ترکیبات پایداری نیستند و نمیتوان برای مطالعه بیشتر، آنها را از واکنش جدا کرد. به چنین ذراتی، «مواد واسط» (Reactive Intermediates) یا مواد واسط فعال میگویند. ساختار عمومی و نام چهار نوع از این مواد واسط را در ادامه متن، ذکر خواهیم کرد اما پیش از ادامه متن باید دو عبارت مهم که در خصوص اسیدها و بازهای لوییس مورد استفاده قرار میگیرد را تعریف کنیم.
- الکتروفیل: به اتم، یون یا مولکولی که فقیر از الکترون باشد و به پذیرش یک جفت الکترون تمایل نشان دهد و با یک باز یا نوکلئوفیل پیوند تشکیل دهد.
- نوکلئوفیل: یک اتم، یون یا مولکولی که دارای یک جفت الکترون باشد. این جفت الکترون ممکن است به هنگام پیوند در اختیار الکتروفیل (اسید لوییس) قرار بگیرد.
با استفاده از این تعریفها میتوان دریافت که کربوکاتیونها، الکتروفیل و کربانیونها نوکلئوفیل هستند. کربِنها (Carbenes) تنها یک لایه ظرفیت دارند و فقیر از الکترون به شمار میآیند. در چنین شرایطی، این مواد، الکتروفیل هستند اما جفتالکترونهای غیرپیوندی نیز به کربِنها خاصیتی هستهدوست میدهد. به عنوان یک قانون، خاصیت الکتروفیلی، بر واکنش پذیری کربِنها احاطه دارد.
رادیکالهای کربن، تنها هفت الکترون ظرفیت دارند و ممکن است آنها را فقیر از الکترون بنامیم. با این وجود، رادیکالهای کربن به طور معمول با جفتالکترونهای نوکلئوفیل پیوند برقرار نمیکنند. در نتیجه، ماهیت شیمیایی آنها تفاوت ویژهای با سایر الکتروفیلها دارد. این نوع از رادیکالها را به طور معمول با نام رادیکال آزاد میشناسند.
اهمیت استفاده از عبارات الکتروفیل و نوکلئوفیل از این حقیقت ناشی میشود که بسیاری از واکنش آلی شامل پیوند یک هستهدوست به یک الکتروندوست هستند و در اثر این فرآیند، فرآورده یا ماده واسط پایداری به تولید میرسد. در برخی موارد، این نوع از واکنشها را با نام واکنشهای یونی میشناسند چراکه به طور معمول، در این نوع از واکنشها، واکنشدهنده یا فرآورده یونی داریم.
شکل مواد واسط
شکل این مواد واسط به هنگام در نظر گرفتن شیمی فضایی واکنشها، اهمیت پیدا میکنند. ترکیب ساده چهار ظرفتی همچون متان، شکلی چهاروجهی دارد. کربوکاتیونها تنها شامل سه پیوند به اتم کربن باردار هستند و در نتیجه، شکل سهضلعی مسطح خواهند داشت. شکل کربانیونها به صورت هرمی است اما این ذرات به سرعت در دمای اتاق تغییر شکل میدهند. رادیکالها نیز کنفیگراسیونی گذرا دارند و اختلاف انرژی بین شکلهای هرمی و مسطح در آنها بسیار کوچک است. از آنجایی که با سه نقطه میتوان یک صفحه را مشخص کرد، شکل کربِنها نیز باید مسطح باشد. با این وجود، توزیع الکترونهای ظرفیت در آنها متفاوت است.












