طیف سنجی جرمی – به زبان ساده
طیف سنجی جرمی (MS)، روشی تحلیلی برای اندازهگیری نسبت جرم به بار در یونها به شمار میآید. نتایج طیف سنجی جرمی به طور معمول به صورت یک طیف جرمی نشان داده میشوند. طیف سنجی جرمی از بین سایر انواع طیف سنجی کاربردهای بسیاری دارد و هم در مخلوطها و هم در نمونههای خالص، بکار گرفته میشود. البته تفاوتهایی بین «طیف سنجی جرمی» (Mass Spectrometry) و «اسپکتروسکوپی جرمی» (Mass Spectroscopy) وجود دارد که در بیشتر موارد، این دو مفهوم در معادل یکدیگر به کار میروند اما در انتهای مطلب نیز به طور مختصری در خصوص تفاوت این دو مفهوم به بحث میپردازیم.

یک «طیف جرمی» (Mass Spectrum) به نموداری از شدت سیگنال یون به عنوان تابعی از نسبت جرم به بار (m/Z) میگویند که بمنظور تعیین ماهیت عنصری یا ایزوتوپی یک نمونه، جرم ذرات، مولکولها و بیان ساختار آنها و سایر ترکیبات شیمیایی بکار میرود.
دستگاه طیف سنجی جرمی
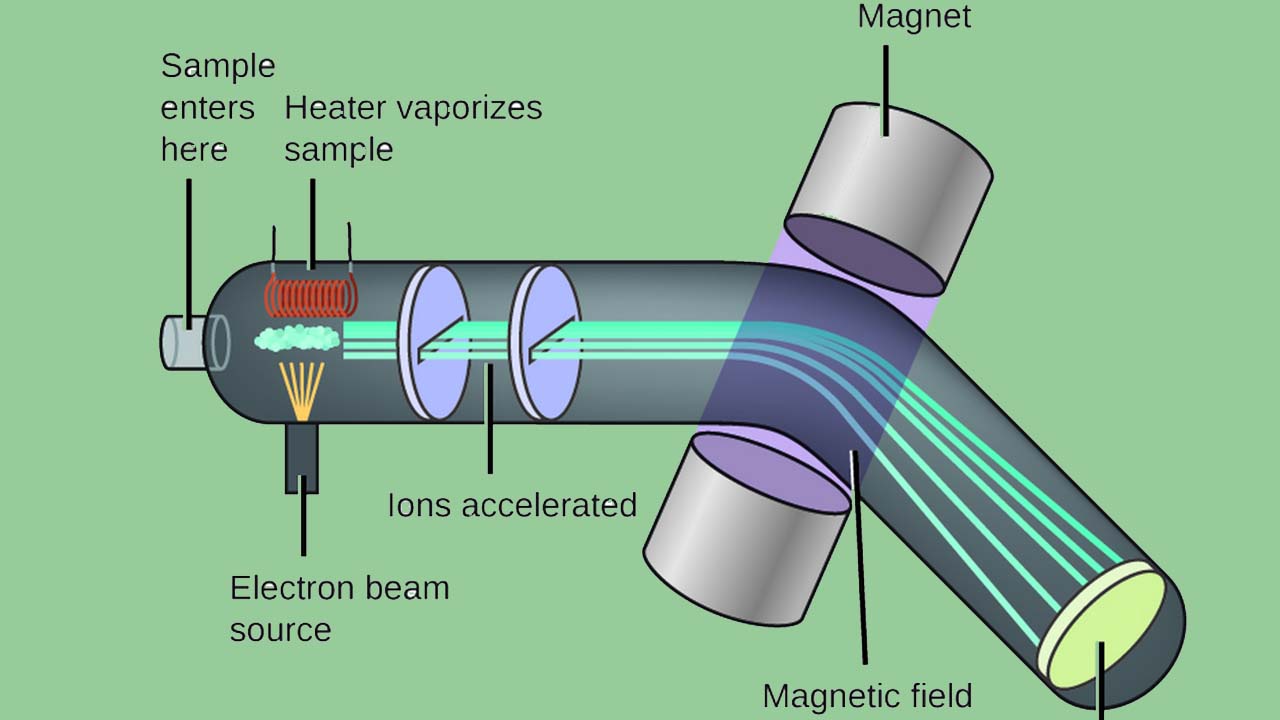
برای اندازهگیری مشخصههای مولکولها، به یک دستگاه طیفسنج جرمی نیاز داریم تا آنها را به یون تبدیل کند.
در اثر این تبدیل، کنترل آنها به کمک میدانهای الکتریکی و مغناطیسی خارجی سادهتر میشود. سه مورد از عملکردهای اساسی دستگاه طیف سنجی جرمی به موارد زیر مربوط میشود که عبارتند از:
- منبع یونی: نمونهای کوچک بر اثر از دست دادن یک الکترون، یونیزه خواهد شد.
- تحلیل جرمی: یونها بر اساس جرم و بار آنها مرتب میشوند.
- آشکارساز: نتایج مربوط به یونهای جدا شده، بر روی نمودار نمایش داده خواهد شد.
با توجه به اینکه یونها بسیار واکنشپذیر هستند و عمر بسیار کمی دارند، تشکیل و کنترل آنها باید در محیط خلا انجام بگیرد. فشار اتمسفری در حدود یا 760 میلیمتر جیوه ذکر میشود اما فشاری که به کمک آنها میتوان یونها را کنترل کرد در حدود تا میلیمتر جیوه خواهد بود. هرکدام از وظایفی (عملکردهایی) که در بالا ذکر شد میتوانند به روشهای مختلفی انجام بگیرند.
به طور معمول، یونش (یونیزاسیون) به کمک یک پرتو پرانرژی از الکترونها صورت میگیرد و جداسازی یونها به کمک شتابدهی و متمرکز کردن یونها در داخل پرتو انجام میگیرد و در ادامه به کمک میدان مغناطیسی خارجی، مسیر این پرتوها را میتوان منحرف (خم) کرد.
برخورد الکترونها با مولکول
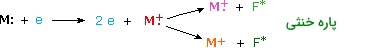
زمانیکه الکترونها با انرژی زیاد با مولکولها برخورد کنند، یکی از الکترونهای مولکولی (پیوندی یا ناپیوندی) را خارج میکنند. در اثر این اتفاق، یک یون مولکولی خواهیم داشت که در دیاگرام پایین، با رنگ قرمز نشان داده شده است.
انرژی باقیمانده از این برخورد سبب میشود یونهای مولکولی به قطعات دیگری شکسته شوند و این قطعات شکسته شده با رنگ سبز در دیاگرام پایین نمایش داده شدهاند. یونهای مولکولی، رادیکال کاتیون هستند اما یونهای شکسته شده بسته به ماهیتی که دارند، میتوانند رادیکال کاتیون (صورتی) یا کربوکاتیون (نارنجی) باشند.
روش طیف سنجی جرمی
در طیف سنجی جرمی نمونهای را شامل اتمها یا مولکولهای مورد نظر، به دستگاه طیفسنج جرمی تزریق میکنند. نمونه که به طور معمول در یک محلول آبی یا آلی قرار دارد، به سرعت توسط یک گرمکن، تبخیر و بخار نمونه توسط الکترونهایی با انرژی بالا، بمباران میشود.
این الکترونها انرژی کافی برای خارج کردن الکترونها از نمونه را دارند و در اثر این اتفاق، یونهایی با بار مثبت ایجاد خواهند شد. سپس، همانطور که در بالا ذکر شد، این یونها از طریق صفحات الکتریکی شتابدهی و به کمک یک میدان مغناطیسی قوی، از مسیر خود منحرف میشوند.
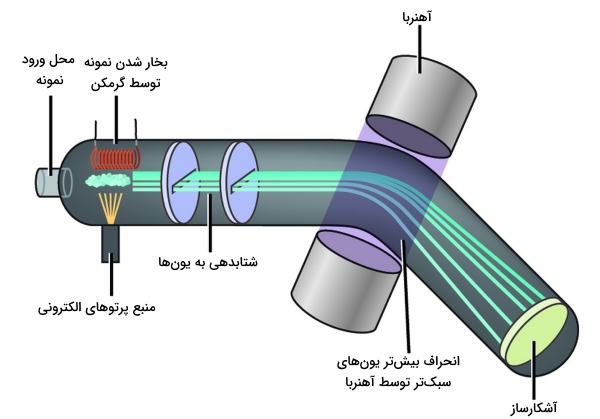
مقدار انحراف هر یون به سرعت و بار آن وابسته است. یونهای سنگینتر که حرکت آهستهتری دارند، کمتر منحرف میشوند درحالیکه یونهای سبکتر با حرکت سریعتر، میزان انحراف بیشتری خواهند داشت. علاوه بر این، میدان مغناطیسی، بر یونها با بار بیشتر، تاثیر بیشتری میگذارند.
مقدار انحراف هر یون به طور عکس با نسبت جرم (یون) به بار تناسب دارد. در روش طیفسنجی جرمی، یونها بعد از انحراف، به یک آشکارساز میرسند و از این طریق، ۲ مورد را میتوان اندازهگیری کرد:
- نسبت جرم به بار برای هر یون
- تعداد یونهای دریافت شده توسط آشکارساز با نسبت جرم به بار معین
فراوانی نسبی یک یون مخصوص در نمونه از طریق تقسیم تعداد یونها (با نسبت جرم به بار معین) بر تعداد کل یونهای شناسایی شده بدست میآید. در پایان فرآیند طیف سنجی جرمی یک طیف جرمی خواهیم داشت که توسط دستگاه تولید میشود. این طیف جرمی به طور معمول به صورت نمودار فراوانی نسبی در مقابل نسب جرم به بار رسم میشود.
مثال برای بررسی مفهوم طیف سنجی جرمی
نمونهای از مس را درون دستگاه طیف سنجی جرمی قرار میدهیم. بعد از حرارت دادن و یونیزاسیون نمونه، یونهای و شناسایی میشوند. کدامیک از یونها در درون دستگاه، بیشتر منحرف خواهند شد.
در مقایسه با یون ، یون ، همان میزان بار را دارد اما جرم اتمی آن کمتر است. این یعنی نسبت جرم به بار کمتری خواهد داشت. با توجه به اینکه مقدار انحراف یون به صورت عکس با نسبت جرم به بار آن متناسب است، در نتیجه، یون ، میزان انحراف بیشتری خواهد داشت.
بحث در خصوص طیف جرمی
«طیف جرمی» (Mass Spectra) به طور معمول به صورت یک نمودار با خطوط عمودی نشان داده میشود. هرکدام از این خطوط بیانگر یک یون با نسبت جرم به بار مشخصی است. همچنین، طول این خطوط، فراوانی نسبی یون را نشان میدهد. بیشترین شدت (فراوانی) با عدد 100 نشان داده و به عنوان «پیک پایه» (Base Pick) شناخته میشود.
بیشتر یونهایی که در دستگاه طیف سنجی جرمی شناسایی میشوند، یک بارِ تنها دارند یعنی عدد در آنها برابر با ۱ و در نتیجه، عدد m/z متناظر با جرم خواهد بود. دستگاههای جدید طیف سنجی جرمی به سادگی یونها را با یک واحد جرم اتمی منفرد تشخیص و مقادیر دقیق از جرم مولکولی یک ترکیب را بدست میدهند.
اگر فرض کنیم که ترکیبی خالص داشته باشیم، در یک طیف جرمی، بیشترین عدد را به عنوان یون مولکولی و کمترین عدد را به عنوان «پیشماده» (Fragments) یون مولکولی در نظر میگیریم. جرم اتمی به صورت «واحد جرم اتمی یکپارچه» (Unified Atomic Mass Unit) با نماد یا «دالتون» (Dalton) با نماد نشان داده میشود.
نمایش طیف جرمی
تصویر زیر، طیف جرمی حاصل از ۳ نمونه ترکیب گازی (دیاکسید کربن، پروپان و سیکلو پروپان) را نشان میدهد. اندازه این مولکولها نزدیک به هم هستند و و ، هردو جرم اسمی برابر با ۴۴ دالتون دارند. جرم نیز برابر با 42 دالتون است.
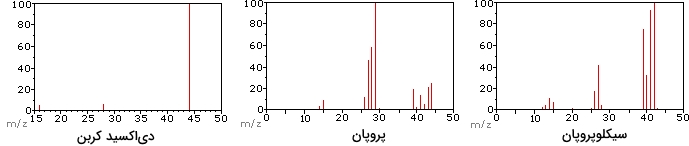
یون مولکولی به قویترین یون در طیف و میگویند و این مقدار در پروپان، به صورت تقریبا قوی دیده میشود. میزان تفکیک جرمی را به سادگی در این طیفها میتوان تشخیص داد. با وجود اینکه اندازه این سه ترکیب تقریبا با یکدیگر مشابه هستند اما به سادگی میتوان آنها را به کمک طیف سنجی جرمی و طیف جرمی حاصل، تشخیص داد.
از آنجایی که یک مولکول دیاکسید کربن، تنها از سه اتم تشکیل شده است، طیف جرمی بسیار سادهای خواهد داشت. در این طیف، یون مولکولی، پیک پایه نیز به شمار میرود و تنها یون شکسته شده، CO با نسبت جرم به بار (m/z) برابر با ۲۸ است.
یون مولکولی پروپان نیز نسبت جرم به بار 44 دارد اما در طیف جرمی، دارای بیشترین فراوانی نیست. شکست پیوند کربن-کربن سبب تشکیل پیشمادههای متیل و اتیل میشود که یکی از آنها کربوکاتیون و دیگری رادیکال است. هر دو توزیع را در طیف میتوان مشاهده کرد اما کاتیون بزرگتر اتیل بیشترین فراوانی را دارد زیرا اندازه آن سبب پخش شدگی بیشتر بار میشود.
گسست پیوندی مشابهی نیز در سیکلوپروپان خواهیم داشت اما مانند قبل، دو پیشماده ایجاد نمیشود بنابراین، یون مولکولی قویتری نیز نسبت به پروپان داریم که و همین امر نیز سبب شده است تا به عنوان پیک پایه (شاخص) در طیف شناخته شود. از دست دادن اتم هیدروژن، قبل یا بعد از باز شدن حلقه سیکلوپروپان، کاتیون آلیل پایدار ایجاد میکند. سومین یون قوی در این طیف، با خواهد بود. در مقایسه هیدروکربنهای پروپان و سیکلوپروپان، مقدار کم nv در پروپان و عدم وجود nv در سیکلوپروپان، از عوامل مهم به شمار میآیند.
مثال بررسی طیف جرمی
فرض کنید که در یک آزمایش طیف سنجی جرمی و تحلیل نمونهای خالص از عنصر زیرکونیم با عدد اتمی ۴۰، به طیف جرمی زیر دست پیدا کردهایم. این نمودار، چه اطلاعاتی را در خصوص این عنصر به ما می دهد.
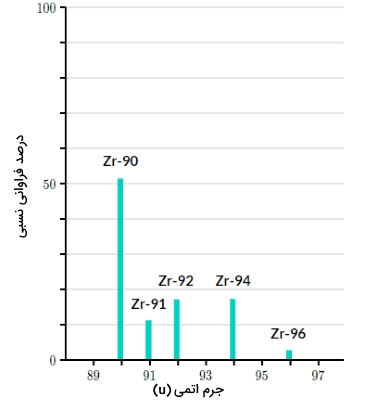
در ابتدا میبینیم که پنج قله (پیک) در طیف داریم و به این معنی است که از این عنصر، ۵ ایزوتوپ طبیعی خواهیم داشت. همچنین، بلندی پیک، فراوانی نسبی هر ایزوتوپ نسبت به دیگری را نشان میدهد.
البته توجه داشته باشید که محور افقی نمودار، به جای عبارت m/z با جرم اتمی (u) علامتگذاری شده است که یعنی تمامی یونهای تولید شده در آزمایش، باری برابر با داشتند. همچنین، با داشتن جرم اتمی ایزوتوپها و فراوانی نسبی آنها، جرم اتمی متوسط زیرکونیم در این نمونه قابل محاسبه خواهد بود.
بررسی ایزوتوپها در طیف سنجی جرمی
در مثال قبل، مختصری در خصوص ایزوتوپها صحبت کردیم. در ادامه، این مفهوم را با دقت بیشتری بیان میکنیم. با توجه به اینکه طیف سنجی جرمی به شناسایی و جداسازی یونها با جرمهای متفاوت میپردازد، بمنظور شناسایی و جداسازی ایزوتوپهای مختلف یک عنصر از آن بهره میگیرند.
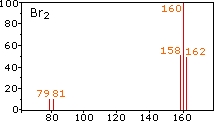
در تصویر زیر، طیف سنجی جرمی را برای ترکیبات شامل برم بررسی میکنیم. به هر فرایندی که منجر به جداسازی ایزوتوپهای یک عنصر شود، غنیسازی ایزوتوپی میگوییم.
از آنجایی که مولکولهای برم تنها شامل دو اتم هستند، نمیتوان در طیف سمت چپ، برم را تنها با جرم اتمی 80 دالتون در نظر گرفت. ۵ پیک در این طیف به روشنی بیان میکنند که برم شامل مخلوطی با نسبت 50:50 از ایزوتوپهایی با جرمهای 79 و 81 دالتون است. بنابراین، مولکول برم ممکن است شامل دو اتم با جرم 158 دالتون، دو اتم با جرم 162 دالتون یا ترکیبی محتملتر از دو ایزوتوپ با جرم 160 دالتون باشد.
الگوهای شکست در طیف سنجی جرمی
شکست یونهای مولکولی به مجموعهای از یونهای شکسته شده، نقاط قوت و ضعف متفاوتی دارد. طبیعت این پیشمادهها (پارهها) به طور معمول نشان از ساختار مولکولی دارند اما اگر یون مولکولی، عمری کمتر از چند میکروثانیه داشته باشد، نمیتوان آنرا شناسایی کرد.
بدون داشتن پیک مرجع در یون مولکولی، تفسیر طیف جرمی بسیار دشوار خواهد بود. خوشبختانه بیشتر ترکیبات آلی، طیف جرمی بدست میدهند که شامل یون مولکولی هستند. در میان ترکیبات آلی ساده، پایدارترین یونهای مولکولی را میتوان در بین حلقههای آروماتیک پیدا کرد. الکلها، اترها و آلکانهای شاخهدار به طور معمول تمایل به شکسته شدن دارند.
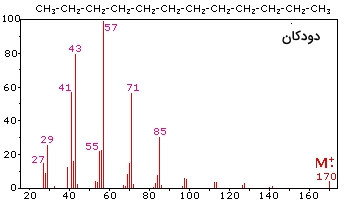
طیف جرمی در «دودکان» (Dodecane) در سمت راست تصویر بالا، رفتار یک آلکان خطی (بدون شاخه) را نشان میدهد. از آنجایی که هیچ هترواتمی در این مولکول وجود ندارد، الکترون ظرفیت غیرپیوندی نیز نخواهیم داشت. در نتیجه، خاصیت رادیکال کاتیون یون مولکولی به صورت «غیرمتمرکز» (Delocalized) در بین تمامی پیوندهای کووالانسی وجود دارد. با توجه به اینکه پیوندهای کربن-کربن به طور معمول، ضعیفتر از پیوندهای کربن-هیدروژن هستند، شکست پیوند پیوندهای کربن-کربن روی میدهد و سبب تولید مخلوطی از رادیکالهای آلکیل و کربوکاتیونهای آلکیل میشود.
بار مثبت در بیشتر موارد بر روی پیشمادههای کوچکتر قرار میگیرد. در نتیجه سری همگنی از کاتیونهای هگزیل ، پنتیل ، بوتیل ، پروپیل ، اتیل و متیل خواهیم داشت. این سریها همراه با کربوکاتیونهای آلکنیل با نسبتهای جرم به بار 55، 41 و 27 هستند.
بررسی گروه عاملی در طیف سنجی جرمی
حضور یک گروه عاملی، بویژه گروه عاملی که شامل هترواتمهای نیتروژن، اکسیژن، گوگرد و ... با الکترونهای غیرپیوندی باشد، الگوهای شکست را به کلی تغییر میدهد. این تاثیر به دلیل متمرکز شدن رادیکال کاتیون یون مولکولی بر روی هترواتم ذکر میشود.
با این وجود، یونیزه کردن یک الکترون غیرپیوندی نسبت به الکترونی در پیوند کووالانسی، سادهتر خواهد بود. با متمرکز شدن بخش واکنشپذیر، فرآیندهای شکستی بوجود میآیند. این فرآیندها به طور خلاصه در تصویر زیر آورده شدهاند.
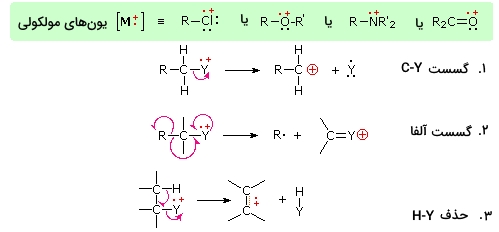
به طور معمول، نوع توزیع بار، به شکل بالا اتفاق میافتد اما ممکن است در هرکدام از فرآیندهای «گسست» (Cleavage)، توزیع بار بر روی ذره دیگری انجام شود. گسست آلفا معمولا در ترکیبات نیتروژن، اکسیژن و گوگرد اتفاق میافتد.
پیچیدگی الگوهای شکست سبب شده است تا طیف سنجی جرمی به عنوان نوعی اثر انگشت برای شناسایی ترکیبات آلی، شناخته شود. شناسایی آلایندههای زیستمحیطی، بقایای آفتکشها بر روی مواد غذایی و کنترل مواد دارویی، از جمله کاربردهای طیفسنجی جرمی به شمار میآید. همچنین در آنالیز گازهای موجود در هوا نیز از طیف سنجی جرمی استفاده میکنند. همچنین، این روش در مشخصهسازی پروتئینها و تحقیقات فضایی نیز بکار گرفته میشود.
تفاوت بین طیف سنجی و طیف بینی
همانطور که در ابتدای متن اشاره شد، در مواردی، عبارات «طیفسنجی» (Spectrometry) و «طیفبینی» (Spectroscopy) مشکلاتی را برای دانشجویان ایجاد میکند چراکه عدهای بر این عقیدهاند که طیفسنجی و طیفبینی، دو مورد مجزا هستند. البته در زبان فارسی، بیشتر از عبارت طیفسنجی استفاده میشود. در حقیقت، طیفبینی (اسپکتروسکوپی)، دانشی نظری است و طیفسنجی، به اندازهگیری عملی و بررسی کاربرد این علم میپردازد. در تعریفی کلی، طیفسنجی به عنوان بخشی از طیفبینی به شمار میرود.














خیلی عالی بود تشکر
سلام در مورد طیف سنجی اسید ریبو نوکلیک RNAهم که مولکول هست میشه یه توضیح بدید؟