انرژی پیوند — به زبان ساده
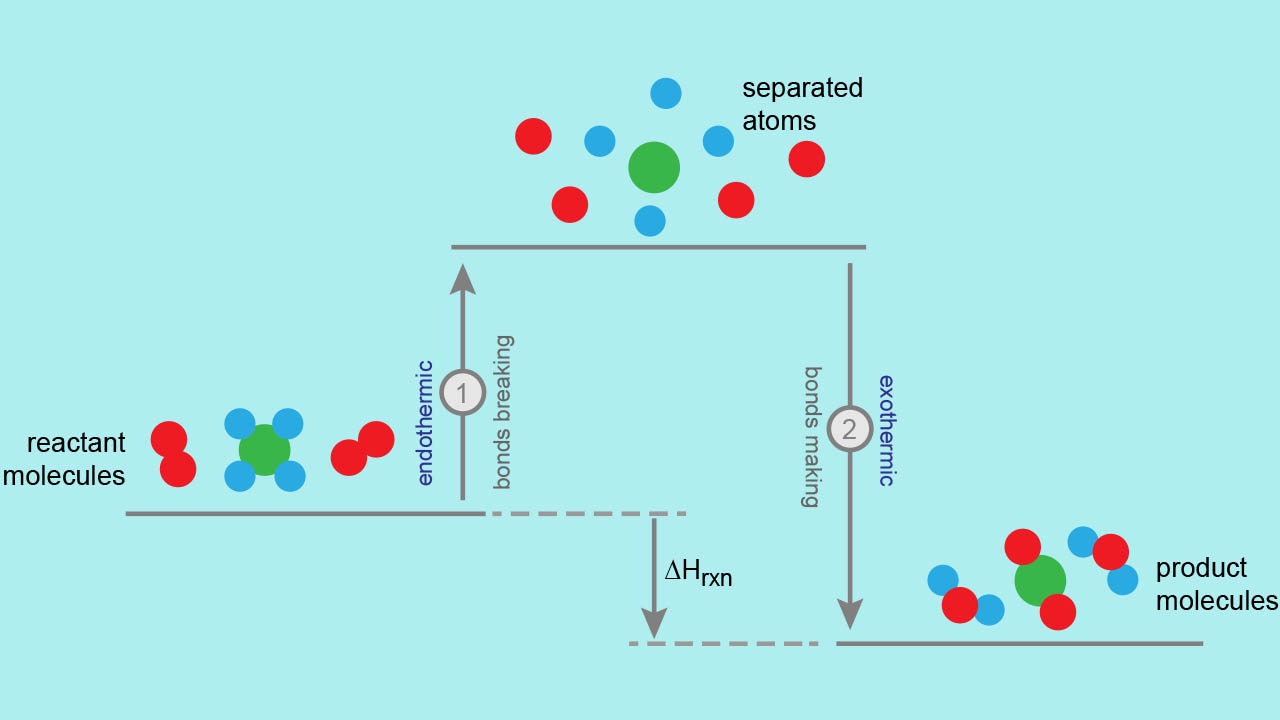
اتمها برای تشکیل ترکیبات، ناگزیر به تشکیل پیوند با یکدیگر هستند چراکه با این کار، انرژی کمتری نسبت به اتمهای منفرد خواهند داشت. به هنگام تشکیل پیوند، مقداری انرژی به صورت گرما آزاد میشود. این انرژی، برابر با اختلاف انرژی اتمهای پیوندی با حالت منفرد آنها است. آزاد شدن انرژی نشان میدهد که اتمهای پیوندی، انرژی کمتری نسبت به اتمهای منفرد دارند. در این مطلب قصد داریم تا به این انرژی آزاد شده یا به عبارت دیگر، انرژی پیوند بپردازیم.
انرژی پیوند معیاری برای اندازهگیری قدرت پیوند به شمار میآید. بمنظور تبدیل یک مول مولکول به اتمهای سازنده آن، مقدار گرمایی برابر با انرژی پیوند باید به سیستم داده شود.
مقدمه
هنگامی که اتمها در اثر برهمکنش با یکدیگر، ترکیبی را تشکیل میدهند، همواره انرژی آزاد میشود و ترکیب حاصل، انرژی کمتری خواهد داشت. زمانی که یک واکنش شیمیایی اتفاق میافتد، پیوندهای مولکولی شکسته میشوند و پیوندهای جدیدی بوجود میآیند تا مولکولهای دیگری را تشکیل دهند.
به طور مثال، در واکنش زیر، پیوندها در دو مولکول آب شکسته میشوند تا اتمهای هیدروژن و اکسیژن تشکیل شوند.
$$\begin {equation} 2 H_{2} O \rightarrow 2 H _{2} +O _{2} \end {equation}$$
برای شکسته شدن پیوندها همواره به انرژی نیاز داریم و همانطور که در ابتدای متن نیز به آن اشاره شد، این انرژی موسوم به انرژی پیوند است. با وجود اینکه انرژی پیوند مفهوم سادهای را در بر میگیرد اما در توصیف ساختار و مشخصه یک مولکول، نقش مهمی را ایفا میکند. زمانیکه چندین ساختار لوویس داشته باشیم، به کمک انرژی پیوند میتوان پایدارترین ساختار را تعیین کرد. پس تا اینجای آموزش یاد گرفتیم که برای شکستن پیوندها به انرژی نیاز داریم و زمانیکه پیوندی تشکیل شود، انرژی آزاد خواهد شد.
با وجود اینکه هر مولکول، انرژی پیوند مخصوص به خود را دارد اما در شرایطی میتوان یکسری قوانین کلی را برای انرژی پیوند متصور شد. به طور مثال، مقدار دقیق انرژی پیوند کربن-هیدروژن به نوع خاص مولکول آن بستگی دارد اما تقریبا تمامی پیوندهای کربن-هیدروژن، انرژی پیوند برابری دارند.
به طور معمول برای شکستن ۱ مول پیوند کربن-هیدروژن، به 100 کیلوکالری انرژی نیاز داریم. بنابراین، انرژی پیوند کربن-هیدروژن، برابر با $$100 kcal/mol$$ خواهد بود. یک پیوند یگانه کربن-کربن نیز به طور معمول انرژی پیوند $$80 kcal/mol$$ دارد درصورتی که انرژی پیوند در پیوند دوگانه کربن-کربن برابر با $$145 kcal/mol$$ است. برای بدست آوردن متوسط انرژی پیوند میتوانیم انرژی پیوند خاصی را در مولکولهای مختلف مورد بررسی قرار دهیم. در تصویر زیر، انرژی پیوند در برخی از ترکیبات، نشان داده شده است:
ارتباط بین طول و انرژی پیوند
زمانیکه پیوند قوی داشته باشیم، انرژی پیوند بالاتری نیز خواهیم داشت زیرا برای شکستن چنین پیوندی باید انرژی بیشتری مصرف شود. انرژی پیوند همچنین با مرتبه پیوند و طول آن همبستگی دارد. وقتی مرتبه پیوند بالاتری داشته باشیم، طول پیوند، کوتاهتر خواهد بود و به همین ترتیب، طول پیوند کوتاهتر به معنای انرژی پیوند بیشتر است زیرا در چنین شرایطی، جاذبه الکتریکی بیشتر میشود. به طور کلی، هر قدر طول پیوند کمتر باشد، انرژی پیوند بیشتری داریم.
متوسط انرژی پیوند
در جداول مختلف به طور معمول، انرژی پیوند را به صورت متوسط انرژیهای تفکیک ذکر میکنند. به طور مثال، مقدار متوسط انرژی پیوند اکسیژن-هیدروژن در مولکول آب برابر با $$464 kJ/mol$$ است زیرا انرژی پیوند $$H-OH$$ برابر با $$498.7 kJ/mol$$ و انرژی پیوند اکسیژن-هیدروژن برابر با $$428 kJ/mol$$ است. بنابراین برای محاسبه متوسط انرژی پیوند اکسیژن-هیدروژن در مولکول آب خواهیم داشت:
$$\begin {equation} \frac {498.7 k J / m o l+428 k J / m o l} {2}= 464 k J / m o l \end {equation}$$
هرقدر تعداد مولکولهای مورد بررسی، بیشتر باشد، متوسط انرژی پیوند محاسبه شده، دقیقتر خواهد بود اما به طور کلی، موارد زیر را میتوان در خصوص متوسط انرژی پیوند مطرح کرد:
- مقادیر متوسط انرژی پیوند به اندازه مقادیر ویژه انرژی تفکیک پیوند، دقیق نیستند.
- پیوندهای دوگانه در مقایسه با پیوندهای یگانه، انرژی پیوند بیشتری دارند.
- پیوندهای سهگانه نیز نسبت به پیوندهای یگانه و دوگانه، انرژی پیوند بیشتری را شامل میشوند.
شکست و تشکیل پیوند
زمانیکه یک واکنش شیمیایی اتفاق میافتد، اتمهای واکنشدهنده با بازآرایی پیوندهای شیمیایی خود موجب تشکیل فرآورده جدید میشوند. این بازآرایی جدید پیوندها، انرژی کل در پیوندهای واکنشدهندهها را شامل نخواهد شد.
بنابراین، یک واکنش شیمیایی، همواره با تغییر انرژی همراه خواهد بود. در تصویر زیر یک واکنش گرماگیر را داریم. البته برای یک واکنش گرماده، با تبدیل واکنشدهندهها به فرآوردهها، انرژی آزاد میشود و همچنین، در یک واکنش گرماگیر، انجام واکنش موجب جذب انرژی خواهد بود.
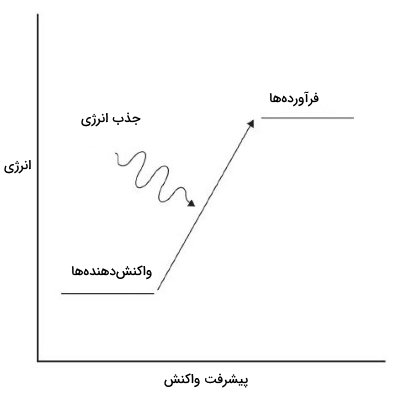
در برخی از واکنشها، انرژی فرآوردهها از انرژی واکنشدهندهها کمتر است. بنابراین، در طول واکنش، مواد، انرژی آزاد شده را به محیط منتقل میکنند که آنها را با نام واکنش گرماده میشناسیم. در بیشتر موارد، این انرژی به صورت گرما ظاهر میشود و در واکنشهای محدودی نیز این انرژی به شکل نور خواهد بود. در واکنشهای شیمیایی که فرآوردهها، انرژی بیشتری نسبت به واکنشدهندهها دارند، واکنشدهندهها باید از محیط اطراف انرژی جذب کنند تا بتوانند در واکنش شرکت کنند. چنین واکنشهایی نیز موسوم به واکنشهای گرماگیر هستند.
بررسی گرما به عنوان عضوی از واکنش شیمیایی
در کتب شیمی، گرما را به عنوان ذرهای جداگانه در واکنش مد نظر قرار میدهند. البته این امر به طور علمی صحیح نیست زیرا در یک واکنش، نمیتوانیم گرما را به عنوان یک ذره به واکنش اضافه یا از واکنش حذف کنیم. از این روش به عنوان مکانیسمی جهت پیشبینی جابجایی یک واکنش با تغییر دما یاد میکنند.
به طور مثال، اگر گرما را به عنوان واکنشدهنده در نظر بگیریم، در نتیجه، آنتالپی مثبت $$(\Delta H > 0)$$ خواهیم داشت و پیشرفت واکنش در دماهای بالا به طرف تولید فرآورده خواهد بود. به طور مشابه، اگر گرما نقش فرآورده داشته باشد، آنگاه آنتالپی منفی $$(\Delta H < 0)$$ داریم و پیشرفت واکنش به طرف واکنشدهندهها خواهد بود.
به عبارت دیگر، در واکنشهای گرماده و گرماگیر، میتوان انرژی را به عنوان فرآورده یا واکنشدهنده در نظر گرفت. واکنشهای گرماده، انرژی آزاد میکنند و بنابراین، انرژی در این واکنشها نقش فرآورده دارد. واکنشهای گرماگیر به انرژی نیاز دارند و در نتیجه، انرژی نقش واکنشدهنده دارد.
مثال مقایسه واکنش گرماده و گرماگیر
گرماده یا گرماگیر بودن هرکدام از واکنشهای زیر را بررسی کنید.
$$\begin {equation} \begin {array} {l}
2 H _ {2( g )} + O _ { 2 ( g )} \rightarrow 2 H _{2} O_ {(\ell)}+135 \mathrm {kcal} \\
N _{2 (g)}+ O_ {2(g)}+45 \mathrm {kcal} \rightarrow 2 N O _ {(g)}
\end {array} \end {equation}$$
برای پاسخ به این سوال نیاز به انجام هیچ محاسباتی نداریم و تنها کافی است که به گرما (انرژی) در معادله شیمیایی واکنشهای بالا نگاه کنیم. در واکنش اول، با توجه به اینکه انرژی آزاد شده است، واکنش گرماده خواهد بود و در واکنش دوم نیز از آنجایی که گرما جذب شده، واکنش به صورت گرماگیر است.
مثال برای انرژی پیوند و تولید هیدروژن یدید
نوع واکنش زیر را از لحاظ گرماده و گرماگیر بودن و همچنین میزان تغییر آنتالپی بررسی کنید. انرژی پیوند در پیوندهای H-H و I-I و H-I به ترتیب 436 و 151 و 297 کیلوژول بر مول است.
$$\begin{equation}H_{2}(g)+I_{2}(g) \rightarrow 2 H I(g)\end {equation}$$
برای پاسخ به این سوال، در ابتدا به معادله واکنش نگاه و نوع پیوندهای واکنشدهندهها را مشخص میکنیم. واکنشدهندهها شامل یک پیوند هیدروژن-هیدروژن و یک پیوند ید-ید هستند. همین کار را نیز برای فرآوردهها انجام میدهیم و میبینیم که در فرآورده، ۲ پیوند $$H-I$$ داریم.
با توجه به دادههای سوال، مجموع آنتالپیهای واکنش عبارتست از:
$$\begin {equation} 436 \mathrm {k J } / \mathrm {mole} +151 \mathrm { k J} / \mathrm {mole} = 587 \mathrm {k J} / \mathrm {mol} \end {equation}$$
عدد بالا بیانکننده مقدار انرژی لازم برای شکستن پیوندها در بخش واکنشدهنده است. حال با توجه به اینکه ۲ مول فرآورده داریم، انرژی پیوند را در عدد ۲ ضرب میکنیم:
$$2 x 297 k J /m o l = 594 k J/ m o l$$
عدد بالا بیانگر انرژی آزاد شده در بخش فرآورده است. با توجه به اعداد بدست آمده، تغییرات انرژی خالص را به صورت زیر محاسبه میکنیم:
$$587-594= -7 k J/m o l$$
با توجه به منفی بودن عدد بدست آمده، واکنش گرماده خواهیم داشت.
مثال تجزیه آب
تغییرات آنتالپی برای تجزیه حرارتی آب در واکنش زیر را محاسبه و واکنش را از لحاظ گرماده یا گرماگیر بودن بررسی کنید.
$$2 H_2 O (g) \rightarrow 2 H_2 + O_2 (g)$$
واکنش بالا شامل شکستن دو مول پیوند O-H و تشکیل ۱ مول پیوند O-O و 2 مول پیوند H-H است.
مجموع انرژیهای مورد نیاز برای شکست پیوندها در بخش واکنشدهنده برابر با $$4 x 460 k J/m o l = 1840 k J /m o l$$ است. همچنین، مجموع انرژیهای آزاد شده برای تشکیل پیوندها در فرآوردهها با توجه به داشتن ۲ مول پیوند $$H - H$$ و یک مول $$O=O$$، برابر است با:
$$\begin {equation} \begin {aligned}
&2 \text { moles of } \mathrm {H}-\mathrm {H} \text { bonds }=2 \times 436.4 \mathrm {k J} / \mathrm {mol}=872.8 \mathrm {k J} / \mathrm {mol}\\
&1 \text { moles of } 0=0 \text { bond }=1 \times 498.7 \mathrm {k J} / \mathrm {mil}=498.7 \mathrm {k J} / \mathrm {mol}
\end {aligned} \end {equation}$$
جمع زدن اعداد بدست آمده، مارا به عدد $$1371.5 kJ/ mol$$ میرساند. اختلاف انرژی کل نیز به صورت زیر محاسبه میشود:
$$1840 k J / m o l – 1371.5 k J /m o l = 469 k J / m o l$$
این عدد نشان میدهد که واکنشی گرماگیر داریم و برای انجام واکنش، این میزان انرژی باید تامین شود.
انرژی بین دو اتم به عنوان تابعی از فاصله بین هسته
برای نشان دادن چگونگی تغییرات انرژی دو سیستم اتمی از «نمودار مورس» (Morse Curve) استفاده میکنیم که این تغییرات را به صورت تابعی از فاصله بین هستهای نشان میدهد. نمودار مورس را در تصویر زیر مشاهده میکنید.
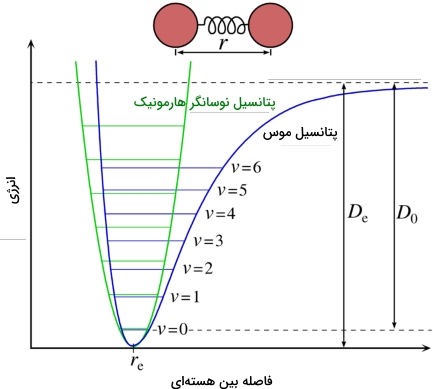
در فاصلههای زیاد، انرژی برابر با صفر است به این معنی که هیچ جاذبهای نداریم. این جمله با فهم ما در خصوص دو اتم منفرد نیز سازگاری دارد به اینصورت که اگر دو اتم در فاصله بینهایت از یکدیگر قرار داشته باشند، به هیچ روی یکدیگر را جذب نمیکنند یا حداقل میتوان گفت پیوندی با یکدیگر تشکیل نمیدهند. در فواصل بینهستهای و به ترتیبِ قطر اتمی، نیروهای جاذبه، حاکم هستند. در نقطه مینیمم نمودار مورس، میبینیم که نیروهای جاذبه و دافعه با یکدیگر در یک توازن قرار میگیرند.
فاصله بین هستهای که در آن، حداقل انرژی را داریم، تعادل طول پیوند را بیان میکند. به عبارت دیگر، این طول پیوند بیانگر یک مقدار تعادلی است زیرا حرکت ناشی از حرارت سبب میشود دو اتم در این فاصله ارتعاش داشته باشند که شبیه ارتعاش رفت و برگشتی یک فنر در طول فاصله تعادلی خود است.
نمودار مورس، به ازای پیوندهای تشکیل شده بین زوج اتمهای مختلف، نقطه مینیمم و وابستگی فاصله متفاوتی دارد. به طور کلی، هر قدر پیوند بین دو اتم قویتر باشد، مینیمم انرژی پایینتر و طول پیوند، کمتر خواهد بود. در تعریفی سادهتر باید گفت انرژی پیوند به میزان کار مورد نیاز برای کشیدن و جدا کردن دو اتم به طور کامل میگویند. به عبارت دیگر، این میزان کار، برابر با عمق چاه پتانسیل در نمودار بالا خواهد بود.
آنتالپی پیوند یا انرژی تفکیک
در کتب مختلف شیمی، از آنتالپی پیوند به جای مفهوم انرژی پیوند استفاده میکنند. با توجه به اینکه هر دو مفهوم به نوعی یکسان هستند اما با توجه به تعاریف مختلف آن، تصمیم گرفتیم تا به طور جداگانه نیز این مفهوم را تحت عنوان آنتالپی پیوند مورد بررسی قرار دهیم.
آنتالپی پیوند که آنرا با نام انرژی تفکیک پیوند نیز میشناسند، به صورت تغییرات آنتالپی استاندارد به هنگام شکست یک پیوند در اثر واکنش «همکافت» (Homolysis) میگویند که در این واکنش، دمای فرآوردهها و واکنشدهنده در صفر مطلق قرار داشته باشند. به طور معمول، آنتالپی پیوند یا انرژی تفکیک پیوند برای یکی از پیوندهای کربن-هیدروژن در اتان را به صورت زیر تعریف میکنند
$$\begin {equation} \begin {array} {l}
\mathrm {C H }_{3} \mathrm {C H}_{2}-\mathrm { H} \rightarrow \mathrm {C H }_{3} \mathrm {C H}_{ 2} \cdot+\mathrm {H} \\
\Delta H= 101 \cdot 1 \frac {\mathrm {kcal}}{\mathrm {mol}}\left (423.0 \frac { \mathrm {k J }} {\mathrm {mol} }\right )
\end {array} \end {equation}$$
لازم به ذکر است که قدرت پیوندهای بین اتمهای مختلف در طول جدول تناوبی تغییر میکند که این تغییرات را میتوانید در جدول ابتدای متن بررسی کنید. توجه داشته باشید که هر پیوند در یک مولکول، انرژی تفکیک پیوند مخصوص به خود را دارد. به طور مثال، برای شکستن پیوندهای یک مولکول با چهار پیوند، به انرژی بیشتری در مقایسه با مولکولی با یک پیوند نیاز داریم. با شکست هرکدام از پیوندها، انرژی تفکیک پیوند برای سایر پیوندها با تغییر کمی همراه خواهد بود.
محاسبه تغییرات آنتالپی واکنش
تغییرات آنتالپی واکنش، به سادگی و به کمک قانون هس، قابل محسابه است. به طور مثال، با توجه به تصویر زیر، تغییرات آنتالپی برای این تصویر، با رابطه زیر محاسبه میشود:
$$\Delta H _ {\rm rxn} = \Delta H_1 + \Delta H_2$$
به طور خلاصه، تغییرات آنتالپی در یک واکنش، برابر با مجموع انرژی مورد نیاز برای شکستن پیوند و انرژی آزاد شده به هنگام تشکیل پیوند است.
$$\Delta H _ {\rm rxn} = \Sigma \Delta H _{\rm breaking} + \Sigma \Delta H_ {\rm making}$$
رابطه بالا بیانگر مجموع آنتالپیهای پیوند به هنگام شکستن پیوندها منهای مجموع آنها به هنگام تشکیل است. از ویژگیهای چنین روشی این است که تنها نیاز داریم تا به پیوندهایی نگاه کنیم که در واکنش تغییر میکنند.
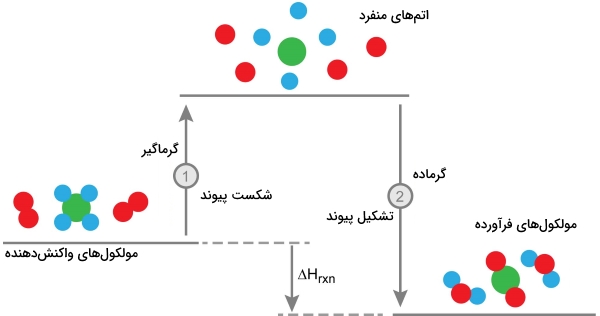
مثال برای محاسبه تغییرات آنتالپی واکنش
هیدروژناسیون اتن برای تولید اتان را در نظر بگیرید:
$$\rm C _2 H_ 4 (g) + H _2 (g) \rightarrow C _ 2 H_ 6 (g)$$
در اینجا میخواهیم پیوند دوگانه کربن-کربن و پیوند هیدروژن-هیدروژن در اتن شکسته شود. در ادامه نیاز داریم تا یک پیوندهای کربن-هیدروژن و کربن-کربن جدید در اتان تشکیل شوند. انرژی پیوند (آنتالپی پیوند) در پیوندهای هیدروژن-هیدروژن، کربن-کربن و کربن-هیدروژن به ترتیب برابر با ۶۰۲، ۶۴۶ و ۴۱۳ کیلوژول بر مول است. تمامی تغییرات انرژی در واکنشدهندهها و فرآورده، در جدول زیر آورده شده است:
| واکنشدهنده | $$\Delta H $$ | فرآورده | $$\Delta H $$ |
| شکست پیوند دوگانه کربن-کربن | $$+602$$ | تولید پیوند یگانه کربن-کربن | $$-346$$ |
| شکست پیوند هیدروژن-هیدروژن | $$+436$$ | تولید پیوند کربن-هیدروژن | $$-826$$ |
| مجموع | $$+1038$$ | مجموع | $$-1172$$ |
| مجموع دو طرف | $$+1038 -1172 = -134 k J /m o l$$ | ||
طول پیوند
طول پیوند بین دو اتم به عوامل مختلفی همچون هیبریداسیون اوربیتالی و طبیعت الکترونی اجزای پیوند وابسته است.
فاصله بین دو اتم پیوندی
فاصله بین دو اتم در یک پیوند یا همان طول پیوند را میتوان به صورت آزمایشگاهی و به کمک پراش اشعه ایکس بلورهای مولکولی تعیین کرد. به کمک پراش اشعه ایکس، به طور دقیق، ساختار سهبعدی مولکولها و فاصلههای بین هستهای تعیین میشود. همچنین، از طریق روشهای مختلف طیفسنجی نیز طول پیوند اتمها در یک مولکول قابل اندازهگیری خواهد بود.
طول پیوند به فاصله متوسط بین هسته دو اتم پیوندی در یک مولکول میگویند. دلیل چنین تعریفی این است که یک پیوند شیمیایی، ساختاری ایستا و ثابت نیست بلکه در حقیقت، دو اتم به دلیل انرژی گرمایی محیط، در هر دمایی بالاتر از صفر مطلق، ارتعاش میکنند. همانطور که در نمودار مورس دیدیم، یک پیوند را میتوان به صورت دو کره مدلسازی کرد که با یک فنر به یکدیگر متصل شدهاند. کشش یا فشردگی فنر موجب ایجاد حرکت رفت و برگشتی بر اساس محل تعادل کرهها میشود. طول پیوند به فاصله بین دو کره یا اتمی میگویند که در حالت تعادل قرار داشته باشند.
مقادیر طول پیوند
طول پیوند را در گذشته بر اساس واحد آنگستروم تعریف میکنند اما امروزه ترجیح بر استفاده از واحد پیکومتر است. طول پیوند به طور معمول، گسترهای بین 100-200 پیکومتر را شامل میشود. با وجود اینکه در یک پیوند ارتعاش داریم، اما طول پیوندهای تعادلی به طور آزمایشگاهی با دقت $$\pm 1 pm$$ محاسبه میشود.
پیوندهایی که شامل هیدروژن هستند، طول کمی دارند. کوتاهترین طول پیوند، مربوط به پیوند هیدروژن-هیدروژن باطول 74 پیکومتر است. با داشتن فاصله پیوند بین دو اتم مشابه، میتوان شعاع کووالانسی یک اتم را تعیین کرد. بر همین اساس، شعاع کوولانسی اتم هیدروژن، برابر با 37 پیکومتر خواهد بود.
روندهای تناوبی طول پیوند
به طور کلی، زمانی که پیوند بین یک اتم با اتم پیوندی دیگری را در جدول تناوبی، بررسی میکنیم به روندهای تناوبی برمیخوریم که آگاهی از این روندها بسیار ضروری است. خوب است بدانید که در هر تناوب از چپ به راست، طول پیوند کاهش مییابد و در هر گروه از بالا به پایین، طول پیوند افزایش پیدا میکند. چنین روندی با روند شعاع اتمی یکسان است.
جمعبندی
در این مطلب به بررسی انرژی پیوند و آنتالپی پیوند پرداختیم و ارتباط بین طول و انرژی پیوند را مورد بررسی قرار دادیم. همچنین، یاد گرفتیم که بمنظور بررسی سادهتر واکنشهای گرماده و گرماگیر در شیمی، کافی است گرما را به عنوان جزئی از یک واکنش شیمیایی در نظر بگیریم تا با قرار دادن آن در طرفهای چپ و راست معادله شیمیایی، گرماده و گرماگیر بودن واکنش مشخص شود. علاوه بر این، به کمک نمودار مورس، انرژی بین دو اتم را به عنوان تابعی از فاصله بین هستهای بررسی کردیم. در پایان نیز روندهای تناوبی طول پیوند در جدول تناوبی را بررسی کردیم.
در بررسی انرژی پیوند، دانستیم که به هنگام تشکیل پیوندها، انرژی آزاد میشود و به همین دلیل، در زمان شکست پیوند، تغییرات آنتالپی مثبت خواهیم داشت. همچنین، با توجه به اینکه در زمان تشکیل پیوند، انرژی آزاد میشود، تغییرات آنتالپی، منفی خواهد بود.












سلام من یک سوال داشتم ، در قسمتی ما اومدیم و پتانسیل برای یک دو اتمی را برحسب ایکس رسم کردیم و تابع پتانسیل موس رو با شکل داریم و طبق این نمودار میتونیم استنباط کنیم این دو اتمی با افزایش دما و در نتیجه افزایش سطح انرژی در فاصله بیشتری از نقطه تعادل خود نوسان میکنه و به همین دلیل با گرم کردنش، انبساط پیدا میکنه، حالا اگر بخواهیم تابع پتانسیل رو برای آب بکشیم به چه شکلی در خواهد اومد؟ چون در آب با افزایش دما از صفر تا ۴ درجه سانتی گراد بجای اینکه ما افزایش حجم داشته باشیم شاهده انقباض هستیم و بعد از ۴ درجه همه چیز عادی رفتار میکنه(مثله یک دو اتمی دیگر)
سلام خسته نباشید. پایین جدول انتالپی پیوند اون کربن ستاره دار چی هستس
با سلام؛
به این معنی است که پیوند کربن و اکسیژن در مولکول دیاکسید کربن، عدد بزرگتری (۷۹۹ کیلوژول بر مول) را شامل میشود.
با تشکر از همراهی شما با مجله فرادرس
با سلام ، انرژی پیوند بین دو اتم به چه عواملی بستگی داره؟ درواقع انرژی پیوند چطور افزایش پیدا میکنه؟
سلام. منبع این بخش (محاسبه تغییرات آنتالپی واکنش) کدوم هست؟
با سلام؛
منبع تمامی مطالب مجله فرادرس اگر ترجمه باشند در انتهای مطلب و پیش از نام نویسنده آورده شدهاند.
با تشکر از همراهی شما با مجله فرادرس
با سلام؛
پیشنهاد میکنیم در همین مطلب، بخش «طول پیوند» را بار دیگر مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام و عرض ادب. بسیار متشکرم بابت محتوای عالی شما.
جسارتا در بخش “شکست و تشکیل پیوند”، اولا این عکس مربوط به واکنش گرما گیر هست که سطح انرژی فرآورده ها بالاتر می رود اما در متن، گفته شده این عکس مربوط به واکنش گرما ده هست. دوما در متن زیر عکس هم، جمله اول بر عکس نوشته شده و باید اینطور می بود: در برخی واکنش ها، انرژی واکنش دهنده از فرآورده بیشتر است….
خیلی ممنونم از شما.
با سلام ممنون بابت مطالب مفیدتان
یه سوالی داشتم
چرا آنتالپی پیوند سه گانه نیتروژن بیشتر از سه گانه کربن شده است. مگه نه اینکه طول پیوند کربن کوچکتر هست و باید انرژی بیشتری داشته باشه؟
سلام و روز شما بهخیر؛
همانطور که اشاره کردید آنتالپی پیوند به طول پیوند بستگی دارد. به این صورت که هرچه طول پیوندی کمتر باشد، انرژی بیشتری دارد، اما توجه داشته باشید که طول پیوند سهگانه کربن-کربن برابر با ۱٫۲ آنگستروم و طول پیوند نیتروژن-نیتروژن برابر با ۱٫۱ آنگستروم است. با توجه به اینکه طول پیوند سهگانه نیتروژن-نیتروژن از کربن-کربن کمتر است، آنتالپی پیوند بیشتری نیز دارد و پایدارتر خواهد بود. این مقادیر برای پیوند سهگانه نیتروژن-نیتروژن برابر با ۹۴۱ کیلوژول بر مول و برای پیوند سهگانه کربن-کربن برابر با ۸۳۹ کیلوژول بر مول است.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. متن بازبینی و اصلاح شد. در بخش اول همانطور که توضیح دادید، اطلاعات و تصاویر مربوط به واکنش گرماگیر است. در بخش دوم نیز جملهبندی باید بر اساس واکنش گرماده نوشته میشد و به همین منظور اصلاح شد.
از همراهی شما با مجله فرادرس سپاسگزاریم
ببخشید رابطه ی انتالپی پیوند و سختی مستقیمه؟؟
با سلام؛
سختی را میتوان به کمک موادری همچون «فاصله بین یونی» (Inter-ionic Distance) و بار یونی مقایسه کرد. به مثال، در ترکیباتی مانند MgO و BeO با افزایش فاصله یونی، سختی کاهش پیدا میکند. همچنین با بررسی ظرفیت یونها نیز میتوان سختی را بررسی کرد. با افزایش ظرفیت یونها، سختی نیز افزایش پیدا میکند.
با تشکر از همراهی شما با مجله فرادرس
سلام خسته نباشید
ببخشید ، آنتالپی پیوند کربن مونوکسید چند هستش ؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. انرژی تفکیک پیوند برای کربن مونواکسید برابر با $$1072 kJ/mol$$ است.
با تشکر
بله کاملا درسته.
فرادرس بسیار به حق مالکیت آموزش ها احترام قایل است اما تعجب می کنم چرا در انتشار این متن آموزشی که دقیقا ترجمه ای از لینک زیر است به این مسئله توجه نکرده است:
با سلام؛
از توجه شما بسیار سپاسگزاریم. منابع استفاده شده در تمامی متون مجله فرادرس را میتوانید در انتهای مطلب مشاهده کنید. برای تهیه این مطلب نیز از ۳ منبع استفاده شده که در انتهای متن آورده شده است.
با تشکر