ژنتیک مولکولی چیست؟ + معرفی منابع یادگیری – به زبان ساده
ژنتیک مولکولی (Molecular Genetics) بررسی و به کارگیری دانش مولکولی در زمینه وراثت و ژنوم ارگانیسمها است. در این مبحث از بیولوژی سازوکارهای مختلف در ارتباط با انواع اسیدهای نوکلئیک مطالعه میشوند. پس از خواندن این مطلب درک خواهید کرد که چگونه ژنتیک مولکولی میتواند بر سلامت جامعه تأثیر بگذارد و به افزایش کیفیت زندگی بشر کمک کند.

علم ژنتیک چیست؟
ژنتیک مطالعه در زمینه عملکرد و ساختمان اسیدهای نوکلئیک و وراثت، به ویژه مکانیسمهای انتقال ارثی و تغییر ویژگیهای ارثی در ارگانیسمهای مشابه یا مرتبط است. برخی از شاخههای ژنتیک ژنتیک رفتاری، ژنتیک کلاسیک، سیتوژنتیک، ژنتیک مولکولی، ژنتیک رشد و ژنتیک جمعیت هستند. به طور خاص ژنتیک مولکولی، مطالعه وراثت و تنوع در سطح مولکولی و بر تنظیم اطلاعات ژنتیکی بین DNA، RNA و پروتئینها متمرکز است.
یکی از زیرمجموعههای ژنتیک، ژنومیکس است (به عنوان مثال مطالعه تمام توالیهای نوکلئوتیدی از جمله ژنهای ساختاری، توالیهای تنظیمی و بخشهای غیر رمزگذار DNA در کروموزومهای موجود زنده) و پروتئومیکس (به عنوان مثال مطالعه کل پروتئینهای بیان شده در یک ارگانیسم). از تکنیکهای مختلف به کار رفته در ژنتیک میتوان به کلونینگ، واکنش زنجیرهای پلیمراز، شبیهسازی DNA، جداسازی DNA و جداسازی mRNA اشاره کرد.
ژنتیک مولکولی در درک و درمان اختلالات ژنتیکی ضروری است و به عنوان پیشرفتهترین رشته ژنتیک شناخته میشود. پروژه ژنوم انسانی یکی از مهمترین زمینههای علمی پژوهشی در حوزه ژنتیک مولکولی بود. این کار از دهه 1990 آغاز شد و در سال 2003 با هدف شناسایی ژنها و توالی جفتبازهای شیمیایی در DNA انسان به پایان رسید.
ژنتیک مولکولی چیست؟
در معنای لغوی، ژنتیک مولکولی شاخهای از ژنتیک است که با ساختار و عملکرد ژنها در سطح مولکولی سروکار دارد. اصطلاح ژنتیک مولکولی گاهی اوقات به یک نظریه بنیادی اشاره دارد که ادعا میکند ژنها تمام فرآیندهای حیات را از طریق تولید پلی پپتیدها (پروتئینها) هدایت میکنند، گاهی اوقات به یک تئوری اساسی نسبتاً کمتری در مورد بیان و تنظیم ژنها در سطح مولکولی و گاهی اوقات به یک روش تحقیقاتی اطلاق میشود که مبتنی بر استراتژیهای تحقیقاتی در نظریه اساسی ژنها است.
ژنتیک مولکولی یک زیرشاخه از زیستشناسی است که به چگونگی بروز تغییرات در ساختارهای اسید نوکلئیک یا بیان مولکولهای DNA و متعاقب آن تغییر در فنوتیپ موجودات میپردازد. ژنتیک مولکولی اغلب برای تعیین ساختار یا عملکرد ژنها در ژنوم ارگانیسم با استفاده از صفحههای ژنتیکی انجام میشود. ژنتیک مولکولی ادغام چندین زیر شاخه در زیستشناسی شامل وراثت کلاسیک مندلی، زیستشناسی سلولی، زیستشناسی مولکولی، بیوشیمی و بیوتکنولوژی است.
در ویدیوی کوتاه زیر، مفاهیم پایه ژنتیک مولکولی به زبان ساده توضیح داده میشود و در پایان، منابع مناسب برای شروع یادگیری معرفی میشوند.
محققان به دنبال جهش در یک ژن یا ایجاد جهش در یک ژن برای کشف ارتباط بین توالی ژن با یک فنوتیپ خاص هستند. ژنتیک مولکولی یک روش قدرتمند برای ارتباط جهشها با شرایط ژنتیکی است که ممکن است به جستجو و کشف درمانهای مختلف بیماریهای ژنتیکی کمک کند.

تاریخچه ژنتیک مولکولی
برای توسعه ژنتیک مولکولی به عنوان یک رشته، چندین کشف علمی لازم بود. کشف DNA به عنوان وسیلهای برای انتقال کد ژنتیکی زندگی از یک سلول به سلول دیگر و بین نسلها برای شناسایی مولکول مسئول وراثت ضروری بود. واتسون و کریک (در رابطه با فرانکلین و ویلکینز) ساختار DNA، سنگ بنای ژنتیک مولکولی را کشف کردند. جداسازی اندونوکلئاز محدودکننده در باکتری اشرشیا کولی (E. coli) توسط ورنر اربر، دانیل ناتانز و همیلتون اسمیت (Werner Arber ،Daniel Nathans ،Hamilton Smith) در سال 1969 زمینه مهندسی ژنتیک را باز کرد. از آنزیمهای محدودکننده برای تعیین خطی DNA برای جداسازی توسط الکتروفورز و ساترن بلات برای شناسایی بخشهای DNA خاص از طریق پروبهای هیبریداسیون استفاده شد.
در سال 1971 برگ با استفاده از آنزیمهای محدود کننده اولین مولکول DNA نوترکیب و اولین پلاسمید DNA نوترکیب را ایجاد کرد. در سال 1972 کوهن و بویر با قرار دادن پلاسمیدهای DNA نوترکیب در E. coli که اکنون به عنوان تحول باکتریایی شناخته میشود، اولین ارگانیسم DNA نوترکیب را ایجاد و زمینه را برای شبیهسازی مولکولی فراهم کردند. توسعه تکنیکهای تعیین توالی DNA در اواخر دهه 1970، ابتدا توسط ماکسام و گیلبرت و سپس توسط فردریک سنگر، در تحقیقات ژنتیکی مولکولی بسیار مهم بود و دانشمندان را قادر به انجام صفحههای ژنتیکی برای ارتباط توالیهای ژنوتیپی به فنوتیپها کرد.
واکنش زنجیرهای پلیمراز (PCR) با استفاده از آنزیم پلیمراز Taq که توسط مولیس در سال 1985 اختراع شد، دانشمندان را قادر ساخت میلیونها نسخه از توالی DNA خاص را که میتواند برای تغییر شکل استفاده شود یا با استفاده از جداسازی ژل آگارز دستکاری کند. یک دهه بعد، اولین ژنوم کامل توالییابی شد و متعاقباً توالی یابی ژنوم انسانی از طریق پروژه ژنوم انسانی در سال 2001 انجام گرفت. نقطه اوج همه این اکتشافات، حوزه جدیدی به نام ژنومیکس بود که ساختار مولکولی یک ژن را به پروتئین یا RNA رمزگذاری شده توسط آن بخش DNA و بیان عملکردی آن پروتئین در داخل ارگانیسم پیوند میدهد.
امروزه از طریق استفاده از تکنیکهای ژنتیکی مولکولی، ژنومیک در بسیاری از موجودات مدل در حال بررسی است و دادهها در پایگاه دادههای رایانهای مانند NCBI و Ensembl جمعآوری میشوند. تجزیه و تحلیل رایانهای و مقایسه ژنها در داخل و بین گونههای مختلف، بیوانفورماتیک نامیده میشود و جهشهای ژنتیکی را در مقیاس تکاملی به هم پیوند میدهد.

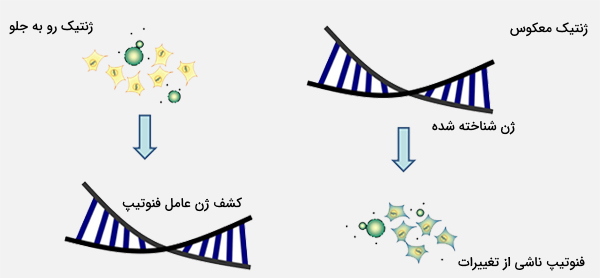
فوروارد ژنتیک چیست؟
ژنتیک فوروارد یا ژنتیک رو به جلو (Forward Genetics) یک روش ژنتیک مولکولی برای تعیین عامل ژنتیکی مسئول یک فنوتیپ است. روشهای ژنتیک رو به جلو با شناسایی یک فنوتیپ آغاز میشوند و ارگانیسمهای مدل را پیدا میکنند یا مشخصه مورد مطالعه را نمایش میدهند. این کار در ابتدا با استفاده از جهشهای رخ داده در طبیعت یا ایجاد جهشهای مصنوعی در اثر تابش، مواد شیمیایی یا جهشزایی درونی (به عنوان مثال عناصر قابل انتقال) انجام میشود. سپس افراد جهش یافته جدا شده و سپس ژن نقشه برداری میشود.
ژنتیک رو به جلو را میتوان به عنوان روش مقابل ژنتیک معکوس در نظر گرفت که با تجزیه و تحلیل اثرات فنوتیپی توالیهای تغییر یافته DNA، عملکرد یک ژن را تعیین میکند. فنوتیپهای جهش یافته اغلب غالباً قبل از داشتن هرگونه ایده مسئول بودن ژن مشاهده میشوند، که میتواند منجر به نامگذاری ژنها به نام فنوتیپ جهشیافته آنها شود. سپس با رویکرد ژنتیک کلاسیک، یک محقق ژن موجود در کروموزوم آن را با استفاده از روش تلاقی با افرادی که صفات غیرمعمول دیگری دارند و جمعآوری آماری از دفعات ارث بردن این دو ویژگی با یکدیگر، مکانیابی میکند.
در دهههای 1980 و 1990، نقشهبرداری ژنتیکی و تشخیص جهش ژنی پیشرفت بسیاری کرد. کشف علت دقیق بیماری و ژن عامل، با استفاده از تکنیکهای قدیمی ژنتیک یک فرایند بسیار طولانی و دشوار بود و تهیه نقشه و شبیهسازی ژن از طریق مطالعات و بررسی کروموزوم انجام میشد. علیرغم اینکه غربالگری ژنتیکی پرهزینه است، اما راهی برای دستیابی به اطلاعات عینی در مورد ارتباط جهش با یک بیماری فراهم میکند. یکی دیگر از مزایای غربالگری این است که نیازی به دانش قبلی در مورد ژن مورد مطالعه نیست.
به طور مثال مطالعات پیوند ژنتیکی توانست با استفاده از مارکرهای پروتئینی مکان بیماری در فیبروز کیستیک را به کروموزوم 7 مشخص کند. پس از آن، تکنیکهای کروموزومی برای شناسایی ژن و تعیین توالی آن استفاده شدند.
متخصصان ژنتیک کلاسیک از صفات فنوتیپی برای نقشهبرداری از آللهای جهش یافته استفاده میکردند. سرانجام امید این است که چنین صفحههایی به اندازه کافی بزرگ برسند که بیشتر یا همه جهشهای ایجاد شده از یک منبع را نشان دهند و در واقع ژنوم را با جهش اشباع کنند. از این نوع جهشزایی اشباع در آزمایشهای کلاسیک برای تعریف مجموعهای از ژنها استفاده میشد که برای ظهور فنوتیپهای خاص بودند. با این حال، چنین صفحات اولیه یا ناقص بودند زیرا مکانهای اضافی و اثرات اپیژنتیکی را نشان نمیدادند و انجام آنها برای برخی از فنوتیپها که غیر قابل اندازهگیری مستقیم هستند، دشوار و بسیار وقتگیر بود.
امروزه برای غربالگری از روشهای ژنتیک رو به جلو استفاده میشود که با شناسایی یک فنوتیپ آغاز میشود و ارگانیسمهای مدل را پیدا میکند یا ویژگیهای مورد مطالعه را نمایش میدهد. یک ارگانیسم رایج گورخر ماهی است که میتواند برای هدف قرار دادن جهشهایی که از بیماریها و شرایط موجود در انسان تقلید میکنند مورد استفاده قرار گیرد. اغلب صدها هزار جهش ایجاد میشود، این میتواند با کمک مواد شیمیایی یا تابش انجام شود. مواد شیمیایی مانند اتیل متان سولفونات (EMS) باعث جهشهای تصادفی میشوند.
این نوع جهشها میتوانند مفید باشند زیرا به راحتی بر روی هر ارگانیسم اعمال میشوند اما به طور سنتی نقشهبرداری از آنها بسیار دشوار است، اگرچه ظهور توالی نسل بعدی این روند را بسیار آسان کرده است. جهشها همچنین میتوانند با جهش زایی درونی ایجاد شوند. به عنوان مثال، عناصر قابل جابجایی حاوی نشانگر به طور تصادفی در ژنوم بسیج میشوند. این ترانسپوزونها غالباً برای جابجایی فقط یکبار اصلاح میشوند و هنگامی که در ژنوم قرار میگیرند میتوان از مارکر قابل انتخاب برای شناسایی افراد جهشیافته استفاده کرد.
اگر فرزندان پس از تلاقی بین دو جهش مغلوب، دارای یک فنوتیپ از نوع وحشی باشند، میتوان استنباط کرد که فنوتیپ توسط بیش از یک ژن تعیین میشود. به طور معمول، آلل حاوی قویترین فنوتیپ، بیشتر مورد تجزیه و تحلیل قرار میگیرد. سپس میتوان با استفاده از مارکرها نقشه ژنتیکی ایجاد و ژن مورد نظر را شبیهسازی و توالییابی کرد. اگر بسیاری از آللهای ژنهای مشابه پیدا شوند، گفته میشود که صفحه اشباع شده است و به احتمال زیاد همه ژنهای تولیدکننده فنوتیپ پیدا شدهاند.
بیماریها و اختلالات انسان میتوانند نتیجه جهشها باشند. روشهای ژنتیک رو به جلو در مطالعه بیماریهای توارثی برای تعیین ژنهای عامل بیماری و الگوی توارث آنها استفاده میشوند. برای شناسایی جهشهای ژنی مرتبط با فنوتیپ اختلال، میتوان پلی مورفیسمهای تک نوکلئوتیدی (SNP) را تجزیه و تحلیل کرد. قبل از سال 1980 تعداد کمی از ژنهای انسانی به عنوان عامل بیماری شناخته شده بودند تا اینکه با پیشرفت فناوریهای آزمایشگاهی، تولید قطعات مورد نظر از ژنوم و ژنتیک معکوس امکانپذیر شد.
فوروارد ژنتیک برای شرایط فنوتیپ تک ژنی یا منفرد کارایی بسیار خوبی دارد اما در بیماریهای پیچیدهتر مانند سرطان، اغلب ژنتیک معکوس به جای آن استفاده میشود. بیماریهای پیچیده بر اثر تغییرات ژنهای متعدد، جهش یا عوامل اپی ژنتیکی هستند که ممکن است مستقیما باعث بیماری شوند و یا فرد را مستعد به بیماری کنند. ژنتیک رو به جلو و ژنتیک معکوس با رویکردهای مختلفی عمل میکنند اما هر دو برای تحقیقات ژنتیک مولکولی مفید هستند و حتی میتوان از ترکیب آنها برای اطمینان از نتایج استفاده کرد.
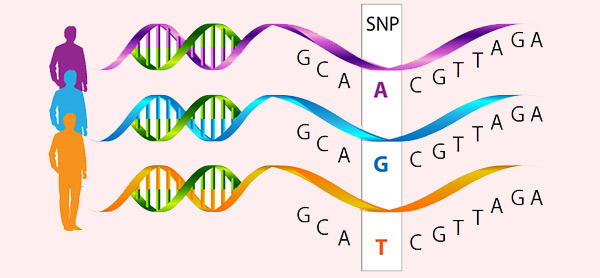
ژنتیک معکوس چیست؟
ژنتیک معکوس (Reverse Genetics) روشی در ژنتیک مولکولی است که برای کمک به درک عملکرد یک ژن از طریق تجزیه و تحلیل اثرات فنوتیپی ناشی از مهندسی ژنتیک توالیهای خاص ژن استفاده میشود. این روند در جهت مخالف و با ایجاد ارگانیسم تراریخت انجام میشود که ژن مورد نظر را بیان نمیکند. ژنتیک رو به جلو به دنبال یافتن توالی ژنی یک فنوتیپ یا صفت است، در حالی که ژنتیک معکوس به دنبال یافتن چیزی است که فنوتیپها توسط توالیهای ژنتیکی خاص کنترل میشوند.
توالی DNA خودکار حجم زیادی از دادههای توالی ژنومی را نسبتاً سریع تولید میکند. بسیاری از توالیهای ژنتیکی پیش از سایر اطلاعات بیولوژیکی که به راحتی به دست نمیآیند، کشف میشوند. در ژنتیک معکوس یک توالی ژنتیکی معین را با تأثیرات خاص به ژنوم ارگانیسم وارد میکند. به منظور یادگیری تأثیر توالی در فنوتیپ یا کشف عملکرد بیولوژیکی آن، محققان میتوانند DNA را تغییر داده یا در آن اختلال ایجاد کنند. پس از ایجاد این تغییر، یک محقق میتواند به دنبال تأثیر چنین تغییراتی در کل ارگانیسم باشد. چندین روش مختلف ژنتیک معکوس وجود دارد:
- حذف مستقیم و جهشهای نقطهای
- خاموش کردن ژن
- تداخل با استفاده از تولید ارگانیسم تراریخت
- سنتز واکسن
روشهای جایگزین تحقیقات ژنتیکی معکوس شامل القای تصادفی حذف (Random Induction Of DNA Deletions) و انتخاب توالی برای حذف (Subsequent Selection For Deletions) در ژن موردنظر و همچنین استفاده از RNA مداخله گر (RNA Interference) هستند.
کاربرد ژنتیک مولکولی چیست؟
از ژنتیک مولکولی برای تولید محیط کشت باکتریها، مطالعات بالینی در زمینه تولید واکسن، تولید حیوانات تراریخت برای مطالعه در زمینه بیماریها و داروها یا تولید محصولات غذایی بیشتر و با کیفیتتر و تولید حیوانات تراریخت با صفات جدید استفاده میشود که نمیتوان آنها را از طریق استراتژیهای استاندارد تولید مثل طی چندین نسل به دست آورد. در کشاورزی و زراعت نیز ژنتیک مولکولی در تولید گیاهانی با ویژگیهای مطلوب مانند مقاومت به شرایط سخت، تولید محصول بیشتر و مقاومت نسبت به آفات کشاورزی اشاره کرد.
همچنین ژنتیک مولکولی برای شناسایی جهشها یا مارکرهای ژنتیکی مرتبط کاربرد دارد که باعث تفاوت در فنوتیپها میشوند. دانش ژنتیک مولکولی انقلابی در زندگی ایجاد کرده است. از زمانی که واتسون و کریک برای اولین بار پیشنهاد کردند که DNA، ماده ژنتیکی همه ارگانیسمها، مارپیچی مضاعف است، طی نیم قرن اخیر روشهای متنوعی برای مطالعه این ساختار ایجاد شدهاند. به عنوان مثال، محققان با استفاده از تکنیکهای شبیهسازی مولکولی که در دهه 1970 توسعه یافتند، توانستند نسخههای زیادی از ژنهای موردنظر خود را تولید و عملکرد آنها را مطالعه کنند. این روشها به ویژه هنگام مطالعه بیماریهای ارثی ژنتیکی مانند سرطان، بسیار مفید هستند و پیشرفت در این زمینه منجر به ایجاد دانش بیوتکنولوژی شده است.
واکنش زنجیرهای پلیمراز یا PCR روشی است که با استفاده از آن تعداد بسیار زیادی کپی از یک قطعه DNA تولید میشوند. پیدایش و توسعه انواع PCR نه تنها تأثیر زیادی در پژوهشهای ژنتیک مولکولی داشته است بلکه در پزشکی، تشخیص و حتی پزشکی قانونی و جُرم شناسی کاربردهای فراوانی دارد. انگشتنگاری DNA یکی از مهمترین ابزارها برای تشخیص و ردیابی مجرمین و مظنونین جنایی است. از آنجایی که DNA هر فرد در اثر انگشت ژنتیکی به قطعات تقسیم میشود، الگوی منحصر به فردی ایجاد میکند و شناسایی با این روش بسیار قابل اعتماد است.
بهبود و اصلاح ژنتیکی، یکی دیگر از کاربردهای ژنتیک مولکولی است که هدف آن بهبود تولید گیاهان و پرورش حیوانات بهینه، برای مصرف انسان است. یکی دیگر از کاربردهای نسبتاً جدید ژنتیک مولکولی، شبیهسازی حیوانات است که از طریق این فرآیند میتوان نمونههای حیواناتی مانند گوسفند شبیهسازی شده را با روشهای آزمایشگاهی تولید کرد. این تکنیکهای جدید ژنتیک مولکولی مرزهای علم را پیش میبرند اما در کنار آن، پژوهشگران این حوزه با بحثهای اخلاقی جدیدی نیز روبرو هستند.
تکنیک های ژنتیک مولکولی
ژنتیک به طور خلاصه، مطالعه وراثت و تغییر صفات بیولوژیکی موجودات زنده است. انجام تحقیقات ژنتیکی بدون مطالعه مستقیم DNA هم امکانپذیر است. در واقع برخی از بزرگترین متخصصان ژنتیک دانش خاصی از DNA نداشتند اما در عوض تجزیه و تحلیل فنوتیپها، الگوهای وراثت و نسبت آنها را با دقت مطالعه و بر اساس مشاهدات خود الگوهای وراثت را طراحی میکردند. امروزه ژنتیک کلاسیک با زیستشناسی مولکولی تکمیل و مباحث تخصصی آن در حوزه ژنتیک مولکولی ارائه میشوند.
معمولاً آزمایشهای ژنتیک مولکولی شامل ترکیبی از تکنیکها برای جداسازی و تجزیه و تحلیل DNA یا RNA رونویسی شده از یک ژن خاص هستند. در برخی موارد، DNA ممکن است متعاقباً با جهش یا ترکیب مجدد با سایر قطعات DNA دستورزی شود. تکنیکهای ژنتیک مولکولی در بسیاری از زمینههای زیستشناسی و همچنین پزشکی قانونی، زیست فناوری و پزشکی کاربرد گستردهای دارند.
تخلیص DNA
استراتژیهای تخلیص DNA متکی بر خصوصیات شیمیایی DNA است که آن را از سایر مولکولهای سلول متمایز میکند، چون یک مولکول بسیار بزرگ با بار منفی است. برای استخراج DNA خالص از یک نمونه بافت، سلولها با خرد کردن یا لیز زدن در محلولی که حاوی مواد شیمیایی محافظت کننده از DNA است در حالی که سایر اجزای سلول را از بین میبرد، شکسته میشوند. این مواد شیمیایی ممکن است شامل مواد شویندهای باشد که غشای چربی و پروتئینهای دناتوره را حل میکند.
یک کاتیون مانند سدیم به ایجاد ثبات DNA با بار منفی و جدا کردن آن از پروتئینهایی مانند هیستون کمک میکند. یک عامل کلاته کننده، مانند EDTA برای محافظت از DNA با جداسازی یونهای منیزیم اضافه میشود که در غیر این صورت میتواند به عنوان یک کوفاکتور مشترک لازم برای نوکلئازها (آنزیمهایی که DNA را هضم میکنند) باشد. در نتیجه مولکولهای DNA دو رشتهای آزاد از کروماتین به داخل بافر استخراج آزاد میشوند که حاوی پروتئین و سایر اجزای سلولی است. مولکولهای DNA آزاد متعاقباً توسط یکی از چندین روش جدا میشوند.
معمولاً پروتئینها با تنظیم غلظت نمک، بنابراین رسوب مییابند. سپس مایع رویی که حاوی DNA و سایر متابولیتهای کوچکتر است، با اتانول مخلوط میشود که باعث رسوب DNA میشود. یک گلوله کوچک از DNA را میتوان با سانتریفوژ جمع آوری کرد و پس از حذف اتانول، DNA را میتوان در آب حل کرد (معمولاً با مقدار کمی EDTA و بافر pH) برای استفاده در واکنشهای دیگر. این فرایند تمام DNA را از یک نمونه بافت تخلیص کرده است. برای جداسازی یک ژن یا قطعه خاص از DNA، باید از تکنیکهای اضافی مانند PCR استفاده کرد.

PCR
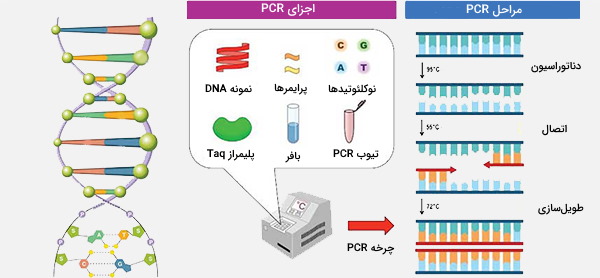
واکنش زنجیرهای پلیمراز روشی برای همانندسازی DNA است که در لوله آزمایش و در شرایط آزمایشگاهی انجام میشود. در اینجا پلی مراز به آنزیمی DNA پلیمراز استخراج شده و از باکتریها خالص میشود و واکنش زنجیرهای به توانایی این روش برای تولید میلیونها نسخه از یک مولکول DNA اشاره دارد، با استفاده از هر مارپیچ دوتایی که به تازگی تکثیر شده است به عنوان الگویی برای سنتز دو مارپیچ دوتایی جدید DNA. بنابراین PCR یک روش بسیار کارآمد برای تکثیر DNA است.
اکثر DNA پلیمرازها فقط میتوانند نوکلئوتیدها را به انتهای رشته موجود DNA اضافه کنند و بنابراین برای شروع روند همانندسازی به یک آغازگر یا پرایمر نیاز دارند. برای PCR از پرایمرهایی با حدود 20 نوکلئوتید استفاده میشود. در یک PCR ایده آل، پرایمرها فقط به ترتیب مکمل دقیق خود روی رشته الگو هیبرید میشوند. طراحی اختصاصی پرایمرها برای یک ناحیه خاص از DNA، باعث تولید و تکثیر ناحیه مورد نظر خواهد شد.
برای PCR تمام اجزای لازم برای همانندسازی DNA، از جمله DNA پلیمراز و محلول حاوی نوکلئوتیدها (dATP ،dCTP ،dGTP ،dTTP)، DNA الگو، محلول پرایمر DNA، بافر و یون (به عنوان مثال منیزیم) مورد نیاز پلیمراز در یک ویال کوچک ترکیب میشوند. PCR موفق فقط با استفاده از یک مولکول DNA به عنوان الگو انجام شده است اما در عمل، واکنش PCR حاوی هزاران مولکول الگو است. DNA الگو معمولاً قبلاً با استفاده از تكنيکهای توضيح داده شده از سلولها يا بافتها تخلیص شده است. با این حال، در بعضی شرایط میتوان سلولهای کامل را مستقیماً در واکنش PCR قرار داد تا به عنوان الگو استفاده شوند.
برش و اتصال DNA
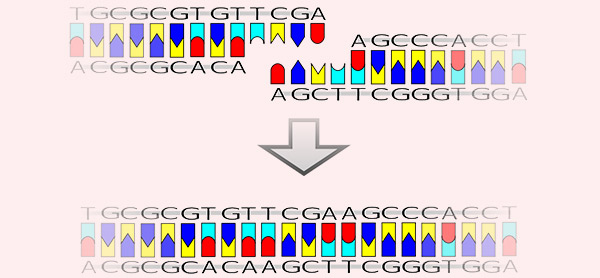
بسیاری از باکتریها دارای آنزیمهایی هستند که توالیهای DNA مشخص را تشخیص میدهند و سپس مارپیچ DNA دو رشتهای را در این توالی قطع میکنند. به این آنزیمها اندونوکلئازهای محدودکننده اختصاصی یا به عبارت سادهتر آنزیمهای محدودکننده گفته میشود و به طور طبیعی به عنوان بخشی از دفاع باکتریایی در برابر ویروسها و سایر منابع DNA خارجی عمل میکنند. برای برش DNA در مکانهای شناخته شده، محققان از آنزیمهای محدود کننده گونههای مختلف باکتریایی استفاده میکنند که امروزه میتوان آنها را از شرکتهای تجاری مختلف خریداری کرد.
این آنزیمها معمولاً بر اساس نام باکتری که برای اولین بار از آن جدا شدهاند نامگذاری میشوند. به عنوان مثال EcoRI و EcoRV هر دو آنزیم E. coli هستند. EcoRI DNA دو رشتهای را در توالی GAATTC برش میدهد. انتهای یک مولکول برش داده شده توسط EcoRI یک منطقه تک رشتهای است که انتهای چسبنده نام دارد. EcoRV نمونهای از آنزیمی است که دقیقاً در وسط توالی تشخیص خود، هر دو رشته را قطع کرده و انتهای صاف یا بلانت اند (Blunt End) ایجاد میکند. انتهای صاف ایجاد می کند. این آنزیم توالی پالیندرومی دارای ۶ باز 'GAT | ATC - 3 را تشخیص میدهد.
فرآیند اتصال DNA زمانی اتفاق میافتد که رشتههای DNA با پیوند کووالانسی به هم متصل شوند و از طریق عملکرد آنزیمی به نام DNA لیگاز از انتها به انتها متصل میشوند. گفته میشود که مولکولهای چسبناک و دارای توالی تعویض مکمل دارای انتهای سازگار هستند که اتصال آنها را برای تشکیل DNA نوترکیب تسهیل میکند. به همین ترتیب، دو توالی انتهای بلانت نیز برای در هم آمیختن سازگار در نظر گرفته میشوند، اگرچه آنها به اندازه انتهای چسبنده به هم متصل نمیشوند. مولکولهای انتهای چسبنده با توالیهای غیر مکمل با DNA لیگاز متصل نخواهند شد. پیوند در تولید DNA نوترکیب، از جمله قرار دادن قطعه DNA دو رشتهای در یک وکتور پلاسمیدی، مهم است.
تکثیر DNA با پلاسمید
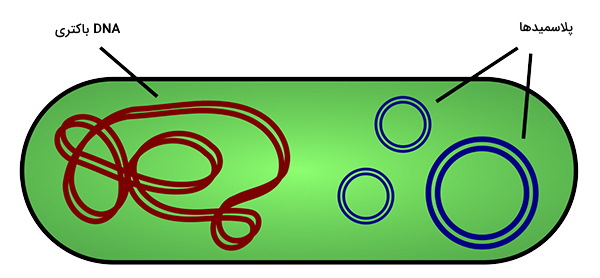
بسیاری از باکتریها حاوی DNA خارج کروموزومی به نام پلاسمید هستند. پلاسمیدها مولکولهای حلقوی کوچکی (با 1000 جفت باز) هستند که به طور مستقل از کروموزوم تکثیر میشوند و میتوانند با تعداد کپی زیاد در سلول وجود داشته باشند. در طبیعت، پلاسمیدها میتوانند طی جفتگیری باکتریایی بین افراد و حتی گاهی بین گونههای مختلف منتقل میشوند. پلاسمیدها غالباً ژنهای بیماریزایی و مقاومت به دارو را حمل میکنند، بنابراین در پزشکی از اهمیت ویژهای برخوردار هستند. در آزمایشگاه، پلاسمیدها را میتوان در فرآیندی به نام ترانفورماسیون، به درون باکتریها منتقل کرد.
استفاده از پلاسمید به عنوان وکتور
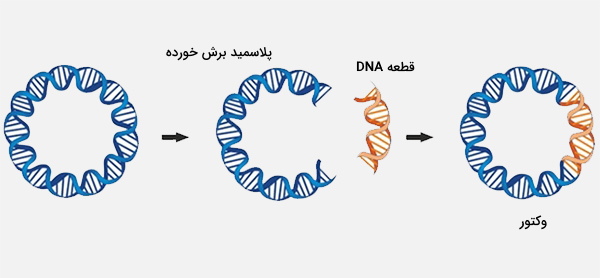
برای قرار دادن قطعه DNA در پلاسمید، قطعه مورد نظر و پلاسمید حلقوی با استفاده از یک آنزیم محدودکننده که انتهای سازگار تولید میکند، برش داده میشوند. با توجه به تعداد زیادی آنزیم محدودکننده که در حال حاضر در دسترس است، یافتن آنزیمی که توالیهای شناسایی مربوطه در آن در پلاسمید و قطعه DNA هدف وجود داشته باشد، معمولاً خیلی دشوار نیست، خصوصاً به دلیل اینکه اکثر وکتورهای پلاسمید مورد استفاده در ژنتیک مولکولی برای داشتن نواحی شناسایی تعداد زیادی از اندونوکلئازهای محدود کننده مهندسی شدهاند.
پس از هضم محدود، قطعات مورد نظر ممکن است قبل از مخلوط شدن با لیگاز، بیشتر خالص سازی یا انتخاب شوند تا به هم متصل شوند. پلاسمیدهای تازه لیگاند شده، حاوی ژن مورد علاقه، به E. coli تبدیل میشوند. تحول با مخلوط کردن DNA لیگاند شده با سلولهای E. coli که به طور ویژه برای جذب DNA آماده شدهاند انجام میشود. سلولهای حامل پلاسمید را میتوان با قرار گرفتن در معرض ترکیباتی مانند CaCl2 یا در میدانهای الکتریکی (الکتروپوراسیون) ایجاد کرد.
از آنجا که تنها بخش کوچکی از سلولها که با DNA مخلوط میشوند در حقیقت تغییر شکل میدهند، یک مارکر قابل انتخاب مانند ژن برای مقاومت به آنتیبیوتیک، معمولاً در پلاسمید نیز وجود دارد. پس از تغییر شکل (ترکیب DNA با سلولهای مناسب)، باکتریها در صفحه آگار باکتریایی حاوی یک آنتیبیوتیک مناسب پخش میشوند به طوری که فقط آن دسته از سلولهایی که واقعاً پلاسمید را در خود جای دادهاند، قادر به رشد و تشکیل کلونی هستند. سپس میتوان این مورد را انتخاب و برای مطالعه بیشتر مورد استفاده قرار داد.
متخصصان ژنتیک مولکولی از پلاسمیدها به عنوان وکتور برای حمل، تقویت، انتقال و گاهی بیان ژنهای مورد نظر که در DNA شبیهسازی شده وجود دارند، استفاده میکنند. غالباً، اولین قدم در یک آزمایش ژنتیک مولکولی کلون کردن یک ژن به یک پلاسمید است، سپس این پلاسمید نوترکیب را دوباره به باکتری منتقل میکنیم تا در اصل نسخههای نامحدود ژن (و پلاسمید حامل آن) همزمان با تکثیر باکتری، تکثیر شوند. این یک ضرورت عملی برای دستکاری بیشتر DNA است، زیرا اکثر تکنیکهای ژنتیک مولکولی آنقدر حساس نیستند که بتوانند همزمان فقط با یک مولکول کار کنند. بنابراین بسیاری از آزمایشات شبیهسازی مولکولی و نوترکیبی فرآیندهای تکراری هستند که در آنها:
- یک قطعه DNA (که معمولاً توسط PCR یا هضم محدود جدا میشود) در یک برش پلاسمید با یک آنزیم محدود سازگار کلون میشود.
- پلاسمید نوترکیب به باکتری منتقل میشود.
- باکتریها معمولا در محیط کشت مایع تکثیر میشوند.
- مقدار زیادی از DNA پلاسمید نوترکیب از محیط کشت باکتری جدا شده میشود.
- دستورزی بیشتر در پلاسمید نوترکیب انجام میشود.
- پلاسمید تغییر یافته قبل از دستورزی بیشتر یا برای بیان، دوباره به باکتری منتقل میشود.
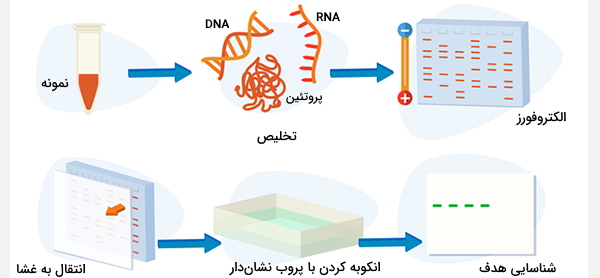
آنالیز DNA با ژل الکتروفورز
محلول DNA بی رنگ است و به جز اینکه در غلظت زیاد چسبناک باشد، از نظر آب از نظر آب قابل تشخیص نیست. بنابراین، تکنیکهایی مانند الکتروفورز ژل برای شناسایی و تجزیه و تحلیل DNA ایجاد شده است. این تجزیه و تحلیل زمانی شروع میشود که محلول DNA در یک انتهای ژل رسوب کند. این ژل از پلیمرهایی مانند آگارز که یک پلی ساکارید جدا شده از جلبک دریایی است، ساخته میشود. سپس DNA توسط یک جریان الکتریکی از طریق ژل مجبور میشود، و مولکولهای DNA به سمت الکترود مثبت حرکت میکنند.
هنگام مهاجرت، هر قطعه DNA از طریق منافذی که در بین پلیمرهای موجود در ژل وجود دارند، جدا میشود. از آنجا که قطعات کوتاهتر می توانند سریعتر از قطعههای بلند در این منافذ حرکت کنند، ژل الکتروفورز مولکولها را بر اساس اندازه (طول) آنها جدا میکند، قطعات DNA کوچکتر با سرعت بیشتری نسبت به قطعات طولانی حرکت میکنند. مولکولهای DNA با اندازه مشابه در هر ژل به مکانی مشابه مهاجرت میکنند. این ویژگی دیدن DNA را پس از رنگآمیزی DNA با یک رنگ فلورسنت مانند اتیدیوم بروماید آسان میکند. البته بر اساس اهداف مختلف و برای جداسازی مولکولهای متفاوت، الکتروفورز نیز انواع مختلفی دارد.
با جداسازی مخلوطی از مولکولهای DNA با اندازه شناخته شده (نشانگرهای اندازه) در مسیرهای مجاور روی همان ژل، میتوان طول قطعه DNA غیر مشخص را تخمین زد. بخشهای ژل حاوی باندهای DNA را نیز میتوان از ژل جدا کرد و DNA انتخاب شده را اندازهگیری کرد و در انواع دیگر واکنشها مانند تعیین توالی و شبیه سازی استفاده کرد.
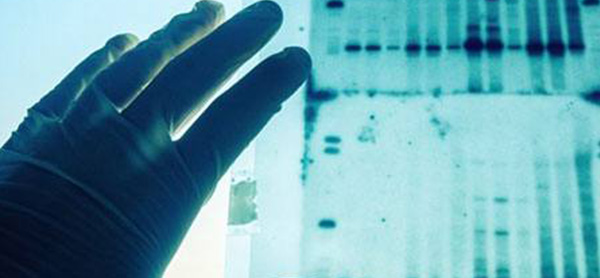
بلاتینگ و هیبریدیزاسیون
تجزیه و تحلیل DNA با رنگآمیزی و هیبریداسیون باندهای DNA در یک ژل الکتروفورتیک فقط در صورت اندازهگیری اکثر مولکولهای DNA در واکنش PCR یا هضم محدود یک پلاسمید، تشکیل میشوند. در موقعیتهای دیگر، مانند پس از هضم محدود DNA کروموزومی (ژنومی)، تعداد زیادی قطعه با اندازه متغیر در هضم وجود دارد و به جای یک باند مشخص، به عنوان یک رنگ DNA ظاهر میشود. در این حالت، استفاده از تکنیکهای اضافی برای تشخیص وجود یک توالی DNA خاص در DNA جدا شده روی ژل الکتروفورتیک ضروری است. این کار را میتوان با استفاده از ساترن بلات (Southern Blot) انجام داد.
ساترن بلات
ساترن بلات (Southern Blott) به افتخار مخترع آن «Ed Southern» نامگذاری شده است. همانطور که توضیح داده شد در مرحله اول این تکنیک، DNA با آنزیمهای محدود کننده هضم و توسط الکتروفورز ژل جدا میشود. سپس یک ورق یا غشا از نایلون یا مواد مشابه زیر ژل گذاشته میشود و DNA، در موقعیت جدا شده (باندها یا اسمیر) با کشیدن مایع از ژل، به روشی موسوم به بلاتینگ به غشا منتقل میشود. DNA بلات شده معمولاً با قرار دادن مختصر بلات در معرض نور UV به غشا UV نایلون متصل خواهد شد.
انتقال DNA به غشای محکم ضروری است زیرا ژل شکننده در طی دو مرحله بعدی فرآیند از بین میرود. بعد، غشا در محلول غلیظ میشود تا DNA متصل شده (دو رشتهای ساخته شده به صورت تک رشتهای) را غسل دهد. سپس یک محلول هیبریداسیون حاوی مقدار کمی DNA پروب تک رشتهای است که به ترتیب توالی یک مولکول هدف روی غشا است. این DNA پروب با استفاده از مولکولهای فلورسنت یا رادیواکتیو برچسبگذاری شده است.
اگر هیبریداسیون به درستی انجام شود، DNA پروب فقط با آن مولکولهای DNA روی غشا که دقیقاً مکمل آن هستند، یک دوبلکس پایدار تشکیل میدهد. سپس، کاوشگر غیر ترکیبی شسته شده و سیگنال رادیواکتیو یا فلورسنت باقی مانده در صورت تشخیص مناسب در یک باند مشخص ظاهر میشود. این باند نشان دهنده وجود یک توالی DNA خاص در مخلوطی از قطعات DNA است.
پروب توالی خاصی است که به مکمل نیاز دارد، با این حال، تغییر در دمای هیبریداسیون و محلولهای شستشو میتواند سختی پروب را تغییر دهد. در حداکثر دما، پروبها فقط با توالیهای هدف دقیق که کاملاً مکمل یکدیگر هستند (حداکثر تعداد پیوندهای هیدروژنی) هیبرید میشوند. در دمای پایین پروبها میتوانند به اهدافی که دقیقاً با آنها مطابقت ندارند ترکیب شوند اما فقط برای بخشی از توالی تقریباً مکمل یکدیگر هستند.
ساترن بلات نه تنها برای تشخیص وجود توالی DNA در مخلوطی از مولکولهای DNA، بلکه همچنین برای تعیین اندازه یک قطعه محدودکننده در یک نمونه DNA مفید است. ساترن بلات برای تشخیص قطعات بزرگتر از آنهایی که به طور معمول توسط PCR تکثیر میشوند و هنگام شناسایی قطعاتی که ممکن است ارتباط کمی با یک توالی شناخته شده داشته باشند، مفید هستند. ساترن بلات قبل از PCR ابداع شد اما PCR به دلیل سادگی، سرعت و راحتی در بسیاری از برنامه ها جایگزین بلات شده است. به دنبال توسعه ساترن بلات، انواع دیگری از تکنیکهای بلات مانند نورترن بلات اختراع شدند.
ارگانیسم تراریخت
ارگانیسمهای تراریخت، تراژن یا ترانس ژن (Transgenic Organisems) حاوی DNA خارجی هستند که با استفاده از بیوتکنولوژی وارد سلولهای آنها شده است. DNA خارجی در اینجا به معنای DNA یک گونه متفاوت یا DNA نوترکیب همان گونه تعریف میشود. اصطلاحات ارگانیسم تراریخت و ارگانیسم اصلاح شده ژنتیکی (GMO) به طور کلی مترادف هستند. به فرآیند ایجاد ارگانیسمها یا سلولهای تراریخت موجودات کامل با تغییر دائمی در رده زایای آنها ترنسفورماسیون (Transformation) یا ترانسفکشن (Transfection) گفته میشود (هر دو واژه معنای متفاوتی هم دارند.
ترنسفورماسیون همچنین به روند سرطانی شدن سلول پستانداران اشاره دارد و معنای دیگر ترانسفکشن، انتقال DNA به سلولها در محیط کشت باکتریایی یا یوکاریوتی، برای استفاده موقت و نه تغییرات رده زایا است). ارگانیسمهای تراریخته ابزار تحقیقاتی مهمی هستند و اغلب برای بررسی عملکرد ژن از آنها استفاده میشود. تراریخته همچنین مربوط به عمل پزشکی ژن درمانی است که در آن DNA برای درمان بیماری به سلولهای بیمار منتقل میشود. محصولات کشاورزی تراریخته نیز به وفور تولید میشوند.
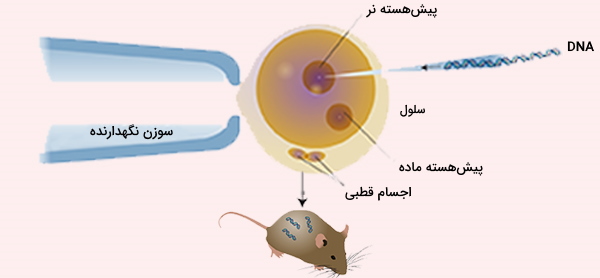
تقریباً 90 درصد کلزا، پنبه، ذرت، سویا و چغندر قند که در آمریکای شمالی رشد میکنند تراریخته هستند. در حال حاضر هیچ دام یا محصول تراریخته دیگری (به استثنای برخی کدو، پاپایا و یونجه) در آمریکای شمالی تولید نمیشوند. برای ساختن سلول تراریخته، ابتدا DNA باید بدون تخریب سلول، از طریق غشای سلول به آن منتقل شود (و در صورت وجود از طریق دیواره سلول).
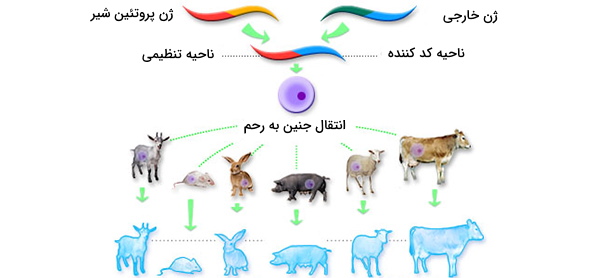
در برخی موارد DNA برهنه (پلاسمید یا DNA خطی که به هیچ نوع پروتئینی متصل نیست) ممکن است با افزودن DNA به محیط و افزایش موقت تخلخل غشا، به عنوان مثال با الکتروپراکشن، به سلول منتقل شود. هنگام کار با سلولهای بزرگتر، DNA برهنه همچنین میتواند با استفاده از یک سوزن مخصوص به سلول تزریق میشود. در روش های دیگر از ناقلها برای انتقال DNA از طریق غشا استفاده میشود.
کلمه وکتور به هر نوع حامل و نه فقط وکتورهای پلاسمیدی اشاره دارد. وکتورهای ترانسفورماسیون یا ترانسفکشن وزیکولهای ساخته شده از لیپیدها یا سایر پلیمرهایی هستند که DNA را احاطه کردهاند. انواع مختلفی از ذرات که DNA را بر روی سطح خود حمل میکنند و ویروسها و باکتریهای عفونی که به طور طبیعی DNA خود را به سلول میزبان منتقل میکنند اما برای انتقال هر مولکول DNA مورد علاقه مهندسی شدهاند. معمولاً DNA خارجی یک واحد بیان کامل و دارای تنظیم کنندههای Cis (به عنوان مثال پروموتر) و ژن هدف برای رونویسی است.
ژن درمانی
در ژن درمانی از جایگزینی و اصلاح ژنها برای درمان یا پیشگیری از بیماری استفاده میکنند. محققان از روشهای مختلفی برای ژن درمانی استفاده میکنند از جمله:
- جایگزینی ژن جهش یافته با کپی سالم ژن
- غیر فعال کردن یا ناک اوت کردن (Knocking Out) ژن جهش یافته
- معرفی ژن جدید به بدن برای کمک به مبارزه با بیماری
اگرچه ژن درمانی یک گزینه درمانی امیدوار کننده برای تعدادی از بیماریها از جمله اختلالات ارثی، برخی از انواع سرطان و برخی از عفونتهای ویروسی است، اما اطمینان از اثربخشی، ایمن و موثر بودن آن هنوز در حال مطالعه است. در حال حاضر برای برخی از بیماریها خصوصا انواعی از سرطان خون و مغز استخوان ژندرمانی قابل انجام است و اغلب نتایج بسیار خوبی دارد.
کاربرد ژنتیک مولکولی در علوم گیاهی
دانش و فناوریهای ژنتیک مولکولی و مهندسی ژنتیک برای انتقال و بیان ژنهای خارجی در گونههای زراعی کاربردهای فراوانی دارند. تعداد نسبتاً کمی از ژنهای مهم گیاهان کلون و توالی یابی شدهاند. این تا حدی ناشی از عدم شناخت مسیرهای بیوشیمیایی گیاهان است. تعداد کمی از محصولات مهم ژنی جدا و خالصسازی شدهاند تا حدی که بتوان از آنها در تولید پروب برای جداسازی ژن استفاده کرد.
ژنتیک مولکولی و کرونا
اپیدمیهای بسیاری مانند HIV ،SARS، ویروسهای خانواده کووید، ویروس ابولا، زیکا و اخیراً کووید ۱۹ یا کرونا در سالهای گذشته جهان را درگیر کردهاند. در تمام این اپیدمیها که از حیوان به انسان منتقل شدهاند، عدم آزمایش سریع و دقیق تشخیص مولکولی سلامت جامعه را تهدید کردهاند. اکثر آزمایشات برای تشخیص زودهنگام SARS-COV-2 RNA به واکنش زنجیرهای معکوس پلیمراز رونویسی متکی هستند اما روشهای تقویت واسطه ایزوترمال و روشهای مبتنی بر کریسپر (CRISPER) گزینههای بهتری هستند.
شناسایی افرادی که آنتیبادیهای ویروس SARS COV-2 را دارند، نیاز به آزمایشات سرولوژی شامل سنجش جاذب ایمنی متصل به آنزیم یا الایزا (ELISA) و روش سنجش ایمنی جریان جانبی دارد و میتوان از آنها به عنوان آزمایشهای مکمل در موارد پیچیده استفاده کرد. رقابت مداومی برای توسعه تکنیکهای آزمایشگاهی کارآمدتر و کیتهای آزمایشگاهی مقرون به صرفه وجود دارد که میتوانند در مقیاس بزرگ استفاده شوند. در حالی که RT-PCR تکنیک غالب برای شناسایی RNA ویروسی است، سایر روشهای سنجش اسید نوکلئیک مانند سنجشهای تقویت هم دما، سنجشهای ریزآرایه هیبریداسیون، توالی متاژنومیک مبتنی بر آمپلیکن و اخیراً فناوریهای مرتبط با کریسپر نیز در دست توسعه هستند.
منابع ژنتیک مولکولی
برای مطالعه مفید در زمینه ژنتیک مولکولی بهتر است اطلاعات پایه بیوشیمی داشته باشید تا مکانیسمهای مولکولی و اثرات آنها را به خوبی درک کنید که بیوشیمی لنینجر یا کتابهای خلاصهای که بر اساس آن تالیف شدهاند مفید خواهند بود. همچنین مطالعه منابع مرجع زیست شناسی سلولی و مولکولی لودیش از منابع انگلیسی و ژنتیک از دیدگاه مولکولی بروان (T.B.Brown) اطلاعات بسیاری را در زمینه ژنتیک مولکولی پوشش میدهند. برای یادگیری دقیقتر و تمرکز بر مباحث مهندسی ژنتیک و ژنتیک مولکولی نیز کتاب ژنتیک مولکولی جیمز واتسون، توصیه میشوند.













بسیار پست مفیدی بود
ممنون