آموزش ژنتیک انسانی به زبان ساده
ژنتیک انسانی بخشی از علم ژنتیک است که ساختار، عملکرد و چگونگی انتقال ژنها بین نسلهای مختلف انسان را بررسی میکند. با استفاده از مفاهیم و تکنیکهای ژنتیک انسانی میتوان احتمال انتقال ژن بیماریها از والدین به جنین را پیش از بارداری یا در زمان بارداری پیشبینی کرد. بررسی دقیق و اختصاصی ژنهای انسانی، تعیین محل دقیق قرار گرفتن ژن روی کروموزومها، تعیین تغییر توالیهای نوکلئوتیدی پس از جهش و تعیین تغییرات ساختاری پروتئین سنتز شده پس از جهش ژن به یافتن روشهای درمانی جدید و کارامدتر کمک فراوانی میکند. در این مطلب از مجله فرادرس مباحث مختلف ژنتیک انسانی را توضیح میدهیم.
- میآموزید ژنتیک انسانی و ساختار ژنوم انسانی چیست.
- با کروموزومهای انسانی و فرآیند همانندسازی آشنا میشوید.
- میتوانید مراحل بیان ژن و تغییرات پس از رونویسی را تشخیص دهید.
- تنظیم بیان ژن و الگوهای وراثت در ژنتیک انسانی را یاد میگیرید.
- درباره جهشها، ترمیم و موتاژنها در ژنتیک انسانی میآموزید.
- با نقشه ژنی، ژنتیک سرطان و تستهای ژنتیکی آشنا میشوید.


ژنتیک انسانی چیست؟
ژنتیک انسانی به بخشی از علم ژنتیک گفته میشود که ژنوم، جهشهای ژنتیکی، بیماریهای ایجاد شده به دلیل جهشها، تنظیم بیان ژن، توراث ژنها از والدین به فرزندان محل قرا گرفتن هر ژن روی کروموزوم انسان، صفت ایجاد شده بهوسیله هر ژن و مکانیسمهای طبیعی ترمیم جهشهای ژنتیکی در انسان را به طور اختصاصی بررسی میکند. به کمک این علم میتوان احتمال انتقال یک صفت سالم یا بیماری ژنتیکی (برای مثال سرطانهای ارثی) را در نسلهای مختلف یک خانواده پیشبینی و از وقوع آن پیشگیری کرد.
ژنوم انسانی چیست؟
ژنوم انسان مجموعهای از ۳ بیلیون نوکلئوتید موجود در تمام کروموزومهای هسته و DNA میتوکندریایی است. ژنوم انسان مانند سایر جانوران از کنار هم قرار گرفتن نوکلئوتیدهای گوانین (G)، سیتوزین (C)، آدنین (A) و تیمین (T) در DNA دو رشته و خطی تشکیل شده است. توالی این نوکلئوتیدها تنها در دوقلوهای همسان کاملا مشابه است. این ژنوم از بخشهای کدشونده و غیرکدشونده تشکیل شده است. ژنها بخشهای کدشونده DNA کروموزومی هستند و بین ۲۰،۰۰۰ تا ۲۵،۰۰۰ نوکلئوتید ژنوم را به خود اختصاص میدهند. انواع RNA از رونویسی این بخش ژنوم سنتز میشوند. بخشهای غیرکدشونده توالیهای تکراری ساختاری و توالیهای تنظیم بیان ژن را تشکیل میدهند. ژنهای عملکردی، ژنهای کاذب و توالیهای تکراری بخشهای مختلف ژنوم هستهای انسان را تشکیل میدهند.
- ژن عملکردی: این ژنها از دو بخش اگزون و اینترون تشکیل شدهاند. اگزونها بخشهای کدشونده ژن و اینترونها بخشهایی هستند که در تغییرات پس از ترجمه حذف میشوند. از رونویسی ژنهای عملکردی پروتئینهای تنظیمی بیان ژن، همانندسازی، هورمونهای پپتیدی، آنزیمهای متابولیکی، ناقلهای غشایی، آنتیبادیهای ایمنی هومورال، پروتئینهای انقباضی ماهیچهها، ترکیبات اسکلت سلولی، rRNA و tRNA سنتز میشود.
- ژن کاذب: دو دسته ژن کاذب در ژنوم هستهای انسان وجود دارد. دسته اول ژنهایی هستند که به دلیل جهشهای نوکلئوتیدی نقطهای در تکامل تبدیل به ژن غیرعملکردی شدهاند. دسته دوم این ژنها از mRNA خود ژن ایجاد میشوند. این mRNA به DNA تبدیل شده و DNA وارد ژنوم میشود. این DNA فاقد توالیهای تنظیمی و اینترونهای ژن والد است. در نتیجه ورود آن به ژنوم منجر به غیرفعال شدن ژن میشود.
- توالی تکراری: توالیهای تکراری بخشهای غیرعملکردی ژنوم هستند. در این بخشها یک یا چند الگوی نوکلئوتیدی تکرار میشود. این توالیها با فواصل منظم در کل ژنوم (توالیهای پراکنده) پخش شده است یا در بخشهای مشخص پشت سر هم قرار دارد. «عناصر هستهای پراکنده کوتاه» (Short interspersed Nuclear Elements | SINEs)، «عناصر هستهای پراکنده بلند» (Long Interspersed Nuclear Elements | lINEs)، «توالیهای انتهایی بلند» (Long Terminal Repeats | LTRs) و DNA ترانسپوزونها انواع توالیهای پراکنده ژنوم انسان هستند. این توالیها با حدواسط RNAای (SINEs، lINEs و LTRs) یا به طور مستقیم (ترانسپوزون) در بخشهای مختلف ژنوم انتقال یافته و تکثیر میشود. ماهوارهها توالیهای تکراری ۱۳ جفتبازی و پشت سر هم هستند. موتیفهای دونوکلئوتیدی CA و توالیهای تکنوکلئوتیدی بیشترین توالیهای پرتکرار پشت سر هم هستند. این توالیها به دلیل خطاهای همانندسازی در مرحله S چرخه سلولی ایجاد میشوند.
DNA میتوکندریایی یک مولکول حلقوی است که از حدود ۱۶،۰۰۰ نوکلئوتید تشکیل شده و مستقل از ژنوم هسته همانندسازی میکند. از ۳۷ ژن ژنوم میتوکندریایی، ۱۳ ژن پروتئینهای تنفس سلولی را کد میکنند. از رونویسی ۲۴ ژن باقیمانده RNAهای لازم در ترجمه پروتئینهای میتوکندری سنتز میشود. DNA میتوکندریایی از DNA هستهای فشردهتر و فاقد اینترون است.
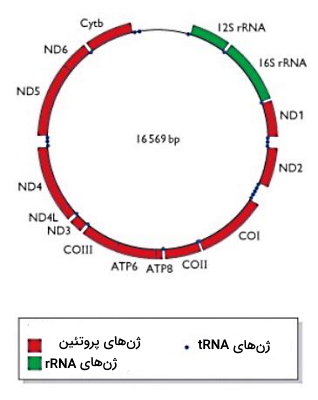
کروموزوم انسانی
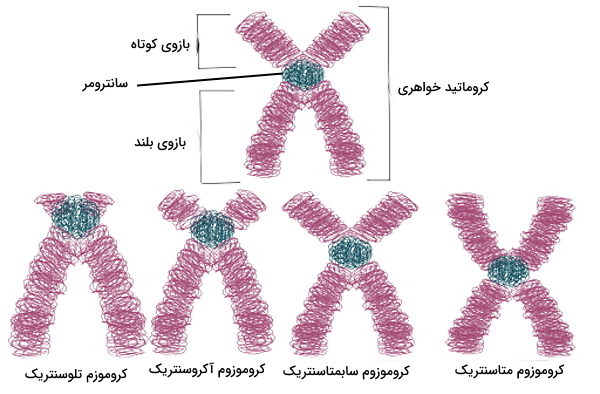
هر کروموزوم انسانی یک مولکول DNA خطی و دو رشتهای به همراه پروتئینها است که ساختار آن از یک سانترومر، یک یا دو بازو و تلومر تشکیل میشود. تلومر بخش انتهایی DNA کروموزومها است که در انسان از ۳۰۰ تا ۸۰۰۰ توالی تکراری TTAGG تشکیل شده است. این ناحیه از یک بخش دو رشته و یک انتهای تکرشتهای با توالی تشکیل شده است. انتهای تکرشتهای تلومر الگوی آنزیم تلومراز برای همانندسازی انتهای مولکول DNA است. سانترومر توالی محافظتشدهای در ساختار کروموزم و محل اتصال کروماتیدهای خواهری (دو رشته DNA مشابه تشکیل شده در همانندسازی) کروموزوم متافازی در تقسیم میتوز و میوز است. سانترومر کروموزوم را به بازوی بلند (q) و بازوی کوتاه (p) تقسیم میکند. بر اساس محل قرارگیری سانترومر میتوان کروموزومها را به انواع متاسنتریک، سابمتاسنتریک، آکروسنتریک، تلوسنتریک و سابتلوسانتریک تقسیم کرد.
- متاسنتریک: سانترومر این کروموزوم در مرکز کروماتید قرار دارد و دو بازوی ایجاد شده تقریبا با هم برابر هستند. شکل این کروموزومها شبیه حرف X انگلیسی است. کروموزومهای شماره ۱، ۳، ۱۶، ۱۹ و ۲۰ انسان متاسانتریک هستند.
- سابمتاسنتریک: در این کروموزومها سانترومر با فاصله کمی از مرکز کروماتید قرار دارد و یکی از بازوهای ایجاد شده کمی کوتاهتر از بازوی دیگر است. کروموزومهای ۲، ۴،۵، ۶، ۷، ۸، ۹، ۱۰، ۱۱، ۱۲،۱۷، ۱۸ و X انسان سابمتاسنتریک هستند.
- آکروسنتریک: در کروموزومهای آکروسانتریک با فاصله زیادی از مرکز کروماتید قرار دارد و اندازه یک بازو بسیار بلندتر از بازوی دیگر است. کروموزومهای ۱۳،۱۴،۱۵،۲۱،۲۲ و Y انسان آکروسنتریک هستند.
- تلوسنتریک: سانترومر این کروموزومها در انتهای کروماتید قرار دارد و کروموزم از یک بازو تشکیل شده است. این کروموزومها در ژنوم طبیعی انسان وجود ندارد.
- سابتلوسانتریک: سانترومر این کروموزمها فاصله زیادی با مرکز دارد و نزدیک انتهای کروماتیدی است.
تشکیل کروموزوم
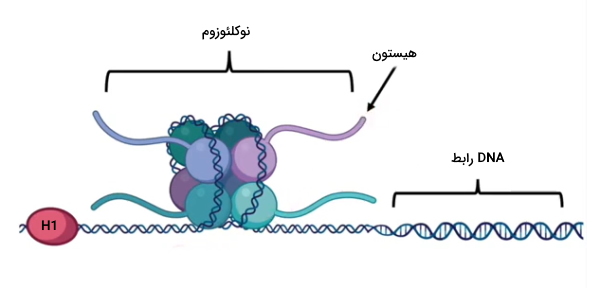
کروماتین، DNA دورشتهای هسته اینترفازی است. این DNA دورشتهای در فواصل منظم بهوسیله پروتئینهای بازی هیستون در ساختارهای نوکلئوزومی فشرده میشود. نوکلئوزوم از DNA در برابر آنزیمهای نوکلئاز محافظت میکند، در تنظیم بیان ژن نقش دارد و با فشرده کردن DNA امکان قرار گرفتن این مولکول چند میلیون بازی در هسته نانومتری را فراهم میکند. هر نوکلئوزوم از کمتر از ۱٫۶۷ پیچ DNA (bp ۱۴۶) سوپرکویل منفی و ۴ جفت پروتئین هیستون (H2A، H2B، H3 و H4) تشکیل شده است. نوکلئوزومها بهوسیله قطعه ۱۰ تا ۸۰ جفتبازی DNA رابط به هم وصل میشوند. در هر پروتئین هیستون یک موتیف تاخوردگی هیستون برای برهمکنش به هیستونهای دیگر وجود دارد. این موتیف از سه آلفا هلیکس تشکیل شده است که بهوسیله دو لوپ از هم جدا میشوند. برای تشکیل نوکلئوزوم تترامر H3/H4 در مرکز و دایمرهای H2A/H2B اطراف آن قرار میگیرند.
این پروتئینها بهوسیله گروههای عاملی زنجیره جانبی و گروههای هیدروکسیل و آمید زنجیره اصلی با گروه فسفات بازهای DNA، برهمکنش یونی و هیدروژنی میدهند. برهمکنش غیرقطبی بین زنجیره جانبی هیستونها با گروههای دئوکسی ریبوز DNA و آمینواسید آرژنین با شیار کوچک DNA به پایداری ساختار نوکلئوزوم کمک میکند. علاوه بر برهمکنشهای DNA-پروتئین، هیستون H1 به پایداری ساختار نوکلئوزوم کمک میکند. این هیستونها خارج از هسته نوکلئوزومی به DNA رابط متصل میشوند. انتهای N هیستونها حدود ۳۰٪ وزن این مولکول را به خود اختصاص میدهد و نقش مهمی در ساختار و عملکرد هیستون دارد. انتهای N پروتئینهای H2A و H2B در فواصل ۲۰ bp از شیار کوچک DNA خارج میشود. انتهای N هیستون H4 از توالی آمینواسیدهای بازی تشکیل شده است که با سطح اسیدی دیمرهای H2A/H2B برهمکنش میدهد. با تشکیل نوکلئوزوم طول کروماتین یکهفتم تا یکدهم کاهش یافته و رشتههایی با قطر ۱۰ نانومتر تشکیل میشود.
تشکیل ساختارهای سلونوئیدی یا DNA زیگزاگ مرحله بعدی فشرده شدن کروماتین است. این ساختارها بهوسیله برهمکنش هیستونهای H1 تشکیل شده و طول کروماتین را ۵۰ برابر کاهش میدهند. هر یک از این ساختارها از ۶ نوکلئوزوم تشکیل شده است که بهوسیله H1 به هم متصل هستند. اما آرایش نوکلئوزوم در این دو ساختار متفاوت است. در پایان این مرحله رشتههای کروماتینی با قطر ۳۰ نانومتر تشکیل خواهد شد. مرحله آخر فشرده شدن کروماتین بهوسیله پروتئینهای داربستی انجام میشود. در پایان، کروموزوم اینترفازی با قطر ۳۰۰ تا ۱۴۰۰ نانومتر تشکیل خواهد شد.
همانندسازی ژنوم انسانی
همانندسازی DNA یکی از فرایندهای مهم در ژنتیک انسانی است که در مرحله S چرخه سلولی انجام میشود. این فرایند امکان انتقال DNA از سلولهای اولیه به سلولهای ایجاد شده در پایان تقسیم سلولی را فراهم میکند. هر مولکول DNA ایجاد شده در پایان همانندسازی از یک رشته مولکول اولیه و یک رشته تازه سنتز شده تشکیل شده است. به همین دلیل همانندسازی یک فرایند «نیمه محافظت شده» (Semiconservative) است. در DNA یوکاریوتی چند جایگاه شروع همانندسازی با توالی وجود دارد. تعداد بیشتر بازهای تیمین و آدنین (با دو پیوند هیدروژنی بین بازی) در این توالی سبب کاهش انرژی موردنیاز برای شروع همانندسازی میشود. پروتئینهای کمپلکس پیش از همانندسازی (PRPC) این جایگاه را شناسایی، پیوند بین بازها را هیدرولیز و حباب همانندسازی را ایجاد میکند.
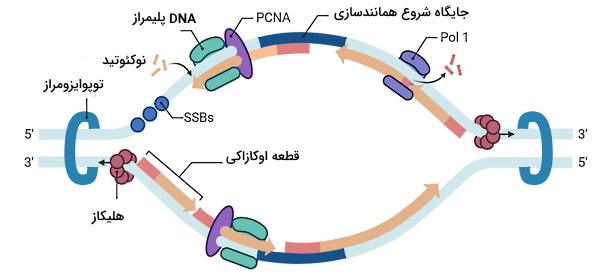
این کمپلکس مجموعهای از ۶ پروتئین ORI، (پروتئین چرخه تقسیم سلولی-۶) Cdc6، Cdt1 و هگزامر MCM است. پس از جدا شدن دو رشته DNA، پروتئینهای اتصالی به DNA تکرشتهای (SSBP) به رشتهها متصل میشود. این پروتئینها از تشکیل دوباره پیوند بین بازها در حباب همانندسازی و تجزیه پیوندهای فسفودیاستر بین بازها بهوسیله آنزیمهای اندونوکلئاز جلوگیری میکنند.
همانندسازی DNA همیشه در جهت به انجام میشود و DNA پلیمرازها گروه فسفات دئوکسی ریبوز قند نوکلئوتید جدید را به گروه هیدروکسیل دئوکسی ریبوز نوکلئوتید قبلی وصل میکنند. در نتیجه آنزیم DNA پلیمراز همیشه برای تشکیل رشته جدید به انتهای OH نیاز دارد. به همین دلیل برای شروع همانندسازی یک قطعه RNA پرایمر مکمل (۱۰ تا ۲۰ نوکلئوتیدی) با پیوند جفت بازی به DNA الگو متصل میشود. OH متصل به کربن ۲ قند ریبوز در این پرایمر محل اتصال نوکلئوتیدهای جدید است.
این پرایمر بهوسیله آنزیم DNA پلیمراز -پرایماز در چنگالهای همانندسازی دو طرف حباب همانندسازی و در جهت به تشکیل میشود. همانندسازی رشته به (رشته پیشرو یا leading) بهوسیله آنزیم DNA پلیمراز و با یک قطعه پرایمر در هر حباب همانندسازی انجام میشود. اما همانندسازی رشته به (پیرو یا lagging) به شکل قطعات کوچک DNA انجام شده که در پایان همانندسازی به هم متصل میشوند.
همزمان با همانندسازی رشته پیرو بهوسیله آنزیم DNA پلیمراز در یک طرف چنگال همانندسازی، هلیکاز بخش دیگری از دورشته DNA را در طرف دیگر چنگال باز میکند. پرایماز، پرایمر جدید را به رشته باز شده اضافه کرده و DNA پلیمراز جدید، قطعه دیگر DNA را همانندسازی میکند. به DNA تشکیل شده بین پرایمرها قطعات اوکازاکی گفته میشود. زمانی که آنزیم پلیمراز به پرایمر ابتدایی قطعات اوکازاکی میرسد، انتهای پرایمر را از DNA جدا میکند. سپس آنزیمهای اندونوکلئاز (FEN1 یا Dna2) پیوند فسفودیاستری نوکلئوتیدهای پرایمر را هیدرولیز کرده و پرایمر جدا میشود. DNA پلیمراز دئوکسی ریبونوکلئوتیدهای جدید را بین قطعات اوکازاکی اضافه کرده و آنزیم لیگاز قطعات را به هم وصل میکند. در رشته پیشرو آنزیم RNase H پرایمر را از DNA تازه سنتز شده جدا میکند.
توالی تلومری انتهای کروموزوم در هر همانندسازی کوتاهتر میشود. این توالی از حذف ژنهای عملکردی در هر تقسیم سلول جلوگیری میکند. با هیدرولیز آخرین پرایمر انتهای در رشته پیرو، گروه عاملی OH برای فعالیت آنزیم DNA پلیمراز وجود ندارد. به همین دلیل این آنزیم نمیتواند باقیمانده رشته پیرو را همانندسازی کند. آنزیم تلومراز ریبونوکلئوپروتئینی است که یک RNA مکمل توالی تلومر در آن وجود دارد. این آنزیم در انتهای DNA قرار گرفته و بخش پلیمرازی آن با استفاده از RNA مکمل تلومر نوکلئوتیدهای جدید را به انتهای رشته پیرو اضافه میکند. در مرحله بعد پرایمراز و DNA پلیمراز رشته مکمل انتهای را همانندسازی میکنند.
همانندسازی میتوکندری انسانی
DNA میتوکندریایی از یک رشته غنی از گوانین (زنجیره سنگین یا H) و یک رشته غنی از سیتوزین (زنجیره سبک یا L) تشکیل شده است. در هر یک از این رشتهها یک جایگاه شروع همانندسازی با فاصله ۱۱ kbp وجود دارد. به بازهای این فاصله کمان اصلی گفته میشود که در مرحله اول همانندسازی میشوند. ۵٫۵ kbp باقیمانده کمان فرعی را تشکیل میدهند که در مرحله دوم همانندسازی میشوند. به همین دلیل حباب همانندسازی تشکیل شده در DNA میتوکندریایی نامتقارن است. تمام آنزیمهای شرکتکننده در همانندسازی میتوکندری در هسته سنتز شده و به این اندامک منتقل میشوند. تمام DNA میتوکندریایی بهوسیله یک نوع آنزیم پلیمراز همانندسازی میشود.
Ori H جایگاه شروع همانندسازی در رشته L و Ori L جایگاه شروع همانندسازی در رشته H است. Ori H مجموعهای از نوکلئوتیدهای غیرکدکننده برای شروع همانندسازی است که در بالادست آن، توالی پایان (TAS)، سه توالی محافظت شده ژنی (CSB) و پروموتور زنجیره سبک قرار دارد. همانندسازی DNA میتوکندریایی به رونویسی آن وابسته است. قبل از همانندسازی آنزیم RNA پلیمراز میتوکندری به پروموتر رشته L متصل شده و رونویسی را در جهت Ori L شروع میکند. بازهای RNA تشکیل شده با بازهای نوکلئوتید الگو (رشته L) پیوند هیدروژنی تشکیل میدهد. این RNA غنی از نوکلئوتید گوانوزین است و با توالی ژنی CSB2 در رشته H (غنی از G) ساختار چهاروجهی G (لوپ R) تشکیل میدهد. همزمان با رونویسی توالی پلی A رونویسی پایان یافته و RNA متصل به ساختار چهاروجهی باقی میماند.
در ادامه RNAase H توالی RNA خارج از لوپ R را تجزیه میکند. پروتئینهای اتصالی به DNA تکرشته به بخشهای باز شده رشتههای L و H متصل شده DNA پلیمراز و آنزیم هلیکاز را به بالادست ژن CSB1 فرا میخواند. آنزیم DNA پلیمراز رشته H را الگو قرار داده و دئوکسی نوکلئوتیدهای مکمل را به OH انتهای لوپ R اضافه میکند. هلیکاز پیوندهای هیدروژنی بخشهای جلوتر را باز کرده و همانندسازی تا توالی Ori L ادامه دارد.
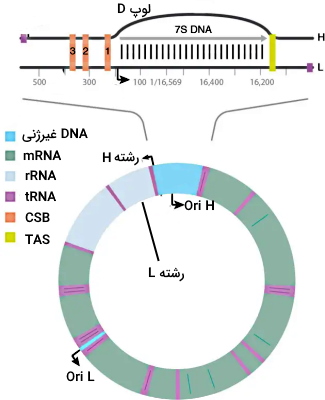
DNA پلیمراز همانندسازی رشته L را ادامه میدهد. زمانی که هلیکاز توالی Ori L را باز میکند، ۱۲ نوکلئوتید این توالی ساختار لوپ-ساقه (Stem-loop) تشکیل داده و پروتئینهای SSBP به لوپ ایجاد شده در رشته H متصل میشود. این پروتئینها آنزیم RNA پلیمراز را به لوپ فرا میخواند. این آنزیم در لوپ روی توالی پلی T قرار میگیرد و یک رشته RNA مکمل رشته H سنتز میکند. پس از رونویسی ۲۵ نوکلئوتید، RNA پلیمراز از رشته H جدا شده و جای خود را به DNA پلیمراز میدهد. همانندسازی در OriH در جهت عقربههای ساعت و OriL در جهت خلاف عقربههایادامه مییابد. پس از یک دور کامل آنزیم به Ori L برمیگردد و چند نوکلئوتید ابتدایی پرایمر RNA را جدا میکند. حرکت پلیمراز روی رشته الگو، پیوند جفتبازی باقیمانده RNA و DNA همراه آن را از رشته الگو جدا میکند. اولیگونوکلئوتید RNA-DNA جدا شده از حرکت بیشتر آنزیم پلیمراز را مهار کرده و همانندسازی پایان مییابد. آنزیمهای اندونوکلئاز (FEN1 یا EXO 5) در ادامه این اولیگونوکلوئید را از رشته تازه سنتز شده جدا میکند. در پایان آنزیم لیگاز ۳ بین نوکلئوتید پایان و شروع همانندسازی پیوند فسفودیاستری ایجاد میکند.
در رشته L، پلیمراز پس از یک دور کامل به OriH برمیگردد. آنزیم هلیکاز پیوند بین بازها در چهاروجهی گوانین را هیدرولیز کرده و RNA از رشته H جدا میشود. در مرحله بعد آنزیم RNaseH1 بخش زیادی از پرایمر را تجزیه میکند. قبل از رسیدن آنزیم به نوکلئوتیدهای باقیمانده پرایمر، پیوند جفتبازی این نوکلئوتیدها و بخشی از DNA جدید (حدود ۱۹۱ نوکليوتید انتهای ۵) باز شده و اولیگونوکلئوتید RNA-DNA از رشته جدید آویزان میشود. این نوکلئوتید بهوسیله اندنوکلئاز MGME1 تجزیه شده و DNA پلیمراز بخش انتهایی رشته L را همانندسازی میکند. در پایان آنزیم لیگاز ۳ بین نوکلئوتید پایان و شروع همانندسازی پیوند فسفودیاستری ایجاد میکند. دو dsDNA تشکیل شده در نهایت بهوسیله آنزیم توپوایزومراز از هم جدا میشوند.
تمام همانندسازیهایی که در OriL شروع میشود، پس از یک دور کامل به نقطه شروع برنمیگردد. در بعضی از همانندسازیهای DNA میتوکندری، DNA پلیمراز پس از رسیدن به توالی پایان (TAS) از رشته L جدا شده و اولیگونوکلئوتید ۶۵۰ بازی (۷s) تشکیل شده باقی میماند. اتصال این DNA به رشته L سبب جدا ماندن رشته H و تشکیل لوپ D میشود. این فرایند احتمالا همانندسازی میتوکندری را کنترل میکند.
ساختار ژن انسانی
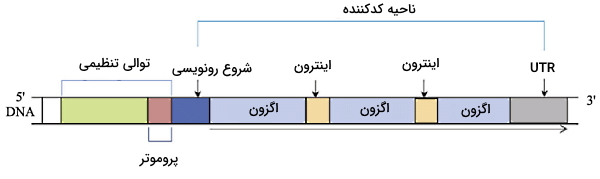
در بخشهای قبلی این مطلب از مجله فرادرس با مفاهیم ژنوم، همانندسازی ژن و کروزوم در ژنتیک انسانی آشنا شدیم. در این بخش قصد داریم توالیهای متفاوت موجود در ساختار ژن انسان را توضیح دهیم. ژنهای کدکننده پروتئین از پروموتر، اگزونها و اینترونها تشکیل شده است. اگزونها از کدونهایی تشکیل شده است که پس از رونویسی به توالی آمینواسیدی ترجمه خواهد شد. اما اینترونهای بخشهای نوکلئوتیدی بین اگزونها هستند که پس از رونویسی و قبل از ترجمه از mRNA حذف میشوند. مجموع اگزونها و اینترونهای هر ژن الگوی خواندن باز (ORF) را تشکیل میدهد.
به بخشهای قبل از کدون شروع توالیهای بالادست ژن (انتهای ) و به توالیهای بعد از کدون پایان توالی پاییندست (انتهای ) گفته میشود. پروموتر توالی تنظیمی بالادست ژن است که شروع رونویسی و میزان بیان ژن را کنترل میکند. جعبه TATA و CAAT دو توالی چهار نوکلئوتیدی در پروموتور بعضی ژنهای انسانی ازجمله بتا گلوبین هستند. توالی TATA در فاصله ۲۵ تا ۳۰ نوکلئوتیدی بالادست کدون شروع قرار دارد. نوکلئوتیدهای بین این توالی و کدون شروع رونویسی شده اما قبل از ترجمه حذف میشود و نام دارد. پروموتر بسیاری از ژنهای با بیان بالا از توالیهای تکراری تشکیل شده است. فاکتورهای رونویسی به این توالی پروموتور متصل شده و متیلاسیون نوکلئوتیدهای آن در تنظیم رونویسی نقش دارد. توالی «افزاینده» (Enhancer) و «مهارکننده» (Suppressor) محل اتصال پروتئینهای تنظیمی هستند که بیان ژن را افزایش یا کاهش میدهند. این دو توالی در فاصله نزدیک تا چند Kb بالادست و پایین دست ژن قرار دارند. در پایین دست کدون پایان بسیاری از ژنها توالی نوکلئوتیدی وجود دارد که رونویسی شده اما ترجمه نمیشود و نام دارد.
بیان ژن انسانی
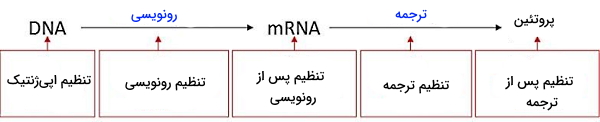
بیان ژن انسان از چهار مرحله رونویسی، تغییرات پس از رونویسی، ترجمه و تغییرات پس از ترجمه تشکیل شده است. در رونویسی کدهای DNA به mRNA تبدیل میشود. تغییرات پس از رونویسی توالیهای ، و اینترونها را حذف میکند. در ترجمه کدونهای mRNA به توالیهای آمینواسیدی زنجیرههای پلیپپتیدی تبدیل شده و تغییرات پس از ترجمه شکل فعال پروتئین را ایجاد میکند. سه آنزیم RNA پلیمراز در هسته رونویسی ژن را بر عهده دارند. RNA پلیمراز I ژنهای rRNA ریبوزومی اولیه ۴۵ s، آنزیم RNA پلیمراز II ژنهای mRNA، میکرو RNA و sRNA و RNA پلیمراز III ژن tRNA را رونویسی میکند. ساختار این سه آنزیم از هسته کاتالیزی همولوگ و زیرواحدهای اتصالی به DNA (با توالی آمینواسیدهای متفاوت) تشکیل شده است. برای مثال انتهای C در RNA پلیمراز II از الگوی تکراری هفت آمینواسید (تیروزین-سرین-پرولین-ترئونین-سرین) تشکیل شده که فسفوریلاسیون زیرواحدهای سرین آن با فعال شدن آنزیم همراه است. پروتئینها و فرایندهای انجام شده در شروع رونویسی، طویل شدن RNA و پایان رونویسی متفاوت است.
- شروع رونویسی: RNA پلیمراز II برخلاف RNA پلیمرازهای پروکاریوتی مستقیم به DNA متصل نمیشود و برای شروع رونویسی به فاکتورهای پروتئینی وابسته است. تجمع این پروتئینها و آنزیم پلیمزار، کمپلکس پیش از شروع رونویسی (PIC) را تشکیل میدهد. فاکتور رونویسی D یا TFIID اولین پروتئینی است که بهوسیله موتیف اتصالی به TATA به این بخش در پروموتر ژن متصل میشود. TFIIB، TFIIA، TFIIE، TFIIF و TFIIH فاکتورهای رونویسی دیگر کمپلکس پیش از شروع رونویسی هستند. FTIIH هلیکازی است که با هیدرولیز پیوند هیدروژنی بین بازها دو رشته DNA را از هم جدا میکند. آنزیم پلیمراز در کمپلکس پیش از شروع رونویسی غیرفعال است. فسفوریلاسیون آنزیم بهوسیله سایکلین کیناز (CDK7) همراه TFIIH سبب فعال شدن آنزیم و شروع رونویسی از رشته الگوی به میشود. اگر چه بدون حضور پروتئینهای افزاینده رونویسی با سرعت بسیار کمی انجام میشود.
- طویل شدن RNA: برای طویل شدن، پروتئینهای FACT جلوی آنزیم RNA پلیمراز حرکت کرده و با جدا کردن دیمر هیستونی H2A\H2B برهمکنش DNA پروتئین را کاهش میدهد. در نتیجه ژن در دسترس پلیمراز قرار میگیرد. در این مرحله زیرواحدهای هلیکازی RNA پلیمراز پیوند بین بازها (حدود ۲۵ جفت باز) را هیدرولیز و حباب رونویسی تشکیل میدهد. ۸ نوکلئوتید از RNA تازه سنتز شده به DNA الگو متصل میماند و باقی DNA به حالت دورشتهای برمیگردد. با هر حرکت پلیمراز یک نوکلئوتید به RNA اضافه شده و این روند تا رسیدن به توالی پایان ادامه دارد.
- پایان رونویسی: جایگاه مشخصکننده پایان رونویسی بین توالی AAUAA در بالادست و توالی غنی از GU در پاییندست mRNA تازه سنتز شده قرار دارد. پس از رونویسی این دو توالی، مجموعه پروتئینهای CPSF (فاکتور مخصوص پلیآدنیلاسیون و برش) به AAUAA و پروتئین CstF به توالی غنی از GC متصل میشود. CPSF با هیدرولیز پیوندهای فسفودیاستر بین نوکلئوتیدها در فاصله ۱۰ تا ۳۰ نوکلئوتیدی پاییندست توالی AAUAA مولکول mRNA تازه تشکیل شده را جدا میکند. پس از آزاد شدن انتهای مولکول RNA تازه سنتز شده، آنزیم پلی A پلیمراز ۵۰ تا ۱۰۰ نوکلئوتید آدنینی به انتهای mRNA اضافه میکند.
تغییرات پس از رونویسی
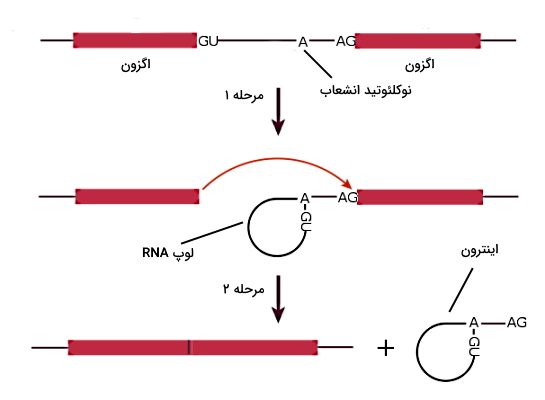
اضافه شدن ساختار 5-CAP به انتهای mRNA یکی از تغییرات پس از شروع رونویسی است. این ساختار با اضافه شدن یک نوکلئوتید گوانین با پیوند ۵ به ۵ و متیله شدن بازها و OH قند یک یا دو نوکلئوتید انتهایی تشکیل میشود. قبل شروع فرایند ترجمه، اینترونهای mRNA باید در فرایند پیرایش (RNA Splicing) جدا شده و اگزونها کنار هم قرار بگیرند. دو توالی انتهای mRNA و اینترونها در واکنشهای پیرایش RNA نقش دارند. در انتهای اینترونها یک توالی ۹ نوکلئوتیدی وجود دارد که دو نوکلئوتید آن (GU) در ژنهای مختلف مشابه است و دقیقا کنار جایگاه برش اگزون و اینترون قرار دارد. در انتهای اینترونها یک توالی ۱۲ نوکلئوتیدی است که دو نوکلئوتید آن (AG) مثل انتهای در ژنهای مختلف مشابه است. اسپلایسوزوم مجموعه آنزیمی از ریبونوکلئوپروتئینهای هسته (snRNPs) است که توالی برش اینترونها را شناسایی و برش ایجاد میکند. اسپلایسوزوم ابتدا در جایگاه اینترون، برش ایجاد میکند. انتهای آزاد شده اینترون با نوکلئوتید نقطه انشعاب (آدنوزین) در اینترون پیوند و یک لوپ بسته (ساختاری شبیه افسار) تشکیل میدهد. در مرحله دوم انتهای OH آزاد اگزون با حمله نوکلئوفیلی به نوکلئوتید جایگاه برش انتهای اینترون، به اگزون کناری متصل شده و اینترون با ساختار لوپ از mRNA خارج میشود. بیشتر ژنها از اگزونهای زیادی تشکیل شده است. الگوی متفاوت اتصال این اگزونها در پیرایش متناوب mRNA منجر به تشکیل پروتئینهای متفاوت از یک ژن میشود.
ترجمه mRNA
mRNA پس از تغییرات رونویسی از هسته خارج و وارد فرایند ترجمه میشود. در این فرایند کدونهای سهنوکلئوتیدی به کمک tRNA و ریبوزومها به توالی آمینواسیدی ترجمه میشود. هر tRNA از ۷۰ تا ۸۰ نوکلئوتید تشکیل شده است. رابطه مکملی بازها در این RNA سبب دو رشتهای RNA در بعضی مناطق و تشکیل ساختاری شبیه حرف L انگلیسی میشود. در انتهای ۳ همه tRNAها یک توالی CCA وجود دارد که آمینواسید با پیوند کوالانسی و بهوسیله آنزیم آمینوآسیل ترانسفراز به ریبوز آدنوزین آن متصل میشود. توالی آنتیکدون انتهای دیگر tRNA مکمل کدونهای mRNA هستند. فرایند ترجمه مثل رونویسی در سه مرحله شروع، طویل شدن زنجیره پلیپپتیدی و پایان انجام میشود.
- شروع ترجمه: برای شروع ترجمه ابتدا eIF-1، eIF-1A و eIF-3 (فاکتورهای شروع یوکاریوتی) به زیرواحد ۴۰S ریبوزوم و eIF-2 به tRNA-میتیونیل آغازگر متصل میشود. در ادامه mRNA بهوسیله پروتئینهای گروه eIF-4 شناسایی میشود. eIF-4E ساختار را تغییر داده و eIF-4G همزمان به eIF-4E پروتئینهای اتصالی به توالی پلی A متصل میشود. این پروتئینها همراه eIF-4B و eIF-4A پروتئین را به زیرواحد ۴۰S ریبوزوم منتقل میکند. در ریبوزوم eIF-4G با eIF-3 برهمکنش داده و به ریبوزوم متصل میشود. در مرحله بعد زیرواحد ۴۰S ریبوزوم همراه فاکتورهای شروع ترجمه و tRNA-میتیونیل mRNA را برای رسیدن به کدون شروع (AUG) بررسی میکند. پس از پیدا کردن اولین کدون AUG پروتئین eIF-5 هیدرولیز GTP به GDP فاکتور eIF-2 را تحریک کرده، فاکتورهای شروع ترجمه از ریبوزوم و mRNA جدا شده و زیرواحد ۶۰ S به ریبوزوم اضافه میشود.
- طویل شدن زنجیره پلیپپتیدی: سه جایگاه اتصال tRNA در ریبوزوم وجود دارد. جایگاه P محل اتصال tRNA همراه زنجیره پلیپپتیدی، جایگاه A محل اتصال tRNA همراه آمینواسید جدید و جایگاه E محل خروج tRNA است. متیونیل-tRNA آغازگر به کدون جایگاه P متصل میشود. مرحله اول طویل شدن زنجیره پلیپپتیدی اتصال tRNA-آمینواسیل به کدون جایگاه A است. (فاکتور طویلسازی یوکاریوتی) آمنیوآسیل-tRNA بعدی را به جایگاه A منتقل میکند. اتصال آنتیکدون-کدون تغییر کنفورماسیون ریبوزوم، تبدیل GTP به GDP و آزاد شدن همراه است. در مرحله بعد متیونین بهوسیله فعالیت آنزیمی rRNA زیرواحد ۶۰ S با آمینواسید موجود در جایگاه A پیوند پپتیدی تشکیل میدهد. در ادامه eEF-2 همراه GTP به ریبوزوم متصل شده و با هیدرولیز GTP به GDP ریبوزوم را به اندازه یک کدون (سه نوکلئوتید) روی mRNA حرکت میدهد. در این حالت پپتیدیل-tRNA وارد جایگاه P و tRNA آغازگر وارد جایگاه E و جایگاه A آماده دریافت tRNA-آمینواسیل جدید میشود. مولکول GDP پروتئین را با GTP تعویض کرده و طویلسازی ادامه پیدا میکند.
- پایان ترجمه: طویل شدن زنجیره پلیپپتیدی تا قرار گرفتن کدون پایان (UAA، UAG و UGA) در جایگاه A ادامه دارد. tRNA با آنتیکدون این توالیها در سلول وجود ندارد. فاکتور آزادسازی (eRF-1) این کدونها را شناسایی کرده و هیدرولیز پیوند زنجیره پلیپپتیدی به tRNA را تحریک میکند. پس از جدا شدن زنجیره پلیپپتیدی زیرواحدهای ریبوزوم و mRNA از هم جدا میشوند.
تنظیم بیان ژن
تمام سلولهای غیرجنسی بدن ما (به جز گلبول قرمز بالغ که فاقد هسته است و لنفوسیتهای B که با نوترکیبی DNA آنتیبادی تولید میکنند) از DNA، ژنها و کروموزومهای یکسانی تشکیل شده است. ژنی که رنگ چشم شما یا ترشح هورمون انسولین را مشخص میکند، به جز چشم و پانکراس در تمام اندامهای دیگر وجود دارد. اگر تمام ژنها یکسان هستند پس چرا سلولهای چشم هورمون انسولین ترشح نمیکند؟ به دلیل اینکه سلول از مکانیسمهای مختلفی برای تنظیم بیان ژنهای مورد نیاز خود استفاده میکند و تمام ژنها در تمام سلولها بیان نمیشوند. این مکانیسمها قبل از شروع رونویسی، در زمان رونویسی DNA، پس از رونویسی، زمان ترجمه mRNA و پس از ترجمه بیان شدن یا نشدن و سرعت بیان ژن را تنظیم میکنند.
تنظیم اپی ژنتیک
در تنظیم اپیژنتیک تغییرات ایجاد شده نوکلئوتیدهای ژن را تغییر نمیدهد. اما اضافه شدن مولکولهای شیمیایی به DNA یا پروتئینهای همراه آن، ساختار کروموزوم را تغییر داده و ژن را خاموش یا فعال میکند. این تغییرات از یک نسل به نسل بعدی منتقل میشود. اضافه شدن گروههای متیل به باز یا قند نوکلئوتیدها، یکی از تغییرات اپیژنتیکی است که با خاموش شدن ژن (توقف بیان ژن) همراه است. اضافه شدن گروههای متیل یا استیل به پروتئینهای هیستون یکی دیگر از تغییرات اپیژنتیک برای تنظیم بیان ژن است. اضافه شدن متیل به هیستونها شدت برهمکنش هیستون و DNA را افزایش میدهد. افزایش فشردگی DNA به دلیل این برهمکنش، DNA را از دسترس RNA پلیمراز خارج کرده و ژن خاموش میشود. اضافه شدن گروههای استیل به هیستون بار مثبت این پروتئین و برهمکنش آن با DNA را کاهش میدهد. در نتیجه فضای کافی برای تشکیل حباب رونویسی و بیان ژن ایجاد خواهد شد.
تنظیم رونویسی و پس از رونویسی
طول پروموتور در ژنهای مختلف متفاوت است. پروموتور با توالی بیشتر فضای بیشتری برای اتصال فاکتورهای شروع رونویسی ایجاد کرده و بیان ژن را افزایش میدهد. به علاوه اتصال پروتئینهای تنظیمی به توالی افزاینده بیان ژن را افزایش و اتصال این پروتئینها به توالی مهارکننده بیان ژن را کاهش میدهد. پیرایش متناوب mRNA با تغییر پروتئینهایی که از یک mRNA واحد در سلولهای مختلف یا در مراحل مختلف رشد یک سلول ترجمه میشود، بیان ژن را پس از رونویسی کنترل میکند. افزایش پایداری mRNA بهوسیله پروتئینهای اتصالی به RNA، توالی پلی A و با افزایش زمان حضور mRNA در سیتوپلاسم، بیان ژن را افزایش میدهد. اتصال میکرو RNA به mRNA یکی دیگر از مکانیسمهای تنظیم بیان ژن پس از رونویسی است. miRNAs در هسته و یک RNA بلند رونویسی میشوند. آنزیم دایسر پس از رونویسی RNA بلند را تجزیه و miRNA تولید میکند. miRNA همراه کمپلکس خاموشی RNA به mRNA متصل شده و با تجزیه آن بیان ژن را مهار میکند.

تنظیم ترجمه و پس از ترجمه
بیان پروتئینهای شبکه اندوپلاسمی (ER) در زمان ترجمه و پس از اتصال mRNA به ریبوزوم کنترل میشود. چند کدون ابتدایی mRNA این پروتئین مربوط به توالی آمینواسیدی است که سیگنال نام دارد. پس از ترجمه این کدونها ذرات شناسایی سیگنال (SRP) به آمینواسیدها متصل شده و ترجمه تا انتقال ریبوزوم-mRNA به ER متوقف میشود. آخرین مرحله تنظیم بیان ژن انسان ایجاد تغییراتی در پروتئین است که عملکرد آن را تغییر میدهد. اضافه شدن گروههای عاملی متیل، فسفات و آسیل یکی از این تغییرات است که فعالیت، پایداری و محل حضور پروتئین (سیتوپلاسم، هسته، غشا یا اندامکها) در سلول را تعیین میکند. تغییر زمان حضور پروتئین در سلول یکی دیگر از روشهای تنظیم بیان ژن پس از ترجمه است. در این روش مولکول یوبیکوئیتین (سیگنال تجزیه) به پروتئین اضافه شده وپروتئین برای تجزیه پروتئازوم منتقل میشود.
الگو وراثت در ژنتیک انسانی
در بخشهای قبلی این مطلب مفاهیم اولیه ژنتیک انسانی را توضیح دادیم. اما ژنها و صفات با چه الگویی از والدین به فرزندان منتقل میشود؟ در ژنوم انسان ۲۳ جفت کروموزوم همولوگ با نسخههای مختلف ژن وجود دارد که یک ست آن را از مادر و ست دیگر را از پدر دریافت کرده است. ۲۲ جفت این کروموزمها ژنهای پروتئینهای ساختاری و متابولیسمی اندامها مختلف وجود دارد و به آنها کروموزومهای اتوزومی یا غیرجنسی گفته میشود. یک جفت کروموزوم باقیمانده ژنهای تعیین جنسیت هستند. X و Y دو کروموزوم جنسی انسان هستند. در زنان دو کروموزوم X و در مردان یک کروموزوم X و یک کروموزوم Y وجود دارد.

به جایگاه ژن در هر کروموزوم لوکوس، به تمام ژنهای یک فرد ژنوتیپ و به صفت ایجاد شده از این ژنها فنوتیپ گفته میشود و الل نسخههای متفاوت یک ژن است که در تعداد کمی از نوکلئوتیدهای تفاوت دارد. در هر لوکوس ژن ممکن است یک یا بیش از یک الل ژن وجود داشته باشد. در پایان میتوز سلولهای تشکیل شده کاملا شبیه سلول اولیه هستند و تمام اللهای ژن در هسته آنها وجود دارد. اما گامتهای تشکیل شده در انتهای هر میوز یکی از کروموزومهای همولوگ سلول اولیه و در نتیجه یکی از اللها را دارد. بیشتر ژنهای انسان دو اللی هستند. اگر دو الل ژن در کروموزومهای همولوگ یکی باشد، فرد برای آن ژن هموزیگوت و اگر اللهای کروموزومهای همولوگ متفاوت باشد، فرد برای آن ژن هتروزیگوت است.
رابطه بین اللها بروز صفات (فنوتیپ) را تعیین میکند. اگر ژن یک فنوتیپ روی کروموزمهای اتوزومی باشد به آن صفت اتوزومی، اگر روی کروزموم X باشد، به آن صفت وابسته به X و اگر روی کروموزوم Y باشد، به آن صفت وابسته به Y میگوییم. بسیاری از صفات بهوسیله ژنهای دو اللی با رابطه غالب و مغلوبی کنترل میشود. در این حالت فنوتیپ ژن تنها در صورتی ایجاد میشود که حداقل یک الل غالب در ژنوتیپ فرد وجود داشته باشد. اللهای غالب را با حروف بزرگ انگلیسی و اللهای مغلوب را با حروف کوچک انگلیسی نشان میدهیم.
برای بررسی اینکه اللها با چه الگویی از پدر و مادر به فرزندان منتقل میشوند، میتوانیم از «مربع پانت» (Punnett Square) استفاده کنیم. برای مثال فرض کنید توانایی لوله کردن زبان فنوتیپ غالبی است که بهوسیله تک ژن N با الل غالب R و مغلوب r کنترل میشود. اگر ژنوتیپ مادر برای این ژن RR (هموزیگوت غالب) و پدر Rr (هتروزیگوت غالب) باشد، تمام گامتهای تشکیل شده از میوز سلولهای جنسی مادر دارای الل R هستند. اما نیمی از گامتهای تشکیل شده از سلولهای جنسی پدر در پایان میوز حاوی الل R و نیم دیگر حاوی الل r هستند. پس از لقاح هر فرزند یک الل از مادر و یک الل از پدر دریافت میکند و ژنوتیپ آن ممکن است Rr یا RR باشد. در هر دو حالت صفت مورد نظر در فرزندان بروز میکند.
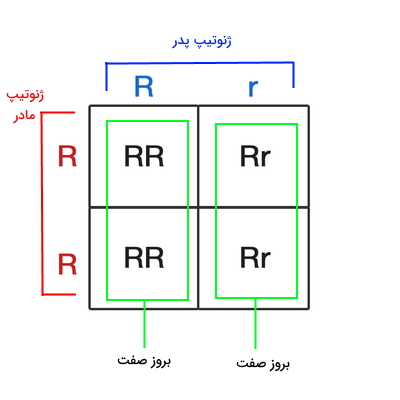
در همین مثال اگر ژنوتیپ پدر Rr و مادر rr باشد، ژنوتیپ نیمی از فرزندان شبیه مادر (rr) و ژنوتیپ نیم دیگر شبیه پدر (Rr) خواهد بود. صفت لوله کردن زبان در فرزندانی که شبیه پدر یک الل غالب دارند، بروز میکند. اگر ژنوتیپ پدر و مادر هر دو Rr باشد، به ارث بردن یک الل از هر والد ژنوتیپ احتمالی فرزندان هموزیگوت غالب (RR)، هتروزیگوت غالب (Rr) و هموزیگوت مغلوب (rr) خواهد بود. احتمال تولد فرزند RR و rr در این والدین ۲۵٪ و فرزند RR ۵۰٪ است. در این خانوادهها فرزندانی با زنوتیپ rr توانایی لوله کردن زبان را ندارند.
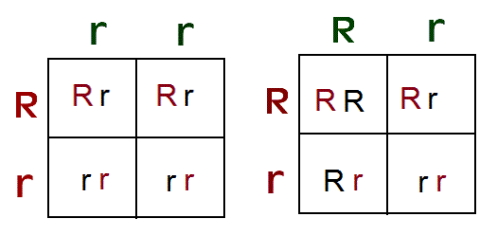
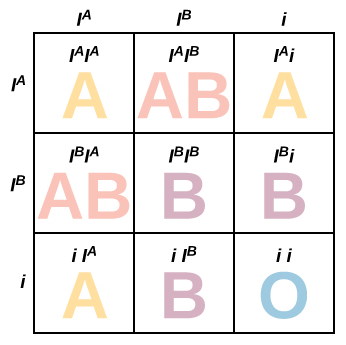
تمام صفات انسانی بهوسیله یک ژن با دو الل به ارث نمیرسد. یک صفت ممکن است بهوسیله یک ژن با دو اللی کنترل شود که رابطه همبارز یا غالب ناقص دارند. در رابطه همبارزی هر دو الل ژن سهم مساوی در ایجاد فنوتیپ دارد. در رابطه غالب ناقص فنوتیپ ایجاد شده ترکیبی از فنوتیپ دو والد است. به علاوه بعضی صفات بهوسیله یک ژن چنداللی کنترل میشوند. برای مثال ژن گروه خونی ABO از سه الل ، و i کنترل میشود. اللهای و نسبت به الل i غالب و نسبت به هم همبارز هستند. به همین دلیل فردی با دو الل یا یک الل و یک الل i، گروه خونی (فنوتیپ) A دارد. فردی با دو الل یا یک الل و یک الل i، گروه خونی B دارد. اگر هر دو الل و در کروموزومهای همولوگ فرد وججود داشته باشد، هر دو آنتیژن بیان شده و گروه خونی فرد AB است. اما اگر دو الل i در کروموزومهای فرد وجود داشته باشد، آنتیژنی بیان نشده و گروه خونی فرد O است.
صفات چندژنی یا پلیژنیک انسان بهوسیله ژنهایی کنترل میشود که هر کدام دو یا چند الل دارند. این ژنها روی دو کروموزوم همولوگ قرار دارند. رنگ پوست و قد از جمله صفات چندژنی انسان است. برای مثال فرض کنید رنگ پوست بهوسیله سه ژن ABC در سه جفت کروموزوم همولوگ کنترل میشود، هر ژن دو الل دارد و رابطه بین اللها غالب ناقص است. اللهای A، B و C فنوتیپ پوست تیره و اللهای a، b و c فنوتیپ پوست روشن را ایجاد میکنند. در نتیجه تعداد بیشتر اللهای A، B و C در کروموزومها سبب تیرهتر شدن پوست و تعداد بیشتر اللهای a، b و c سبب روشنتر شدن پوست میشود. اگر ژنوتیپ دو والد برای این ژن هتروزیگوت غالب باشد () ۶۴ ژنوتیپ و فنوتیپ مختلف برای فرزندان آنها محتمل است.

اثر محیط بر فنوتیپ
محیط و سبک زندگی فنوتیپ ژن را تغییر میدهد. برای مثال بیماری فنولکتونوریا، یک بیماری ژنتیکی اتوزومی و مغلوب است. در افراد هموزیگوت مغلوب، ژن آنزیم لازم برای تجزیه آمینواسید فنیل آلانین بیان نمیشود. در نتیجه غلظت این آلانین به سرعت در بدن افزایش یافته و به سلولها آسیب میزند. تجمع این آمینواسید در مغز، رشد طبیعی مغز را مهار کرده و منجر به عقبماندگی ذهنی، تشنج و اختلالات خلق میشود. کاهش فنیل آلانین رژیم غذایی، اثرات این بیماری را کاهش میدهد.
تعیین الگوی وراثت در ژنتیک انسانی به وسیله شجره
بررسی شجره یکی از روشهای مهم در ژنتیک انسانی برای تعیین الگوی انتقال صفات است. برای تعیین الگوی وراثت بیماریها یا فنوتیپهای چندژنی، وابسته به X یا فنوتیپی که نوع ژن آن مشخص نیست، میتوان از شجره یا دودمان استفاده کرد. در رسم شجره دایره نماد زن، مربع نماد مرد، دایره و مربع خالی نماد عدم بروز صفت، دایره و مربع رنگ شده نماد بروز صفت و خط افقی بین دایره و مربع نماد آمیزش است.
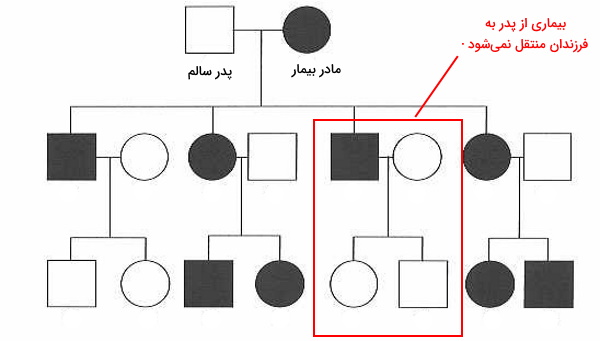
فرض کنید شجره زیر مربوط به بیماری X است. در این شجره فرزندان بیمار از والدین سالم متولد شدهاند. در این حالت میتوان نتیجه گرفت بیماری بهوسیله بیان ژن مغلوب منتقل میشود و هر دو والد برای این ژن هتروزیگوت هستند. بروز بیماری در دختر و پسر نشان میدهد، این بیماری وابسته به جنس نیست.
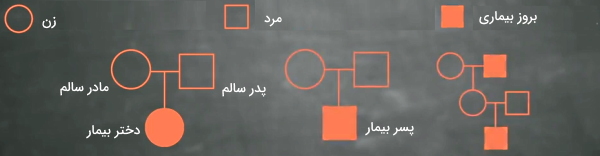
در صورتیکه یکی از والدین بیمار باشد و بیماری به هر دو فرزند دختر و پسر منتقل شود، میتوان گفت بیماری غالب اتوزومی است. اگر این پدر و مادر فرزندی بدون بیماری داشته باشند، میتوان گفت والد بیمار برای ژن بیماری هتروزیگوت و والد دیگر هموزیگوت مغلوب است.
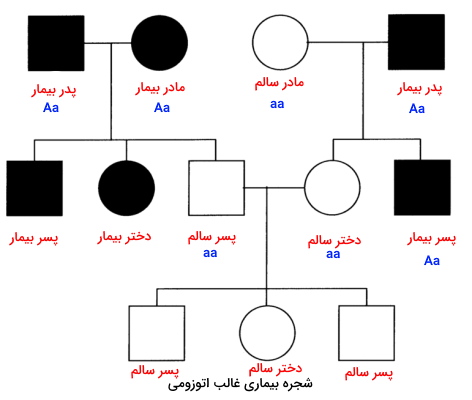
در صورتیکه پدر و مادر سالم باشند اما بیماری در فرزندان وجود داشته باشد، ژن بیماری شدن، مغلوب است. اگر بیماری در فرزندان دختر و پسر یک یا چند نسل بعد وجود داشته باشد، بیماری وابسته به کروموزومهای اتوزومی است. در شجره زیر ژنوتیپ فرد X ممکن است AA یا Aa باشد. اما داشتن یک فرزند بیمار نشان میدهد ژنوتیپ فرد Aa است.
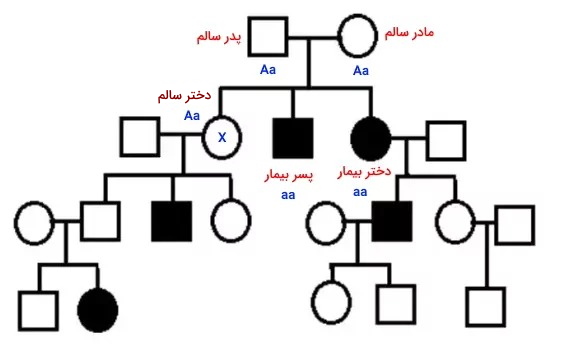
در شجره بیماری غالب وابسته به X، تمام دختران پدر بیمار، بیمار هستند (یک کروموزوم X مردان صفت غالب را بروز میدهد) و بیماری از پدر به فرزند پسر منتقل نمی شود (پسرها کروموزوم X را از مادر دریافت میکنند).
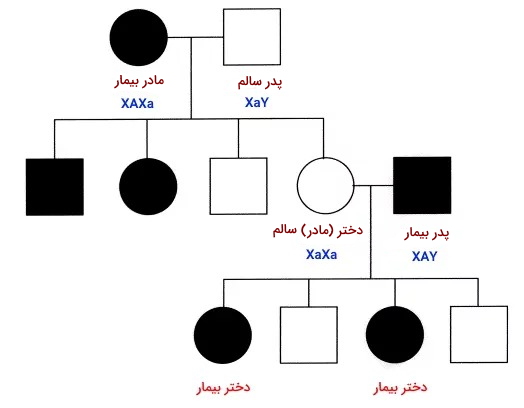
در شجره بیماری مغلوب وابسته به X تعداد مردان بیمار در نسلهای مختلف از زنان بیشتر است. تمام پسرهای مادر بیمار، بیمار هستند. بیماری از پدر به پسران منتقل نمیشود.
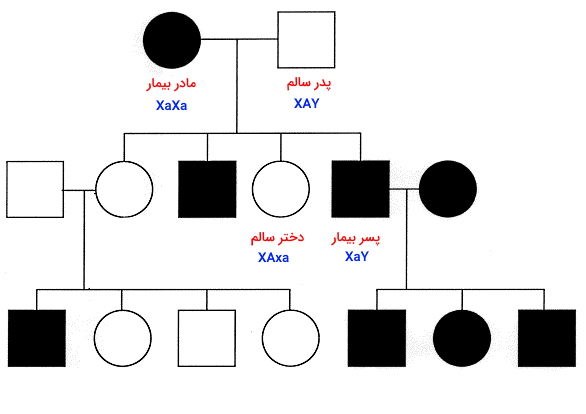
اگر بیماری وابسته به Y باشد، فقط پسران پدر بیمار، بیماری را نشان میدهند.
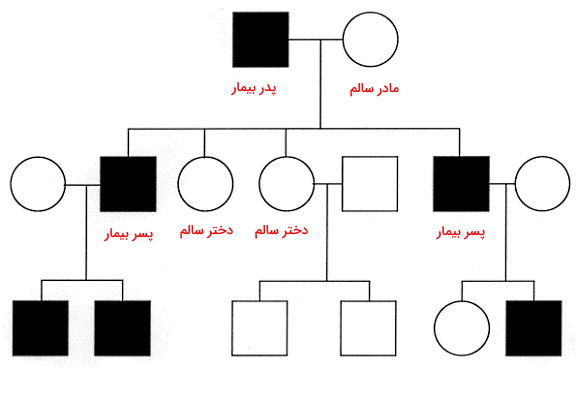
وراثت میتوکندری
در بخشهای قبلی این مطلب از مجله فرادرس توضیح دادیم که ژنوم میتوکندری ژنهای متفاوتی دارد که آنزیمهای زنجیره انتقال الکترون را کد میکنند و فرایندهای همانندسازی و رونویسی آن مستقل از ژنهای هسته است. همچنین الگوهای وراثتی ژنهای هستهای در ژنتیک انسانی را بررسی کردیم. ژنوم میتوکندری از میتوکندری مادر به فرزندان منتقل میشود. به دلیل جهش زیاد، DNA میتوکندریایی در افراد غیرخویشاوند تفاوت زیادی دارد. جهشهای ایجاد شده در DNA میتوکندریایی وابسته به جنس نیست. اما اگر بیماری ایجاد شده به دلیل جهش فقط در مرد وجود داشته باشد، فرزندان بیمار نمیشوند.
جهش در ژنتیک انسانی
جهش به دلیل تغییر نوکلئوتیدهای DNA یا ساختار و تعداد کروموزمها در سلولهای سوماتیک و تولیدکننده گامت ایجاد میشود. این تغییرات به دلیل خطاهای اصلاح نشده در همانندسازی یا برهمکنش موتاژنهای شیمیایی و فیزیکی با DNA والد ایجاد میشود. جهش ژنتیکی سلولهای سوماتیک به نسل بعدی منتقل نشده اما جهشهای سلولهای تولیدکننده گامت به نسل بعدی منتقل میشود. جایگزینی، حذف یا اضافه شدن نوکلئوتید سه فرایندی است که منجر به تغییر توالی DNA و ایجاد جهش میشود. جایگزینی به دو روش انتقالی و تراگشت انجام میشود. در جایگزینی انتقالی باز پورین (A و G) با پورین و باز پیریمیدین (C و T) با پیریمیدن جایگزین شود. در جایگزینی تراگشت باز پورین با نوکلئوتید دارای باز پیریمیدین و برعکس جایگزین میشود. اضافه یا حذف شدن سه نوکلئوتید (یا اعداد مضرب ۳) منجر به حذف یا اضافه شدن یک آمینواسید در زنجیره پلیپپتیدی نهایی میشود و اضافه یا حذف شدن بیش از سه نوکلئوتید الگوی خوانش DNA را تغییر میدهد. جهشها اثرات متفاوتی در نواحی کدکننده پروتئین و تنظیمی دارند.
- تغییر کدون بدون تغییر آمینواسید منجر به جهش خاموش ژن میشود. در این حالت جایگزینی نوکلئوتید سبب ایجاد کدون دیگر همان آمینواسید شده است. جهش خاموش در ساختار و عملکرد پروتئین تغییری ایجاد نمیکند.
- جایگزینی کدون آمینواسید با کدون آمینواسید دیگر به دلیل جایگزینی نوکلئوتید منجر به ایجاد جهش Missense میشود. این تغییر آمینواسیدی ممکن است عملکرد پروتئین نهایی را تغییر دهد.
- حذف و اضافه شدن سه نوکلئوتید (یا اعداد مضرب ۳) منجر به اضافه شدن یا حذف یک آمینواسید در پروتئین نهایی میشود. بر اساس محل جهش ممکن است تغییری در عملکرد پروتئین ایجاد نشود، بخشی از عملکرد پروتئین تغییر کند یا عملکرد پروتئین کاملا از بین برود. حذف یا اضافه شدن نوکلئوتیدها به ژن جهش تغییر الگو ایجاد میکند. برای مثال اگر نوکلئوتیدهای اولیه توالی غیرالگو ATGACGGATCAGCCGCAAT باشد که از ترجمه آنها آمینواسیدهای متیونین (AUG)، تروئونین (ACG)، آسپارژین (GAU) و گلوتامین (CAG)، پرولین (CCG) و گلوتامین (CAA) زنجیره پلیپپتیدی را میسازند، اضافه شدن یک نوکلئوتید گوانوزین بین نوکلئوتیدهای ۱۷ و ۱۸ این توالی الگوی سهنوکلئوتیدی خوانش ژن، نوع آمینواسیدها و تعداد آن در پروتئین را تغییر میدهد. شکل زیر تغییرات ایجاد شده در این جهش را نشان میدهد.
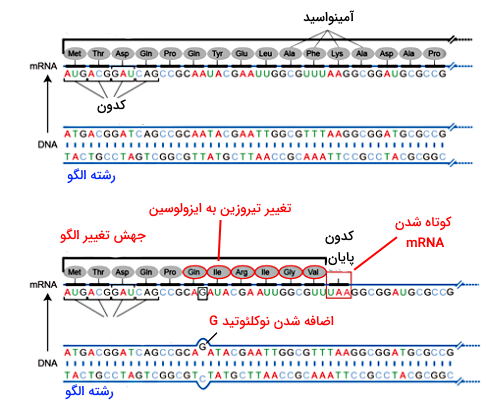
- تغییر کدون آمینواسید با تغییر کدون پایان به دلیل اضافه، حذف یا جایگزینی نوکلئوتیدی منجر به ایجاد جهش «بیمعنی» (Nonsense)، کوتاه شدن زنجیره پلیپپتیدی و از بین رفتن عملکرد پروتئین میشود.
- جهش در پروموتور، توالی افزاینده یا مهارکننده ممکن است منجر به بیان ژن در زمان و سلول اشتباه یا افزایش و کاهش سرعت بیان شود.
موتاژن های فیزیکی و شیمیایی
موتاژنهای عوامل محیطی (فیزیکی) یا شیمایی هستند که سبب جهش DNA میشود. ترکیبات آنالوگ بازها، عوامل آلکیلهکننده، ترکیبات دآمینهکننده DNA، ترکیبات اینترکلاته کننده (Intercalating Agents)، اشعه فرابنفش و پرتوهای یونساز در DNA جهش ایجاد میکنند.
- ترکیبات آنالوگ بازها: آنالوگهای بازی به طور طبیعی در بدن سنتز میشوند یا داروهای مصرفی هستند. برای مثال ویژگیهای تشکیل جفتبازی ۵-برومویوراسیل بسیار شبیه تیمین است. این نوکلئوتید پس از اتصال به نوکلئوتیدهای دیگر به انول-۵-برومویوراسیل تغییر میکند. این باز به جای آدنین با گوانین جفت میشود. به همین دلیل در همانندسازی بعدی DNA جهش نقطهای ایجاد خواهد شد.
- ترکیبات دآمینهکننده DNA: دآمینه شدن بازهای آدنین و سیتوزین در DNA با جهش نقطهای همراه است. باز تیمین گروه آمین ندارد و از دآمینه شدن باز گوانین، باز زانتین ایجاد میشود که با مهار همانندسازی در رشته الگو از ایجاد جهش جلوگیری میکند. نیتروز اسید () ترکیبی است که سرعت جدا شدن گروه آمین بازهای آدنین و سیتوزین و سدیم بیسسولفات جدا شدن آمین از سیتوزین در ساختار DNA را افزایش میدهد. از دآمینه شدن آدنین، هیپوگزانتین و از دآمینه شدن باز سیتوزین، یوراسیل ایجاد میشود. هیپوگزانتین با C و یوراسیل با A جفتباز تشکیل میدهد.
- عوامل آلکیلهکننده: این ترکیبات با اضافه کردن زنجیره جانبی |آلکیل به نوکلئوتیدها جهش نقطهای ایجاد کرده یا همانندسازی رشته الگو را متوقف میکنندو نوع تغییر ایجاد شده به نوع آلکیل و موقعیت نوکلئوتید در DNA دارد.
- ترکیبات اینترکلاته کننده: این ترکیبات بین دو رشته DNA قرار میگیرند و از ایجاد پیوند هیدروژنی بین بازها جلوگیری میکنند.
- پرتو فرابنفش: تابش پرتو فرابنفش به DNA منجر به تشکیل دیمر تیمین در DNA شده و جهش حذف در همانندسازی بعدی میشود.
- پرتوهای یونساز: پرتوهای یونساز با اثر مستقیم بر DNA یا ایجاد رادیکالهای آزاد جهشهای جایگزینی، حذف یا اضافه ایجاد میکنند.
ترمیم جهش نوکلئوتیدی در ژنتیک انسانی
اگر تا اینجا مطلب را دنبال کرده باشید، با انواع جهش و عوامل ایجاد آن در ژنتیک انسانی آشنا شدهاید. در این بخش مکانیسمهای سلولی برای ترمیم این آسیبها را توضیح میدهیم. آسیب DNA و جهشهای نوکلئوتیدی، مسیر پاسخ به آسیب (DNA Damage Response | DDR) را فعال میکند. آنزیمهای این مسیر با ۵ مکانیسم «برش باز» (Base Excision Repair | BER)، «برش نوکلئوتید» (Nucleotide Excision Repair | NER) و «ترمیم بازهای ناجور باز» (Mismatch Repair | MMR) آسیب در یک رشته DNA و «نوترکیبی همولوگ» (Homologous Recombination | HR) و «اتصال انتهای غیر همولوگ» (Non-Homologous End Joining | NHEJ) آسیب ایجاد شده در دو رشته DNA را در مراحل مختلف چرخه سلولی ترمیم DNA میکنند.
در این ترمیم بازهای تغییریافته به دلیل اکسیداسیون، آلکیلاسیون و دآمیناسیون در مرحله G1 تقسیم سلولی ترمیم میشود. باز تغییریافته بهوسیله ۱۱ آنزیم گلیکوزیلاز مختلف شناسایی میشود. بعضی آنزیمهای گلیکوزیلاز ازجمله یوراسیل گلیکوزیلاز و N-متیل پورین DNA گلیکوزیلاز فقط پیوند باز با قند (پیوند گلیکوزیدی) را هیدرولیز میکنند و به آنها آنزیم تکعملکردی گفته میشود. اما بعضی از این آنزیمها ازجمله آنزیم گلیکوزیلاز شبه نیل ۱ (Nei-like DNA glycosylase 1 | NEIL1) علاوه بر هیدرولیز پیوند گلیکوزیدی، پیوند فسفودیاستری انتهای جایگاه فاقد باز را تجزیه میکنند و به آنها آنزیم دوعملکردی گفته میشود. ترمیم باز از دو مسیر قطعه کوتاه و قطعه بلند انجام میشود.
- قطعه کوتاه: در این ترمیم ابتدا آنزیم گلیکوزیداز باز تغییریافته را از DNA خارج کرده و یک جایگاه بدون باز () ایجاد میکند. اگر باز بهوسیله آنزیم گلیکوزیدی تک عملکردی جدا شود، در مرحله بعد آنزیم اندونوکلئاز AP1 پیوند فسفودیاستری انتهای جایگاه بدون باز را در رشته بدون باز هیدرولیز کرده و آزاد ایجاد میشود. DNA پلیمراز بتا آنزیم دیگر مسیر ترمیم تکبازی است. دومین انتهای C این آنزیم، پلیمراز و دومین انتهای N این آنزیم لیاز است. دومین لیاز این آنزیم قند باقیمانده از نوکلئوتید قبلی را جدا میکند و دومین پلیمرازی نوکلئوتید مکمل رشته سالم را در AP قرار میدهد. سپس کمپلکس آنزیمی لیگاز بین انتهای نوکلئوتید جدید و نوکلئوتید قبلی پیوند ایجاد میکند.
- قطعه بلند: این روش بیشتر برای ترمیم اکسیداسیون نوکلئوتید و در زمان کمبود ATP در سلول انجام میشود. در این روش یک توالی نوکلئوتیدی شامکل نوکلئوتید تغییریافته از رشته DNA خارج میشود. آنزیمهای گلیکوزیلاز دوعملکردی با جدا کردن باز و هیدرولیز پیوند فسفودیاستر بین نوکلئوتیدها آزاد در DNA ایجاد میکنند. آنزیم DNAپلیمراز دلتا، PCNA، FEN1 و لیگاز I جایگاه بدون باز ایجاد شده بهوسیله این آنزیمها را شناسایی میکند. DNA پلیمراز به کمک PCNA به رشته متصل شده و نوکلئوتیدهای جدید را به جایگاه AP اضافه، آنزیم FEN1 قطعه اولیگونوکلئوتیدی ایجاد شده را از DNA اصلی جدا و لیگاز بین فسفودیاستری آخرین نوکلئوتیدها را ایجاد میکند.
برش نوکلئوتید
از این روش بیشتر برای ترمیم تغییرات ایجاد شده در اثر اشعه UV و ترکیبات شیمیایی محیط استفاده میشود. در این ترمیم پروتئینهای XP آسیب DNA بهوسیله اشعه UV را شناسایی میکند. جهش ژن این پروتئینها با حساسیت زیاد با نور خورشید (Xeroderma Pigmentosume) همراه است. XPc اولین پروتئینی است که به محل آسیب متصل میشود. در ادامه XPA و XPD پیوند هیدروژنی بین بازها در محل آسیب را هیدرولیز میکند. در مرحله بعد اندونوکلئاز (ERCC1-XPF) پیوند فسفودیاستری نوکلئوتید در انتهای و محل آسیب را در یک رشته برش داده و تعدادی از نوکلئوتیدها را جدا میکند و در آخر DNA پلیمراز نوکلئوتیدهای مکمل رشته سالم را در جای خالی اضافه میکند. برش نوکلئوتیدی علاوه بر پایان همانندسازی، در زمان رونویسی به ترمیم DNA کمک میکند. اگر RNA پلیمراز در مسیر رونویسی به دیمر تیمین یا ترکیبات شیمیایی بین DNA برسد، TF2H (فاکتور رونویسی) پروتئینهای ترمیم را به محل ترمیم فرا میخواند.
ترمیم ناجور باز
در این روش نوکلئوتیدهای غیرمکمل ایجاد شده در همانندسازی ترمیم میشوند. جفتهای غیرمکمل ساختار شیار کوچک DNA را تغییر میدهند. پروتئین MutS این آسیب را شناسایی و بهوسیله موتیف Phe-X-Glu انتهای آمینی به DNA متصل میشود. در مرحله بعد MutL به هومودیمر MutS متصل شده و بین این پروتئین و پروتئینهای برش DNA ارتباط برقرار میکند. باز غیرمکمل بهسیله اگزونوکلئاز I جدا شده و پروتئین همانندسازی ۱ (RP1) نوکلئوتید مکمل را جایگزین نوکلئید جدا شده میکند.
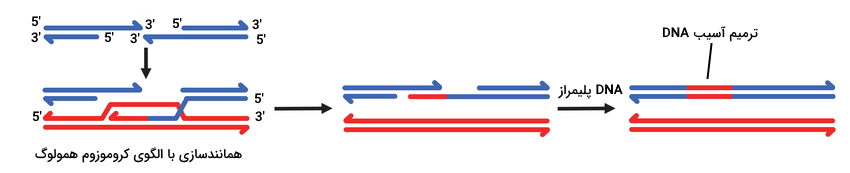
نوترکیبی همولوگ
نوترکیبی همولوگ مکانیسمی است که برای ترمیم شکست ایجاد شده در دو رشته DNA در اثر پرتوهای یونساز استفاده میشود. این پرتوها در محل شکست انتهای آزاد تکرشتهای (Overhang) ایجاد میکنند. در این مکانیسم کمپلکس پنتامری MRN مولکول DNA آسیبدیده را شناسایی میکند. این کمپلکس از پروتئینهای هومودیمرهای MRE11 ، Rad50 (اندونوکئاز نوترکیبی میتوز) و مونومرNBS-1 (پروتئین سندروم شکست نیچمیگن) تشکیل شده است. پروتئین Rad50 این کمپلکس از یک دومین سر، دومین روی و هلیکس بین این دومینها تشکیل شده است. در این کمپلکس هومودیمر MRE11 به Rad50 و همودیمر NBS-1 به MRE11 متصل است. این کمپلکس در دو طرف شکست ایجاد شده روی انتهای دورشتهای DNA قرار میگیرید. قرار گرفتن کمپلکس روی DNA کنفورماسیون پروتئین NBS-1 را تغییر داده و این پروتئین سرین-تروئونین کیناز ATM را فعال میکند. این کیناز فعال هیستونهای H2AX را فسفوریله میکند.

هیستون فسفوریله CDK2 (کیناز چرخه تقسیم سلول) را فعال میکند. CDK2 ژن TP53 روی کروموزم ۱۷ را فعال میکند. پروتئین این ژن (p53) بیان فاکتورهای رونویسی مهار چرخه سلولی و آنزیمهای ترمیم را فعال تحریک میکند. CTLP یکی از این پروتئینها است که به پروتئینNBS-1 متصل میشود. پس از اتصال این پروتئین کمپلکس MRN به اندازه ۱۰۰ تا ۲۰۰ نوکلئوتید در جهت مخالف برش ایجاد شده حرکت کرده و پروتئین MRE11 در رشتهای که انتهای آن آسیب دیده است (رشته به )، برش ایجاد میکند. در ادامه کمپلکس MRN به سمت محل آسیب حرکت کرده و تمام نوکلئوتیدهای بین برش MRE11 و محل آسیب را جدا میکند. همزمان اگزونوکلئاز EXO1 در جهت به حرکت کرده و نوکلئوتیدهای حدود ۸۰۰ نوکلئوتید دیگر را جدا میکند. در نهایت دو انتهای تکرشتهای در محل آسیب DNA ایجاد خواهد شد. RPA (پروتئین همانندسازی A) به DNA تکرشتهای متصل شده و کمپلکس MRN از DNA جدا میشود. در ادامه پروتئین BRCA2 (پروتئین سرطان پستان ۲) پروتئینهای Rad51 راجایگزین RPA میکند.
اگر سلول در مراحل پایانی تقسیم سلولی باشد، کروموزمها همانندسازی شده و به کروموزمهای همولوگ متصل هستند. در این مرحله سلول از هر کروماتید خواهری به عنوان الگوی همانندسازی اولیگونوکلئوتیدهای خارج شده از استفاده میکند. اگر سلول در G0 و قبل از شروع چرخه تقسیم باشد، سلول کروموزمهای همولوگ را الگوی همانندسازی اولیگونوکلئوتید خارج شده قرار میدهد. پروتئین Rad51 هلیکازی است که بخشی از دو رشته DNA کروموزوم همولوگ را از هم جدا میکند. DNA آسیبدیده با رشته مکمل خود در کروموزوم همولوگ جفت میشود. DNA پلیمراز نوکلئوتیدهای مکمل را به انتهای اضافه کرده و پس از اضافه شدن چند نوکلئوتید، رشته آسیبدیده از رشته مکمل خود جدا میشود. بلندتر شدن انتهای فاصله بین شکاف بین دو قطعه DNA را پر کرده و چند نوکلئوتید انتهای با رشته مکمل خود جفتباز میشوند. در ادامه DNA پلیمرازهای گاما و دلتا بخشهای خالی دو رشته را پر میکند.
اتصال انتهای غیر همولوگ
مکانیسم اتصال انتهای غیرهمولوگ یکی دیگر از روشهای ترمیم آسیب دو رشته DNA است. در این روش برخلاف روش نوترکیبی همولوگ بخشی از DNA آسیبدیده از بین میرود و توالی DNA پس از ترمیم مثل قبل نیست. شناسایی DNA آsیبدیده بهوسیله کمپلکس MRN، فعال شدن CDK2 و پروتئین p53 با رونویسی ژنهای پروتئین ku و DNA-pkcs همراه است. هترودیمر ku از دو زیرواحد ku70 و ku80 تشکیل شده و ساختار حلقهای دارد. DNA-pkcs (زیرواحد کاتالیزی پروتئین کیناز DNA) سرین-تروئونین کینازی است که پس از اتصال به ku فعال میشود. این آنزیم به هترودیمر ku روی DNA متصل و فعال میشود. آرتمیس اندونوکلئاز مکانیسم ترمیمی اتصال انتهای غیرهمولوگ است که به DNA-pkcs متصل میشود. اضافه شدن گروه فسفات بهوسیله DNA-pkcs به باقیمانده سرین در این آنزیم با فعال شدن فعالیت اندونوکلئازی و ایجاد برش در رشته overhang همراه است. در ادامه کمپلکس سه پروتئین لیگاز IX، XRCC4 و XLF (پروتئین همراه XRCC4) در شکاف ایجاد شده بین دو قطعه DNA قرار میگیرد. آنزیم لیگاز با ایجاد پیوند فسفودیاستری دو انتهای DNA به هم متصل میکند. در نتیجه DNA با حذف بخشی از توالی نوکلئوتیدی آن ترمیم شده است.
جهش کروموزومی در ژنتیک انسانی
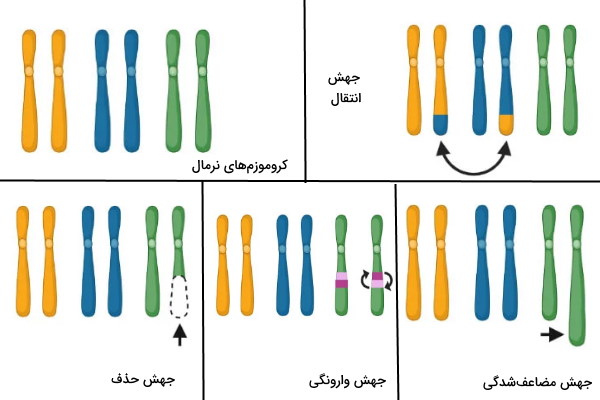
در بخشهای قبلی این مطلب از مجله فرادرس انواع جهشهای نوکلئوتیدی و روشهای ترمیم آن در ژنتیک انسانی را توضیح دادیم. در این بخش جهشهای کروموزومی که ممکن است با بیماریهای ژنتیکی همراه باشد را بررسی میکنیم. جهشهای کروموزومی به دلیل خطاهای ایجاد شده در تقسیم سلولی یا بهوسیله موتاژنها ایجاد میشود. این جهشها ساختار یا تعداد کروموزومها را تغییر میدهد. «مضاعف شدگی» (Duplication/Amplifications)، «جابهجایی» (Translocation)، «وارونگی» (Inversion) و حذف چهار جهش ساختاری کروموزم هستند.
- مضاعف شدگی: در این جهش بخشی از کروموزم دو یا چند برابر میشود. سلولی که این کروموزوم را دریافت میکند بیش از یک نسخه از ژن دارد. قطعه مضاعف شده ممکن است کنار قطعه قبلی یا در بخشهای دیگر همان کروموزوم قرار بگیرد، به کروموزم غیرهمولوگ متصل شود یا اگر قطعه همراه سانترومر باشد، یک کروموزم جدید به سلول اضافه کند.
- جابهجایی: در جهش جابهجایی بخشی از کروموزم بین دو کروموزوم غیرهمولوگی جابهجا میشود. در این جهش ممکن است بخشی از کروموزم جدا شده و به انتهای یا بخشهای میانی کروموزم غیرهمولوگ متصل شود. روش دیگر جابهجای تبادل قطعه کروموزی بین دو کروموزم غیرهمولوگ است.
- وارونگی: در این جهش قطع جدا شده از کروموزوم پس از معکوس شدن در محور عمودی در همان محل و درهمان کروموزوم قرار میگیرد. این جهش در عملکرد نهایی ژن تغییری ایجاد نمیکند. اگه سانترومر در قطعه معکوس شده ورجود نداشته باشد، وارونگی پاراسنتریک و اگر سانترومر در این قطعه وجود داشته باشد، وارونگی پریسنتریک ایجاد شده است.
- حذف: در این جهش بخشی از کروموزم به دلیل فعالیت آنزیمهای نوکلئازی از کروموزوم جدا شده و حذف میشود. در نتیجه بخشی از ژنها در سلول دریافتکننده کروموزم وجود ندارد. این جهش با کوتاه شدن طول کروموزوم همراه است.
تغییر تعداد کروموزوم های انسان
تغییر تعداد کروموزومها به دلیل جدا نشدن کروماتیدهای خواهری در متافاز میتوز یا کروموزومهای همولوگ در متافاز میوز ایجاد میشود. به افزایش یا کاهش یک کروموزم آنیوپلوئیدی و اضافه شدن یک ست هاپلوئید به سلول، پلیپلوئیدی گفته میشود. پلیپلوئیدی به دلیل جدا نشدن تمام کروموزومها در متافاز ایجاد میشود. این جهش در انسان با مرگ سلول همراه است. سندروم ترنر و داون دو بیماری ژنتیکی ایجاد شده به دلیل افزایش تعداد کروموزوم هستند. در سندروم ترنر کروموزمهای X در متافاز کامل جدا نشده و در یکی از اووسیتهای ایجاد شده یک کروموزوم X وجود دارد. لقاح این گامت منجر به تولد نوزاد دختر مبتلا به سندروم ترنر میشود. در سندروم داون کروموزم ۲۱ در متافاز میوز کامل جدا نشده و در یکی از اووسیتهای ایجاد شده ۳ کروموزوم ۲۱ وجود دارد. لقاح این گامت منجر به تولد نوزاد مبتلا به سندروم داون میشود.
نقشه ژنی انسان
تعیین نقشه ژنتیکی به معنی مشخص کردن جایگاه هر ژن روی کروزوم و تعیین فاصله بین ژنها در یک کروزوم است. این نقشه به تعیین شیوه وراثت ژنها، صفات و بیماریهای ژنتیکی کمک میکند. این نقشه را میتوان به دو روش فیزیکی و ژنتیکی تعیین کرد. در روش فیزیکی فاصله واقعی ژنها بر اساس تعداد نوکلئوتیدهای بین دو ژن محاسبه میشود. نقشه فیزیکی را میتوان با استفاده از تکنیکهای جایگاه آنزیم محدودکننده، «هیبریداسیون فلورسنت درجا» (Fluorescent in Situ Hybridization | FISH) و «جایگاه توالی نشانه» (Sequence-Tagged Sites | STS) مشخص کرد.
- جایگاه آنزیم محدودکننده: جایگاه آنزیم محدودکننده توالی ۶ تا ۸ نوکلئوتیدی است که بهوسیله آنزیمهای محدودکننده شناسایی و پیوند فسفودیاستری بین نوکلئوتیدهای آن برش داده میشود. جایگاه برش این آنزیمها ممکن است در محل شناسایی یا در فاصله چندین نوکلئوتیدی این جایگاه باشد. در این روش قطعه DNA با توالی نامشخص بهوسیله آنزیمهای محدودکنندهای که توالی جایگاه شناسایی آن را میدانیم، برش داده میشود. تعداد بازهای قطعات DNA ایجاد شده بهوسیله یک آنزیم و مخلوط آنزیمها در ژل الکتروفورز تعیین شده و جایگاه شناسایی آنزیم محدودکننده مشخص میشود.
- FISH: در این روش از قطعات DNA نشاندار شده بهوسیله مولکول فلورسنت یا رادیوایزوتوپ برای شناسایی توالی مشخصی در DNA استفاده میشود.
- STS: توالی نشانه، توالی ۲۰۰ یا ۵۰۰ جفتبازی DNA است که یک نسخه از آن در ژنوم وجود دارد و نوع بازهای آن مشخص است.

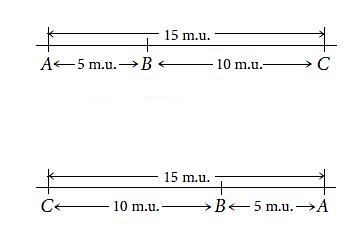
در روش ژنتیکی جایگاه هر ژن و فاصله ژنها بهوسیله فراوانی نوترکیبی محاسبه میشود. در بخشهای قبلی این مطلب از مجله فرادرس توضیح دادیم که در انسان ژنها روی ۲۳ جفت کروموزوم همولوگ قرار دارند. در زمان تقسیم میوز برای تولید گامتها و تولید مثل جنسی، ژنهایی که روی یک کروزموزوم قرار دارند وارد یک گامت شده و فنوتیپ آنها با هم بروز میکند. برای مثال اگر ژن رنگ چشم آبی و رنگ موی قهوهای روی یک کروموزوم باشد، این دو صفت همزمان در فرد بروز میکند. اما در متافاز میوز که کروموزومهای همولوگ چسبیده به هم (تترادها) در مرکز دوک تقسیم قرار دارند، ممکن است کراسینگ اورر، این ژنها را از هم جدا و نوترکیبی ایجاد کند. برای مثال فرض کنید ژن A و B روی یک کروموزوم قرار دارد و ژنوتیپ والدین برای دو ژن A و B، به شکل AB/AB و ab/ab است. اگر نوترکیبی و کراسینگ اور در میوز ایجاد نشود، اللهای ab روی یک کروموزوم همولوگ AB روی کروموزوم همولوگ دیگر به فرزندان با ژنوتیپ AB/ab منتقل میشود. AB روی یک کروموزوم همولوگ و ab روش کروموزوم دیگر است. اما اگر کراسینگ اور و نوترکیبی در میوز ایجاد شود، ژنهای روی یک کروموزوم جدا شده و کروموزومهای همولوگ با ژنوتیپ Ab، aB، ab و AB ایجاد میشود. در نتیجه در این آموزش احتمال ایجاد چهار گامت با ژنوتیپ AB/aB، AB/ab، Ab/ab و AB/ab وجود دارد. درصد نوترکیبی در این آمیزش فرضی ۵۰٪ است. به این ترتیب فراوانی نوترکیبی در هر آمیزش را میتوان از حالضرب ۱۰۰ در تقسیم تعداد ژنوتیپهای نوترکیب به کل ژنوتیپها محاسبه کرد.
فاصله بین ژنها در این روش را با «واحد نقشه» (Map unit | M.U)، «سانتی مرگان» (Centimorgan) یا درصد نوترکیبی ژنها گزارش میکنیم. اگر فاصله دو ژن در کروموزوم ۱ سانتی مرگان باشد، احتمال ایجاد نوترکیبی و جدا شدن این ژنها در هر میوز ۱٪ است. هر چه فاصله دو ژن در یک کروموزوم بیشتر باشد، DNA بیشتری بین آنها قرار دارد. در نتیجه احتمال کراسینگ اور کروزموزومها در میوز، جابهجا شدن ژنها بین دو کروموزوم همولوگ و نوترکیبی بیشتر است. برای مثال اگر درصد نوترکیبی دو ژن یک کروموزوم ۲۵٪ باشد، فاصله این دو ژن ۲۵ M.U و اگر درصد نوترکیبی دو ژن یک کروموزوم ۶٪ باشد، فاصله این دو ژن ۶ M.U یا سانتی مرگان است. اگر فاصله ژن A و B پنج سانتیمرگان، ژن B و C ده سانتیمرگان و فاصله A تا C پانزده سانتیمرگان باشد، ژن B بین دو ژن C و A قرار دارد. نقشه ژنتیکی این ژن را میتوان به دو صورت زیر رسم کرد. با توجه به اینکه تنها اطلاعات سه ژن را در اختیار داریم، هر دو نقشه زیر صحیح است.
ژنتیک سرطان
سرطان در اثر جهش ژنهای پروتئینهای ترمیم DNA و پروتئینهای تنظیمی چرخه سلول ایجاد میشود. جهش این ژنها در سلولهای تولیدکننده گامت از نسلی به نسل بعدی منتقل شده و سرطان ارثی یا سندروم سرطان خانوادگی را ایجاد میکند. این سرطانهامعمولا در سن پایینتر (کمتر از ۵۰ سال) شروع شده و با ایجاد همزمان تومور در چند اندام همراه است. اما جهش این ژنها در سلولهای سوماتیک به نسل بعدی منتقل نمیشود و به آن سرطان پراکنده گفته میشود. سندروم سرطان ارثی پستان و تخمدان (تومورهای پستان، تخمدان، پروستات، پانکراس و پوست)، سندروم لینچ (تومورهای کولون، رکتوم، تخمدان، رحم، پانکراس و مجرای صفرا)، سندروم لی-فرمنی (تومورهای پستان، استخوان، بافت نرم، مغز و غدد فوق کلیه)، سندروم کودن (تومورهای پستان، تیروئید، رحم، کولون، کلیه و پوست) و سندروم پوتز جگر (تومورهای معده، تیروئید، رحم، کولون، کلیه و پوست)، سرطانهای ارثی متداول هستند. احتمال ایجاد سرطانهای پراکنده بیشتر از سندروم سرطان خانوادگی است. سندروم سرطان ارثی پستان و تخمدان به دلیل جهش در ژن BRCA، سندروم لینچ به دلیل جهش ژنهای ترمیم DNA و سندروم لی-فرمنی به دلیل جهش ژن p53 ایجاد میشود.
ژن های ایجاد سرطان
«اونکوژنها» (Oncogenes) و «ژنهای مهارکننده تومور» (Tumor Suppressor Genes)، ژنهای تنظیم چرخه سلولی هستند که جهش آنها منجر به ایجاد سرطان میشود. برای تقسیم یک سلول ابتدا باید آنزیمهای لازم برای چرخه سلولی در مرحله G1 سنتز شود. سپس DNA سلول در مرحله S دو برابر (همانندسازی) شود. در مرحله G2 اندامکها و ترکیبات سیتوپلاسم دو برابر شده و در نهایت سلول برای تقسیم میتوز آماده است. برای تنظیم این چرخه، پیشگیری از انتقال DNA آسیبدیده به نسل بعد و توقف ورود سلول به مرحله بعد قبل از کامل شدن هر مرحله، نقاط تنظیمی در پایان مراحل G1، S و M وجود دارد. در پایان G1 پروتئینهای تنظیمی جهش احتمالی ایجاد شده در سلول مادری را بررسی میکند.
در پایان مرحله G2 پروتئینهای تنظیمی ساختار DNA همانندسازی شده، مضاعف شدن اندامکها و سیتوپلاسم را بررسی میکنند. قبل از پایان میتوز پروتئینهای تنظیمی جدا شدن کامل کروماتیدهای خواهری و کامل شدن میتوز را بررسی میکند. Cycline ها و CDK همراه آنها پروتئینهای تنظیمی چرخه سلول هستند. کاهش بیان این پروتئین سبب کند شدن چرخه سلول و کاهش تقسیم میشود. افزایش بیان این پروتئین سرعت تقسیم سلولی را افزایش داده و یکی از مکانیسمهای ایجاد سرطان است.
RAS و Myc دو اونکوژن و p53، APC و BrcA1-2 ژنهای مهارکننده توموری هستند که با تغییر تنظیم چرخه سلولی در ایجاد سرطان نقش دارند. در سلولهای سالم پروتئین RAS پس از اتصال فاکتور رشد فعال شده و با ایجاد آبشاری از فسفوریلاسیونهای سیتوپلاسمی، فاکتور رونویسی ژن CDK/Cycline ورود از مرحله G1 به S را فعال میکند. فاکتور رشد در زمانی ترشح میشود که تقسیم سلولی ضروری است. جهش در ژن RAS منجر به سنتز پروتئینی میشود که برای فعال شدن نیازی به تحریک گیرنده رشد ندارد.
افزایش RAS فعال در سلول با افزایش فاکتور رونویسی Cycline، افزایش سرعت تقسیم سلول و افزایش کنترل نشده سلولها در زمان غیرضروری است. Myc خانوادهای از ژنهای فاکتورهای رونویسی است. این فاکتورهای رونویسی بیان ژنهای چرخه سلولی، انتقال پیام، فاکتورهای تنظیمی ترجمه، اسکلت سلولی و مسیرهای متابولیسمی را کنترل میکنند. جهش این ژنها با افزایش بیان تعداد زیادی از پروتئینهای تنظیمی و ساختاری، تقسیم کنترل نشده سلول و سرطان را افزایش میدهد.
تشخیص آسیب DNA در نقطه وارسی پایان G2 با فعال شدن ژن p53 همراه است. این پروتئین فاکتور رونویسی است که بیان ژن پروتئین p21 و آنزیمهای ترمیم DNA را فعال میکند. پروتئین p21 با مهار CDK/Cycline به سلول اجازه ورود به مرحله بعد را نمیدهد و فرصت کافی برای ترمیم DNA فراهم میکند. اگر آسیب ایجاد شده زیاد باشد، p53 ژن آنزیمهای مسیر آپوپتوز را فعال کرده و سلول از بین میرود. جهشهایی که منجر به تولید پروتئین p53 غیرعملکردی یا توقف بیان ژن p53 میشوند، با انتقال DNA آسیبدیده به مرحله میتوز و سرطان همراه هستند.
تست های ژنتیک
آزمایشهای ژنتیکی برای بررسی تغییرات DNA و ساختار کروموزوم یا محصولات بیوشیمایی آنها (RNA و پروتئین) انجام میشود. این آزمایشها به تشخیص اختلالهای ژنتیکی پیش از تولد یا احتمال وراثت یک بیماری به نسل بعدی کمک میکند. این تستها را میتوان به دو دسته کلی تشخیصی و غیرتشخیصی تقسیم کرد. غربالگری نوزاد، تست فرد ناقل، تست ژنتیکی قبل از IVF، تست غربالگری جنین، تستهای تشخیص بیماریها و تستهای فاماکوژنومیک ازجمله تستهای تشخیصی هستند که برای تشخیص جهشهای کروموزومی یا نوکلئوتیدی پیش از تولد و پس تولد، بررسی ژنوتیپ هتروزیگوت در فردی که سابقه بیماری ژنتیکی در خانواده دارد و اثر تنوع ژنتیکی افراد در پاسخ به داروی مشترک انجام میشود. برای انجام این آزمایشات از روشهای PCR، توالیيابی DNA، کاریوتایپینگ، «ریزآرایه» (Microarrays) و تعیین پروفایل بیان ژن استفاده میشود.
- PCR: واکنش زنجیره پلیمراز یا PCR یکی از روشهای متداولی است که برای تکثیر DNA قبل از آنالیز استفاده میشود. بهعلاوه از این روش میتوان برای تشخیص مارکرهای سرطان و بیماریهای ژنتیکی استفاده کرد.
- توالیيابی DNA: در توالییابی DNA الگوی کنار هم قرار گرفتن بازها مشخص میشود. به کمک این روش میتوان جهشهای ایجاد شده در جایگاه تنظیمی یا بخشهای کدکننده پروتئین را مشخص کرد. توالییابی سنگجر و توالییابی نسل بعدی (Next-generation Sequencing | NGS) دو روش متداول توالییابی در آزمایشگاههای ژنتیک و مولکولی هستند.
- توالییابی سنگجر: در این روش مولکول DNA هدف در محیط آزمایشگاه بهوسیله دئوکسی ریبونوکلئوتیدها، آنزیمهای پلیمراز و دیدئوکسی ریبونوکلئوتیدها تکثیر میشود. در دیدئوکسی ریبونوکلئوتیدها یک گروه فلوسنت جایگزین گروه OH کربن ۳ قند نوکلئوتید میشود. قرار گرفتن این نوکلئوتید در DNA در حال سنتز منجر به پایان همانندسازی میشود. در پایان فرایند تکثیر، قطعات DNA سنتز شده در ژل الکتروفروز مویرگی از هم جدا میشوند. در انتهای ژل نوع نوکلئوتید انتهایی هر قطعه بهوسیله نور فلوسنت آن مشخص خواهد شد. قطعات کوتاهتر سریعتر و قطعات بلندتر آهستهتر به انتهای ژل میرسند. کوچکترین قطعه با یک نوکلئوتید اصلی و یک نوکلئوتید نشاندار اول و طولانیترین قطعه با تمام نوکلئوتیدهای اصلی و یک نوکلئوتید نشاندار در آخر به پایان ژل میرسد. آشکارساز بر اساس نورهای ساطع شده توالی نوکلئوتیدی DNA هدف را مشخص میکند.
- NGS: روش توالییابی در سنگجر و NGS یکسان است. اما NGS برخلاف سنگجر میتوان قطعات زیاد DNA را همزمان توالییابی کرد.
- کاریوتایپینگ: در روش کاریوتاپپینگ ساختار و تعداد کروموزومها را بررسی میکنیم. در این روش از رنگ گیمسا برای رنگآمیزی کروموزوم استفاده میشود. مراحل اولیه آمادهسازی کروموزوم سبب برهمکنش متفاوت رنگ گیمسا با بخشهای مختلف کروموزوم و ایجاد نوارهای رنگی متفاوت میشود. در این روش کروموزومها پس از جدا شدن از هسته سلول رنگآمیزی شده و زیر میکروسکوپ از آنها عکس گرفته میشود. سپس کروموزومهای شبیه از تصویر جدا شده و کنار هم قرار میگیرند. به تصویر مرتب شدن کروموزومها کاریوتایپ گفته میشود. بر اساس روش رنگآمیزی چهار الگوی باند G، باند R، باند C و باند T با رنگآمیزی گیمسا ایجاد میشود.
- باند G: در آمادهسازی کروموزومهای متافازی این روش از پروتئازهای ضعیف استفاده میشود. به همین دلیل پروتئینهایی که پیوندهای دیسولفیدی بیشتری دارند از کروموزوم جدا نمیشوند. کروموزم پس از این رنگآمیزی از دو باند تیره () و روشن () تشکیل شده است. باندهای تیره مناطق غنی از AT و هتروکروماتین هستند که پروتئینهای آن در مراحل آمادهسازی تجزیه نشده است. مناطق روشن یوکروماتین غنی از GC هستند که پروتئینهای آن در مراحل آمادهسازی تجزیه شده است.
- باند R: در این روش کرومووزمهای متافازی قبل از رنگآمیزی با بافر فسفات گرم (حدود ۸۷ درجه) آماده میشود. در نتیجه توالیهای هتروکروماتینی غنی از AT دناتوره شده و رنگ را جذب میکنند. باندهای تیره این روش هتروکروماتینها و باندهای روشن یوکروماتینها هستند.
- باند C: در این روش کروموزومها در سه مرحله متوالی با اسیدکلریدریک، محلول آلکالینی بروماید هیدروکسید و نمک سالین سیترات آماده میشوند. باندهای تیره این روش هتروکروماتینهای ساختاری نزدیک سانترومرها هستند که در کروموزومهای ۹، ۱، ۶ و بازوی بلند کرومووزم Y فراوانی بیشتری دارند.
- باند T: باندهای تیره ایجاد شده در این روش نشاندهنده تلومرهای کروموزوم هستند.
- ریزآرایه: در این روش قطعات DNA کوتاه و تکرشتهای از توالیهای ژن سالم روی یک بید یا چیپ قرار میگیرد. DNA هدف با رنگهای فلورسنت نشانهگذاری شده و به DNA روی چیپ اضافه میشود. به کمک این روش میتوان حذف و اضافه شدن نوکلئوتید یا مضاعف شدن ژنها را با دقت بالاتری نسبت به روشهای دیگر بررسی کرد.
- تعیین پروفایل بیان ژن: در این روش RNA موجود در نمونه بافت برای تعیین ژنهای فعال بررسی میشود.
جمعبندی ژنتیک انسانی
در این مطلب از مجله فرادرس ژنوم انسان، روش همانندسازی این ژنوم، رونویسی و بیان ژنها را توضیح دادیم. در ادامه توضیح دادیم که جهشهای نوکلئوتیدی و تغییر تعداد یا ساختار کروموزم عوامل تغییردهنده این ژنوم هستند. جهشهای ایجاد شده در سلولهای گامتساز به نسل بعدی منتقل میشوند و تعیین نقشه ژنتیکی انسان به شناسایی این جهشها کمک میکند.












