فرمول شیمیایی — به زبان ساده

فرمول شیمیایی روشی برای بیان نسبتهای اتمی یک ماده شیمیایی یا مولکول خاص است. در فرمول شیمیایی از نماد عناصر، تعداد و دیگر نمادها همچون پرانتز، خط فاصله، کروشه و ... استفاده میشود. فرمول شیمیایی با نام شیمیایی یک ماده تفاوت دارد و در خود شامل حروف و عبارات معناداری نیست. با وجود اینکه فرمول شیمیایی ممکن است برخی ساختارهای ساده شیمیایی را بیان کند اما نمیتواند مانند یک فرمول ساختاری عمل کند. به عبارت دیگر فرمولهای شیمیایی تنها زمانی میتوانند ساختار یک ماده را بیان کنند که آن ماده شیمیایی یا مولکول، ساختاری ساده داشته باشد.
استفاده از فرمول شیمیایی
سادهترین نوع از فرمول شیمیایی، با نام «فرمول تجربی» (Empirical Formula) شناخته میشود. این فرمول برای بیان نسبتهای عددی اتمها در هر نمونه بکار میرود. فرمولهای مولکولی، تعداد هر اتم در یک مولکول را با سادهترین نسبت بیان میکنند و شامل اطلاعات ساختاری مولکول نیستند. به طور مثال، فرمول تجربی برای گلوگوز به شکل $$C H _ 2 O $$ نوشته میشود که بیانگر حضور دو برابری اتم هیدروژن در مقابل اتمهای کربن و اکسیژن است اما فرمول مولکولی آن $$C _ 6 H _ {12} O _ 6 $$ است. یعنی در هر مولکول گلوکز ۶ اتم اکسیژن، ۱۲ اتم هیدروژن و ۶ اتم کربن خواهیم داشت.
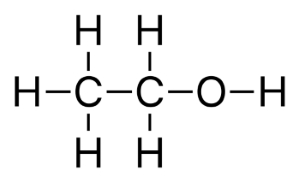
در برخی موارد، نوشتن یک فرمول شیمیایی با لحاظ کردن نوع پیوندهای شیمیایی در مولکول و ساختار آن کار پیچیدهای است. معمولا از این روش در بیان «فرمول تراکمی» (Condensed Formula)، استفاده میشود. نمونهای از این فرمول تراکمی را میتوان در مولکول اتانول به صورت $$C H _ 3 - C H _ 2 - O H $$ یا $$C H _ 3 C H _ 2 O H $$ مشاهده کرد. در هر صورت فرمول تراکمی هم محدودیتهایی در خصوص نمایش ارتباطات پیچیده پیوندها دارد که از آن جمله میتوان به اتمهایی اشاره کرد که با ۴ اتم یا بیشتر پیوند تشکیل میدهند.
فرمول شیمیایی در واکنش
از فرمولهای شیمیایی میتوان در بیان واکنشهای شیمیایی یا برخی تغییرات فیزیکی و شیمیایی مانند انحلال یونی ترکیبات در محلولها استفاده کرد. با وجود اینکه نمیتوان از فرمولهای شیمیایی در بیان ساختار مولکولها استفاده کرد اما برای بیان تعداد و نوع بار اتمها در واکنش شیمیایی بسیار مناسب هستند. در نتیجه، از این نوع فرمولها برای موازنه واکنشهای شیمیایی و حل مسائل مربوط به آن میتوان بهره گرفت.
از فرمولهای مولکولی تراکمی میتوان در بیان ترکیبات یونی استفاده کرد چراکه این ترکیبات، مولکولهایی پیوسته نیستند بلکه به شکل «خوشههایی» (Clusters) با پیوند کووالانسی وجود دارند. در حقیقت این نوع از یونهای چنداتمی به صورت گروهی از اتمها با یک بار کلی هستند که از نمونههای آن میتوان به یون «سولفات» $$([ S O _ 4]^ {2-}) $$ اشاره کرد.
همانطور که در این مثال مشخص است، ترکیبات یونی چنداتمی را به گونهای نشان میدهند که از بقیه ترکیبات متمایز باشند. به طور مثال، ترکیب دیکلرین هگزاکسید دارای فرمول تجربی به شکل $$ClO_3$$ و فرمول مولکولی $$Cl _2 O_6$$ است. برای نمایش این ماده در شکلهای مایع یا جامد از شکل صحیحتر $$( [Cl O _ 2]^+ [C l O _ 4 ]^ - )$$ استفاده میکنیم که بیان میکند این ترکیب، یونهای $$[C l O _ 4 ]^ -$$ و $$[Cl O _ 2]^+$$ را همراه دارد.
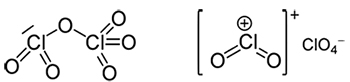
انواع فرمولهای شیمیایی
همانطور که در مقدمه بیان شد، در علم شیمی از فرمولهای متفاوتی اعم از فرمول تجربی، مولکولی و تراکمی استفاده میشود که در ادامه به توضیح هرکدام خواهیم پرداخت.
فرمول شیمیایی تجربی
در شیمی، فرمول تجربیِ یک ماده شیمیایی، بیان سادهای از نسبت عنصرها یا اتمها به یکدیگر در ترکیبی شیمیایی است. از فرمول تجربی برای نشان دادن ترکیبات یونی همچون $$CaCl_2$$ و درشتمولکولهایی مانند $$Si O _ 2$$ میتوان استفاده کرد. فرمول تجربی توضیحی در خصوص ساختار، تعداد واقعی اتمها در ترکیبات و حالت ایزومری بدست نمیدهد. عبارت «تجربی» به فرآیند «آنالیز عنصری» (Elemental Analysis) اشاره دارد. این فرآیند، روشی در شیمی تحلیلی (شیمی تجزیه) است که به کمک آن درصد نسبی ترکیبات عنصری یک ماده شیمیایی خالص را بدست میآورند.
به طور مثال، فرمول مولکولی هگزان به صورت $$C _ 6 H _ {14}$$ است. این فرمول بیان میکند که هگزان یک زنجیر با طول ۶ اتم کربن ۱۴ اتم اکسیژن دارد. اما فرمول تجربی هگزان را به صورت $$C _ 3 H _ {7}$$ نشان میدهند. به همین شکل، فرمول تجربی هیدروژن پراکسید به صورت $$HO$$ و فرمول مولکولی آن $$H _ 2 O _ 2$$ است. فرمول تجربی فرمالدهید و استیک اسید را به صورت $$C H _ 2 O $$ نمایش میدهند. البته فرمول مولکولی فرمالدهید با فرمول تجربی آن یکسان است.
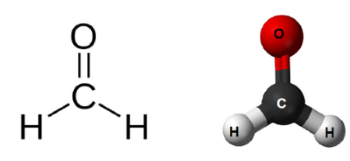
فرمول شیمیایی مولکولی
فرمول مولکولی تعداد اتمها را در هر مولکول نشان میدهد. اگر مولکولی در ساختار خود شامل یک اتم باشد، فارغ از تعداد اتمهای دیگر در آن مولکول، فرمول تجربی و مولکولی آن به صورت یکسان نشان داده میشود. به طور مثال، فرمول مولکولی و تجربی آب، $$H _ 2 O $$ است. فرمول مولکولی اطلاعات بیشتری در خصوص خود مولکول بدست میدهد اما پیادهسازی آن دشوارتر خواهد بود.
فرمول شیمیایی تراکمی و ساختاری
نحوه اتصال اتمها در یک مولکول، تاثیر بالایی بر خواص شیمیایی و فیزیکی آن دارد. اگر دو مولکول با تعداد اتم یکسان به طور متفاوتی با یکدیگر پیوند تشکیل داده باشند، خواص فیزیکی و شیمیایی متفاوتی خواهند داشت. در چنین شرایطی میتوان از فرمول ساختاری استفاده کرد. فرمول ساختاری نشان میدهد که هر اتم به چه شکل با دیگری پیوند تشکیل داده است. به طور معمول، به کمک فرمول ساختاری میتوان شکل حدودی مولکول را هم شناسایی کرد.
فرمول تراکمی، نوع اتمها و آرایش فضایی پیوندهای آنها را مشخص میکند. البته این فرمول در خصوص ایزومر بودن مولکول اطلاعاتی بدست نمیدهد. به طور مثال، اتان در ساختار خود شامل دو اتم کربن است که با پیوند یگانه به یکدیگر متصل شدهاند و فرمول شیمیایی آن را به صورت $$CH_ 3 C H _ 3$$ نشان میدهند.
در خصوص اتیلن، بین کربنها پیوند دو گانه وجود دارد که فرمول شیمیایی آن را میتوان به شکل $$CH_ 2 C H _ 2$$ نشان داد اما در این حالت، پیوند دوگانه مشخص نیست. بنابراین میتوان آن را به صورت $$H_2C= C H _ 2 $$ نشان داد. پیوند سهگانه را با سه خط به صورت $$H C \equiv CH$$ نشان میدهند.
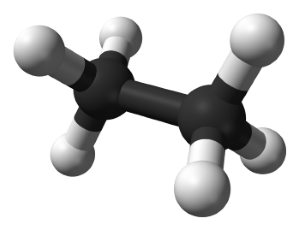
گروههای عاملی
برای نشان دادن مولکولها با چندین گروه عاملی یکسان میتوان از پرانتز استفاده کرد و گروه تکرارشونده را در داخل آن قرار داد. به طور مثال، ایزو بوتان را به شکل $$(C H _ 3 ) CH$$ نشان میدهند. این فرمول تراکمی، یک اتم کربن مرکزی متصل به هیدروژن را نشان میدهد که به سه گروه $$(C H _ 3 ) $$ وصل شده است. اگر از همین فرمول استفاده کنیم و با تعداد اتم یکسان، یعنی ۴ اتم کربن و ۱۰ اتم هیدروژن، یک مولکول راست زنجیر بسازیم به مولکول «نرمال بوتان» (n-Butane) میرسیم که فرمول آن به صورت زیر خواهد بود:
$$\mathrm { CH } _ { 3 } \mathrm { CH } _ { 2 } \mathrm { CH } _ { 2 } \mathrm { CH } _ { 3 }$$
قانون نسبتهای معین
در یک ترکیب شیمیایی، نسبت عناصر تشکیل دهنده ترکیب همواره یکسان است. این مطلب را با نام «قانون نسبتهای معین» (Law of Definite Composition) میشناسند. این قانون بیان میکند که تمامی نمونههای یک ترکیب شیمیایی خاص، همگی از عناصری با نسبتهای یکسان تشکیل شدهاند. به طور مثال، هر مولکول آب همواره از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است.
ایزوتوپها
ایزوتوپهای مختلف را میتوان با یک پیشوند بالانویس نشان داد. به طور مثال یون فسفاتی که شامل فسفر رادیواکتیو باشد را به صورت $$\left[ ^ { 32 } P O _ { 4 } \right] ^ { 3 - }$$ نشان میدهند.
اتمهای به دام افتاده
نماد $$@$$ در فرمول شیمیایی نشاندهنده اتمها یا مولکولهایی است که داخل یک ساختار قفس مانند به دام افتادهاند اما پیوند شیمیایی برقرار نکردهاند. به طور مثال «باکمینسترفولرن» (Buckminsterfullerene) را که یک آلوتروپ است، به صورت $$M@C_{60}$$ نشان میدهند. به بیان بهتر، در این ساختار، عنصر M در داخل شبکه کربن قرار دارد. در مثالی دیگر میتوان به یون $$[As @ Ni_{12}As_{20}]^{3-}$$ اشاره کرد که اتم $$As$$ در میان ۳۲ اتم دیگر به دام افتاده است.
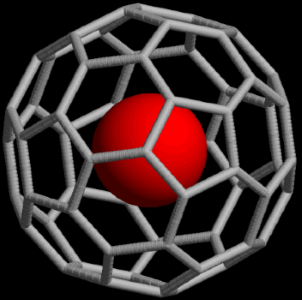
ترکیبات غیر استوکیومتری
در یک فرمول شیمیایی، به طور معمول از اعداد صحیح برای نمایش عنصرها استفاده میشود؛ اما دستهای از ترکیبات موسوم به «ترکیبات غیر استوکیومتری» (non-Stoichiometric Compounds) وجود دارند که نمیتوان آنها را با اعداد صحیح نشان داد.
در این خصوص معمولا از اعداد اعشاری استفاده میشود، مانند $$Fe _ {0.95} O$$ یا اینکه ترکیب مورد نظر شامل یک متغیر است و در اینصورت آن را به شکل حروف انگلیسی نشان میدهند مانند: $$Fe _ {1-x} O$$
شکل کلی برای ترکیبات آلی
ترکیبات آلی شامل سریهای همولوگ (Homolog Series) هستند. این سریها در حقیقت یک فرمول کلی را شامل میشوند که به کمک آنها میتوان فرمولهای کلی ترکیبات آلی را نشان داد. به طور مثال، الکلها را با فرمول کلی زیر نشان میدهند:
$$\mathrm { C } _ { n } \mathrm { H } _ { ( 2 n + 1 ) } \mathrm { OH } ( n \geq 1 )$$
در نتیجه برای مقادیر $$n$$ از 1 تا ۴ میتوان همولوگهای متانول، اتانول، پروپانول و بوتانول را مشخص کرد.
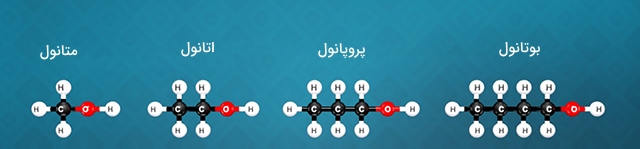
نمایش ترکیبات با کمک روش هیل
روش نوشتاری «هیل» (Hill System) برای نوشتن فرمولهای تجربی، مولکولی و همچنین اجزای فرمولهای تراکمی بکار میرود. در روش هیل، در ابتدا تعداد اتم کربن، سپس هیدروژن و بعد از آن سایر عناصر یک ترکیب به ترتیب الفبا آورده میشوند. اگر ترکیب مورد نظر شامل اتم کربن نباشد، همه عناصر حتی هیدروژن را به ترتیب الفبا مینویسیم. این روش در سال 1900 توسط «ادوین هیل» (Edwin A. Hill) ابداع و به معروفترین روش برای نشان دادن مواد شیمیایی تبدیل شد. مواد شیمیایی زیر به کمک روش هیل نوشته و مرتب شدهاند. به مثال آخر بیشتر توجه کنید:
- $$Br I $$
- $$C Cl _ 4$$
- $$C H _ 3 I $$
- $$C _ 2 H _ 5 B r $$
- $$H _ 2 O _ 4 S $$
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش رسم چند بعدی ساختار شیمیایی با ChemOffice (کم آفیس)
- کتون ها — به زبان ساده
- استرها — به زبان ساده
^^











فرمولهای مولکولی، تعداد هر اتم در یک مولکول را با سادهترین نسبت بیان میکنند و شامل اطلاعات ساختاری مولکول نیستند
سلام ،ببخشید اینجا باید می نوشتید فرمول تجربی،فکر کنم اشتباه شده
با سلام؛
متن مجدد بازبینی شد و صحیح است. منظور این است که ما بدون داشتن فرمول ساختاری، اطلاعی از ساختار مولکول – با استفاده از فرمول مولکولی – بدست نمیآوریم.
با تشکر از بازخورد و همراهی شما با مجله فرادرس
سلام نمیشه اپلیکیشنی معرفی کنید که اگ بنویسیم که چند مورد اگ با هم واکنش بدن چی میشه و خوب خودش بیاره؟؟
سلام؛ زنده باد
میشه لطفا بفرمایید که پسوندهایی مثل “ید” (برای مثال در اکسید / هیدرید / نیترید)، “ات” (برای مثال در سولفات / کلرات)، “یت” (برای مثال در سولفیت / نیتریت) به چه معنا هستند؟
آیا این پسوندها، استاندارد آیوپاک هستند؟
اگر اطلاعات مفید و بیشتری در این مورد وجود داره، ممنون میشم منبعی چیزی معرفی کنید.
سپاسگذارم
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. از آنجایی که معیار اصلی برای نامگذاری، آیوپاک است، نامهایی مثل سولفات و نیترات از نامهای پذیرفته شده آیوپاک است اما توجه داشته باشید که اینها پسوند نیستند به طور مثال نیترات را نمیتوان نیتر+ات توصیف کرد. علاوه بر این برای اینکه نام آیوپاک ترکیبات را بدانید کافی است نام آنها را در اینترنت جستجو کنید و به طور معمول در دانشنامههایی همچون ویکیپدیا، در ستونی مجزا نام آیوپاک آنها نوشته شده است.
با تشکر