ژل الکتروفورز چیست؟ — تکنیک، انواع و کاربردها — به زبان ساده

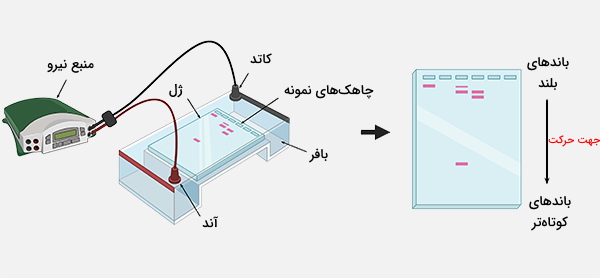
الکتروفورز یک تکنیک آزمایشگاهی است که برای جداسازی مولکولهای DNA ،RNA و پروتئین بر اساس اندازه و بار الکتریکی آنها استفاده میشود. اساس ژل الکتروفورز این است که از جریان الکتریکی برای حرکت مولکولها برای جدا شدن از طریق ژل استفاده میشود. منافذ ژل، مانند الک عمل کرده و مولکولهای کوچکتر سریعتر از مولکولهای بزرگ حرکت میکنند. آزمایش الکتروفورز معمولاً درون جعبهای انجام میشود که یک انتهای آن بار مثبت و انتهای دیگر بار منفی دارد.
الکتروفورز در واقع یک تکنیک آزمایشگاهی است که به دلیلی یکی از کاربردهای آن در تشخیص بیماریها، گاهی به عنوان آزمایش الکتروفورز نیز گفته میشود که بیشتر بر جنبه بالینی و طبی آن تأکید دارد.
آزمایش الکتروفورز چیست؟
آزمایش الکتروفورز یک تکنیک بسیار پرکاربرد است که جریان الکتریکی را روی مولکولهای بیولوژیک مانند DNA، پروتئین یا RNA اعمال کرده و آنها را بر اساس اندازه و بار الکتریکی جدا میکند. آزمایش الکتروفورز کاربردهای مختلفی در پژوهش و تشخیص دارد. الکتروفورز به نیروی الکتروموتور (EMF) گفته میشود که در این روش برای حرکت مولکولها از طریق ماتریس ژل مورد استفاده قرار میگیرد. با قرار دادن مولکولها در چاهکهای داخل ژل و استفاده از میدان الکتریکی، مولکولها با سرعتهای مختلف درون ژل حرکت میکنند که وقتی که نسبت بار به جرم (Z) یکنواخت باشد، عمدتا بر اساس جرم آنها تعیین میشود.
با این حال، هنگامی که بار همه ذرات یکسان نیست، میدان الکتریکی تولید شده توسط ازمایش الکتروفورز باعث میشود که مولکولها با توجه به تفاوت بار سرعت و جهت حرکت متفاوتی داشته باشند. مولکولهایی که دارای بار مثبت خالص هستند به سمت کاتد که بار منفی دارد مهاجرت میکنند (زیرا یک سلول الکترولیتی است تا سلول گالوانی) و انواعی که دارای بار منفی خالص هستند به سمت آند با بار مثبت مهاجرت میکنند. جرم همچنان عاملی در سرعت مهاجرت این مولکولها با بار غیر یکنواخت است که از طریق ژل به سمت الکترودها حرکت میکنند.
در این فرایند امکان مرتبسازی مولکولها بر اساس اندازه فراهم میشود. همانطور که گفته شد، با استفاده از میدان الکتریکی مولکولهایی مانند DNA، از طریق ژل ساخته شده از آگارز یا پلی آکریل آمید، بین دو سوی میدان الکتریکی حرکت میکنند. ژل در محفظه الکتروفورز قرار میگیرد و پس از لود کردن مواد مورد آزمایش درون چاهکها، به منبع تغذیه متصل میشود.
هنگامی که میدان الکتریکی اعمال میشود، مولکولهای بزرگتر با سرعت کمتر و مولکولهای کوچکتر با سرعت بیشتری حرکت میکنند و در نهایت مولکولهای با اندازههای مختلف نوارهای متمایزی روی ژل تشکیل میدهند. مولکول DNA کامل به دلیلی طویل و سنگین بودن، الکتروفورز نمیشود چون آنقدر بزرگ است که قادر به ورود به منافذ ژل نیست. بنابراین DNA با استفاده از آنزیمهای خاصی (Inscription Enzymes) که DNA را به قطعات کوچکتر خرد میکنند برای آزمایش الکتروفورز آماده میشود. سپس این قطعات، بر اساس اندازه قطعات، کم و بیش به داخل ژل الکتروفورز از بالا به پایین مهاجرت میکنند.
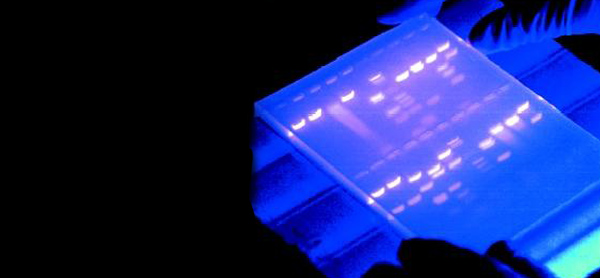
کاربرد الکتروفورز چیست؟
تکنیک ژل الکتروفورز در تحقیقات پروتئینی و بررسی جهش ژنتیکی بسیار مهم است، زیرا پروتئینهای جهش یافته، اغلب بلند یا کوتاهتر از مولکول طبیعی هستند، بنابراین در ژل الکتروفورز جایگاه متفاوتی دارند. همچنین با جداسازی مولکولهای مورد نظر روی ژل، و خالص سازی آن قسمت از ژل میتوان به کمک آزمایشهای تکمیلی توالی یا سایر خصوصیات مولکولهای مورد نظر را بررسی کرد.
اگرچه این تکنیک در تحقیقات پایهای برای درک عملکرد ژن و پروتئین اهمیت دارد، اما بسیاری از تشخیصهای پزشکی در زمینه بیماریها و ناهنجاریها و بررسیهای پزشکی قانونی با استفاده از آزمایش الکتروفورز انجام میشوند. آزمایش الکتروفورز روتین، یک روش سنتی و پرکاربرد برای جداسازی پروتئینها و اسیدهای نوکلئیک است. این روش معمولاً روی ژل مستطیلی شکل انجام میشود. نمونههای مجهول و نمونه شاهد (کنترل) را برای مقایسه درون چاهکها قرار میگیرند که میتواند برای جدا کردن املاح در دور آزمایش استفاده شود. همچنین در جداسازی CSF و پروتئینهای ادرار، ایزوآنزیمها، لیپوپروتئینها و هموگلوبین کاربرد دارد.
الکتروفورز ایمونوفیکساسیون
آزمایش الکتروفورز ایمونوفیکساسیون (Immunofixation Electrophoresis) (IFE) در تشخیص گاموپاتیهای ایمونوگلوبولین مونوکلونال یا گسترش مونوکلونال یک آنتیبادی منفرد و غیر عملکردی مانند IgA، IgG و IgM مورد استفاده قرار میگیرد که وجود آن ممکن است شرایطی مانند مولتیپل میلوما یا ماکروگلوبولینمی Waldenstrom را نشان دهد. همچنین میتواند در مطالعه آنتیژنهای پروتئینی و محصولات تقسیم شده آنها مورد استفاده قرار گیرد.
الکتروفورز با وضوح بالا
آزمایش الکتروفورز با وضوح بالا (High Resolution Electrophoresis) یا به اختصار (HRE) مشابه آزمایش الکتروفورز روتین است که با استفاده از ولتاژ بالا انجام میشود. این روش معمولاً در صورت نیاز به وضوح بالاتر پروتئین (به عنوان مثال جداسازی پروتئینهای مایع مغزی نخاعی برای تشخیص بیماری مولتیپل اسکلروز، جداسازی زنجیرههای سبک در ادرار برای تشخیص به موقع مولتیپل میلوما) بسیار توصیه میشود. از آنجا که افزایش ولتاژ گرمای تولید شده را نیز افزایش میدهد، الکتروفورز با وضوح بالا شامل یک ابزار خنککننده برای جلوگیری از دناتوره شدن پروتئینها و خشک شدن ژل و سایر اجزا است.
الکتروفورز مویینه ای
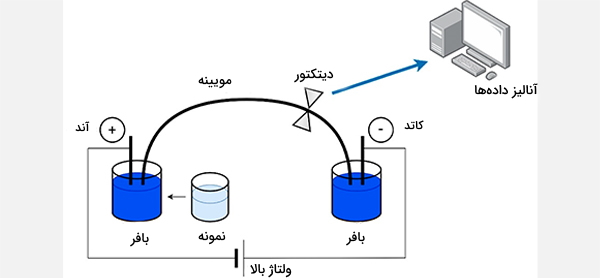
الکتروفورز مویینهای (Capillary Electrophoresis) (CE) در مویرگهایی با قطر زیر ۱ میلیمتر انجام میشود (لولههای مویینهای سیلیس بسیار نازک و ذوب شده با قطر داخلی 25 تا 100 میلیمتر) و ترکیبی از الکتروفورز و کروماتوگرافی مایع با کارایی بالا برای تسهیل جداسازی آنالیت است. بسیاری از محققان استفاده از CE را ترجیح میدهند زیرا فقط به مقدار کمی نمونه نیاز دارد، بسیار کارآمد است و نتیجه آن به آماده میشود.
آزمایش الکتروفورز مویینهای، با جدا کردن DNA به قطعات کوتاهتر و سپس لود آنها بر روی ژل الکتروفورز باعث میشود الگوهای As ،Cs ،Ts و Gs روشن شوند. پروتئینهای کوچک در انتهای ژل قرار میگیرند، زیرا بیشترین مسافت را طی کردهاند و بزرگترین آنها در قسمت بالا (نزدیک به چاهک) باقی میمانند. نتایج الکتروفورز مویینهای معمولاً به صورت الکتروگرام نشان داده میشوند.
آزمایش الکتروفورز با تمرکز ایزوالکتریک
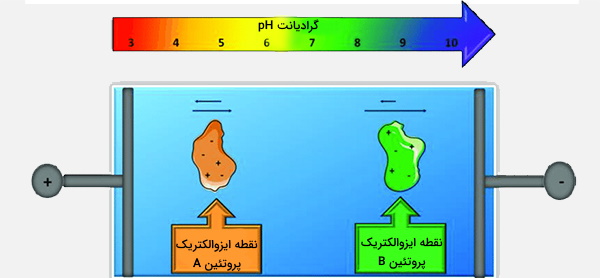
آزمایش الکتروفورز با تمرکز ایزوالکتریک (Isoelectric Focusing) (IEF) برای جدا کردن ترکیبات آمفوتریک (به عنوان مثال پروتئینها) با وضوح بالاتر، استفاده میشود. IEF از ژلهای تزریق شده شیمیایی برای ایجاد یک شیب pH در سطح ژل استفاده میکند و یک ولتاژ فوقالعاده بالا را برای تسهیل مهاجرت مولکولهای پروتئین به نقطهای که بار خالص آنها صفر است (نقطه ایزوالکتریک) اعمال میکند. برخی از مزایای استفاده از IEF شامل سهولت روش کار (به عنوان مثال قرار دادن کاربرد نمونه مهم نیست زیرا پروتئین همیشه در موقعیتی مطابق با pl قرار میگیرد) و وضوح بالای آن هستند.
ژل الکتروفورز در ميدان ضربانی
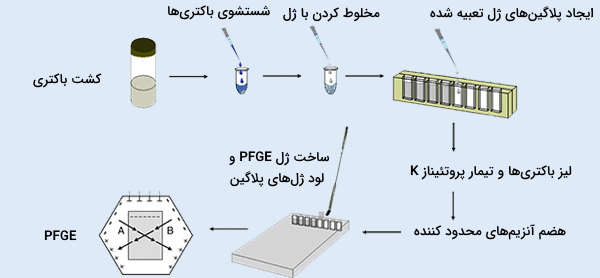
با استفاده از AGE یا PAGE در سیستمهای الکتروفورز معمول نمیتوان مولکولهای DNA بزرگتر از 50 کیلوباز (کیلوبایت) را جدا کرد زیرا اندازه منافذ ژل خیلی کوچک هستند و امکان مهاجرت آنها را ندارند. برای سهولت تقسیم موفقیتآمیز مولکولهای بزرگ DNA (تا 10 مگابایت) میتوان از روش ژل الکتروفورز در ميدان ضربانی (Pulsed - Field Gel Electrophoresis) (PFGE) استفاده کرد. PFGE با یک جریان الکتریکی که به طور مداوم جهت را روی ژل تغییر میدهد، قطعات DNA را به خوبی از یکدیگر جدا میکند.
با متناوب کردن الکترودهای مثبت و منفی در چرخههای الکتروفورز، مولکولهای DNA مجبور میشوند دوباره تغییر جهت دهند و در نهایت به قطعات کوچکتر تقسیم میشوند. آزمایش الکتروفورز PFGE معمولاً در ژنوتیپ یا انگشتنگاری ژنتیکی استفاده میشود و به دلیل سادگی و تکرارپذیری، استاندارد خوبی در تعیین نوع باکتری دارد. با این حال، این پروتکل بسیار وقتگیر است و به مهارت بالایی نیاز دارد. به علاوه، تفسیر نتایج ممکن است دشوار باشند چون قطعات بر اساس اندازه از هم جدا میشوند و جداسازی براساس توالی نیست، بنابراین قطعات با اندازه یکسان ممکن است از قسمت مورد نظر روی کروموزوم نباشند.
ژل الکتروفورز چیست؟
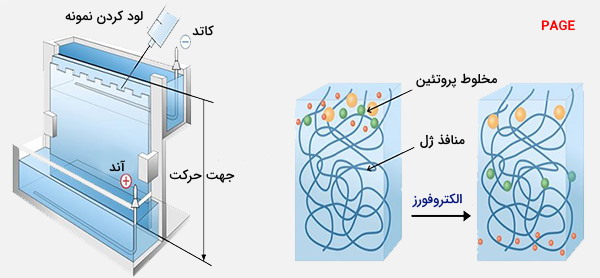
ژل الکتروفورز روشی برای جداسازی و تجزیه و تحلیل ماکرومولکولها (DNA، RNA و پروتئینها) و قطعات آنها بر اساس اندازه و بار بر روی ژل است. ژل الکتروفورز در شیمی آلی برای جداسازی پروتئینها از نظر بار یا اندازه (IEF آگارز، اساساً از نظر اندازه مستقل) و در بیوشیمی و زیستشناسی مولکولی برای جداسازی مخلوط قطعات DNA و RNA از نظر طول، تخمین اندازه قطعات DNA و RNA یا پروتئینها از طریق بار استفاده میشود. مولکولهای اسید نوکلئیک با استفاده از میدان الکتریکی جدا میشوند تا مولکولهای بار منفی را از طریق ژل آگارز یا انواع دیگر حرکت کنند.
اصطلاح ژل به ماتریسی گفته میشود که مولکولهای هدف، درون آن از یکدیگر جدا میشوند. در اکثر موارد، ژل یک پلیمر پیوندی است که ترکیب و تخلخل آن براساس وزن مخصوص و ترکیب مولکولهای هدف انتخاب میشوند. برای جدا کردن پروتئینها یا اسیدهای نوکلئیک کوچک (DNA، RNA یا اولیگونوکلئوتیدها)، ژل معمولاً از غلظتهای مختلف آکریل آمید و یک اتصالدهنده تشکیل میشود و شبکههای مختلفی از پلی آکریل آمید را ایجاد میکند. هنگام جدا کردن قطعات اسید نوکلئیکی بزرگ (بزرگتر از چند صد باز)، ماتریس ترجیحی، ژل آگارز خالص است. در هر دو حالت، ژل یک ماتریس جامد و در عین حال متخلخل تشکیل میدهد.
آكریل آمید برخلاف پلیآكریلآمید، یک نوروتوكسین است و برای جلوگیری از مسمومیت باید با اقدامات احتیاطی و ایمنی مناسب از آن استفاده كرد. آگارز از زنجیرههای طولانی منشعب نشده از کربوهیدرات بدون بار و بدون اتصالات عرضی تشکیل شده است که منجر به ایجاد ژل با منافذ بزرگ میشود و مجزای ماکرومولکول و ماکرومولکولار را از هم جدا میکند. پروتئینها توسط بار موجود در آگارز جدا میشوند زیرا منافذ ژل برای الک پروتئینها بسیار کوچک هستند.
همچنین میتوان از ژل الکتروفورز برای جداسازی ذرات نانو استفاده کرد. در ژل الکتروفورز هنگام حرکت یک ذره باردار در یک جریان الکتریکی، از ژل به عنوان محیط ضد همرفت استفاده میشود. ژلها همرفت حرارتی ناشی از استفاده از میدان الکتریکی را سرکوب میکنند و همچنین میتوانند به عنوان یک محیط غربالکننده عمل کنند و باعث جلوگیری از عبور مولکولها شوند. ژلها همچنین میتوانند به سادگی برای حفظ جدایی کامل به کار روند تا بتوان از یک لکه روی ژل برای آزمایشات بعدی بعد از الکتروفورز استفاده کرد.
الکتروفورز DNA معمولاً برای اهداف تحلیلی پس از تغلیظ DNA از طریق واکنش زنجیرهای پلیمراز (PCR) استفاده میشود. اما ممکن است به عنوان روش آمادهسازی قبل از استفاده از روشهای دیگر مانند طیفسنجی جرمی، RFLP ،PCR، کلونینگ، توالی یابی DNA یا ساترن بلات برای توصیف بیشتر ویژگیهای قطعات مورد نظر به کار رود.

انواع ژل الکتروفورز
انواع ژلهایی که معمولاً در ژل الکتروفورز مورد استفاده قرار میگیرند ژلهای آگارز و پلی آکریل آمید هستند. هر نوع ژل برای انواع و اندازههای متفاوتی از آنالیتها مناسب است و البته با تغییر در میزان غلظت ژل نیز میتوان اندازه منافذ و تخلخل نهایی ژل را تعیین کرد که در بهترین زمان ممکن، با یهینهترین حالت مولمولها از یکدیگر جداسازی شوند. ژلهای پلی آکریل آمید معمولاً برای پروتئینها استفاده میشوند و قدرت تجزیه بسیار بالایی برای قطعات کوچک DNA دارند (5 تا 500 جفت باز).
از طرف دیگر، ژلهای آگارز قدرت تفکیک کمتری برای DNA دارند اما دامنه جدایی بیشتری دارند و بنابراین برای قطعات DNA با اندازه 50 تا 20000 جفت باز استفاده میشوند اما وضوح بیش از 6 مگابایت با PFGE امکانپذیر است. ژل پلی آکریل آمید در الکتروفورز عمودی و ژل آگارز معمولاً به صورت افقی اجرا میشوند. روش ساخت این دو ژل نیز متفاوت است. ژل آگارز از نظر حرارتی تنظیم میشود، در حالی که پلیاکریلآمید در یک واکنش پلیمریزاسیون شیمیایی تشکیل میشود.
ژل آگارز
آگارز ژل الکتروفورز در بیوشیمی، زیستشناسی مولکولی، ژنتیک و شیمی بالینی برای جداسازی مخلوطی از ماکرومولکولها مانند DNA یا پروتئینها در یک ماتریس آگارز، یکی از دو جزء اصلی آگار استفاده میشود. پروتئینها ممکن است بر اساس بار یا اندازه (الکتروفورز آگارز با تمرکز ایزوالکتریک اساساً مستقل از اندازه است) و از نظر طول قطعات DNA و RNA از هم جدا میشوند.
ریختن ژل آگارز آسان است، گروههای نسبتاً کمتری دارد و برای جداسازی DNA در محدوده اندازهای که بیشتر در آزمایشگاهها مشاهده میشود، مناسب است. DNA جدا شده روی ژل، به صورت نوارهای یا لکههایی زیر نور UV مشاهده میشوند و میتوان این قطعات DNA را پس از برش، از ژل استخراج کرد. برای این کار لازم است غلظت ژل تا جایی که در اثر حرارت دستگاه حل نشود پایین باشد تا در تخلیص DNA میزان ناخالصی به حداقل برسد.
ژل آگارز مورد استفاده برای محصول PCR معمولا بین 0/7 تا 2 درصد غلظت دارد که از حل کردن پودر آن در یک بافر مناسب به دست میآید. ژل آگارز یک ماتریس سه بعدی است که از مولکولهای مارپیچ آگارز در بستههای فوق پیچیده تشکیل شده و در ساختارهای سه بعدی، کانالها و منافذی دارد که از طریق آنها مولکولهای زیستی عبور میکنند. ساختار سه بعدی با پیوندهای هیدروژنی نگه داشته میشود و بنابراین میتواند با گرم شدن مجدد به حالت مایع باز گردد.
دمای ذوب با دمای ژل متفاوت است. بسته به منابع استخراج، ژل آگارز دارای دمای ژل 35 تا 42 درجه سانتیگراد و دمای ذوب 85 تا 95 درجه سانتیگراد است. آگارزهای با ذوب کم و ژل کم که از طریق تغییرات شیمیایی ساخته شدهاند نیز موجود هستند. ژل آگارز دارای اندازه منافذ بزرگ و استحکام خوبی است که آن را به عنوان یک ماده ضد همرفت برای الکتروفورز DNA و مولکولهای پروتئین بزرگ مناسب میکند. اندازه منافذ ژل 1 درصد از 100 نانومتر تا 200 الی 500 نانومتر برآورد شده است و مقاومت آن به ژلهای رقیق 0/15 درصد اجازه میدهد تا برای ژل الکتروفورز مناسب باشند.
با این حال ژلهای با غلظت کم (0/1 تا 0/2 درصد) شکننده هستند و بنابراین کار با آنها سخت است خصوصا اگر هدف جداسازی نوار و مراحل بعدی باشد. ژل آگارز قدرت تفکیک کمتری نسبت به ژل پلی آکریل آمید برای DNA دارد اما دامنه جدایی آن بالاتر است، بنابراین برای قطعات DNA با اندازه معمول 50 تا 20000 جفتباز، استفاده میشود.
حد تفکیک آگارز ژل الکتروفورز استاندارد در حدود 750 کیلو بایت است اما با PFGE وضوح بیش از 6 مگابایت امکانپذیر خواهد بود. همچنین میتوان از آن برای جداسازی پروتئینهای بزرگ استفاده کرد و ماتریس ارجح برای ذرات با شعاع بزرگتر از 5 تا 10 نانومتر است. ژل 0/9 درصد آگارز، منافذی دارد که برای ورود باکتریوفاژ T4 به اندازه کافی بزرگ هستند.
پلیمر آگارز شامل گروههای باردار، به ویژه پیروات و سولفات است. این گروههای دارای بار منفی در فرایندی به نام الکتروآنندوزموزیس (EEO) جریان آب را در جهت مخالف حرکت DNA ایجاد میکنند و بنابراین میتوانند حرکت DNA را عقب بیندازند و باعث تیرگی باندها شوند. ژلهای با غلظت بالاتر جریان الکتروآنزموزوتیک بالاتری دارند. بنابراین آگارز با EEO کم به طور کلی برای استفاده در ژل الکتروفورز آگارز اسیدهای نوکلئیک ترجیح داده میشود اما آگارز با EEO بالا ممکن است برای اهداف دیگر استفاده شود.
محتوای سولفات پایین آگارز با EEO کم، به ویژه آگارز با نقطه ذوب پایین (LMP)، در مواردی که DNA استخراج شده از ژل برای آزمایشات بعدی مورد استفاده قرار میگیرد نیز مفید است چون وجود سولفات های آلوده ممکن است روی مراحل بعدی مانند PCR تأثیر بگذارد. آگارزهایی با EEO صفر برای برخی از آزمایشات نامطلوب هستند زیرا ممکن است با افزودن گروههایی با بار مثبت ایجاد شوند و این گروهها میتوانند بر واکنشهای آنزیمی بعدی تأثیر بگذارند.
الکتروآنزوموز دلیل استفاده از آگارز به جای آگار است زیرا مؤلفه آگاروپکتین موجود در آگار حاوی مقدار قابل توجهی از گروههای سولفات و کربوکسیل با بار منفی است. حذف آگاروپکتین در آگارز باعث کاهش قابل توجه EEO و همچنین کاهش جذب غیر اختصاصی مولکولهای زیستی به ماتریس ژل میشود. با این حال، برای برخی از آزمایشات مانند الکتروفورز پروتئینهای سرم، EEO بالا ممکن است مطلوب باشد و بنابراین آگاروپکتین به ژل اضافه شود.
الکتروفورز ژل پلی آکریل آمید چیست؟
الکتروفورز ژل پلی آکریل آمید (PAGE) معمولاً برای جداسازی پروتئینها بر اساس اندازه مولکولی و نسبت بار به جرم استفاده میشود. با کمک اسلبهای عمودی یا ژل گنجانیده شده در میلهها یا استوانههای عمودی، محققان میتوانند DNA 100 جفت باز یا کمتر را جدا کرده و پروتئینهای منفرد را در سرم تجزیه و تحلیل کنند (به عنوان مثال انواع ژنتیکی، ایزوآنزیمها). فارغ از سادگی و سرعت جداسازی، محققان PAGE را دوست دارند زیرا ژل آن در طیف وسیعی از pH و دما پایدار است و ژلهایی با اندازه منافذ مختلف را میتوان ساخت.
این تکنیک به طور گسترده در بیوشیمی، شیمی پزشکی، ژنتیک، زیستشناسی مولکولی، ژنتیک مولکولی و بیوتکنولوژی برای جداسازی ماکرومولکولهای بیولوژیکی، معمولاً پروتئینها یا اسیدهای نوکلئیک و با توجه به تحرک الکتروفورزی استفاده میشود. تحرک الکتروفورتیک تابعی از طول، ترکیب و بار مولکول است. ژل الکتروفورز پلی آکریل آمید ابزاری قدرتمند است که برای تجزیه و تحلیل نمونههای RNA استفاده میشود. هنگامی که ژل پلی آکریل آمید پس از الکتروفورز دناتوره میشود، اطلاعات مربوط به ترکیب نمونه RNA را فراهم میکند. هیدراتاسیون اکریلونیتریل منجر به تشکیل مولکولهای آکریلآمید توسط نیتریل هیدراتاز میشود.
مونومر آكریلآمید قبل از افزودن آب، حالت پودر دارد. آکریلآمید برای سیستم عصبی انسان سمی است، بنابراین هنگام کار با آن باید تمام اقدامات ایمنی رعایت شوند. آکریلآمید در آب محلول است و با افزودن آغازگرهای رادیکال آزاد، پلیمریزه شده و در نتیجه پلی آکریل آمید تشکیل میشود. تهیه ژل پلی آکریل آمید از طریق هیدراتاسیون آکریلآمید مفید است چون اندازه منافذ قابل تنظیم هستند. افزایش غلظت آکریلآمید باعث کاهش اندازه منافذ بعد از پلیمریزاسیون میشود.
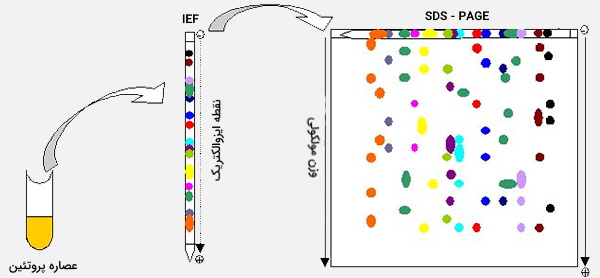
ژل پلی آکریل آمید با منافذ کوچک به بررسی مولکولهای کوچکتر کمک میکند زیرا مولکولهای کوچک میتوانند وارد منافذ شوند و از طریق ژل عبور کنند در حالی که مولکولهای بزرگ در روزنههای منافذ گیر میکنند. همانند تمام انواع الکتروفورز، ممکن است حالت اصلی مولکولها و ساختار مرتبه بالاتر مولکولها حفظ شوند. به این روش Native - PAGE گفته میشود. متناوباً، ممکن است یک دناتورهکننده شیمیایی هم اضافه شود تا این ساختارها از بین بروند و مولکولهای بدون ساختار ایجاد شوند که تحرک آنها فقط به طول آن بستگی دارد (زیرا مجموعههای پروتئین - SDS نسبت جرم به بار مشابه دارند).
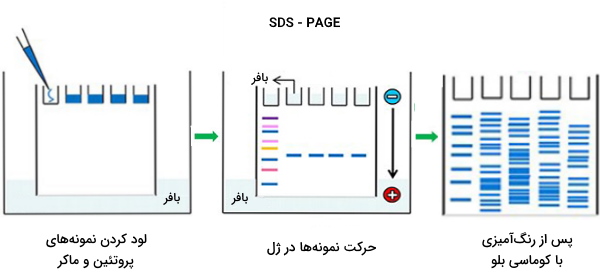
این روش SDS - PAGE نامیده میشود. پلی آکریل آمید ژل الکتروفورز - سدیم دودسیل سولفات (SDS - PAGE) روشی برای جداسازی مولکولها بر اساس تفاوت وزن مولکولی آنها است. در pH که در آن ژل الکتروفورز انجام میشود، مولکولهای SDS بار منفی میگیرند و به نسبت تعیین شده، تقریباً یک مولکول SDS به ازای هر 2 اسید آمینه به پروتئین متصل میشود. به این ترتیب، پس از شستشوی تمام پروتئینها با نسبت بار به جرم یکنواخت به دست میآیند. مواد شوینده با اتصال به پروتئینها ساختار ثانویه، سوم یا چهارم آنها را از بین میبرند و آنها را به زنجیرههای پلیپپتیدی خطی با بار منفی تبدیل میکنند.
هنگامی که PAGE تحت میدان الکتریکی قرار میگیرد، زنجیرههای پلیپپتیدی با بار منفی با تحرک متفاوت به سمت آند حرکت میکنند. تحرک یا مسافت پیموده شده توسط مولکولها، با لگاریتم وزن مولکولی آنها متناسب است. با مقایسه نسبت مسافت طی شده توسط هر پروتئین به طول ژل (Rf) میتوان در مورد وزن مولکولی نسبی پروتئینها نتیجهگیری کرد. طول ژل با مسافت طی شده توسط یک مولکول کوچک مانند رنگ ردیابی میشود. برای اسید نوکلئیکها، اوره متداولترین ماده دناتوران است.
برای پروتئینها، سدیم دودسیل سولفات (SDS) یک شوینده آنیونی است که برای پوشاندن پروتئینها به نمونههای پروتئین اعمال میشود تا دو بار منفی (از هر مولکول SDS) به هر دو اسید آمینه پروتئین دناتوره داده شود. از 2- مرکاپتواتانول نیز ممکن است برای برهم زدن پیوندهای دیسولفید موجود در بین کمپلکسهای پروتئینی استفاده شود که به تکامل بیشتر پروتئین کمک میکند. در اکثر پروتئینها، اتصال SDS به زنجیرههای پلی پپتیدی باعث توزیع یکنواخت بار در واحد جرم میشود.
پروتئینهایی که محتوای آبگریز بیشتری دارند. به عنوان مثال، بسیاری از پروتئینهای غشایی و آنهایی که با سورفاکتانتها در محیط بومی خود ارتباط برقرار میکنند، به دلیل تنوع بیشتر در نسبت وابسته به SDS، درمان ذاتی آنها دشوارتر است. از نظر رویهای، استفاده از Native و SDS -PAGE با هم میتواند برای تصفیه و جداسازی زیرواحدهای مختلف پروتئین استفاده شوند. Native - PAGE فرم اولیگومری را دست نخورده نگه میدارد و نواری را روی ژل نشان میدهد که نمایانگر سطح فعالیت است.
SDS - PAGE فرم الیگومریک را به مونومرهای خود تکثیر و جدا میکند و نوارهایی را نشان میدهد که نمایانگر وزن مولکولی آنها هستند. از این نوارها میتوان برای شناسایی و ارزیابی خلوص پروتئین استفاده کرد.
ژل الکتروفورز دو بعدی چیست؟
در ژل الکتروفورز دو بعدی (Two Dimensional Electrophoresis)، نمونه با استفاده از دو تکنیک جداسازی مجزا (به عنوان مثال IEF به دنبال PAGE یا AGE) از هم جدا شده و در دو بعد جهتدار از زاویههای یکدیگر مشخص میشود. از آنجا که نوارهای حاصل، با الکتروفورز دوم بیشتر جدا میشوند، میتوان از نمونه اطلاعات بیشتر و دقیقتری کسب کرد. آزمایش الکتروفورز دو بعدی بسیار تخصصی است و معمولاً در تحقیقات پروتئومیکس و ژنتیک مورد استفاده قرار میگیرد.
اگرچه الکتروفورز دو بعدی میتواند هزاران پروتئین را در یک مرحله تجزیه و تحلیل کند اما این روش به مقدار قابل توجهی از نمونه اولیه نیاز دارد، قابلیت تولید مجدد و توان تولید محدود هستند. همچنین این روش فقط با مولکولهای زیستی متوسط تا بزرگ کار میکند و اندازهگیری دقیق ندارد که این موارد از معایب این روش هستند.
الکتروفورز دو بُعدی با الکتروفورز یک بُعدی آغاز میشود و سپس مولکولها را عمود بر حالت اول جدا میکند تا در بعد دوم الکتروفروگرام ایجاد شود. آزمایش الکتروفورز در بُعد اول، مولکولها با توجه به نقطه ایزوالکتریک خود بطور خطی جدا میشوند. در بُعد دوم، مولکولها با توجه به جرم مولکولی در 90 درجه از الکتروفروگرام اول جدا میشوند. از آنجا که بعید به نظر می رسد دو مولکول از نظر دو ویژگی مجزا مشابه باشند، مولکولها در الکتروفورز دو بُعدی به طور موثرتری از الکتروفورز یک بُعدی جدا میشوند.
دو بُعدی که پروتئینها با استفاده از این روش به آنها تفکیک میشوند میتوانند نقطه ایزوالکتریک، جرم پیچیده پروتئین در حالت بومی یا جرم پروتئین باشند. جداسازی پروتئینها توسط نقطه ایزوالکتریک تمرکز ایزوالکتریک (IEF) نامیده میشود. بدین ترتیب، گرادیان pH بر روی ژل اعمال و پتانسیل الکتریکی در سراسر ژل اعمال میشود و یک انتهای آن مثبتتر از دیگری خواهد بود. در تمام مقادیر pH غیر از نقطه ایزوالکتریکی آنها، پروتئینها باردار میشوند.
اگر پروتئینها بار مثبت داشته باشند، به سمت انتهای منفی و اگر بار منفی داشته باشند، به انتهای مثبت ژل کشیده میشوند. پروتئینهای بُعد اول در امتداد ژل حرکت کرده و در نقطه ایزوالکتریک خود جمع میشوند، یعنی نقطهای که در آن بار کلی پروتئین صفر است (خنثی). برای تجزیه و تحلیل عملکرد پروتئینها در سلول، به کار گرفتن دانش همکاری آنها ضروری است. غالباً پروتئینها در غالب مجتمعهای پروتئینی عملکرد دارند که تجزیه و تحلیل آن نیاز به تکنیکهای دارد که حالت بومی مجتمعهای پروتئینی طی آنها حفظ شود.
در پلی آکریل آمید ژل الکتروفورز بومی، پروتئینها به ترتیب در حالت اصلی خود باقی میمانند و در میدان الکتریکی به ترتیب به دنبال جرم و جرم مجتمعهایشان جدا میشوند. برای به دست آوردن جداسازی بر اساس اندازه و نه بار خالص (مانند IEF)، با استفاده از کوماسی بلو (Coomassie Brilliant Blue) یا سدیم سولفات لیتیوم، بار اضافی به پروتئینها منتقل میشود. پس از اتمام بُعد اول، مجتمعها با استفاده از SDS - PAGE در بُعد دوم، دناتوره میشوند.
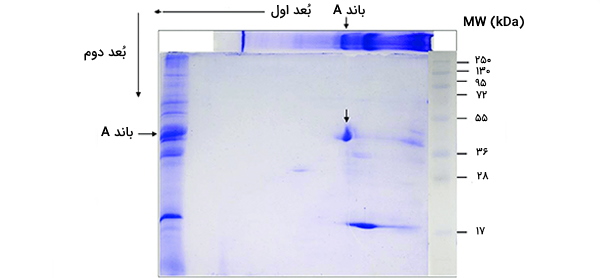
قبل از جداسازی پروتئینها توسط جرم، آنها با سدیم دودسیل سولفات (SDS) همراه با سایر معرفها (SDS - PAGE در بُعد اول) تیمار میشوند. این کار پروتئینها را دناتوره میکند (یعنی آنها را به صورت مولکولهای خطی و طویل در می آورد) و تقریباً متناسب با طول پروتئین تعدادی از مولکولهای SDS را به هم متصل میکند. از آنجا که طول پروتئین دناتوره شده تقریباً متناسب با جرم آن است، معادل این محسوب میشود که بگوییم تعدادی از مولکولهای SDS را تقریباً متناسب با جرم پروتئین متصل میکند. چون مولکولهای SDS بار منفی دارند، همه پروتئینها تقریباً نسبت جرم به بار مشابهی با یکدیگر خواهند داشت.
علاوه بر این، پروتئینها هنگامی که فاقد بار باشند، مهاجرت نخواهند کرد (نتیجه مرحله تمرکز ایزوالکتریک) بنابراین پوشش پروتئین در SDS (با بار منفی) اجازه انتقال پروتئینها در بُعد دوم را میدهد (SDS - PAGE اینگونه نیست و برای استفاده در بُعد اول سازگار است زیرا شارژ میشود و لازم است از یک شوینده غیر یونی یا زوئتریونیک استفاده شود). در بُعد دوم، پتانسیل الکتریکی اما با یک زاویه 90 درجه از میدان اول دوباره اعمال میشود و پروتئینها متناسب با نسبت جرم به بار خود، به سمت مثبتتری از ژل جذب میشوند (زیرا SDS بار منفی دارد).
همانطور که قبلاً توضیح داده شد، این نسبت برای همه پروتئینها تقریباً یکسان خواهد بود. پیشرفت پروتئینها در ژل توسط نیروهای اصطکاکی کاهش مییابد. بنابراین ژل هنگام استفاده از جریان مانند الک مولکولی عمل کرده و پروتئینها را بر اساس وزن مولکولی آنها جدا میکند و پروتئینهای بزرگتر در ژل بیشتر حفظ میشوند و پروتئینهای کوچکتر قادر به عبور از غربال و رسیدن به مناطق پایین ژل هستند.
نتیجه این آزمایش، یک ژل با پروتئینهای پخش شده در سطح آن است. این پروتئینها از طریق روشهای مختلف قابل تشخیص هستند اما بیشترین رنگهای مورد استفاده رنگ نقره و رنگآمیزی کوماسی بلو است. در حالت اول، یک کلوئید نقره به ژل زده میشود و نقره به گروههای سیستئین درون پروتئین اتصال پیدا میکند. نقره در معرض نور ماورا بنفش تیره میشود. مقدار نقره میتواند مربوط به تاریکی و در نتیجه مقدار پروتئین در یک مکان مشخص روی ژل باشد. این اندازهگیری فقط میتواند مقادیر تقریبی را ارائه دهد اما برای بیشتر اهداف تحقیقاتی کافی است.
رنگآمیزی نقره نسبت به کوماسی بریلیانت بلو با طیف خطی 40 برابر، حساسیت 100 برابر دارد. مولکولهای غیر از پروتئین را میتوان با الکتروفورز دو بُعدی جدا کرد. در سنجشهای سوپرکویل DNA، در بُعد اول این مولکول ها از هم جدا شده و توسط یک مقیاسساز DNA (مانند اتیدیم بروماید یا کلروکین سرطانزا کمتر) در مرحله دوم دناتوره میشوند. این روش قابل مقایسه با ترکیب PAGE / SDS-PAGE بومی در جداسازی پروتئین است.
یک روش معمول در الکتروفورز دو بُعدی، استفاده از گرادیان pH ثابت (IPG) در بُعد اول است و روش IPG - DALT نام دارد. نمونه ابتدا بر روی ژل IPG جدا میشود (که به صورت تجاری موجود است) سپس ژل را برای هر نمونه برش میخورد و بعد در SDS - مرکاپتواتانول (SDS - Mercaptoethanol) متعادل و برای وضوح در بُعد دوم روی ژل SDS - PAGE اعمال میشود. به طور معمول از IPG - DALT به دلیل از دست دادن اجزایی با وزن مولکولی کم در حین انتقال به ژل SDS - PAGE، برای کمیسازی پروتئین استفاده نمیشود. نوع دیگر این روش نیز SDS - PAGE ایزوالکتریک فوکوسینگ (IEF SDS - PAGE) است.
آنالیز کمی ژل الکلتروفورز دو بعدی
در پروتئومیکس کمی، این ابزارها در درجه اول با کمیسازی پروتئینهای جدا شده و نشان دادن جدایی بین یک یا چند لکه پروتئین در تصویر اسکن شده از ژل دو بعدی، نشانگرهای زیستی را تجزیه و تحلیل میکنند. علاوه بر این، ابزارهای نرمافزاری شامل Delta2D ،ImageMaster، ملانی، PDQuest ،Progenesis و REDFIN، نقاط بین ژلهای نمونههای مشابه را مطابقت میدهند تا به عنوان مثال، تفاوت پروتئومی بین مراحل اولیه و پیشرفته یک بیماری را نشان دهند.
اگرچه این فناوریها کاربرد وسیعی دارند اما اطلاعات در مورد آن هنوز کامل نیست. به عنوان مثال، در حالی که PDQuest و Progenesis کمیسازی و تجزیه و تحلیل لکههای پروتئینی کاملاً جدا از هم را نشان میدهند، نتایج و تجزیه و تحلیل متفاوتی در مورد لکههایی با درجه تفکیک پایینتر ارائه میکنند. چالشهای تجزیه و تحلیل خودکار با نرم افزار عبارتند از موارد زیر:
- نقاط کاملاً جدا شده با هم تداخل دارند.
- درباره نقاط با درجه تفکیک پایین، اطلاعات اندکی میدهند.
- نقاط ضعیف از نظر غلظت، به خوبی تحلیلی نمیشوند.
- تفاوت بین ژلها (به عنوان مثال، پروتئین در انواع ژل به موقعیتهای مختلف مهاجرت میکند)
- وجود نقاط بیهمتا یا غیر قابل شناسایی منجر به از دست رفتن مقادیر
- خطا در تعیین مقدار (چندین نقطه مجزا ممکن است به اشتباه به عنوان یک نقطه واحد یا قسمتهایی از یک نقطه شناسایی شوند)
میتوان برای هضم خودکار ژل لکههای پروتئین و شناسایی بعدی پروتئینها از طیفسنجی جرمی استفاده کرد. تحلیل دادههای طیفسنجی جرمی میتواند اندازهگیریهای جرمی دقیق را همراه با تعیین توالی پپتیدهایی که از 1000 تا 4000 واحد جرم اتمی دارند، شناسایی کند.
ژل الکتروفورز افتراقی چیست؟
ژل الکتروفورز افتراقی (Difference Gel Electrophoresis) (DIGE) نوعی ژل الکتروفورز است که در آن میتوان قبل از ژل الکتروفورز دو بعدی تا سه نمونه پروتئین مختلف را با رنگهای فلورسنت قابل حل، با طیف مطابق با اندازه و مطابق با بار (به عنوان مثال Cy3 ،Cy5 ،Cy2) برچسبگذاری کرد. این محدودیتها در آزمایش الکتروفورز دو بُعدی سنتی که به دلیل تنوع بین ژل است، غلبه میکند و حتی در نمونههای یکسان نیز قابل توجه است.
از آنجا که پروتئینهای نمونههای مختلف (مثلا سالم یا بیمار، ویروسی یا غیر ویروسی) روی یک ژل اجرا میشوند، میتوان آنها را مستقیماً مقایسه کرد. در حالی که برای انجام این کار با آزمایش الکتروفورز دو بُعدی، نیاز به تعداد زیادی تکرار است.
در آزمایشات حاوی چندین ژل، روش معمول شامل استاندارد داخلی در هر ژل است. استاندارد داخلی با مخلوط کردن چند نمونه یا همه نمونههای آزمایش تهیه میشود. این کار امکان اندازهگیری فراوانی یک پروتئین در هر نمونه نسبت به استاندارد داخلی را فراهم میکند. مقدار هر پروتئین در استاندارد داخلی در هر ژل یکسان است، بنابراین این روش تنوع بین ژلها و اثرگذاری آن در نتیجه را کاهش میدهد.
روش انجام آن به این صورت است که سه نمونه مخلوط شده و برای اندازه اول بر روی IEF (کروماتوگرافی با تمرکز ایزوالکتریک) بارگذاری میشوند و نوار به یک صفحه SDS منتقل میشود. بعد از ژل الکتروفورز نیز ژل با طول موج تحریک هر رنگ، یکی پس از دیگری اسکن میشود، بنابراین هر نمونه را میتوان جداگانه مشاهده کرد (اگر ژل در طول موج تحریک رنگ Cy3 اسکن شود، نمونهای که با آن رنگ برچسبگذاری شده فقط در ژل مشاهده خواهد شد).
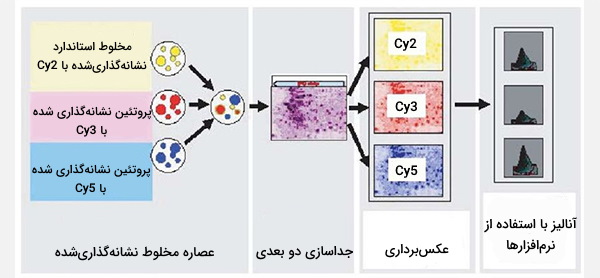
این روش برای دیدن تغییرات فراوانی پروتئین (به عنوان مثال بین یک نمونه از یک فرد سالم و یک نمونه از یک فرد مبتلا به بیماری)، اصلاحات پس از ترجمه، اصلاح و هرگونه تغییراتی که ممکن است اندازه یا نقطه ایزوالکتریک پروتئینها را تغییر دهد، استفاده میشود. شیفتهای دوتایی ممکن است از چپ به راست (تغییر در نقطه ایزوالکتریک)، عمودی (تغییر در اندازه) یا مورب (تغییر در اندازه و نقطه ایزوالکتریک) باشند. برچسب زدن متقابل برای اطمینان از اینکه تغییرات مشاهده شده به دلیل فعل و انفعالات وابسته به رنگ نیست، انجام میشود.
آزمایش الکتروفورز کمی چیست؟
پلی آکریل آمید ژل الکتروفورز متوالی محلی با مقدمات کمی (QPNC - PAGE) یک روش تجزیه و تحلیل، وضوح بالا و بسیار دقیق است که در بیوشیمی و شیمی آلی برای جداسازی کمی پروتئینها توسط نقطه ایزوالکتریک استفاده میشود. این نوع استاندارد ژل الکتروفورز بومی، توسط زیستشناسان برای جداسازی مولکولهای زیستی در محلول، به عنوان مثال، متالوپروتئینهای فعال یا محلی در نمونههای بیولوژیک یا پروتئینهای حاوی فاکتور فلزی یا ایزوفرمهای پروتئینی که به طور صحیح و نامناسب پیچخوردهاند، در مخلوطهای پروتئینی پیچیده استفاده میشود.
از آنجا که حدود 30 تا 40 درصد از کل پروتئینهای شناخته شده حاوی یک یا چند کوفاکتور یون فلزی هستند (به عنوان مثال سرولوپلاسمین، فریتین، پروتئین پیش ساز آمیلوئید، متالوپروتئیناز)، به ویژه متالوپروتئینهای محلی باید پس از بیوپسی مایع جدا، شناسایی و کمیشوند. بسیاری از این کوفاکتورها (به عنوان مثال آهن، مس یا روی) نقشی اساسی در فرایندهای کاتالیزوری آنزیمی دارند یا پیچ خوردن صحیح مولکولهای پروتئینی کروی را تثبیت میکنند.
بنابراین، الکتروفورز با دقت بالا و سایر تکنیکهای جداسازی به عنوان مرحله اولیه تجزیه و تحلیل گونههای پروتئین و فلزات کمیاب بسیار مهم هستند، به دنبال این روشها، طیفسنجی جرمی و روشهای تشدید مغناطیسی برای تعیین کمیت و شناسایی پروتئینهای محلول مورد علاقه هستند. غلظتهای فیزیولوژیک (دامنه ppb) Fe ،Cu ،Zn ،Ni ،Mo ،Pd ،Co ،Mn ،Pt ،Cr ،Cd و سایر کوفاکتورهای فلزی را میتوان در یک مقدار از کسر توسط توده پلاسما به صورت القایی جفت شده به عنوان مثال طیفسنجی (ICP - MS) یا فلورسانس اشعه ایکس با انعکاس کل (TXRF)، شناسایی و کاملاً کمی کرد.
در صورت استفاده از روش ICP - MS، اطلاعات ساختاری متالوبیومولکولهای مرتبط به دلیل یونیزاسیون نمونه با پلاسما برگشتناپذیر است. روش دیگر برای تعیین حساسیت و تعیین عناصر (ردیابی)، طیفسنجی جذب اتمی کوره گرافیت (GF - AAS) است. به دلیل خلوص بالا و غلظت بهینه متالوپروتئینهای جدا شده، به عنوان مثال داروهای گیاهی نوترکیب مانند چاپرون مس برای سوپراکسید دیسموتاز (CCS) از گیاهان دارویی در چند PAGE خاص، تجزیه و تحلیلها میتوانند بر اساس طیفسنجی NMR محلول در شرایط غیر دناتوراسیون انجام شوند.
پروتئینهای فلزی که به صورت نامناسب تاخوردهاند، به عنوان مثال CCS یا «Cu / Z - سوپراکسید دیسموتاز ۱ (SOD1)» موجود در مغز، خون یا سایر نمونههای بالینی، نشاندهنده بیماریهای نورودژنراتیو مانند بیماری آلزایمر (AD) یا اسکلروز جانبی آمیوتروفیک (ALS) است. مولکولهای فعال CCS یا SOD به کنترل هومئوستاتیک درون سلولی یونهای فلزی ضروری مانند روی، مس، نیکل، منگنز، آهن در ارگانیسمها کمک میکنند. بنابراین این مولکولهای زیستی میتوانند فرآیندهای پیشاکسیداتیو و آنتیاکسیدانی را در بدن متعادل کنند.
در غیر این صورت، یونهای فلزی سیتوپلاسم در واکنشهای شبه فنتون شرکت میکنند که در آن رادیکال هیدروکسیل مضر ایجاد میشود که مهار نشده و برای پروتئینها مخرب است. از دست دادن CCS (فعال) باعث افزایش تولید آمیلوئید β در سلولهای عصبی میشود که به نوبه خود یکی از علائم مهم بیماری شناختی آلزایمر (AD) است. بنابراین به نظر میرسد که چاپرون مس برای سوپراکسید دیسموتاز یکی از نشانگرهای زیستی مسمومیت مس در این بیماریها باشد. CCS باید در درجه اول در خون تجزیه و تحلیل شود زیرا متاآنالیز دادههای سرم نشان میدهند که غلظت سرمی مس در بیماران آلزایمر بالاتر از افراد سالم است.
ژل الکتروفورز اسیدهای نوکلئیک
آزمایش الکتروفورز اسیدهای نوکلئیک یک روش تحلیلی است که برای جداسازی قطعات DNA یا RNA بر اساس اندازه و واکنش به کار میرود. مولکولهای اسید نوکلئیک که قرار است مورد تجزیه و تحلیل قرار گیرند، روی محیط چسبناک ژل تنظیم میشوند و میدان الکتریکی باعث حرکت اسیدهای نوکلئیک (که به دلیل ستون فقرات قند فسفات بار منفی دارند) به سمت آند میشوند. جداسازی این قطعات با بهرهگیری از تحرکاتی که مولکولهایی با اندازه مختلف قادر به عبور از طریق ژل هستند، انجام میشود.
مولکولهای طویل کندتر مهاجرت میکنند زیرا در ژل با مقاومت اصطکاکی بالاتری روبرو هستند. از آنجا که اندازه مولکول بر تحرک آن تأثیر میگذارد، قطعات کوچکتر نسبت به آند در یک مدت زمان مشخص، نزدیکتر میشوند. پس از مدتی ولتاژ برداشته شده و شیب تقسیم، تجزیه و تحلیل میشود. برای جداسازی بین قطعات با اندازه مشابه، میتوان ولتاژ یا زمان را افزایش داد. لود کردن گسترده نمونه در یک ژل با ولتاژ پایین، دقیقترین وضوح را ایجاد میکند. ولتاژ تنها عامل در ژل الکتروفورز اسیدهای نوکلئیک نیست. اسید نوکلئیک جدا شده را میتوان به روشهای مختلفی، قبل از جداسازی توسط آزمایش الکتروفورز تهیه کرد.
در مورد مولکولهای بزرگ DNA، مولکولها با استفاده از اندونوکلئاز محدودکننده DNA (یا آنزیم محدودکننده) اغلب به قطعات کوچکتر برش داده میشوند. در موارد دیگر، مانند نمونههای حاصل از PCR، آنزیمهای موجود در نمونه که ممکن است بر جدایی مولکولها تأثیر بگذارند، قبل از تجزیه و تحلیل از طریق روشهای مختلف حذف میشوند. پس از تهیه صحیح اسید نوکلئیک، نمونه محلول اسید نوکلئیک در چاهکهای ژل قرار میگیرد و برای مدت زمان مشخصی ولتاژ روی ژل اعمال میشود. قطعات DNA با طولهای مختلف با استفاده از یک رنگ فلورسنت خاص برای DNA مانند اتیدیوم بروماید، تجسم مییابد.
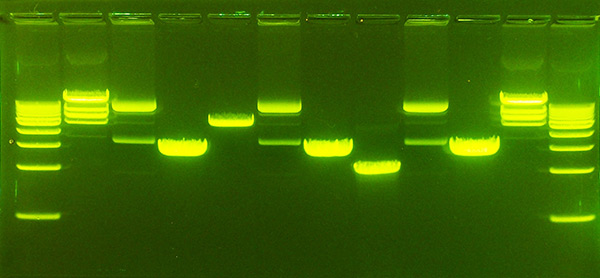
فلورسنت نوارهای مربوط به جمعیتهای مختلف مولکولهای اسید نوکلئیک با وزن مولکولی مختلف در ژل را نشان میدهد. اندازه قطعه معمولاً در نوکلئوتید، جفت باز یا کیلوبایت (برای هزاران جفت باز) بسته به اینکه اسید نوکلئیک تک رشته یا دو رشته جدا شده باشد، گزارش میشود. تعیین اندازه قطعه معمولاً از طریق مقایسه با مارکرهای DNA موجود که شامل قطعات DNA خطی با طول مشخص هستند، انجام میشود. انواع ژلهایی که معمولاً برای الکتروفورز اسید نوکلئیک استفاده میشوند، آگارز (برای مولکولهای نسبتاً طولانی DNA) و پلی آکریل آمید (برای وضوح بالای مولکولهای DNA کوتاه، به عنوان مثال در توالی یابی DNA) هستند.
ژلها به طور معمول در قالب اسلب اجرا میشود اما الکتروفورز مویینهای برای کاربردهایی مانند توالی یابی DNA با توان بالا مهم شده است. تکنیک های الکتروفورز که در ارزیابی آسیب DNA استفاده میشود شامل ژل الکتروفورز قلیایی و ژل الکتروفورز میدان پالسی است. برای بخشهای کوتاه DNA مانند DNA دو رشتهای 20 تا 60 جفت باز، اجرای آنها در ژل پلی آکریل آمید (PAGE) وضوح بهتری خواهد داشت (شرایط طبیعی).
RNA و DNA تکرشتهای نیز توسط PAGE حاوی عوامل دناتوره مانند اوره قابل اجرا و نمایش روی ژل هستند. از روش PAGE به طور گسترده در تکنیکهایی مانند EMSA و سایر روشهای تعامل DNA - پروتئین استفاده میشود. اندازهگیری و تحلیل بیشتر با یک نرم افزار تخصصی تجزیه و تحلیل ژل انجام میگیرد. برخی از فاکتورها میتوانند بر مهاجرت اسیدهای نوکلئیک تأثیر بگذارند که عبارتند از موارد زیر:
- منافذ ژل
- ولتاژ استفاده شده
- قدرت یونی بافر
- غلظت
حد وضوح به ترکیب ژل و مقاومت میدان بستگی دارد. تحرک DNA حلقوی بزرگتر ممکن است به شدت تحت تأثیر اندازه منافذ ژل از DNA خطی تحت تأثیر قرار گیرد. جداسازی قطعات DNA بسیار بزرگ به PFGE نیاز دارد. در ژل الکتروفورز وارونگی میدانی (FIGE، نوعی PFGE)، امکان وارونگی باند وجود دارد که ممکن است مولکولهای بزرگ سریعتر از مولکولهای کوچک حرکت کنند.
کانفورماسیون DNA
ساختار DNA میتواند به طور قابل توجهی بر حرکت آن تأثیر بگذارد، به عنوان مثال، DNA سوپرکویل معمولاً سریعتر از DNA ریلکس حرکت میکند چون فشردهتر است. در آمادهسازی پلاسمید، ممکن است اشکال مختلفی از DNA وجود داشته باشند. ژل حاصل از الکتروفورز پلاسمیدها معمولا یک باند اصلی را نشان میدهد که به صورت سوپرکویل منفی است، در حالی که سایر اشکال DNA ممکن است کم رنگتر باشند. باندهای ژل حاصل ممکن است حاوی DNA شکسته شده (حلقه باز) و فرم حلقوی و ریلکس باشند که معمولا کندتر از DNA سوپرکویل است.
فرم تکرشتهای (که گاهی اوقات بسته به روشهای آمادهسازی ممکن است ظاهر شود) ممکن است جلوتر از DNA سوپرکویل باشد. سرعت حرکت اشکال مختلف میتواند با استفاده از شرایط مختلف الکتروفورز تغییر کند، به عنوان مثال DNA خطی بسته به شرایط ممکن است سریعتر یا کندتر از DNA پیچخورده حرکت کند و تحرک DNA حلقوی با اندازه بزرگتر، ممکن است به شدت تحت تأثیر اندازه منافذ ژل باشد.
اندازه DNA حلقوی مانند پلاسمید، پس از خطی شدن با هضم محدودیت، میتواند با دقت بیشتری اندازهگیری شود مگر اینکه تا زمانی که از مارکرهای DNA سوپرکویل استفاده شود. آسیب DNA به دلیل افزایش اتصال عرضی، مهاجرت DNA الکتروفورتیک را نیز به روشی وابسته به دوز کاهش میدهد.
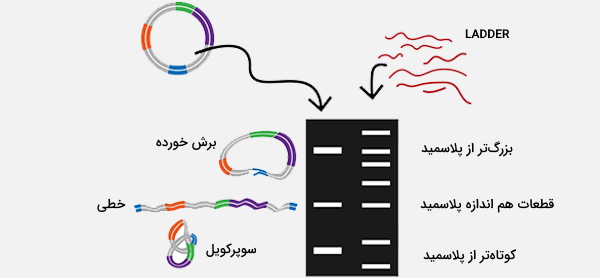
رنگ آمیزی ژل با اتیدیوم بروماید
اگر در زمان الکتروفورز اتیدیم بروماید در ژل وجود داشته باشد، DNA دایره ای تحت تأثیر غلظت اتیدیم بروماید بیشتر از DNA خطی است. تمام حلقههای DNA که به طور طبیعی وجود دارند زیر زخم هستند اما اتیدیم بروماید که به DNA دایرهای تبدیل میشود، میتواند بار، طول و همچنین فوق ماده مولکول DNA را تغییر دهد، بنابراین وجود آن در هنگام الکتروفورز میتواند بر حرکت آن در ژل تأثیر بگذارد. رنگآمیزی متقاطع مانند استفاده از اتیدیوم بروماید در هنگام الکتروفورز، ژل DNA را به اندازه مولکول DNA غربال میکند که به موجب آن مولکولهای کوچکتر سریعتر حرکت میکنند.
DNA دو رشتهای با سرعتی حرکت میکند که تقریباً معکوس با لگاریتم تعداد جفتبازها متناسب است. این رابطه با قطعات DNA بسیار بزرگ از بین میرود و جدا کردن آنها با استفاده از ژل الکتروفورز آگارز استاندارد امکان پذیر نیست. افزایش برادور اتیدیم به درون DNA تبدیل میشود و میتواند آن را از یک مولکول فوق منجمد منفی به شکل کاملاً آرام و سپس در حداکثر درهم آمیزی به ابرقهرمان مثبت پیچیده تبدیل کند. از ژل الکتروفورز آگارز میتوان برای حل DNA حلقوی با توپولوژی متفاوت ابرپوشش استفاده کرد.
غلظت ژل در الکتروفورز DNA
غلظت ژل اندازه منافذ ژل را تعیین میکند و بر نحوه مهاجرت DNA تأثیر میگذارد. وضوح DNA با درصد غلظت ژل تغییر میکند. افزایش غلظت آگارز یک ژل سرعت مهاجرت را کاهش میدهد و جدایی مولکولهای DNA کوچکتر را بهبود میبخشد، در حالی که کاهش غلظت ژل باعث میشود که مولکولهای بزرگ DNA جدا شوند. برای ژل الکتروفورز آگارز استاندارد 0/7 درصد تفکیک یا تفکیک خوبی از قطعات بزرگ 5 تا 10 کیلوبایت از DNA ایجاد میکند، در حالی که 2 درصد ژل تفکیک خوبی برای قطعات کوچک 0/2 تا ۱ کیلوبایت میدهد. حداکثر 3 درصد میتواند برای جداسازی قطعات بسیار ریز استفاده شود اما یک ژل پلیاکریلآمید عمودی برای حل قطعات کوچک مناسبتر است.
با این وجود ژل با غلظت بالا به زمان طولانیتری (گاهی روزها) نیاز دارد و ژلهای با درصد بالا اغلب شکننده هستند و ممکن است به طور یکنواخت تنظیم نشوند. ژل آگارز با درصد بالا باید با PFGE یا FIGE استفاده شود. ژلهای با درصد کم (2/ 0 تا 0 درصد) شکننده هستند. ژلهای 1 درصد برای بسیاری از کاربردها معمول است.
تنظیم ولتاژ ژل الکتروفورز
در ولتاژهای پایین، سرعت انتقال DNA متناسب با ولتاژ اعمال شده است، هرچه ولتاژ بیشتر باشد، DNA سریعتر حرکت میکند. با این حال، در افزایش قدرت میدان الکتریکی، تحرک قطعات DNA با وزن مولکولی بالا به طور متفاوتی افزایش مییابد و دامنه موثر جدایی کاهش مییابد و بنابراین تفکیکپذیری در ولتاژ بالا کمتر است. برای تفکیک مطلوب DNA بزرگتر از 2 کیلو بایت در ژل الکتروفورز استاندارد، 5 تا 8 ولت بر سانتیمتر توصیه میشود. ولتاژ همچنین به دلیل گرم شدن ژل محدود میشود و قرار گرفتن ژل در ولتاژ بالا برای مدت طولانی، به ویژه برای ژل آگارز با نقطه ذوب پایین، ممکن است باعث ذوب شدن ژل شود.
تحرک DNA ممکن است در یک زمینه ناپایدار تغییر کند. در زمینهای که به صورت دورهای معکوس میشود، ممکن است تحرک DNA با اندازه خاص در یک فرکانس خاص کاهش چشمگیری داشته باشد. این پدیده میتواند منجر به وارونگی باند شود که به موجب آن قطعات بزرگتر DNA سریعتر از قطعات کوچکتر در PFGE حرکت میکنند.

مکانیسم مهاجرت DNA در الکتروفورز
بار منفی ستون فقرات فسفاته DNA، آن را به سمت آند با بار مثبت در حین آزمایش الکتروفورز حرکت میدهد. با این حال، مهاجرت مولکولهای DNA در محلول، در غیاب ماتریس ژل، در طول الکتروفورز مستقل از وزن مولکولی خواهد بود، یعنی بدون ماتریس ژل هیچ اندازهای از نظر تفکیک وجود ندارد. فعل و انفعال هیدرودینامیکی بین قسمتهای مختلف DNA با جابجایی جریانهای متقابل در جهت مخالف قطع میشود، بنابراین هیچ مکانیسمی برای ایجاد وابستگی سرعت به طول، در مقیاس بزرگتر از طول غربالگری حدود 10 نانومتر وجود ندارد. این امر الکتروفورز DNA را از رسوبگذاری یا انتشار که در آنها تعامل هیدرودینامیکی طولانی مدت مهم است متفاوت میکند.
بنابراین ماتریس ژل مسئول جداسازی DNA بر اساس اندازه طی آزمایش الکتروفورز است، با این حال مکانیسم دقیق جداشدن کاملاً مشخص نیست. مدلهای مختلفی برای جداسازی مولكولهای زیستی در ماتریس ژل وجود دارند. یکی از مدلهای پذیرفته شده، «مدل اوگستون» (Ogston) است كه ماتریس یک پلیمر متشكل از شبكه منفذهای متصل است که به طور تصادفی توزیع شدهاند. پروتئین کروی یا سوپرکویل DNA از طریق منافذی که به اندازه کافی بزرگ باشند، حرکت میکنند و حرکت مولکولهای بزرگتر به دلیل برخورد با ماتریس ژل با مشکل روبرو شده و کند میشود، بنابراین مولکولهایی با اندازههای مختلف میتوانند در این فرآیند غربال شده و به صورت باندها یا نقاطی از هم جدا شوند.
مدل اوگستون برای مولکولهای بزرگ تجزیه میشود که در نتیجه منافذ به طور قابل توجهی کوچکتر از اندازه مولکول هستند. برای مولکولهای DNA با اندازه بزرگتر از 1 کیلوبایت، معمولاً از یک مدل ترکیبی یا انواع آن، استفاده میشوند. این مدل فرض میکند که DNA میتواند به عنوان یک مولکول طویل از طریق منافذ حرکت کند. در میدان الکتریکی بالاتر، انتهای مولکول به شدت در جهت جلو کشیده میشود و این لبه پیشرو بقیه مولکول را هم به سمت خود میکشد. در نهایت تحرک به یک نقطه اشباع میرسد و DNA بیش از یک مقدار مشخص جداسازی نمیشود. تراز کامل مولکول و میدان در عمل مشاهده نمیشود چون به معنای تحرک یکسان برای مولکولهای کوتاه و بلند است. این روش بیشتر، نوسانات داخلی زنجیره را در نظر میگیرد.
همچنین از مدل تورفتگی برای توضیح تحرک DNA در PFGE استفاده شده است. جهتگیری DNA به تدریج پس از شروع میدان الکتریکی با افزایش سرعت ایجاد میشود و زمان رسیدن آن به سرعت ثابت به اندازه مولکول بستگی دارد. وقتی میدان تغییر میکند، جهتگیری مجدد مولکولهای بزرگتر بیشتر طول میکشد، بنابراین میتوان بین زنجیرهای طولانی که نمیتوانند به سرعت ثابت خود برسند از زنجیرههای کوتاه که بیشتر اوقات با سرعت ثابت حرکت میکنند، تفکیک قائل شد.
مدلهای دیگری نیز وجود دارند. مشاهده مولکولهای رنگآمیزی شده در طول الکتروفورز زیر میکروسکوپ فلورسانس، پویایی ظریفتری را نشان می دهد. با کشش متناوب DNA در جهت میدان، مولکول فشرده شده یا هنگام گرفتن به شکل U قلاب میشود. در الیاف پلیمر گیر کرده است. این مشاهده را میتوان مدل کاترپیلار نامید. مدل دیگر پیشنهاد میکند که DNA با ماتریس پلیمری درگیر شود و هرچه مولکول بزرگتر باشد، احتمال گرفتار شدن و جلوگیری از حرکت آن بیشتر است.
روش انجام ژل الکتروفورز
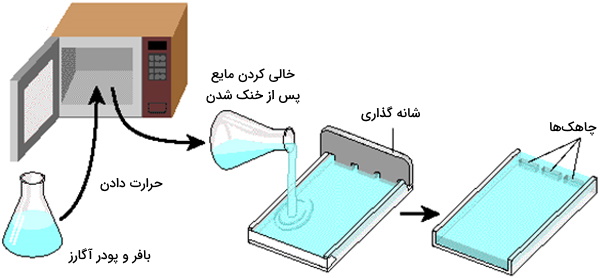
جزئیات آزمایش آگارز ژل الکتروفورز ممکن است بسته به روشها متفاوت باشد اما بیشتر آنها از یک روش کلی پیروی میکنند. ژل با حل شدن پودر آگارز در یک بافر مناسب مانند TAE یا TBE تهیه و در جعبه ریخته میشود و بعد در دمای اتاق تا زمان سفت شدن باقی میماند. آگارز را باید تا نزدیک نقطه جوش در بافر حل کرد و از جوشیدن محلول جلوگیری کرد چون در این صورت غلظت ژل تغییر میکند.هیچ ذره حل نشدهای نباید در ژل باشد چون در این صورت تصویر ژل دقیق نیست و تخلخل یکنواختی برای حرکت یکنواخت ذرات ندارد. شانه حاوی تعداد مناسب چاهک، قبل از ریختن ژل روی جعبه ثابت میشود. آگارز ذوب شده قبل از ریختن محلول در جعبه الکتروفورز باید به اندازه کافی خنک شود.
غلظت ژل بر تفکیک DNA اثرگذار است. ژل آگارز از منافذ میکروسکوپی تشکیل شده که از طریق آنها مولکولها حرکت میکنند و بین اندازه منافذ ژل آگارز و غلظت آن رابطه معکوس وجود دارد. با افزایش غلظت آگارز، اندازه منافذ کاهش مییابند. غلظت ژل زیاد باعث جدا شدن مولکولهای DNA کوچکتر میشود، در حالی که کاهش غلظت ژل باعث میشود که مولکولهای DNA بزرگ از هم جدا شوند. این فرآیند اجازه می دهد قطعات مختلفی از 50 جفت باز تا چندین مگا باز بسته به غلظت ژل مورد استفاده از هم جدا شوند. غلظت آن در وزن آگارز نسبت به حجم بافر مورد استفاده (g/ml) اندازهگیری میشود.
برای ژل الکتروفورز آگارز استاندارد، ژل 0/8 درصد، تفکیک خوبی از قطعات بزرگ 10kb با اندازه ۵ تا ۱۰ کیلوبایتی ایجاد میکند، در حالی که ژل 2 درصد برای قطعات کوچک 0/2 تا ۱ کیلوبایت وضوح خوبی ارائه میدهد. از ژلهای 1 درصد اغلب برای الکتروفورز استاندارد استفاده میشود. ژلهای با درصد بالا اغلب شکننده هستند و ممکن است به طور مساوی تنظیم نشوند، در حالی که ژلهای با درصد کم (2/0 تا 0/0 درصد) شکننده هستند و به راحتی قابل کنترل نیستند. ژلهای آگارز با نقطه ذوب پایین (LMP) نیز شکنندهتر از ژل آگارز طبیعی هستند.
آگارز با نقطه ذوب پایین ممکن است به طور خودکار یا همزمان با آگارز استاندارد برای جداسازی و جداسازی DNA استفاده شود. PFGE و FIGE اغلب با ژل آگارز با درصد بالا انجام میشود. هنگامی که ژل خود را گرفت، شانه برداشته میشود و چاه هایی باقی می ماند که میتوان نمونههای DNA را بارگیری کرد. قبل از بارگیری مخلوط در چاهکها، بافر بارگیری با نمونه DNA مخلوط میشود. بافر بارگیری حاوی ترکیبی متراکم است که ممکن است گلیسرول، ساکارز یا فیکول باشد، چگالی نمونه را بالا میبرد به طوری که نمونه DNA ممکن است در ته چاه فرو رود.
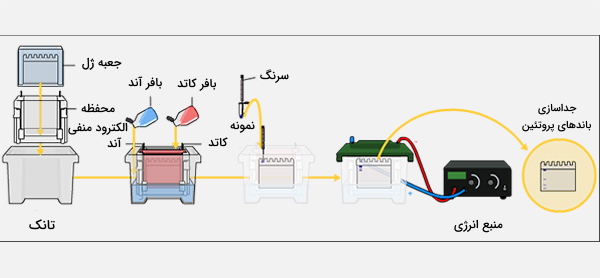
اگر در نمونه DNA اتانول باقی مانده باشد، ممکن است از چاهک شناور و خارج شود. بافر ممکن است شامل رنگهایی مانند زایلن سیانول و بروموفنول آبی باشد که برای نظارت بر پیشرفت الکتروفورز استفاده میشوند. نمونههای DNA با استفاده از سمپلر در چاهک لود میشوند. آگارز ژل الکتروفورز معمولاً به صورت افقی درون دستگاهی که پر از بافر است انجام میشود و ژل در حین الکتروفورز کاملاً در بافر غوطهور است. همچنین میتوان آزمایش الکتروفورز را به صورت عمودی و با ژلی که روی پایه و با استفاده از دستگاه مناسب انجام داد اما کمتر معمول است.
بافر استفاده شده در ژل همان بافر در حال کار در مخزن الکتروفورز است، به همین دلیل الکتروفورز در حالت غوطهوری با ژل آگارز امکانپذیر است. برای تفکیک بهینه DNA در اندازه بزرگتر از 2 کیلو بایت در ژل الکتروفورز استاندارد، ولتاژ 5 تا 8 ولت بر سانتیمتر توصیه میشود (فاصله در سانتیمتر به فاصله بین الکترودها اشاره دارد، بنابراین ولتاژ توصیه شده 5 تا 8، در فاصله بین الکترودها بر حسب سانتیمتر است). ولتاژ ممکن است به دلیل گرم شدن ژل محدود شود و اگر در ولتاژ بالا برای مدت طولانی کار کند، باعث ذوب شدن آن میشود، به خصوص اگر ژل مورد استفاده ژل LMP آگارز یا ژل با غلظت و ضخامت کم باشد.
ولتاژ بسیار زیاد همچنین ممکن است باعث کاهش تفکیک و همچنین ایجاد رگههای باند برای مولکولهای بزرگ DNA شود. ولتاژ بسیار پایین ممکن است منجر به گسترش باند برای قطعات کوچک DNA به دلیل پراکندگی و انتشار شود. از آنجا که DNA در نور طبیعی قابل مشاهده نیست، پیشرفت الکتروفورز با استفاده از رنگهای رنگی کنترل میشود. زایلن سیانول (رنگ آبی روشن) قطعات بزرگ DNA را منجمد میکند، در حالی که رنگ آبی بروموفنول (آبی تیره) با قطعات کوچکتر ترکیب میشود.
رنگهایی که کمتر مورد استفاده قرار میگیرند شامل Cresol Red و Orange G هستند که زودتر از رنگ آبی بروموفنل مهاجرت میکنند. همچنین یک مارکر DNA برای تخمین وزن مولکولی قطعات DNA همزمان لود میشود. با این حال باید توجه داشت که اندازه DNA حلقوی مانند پلاسمیدها را نمیتوان به طور دقیق با استفاده از نشانگرهای استاندارد اندازهگیری کرد، مگر اینکه با هضم محدود به شکل خطی تبدیل شده باشند، یا ممکن است از یک نشانگر DNA استفاده شود.
بافر ژل الکتروفورز
به طور کلی، بافر ایدهآل باید هدایت کنندگی خوبی داشته باشد، گرمای کمتری تولید کند و عمر طولانی داشته باشد. تعدادی بافر برای الکتروفورز آگارز استفاده میشود. موارد رایج اسیدهای نوکلئیک شامل تریس/ استات/ EDTA (TAE) و تریس/ بورات/ EDTA (TBE) هستند. بافرهای استفاده شده حاوی EDTA برای غیرفعال کردن بسیاری از نوکلئازها است که برای عملکرد خود به کاتیون دو ظرفیتی نیاز دارند. بورات در بافر TBE میتواند مشکل ساز باشد زیرا بورات میتواند پلیمری شود یا با دیولهای سیس مانند آنهایی که در RNA یافت میشوند تعامل داشته باشد. TAE کمترین ظرفیت بافر را دارد اما بهترین وضوح را برای DNA بزرگتر فراهم میکند.
این به معنای ولتاژ کمتر و زمان بیشتر اما محصول و نتیجه بهتر است. بسیاری از بافرهای دیگر به عنوان مثال بورات لیتیوم (LB)، هیستیدین الکتریکی ایزو، بافرهای کالای همسان با pK پیشنهاد شدهاند که ادعا میشود جریان کمتری نیاز دارند و بنابراین گرمای کمتری تولید میکنند و یا تحرکات یونی در آنها یکنواختتر است و منجر به عمر طولانیتر بافر میشود. بافر تریس فسفات ظرفیت بافری بالایی دارد اما اگر قرار باشد DNA استخراج شده در واکنش حساس به فسفات استفاده شود، نمیتوان این بافر را به کار برد.
بافر بورات لیتیوم نسبتاً جدید بوده و در حل قطعات بزرگتر از 5 kbp بیاثر است. با این حال، به دلیل هدایت کم آن، میتوان از ولتاژ بسیار بالاتری (حداکثر 35 ولت در سانتیمتر) استفاده کرد که به معنی زمان کوتاهتر برای آزمایش الکتروفورز است. اختلاف اندازه یک جفتباز را میتوان در ژل آگارز 3 درصد در یک محیط با رسانایی بسیار کم (1 میلیمولار بورات لیتیوم) حل کرد. سیستم بافر دیگری ممکن است برای کاربردهای خاص مورد استفاده قرار گیرد، به عنوان مثال بافرهای بوربیتوریک اسید - سدیم باربیتورات یا تریس - باربیتورات برای الکتروفورز پروتئینهای ژل آگارز و به عنوان مثال در تشخیص توزیع غیر طبیعی پروتئینها استفاده میشوند.
رنگ آمیزی ژل الکتروفورز
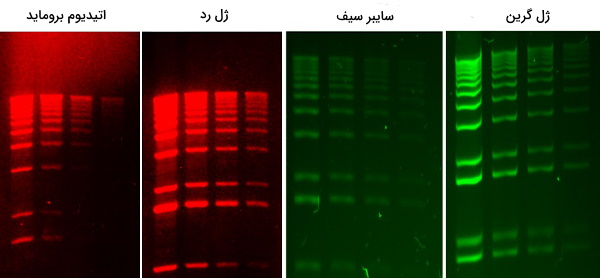
DNA و RNA به طور معمول با رنگآمیزی اتیدیوم بروماید قابل مشاهده خواهند بود. اتیدیوم بروماید به شیارهای بزرگ DNA متصل میشود و زیر نور UV در دستگاه لومینسانس قابل مشاهده است. میزان رنگپذیری هر باند به غلظت DNA بستگی دارد و بنابراین، یک باند با شدت انتشار بالا مقدار بیشتری از DNA را در مقایسه با یک باند با شدت کمتر نشان میدهد. اتیدیوم بروماید ممکن است قبل از سفت شدن ژل به محلول آگارز اضافه شود همچنین میتوان ژل را بعد از الکتروفورز با قرار دادن در محلول ایتیدیوم بروماید رنگآمیزی کرد. از بین بردن ژل لازم نیست اما ممکن است تصاویر بهتری تولید کند. روشهای دیگر رنگآمیزی موجود هستند. به عنوان مثال میتوان به ژل گرین (Gel Green)، سایبر سیف (SYBR Sefe)، ژل رد (GelRed)، آبی متیلن، آبی کرزیلی درخشان، سولفات آبی نیل و بنفش کریستالی اشاره کرد.
محصولات SYBR ،Green ،GelRed و سایر محصولات تجاری مشابه به عنوان گزینههای ایمنتری به برمید اتییدیم فروخته میشوند، زیرا در آزمایش Ames نشان داده شده است که جهشزا است، اگرچه سرطان زایی اتییدیم بروماید در واقع مشخص نشده است. SYBR Green مستلزم استفاده از مبدل روشنایی با نور آبی است. DNA آغشته به بنفش کریستال را میتوان در زیر نور طبیعی و بدون استفاده از دستگاه تابش اشعه ماورا بنفش (UV) مشاهده کرد که یک مزیت است، اما ممکن است یک باند قوی تولید نکند. هنگامی که با اتیدیوم بروماید آغشته میشود، ژل با یک دستگاه روشنایی UV مشاهده میشود.
UV، الکترونها را در حلقه اتیدیوم بروماید تحریک میکند، و پس از بازگشت آنها به حالت پایه، نور آزاد میشود و باعث میشود DNA و کمپلکس اتیید بروماید فلورس شود. روشنکنندههای استاندارد از طول موجهای 302- تا 312- نانومتر (UV-B) استفاده میکنند، اما قرار گرفتن در معرض اشعه ماورا بنفش DNA به مدت 45 ثانیه میتواند به DNA آسیب برساند و روی مراحل بعدی تأثیر بگذارد. به عنوان مثال کارآیی تحول، رونویسی آزمایشگاهی را کاهش می دهد، و PCR. قرار گرفتن در معرض اشعه ماورا بنفش DNA باید محدود شود. استفاده از طول موج بالاتر از 365 نانومتر (دامنه UV-A) باعث آسیب کمتری به DNA میشود و همچنین با اتیدیم برومید فلورسانس بسیار ضعیفتری تولید میکند.
در مواردی که میتوان طول موجهای مختلفی را در مبدل لامپ انتخاب کرد، از طول موج کوتاهتر برای گرفتن تصاویر استفاده میشود، در حالی که اگر لازم باشد روی ژل برای هر مدت طولانی کار کنید، باید از طول موج طولانیتر استفاده شود. دستگاه ترنسلومینیتور (Transilluminator) همچنین ممکن است شامل دستگاههای ضبط تصویر مانند دوربین دیجیتال یا پلاروید باشد که اجازه میدهد تصویر ژل گرفته یا چاپ شود. برای ژل الکتروفورز پروتئین، نوارها ممکن است با لکههای Coomassie یا نقره ظاهر شوند.
باندهای DNA جدا شده اغلب برای اقدامات بعدی مانند توالی یابی و بررسی جهش یا سایر تغییرات نوکلئوتیدی استفاده شوند. برای این کار قطعه حاوی باند DNA مورد نظر، بریده، حل و محتوای DNA از آن تخلیص میشود. در صورت وجود آلودگی یا بهینه نبودن اتصال پرایمر به قطعه مورد نظر، در مراحل قبل از آزمایش الکتروفورز مانند PCR، روی نتیجه الکتروفورز و توالییابی اثر میگذارند. گاهی آگارز با نقطه ذوب کم ترجیح داده شود زیرا حاوی سولفاتهای کمتری است که برخی از واکنشهای آنزیمی هنگام تخلیص را تحت تأثیر قرار میدهد. همچنین ممکن است از جداسازی باند روی ژل برای تکنیکهای بلات در مرحله بعد، استفاده شوند.
دستگاه تصویربرداری از ژل الکتروفورز
ژل داک (Gel Doc)، سیستم تصویربرداری از ژل، به تجهیزات گستردهای که در آزمایشگاههای زیستشناسی مولکولی برای تصویربرداری و مستندسازی اسید نوکلئیک و پروتئین معلق در ژلهای پلی آکریل آمید یا آگارز استفاده میشود، اشاره دارد. این ژلها به طور معمول با اتیدیوم بروماید یا سایر رنگهای اسیدنوکلئیک مانند GelGreen رنگآمیزی میشوند. به طور کلی، ژل داک شامل یک دستگاه تابش نور ماورا بنفش (UV)، یک کاپوت یا یک اتاق تاریک برای محافظت از منابع نور خارجی و محافظت از کاربر در برابر اشعه ماورا بنفش و دوربین CMOS برای گرفتن تصویر است.

تولیدکنندگان اصلی سیستمهای اسناد ژل Bio Rad ،Azure Biosystems ،Bioolympics ،Syngene ،Vilber Lourmat ،UVItec و Aplegen هستند. مدلهای تصویری که اخیراً تولید شدهاند نیز دارای ویژگیهایی برای کنترل انواع فلورسانس و شیمی لومینسانس با دوربینهای خنک شده تا 28- تا 60- درجه سانتیگراد هستند. از دیگر ویژگیهای پیشرفته میتوان به چاپ فوری روی دوربین و اتصال WiFi برای کنترل توسط دستگاههای تلفن هوشمند و تبلت اشاره کرد.
دستگاه ترنسلومیناتور
ترانس لومیناتور از یک منبع اشعه ماورا بنفش استفاده میکند تا نشانگر فلورسنت مورد استفاده در ژلهای الکتروفورز قابل مشاهده باشند. این ژل بر روی پنجره انتقالدهنده قرار گرفته و از زیر روشن میشود. اشعه ماورا بنفش هم برای پوست و هم برای چشم خطرناک است و هنگام کار با این دستگاه باید از محافظ صورت و دستکش مخصوص استفاده کرد. بهتر است زمان کار با ترانس لومیناتور کوتاه باشد. استفاده از این دستگاه به جای ژل داک زمانی کاربرد دارد که نیاز به برش باند مورد نظر از روی ژل برای انجام مراحل بعدی مانند توالییابی ژنوم یا تخلیص DNA باشد.

آزمایش الکتروفورز پروتئین
الکتروفورز پروتئین روشی برای تجزیه و تحلیل پروتئینهای موجود در یک نمونه یا عصاره است. الکتروفورز ممکن است با حجم کمی از نمونه به روشهای جایگزین با یا بدون محیط حمایتی انجام شود:
- ژل الکتروفورز پلی آکریل آمید SDS (به طور خلاصه ژل الکتروفورز، PAGE یا الکتروفورز SDS)
- الکتروفورز جریان آزاد، تمرکز الکتریکی
- ایزوتاکوفورز
- الکتروفورز تمایلی
- ایمونوالکتروفورز
- الکتروفورز مویینهای
هر روش دارای تنوع زیادی با مزایا و محدودیتهای خاص خود است. ژل الکتروفورز پروتئینها غالباً در ترکیب با ایمونوبلات الکتروبلاتین انجام میشود تا اطلاعات بیشتری در مورد پروتئین خاصی بدست آورد. به دلیل محدودیتهای عملی، الکتروفورز پروتئین به طور کلی به عنوان یک روش مقدماتی مناسب نیست.
آزمایش الکتروفورز تمایلی چیست؟
الکتروفورز تمایلی (Affinity Electrophoresis) نام کلی روشهای تحلیلی است که در بیوشیمی و بیوتکنولوژی استفاده میشوند. اطلاعات کمی و کیفی را میتوان از طریق الکتروفورز تمایلی به دست آورد. این روشها شامل به اصطلاح سنجش تغییر تحرک الکتروفورزی، الکتروفورز شیفت شارژ و الکتروفورز مویینهای میل است. این روشها بر اساس تغییر الگوی الکتروفورتیک مولکولها (عمدتا ماکرومولکولها) از طریق برهم کنش اختصاصی هستند. فعل و انفعال یا اتصال مولکول باردار یا بدون بار، به طور معمول خصوصیات الکتروفورتیک مولکول را تغییر میدهد.
پروتئینهای غشایی ممکن است با تغییر در تحرک ناشی از مواد شوینده شارژ شده شناسایی شوند. اسیدهای نوکلئیک یا قطعات اسید نوکلئیک ممکن است با میل آنها به سایر مولکولها مشخص شود. این روشها برای تخمین ثابتهای اتصال، به عنوان مثال در الکتروفورز میل لکتین یا توصیف مولکولها با ویژگیهای خاص مانند محتوای گلیکان یا اتصال لیگاند، استفاده شده است. برای آنزیمها و سایر پروتئینهای متصل کننده لیگاند، الکتروفورز یک بعدی مشابه الکتروفورز ضد و یا ایمونوالکتروفورز موشکی، الکتروفورز میل ترکیبی ممکن است به عنوان کمیسازی جایگزین پروتئین استفاده شود. برخی از روشها مشابه کروماتوگرافی میل ترکیبی با استفاده از لیگاندهای بیحرکت هستند.
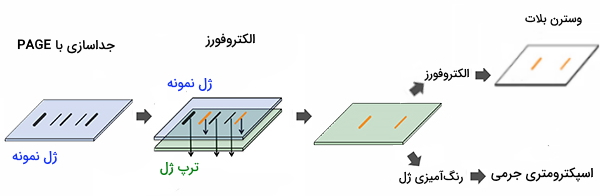
روش های دناتوره کننده پروتئین
SDS - PAGE مجموعهای از تکنیکهای مرتبط برای جداسازی پروتئینها را با توجه به تحرک الکتروفورتیک آنها (تابعی از وزن مولکولی یک زنجیره پلی پپتیدی) توصیف میکند در حالی که در حالت دناتوره (گشوده) است. در اکثر پروتئینها اتصال SDS به زنجیره پلیپپتیدی باعث توزیع یکنواخت بار در واحد جرم میشود در نتیجه منجر به یک تقسیم با اندازه تقریبی در طی الکتروفورز میشود. SDS یک ماده شوینده قوی است که برای تداخل پروتئینهای بومی تا پلیپپتیدهای جداگانه و جداشده استفاده میشود.
هنگامی که یک مخلوط پروتئینی در حضور SDS تا 100 درجه سانتیگراد گرم میشود، مواد شوینده به دور پلیپپتید میپیچند. در این فرآیند، بارهای ذاتی پلی پپتیدها در مقایسه با بارهای منفی ناشی از SDS ناچیز میشوند. بنابراین پلیپپتیدها پس از تیمار تبدیل به ساختارهای میلهای مانند دارای تراکم بار یکنواخت میشوند که همان بار منفی خالص در واحد طول است. تحرکات الکتروفورتیک این پروتئینها یک عملکرد خطی از لگاریتمهای وزن مولکولی آنها خواهد بود.
الکتروفورز پروتئین با حفظ ساختار طبیعی
ژلهای غیر دناتوره پروتئینهایی را که هنوز در حالت تا شده قرار دارند تجزیه و تحلیل میکنند. بنابراین تحرک الکتروفورتیک نه تنها به نسبت بار به جرم، بلکه به شکل و اندازه فیزیکی پروتئین نیز بستگی دارد. انواع این روشها در ادامه توضیح داده شدهاند.
ژل الکتروفورز صفحه بومی آبی
BN-PAGE یک روش PAGE بومی است، جایی که رنگ Coomassie Brilliant Blue بارهای لازم را برای جداسازی الکتروفورز به مجموعههای پروتئینی میدهد. عیب رنگ کوماسی این است که در اتصال به پروتئینها میتواند مانند مواد شوینده عمل کند و باعث جدا شدن مجتمعها شود. اشکال دیگر خاموش شدن احتمالی کمولومینسانس (به عنوان مثال در آزمایش لک وسترن بعدی یا سنجش فعالیت) یا فلورسانس پروتئینهای دارای گروه های مصنوعی (به عنوان مثال هم یا کلروفیل) یا برچسب دار با رنگهای فلورسنت است.
پاک کردن صفحه بومی
CN - PAGE (که معمولاً به آن PAGE بومی گفته میشود) پروتئینهای محلول در آب و غشا را در یک ژل شیبدار پلی آکریل آمید جداسازی میکند. از هیچ ماده رنگی باردار در این روش استفاده نمیشود بنابراین تحرک الکتروفورتیک پروتئینها در CN - PAGE (برخلاف روش تغییر بار BN - PAGE) به بار ذاتی پروتئینها مربوط میشود. فاصله مهاجرت به بار پروتئین، اندازه آن و اندازه منافذ ژل بستگی دارد.
در بسیاری از موارد، وضوح این روش کمتر از BN - PAGE است اما CN - PAGE مزایایی را به همراه دارد هرگاه رنگ کوماسی با تکنیکهای تجزیه و تحلیل بیشتر تداخل کند، به عنوان مثال به عنوان یک روش جداسازی میکرو مقیاس بسیار کارآمد برای تجزیه و تحلیل FRET توصیف شده است. همچنین CN - PAGE نسبت به BN - PAGE ملایم تر است، بنابراین میتواند مجموعههای فوق مولکولی ناپایدار مجتمعهای پروتئینی غشایی را که تحت شرایط BN - PAGE جدا شدهاند، حفظ کند.

صفحه بومی کمی
مجتمع های پروتئینی تا شده مورد علاقه به دلیل ویژگیهای خاص ژل پلی آکریل آمید، تمیز و قابل پیشبینی جدا میشوند. پروتئینهای جدا شده به طور مداوم به یک ماده شوینده فیزیولوژیکی شسته میشوند و به یک جمعکننده کسری منتقل میشوند. در چهار تا پنج بخش PAGE هریک از فاکتورهای فلزی را میتوان شناسایی و کاملاً توسط ICP - MS با وضوح بالا تعیین کرد. ساختارهای متالوپروتئینهای جدا شده را میتوان با طیف سنجی NMR محلول تعیین کرد.
بافر الکتروفورز پروتئین
بیشترین جداسازی پروتئینها با استفاده از سیستم بافر ناپیوسته (یا DISC) انجام میشود که وضوح باندهای داخل ژل را به میزان قابل توجهی افزایش می دهد. در طی الکتروفورز در سیستم ژل ناپیوسته، یک گرادیان یونی در مرحله اولیه الکتروفورز تشکیل میشود که باعث میشود تمام پروتئینها به یک باند تیز متمرکز شوند. تشکیل شیب یون با انتخاب مقدار pH حاصل میشود که در آن یونهای بافر در مقایسه با پروتئینهای پوشش داده شده با SDS متوسط باردار شوند. این شرایط محیطی را فراهم میکند که در آن واکنش های کهلراوش هدایت مولی را تعیین میکند.
در نتیجه پروتئینهای پوشیده شده با SDS طی چند دقیقه در یک ناحیه نازک از مرتبه 19 میکرومتر به چندین برابر متمرکز میشوند. در این مرحله همه پروتئینها با همان سرعت مهاجرت توسط ایزوتاکوفورز مهاجرت میکنند. این در ناحیه ای از ژل رخ می دهد که منافذ بزرگتری دارد تا ماتریس ژل در هنگام تمرکز یا انباشته شدن مهاجرت را عقب نیندازد. جداسازی پروتئینها بر اساس اندازه در ناحیه تحتانی و حل ژل حاصل میشود. ژل محلول به طور معمول دارای اندازه منافذ بسیار کمتری است، که منجر به یک اثر الک میشود که اکنون تحرک الکتروفورز پروتئینها را تعیین میکند.
در همان زمان، قسمت جدا کننده ژل نیز دارای مقدار pH است که در آن یونهای بافر به طور متوسط بار بیشتری را حمل میکنند و باعث میشود آنها از پروتئینهای پوشیده شده با SDS پیشی بگیرند و شیب یون را از بین ببرند و در نتیجه اثر انباشتگی را ایجاد میکنند. یک سیستم بافر ناپیوسته بسیار گسترده، سیستم تریس - گلیسین یا Laemmli است که با pH 6/8 روی هم قرار میگیرد و در pH برابر با 3/3 تا 9/0 برطرف میشود.
اشکال این سیستم این است که این مقادیر pH ممکن است باعث ایجاد پیوند دیسولفید بین باقیماندههای سیستئین در پروتئینها شود زیرا pKa سیستئین از 8 تا 9 متغیر است و از آنجا که عامل کاهشدهنده موجود در بافر بارگیری با پروتئینها مهاجرت نمیکند.
پیشرفتهای اخیر در فناوری بافر با حل کردن پروتئینها در pH کاملاً زیر pKa سیستئین (به عنوان مثال Bis - Tris، pH 6/5) این مشکل را برطرف میکند و شامل عوامل احیا کننده (به عنوان مثال سولفیت سدیم) است که قبل از پروتئینها به داخل ژل میروند حفظ محیط کاهش یک مزیت اضافی استفاده از بافرهایی با مقادیر pH پایین این است که ژل آکریل آمید در مقادیر pH پایین پایدارتر است، بنابراین میتوان ژلها را برای مدت زمان طولانی قبل از استفاده ذخیره کرد.
کاربرد آزمایش الکتروفورز در پزشکی چیست؟
متخصصین آزمایشگاههای تشخیص طبی با استفاده از آزمایش الکتروفورز میتوانند برخی اختلالات پروتئینی و ژنتیکی را تشخیص دهند که برای غربالگری بارداری نیز کاربرد مهمی دارد. در ادامه، فقط چند مورد از کاربردهای آزمایش الکتروفورز در پزشکی شامل تولید آنتیبیوتیک، غربالگری در بارداری، تولید واکسن و تشخیص برخی بیماریهای سیستم ایمن توضیح داده شدهاند.
- تولید آنتیبیوتیک: امروزه از آنتیبیوتیکها استفاده گستردهای دارند اما برای اطمینان از ایمنی، خلوص و اثربخشی باید روی آنها تحقیقات گستردهای انجام شود. الکتروفورز برای جدا کردن آنتیبادیهای موجود در آنتیبیوتیکها از هر گونه ناخالصی استفاده میشود. همچنین محققان را قادر میسازد تا غلظت آنتیبیوتیک و دوز آن را با دقت بیشتری تعیین کنند.
- غربالگری بارداری: آنالیز DNA یکی از رایجترین کاربردهای الکتروفورز است. یکی از تکنیکهای مورد استفاده برای غربالگری در بارداری و بررسی اختلالات ژنتیکی، آزمایش الکتروفورز است که با استفاده از نمونه آمنیون انجام میشود.
- تولید واکسن: واکسنها جان بیشماری از افراد را نجات میدهند و شیوع بیماریهایی مانند سرخک و سیاه سرفه را کاهش دادهاند. آزمایش الکتروفورز نقش اساسی در تولید واکسنهای مدرن داشته است و از آن برای آزمایش خلوص و غلظت واکسنها استفاده میشود. محققان از الکتروفورز برای آزمایش انواع واکسنها و آنتیبادیها برای یافتن بهترین نسخه ممکن از یک واکسن استفاده میکنند.
- تشخیص بیماریهای سیستم ایمنی: ایمونوالکتروفورز برهم کنش بین پروتئینها و آنتیبادیها را بررسی میکند تا طیف گستردهای از بیماریهای ایمنی از جمله بیماری کلیه و مولتیپل اسکلروزیس تشخیص داده شوند. علاوه بر این، محققان میتوانند نحوه تعامل آنتیبادیهای مختلف با پروتئینهای غیر طبیعی موجود در این نمونهها را برای یافتن درمانهای بالقوه یا حتی درمان بیماریهای خودایمنی تجزیه و تحلیل کنند.
- تشخیص در آزمایش خون و آزمایش ادرار: تشخیص وجود و مقادیر برخی ترکیبات مانند هورمونها، پروتئینها یا آنزیمهای خاص در خون و ادرار که میتوانند در تعیین وضعیت سلامت فرد مورد ارزیابی قرار بگیرند.

کاربرد آزمایش الکتروفورز پروتئین در پزشکی
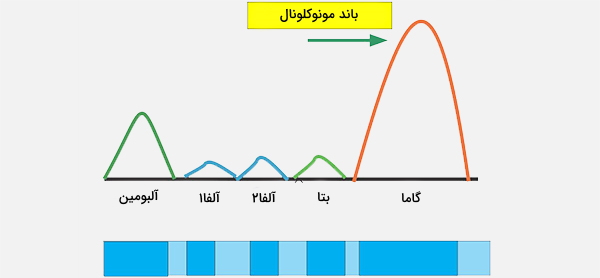
در پزشکی، الکتروفورز پروتئین روشی برای تجزیه و تحلیل پروتئینها به طور عمده در سرم خون به کار میرود. قبل از استفاده گسترده از ژل الکتروفورز، الکتروفورز پروتئین به صورت الکتروفورز جریان آزاد (روی کاغذ) یا به عنوان ایمونوالکتروفورز انجام میشد. به طور سنتی، دو گروه پروتئین خونی در نظر گرفته میشود: آلبومین سرم و گلوبولین. نسبت آنها عموماً برابر است، اما آلبومین به عنوان یک مولکول بسیار کوچکتر و سبک، بار منفی دارد و در ژل الکتروفورتیک تجمع مییابد. یک باند کوچک قبل از آلبومین، ترانستیرتین را نشان میدهد (پرآلبومین نیز نامیده میشود).
برخی از انواع داروها یا مواد شیمیایی بدن میتوانند باند خاص خود را ایجاد کنند، اما معمولاً کم است. باندهای غیرطبیعی در گاموپاتی مونوکلونال با اهمیت نامشخص و میلوم چندگانه دیده میشود و در تشخیص این شرایط مفید است. گلوبولینها بر اساس الگوی باند آنها در آزمایش الکتروفورز طبقهبندی میشوند:
- باند آلفا (α) که از دو قسمت 1 و 2 تشکیل شده است:
- α1 -α1- آنتی تریپسین، گلیکوپروتئین α1 - اسید
- α2 - هاپتوگلوبین، α2-ماکروگلوبولین، α2 - آنتی پلاسمین، سرولوپلاسمین
- باند بتا - ترانسفرین، LDL، مکمل باند گاما (γ) - ایمونوگلوبولین (IgA ،IgD ،IgE ،IgG و IgM)
- پاراپروتئینها (در مولتیپل میلوما) معمولاً در این باند ظاهر میشوند.
در حال حاضر تعیین پروتئینهای زیادی در پلاسما از جمله هورمونها و آنزیمها در پزشکی کاربرد دارند که برخی از آنها نیز توسط الکتروفورز تعیین میشوند. با این حال، آزمایش الکتروفورز عمدتا یک ابزار تحقیقاتی و یا طبی برای بررسی پروتئینهای خون در تشخیص برخی از بیماریها است.
ژل الکتروفورز ذرات نانو
یکی از کاربردهای جدید ژل الکتروفورز جداسازی یا توصیف نانوذرات نانو اکسید فلز یا فلزات (به عنوان مثال Au ،Ag ،ZnO ،SiO2) با توجه به اندازه، شکل یا شیمی سطح نانو ذرات است. هدف این است که یک نمونه همگنتر (مثل توزیع ذرات کوچکتر) به دست آورد که میتواند در محصولات یا فرآیندهای بعدی استفاده شود. برای جداسازی ذرات نانو در ژل الکتروفورز، اندازه ذرات در مقایسه با اندازه منافذ ژل پارامتر اصلی است که بر اساس آن دو مکانیسم مهاجرت دارند:
- مکانیسم نامحدود که در آن اندازه ذرات بسیار بیشتر از اندازه منافذ ژل است.
- مکانیسم محدود که اندازه ذرات و منافذ مشابه هستند.










با سلام و احترام ممنون از مطالب مفید و عالی شما.
سلام و خسته نباشین. مطالب بسیار مفید میباشد. ممنون میشم مطالب ارائه شده بصورت فایل برای بنده ارسال کنین. دکتر علیپور
واقعا این مطالب شما به من خیلی کمک کردند برای کار تحقیقاتی و ازمایشگاه. عالی عالی