تبلور مواد چیست؟ – از صفر تا صد
«تبلور» (Crystallization)، به جامدسازی اتمها یا مولکولها و تبدیل آنها به ساختاری منظم تحت عنوان بلور میگویند. به طور معمول، از عبارت تبلور مواد در تعریف رسوب آهسته یک بلور استفاده میکنند. البته در فرآیندهای همچون انجماد و رسوب مستقیم یک گاز هم از تبلور بهره میگیرند.


تبلور مواد در آزمایشگاههای شیمی بمنظور خالصسازی جامدات مورد استفاده قرار میگیرد. روند کلی به این صورت است که یک جامد ناخالص به طور کامل در مقدار کمی از حلالی داغ و جوشان، حل میشود و به محلول حاصل، فرصت میدهند تا به آرامی سرد شود. بلورهایی که در نهایت بر اثر این امر تشکیل خواهند شد، خلوص بسیار بالایی دارند و ناخالصیهای ماده جامد در محلول اشباع باقی میمانند. در آخر نیز بلورهای جامد را میتوان به کمک فیلتراسیون از ناخالصیها جدا کرد.
مقدمه
در نظر مردم، بلور (کریستال) از جمله زیباییهای طبیعت به حساب میآید چرا که در بسیاری از بلورها، خطوط زیبایی یافت میشود که در نهایت، انعکاس نور را از سطح خود به همراه دارند. ظاهر یک بلور به دلیل ساختار ماکروسکوپی آن است که واحدی تکرارشونده، شبکهای سهبعدی از بلور را میسازد.
شکل یکنواخت و ساختار الگویی یک بلور، آن را از یک جامد بیشکل (آمورف) متمایز میکند. به همین دلیل، فرآیندهای «تهنشینی» (Precipitation) و «تبلور» (Crystallization) با یکدیگر تفاوت دارند. جامدهای حاصل از تهنشینی (رسوب)، خلوص کمتری نسبت به بلورها دارند.

برای انجام تبلور، به دو اتقاق نیاز است: ابتدا، در فرآیندی موسوم به «هستهزایی» (Nucleation)، اتمها یا مولکولها در مقیاس ماکروسکوپی، خوشههایی را تشکیل دهند. در مرحله دوم، درصورتیکه «خوشهها» (Clusters)، پایدار و به اندازه کافی بزرگ شوند، رشد بلور صورت میگیرد. اتمها و ترکیبات به طور معمول، بیش از یک ساختار از بلورها را تشکیل میدهند. لازم به ذکر است که نوع آرایش اتمهای بلور در مراحل هستهزایی تعیین میشود که به عوامل مختلفی وابسته است که برخی از آنها در زیر آورده شدهاند:
به هنگام رشد بلورها، تعادلی بین محلول و بلورها صورت میگیرد به گونهای که ذرات حلشونده دوباره در محلول حل میشوند و همزمان، مواد محلول رسوب میکنند. همچنین اگر محلول به صورت فوق اشباع باشد، تبلور خواهیم داشت چراکه مواد حل شونده دیگر توانایی انحلال و رسوب همزمان را ندارند. در برخی موارد، استفاده از محلولهای فوق اشباع، برای القای شرایط تبلور مواد، مناسب نیستند. به طور معمول برای شروع پدیده هستهزایی باید از «بذر بلور» (Seed Crystall) یا یک سطح زبر استفاده کرد.
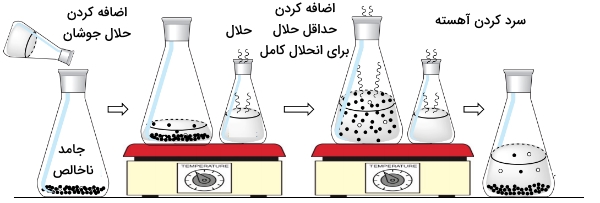
همانطور که در ابتدای متن نیز به آن اشاره شد، از تبلور مواد به منظور روشی برای خالصسازی مواد جامد استفاده میشود. در تصویر زیر میتوان روند کلی این فرآیند را مشاهده کرد:
مثالهایی از تبلور مواد
مواد مختلف به صورت طبیعی یا مصنوعی متبلور میشوند که زمان این تبلور میتواند سریع یا در مقیاس زمانهای زمینشناسی باشد. برخی از مثالهای تبلور مواد در زیر آورده شدهاند:
- تشکیل دانه برف
- شکرک زدن عسل
- تشکیل «استالاکتیت» (Stalactite) و «استالاگمیت» (Stalagmite) در غارها
- ساخت نبات و سنگهای جواهر مصنوعی
روشهای بلورسازی
روشهای مختلفی وجود دارد که به کمک آن میتوان مادهای را متبلور کرد. همچنین، همانطور که در ادامه متن نیز به آن خواهیم پرداخت، نوع پیوندهای دخیل در ترکیبات اعم از یونی، کووالانسی یا فلزی، در نحوه انجام روشها مهم هستند. روشهای مختلف تبلور مواد در زیر آورده شدهاند:
- سردکردن یک محلول یا ماده مذاب
- تبخیر حلال
- اضافه کردن حلال دوم و کاهش انحلالپذیری حلشونده
- تصعید
- «لایهبندی» (Layering)
- اضافه کردن کاتیون یا آنیون
متداولترین روش در بلورسازی، اضافه کردن حلشونده به یک حلال است. به طور معمول، دمای محلول را افزایش میدهند تا انحلالپذیری افزایش یابد. در مرحله بعد، مخلوط گرم را از فیلتر عبور میدهند. با این کار، ناخالصیها و ذرات حلنشده از محلول جدا میشوند. سپس، به فیلترات فرصت میدهند تا به آرامی سرد شود و در این مرحله، بلورها تشکیل خواهند شد. در نهایت، بلورهای تشکیل شده را از محلول جدا میکنند و به آنها فرصت میدهند تا خشک شوند.
در روشی دیگر، بلورها را با حلالی شستشو میدهند که بلورها در آن نامحلول باشند. در صورتیکه این فرآیند بمنظور افزایش خلوص، دوباره انجام شود، به آن «تبلور مجدد» (Recrystallization) میگویند.
سرعت سرد کردن محلول و مقدار تبخیر حلال، تاثیر بسیاری بر اندازه و شکل بلورهای حاصل دارد. هرقدر سرعت سرد کردن آهستهتر و میزان تبخیر کمتر باشد، به نتایج بهتری دست پیدا میکنیم.
ظرف OSLO برای تبلور مواد
محفظه یا تبلور «اسلو» (OSLO) که با نام ظرف تبلور «تعلیقه» (Suspension) طبقهبندی شده شناخته میشود ازجمله قدیمیترین محفظهها برای تولید بلورهای درشت و بزرگ به شمار میرود. طراحی این محفظه باید از دو معیار زیر برخوردار باشد:
- اشباعزدایی مایع اصلی یا مادر توسط تماس با بزرگترین بلورها در محفظه تبلور.
- نگهداری بیشتر بلورها در حالت تعلیقه بدون تماس با دستگاه همزن به منظور دستیابی با بلورهای بزرگ با توزیع میانگین باریک.
شکل این دستگاه در تصویر زیر نشان داده شده است:
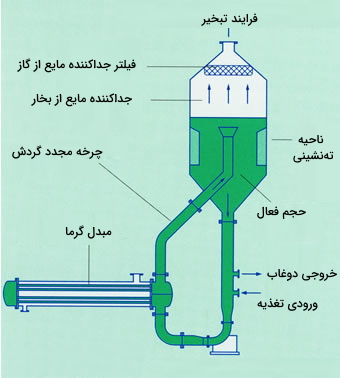
محفظه تبلور در پایینترین ناحیه قرار دارد. بالاترین قسمت نیز متعلق به جداسازی بخار- مایع بوده و در آن اشباعزدایی از طریق حذف حلال (برای بسیاری از کاربردها حلال، آب است). مایعی که به مقدار کمی فوق اشباع رسیده از طریق لوله مرکزی به سمت پایین جریان پیدا میکند و فوق اشباع بودن آن از طریق تماس مایع با بستری از سیال بلورها از بین میرود. زمانیکه برای کاربردهای خاص رسیدن به بلورهایی با اندازههای بزرگ و درشت نیاز و مطلوب است استفاده از این دستگاه برای تبلور مواد از جهت اقتصادی بسیار باصرفه خواهد بود.
از آنجا که در این روش خبری از دستگاه همزن نیست مقدار از بین رفتن بلورهای ریزدانه و همچنین انرژی مورد نیاز کمتر است. استفاده از ظرف اسلو برای تبلور این امکان را میهد که چرخههای طولانی تولید در بین دورههای شست و شو ظرف انجام شوند. اغلب انواع ظرفهای تبلور OSLO از «نوع بسته» (Close type) هستند. البته زمانهاییکه به ناحیه تهنشینی بزرگ یا ساخت لولههایی از فلزات یا آلیاژهای گرانقیمت نیاز است بهتر است که از ظرف OSLO از نوع «باز» استفاده شود. تصویر زیر ظرف OSLO از نوع باز را نشان میدهد.
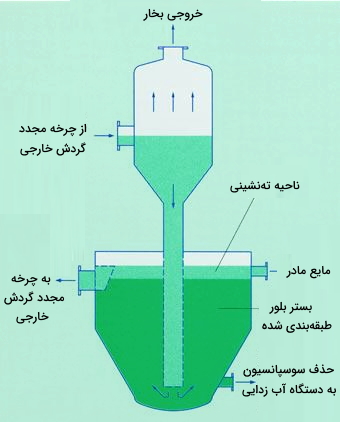
همچنین تصویر زیر ظرف تبلور مواد OSLO را در صنعت نشان میدهد.

ویژگیهای مطلوب OSLO
ظرف OSLO برای تبلور مواد از یک سری ویژگیها برخوردار است که عبارتند از:
- بلورهایی با اندازه بالای ۶ میلیمتر
- عدم وجود پمپ گردش داخلی
- نرخ جوانهزنی مجدد قابل توجه
- خصلت فوق اشباع بالا
- توزیع بلورهای ریز
- زمان نگهداری زیاد در بستر جریان
- چرخههای تولید بالا در بین بازههای تمیزکاری ظرف
تبلور از نگاه ترمودینامیک
فرآیند تبلور، گویی قانون دوم ترمودینامیک را نقض میکند. درحالیکه بیشتر فرآیندها، نتایج بهتری را در دماهای بالاتر بدست میدهند، تبلور در دماهای پایینتر اتفاق میافتد. با این وجود، به دلیل آزاد شدن گرمای نهان ذوب در زمان تبلور، آنتروپی سیستم افزایش پیدا میکند و بنابراین، این اصل بدون تغییر حفظ میشود.
زمانی که مولکولهای یک بلور خالص را حرارت بدهیم، به مایع تبدیل میشوند. این اتقاق در یک بازه دمایی محدود بوجود میآید که برای هر بلور، نقطه مشخصی دارد. زمانی که بلور، مایع شود، ساختار پیچیده آن از بین میرود. دلیل انجام عمل ذوب، غلبه آنتروپی سیستم بر آنتالپی آن است:
با در نظر گرفتن بلورها نیز، این قانون همچنان برقرار است. به طور مشابه، زمانی که یک بلور مذاب، سرد شود، مولکولها به حالت بلوری خود برخواهند گشت. دلیل این اتفاق را باید در از دست دادن آنتروپی، به هنگام منظم شدن مولکولها در سیستم جستجو کرد.
طبیعت فرآیند تبلور با عوامل ترمودینامیکی و سینتیکی هدایت میشود. در نتیجه، عوامل متغیر بسیاری در آن دخیل هستند که کنترل این فرآیند را دشوار میسازند. عواملی همچون سطح ناخالصی، طراحی دستگاههای تبلور و نوع سردسازی، بر اندازه، تعداد و شکل بلورها تاثیرگذارند.
کاربردهای تبلور
اصلیترین کاربرد تبلور در آزمایشگاههای شیمی، خالصسازی جامدهای ناخالص است. این مواد میتوانند واکنشگر (ریجنت) باشند که در طول زمان تغییر کردهاند یا اینکه جامدهای ناخالص حاصل از واکنشهای شیمیایی را شامل شوند.
خالصسازی ریجنت
ان-بروموسوکسین ایمید (N-Bromosuccinimide)، واکنشگری برای واکنشهای «برمزنی» (Bromination) است. این ماده به طور معمول در ظرف خود به رنگ زرد یا نارنجی حضور دارد چراکه با گذشت زمان، این جامد تغییر و تولید میکند و رنگ زرد نیز به همین دلیل ایجاد میشود. قبل از استفاده از این ماده، باید به کمک تبلور، آن را خالصسازی کنیم تا به رنگ اصلی خود، یعنی رنگ سفید برسد. اگر این ماده را بدون تبلور، در واکنشها استفاده کنیم، بازده واکنش بسیار پایین خواهد آمد چراکه اطلاع دقیقی از مقدار ریجنت نداریم و به دلیل حضور بُرم اضافی در واکنش، فرآوردههای فرعی خواهیم داشت.

خالصسازی مخلوطها
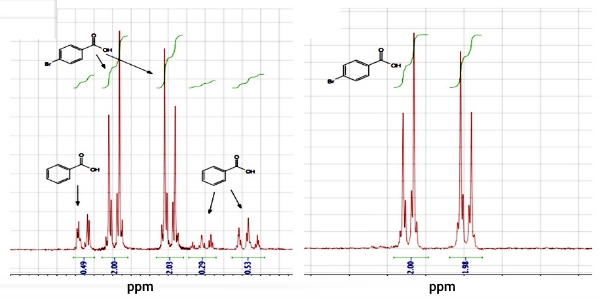
اگر فرآورده خام یک واکنش شیمیایی، جامد باشد، ممکن است برای حذف ناخالصیها از تبلور استفاده شود. به طور مثال، با بُرمزنی بنزوییک اسید، ام-بروموبنزوییک اسید تولید میشود که واکنش آن در زیر آورده شده است. جامد حاصل، به دلیل ناخالصی، واکنشپذیری کمی دارد که آن را به کمک تبلور میتوان خالصسازی کرد.
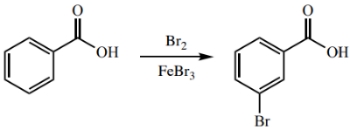
به طور مثال، مخلوطی حاوی ۸۵ درصد مولی «پی-بروموبنزوییک اسید» (p-Bromobenzoic Acid) و ۱۵ درصد مولی بنزوییک اسید در اختیار داریم. رنگ زرد این جامد، بر ناخالصی آن دلالت دارد. با استفاده از اتانول، این جامد را در فرآیند تبلور، خالصسازی کردیم که تغییر رنگ آن، شاهدی بر این ادعا است.
نه تنها رنگ جامد حاصل، گواه خلوص این ماده است بلکه با آنالیز نقطه ذوب و رزونانس مغناطیسی هستهای پروتون میتوان به جواب قابل استنادی دست پیدا کرد. نقطه ذوب جامد اولیه در حدود 221-250 درجه سانتیگراد بود درحالیکه نقطه ذوب جامد خالص، بین 248 تا 259 درجه سانتیگراد ذکر شده است.

جامد متبلور، دامنه ذوب کمتری دارد که همین امر را میتوان دلیل بر خلوص این ماده ذکر کرد. علاوه بر این، در طیف جامد اولیه، ردی از هر دو ماده بنزوییک اسید و پی-بروموبنزوییک اسید دیده میشود اما در جامد متبلور، هیچ ردی از ناخالصی بنزوییک اسید نیست.
انتخاب حلال مناسب
از آنجایی که بسیاری از جامدات در حلالهای گرم، به راحتی حل میشوند، میتوان در بسیاری از موارد از تبلور برای خالصسازی استفاده کرد اما برای بکارگیری این روش باید نکاتی را مد نظر قرار داد که اصلیترین آن، نوع انحلال جامد در دماهای مختلف حلال است.
پروفایل دمایی ایدهآل
همانطور که گفته شد، با افزایش دمای یک حلال، میتوان جامدات ناخالص را در آن حل کرد. کافئین، جامد سفیدی است که از این الگو پیروی میکند، به طوریکه ۱ گرم از آن در 46 میلیلیتر آب حل میشود. اگر دمای آب به 80 درجه سانتیگراد برسد، همین مقدار کافئین را میتوان در ۵/۵ میللیتر آب حل کرد و باز هم اگر دما را به نقطه جوش آب برسانیم، ۱ گرم کافئین در تنها 1/5 میلیلیتر آب نیز حل میشود.
اگر این مساله را بخواهیم سادهتر بیان کنیم، کافی است که به شستشوی ظروف توجه کنیم. ظروفی که لک غذاها بر روی آن باقی ماندهاند، با آب گرم به راحتی تمیز خواهند شد چراکه بخشی از شستشوی ظروف شامل حل کردن ناخالصیهای روی ظروف در آب است.
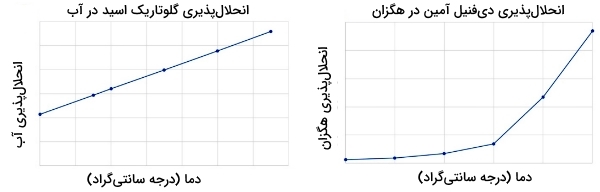
میزان انحلالپذیری یک ترکیب را میتوان به صورت تجربی تعیین کرد. حلشوندگی برخی از مواد با افزایش دما افزایش مییابد. این افزایش ممکن است به صورت خطی یا «نمایی» (Exponential) باشد. برای اینکه تبلور مناسبی داشته باشیم ترکیب مورد نظر ما باید در حلال گرم به شدت انحلالپذیر باشد و همزمان حلالپذیری کمی در حلال سرد داشته باشد. در تصویر زیر نمودار انحلالپذیری «گلوتاریک اسید» (Glutaric Acid) با فرمول (طرف چپ) در آب و دیفنیل آمین در هگزان (طرف راست) نشان داده شده است.
در هر دو ماده، انحلالپذیری با افزایش دما افزایش پیدا میکند اما توجه داشته باشید که نمیتوان گلوتاریک اسید را با تبلور، از آب جدا کرد چراکه این ماده در دماهای پایین نیز انحلالپذیری بالایی در آب دارد.
تعیین حلال
عامل اصلی در موفقیت فرآیند تبلور، انتخاب مناسب نوع حلال است. علاوه بر عواملی که پیشتر توضیح داده شد، همچون انحلالپذیری زیاد و کم در دماهای بالا و پایین، عوامل دیگری نیز در انحلالپذیری دخیل هستند که در ادامه به آنها خواهیم پرداخت.
یک حلال مناسب باید، ارزانقیمت، غیرسمی و با واکنشپذیری و نقطه جوش پایین باشد. به طور معمول، نقطه جوش کمتر از ۱۰۰ درجه سانتیگراد برای یک حلال مناسب است. جدول زیر، حلالهای معمول در تبلور مواد را نشان میدهد. در این میان، تولوئن، بالاترین نقطه جوش را دارد که در صورت وجود جایگزین، میتوان آنرا تعویض کرد چراکه مادهای سمی است و بوی نامطبوعی دارد. استفاده از حلال با نقطه جوش پایین، علاوه بر تبخیر سریع، از خروج مواد محلول نیز جلوگیری میکند زیرا در مواردی، نقطه جوش مواد محلول، از حلال پایینتر است و در این شرایط، مواد از محلول خارج خواهند شد و به جای شکلگیری یک جامد، مایع تشکیل میدهند و در این حالت، تبلور صورت نمیگیرد.
| حلال | نقطه جوش (درجه سانتیگراد) |
| دیاتیل اتر | 35 |
| استون | 56 |
| اتر نفتی | 30-60 |
| «لیگروین» (Ligroin) | 60-90 |
| متانول | 65 |
| هگزان | 69 |
| اسیل استات | 77 |
| اتانول | 78 |
| آب | 100 |
| تولوئن | 111 |
حلالهایی همچون استون و دیاتیل اتر که نقطه جوش پایینی دارند، به شدت اشتعالپذیر هستند و کار با آنها دشوار است چراکه به سادگی تبخیر میشوند. البته تا زمانی که جایگزینی برای آنها وجود نداشته باشد، با رعایت احتیاط میتوان از این حلالها استفاده کرد.
در پیشبینی انتخاب حلال مناسب، روندهایی کلی وجود دارد که میتوان از آنها بهره برد:
- از آنجایی که ترکیب مورد نظر باید در حلال در حال جوش، انحلالپذیر باشد، بهتر است که ترکیب و حلال، هردو دارای نیروهای بین مولکولی یکسانی باشند. به طور مثال، اگر ترکیب، پیوند هیدروژنی داشته باشد همچون الکلها، کربوکسیلیکاسیدها و آمینها، میتوان از آب برای فرآیند تبلور مواد استفاده کرد.
- اگر قطبیت ترکیب، شدید نباشد، استفاده از اتانول به عنوان حلال، گزینه مناسبی است.
- اگر ترکیب، ناقطبی باشد، به طور معمول از اتر نفتی یا هگزان میتوان استفاده کرد.
با توجه به اینکه پیشبینی یک حلال ایدهآل برای تبلور مواد کار دشواری است، باید از مقالات چاپشده در این خصوص کمک گرفت، همچنین به کمک دادههای انحلالپذیری و کتب مرجع شیمی آلی، میتوان حلال مناسب را انتخاب کرد.

دستورالعمل کلی برای حذف ناخالصیها
تبلور مواد زمانی کارایی مناسبی دارد که میزان ناخالصی، اندک و کمتر از ۵ درصد مولی در جامد باشد. همچنین، اگر پروفایل (روند) دمایی ناخالصی، تفاوت زیادی با ماده مورد نظر داشته باشد نیز میتوان از تبلور برای خالصسازی استفاده کرد.
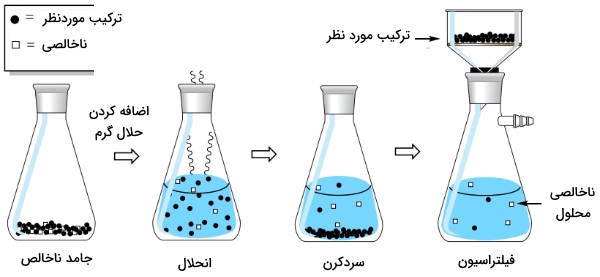
تصویر زیر، مراحل کلی را برای حذف «ناخالصی انحلالپذیر» (Soluble Impurity) از یک جامد ناخالص نشان میدهد. در حقیقت، این ناخالصی، در بافت (ماتریکس) بلور حضور دارد اما به طور کامل در حلال حل میشود. در ابتدا، جامد ناخالص را در مقدار بسیار کمی از حلال گرم، به طور کامل حل میکنیم. با اینکار، ناخالصیهای به دام افتاده در بافت جامد را آزاد خواهیم کرد. به هنگام سرد کردن، ناخالصی به صورت محلول باقی میماند و درحالیکه ماده مورد نظر متبلور خواهد شد. جامد متبلور را در نهایت میتوان به کمک فیلتراسیون از محلول جدا کرد.
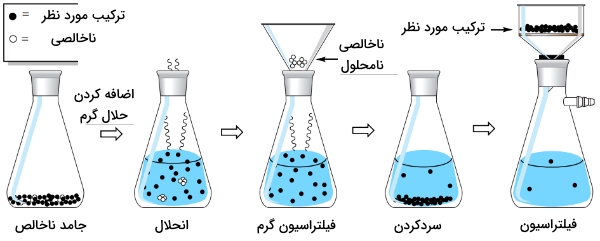
در تصویر زیر نیز دستورالعمل کلی برای حذف «ناخالصی نامحلول» (Insoluble Impurity) از یک جامد ناخالص نشان داده شده و بدان معنی است که ناخالصی در ماتریکس بلور حضور دارد اما در حلال، نامحلول است. جامد ناخالص را در حداقل مقدار حلال مورد نیاز برای انحلال، حرارت میدهند. در این حالت، مواد نامحلول را به کمک «فیلتراسیون گرم» (Hot Filtration) از محلول خارج میکنند. در مرحله بعد، به کمک تبلور و فیلتراسیون، خالصسازی انجام میشود.
آزمایش تبلور
در آزمایش ساده زیر، میخواهیم تبلور مواد را نشان دهیم.
- در ابتدا، کمی آب در یک بشر بریزید.
- به کمک چراغ بونزن، مخلوط را گرم کنید. زمانی که مخلوط شروع به جوشیدن کرد، پودر سولفات مس به آن اضافه کنید.
- به طور مداوم، محلول حاصل را هم بزنید. میتوانید از اسپاتول برای این کار استفاده کنید و تا زمان انحلال کامل به آن پودر سولفات مس اضافه کنید.
- محلول را فیلتر کنید و به آن اجازه دهید تا سرد شود.
- در نهایت بلورهای سولفات مس را به صورت معلق در محلول خواهید دید.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش مقدمهای بر مهندسی شیمی
- آلدهیدها — به زبان ساده
- استرها — به زبان ساده
^^













با سلام و سپاس، چگونه می توان جلوی تبلور مجدد جامدات محلول را گرفت؟ لطفا به صورت کاربردی بفرمایید از موادی باید استفاده کرد تا جلوی تبلور دوباره ی یک جامد محلول را گرفت. سپاس دوباره
سلام از ظرف تبلور olso
فیلم یا عکس یا توضیحی ندارین
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. مطلب ظرف تبلور OSLO همراه با تصویر به متن اضافه شد.
با تشکر.
سلام و خدا قوت . به مطالب خیلی عالی پرداخته شده ، فقط من یه سوال از شما داشتم [منظور از تبلور دو حلالی چیست و اصول و روش کار آن چگونه است؟]
ممنون میشم اگه کمکم کنید.
با سلام؛
برای داشتن «تبلور مجدد دوحلالی» (Two-Solvent Recrystallization) باید محلولی داشته باشید (محلول ۱) که ترکیب مورد نظر، در نقطه جوش، در آن انحلالپذیر باشد. محلول دوم باید زمانی که به محلول اشباع اول اضافه میشود، سبب تبلور شود.
با تشکر از همراهی شما با مجله فرادرس
سلام
با سرد کردن ناگهانی نمی شود نبات درست کرد؟
با تشکر
با سلام
در بیشتر موارد برای تشکیل بلور باید محلول مورد نظر به آرامی سرد شود.
با تشکر از همراهی شما با مجله فرادرس
خیلی عالی بود ولی من یه چیزیو نفهمیدم چجوری سردش میکنن؟؟
ممنونم
با سلام؛
برای سرد کردن همانطور که در «آزمایش تبلور» بیان شده است، گاهی اوقات محلول را در دمای محیط قرار میدهند و به آن فرصت میدهند تا سرد شود.
با تشکر از همراهی شما با مجله فرادرس
ممنون چقدر مطالب کافی و دقیقیبود خیلی لطف کردید
ممنون توضیحاتتون بسیار کامل بود .