تعلیقه چیست؟ – به زبان ساده + تعریف و مثال

تعلیقه یا «سوسپانسیون» (Suspensions) مخلوطی ناهمگن تشکیل شده از سیال و ذرات معلق درون آن است. این ذرات معلق در تعلیقه دارای وزن یا ویژگی های خاصی هستند که به آنها کمک میکنند در سیال معلق بمانند. در ادامه مطلب تعلیقه و تفاوت آن با محلول، امولسیون و کلوئید توضیح داده میشود. علاوه بر این تعلیقههای دارویی و عوامل موثر بر پایداری آنها مورد بحث قرار میگیرد.
تعلیقه چیست ؟
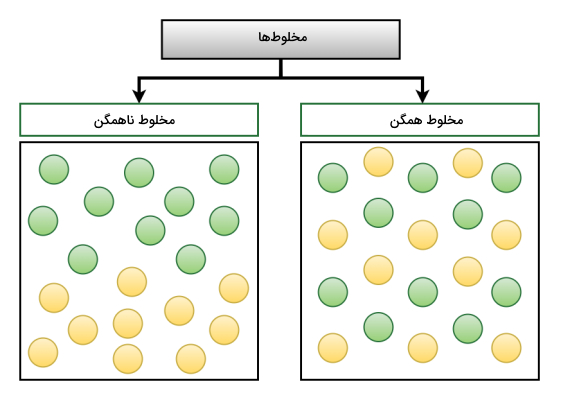
همانطور که در مقدمه توضیح داده شد تعلیقه یا «سوسپانسیون» (Suspension) به مخلوط ناهمگنی گفته میشود که ذرات معلق درون آن اندازهای بزرگتر از 1000 نانومتر دارند. تعلیقه حداقل از دو فاز تشکیل شده است. فاز خارجی که به آن «فاز پیوسته» (Continuous Phase) یا «محیط پراکنده» (Dispersion Medium) گفته میشود و معمولا مایع (مانند آب) یا نیمهمایع (مانند ژل) است. در حالی که فاز داخلی یا فاز «پراکنده» (Dispersed) ذرات معلق را تشکیل میدهد.
به این دلیل که تعلیقه لااقل از دو ماده مجزا تشکیل شده است، به آن مخلوط ناهمگن میگویند. ممکن است در صورت کنار گذاشتن تعلیقه ذرات معلق در آن تهنشین شوند ولی در این حالت دیگر به آن مخلوط نمیگوییم. تعلیقه در حالتی ایجاد میشود که ذرات درون سیال معلق باشد.
مثال هایی از تعلیقه
بعضی از انواع مخلوطهای تعلیقه شامل موارد زیر میشوند.
- آب گلآلود
- غبار موجود در هوا
- آرد در آب
- گچ موجود در آب
- دوغ
- شیرکاکائو
- رنگ گواش
- شربت خاکشیر
ویژگیهای سوسپانسیون
ویژگیهای تعلیقه به شرح زیر هستند.
- مخلوط ناهمگن که حداقل از دو ماده تشکیل شده باشد.
- میتواند هم پراکندگی نوری داشته باشد.
- پایدار نیست چون در صورت حرکت ندادن آن، ذرات معلق ته نشین میشوند و دیگر نمیتوان آن را تعلیقه دانست.
- ذرات معلق درون آن را میتوان با روشهای فیزیکی مثل فیلتر از سیال جدا کرد.
- ذرات معلق موجود در آن در سیال حل نمیشوند.
- تعلیقه در حالت طبیعی به صورت کدر دیده میشود.
- ذرات معلق در تعلیقه با چشم غیرمسلح دیده میشوند چون بزرگتر از 1000 نانومتر هستند.
- وقتی که ذرات درون آن تهنشین شوند، دیگر قادر به پراکنده کردن نور نیست.
پراکندگی نور در تعلیقه چگونه ارزیابی میشود ؟
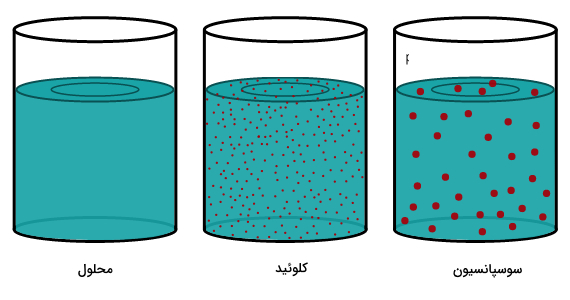
پراکندگی نور در کلوئيد و تعلیقه را با استفاده از «اثر تیندال» (Tyndall Effect) میسنجند که توسط «جان تیندال» (John Tyndall) در قرن 19 معرفی شده است. برای بررسی اثر تیندال نوار باریکی از نور را از نمونه عبور میدهند. اگر ذرات کاملا در نمونه حل شده باشد (مثل محلولها) مسیر عبور نور در آن دیده نمیشود و سطح مقطع نوری که از محلول عبور میکند تغییری نمیکند.
در صورتی که ذرات جامد در نمونه معلق باشد (مثل کلوئیدها یا تعلیقه)، نور را پراکنده میکنند. به همین جهت مسیر عبور نور در نمونه مشخص میشود و به دلیل پراکنده کردن نور سطع مقطع نور عبور کرده از نمونه بیشتر میشود. به طور کلی اثر تیندال در ذراتی با قطری بین 40 تا 900 نانومتر، دیده میشود. اگر ذرات سوسپانسیون خیلی بزرگ باشند، نور اصلا از نمونه عبور نمیکند. اثر تیندال را میتوانید در تصویر زیر روی محلول، کلوئید و تعلیقه مشاهده کنید.

تفاوت تعلیقه، کلوئید و محلول
تمام مخلوطهای همگن محلول در نظر گرفته میشوند اما مخلوطهای ناهمگن میتوانند کلوئید یا سوسپانسیون باشند. ذراتی که در مخلوطهای سوسپانسیونی هستند، با چشم دیده میشوند.
در صورتی که ذرات کلوئیدی کوچک هستند اما نه آنقدر که در سیال حل شوند. سایر تفاوتهای سوسپانسون، کلوئيد و محلولها در جدول زیر توضیح داده شدهاند.
| ویژگی | محلول | کلوئید | سوسپانسیون |
| اندازه ذرات | کمتر از 1 نانومتر | بین 1 تا 1000 نانومتر | بیش از 1000 نانومتر |
| همگن بودن | همگن | ناهمگن | ناهمگن |
| اثر تیندال | ندارد | دارد. | دارد. |
| تحرک | معمولا دیده نمیشود. | دیده میشود. | ممکن است دیده شود. |
| شفافیت | شفاف | شفاف | کدر |
| تهنشین شدن ذرات | تهنشین نمیشود. | با سانتریفیوژ تهنشین میشوند. | خودبخود تهنشین میشوند. |
| جداسازی با روش فیزیکی | خیر | خیر | بلی |
| پایداری | پایدار | پایدار | ناپایدار |
| مثال | محلول آب و شکر | شیر | مخلوط آب و آرد |
تفاوت امولسیون و تعلیقه در چیست ؟
«امولسیون» (Emulsion) فقط از این جهت شبیه به سوسپانسیون است که از دو فاز تشکیل شده است. برخلاف سوسپانسیون که میتواند از دو فاز از هر حالتی (مایع، جامد، گاز) تشکیل شده باشد، امولسیون مخلوطی از دو مایع است.
چیزی که امولسیون را جالب می کند این واقعیت است که این دو مایع غیرقابل اختلاط هستند، یعنی بدون کمک خارجی امکان مخلوط کردن آنها وجود ندارد. به عبارت دیگر، امولسیونها خود به خود تشکیل نمیشوند و برای حفظ پایداری خود به یک نیروی خارجی مثل تکان دادن، هم زدن، یا افزودن «امولسیفایر» (Emulsifier) نیاز دارند. برای مثال ترکیب شیر و آب یک امولسیون کلوئیدی است. همچنین آب و روغن و مایونز نیز امولسیون هستند.
امولسیفایرها از یک بخش آبگریز (معمولا اسیدچرب بلندزنجیر) و یک بخش آبدوست (باردار یا بدونبار) تشکیل شدهاند. بخشهای ابگریز با مایع روغنی و ذرات آبدوست با مایع آبی ارتباط برقرار میکند و ذرات کوچک روغنی در آب را تشکیل میدهد.
سوسپانسیون در ترکیبات دارویی
بیشتر سوسپانسیونهای دارویی از ذرات معلق جامد در محیط آب تشکیل شدهاند. البته سوسپانسیونهای روغنی نیز وجود دارند که در این مطلب بحث نمیشوند. ذرات معلق در سوسپانسیونهای دارویی معمولا اندازهای بزرگتر از 0٫۵ میکرومتر دارند. تعلیقههای دارویی براساس نحوه تجویز به سه دسته تقسیم میشوند.
- خوراکی
- تزریقی
- لوسیون موضعی

البته داروهای تعلیقی به شکل «ایروسل» (Aerosol) نیز وجود دارند که میتوان از آنها روی پوست یا به صورت استنشاغی استفاده کرد. برخی از داروهای سوسپانسیونی به صورت پودر فروخته میشوند تا بلافاصله بعد از حل شدن در آب مصرف شوند (برای مثال آمپول پنیسیلین). در این حالت هیدرولیز ماده دارویی به حداقل میرسد و ماده دارویی بیشترین اثر خود را خواهد داشت. مثالهایی از سوسپانسیونهای دارویی موجود به شرح زیر هستند.
- سوسپانسیونهای ضداسید خوراکی
- سوسپانسیونهای آنتیباکتریال خوراکی
- سوسپانسیونهای ضددرد خوراکی
- سوسپانسیونهای ضدانگل خوراکی
- سوسپانسیونهای ضدتشنج خوراکی
- سوسپانسیونهای ضدقارچ خوراکی
- سوسپانسیونهای ضدسرطان داخل وریدی
- سوسپانسیونهای ضدبارداری عضلانی
- لوسیونهای موضعی
مزایای استفاده از سوسپانسیون در ترکیبات دارویی
سوسپانسونها کلاس مهمی از انواع داروها را تشکیل میدهند که مزایای آنها به شرح زیر است.
- پراکنده کردن داروهای آبگریز
- عدم نیاز به استفاده از دو حلال
- پوشاندن مزه بد بعضی از ترکیبات دارویی
- مقاومت در برابر هیدرولیز و اکسید شدن ترکیبات دارویی
- جلوگیری از فعالیت میکروبها
- بلع راحت
- مناسب برای تزریقات عضلانی
علاوه بر مزایای ذکر شده، در مقایسه با حالت محلول غلظت بیشتری از ماده موثر را میتوان در حالت سوسپانسیون نگهداری کرد.
معایب استفاده از سوسپانسیون در ترکیبات دارویی
نگهداری داروها به صورت تعلیقه معایبی هم دارند که شامل موارد زیر میشوند.
- امکان تغییر در دوز مصرفی (اگر به خوبی مخلوط نشده باشند.)
- نیاز به محل نگهداری بزرگ
ویژگیهای سطحی ذرات معلق در تعلیقه دارویی
در سوسپانسیونهای دارویی، فاز جامد به صورت ذرات ریز در محیط آبی قرار میگیرد که به همین دلیل سطوح زیادی از دارو با محیط آب در ارتباط است. این موضوع میتواند بر پایداری سوسپانسیون تاثیر بگذارد به همین جهت دو ویژگی مهم سطح همچون «انرژی آزاد سطح» (Surface Free Energy) و «پتانسیل سطحی» (Surface Potential) برای پایداری تعلیقه بررسی میشوند. در ادامه مطلب این دو ویژگی توضیح داده خواهند شد.
انرژی آزاد سطح
وقتی ذرات ریز جامد در ارتباط با فاز خارجی (منظور همان مایع است.) مخلوط هستند معمولا انرژی آزاد زیادی روی سطوح آنها به وجود میآید. رابطه بین انرژی آزاد و اندازه سطح از طریق فرمول زیر محاسبه میشود.
$$\triangle G = \gamma \triangle A$$
در این فرمول $$\triangle G$$ نشان دهنده انرژی آزاد سطح، $$\triangle A$$ نشان دهنده اندازه سطح و $$ \gamma$$ کشش سطحی بین سطح ذرات معلق و فاز خارجی را نشان میدهد.
هر چه انرژی سطح کمتر باشد پایداری تعلیقه بیشتر است. یعنی ذرات معلق در آن دیرتر رسوب میکنند. در تعلیقههایی که انرژی آزاد سطح ذرات آنها بالا است، ذرات معلق تجمع پیدا میکنند تا اندازه سطح را کاهش دهند. به دنبال تجمع، سنگین میشوند و زود رسوب میکنند. برای جلوگیری از این موضوع به تعلیقههایی با انرژی آزاد سطحی بالا، «عامل مرطوب کننده» (Wetting Agent) اضافه میکنند تا کشش سطحی را کاهش دهد و انرژی آزاد سطح نیز به دنبال آن کاهش یابد.
پتانسیل سطحی
پتانسیل سطحی وقتی ایجاد میشود که در سطح ذرات معلق در مایع بار الکتریکی ایجاد شود. بار الکتریکی به دلالیل مختلفی ایجاد میشود. برای مثال اگر در تعلیقه الکترولیت وجود داشته باشد، ذرات معلق میتوانند بخشی از یونها را در سطح خود جذب کنند و باعث تولید بار سطحی شوند.
در برخی مواقع عوامل فعال سطحی، که قبلا در سطح مشترک بین ذرات معلق و مایع جذب شدهاند، یونیزه میشوند و بار مثبت یا منفی به ذرات میدهند. برای مثال، «سدیم دودسیل سولفات» (Sodium Dodecyl Sulfate | SDS)، در محیط آبی آنیونی است.
گاهی نیز گروههای عاملی موجود در سطح ذرات به دلیل pH محیط اطراف یونیزه میشوند و بار ایجاد میکنند. برای مثال پپتیدها و پروتئینها حاوی گروههای عاملی (مانند $$-COOH$$ و $$–NH_2$$) هستند که میتوانند در این شرایط یونیزه شوند.
ایجاد دو لایه الکتریکی در تعلیقه
هنگامی که ذرات معلق در محلول آبی الکترولیت قرار دارند، ذرات ممکن است به طور انتخابی یکی از گونههای بار (مثبت یا منفی) را جذب کنند. اگر گونه جذب شده آنیون باشد، ذرات به طور کلی دارای بار منفی خواهند شد. در این حالت به این آنیونها، «یونهای تعیین کننده پتانسیل الکتریکی» (Potential-determining Ions) یا «یون همراه» (Co-ions) میگویند. گونههای یونی باقی مانده در محلول که به ذره جذب نشدهاند، شامل آنیونهای باقیمانده (آنیونهایی که به ذره جذب نشدهاند.) و تمام کاتیونها هستند. این به این معنی است که کاتیونهای موجود در فاز خارجی بیشتر از آنیونها خواهند بود. این کاتیونها که بار مخالف با یونهای همراه دارند، به عنوان «یونهای مخالف» (Counter-ions) یا «ژژنیون» (Gegenions) شناخته میشوند.
یونهای مخالف توسط نیروهای الکتریکی به سطح ذره معلق دارای بار منفی جذب میشوند و همراه آن جابجا میشوند. یعنی اگر روی ذرات معلق بار منفی قرار داشت، یونهای دارای بار مثبت موجود در سیال، به آنها جذب میشوند و لایه محکمی از بار مخالف (در اینجا مثبت) دور ذره (در اینجا دارای بار منفی) تشکیل میدهند. یونهای مخالف همچنین مانع جذب بیشتر آنیونها (یونها بار منفی) به سطح ذره میشوند. این نیروهای الکتریکی و «حرکت حرارتی» (Thermal Motion) باعث توزیع برابر یونها در محیط میشوند.
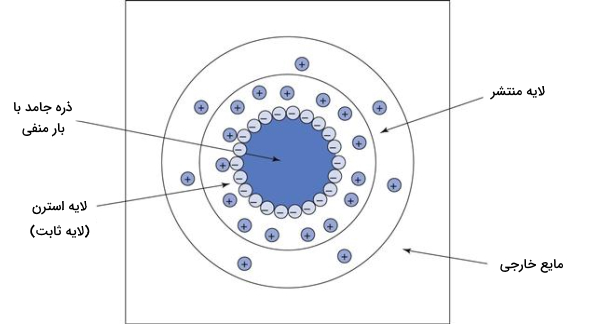
به این بخش از سیال که دورتادور ذره معلق پوشیده از یون قرار میگیرد و لایهای با بار مخالف ذره را تشکیل می دهد، «لایه ثابت» (Stern Layer) میگویند. دور لایه استرن (که در اینجا بار مثبت دارد)، بیشتر یونهای مخالف قرار میگیرند و «لایه منتشر» (Diffuse Layer) را تشکیل میدهند. یونهای موجود در این لایه نسبتا متحرک هستند و به دلیل انرژی گرمایی در محیط پیرامون جابجا میشوند و یونهای دیگر جای آنها را میگیرند. بعد از لایه انتشار میزان یونهای مثبت و منفی در محیط یکسان است و از نظر الکتریکی خنثی است. این لایهها و بار آنها در تصویر بالا مشخص شدهاند.
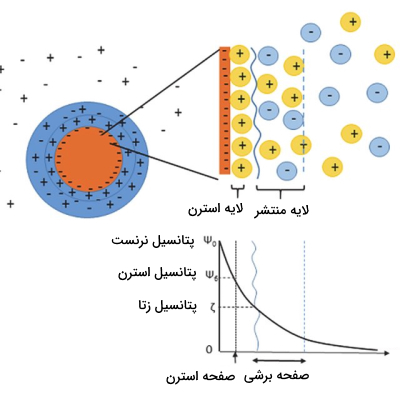
وقتی که ذره درون سیال حرکت میکند لایه ثابت نیز همراه آن جابجا میشود به همین جهت، ذره روی لایه ثابت در سیال حرکت میکند که به آن «صفحه برشی» (Shear Plane) میگویند. صفحه برشی لایه منتشر و مرز لایه ثابت را دربر میگیرد. تعداد یونهای مخالف در صفحه برشی کمتر از تعداد یونهای همراه است، بنابراین در مورد مثال زده شده این صفحه نیز بار منفی دارد.

به طور خلاصه، لایه استرن به طور محکم به ذره معلق متصل میشود و عمدتا از یونهای مخالف (مخالف بار ذره) تشکیل میشود. لایه منتشر نسبتا تحرک بیشتری دارد و بیشتر از یونهای همراه (موافق بار ذره) تشکیل شده است. به این دولایه، دولایه الکتریکی تعلیقه میگویند. میزان ضخامت این دولایه الکتریکی به میزان و نوع یونهای موجود در سیال بستگی دارد. البته باید به این موضوع توجه کرد که سوسپانسیون علارغم وجود این دولایه الکتریکی خنثی است.
نرنست و پتانسیل زتا در تعلیقه
تفاوت در پتانسیل الکتریکی بین سطح ذرات و منطقه خنثی از نظر الکتریکی در سیال را «پتاسیل نرنست» (Nernst Potential) میگویند. بنابراین، پتانسیل نرنست توسط پتانسیل الکتریکی به وجود آمده توسط یونهای سطح ذرات کنترل میشود. اختلاف پتانسیل بین صفحه برشی و منطقه خنثی از نظر الکتریکی در سیال را نیز «پتانسیل زتا» (Zeta Potential) میگویند که آن را با نماد $$\zeta$$ نشان میدهند.
پتانسیل نرنست در پایداری تعلیقه تاثیر چندانی ندارد اما پتانسیل زتا اهمیت ویژهای در پایداری سوسپانسیون دارد. پتانسیل زتا باعث ایجاد درجاتی از دافعه بین ذرات معلق با بار یکسان میشود. اگر پتانسیل زتا از محدوده خاصی پایینتر بیاید میزان نیروهای جاذبه واندروالسی بین ذرات به نیروی دافعه پتانسیل زتا غلبه میکند و باعث دلمه شدن ذرات میشود که در نتیجه آن ذرات موجود در تعلیقه رسوب خواهند کرد.
مرطوب کردن ذرات برای ایجاد سوسپانسیون
تعلیقهها از ذرات نامحلول در محیط پراکندهای (معمولا آبی) تشکیل شدهاند. بعضی از ذرات نامحلول ممکن است به راحتی توسط آب با مقدار کمی تکان دادن ظرف، مرطوب شوند. اما برخی از ذرات بسیار آبگریز هستند و در نتیجه با قرار گرفتن در محیط آبی یا تشکیل توده میدهند یا علیرغم چگالی بالا بر روی آب شناور میمانند. این درمورد ذرات بسیار ریز بیشتر صادق است چون نسبت سطح به حجم بیشتری دارند.
قرار نگرفتن ذرات درون محیط آبی ممکن است به دلیل «کشش سطحی» (Interfacial Tension) بسیار زیاد ذره با محیط آبی باشد. به دلیل وجود کشش سطحی زیاد، «زاویه تماس» (Contact Angle) بین ذره و محیط نیز بالا میرود.
برای حل این مشکل و تشکیل تعلیقه از «عوامل فعال کننده سطوح» (Surface Active Agents) استفاده میکنند که کشش سطحی و در نتیجه زاویه تماس را کاهش میدهند. زنجیره هیدروکربنی موجود در عوامل فعال کننده سطوح، روی سطح آبگریز ذرات قرار میگیرد و بخش قطبی آنها با محیط آبی تماس پیدا میکند. مرطوب شدن ذرات تعلیقه را میتوان با استفاده با «فرمول یانگ» (Young’s Equation) محاسبه کرد.
$$costheta=\frac{gamma_{s/v}-gamma_{s/l}}{gamma_{l/v}}$$
در این فرمول، $$\theta$$ نشاندهنده زاویه تماس، $$\gamma$$ کشش سطحی بین فازهای مختلف جامد (S)، بخار (V) و مایع (L) است. عوامل مرطوب کننده میزان $$gamma_{s/l}$$ و $$gamma_{l/v}$$ را کاهش میدهند که در نتیجه آن زاویه تماس کاهش مییابد.
سورفکتانتهایی که میزان «تعادل آبدوست چربیدوست» (Hydrophilic–lipophilic Balance | HLB) آنها بین 7 تا 9 باشد به عنوان عوامل مرطوبکننده عمل میکنند. بیشتر سورفکتانتها تا غلظت 0٫1٪ در تعلیقهها استفاده میشوند چون استفاده از مقادیر بالای سورفکتانت باعث تولید کف یا سوسپانسیونهای پراکنده میشود که برای مصارف دارویی مناسب نیستند.
از جمله رایجترین عوامل مرطوبکنندهای که در سوسپانسیونهای دارویی خوراکی استفاده میشوند، «پلیسورباتها» (Polysorbates) و «سوربیتاناسترها» (Sorbitan Esters) هستند. پلیمرهای آبدوست نیز میتوانند به عنوان عوامل مرطوب کننده استفاده شوند. مثالهایی از این پلیمرها در بخش زیر لیست شده اند.
- «اقاقیا» (Acacia)
- «کتیرا» (Tragacanth)
- «گزانتانگام» (Xanthan Gum)
- «سیلیکاتهای الومینیوم منیزیم» (Aluminum–magnesium Silicates)
- «سیلیکاهای کلوئیدی» (Colloidal Silica)
- مشتقات سلولزی
این پلیمرها پوشش آبدوست روی ذرات جامد تشکیل میدهند و میزان مرطوب شدن آنها را بیشتر میکنند. اگر از این پلیمرها بیش از حد استفاده شود باعث تشکیل ژل در سوسپانسیون میشود.
علاوه بر عوامل مرطوبکننده ذکر شده میتوان از «مواد رطوبتگیر» (Hygroscopic Solvents) مانند الکل، گلیسرول، گلایکول استفاده کرد. این مواد کشش سطحی بین مایع و هوا را کاهش میدهند و به ذرات کمک میکنند تا به صورت تودهای در محیط پراکنده نفوذ کنند و هوای موجود در منافذ آنها پس از مدتی خارج میشود.
نظریه DLVO در مخلوطهای تعلیقه
برخورد ذرات موجود در تعلیقه با یکدیگر ممکن است به دلیل «حرکت براونی» (Brownian Motion) یا تفاوت در سرعت رسوب ذرات اتفاق بیفتد. در نتیجه برخود ذرات با یکدیگر، یکی از دو اتفاق زیر رخ میدهد.
- ذرات به یکدیگر متصل میشوند و تشکیل دلمه میدهند.
- ذرات از هم دور میشوند و در سیال پراکنده میشوند.
این که کدام یک از نتایج بالا اتفاق بیفتد به میزان نیروهای دافعه و جاذبه میان ذرات بستگی دارد. همانطور که در بخش قبل توضیح داده شد، پتانسیل زتا نقش مهمی در پایداری سوسپانسیون دارد. پتانسیل زتای حداقل یا بحرانی برای پایداری تعلیقه مورد نیاز است. یعنی سیستمهایی که بار کمی دارند پایداری بیشتری در مقابل اضافه کردن الکترولیتها دارند. اضافه کردن الکترولیتها به سوسپانسیون باعث رسوب ذرات آن میشود. یعنی با افزایش ظرفیت یونی تعلیقه میزان قدرت رسوب افزایش پیدا میکند. به این مسئله قانون «شولز هاردی» (Schulze Hardy) میگویند.

«درژاگوین» (Derjaguin)، «لاندو» (Landau)، «وروی» (Verwey) و «اوربیک» (Overbeek) به طور مستقل از اطلاعات حاصل از قانون شولز هاردی استفاده کردند تا پایداری «کلوئیدهای لیوفوبیک» (Lyophobic Colloids) را توضیح دهند. نتیجه تلاش آنها نظریه کلاسیک DLVO شد که برهمکنش ذرات در مخلوطهای کلوئیدی لیوفوبیک را توضیح میدهد. حدود 20 سال بعد «کایس» (Kayes) نشان داد که از این نظریه میتوان برای توصیف برهمکنش ذرات در مخلوطهای سوسپانسیونی نیز استفاده کرد.
بر اساس این نظریه پتانسیل انرژی برهمکنش بین ذرات موجود در تعلیقه ($$V_T$$)، نتیجه دافعه ناشی از دو لایه الکتریکی ($$V_R$$) و جذب ناشی از نیروهای واندروالس است ($$V_A$$). این مسئله را با فرمول زیر بررسی میکنند.
$$V_T=V_R+V_A$$
میزان $$V_R$$ به عواملی مانند پتانسیل زتا، ثابت دیالکتریک محیط، شعاع ذرات و فاصله بین ذرات بستگی دارد. در مقابل فاکتورهایی مثل شعاع ذرات و فاصله بین آنها روی $$V_A$$ تاثیر میگذارند.
نظریه DLVO را میتوان با توجه به نمودار زیر درک کرد. در این نمودار جاذبه و دافعه الکتریکی در مقابل هم رسم شدهاند. در فواصل مشخص از یک ذره (h)، انرژی خالص ($$V_T$$) با تفریق کردن مقدار کوچکتر از مقدار بزرگتر محاسبه میشود. وقتی انرژی خالص در بالای مقدار پایه (صفر) قرار بگیرد، نشان دهنده نیروی دافعه است و وقتی در پایین مقدار پایه قرار بگیرد نیز نیروی جاذبه را نشان میدهد.
بیشینه مقادیر دافعه تحت عنوان «مانع انرژی» (Energy Barrier) شناخته میشود. برای اینکه ذرات به یکدیگر نزدیک شوند و دلمه تشکیل دهند، میزان برخورد باید به حدی باشد که از مانع انرژی بگذرد. اگر ذرات از مانع انرژی عبور کنند نیروهای دافعه باعث دلمه شدن آنها میشود.
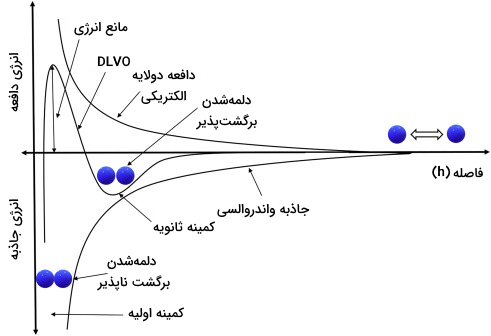
علاوه بر پایداری الکتریکی در سیستمهای تعلیقه، «پایداری فضایی» (Steric Stabilization) نیز بر معلق ماندن ذرات موجود در تعلیقه کمک میکند. موادی مثل سورفکتانتهای غیریونی وقتی توسط ذرات معلق موجود در تعلیقه جذب شوند، باعث پراکنده شدن ذرات در تعلیقه میشوند حتی اگر پتانسیل زتای مشخصی در سیستم وجود نداشته باشد. در این حالت در فرمول نظریه DLVO، پایداری فضایی ($$V_S$$) را نیز در نظر میگیرد.
$$V_T=V_R+V_A+V_S$$
الکتروکینتیک در تعلیقه
وجود پتانسیل سطحی در ذرات معلق در سوسپانسیون ممکن است منجر به ایجاد چهار پدیده الکتروکینتیک شود که شامل موارد زیر میشوند.
- «الکتروفورزیس» (Electrophoresis)
- «الکترواسموزیس» (Electroosmosis)
- «پتانسیل رسوبی» (Sedimentation Potential)
- «پتانسیل جریان» (Streaming Potential)
تمام این ویژگی ها به دلیل حرکت یک سطح دارای بار نسبت به فاز مایع مجاور آن ایجاد میشوند. الکتروفورزیس حرکت ذره باردار در محیط مایع را تحت اعمال اختلاف پتاسیل، اندازهگیری میکند که میتوان با استفاده از آن پتانسیل زتا را محاسبه کرد. پتانسیل زتا در سوسپانسیونها از طریق فرمول زیر محاسبه میشود.
$$\zeta=\frac{\nu}{E}timesfrac{4pieta}{\epsilon}timesleft(9times10^{4}\right)$$
در این فرمول $$\zeta$$ نشاندهنده پتانسیل زتا است (واحد ولت). $$\nu$$ سرعت حرکت ذرات در لوله الکتروفورز را نشان میدهد (واحد cm/s). $$\eta$$ ویسکوزیته محیط (واحد پویز)، $$\epsilon$$ ثابت دیالکتریک محیط و E پتانسیل گرادیان (واحد V/cm) را نشان میدهد.
الکترواسموزیس از جهاتی، مخالف الکتروفورزیس در نظر گرفته میشود. در الکتروفورزیس ذره باردار تحت اختلاف پتانسیل در سیال جابجا میشود اما در الکترواسموزیس ذره ثابت است و محیط پیرامون آن با توجه به بار سطحی جابجا میشود.
پتانسیل رسوب، پتانسیلی است که در اثر تهنشین شدن ذرات به وجود میآيد. پتانسیل جریان با وادار کردن سیال به جریان در پیرامون ذرات جامد ایجاد میشود. همانند الکتروفورزیس سایر پارامترهای الکتروکینتیک نیز برای بررسی پتانسیل زتا و پایداری سوسپانسیون استفاده میشوند.
سوسپانسیونهای پراکنده و دلمه شونده
سوسپانسیون هایی که ذرات داخل آن پراکنده هستند، زمانی که نیروهای دافعه بر نیروهای جاذبه غلبه کنند، پتانسیل زتای بیشتری نسبت به مقدار بحرانی دارند. ذرات معلق در این سیستمها برای مدت طولانی معلق باقی میمانند و فقط مقدار کمی از ذرات آن به مرور زمان در نتیجه نیروی جاذبه زمین تهنشین میشوند. در هنگام رسوب، ذرات کوچک فضاهای خالی بین ذرات بزرگتر پر میکنند. همچنین به مرور زمان به دلیل فشار ناشی از وزن ذرات قرار گرفته روی رسوب، رسوبات متراکمتر میشوند. در نتیجه این اتفاقها رسوبی متراکم و کیکمانند تشکیل میشود که حل کردن دوباره آن در سیال مشکل است. این ویژگیها، خصوصیات «سوسپانسیون پراکنده» (Deflocculation) هستند.
با اضافه کردن مقدار کمی الکترولیت، پتانسیل زتای این سیستمها کاهش مییابد و اگر پتانسیل زتا کمتر از حد بحرانی باشد، نیروهای جاذبه بر نیروهای دافعه غلبه میکنند و در نتیجه آن دلمه تشکیل میشود. علاوه بر اضافه کردن الکترولیتها، عوامل دلمه کننده (مثل سورفکتانت) نیز میتوانند به تولید دلمه کمک کنند.
| ویژگی | تعلیقه پراکنده | تعلیقه دلمهشونده |
| ذرات | از هم جدا هستند. | دلمه تشکیل میدهند. |
| سرعت رسوب | کم | سریع |
| ساختار رسوب | متراکم | سست |
| دوباره پراکنده شدن رسوب | دشوار | آسان |
| مایع روی رسوب | کدر | معمولا شفاف |
همانطور که در نمودار بخش قبل نشان داده شد، دلمه شدن برگشتپذیر در کمینه دوم اتفاق میافتد. وقتی ذرات در این سیستمها با یکدیگر برخورد میکنند، به دلیل غلبه نیروهای جاذبه دلمه تشکیل میدهند. این دلمهها چون سنگینتر از ذرات تکی هستند رسوب میکنند ولی رسوب آنها به شکل متراکم و کیکمانند نیست. در واقع دلمهها ساختارهای تودهای شکلی هستند که اتصال سستی با یکدیگر دارند و با کمی تکان دادن ظرف محتوی تعلیقه، دوباره در آن پراکنده میشوند. به تعلیقههایی که این ویژگی را دارند سوسپانسیونهای «دلمه شونده» (Flocculation) میگویند.
پایداری سوسپانسیون
تهنشین شدن یکی از عوامل مهم در حفظ پایداری تعلیقه است. معمولا تلاش بر این است که میزان سرعت تهنشین شدن ذرات معلق در تعلیقه را کاهش دهند. البته باید این موضوع را در نظر داشت که سرعت بسیار آهسته ته نشین شدن در یک سوسپانسیون «پراکنده» (Deflocculated) ممکن است باعث ته نشین شدن ذرات در کف ظرف به صورت تودهای متراکم شود.
معادله یا قانون «استوک» (Stokes)، نظریه ای است که توسط «جورج استوک» (George Gabriel Stokes) ارائه شد که میتواند کینتیک تهنشین شدن ذرات معلق در سوسپانسیون را توضیح دهد. این معادله به صورت زیر است.
$$v=\frac{d^{2}(rho_{1}-rho_{2})g}{18eta}=\frac{2r^2(rho_{1}-rho_{2})g}{9eta}$$
در این معادله v به معنای سرعت تهنشین شدن است. d و r به ترتیب قطر و شعاع ذره معلق هستند. $$rho_{1}$$ و $$rho_{2}$$ به ترتیب چگالی فاز داخلی و فاز خارجی تعلیقه هستند. g شتاب گرانش است و $$\eta$$ میزان ویسکوزیته فاز خارجی است.

اندازه ذرات همانطور که در معادله میبینید توان دو دارد که نشان دهنده اهمیت بیشتر آن در تهنشین شدن ذرات است. ذرات با اندازه کوچکتر دیرتر تهنشین میشوند. افزایش ویسکوزیته محیط میتواند میزان تهنشینی را کاهش دهد. مشتقات سلولز (مانند متیل سلولز و هیدروکسیپروپیل متیلسلولز) از جمله موادی هستند که برای افزایش ویسکوزیته به محیط اضافه میشوند. اضافه کردن آدامسهای طبیعی مثل کتیرا و اقاقیا هم میتوانند ویسکوزیته را افزایش دهند.
طبق معادله، تفاوت در چگالی بین فاز داخلی و خارجی نیز می تواند بر رسوب ذرات معلق تاثیر بگذارد. اگر اختلافی بین چگالی این دو فاز وجود نداشته باشد (اختلاف صفر)، رسوب اتفاق نمیافتد. اگر اختلاف باشد ولی امکان تغییر چگالی فاز داخلی (ذرات معلق) وجود نداشته باشد، آنگاه باید میزان چگالی فاز خارجی را افزایش داد. البته معمولا افزایش چگالی فاز داخلی بیش از 1.3 انجام نمیشود.
محدودیتهای قانون استوک در تعلیقه های دارویی
قانون استوک معادلهای است که تاثیر عوامل مختلف در رسوب ذرات معلق موجود در تعلیقه را نشان میدهد. اما این قانون بر روی فرضیاتی بنا شده است که همیشه رعایت آنها در تولید سوسپانسیونهای دارویی امکان پذیر نیست.
قانون استوک برای سوسپانسیونهای دارویی رقیق شده تشکیل شده از حداکثر 2٪ ذرات صادق هستند. در سوسپانسیونهای رقیق ، ذرات جامد بدون اینکه برهمکنشی با یکدیگر داشته باشند رسوب میکنند که به آن «رسوب آزاد» (Free Settling) گفته میشود. ولی در تعلیقههای غلیظ برهمکنشی که بین ذرات ایجاد میشود، ممکن است مانع رسوب کردن ذرات شود.
شکل و اندازه ذرات نیز در معادله استوک اهمیت دارند. در این معادله ذرات کروی و متقارن در نظر گرفته شدهاند که ممکن است با شرایط واقعی متفاوت باشد. به همین خاطر معادله زیر برای ذرات با اندازههای متفاوت معرفی شد.
$$\acute{\nu} = nuepsilon^{n}$$
در این معادله $$\acute{\nu}$$ نرخ رسوب اصلاح شده و $$\epsilon$$ تخلخل اولیه سیستم است که نشاندهنده کسر حجمی اولیه از سوسپانسیون یکنواخت است. عددی که به جای مینشیند می تواند از صفر تا بینهایت باشد. توان n نیز که در هر سیستم ثابت است میزان ممانعت سیستم را نشان میدهد.
معادله استوک همچنین اگر تفاوت چگالی منفی باشد (ذرات از سیال سبکتر باشند) نیز صحیح نخواهد بود. در این شرایط، مانند سیستمهای امولسیونی، شناوری اتفاق میافتد.
اگر محتوای ذرات جامد زیاد باشد هم معادله استوک درست کار نخواهد کرد. در این معادله فقط ویسکوزیته سیال در نظر گرفته شده است در صورتی که اگر محتوای ذرات جامد زیاد باشد روی ویسکوزیته تعلیقه تاثیر میگذارد.
ثابت دیالکتریک نیز پارامتر پر اهمیتی در سوسپانسیونها است در صورتی که در معادله استوک اصلا بررسی نمیشود. پتانسیل الکتریکی بین دو بار با ثابت دی الکتریک محیط نسبت معکوس دارد. بنابراین پتانسیل زتا به ثابت دیالکتریک محیط وابسته است. این عامل وقتی اهمیت پیدا میکند که از حاملهای غیرآبی مثل روغن کنجد، روغن ذرت یا پیشران کلروفلوروکربن (در تعلیقههای ایروسل) استفاده شود. در این حامل ها با ثابت دیالکتریک پایین معمولا دولایه الکتریکی بسیار ضخیمی (نسبت به محیط آبی) تشکیل میشود که در نتیجه ان پتانسیل زتا و سرعت رسوب ذرات متفاوت خواهد بود.
علاوه بر فاکتورهای ذکر شده، حرکت براونی (Brownian movement) نیز بر صحت نتیجه معادله استوک تاثیر میگذارد. اگر ذرات معلق در سیال بسیار کوچک باشند برخورد ان ها با یکدیگر با عث حرکت تصادفی در سیال میشود که به حرکت براونی معروف است. جابجایی ناشی از حرکت براونی را میتوان به صورت زیر محاسبه کرد.
$$D_i=\frac{RT}{3Npieta r}\times t $$
در این معادله R ملاریته محتوای گاز، N عدد آواگادرو، T دمای مطلق، t زمان، $$\eta$$ ویسکوزیته سیال و r شعاع ذرات است. حرکت براونی به میزان قابل توجهی با رسوب کردن ذرات معلق مقابله میکند. بنابراین میزان واقعی رسوب ذرات ممکن است تا حد زیادی با میزان محاسبه شده با استفاده از معادله استوک متفاوت باشد. وقتی اندازه ذرات معلق کاهش پیدا میکند، حرکت براونی بیشتر میشود و احتمال رسوب کمتر میشود.
رسوب در سوسپانسیونها پراکنده و دلمه شده
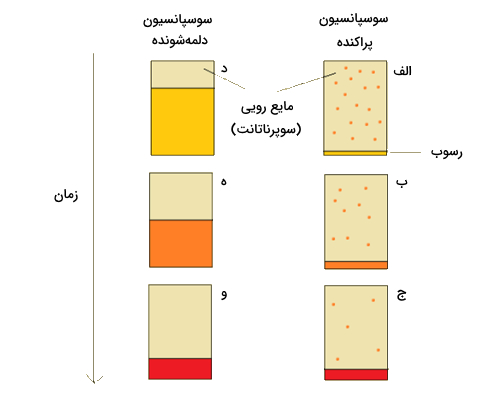
سوسپانسیونهای دلمه شده، به یریع رسوب میکنند و رسوبهای انها حالت شل دارد. در حالی که در تعلیقههای پراکنده کندتر رسوب میکنند اما رسوب متراکمی را تشکیل میدهند. این فرایند در تصویر زیر نشان داده شده است.
معمولا در سوسپانسیونهای پراکنده چند دقیقه پس از تولید شدن تغییری ایجاد نمیشود (الف). و بعد از چند ساعت همچنان ظاهر سوسپانسیون کدر است اما رسوبی کوچک و متراکم خود را نشان میدهد (ب). بعد از گذشت زمان طولانی، رسوب متراکمی در ته ظرف تشکیل میشود که سیال روی ان کاملا شفاف است (ج).
در تعلیقههای دلمه شده چند دقیقه پس از تولید، مرزی از سیال شفاف روی مواد معلق در حال رسوب تشکیل میشود (د). بعد از چند ساعت به میزان منطقه شفاف اضافه میشود (ه). در نگهداری طولانی نیز به میزان تشکیل منطقه شفاف افزوده میشود ولی در کل میزان اندازه رسوب از سوسپانسیونهای پراکنده کمتر است (و).
تعلیقههای پراکنده دیرتر از دلمه شده رسوب میکنند و دوز یکنواختی از دارو را فراهم میکنند ولی در درازمدت وقتی رسوب متراکم تشکیل میدهند، پخش کردن دوباره رسوب در سیال مشکل خواهد بود. در طرف دیگر، رسوبات در تعلیقههای دلمه شده راحتتر در سیال پخش میشوند ولی به دلیل سرعت بالای تهنشین شدن آن ممکن است دوز یکنواختی از دارو حاصل نشود. با توجه به مزایا و معایب این دو نوع سوسپانسیون حالت واسطهای از این دو وجود دارد که امکان تولید محصول مطلوب را فراهم میکند که دلمه شدن کنترلشده نامیده میشود.
دلمه شدن کنترلشده
برای تولید تعلیقه دارویی مطلوب باید به سوسپانسیونی با ویژگی دلمهشدن کنترل شده برسیم. در این سیستمها دلمهشدن به خوبی کنترل میشود و ویسکوزیته نیز آنقدر بالا نیست که امکان پخش کردن دوباره رسوب وجود نداشته باشد. برای داشتن این ویژگیها اندازه ذرات کنترل میشود و از عوامل دلمهکننده نیز استفاده میشود.
اهمیت اندازه ذرات و نقش آن در رسوب ذرات پیشتر توضیح داده شد. در این بخش به توضیح عوامل دلمهکننده میپردازیم که مهمترین آنها الکترولیت، سورفکتانت و پلیمرها هستند.
اولین مرحله در تهیه این نوع سوسپانسیون مرطوب کردن ذراتی است که اندازه آنها را کاهش دادهایم. بسته به بار عوامل مرطوب کننده و ذرات، سوسپانسیون دلمه شده یا پراکنده ایجاد میشود. اگر سوسپانسیون از نوع پراکنده بود به آن عوامل دلمهکننده اضافه می کنیم تا محصول مورد نظر حاصل شود.
الکترولیت
الکترولیتها با کاهش پتانسیل زتا، ذرات را به هم نزدیک میکنند و تودههای غیرمتراکمی ایجاد میکنند. قدرت دلمه شدن با افزایش ظرفیت یونهای موجود در سوسپانسیون افزایش مییابد. برای مثال یون کلسیم قدرت بیشتری نسبت به یون سدیم و پتاسیم دارد. با این حال یونهای سه ظرفیتی معمولا به دلیل اثر سمیت استفاده نمیشوند.
وقتی الکترولیت به سوسپانسیون پراکنده دارای بار مثبت اضافه میشود، پتانسیل زتا آرام آرام کاهش پیدا میکند تا جایی که به صفر برسد. اگر باز هم الکترولیت به سوسپانسیون اضافه شود، پتانسیل زتا از محدوده صفر گذر میکند و منفی میشود. وقتی پتانسیل زتا کاهش مییابد، حجم رسوب تا نقطهای خاص افزایش تا به حداکثر مقدار خود برسد بعد از آن در محدوده معینی از پتانسیل زتا نسبتا ثابت میماند یعنی محدودهای که پتانسیل زتا بین مثبت کم (نزدیک به صفر) تا منفی کم (نزدیک به صفر) باشد. وقتی پتانسیل زتا خیلی منفی شود، دوباره حجم رسوب کاهش پیدا میکند.
سورفکتانت
هم سورفکتانتهای یونی و هم غیریونی میتوانند به عنوان عامل دلمه کننده استفاده شوند. سورفکتانتهای یونی با خنثی کردن بار روی ذرات باعث دلمه شدن آنها میشود. سورفکتانتهای غیریونی به دلیل ساختار بلندی که دارند بر روی بیش از یک ذره جذب میشوند و در نتیجه آن، یک ساختار دلمه شده شل را تشکیل میدهند.
پلیمرها
پلیمرهای خطی و شاخهدار می توانند شبکههایی ژل مانند تشکیل دهند که ذرات معلق تعلیقه در بین آنها قرار بگیرد و تشکیل دلمه شل دهد. علاوه بر این، پلیمرهای آبدوست نیز میتوانند به عنوان کلوئیدهای محافظ عمل کنند. در این حالت، دلمهها به دلیل ممانعت فضایی به یکدیگر نمیچسبند و رسوب سست تشکیل میشود.
اندازه ذرات معلق
کنترل نادرست اندازه ذرات میتواند نتایج نامطلوبی در سوسپانسیونهای دارویی ایجاد کند. سوسپانسیونهای حاوی ذرات با قطر بیشتر از 5 میکرومتر، به دلیل احتمال ایجاد تحریک، برای تزریقات و استعمال در چشم مناسب نیستند. ذرات با قطر بیشتر از 25میکرومتر نیز ممکن است سوزنهای زیرپوستی را مسدود کنند. همانطور که قبلا نیز توضیح داده شد، در سوسپانسیونهای پراکنده ذرات بسیار ریز به صورت تودهای سخت و متراکم رسوب می کنند.
علاوه بر تاثیر اندازه ذرات بر رسوب، در تعلیقههای غلیظ، برهمکنشهای بسیاری بین ذرات معلق در سیال به وجود میآيد که باعث افزایش ویسکوزیته تعلیقه میشود. ذرات کوچکتر به دلیل نسبت سطح به حجم بیشتر در مقایسه با ذرات بزرگ اثر بیشتری روی افزایش ویسکوزیته دارند.
اندازه ذرات همچنین می تواند به طور قابل توجهی بر فراهمی زیستی دارو تاثیر بگذارد. معمولا از تعلیقهها برای ساخت داروهایی با انحلالپذیری پایین استفاده میشود. در چنین مواردی، استفاده از ذرات کوچکتر ممکن است سرعت و میزان جذب دارو را به دلیل داشتن سطح بیشتر افزایش دهند.
تشکیل کریستال در تعلیقه
ذرات موجود در تعلیقهها معمولا یکاندازه و یکشکل نیستند. انرژی آزاد سطحی در ذرات کوچک بیشتر است و به همین دلیل آنها انحلالپذیری بیشتری نسبت به ذرات بزرگ دارند. اگر دما افزایش پیدا کند بخش بیشتری از ذرات کوچک در سیال حل میشود و اندازه ذرات باقیمانده کوچکتر نیز میشود. وقتی دما دوباره کاهش پیدا کند، مواد حل شده در سیال تمایل دارند روی سطح ذرات موجود در سیال کریستالیزه شوند. به همین دلیل ذرات کوچک با ادامه یافتن این فرایند به تدریج کوچکتر میشوند و ذرات بزرگ سوسپانسیون اندازهای بزرگتر پیدا میکنند.
این پدیده در سوسپانسیونهایی با ذرات معلق با انحلالپذیری اندک در سیال، بیشتر دیده میشود. این مشکل را می توان با استفاده از ذراتی با اندازه یکنواخت کم کرد. عوامل فعال کننده سطحی یا پلیمرهای کلوئیدی نیز میتوانند با جذب شدن روی سطح ذرات از رشد کریستال جلوگیری کنند.
تاثیر دما در پایداری تعلیقه
دما میتواند بر ویسکوزیته فاز خارجی تاثیر بگذارد. به طور کلی با افزایش دما ویسکوزیته کاهش مییابد. رابطه بین دما و ویسکوزیته را با فرمول زیر محاسبه میکنند.
$$\eta=Ae^{E}v^{RT}$$
در این فرمول $$\eta$$ نشاندهنده ویسکوزیته مایع است. A ثابتی است که به جرم مولکولی و حجم مولار مایع بستگی دارد و $$^{E}v$$ نیز انرژی فعالسازی برای به جریان انداختن مولکولها است.
دما همچنین میتواند با تغییر دادن کشش سطحی بین ذرات و محیط باعث تغییر ویسکوزیته شود. دما با افزایش حرکت براونی نیز روی ویسکوزیته سیستم تاثیر میگذارد. با افزایش حجم سیال فضای بیشتری در اختیار ذرات جامد میگذارد و ویسکوزیته سیستم را کاهش میدهد.
جمعبندی
تعلیقه یا سوسپانسیون مخلوطهای ناهمگنی هستند که ذرات معلق در آن نمیتوانند در سیال حل شوند و در آن معلق میمانند. این مخلوطها با کلوییدها در اندازه ذرات معلق تفاوت دارند. ذرات معلق در تعلیقهها بزرگتر است به هم خاطر به طور خودبخودی میتوانند رسوب کنند. اما رسوب ذرات در کلویید توسط سانتریفیوژ انجام میشود. سوسپانسیونها در داروسازی نیز استفاده میشوند. به دلیل اهمیت پایداری تعلیقهها در صنعت داروسازی، تاثیر عوامل متعددی در پایداری سوسپانسیون بررسی میشوند.










