محلول ها — به زبان ساده

محلول ها شامل مخلوطهایی همگن با دو جزء حلال و حل شونده هستند. به جزء بیشتر، «حلال» (Solvent) و جزء کمتر «حلشونده» (Solute) میگویند. اگر در یک محلول، هر دو جزء به نسبت ۵۰ درصد حضور داشته باشند، نام حلال یا حل شونده را میتوان به هرکدام نسبت داد یا اینکه مادهای که بیشتر عمومیت دارد و مورد استفاده قرار میگیرد را به عنوان حلال نامگذاری میکنیم. زمانی که دو مایع در یکدیگر حل شوند، به هرکدام بسته به میزان حضور در محلول، نامهای حلال و حل شونده اطلاق میشود.
بیشتر واکنشهای شیمیایی در محلول ها روی میدهند. همچنین محلول ها در زندگی روزمره ما نقش اساسی دارند. هوایی که تنفس میکنیم، آبی که مینوشیم و تمام سیالات موجود در بدن ما همگی به صورت محلول هستند.
در معرفی محلول ها عموما چهار بخش را در نظر میگیرند:
- نوع محلول: گاز، مایع و جامد.
- استوکیومتری محلول ها: تعریف غلظت محلول ها با واحدهای مختلف و استوکیومتری واکنشهای شامل محلول.
- الکترولیت بودن محلول: محلول های اسیدی، بازی و نمکهایی که به یونهای آبپوشی شده مثبت و منفی قابل تفکیک هستند.
- واکنشهای جانشینی: واکنشهای الکترولیتها که سبب تشکیل مولکولها، گازها و جامدات خنثی میشوند.

انواع محلول ها
زمانی که یک حلشونده در حلال حل شود، مولکولها و یونهای حلشونده به طور کامل با حلال مخلوط میشوند. بعد از انحلال، هیچ مرزی بین حلشونده و حلال قابل مشاهده نیست. به این دسته از محلول ها، همگن یا هموژن میگویند. همانطور که مواد دارای سه حالت جامد، مایع و گاز هستند، محلول های آنها نیز در این سه حالت وجود دارند.
مخلوطهای گازی معمولا به صورت همگن هستند و به محلول های «گاز در گاز» (Gas-Gas) موسوماند. اتمسفر یک محلول گازی شامل نیتروژن، اکسیژن، آرگون، دیاکسید کربن، آب، متان و اجزای دیگر است. البته مقادیر آب و دی اکسید کربن بسته به دما و مکان تغییر میکنند.
زمانی که مولکولهای گاز، جامد یا مایع، در مایعات مخلوط و پخش شوند، حالت همگن ایجاد شده را «محلول مایع» (Liquid Solution) میگویند. در حالت کلی، کلمات محلول مایع و محلول، به جای یکدیگر مورد استفاده قرار میگیرند. شیمیدانها، در بیشتر موارد، جذب محلول های مایع و گاز میشوند در حالیکه مهندسین مواد به خواص محلول های جامد علاقهمند هستند. بیشتر آلیاژها، مواد سرامیکی و پلیمری در طبقهبندی محلول های جامد قرار میگیرند. در حالات مختلفی، مس و روی با حل شدن در یکدیگر و پس از سخت شدن، تشکیل یک محلول جامد را به نام «برنج» (Brass) میدهند. نقره، طلا و مس، آلیاژهایی با خصوصیات و رنگهای متفاوت هستند. در علم مواد، آلیاژها و محلول های جامد بسیار مورد توجه قرار میگیرند.

انحلال پذیری
بیشترین میزانی که یک ماده در حجم مشخصی از حلال میتواند حل شود را «حل شوندگی» (Solubility) یا انحلالپذیری میگویند. به طور معمول، حل شوندگی در آب با واحد $$g / 100 mL$$ بیان میشود. زمانی که یک مایع به طور کامل در دیگری حل شود، هر دو مایع «امتزاج پذیر» (Miscible) هستند. مایعاتی که به هیچ شکل در یکدیگر حل نمیشوند را «امتزاج ناپذیر» (Immiscible) مینامند.
تمامی محلول ها به هنگام مخلوط شدن، آنتروپی مثبت دارند. برهمکنش بین مولکولهای مختلف از لحاظ انرژی ممکن است سبب ادامه فرآیند یا توقف آن باشد. اگر برهمکنشها مفید نباشند، انرژی آزاد با افزایش غلظت حلشونده، کاهش پیدا میکند. در لحظهای خاص، انرژی از دست رفته بر افزایش آنتروپی غلبه میکند و پس از آن هیچ یک از اعضای حل شونده، قابلیت حل شدن در محلول را ندارند. این نوع از محلول، «اشباع» (Saturated) نام دارد.
با این وجود، نقطهای که یک محلول اشباع میشود، با تغییر عوامل محیطی همچون دما، فشار و آلودگیها به سادگی قابل تغییر است. در برخی موارد، میتوان یک محلول «فوق اشباع» (Super Saturated) بدست آورد. برای این کار باید قابلیت حل شوندگی را در محلول افزایش داد. به طور مثال این کار با افزایش دما قابل انجام است و پس از افزایش حل شوندگی، میتوان با کاهش دما به یک محلول فوق اشباع دست یافت. به طور کلی، هرقدر دمای یک حلال بیشتر باشد، مقدار بیشتری از حل شونده جامد میتواند در آن حل شود. اما حل شوندگی بیشتر گازها و برخی ترکیبات، با افزایش دما کاهش مییابد. این رفتار نتیجه آنتالپی گرماده محلول است. برخی سورفکتانتها (Surfactants) این رفتار را از خود نشان میدهند. حل شوندگی مایع در مایع در مقایسه با جامدات یا گازها حساسیت کمتری نسبت به دما دارد.

تعریف سادهتر
محلولی که حل شوندگی در آن به بیشترین حد خود رسیده باشد، محلول اشباع (سیر شده) نام دارد. در این شرایط، به طور معمول فاز دیگری از حل شونده مانند گاز، مایع یا جامد در تماس با محلول وجود دارد. با وجود اینکه هیچ تغییری در مقادیر ماده حل شونده دیده نمیشود، اما این سیستم به هیچ روی ثابت نیست. در حقیقت، مواد حل شونده در این محلول به طور همزمان و با یک سرعت مشخص در حال حل شدن و رسوب هستند. به بیان بهتر این نوع از محلول ها در حال تعادل قرار دارند. زمانی که فاز دیگری نداشته باشیم، محلول ممکن است «اشباع» (Saturated) یا فوق اشباع باشد.
شبیه، شبیه را در خود حل میکند
مواد قطبی یکدیگر را در خود حل میکنند. به طور مشابه، مواد ناقطبی نیز یکدیگر را در خود حل میکنند. عامل دیگری که باید در نظر گرفته شود پیوند هیدروژنی است. به طور مثال، آب و اتانول به دلیل وجود پیوند هیدروژنی در میان مولکولهای خود، به خوبی و با هر نسبتی در یکدیگر حل میشوند و امتزاج پذیر هستند.
محلول های الکترولیت یا مواد یونی به دلیل هیدراته شدن (هیدراسیون) در آب حل میشوند. هر زمان که حل شدن نمک در آب مطرح شود باید به مفهوم تفکیک یونی نیز پرداخته شود. به دلیل قطبیت شدید مولکولهای آب، یونهای مثبت و منفی به اطراف برده و آبپوشی میشوند. معمولا این طور فرض میشود که هر یون، با تعداد ۶ مولکول آب در اطراف خود احاطه شده است، اما در حقیقت این مولکولها در فضای آب، جای خود را با یکدیگر عوض میکنند. لازم به ذکر است که تمامی مایعات رفتاری از نوع حلال دارند. گازهای نجیبِ مایع، فلزات و نمکهای ذوب شده همگی از این جمله هستند.
خواص محلول ها
خواص فیزیکی ترکیبات مانند نقطه جوش و نقطه ذوب، با اضافه کردن ترکیبات دیگر به آنها تغییر میکنند. به این نوع از خواص، «خواص کولیگاتیو» (Colligative Properties) میگویند. روشهای متعددی برای تعیین میزان حل شونده در یک حلال یا به عبارت بهتر غلظت وجود دارد که از آنجمله میتوان به مولاریته، کسر حجمی و کسر مولی اشاره کرد. خواص محلول های ایدهآل از طریق ترکیب خطی خواص هر جزء محاسبه میشوند.
خواص کولیگاتیو
همانطور که اشاره شد، خواص کولیگاتیو به آندسته از خواص مایعاتی اطلاق میشود که در حضور حل شونده ممکن است تغییر کنند. کولیگاتیو یعنی وابسته به کل مجموعه چرا که میزان تغییرات این خواص به تعداد اجزای یک محلول وابسته است و ارتباطی به خاصیت شیمیایی آن ندارد. فشار بخار، نقطه ذوب، نقطه جوش و فشار اسمزی در این دسته از خواص جای میگیرند. در حقیقت تمامی این خواص به فشار بخار ارتباط پیدا میکنند.
اثر فشار بخار
فشار بخار یک حلال، به هنگام اضافه شدن یک حلشونده غیر فرار، کاهش پیدا میکند. برای یک محلول ایدهآل - محلولی که خواص ترمودینامیکی آن مشابه خواص مخلوطهایی گازی است - فشار بخار تعادلی از قانون رائول محاسبه میشود:
$$p=p_{\mathrm{A}}^{\star} x_{\mathrm{A}}+p_{\mathrm{B}}^{\star} x_{\mathrm{B}}+\cdots$$
در رابطه بالا، $$p ^ * _ i$$ فشار بخار جزء خالص $$i$$، و $$x ^ * _ i$$ کسر مولی آن جزء در محلول است. برای یک محلول با حلال $$A$$ و حل شونده $$B$$ خواهیم داشت:
$$P ^ * _ B = 0$$
$$p = P ^ * _ A x _ A$$
تغییرات فشار بخار یا به عبارت بهتر فشار بخار کاهش یافته عبارتست از:
$$\Delta p=p_{\mathrm{A}}^{\star}-p=p_{\mathrm{A}}^{\star}\left(1-x_{\mathrm{A}}\right)=p_{\mathrm{A}}^{\star} x_{\mathrm{B}}$$
از رابطه بالا میتوان دریافت که این تغییر فشار بخار، به کسر مولی حل شونده وابسته است.
اثر نقطه ذوب و انجماد
اضافه کردن حل شونده به حلال سبب پایداری آن در فاز مایع خواهد بود و پتانسیل شیمیایی حلال را کاهش میدهد. این کار سبب کاهش تمایل مولکولها به حرکت به فاز مایع یا گاز میشود. در نتیجه نقطه ذوب در این محلول ها افزایش پیدا میکند. به طور مشابه، نقطه انجماد در این محلول ها کاهش مییابد. لازم به ذکر است که افزایش نقطه ذوب و کاهش نقطه انجماد به کاهش فشار بخار وابسته است.

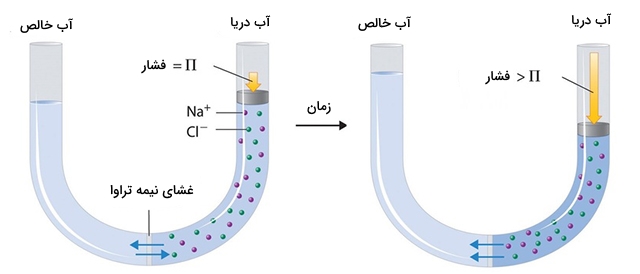
فشار اسمزی
«فشار اسمزی» (Osmotic Pressure) یک محلول، اختلاف فشار در حالت تعادل بین یک محلول و یک مایع خالص است که در میان آنها لایهای نیمه تراوا قرار داشته باشد. این غشای نیمه تراوا اجازه عبور مولکولهای حلال را از میان خود میدهد اما اجزای حلشونده از آن نمیتوانند عبور کنند. اگر هر دو فاز در یک فشار اولیه قرار داشته باشند، حلال از طریق غشای نیمه تراوا، یک جابجایی خالص به سمت محلول خواهد داشت که به این پدیده، «اسمز» (Osmosis) میگویند. زمانی که اختلاف فشار با فشار اسمزی برابر شود، این فرآیند متوقف میشود و سیستم به تعادل میرسد.
دو قانون حاکم بر فشار اسمزی محلول های رقیق توسط یک گیاهشناس آلمانی و یک شیمیدان هلندی کشف شدند:
- فشار اسمزی یک محلول رقیق در یک دمای ثابت به طور مستقیم به غلظت آن وابسته است.
- فشار اسمزی یک محلول به طور مستقیم به دمای مطلق آن وابسته است.
این قوانین تشابهات بسیاری با قوانین بویل و چارلز برای گازها دارند. همانطور که در قانون گازهای ایدهآل داریم:
$$pV = nRT$$
به طور مشابه نیز برای محلول های ایدهآل خواهیم داشت:
$$\Pi V = n R T i$$
در رابطه بالا:
- $$\Pi$$: فشار اسمزی
- $$V$$: حجم
- $$n$$: تعداد مول حل شونده
- $$R$$: ثابت جهانی گازها و برابر با $$8.314 J K ^ {-1} mol ^ {-1}$$
- $$T$$: دمای مطلق
- $$i$$ ضریب وانت هوف
در نتیجه، فشار اسمزی به غلظت مولار $$(C = n / V)$$ وابسته است چرا که خواهیم داشت:
$$\Pi=\frac{n R T i}{V}=c R T i$$
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش مقدماتی غشا (Membrane) و فرایندهای جداسازی غشایی
- آموزش محلول سازی در آزمایشگاه
- کلوئید — به زبان ساده
- هیدروکربن ها — به زبان ساده
^^











خاصیت یک ماده در محلول تغییر میکند ؟
با سلام؛
بر اساس نوع محلول ممکن است متفاوت باشد. به طور مثال، بلورهای یک نمک به تنهایی توانایی هدایت جریان الکتریسیته را ندارند اما با انحلال در آب، این امکان بوجود میآید.
با تشکر از همراهی شما با مجله فرادرس
تشکر بابت معلومات خیلی خوبی که به درستی درک میشد…✨?