بنزن چیست؟ – به زبان ساده + فرمول و کاربرد

بنزن با فرمول شیمیایی $$C_{۶}H_{۶}$$، به عنوان عضو اصلی هیدروکربنهای معطر، در شمار بحثبرانگیزترین ترکیبات در شیمی آلی، متداولترین محصولات مصرفی در صنعت پتروشیمیِ جهان و اساسیترین پیشماده (Precursor) یا واسطهها در تولید طیف وسیعی از محصولات آلی با ساختارهای پیچیدهتر برای استفاده در صنایع مختلف مانند داروسازی، کشاورزی، صنایع پوششی و... است که به طور طبیعی از نفت خام و در مقیاس صنعتی از طریق مکانیزمهای تعریف شده قابل حصول است. در کنار کاربردهای گسترده بنزن، طبق اعلام چندین مرکز از جمله وزارت بهداشت و خدمات انسانی ایالات متحده، مادهای سرطانزا بوده و نیز دارای آثار منفی بر جنین است. این موضوع به دغدغهای در سطح جهانی تبدیل شده و لزوم توجه بیشتر به استفاده مناسب و متناسب آن را نشان میدهد که این امر نیز به نوبه خود بازار مصرف آن را تحت تاثیر قرار میدهد. در مقاله حاضر از مجله فرادرس یاد میگیریم که بنزن چیست و ساختار، کاربرد و واکنشهای آن را نیز بررسی میکنیم.
بنزن چیست؟
بنزن، سادهترین «هیدروکربن آروماتیک یا «آرن» (Arene) است که به طور طبیعی در نفت خام وجود دارد. آرنها یا هیدروکربنهای معطر (آروماتیک)، هیدروکربنهایی هستند که شامل دستکم یک واحد ساختاری از «حلقه بنزن» باشند.
ساختار بنزن چیست ؟
ساختار بنزن از زمان کشف آن مبهم و به عنوان معمایی برای دانشمندان مطرح بوده است. در این راستا نظریههای متعددی برای تبیین و توجیه آن استفاده شده است که در ادامه برای اینکه یاد بگیریم ساختار بنزن چیست به برخی از مهمترین این نظریهها میپردازیم.
در اوایل کشف بنزن، نسبت هیدروژن به کربن پایین در ترکیب آن (۱:۱) شیمیدانان را به این باور رساند که این ماده در ساختار خود دارای پیوندهای دوگانه یا سهگانه باشد. این نوع پیوندها به سرعت با برم ($$Br_{2}$$) وارد واکنش میشوند، اما وقتی شرایط واکنش بنزن با برم فراهم شد، در کمال تعجب هیچ واکنشی با آن نداد. علاوه بر این، وقتی بنزن از طریق افزودن کاتالیزور مجبور به واکنش با برم شد، به جای واکنشهای افزایشی معمولِ آلکنها، تحت واکنشهای جانشینی قرار گرفت که نشاندهنده مقاومت غیرمعمول هسته بنزن در برابر اصلاحات شیمیایی بود.
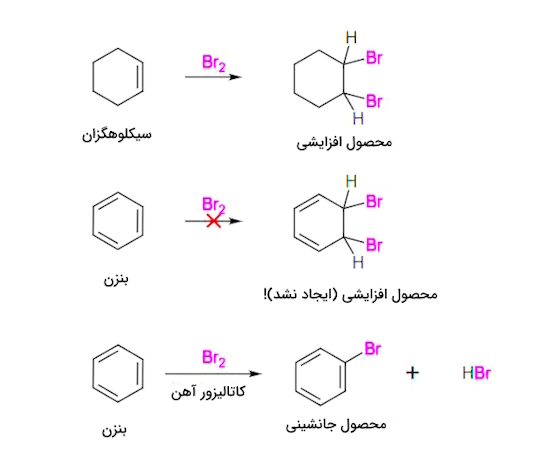
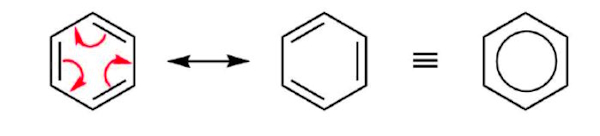
درجه بالای اشباع نشدگی (نسبت H:C) پایینِ بنزن، در کنار پایداری شیمیایی بالای خود و ترکیبات مرتبطِ آن، سالها به عنوان یک تناقض مطرح بود تا در نهایت ساختار بنزن در قالب حلقه ششضلعی و مسطح کربن با پیوندهای متناوب ساده و دوگانه پذیرفته شد و پایداری شیمیایی خاص این سیستم هم به رزونانس آن نسبت داده شد.
در واقع هیچ ساختاری به تنهایی نمایش دقیقی از بنزن را ارائه نمیدهد، چون لازم است ترکیبی از دو شکل رزونانسی معادل ساختاری و انرژی، برای نمایش پیوستگی چرخهای پیوندهای دوگانه باشد. امروزه از فرم رزونانسی بنزن که در بالا نیز اشاره شد، با اشراف به این موضوع که نشاندهنده ساختار دقیق بنزن نیست، برای توصیف ساده آن استفاده میشود.
ساختارهای دیگری نیز برای نمایش بنزن به کار میرود که مروری بر آنها خواهیم داشت.
نمادهای مرسومِ ساختار بنزن چیست؟
نگاهی میکنیم به سه نماد کاربردی برای نمایش ساختار بنزن.
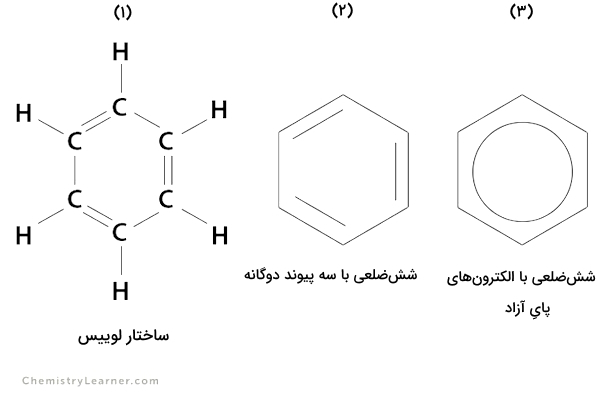
توضیحات سه ساختار نشان داده شده در تصویر بالا که همانطور که میدانیم نه تعریف دقیق ساختار بنزن، بلکه تعاریف قراردادی آن هستند.
تصویر شماره ۱: بنزن دارای شش اتم کربن است که به شکل حلقوی قرار گرفتهاند. پیوندهای ساده و دوگانه به طور متناوب اتمهای کربن را از هم جدا میکند. آرایش اتمی آن «ساختار مزدوج» (Conjugated Structure) است و هر اتم کربن به تنهایی به یک اتم هیدروژن متصل است. این ساختار به نام ساختار نقطهای یا لوییسِ بنزن نیز شناخته میشود.
تصویر شماره ۲: در این نمایش، هر گوشه ششضلعی نشاندهنده یک اتم کربن است. سه پیوند دوگانه نیز در تصویر مشخص میشود و اتمهای هیدروژن نشان داده نمیشود.
تصویر شماره ۳: این ساختار که در قسمت بالا در مورد آن صحبت شد، با یک ششضلعی و دایرهای در داخل آن، «الکترونهای پای آزاد»، رسم میشود. اغلب از این تصویر برای اشاره به ساختار بنزن استفاده میشود.
زاویه پیوندها در ساختار بنزن چیست ؟
هر اتم کربن در بنزن به دو اتم کربن دیگر و تنها یک اتم هیدروژن متصل است، مانند تصویر زیر، و هر کربن موجود در این حلقه، $$sp^{2}$$ هیبرید است که موجب میشود تمامی پیوندهای $$C-C-C$$ و $$H-C-C$$ در بنزن ۱۲۰ درجه بوده و شکل هندسی آن به فرم «سهضلعی مسطح» (Trigonal Planar) درآید.
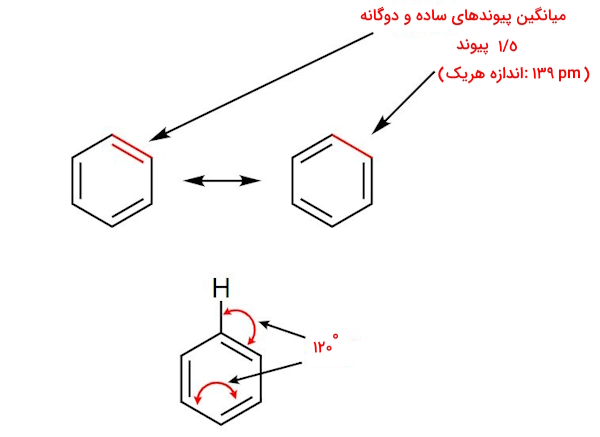
نوع و طول پیوندها در ساختار بنزن
از جمله نظریهها برای توجیه ساختار بنزن، با در نظر گرفتن آن به صورت ساختاری شامل سه پیوند دوگانه، مانند تصویر بالا، است. ولی در واقعیت بنزن حاوی پیوند دوگانه مستقل نبوده و تمامی پیوندهای کربن-کربن در آن، مابین پیوند ساده و دوگانه هستند. یعنی به طور میانگین ۱٫۵ پیوند! اما سوال این است که چگونه چنین چیزی ممکن است؟ و پاسخ این است که جابهجایی پیوسته پیوندهای ساده و دوگانه با یکدیگر باعث میشود سهم هر یک نه به طور مستقل پیوند ساده و نه پیوند دوگانه، بلکه «یک و نیم پیوند» باشد.
حلقه بنزن، یک ششضلعی منتظم دارای پیوندهای کربن-کربن با طول یکسان $$pm$$ ۱۳۹ است که مابین اندازه پیوند دوگانه کربن=کربن، $$pm$$ ۱۳۴، و پیوند ساده کربن-کربن، $$pm$$ ۱۵۴، قرار میگیرد و با فرض بالا که حلقه بنزن را به صورت یک هیبرید رزونانسی متشکل از پیوندهای ۱٫۵ کربن-کربن لحاظ کنیم، مطابقت پیدا میکند.
حال سوال بعدی این است که چرا در بنزن پیوند ساده یا دوگانه خالص نداریم؟ در ادامه، در قسمت «سیستم پای» به این موضوع میپردازیم.
سیستم پای غیرمتمرکز در بنزن چیست ؟
تا اینجا ضمن بررسی طول و زاویه پیوند در مولکول بنزن، متوجه شدیم که هر اتم کربن در ساختار آن، با دو اتم کربن دیگر و یک اتم هیدروژن پیوند تشکیل میدهد. با این حال میدانیم اتم کربن دارای چهار الکترون ظرفیت است که سه تای آنها تشکیل پیوند دادهاند. در نتیجه یک الکترون به حالت آزاد باقی میماند. الکترونهای پیوند داده در «اوربیتال سیگما» و الکترون چهارم در «اوربیتال پی» قرار میگیرد. اوربیتالهای سیگما بین اتمها کشیده شده و اوربیتالهای پی مانند تصویر سمت چپِ زیر، در بالا و پایین اتم امتداد مییابند. در بنزن، همه اوربیتالهای پی اتمهای کربن، با یکدیگر همپوشانی داشته و تشکیل ناحیه پیوسته در بالا و پایین مولکول را میدهند.
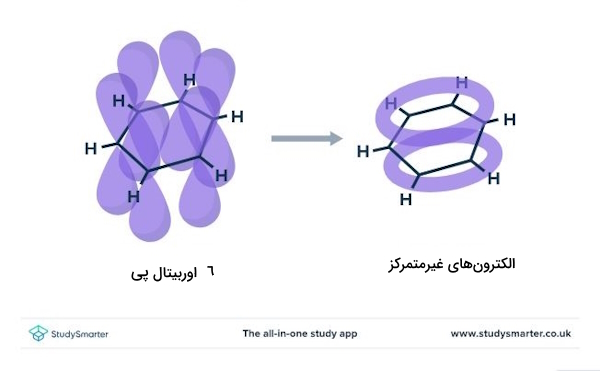
در منطقه همپوشانی، الکترونها قادرند آزادانه حرکت کنند که گفته میشود این الکترونها آزاد یا غیرمتمرکز یا غیرمستقر یا دلوکالایزند (Delocalised)؛ یعنی به نقطه خاصی تعلق نداشته و مانند شکل، حلقهای با بار منفی در بالا و پایین صفحه حلقه بنزن تشکیل میدهند. به ساختار تشریح شده، «سیستم پای غیرمتمرکز» (Delocalised Pi System) میگوییم و به خاطر وجود این الکترونهای غیرمتمرکز، بنزن نیازی به تشکیل پیوندهای دوگانه مستقل ندارد.
تبیین ساده پایداری بنزن
اگر مانند شکل پایین، ساختار بنزن را به مانند یک جارودستی لحاظ کنیم، زمانی که مانند تصویر سمت راست، ساقهها به صورت تصادفی و نامنظم روی هم چیده شوند، میتوانیم به راحتی تک تک و حتی دستهای از این ساقهها را بشکنیم. اما زمانی که مانند تصویر سمت چپ به طور منظم و در یک راستا قرار بگیرند، مانند اوربیتالهای پای در حلقه بنزن، استحکام بالاتری داشته و شکستن آنها بسیار دشوارتر خواهد بود.
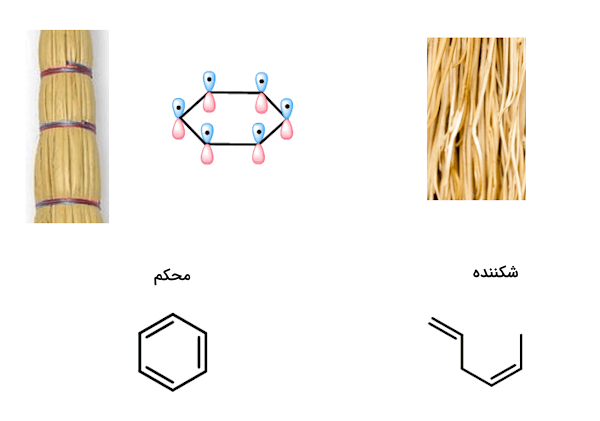
بنزن تنها نمونهای نیست که حالت پایداری ششضلعی را در طبیعت نشان میدهد و در مقیاسهای بالاتر، نمونههایی از این شکلگیری را میتوانیم ببینیم. به عنوان مثال، مکان زیبای «سمفونی سنگها» (Symphony Of the Stones) در معبد گارنی (Garni)، ساخته شده در قرن نخست پس از میلاد در ارمنستان، درهای است که در آن دیوارهای صخرهای بازالتی که صدها فوت امتداد دارند، به فرم ستونهای ششضلعی بلند شکل گرفتهاند.

خلاصه ساختار بنزن
خلاصهای از ساختار بنزن را میتوانیم به قرار زیر داشته باشیم:
- به شکل ششضلعی مسطح است.
- هر اتم کربن، با سه تا از الکترونهای ظرفیت خود، با دو اتم کربنِ دیگر و یک اتم هیدروژن پیوند دارد.
- الکترون چهارم لایه ظرفیت کربن، به طور غیرمتمرکز در ناحیه بالا و پایین مولکول است.
- طول هرکدام از پیوندهای کربن - کربن، بین پیوند ساده و دوگانه است.
- زاویه بین پیوندها ۱۲۰ درجه است.
تولید بنزن
بنزن مادهای طبیعی است که توسط آتشفشانها و آتشسوزیهای جنگلی تولید میشود و در بسیاری از گیاهان و حیوانات وجود دارد. از طرفی بنزن را میتوان به عنوان ماده شیمیایی صنعتی در نظر گرفت که از زغالسنگ و نفت ساخته میشود. امروزه مقادیر بالایی از بنزن از نفت استخراج میشود.
تولید صنعتی بنزن
حدود دو قرن از کشف بنزن میگذرد. برای چندین دهه، متخصصان به طور مستمر در حال تلاش برای بهبودی واکنشهای تولید بنزن هستند تا فرآیندهای تولید پربازدهتر شده و با کمترین زباله سمی همراه باشد. ازاینرو فناوریهای مختلفی برای تولید این هیدروکربن وجود دارد.
توجه: چون بنزن بسیار سمی است، تولید آن مستلزم شرایط کنترلشده و اقدامات احتیاطی خاصی است.
فرآیندهای مهم برای تولید بنزن صنعتی
فرآیندهای شیمیایی مهمِ تولید بنزن در سطح صنعتی عبارتند از:
- اصلاح کاتالیستی (Catalytic Reforming)
- هیدرودآلکیلاسیون تولوئن (Toluene Hydrodealkylation)
- کراکینگ با بخار (Steam Cracking)
ویژگیهای بنزن
در راستای ویژگیهای این ماده مهم صنعتی به برخی از خواص آن اشاره میشود.

خواص فیزیکی بنزن
برخی از خواص فیزیکی بنزن عبارتند از:
- در حالت خالص، در دمای اتاق، مایعی شفاف و بیرنگ یا به رنگ مایل به زرد روشن است.
- سادهترین هیدروکربن معطر آلی است.
- دارای بوی بسیار تند و کمی شیرین و تا حدی شبیه بوی پلاستیک، گازوئیل یا بنزین است.
- به سرعت در هوا تبخیر شده و بخار آن سنگینتر از هوا است.
- ترکیبی غیرقطبی است.
- بسیار اشتعالپذیر است.
- با شعله دودهای (Sooty Flame) میسوزد.
- به عنوان یک حلال خوب برای بسیاری از ترکیبات شیمیایی استفاده میشود. (این ویژگی باعث استفاده از آن در خشکشویی میشود).
- در آب اختلاط ناپذیر، نامحلول (Immiscible) یا یا با حلالیت بسیار کم، اما در حلالهای آلی محلول است.
- رزونانس نشان میدهد.
- بسیار فرار است (به همین دلیل است که فقط باید در جای خنک و دور از نور خورشید نگهداری شود).
| ویژگیهای بنزن | |
| فرمول شیمیایی | $$C_{۶}H_{۶}$$ |
| جرم مولی | $$gmol^{-۱}$$ ۷۸٫۱۱۴ |
| چگالی | $$g/cm^{۳}$$ ۰٫۸۷۶۵ (از آب سبک تر است) / در دمای اتاق (تقریباً ۲۰ درجه سانتیگراد) |
| نقطه ذوب | ۵٫۵۳ درجه سانتیگراد، نقطه ذوب بالا. |
| نقطه جوش | ۸۰٫۱ درجه سانتیگراد. نقطه جوش متوسط رو به بالا |
| حلالیت/ قابل حل در | الکل، $$CHCl_{۳}$$، $$CCl_{۴}$$، دیاتیل اتر، استون، اسید استیک و... |
| ممان دوقطبی | $$D$$ ۰ |
ویژگی آروماتیکی بنزن
متوجه شدیم که بنزن ترکیبی معطر یا در اصطلاحِ شیمی، آروماتیک است که وجود پیوندهای «پای» پیوسته در بنزن، علت معطر بودن آن است.
در حالت کلی ترکیبات معطر به دو دسته تقسیم میشوند:
- بنزنوئیدها (Benzenoids) (دارای حلقه بنزن)
- غیر بنزنوئیدها (Non-Benzenoids) (بدون حلقه بنزن)، به شرط اینکه از قانون هوکل (Huckel Rule) پیروی کنند.
طبق قانون هوکل، لازمه آروماتیک بودن حلقه داشتن شرایط زیر است و لازم است تمامی ترکیبات معطر واجد آن باشند:
- مسطح بودن (Planarity)
- امکان جابجایی کامل (Complete Delocalization) الکترونهای π در حلقه
- وجود ($$۴n+۲$$) الکترون π در حلقه که n در آن یک عدد صحیح است.
واکنش های بنزن چیست؟
در بررسی ساختار بنزن، اشارهای داشتیم به عدم تمایل بنزن به واکنش و علت آن! به عنوان مثال هیدروژنه شدن بنزن بسیار کندتر از هیدروژنه شدن سایر ترکیبات آلی حاوی پیوندهای ساده کربن-کربن اتفاق میافتد و اکسید شدن آن نیز بسیار دشوارتر از آلکنها است.
بیشتر واکنشهای بنزن متعلق به گروهی به نام «جانشینی الکتروندوست آروماتیکی» (Electrophilic Aromatic Substitution) یا واکنشهای جانشینی الکتروندوست (Electrophilic Substitution Reactions) است که در آن حلقه را سالم و بدون درگیری (Intact) باقی میگذارد اما جایگزین یکی از هیدروژنهای متصل به آن میشود. این واکنشها به طور معمول برای تهیه مشتقات بنزن استفاده میشود که در ادامه مورد بررسی قرار میگیرند.
واکنشهای جانشینی الکتروندوست
متوجه شدیم که بنزن و مشتقات آن بسیار پایدارتر از حد انتظار است. پایداری بالا به این معنی است که کمتر تحت واکنشهای افزایشی قرار میگیرد. الکترونهایی که آزادترند، در معرض حمله الکتروفیلها یا الکتروندوستها هستند. از این رو، این واکنش، به عنوان واکنش مشخصه بنزن شناخته میشود. در ادامه به برخی از این واکنشها شامل نیتراسیون، هالوژناسیون و سولفاسیون اشاره میشود که لازم است به عوامل جانشینی در ساختار آنها در هر واکنش جانشینی توجه کنیم.
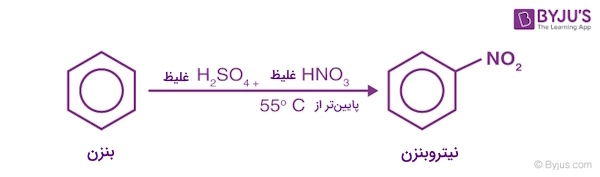
واکنش نیتراسیون
در این واکنش، بنزن در دمایی حدود ۳۲۳ الی ۳۳۳ کلوین، در حضور اسیدسولفوریک غلیظ با اسید نیتریک غلیظ واکنش داده و تشکیل نیتروبنزن (Nitration) را میدهد.
واکنش هالوژناسیون
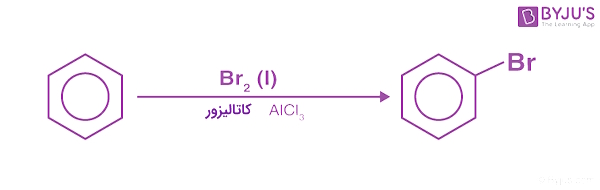
در طی واکنش هالوژناسیون، بنزن در حضور اسیدهای لوییس مانند $$FeCl_{3}$$ یا $$FeBr_{3}$$ با هالوژنها واکنش داده و تشکیل «آریل هالیدها» (Aryl Halides) را میدهد.
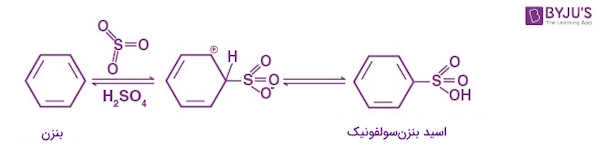
واکنش سولفوناسیون
سولفوناسیون بنزن، فرآیند گرمادهی بنزن با اسید سولفوریک دودکننده یا همان اسید سولفوریک اولئوم (Fuming Sulphuric Acid) ($$H_{2}SO_{4} + SO_{3}$$)، برای تولید اسید بنزنسولفونیک (Benzenesulfonic Acid) است.
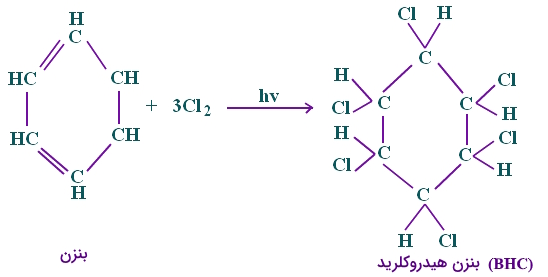
واکنشهای افزایشی
واکنشهای افزایشی که با واکنش بیشتر از دو مولکول، ایجاد مولکولی بزرگتر میکنند، در بنزن به شرح تصویر زیر میتواند صورت گیرد.
احتراق بنزن
در نهایت اشارهای داریم به احتراق یا سوختن بنزن که در آن با اکسیژن وارد واکنش میشود.
$$C_{۶}H_{۶}+O_{۲}\rightarrow CO_{۲}+ H_{۲}O$$
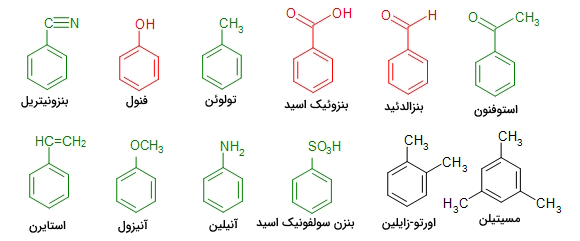
مشتقات متداول بنزن
جایگزینی گروههای عاملی مختلف در بنزن منجر به ایجاد مواد شیمیایی آلی متنوع با کاربردهای متعدد صنعتی میشود. به عنوان مثال در برخی از این فرآیندها، یک یا چند اتم هیدروژن از حلقه بنزن را با گروههای عاملی جایگزین کرده و ترکیبات جدیدی را از آن سنتز میکنند. نمونههایی از مشتقات بنزن را با عوامل جانشینی آنها در تصاویر میبینیم.
کاربرد بنزن
در وهله نخست، اگر بخواهیم طبقهبندیهایی بر اساس شاخصهای متعدد در بازار جهانی بنزن را ارائه دهیم، میتوانیم به طبقهبندی بر اساس موارد زیر اشاره داشته باشیم.
- بر اساس مشتقات: اتیلبنزن، آنیلین، فنول، آلکیلبنزن، استایرن و ...
- بر اساس کاربرد: رنگها، پاککنندهها، لاستیک، مواد شیمیایی مصرفی در کشاورزی (حشرهکشها، آفتکشها، کودها، علفکشها و ...)، روانکنندهها، چسبها و ...
- بر اساس استفاده نهایی در صنایع: پتروشیمی، خودرو (خودروهای سواری، خودروهای تجاری سبک و سنگین)، چاپ، داروسازی، کشاورزی، ساختوساز اعم از مسکونی، تجاری و صنعتی، صنایع شیمیایی و...
- بر اساس منطقه جغرافیایی: آمریکای شمالی، اروپا، آسیا و اقیانوسیه، خاورمیانه و آفریقا، آمریکای جنوبی و بقیه مناطق جهان.
کاربرد اصلی بنزن این است که در ساخت سایر مواد شیمیایی مانند اتیلبنزن (Ethylbenzene)ُ، سیکلوهگزان (Cyclohexane)، کومن (Cumene)، نیتروبنزن (Nitrobenzene)، آلکیلبنزن (Alkylbenzene) و ... استفاده شود. در ارزیابی مصرف بنزن برای تولید و مصرف مشتقات آن، میتوان به فلوچارت و نمودار زیر اشاره داشت که به داشتن دیدی تقریبی در این خصوص کمک میکند.
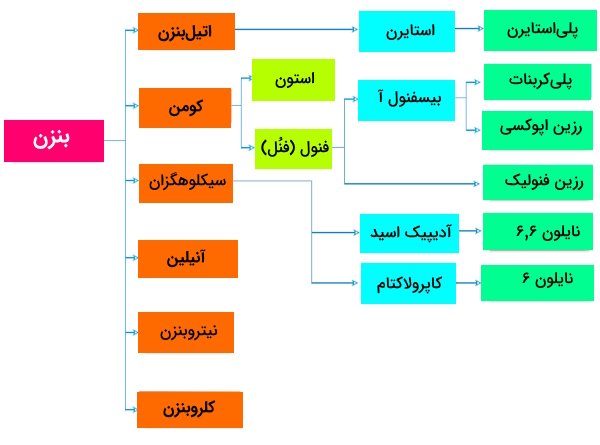
در قالب نمودار نیز، میتوان به موارد مطرح شده اشاره کنیم که کلیات توزیع مصرف بنزن در فرآوری سایر مشتقات آن را نشان میدهد.
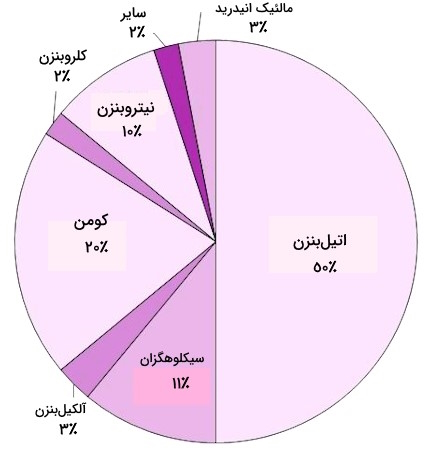
همانطور که تصاویر نیز گویا است:
- حدود نیمی از بنزن تولیدی برای تولید «اتیلبنزن» (Ethylbenzene) استفاده میشود که آن هم به نوبه خود برای تولید «استایرن» (Styrene) و سپس «پلیاستایرن» (Polystyrene) استفاده میشود که استفاده در تولید پلیاستایرن از عمدهترین کاربردهای بنزن است.
- «کومن»(Cumene)، یکچهارم دیگر از مصرف بنزن را شامل میشود که برای ساخت فنول و پروپانون (استون) استفاده میشود که آنها هم از جمله برای تولید طیف وسیعی از پلیمرها استفاده میشوند.
- «سیکلوهگزان» (Cyclohexane) کاربرد مهم دیگر بنزن است که آن هم به نوبه خود برای ساختن «اسید آدیپیک» (Adipic Acid) و «کاپرولاکتام» (Caprolactam)، واسطههای ضروری در ساخت پلیآمیدها به کار میروند.
کاربردهای صنعتی بنزن چیست؟
برخی از کابردهای بنزن به عنوان یک حلال صنعتی در صنایع مختلف را میتوان به شرح زیر نام برد:
صنایع لاستیک و پلاستیک
بنزن در مراحل مختلف فرایند تولید لاستیک و پلاستیک مورد استفاده قرار میگیرد. تولید محصولاتی مانند نایلون، استایرن و استایروفوم (Styrofoam) به بنزن نیاز دارد. همچنین موارد جانبی امثال چسب مورد استفاده برای چسباندن انواع کفهای لاستیکی (Rubber Soles) نیز شامل بنزن است.
صنایع رنگ، رزین و پوشش و صنعت ساختوساز
محصولات مختلفی که در صنعت چاپ به کار میروند و محصولات مختلف نقاشی حاوی بنزن هستند. از بنزن در ساخت انواع رنگها استفاده میشود که ماده اولیه اصلی در انواع فعالیتهای ساختمانی است. در رزینها و تینرها بنزن مورد استفاده قرار میگیرد. بنزن به عنوان حلال در پوششها استفاده شده و قابلیت پخش شدن آنها را افزایش میدهد و... .
صنایع داروسازی
بخش داروسازی، با به کارگیری بنزن به عنوان حلال، جزو قسمتهای با مصرف بالا در بازار آن در طی سالهای اخیر بوده است.
صنایع کشاورزی
بنزن به طور گستردهای در تولید مواد شیمیایی مورد استفاده در صنعت کشاورزی مانند حشرهکشها، آفتکشها، کودها و علفکشها استفاده میشود. این مواد شیمیایی بهمنظور کاهش علفهای هرز و در نتیجه ارتقای رشد گیاهان عمل میکنند. انواع علفکشها و آفتکشها را میتوان از بنزن تهیه کرد که ویژه گیاه هدف تهیه میشود. مانند علفکشهای دیفنیلاتر، سنتز شده از بنزن و فنیل، که برای علفهای هرز در کشت سویا و بادامزمینی استفاده میشود.
صنایع خودروسازی
در فرآیندهای مختلف این صنعت، از تولید و پوششدهی تا تعمیرات و نگهداری از بنزن استفاده میشود.
صنایع جادهسازی و روسازی
بنزن به عنوان پیشمادهای در تولید آسفالت استفاده میشود.
تاریخچه کشف بنزن چیست؟
در سال ۱۸۲۵، «مایکل فارادی» (Michael Faraday)، دانشمند انگلیسی، به روغن ایجاد شده به عنوان محصول جانبی در تولید «گاز همراه» (Portable Gas) یا گاز روشنایی (Illuminating Gas) که با پیرولیز روغن نهنگ و تحت فشار قرار دادن گاز آن به منظور استفاده در لامپهای ساختمانی ساخته میشد، کنجکاوی نشان داده و با تقطیر و آزمایش روی این ماده، برای نخستین بار بنزن را جدا و شناسایی کرد.
شاید در آن زمان کسی پیشبینی نمیکرد این مایع شفاف که با نام «بیکاربورِت هیدروژن» (Bicarburet of hydrogen) شناخته میشد، تبدیل به یکی از انقلابیترین مواد خام در صنعت معاصر شود. پس از این کشف، بنزن در سال ۱۸۴۲ پس از طی مراحلی عرضه عمومی شد.

بنزن به دست آمده توسط آقای فارادی، در یک ویال (ظرف شیشهای) کوچک با نام اولیه مندرج، در «موزه فارادی» به نمایش گذاشته شده است که تصویر و مشخصات آن را در زیر میبینیم.

منشا نام بنزن چیست؟
در این مطلب از مجله فرادرس گفتیم که تاریخچه کشف بنزن چیست اما نامیدن «بنزن» به این نام در سال ۱۸۳۳ توسط شیمیدان آلمانی «الهارد میتشرلیچ» (Eilhard Mitscherlich) پیشنهاد شد. ریشه تاریخی آن از «صمغ بنزوئین» (Gum Benzoin) گرفته شده است که «بنجامین» (Benjamin) نیز نامیده و به عنوان رزین معطر شناخته میشد.

همانطور که فهمیدیم ساختار بنزن چیست، متوجه شدیم ساختار آن از زمان کشف مورد توجه دانشمندان بوده و موضوع تحقیقات زیادی را به خود اختصاص داده است. نظریههای متعددی در طول قرن نوزدهم در این راستا مطرح شد؛ از جمله در سال ۱۸۶۵، «فردریش آگوست ککوله» (Friedrich August Kekulé) دانشمند آلمانی مقالهای در مورد ساختار بنزن منتشر کرد.
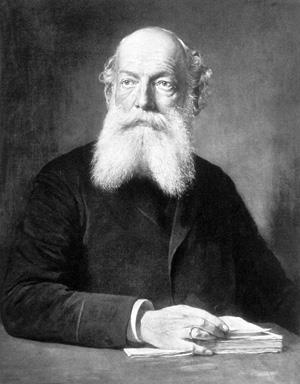
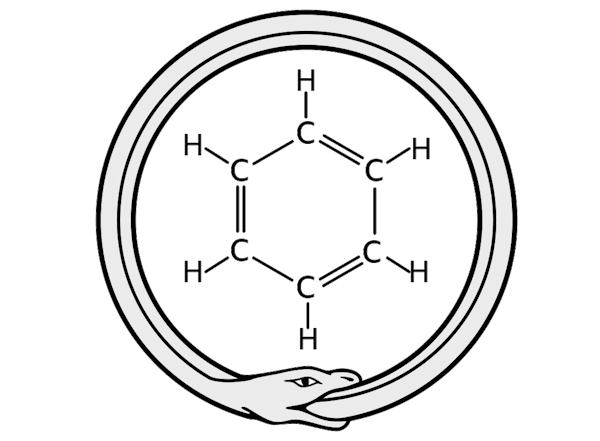
ادعای ایشان این بود که با دیدن ماری در خواب که دم خود را گاز میگیرد، ماهیت حلقوی بنزن که با عنوان حلقه بنزن میشناسیم برایشان آشکار شد و پیشنهاد کردند که بنزن حاوی پیوندهای متناوب ساده و دوگانه کربن-کربن است که بعدها نقدهایی به برخی از جنبههای نظریه ایشان وارد آمد.
در نهایت در سال ۱۹۲۵، یک قرن پس از کشف بنزن، خانم «کاتلین لونسدال» (Kathleen Lonsdale) دانشمند بریتانیایی و نخستین استاد زن در دانشگاه UCL لندن، ساختار آن را از طریق کریستالوگرافی اشعه ایکس تایید کرد.

خطرات بنزن چیست ؟
در کنار مزایای متنوع، بنزن یک ماده بالقوه خطرناک محسوب میشود و مواجهه کوتاهمدت و طولانیمدت با آن میتواند مشکلات جدی برای سلامتی ایجاد کند. طبق اعلام چندین مرکز از جمله وزارت بهداشت و خدمات انسانی (The Department of Health and Human Services)، آژانس بینالمللی تحقیقات سرطان (IARC) (The International Agency for Research on Cancer) که بخشی از سازمان بهداشت جهانی World Health Organization) ( (WHO))) است، بنزن به عنوان مادهای «سرطانزا برای انسان» طبقهبندی شده است. این اثرات نامطلوب و جدی بر سلامتی، رشد بازار جهانی را مهار کرده و جزو چالشهای این بازار است. برخی از خطرات آن عبارتند از:
- این ماده با بیماریهای دیگری مانند لوسمی لنفوسیتی حاد یا سرطان خون Acute Lymphocytic Leukemia) (ALL)) و لوسمی لنفوسیتی مزمن Chronic Lymphocytic Leukemia) (CLL)) مرتبط است.
- مواجهه حاد (Acute Exposure) با بنزن اثرات سمی روی سیستم عصبی مرکزی ایجاد میکند.
- تاثیرات منفی بر روی جنین و رشد آن دارد.
- بیشتر موارد مسمومیت شدید با بنزن در کارگرانی که در شرایط کاری غیربهداشتی و غیراستاندارد، در معرض غلظتهای نسبتا بالایی از بنزن میگیرند گزارش شده است. همچنین این احتمال وجود دارد که تمامی موارد گزارش شده به عنوان «لوسمی مرتبط با قرار گرفتن در معرض بنزن» (Leukemia Associated With Benzene Exposure)، ناشی از قرار گرفتن در معرض غلظت نسبتا بالای بنزن و سایر مواد شیمیایی باشد.
- قرار گرفتن کوتاه مدت و استنشاق بنزن ممکن است باعث خوابآلودگی، سرگیجه، سردرد و همچنین تحریک چشم، پوست و مجاری تنفسی و در سطوح بالا بیهوشی شود.
- بنزن به سرعت در هوا تبخیر میشود و مردم عمدتا با تنفس هوای آلوده به بنزن در معرض آن قرار میگیرند.
- یکی از انواع اصلی قرار گرفتن در معرض بنزن، دود سیگار است.
- سطح پایین بنزن در میوهها، آجیل، محصولات لبنی و سبزیجات و ماهی مشاهده میشود.
- به دلیل تفاوت در میزان حساسیت افراد، زمان مورد نیاز برای بیان سمیت آن متفاوت است.
جمعبندی
در این مطلب از مجله فرادرس یاد گرفتیم که بنزین چیست و گفتیم مادهای با فرمول شیمیایی $$C_{۶}H_{۶}$$، سادهترین هیدروکربن آروماتیک با ساختاری حلقوی است که مشتقات مختلفی از آن مانند فنول، تولوئن، اتیلبنزن، نیتروبنزن و... را میتوان سنتز کرد. این ماده به عنوان یک حلال صنعتی عمل میکند و در صنایع و فرآیندهای صنعتی مختلف به طور مستقیم و غیرمستقیم به کار میرود. از جمله برای ساخت سایر مواد شیمیایی مانند روانکنندهها، انواع پلاستیکها، لاستیکها، رنگها، مواد شوینده و آفتکشها و... . در نتیجه افزایش تقاضا برای بازار مصرف هریک از صنایع مذکور اعم از کشاورزی، داروسازی، پلاستیک، مسکن و خودرو و... باعث افزایش همزمان تقاضا برای بنزن میشود و بالعکس. کاربردهای غیرصنعتی بنزن به دلیل سمی و سرطانزا بودن آن به نسبت محدود و کاربردهای صنعتی آن نیز مشمول ملاحظاتی در این راستا است.










