نظریه مولکولی چیست؟ — به زبان ساده

نظریه مولکولی مکمل نظریه اتمی بوده که به شیوهای مدرن آن را تکمیل کرده است. محور اصلی نظریه مولکولی بر پایه این است که همه مواد از ذرات ریزی به نام اتم یا مولکول تشکیل شدهاند. البته در این نظریه، فاصله بین اتم یا مولکولها و جنبش آنها اهمیت بالایی دارد. بر اساس نظریه مولکولی نظریههایی همچون نظریه جنبش مولکولی گازها و اوربیتالی مولکولی به وجود آمدند. در این مطلب برای اینکه یاد بگیریم نظریه مولکولی چیست به هر یک از نظریهها و موضوع آنها میپردازیم.
نظریه مولکولی چیست ؟
به طور کلی نظریه مولکولی بر ۳ پایه زیر استوار است.
- مواد از ذرات ریزی مانند اتم، مولکول یا یون تشکیل شدهاند.
- فضایی که مولکولها اشغال میکنند (حجم) به فضای بین مولکولها بستگی دارد و هیچ ارتباطی به فضایی که خود مولکولها در ساختار ماده اشغال کردهاند ندارد.
- مولکولها در یک وضعیت ثابت قرار دارند که این وضعیت در هر سه حالت فیزیکی ماده متفاوت است. مولکولها با یکدیگر و همچنین دیواره ظرفی که در آن قرار دارند برخورد میکنند و وقتی که مولکولها به هم یا به دیواره ظرف برخورد میکنند هیچ افت انرژی در ماده رخ نمیدهد.
همانطور که گفتیم بر اساس نظریه مولکولی، نظریه جنبشی گازها پدید آمد. اما قبل از اینکه متوجه شویم نظریه مولکولی گازها چیست و مفهوم آن را بهتر درک کنیم بهتر است که مروری بر سه حالت فیزیکی مواد داشته باشیم اما قبل از آن به تصویر زیر نگاهی بیندازیم تا مطلب بعدی را بتوان احتتر درک کرد.
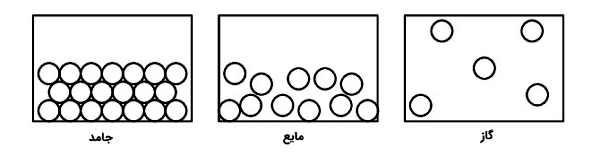
حالتهای های مختلف ماده
هر مادهای در طبیعت به سه حالت فیزیکی جامد، مایع، و گاز تقسیمبندی می شود که هر کدام خصوصیات و ویژگیهای منحصر به فرد خود را دارند.
در جدول زیر هر یک از این سه حالت ماده به طور خلاصه تعریف شدهاند.
- جامد: مولکولهایی هستند که از طریق بارهای الکتریکی با یکدیگر جاذبه برقرار میکنند. این مولکولها در محل خود ارتعاش دارند و از نظم خاصی برخوردار هستند.
- مایع: مولکولهای مایع بر روی هم شناور هستند و در کف ظرفی که در آن قرار دارند قرار می گیرند. میانگین جنبش مولکولهای مایع از مولکولهای جامد بیشتر است. انرژی جنبشی این مولکولها به گونهای است که نسبت به مولکولهای جامد آزادانهتر حرکت می کنند و به همین دلیل سیستم در این حالت بینظمتر از حالت جامد است.
- گاز: حرکت مولکولهای گاز در راستای یک خط مستقیم است. انرژی جنبشی مولکولهای گاز بیشتر از نیروی جاذبه میان آنهاست. به همین دلیل مولکولها بسیار از هم دور هستند و به طور آزادانه میتوانند حرکت کنند.
حال که با مفهوم کلی نظریه مولکولی و تعریف هر یک از حالات فیزیکی مواد آشنا شدیم به بررسی نظریههای جنبشی مولکولهای گاز و اوربیتالهای مولکولی میپردازیم.
نظریه جنبشی مولکولی گازها
نظریه جنبشی مولکولی، حالت ماده را توصیف میکند و بر پایه نظریه مولکولی بنا شده است. نظریهای که همانطور که در قسمت بالا توضیح دادیم بیان میکند ماده از ذرات ریزی تشکیل میشود که همیشه در حال ارتعاش هستند. این نظریه کمک میکند که خواص و رفتار جامدات، مایعات و گازها را بتوان توضیح داد و بررسی کرد. درک نظریه جنبشی مولکولی بسیار راحت است و اغلب در مورد گازها کاربرد دارد که در این مطلب هم به بررسی نظریه مولکولی برای جنبش گازها می پردازیم.
این نظریه به طور ویژه برای مدلی از گازها به نام گاز ایدهآل به کار میرود. گاز ایدهآل، گازی است که در حقیقت وجود ندارد و درواقع گازی است که به صورت ایدهآل مدلسازی شده که رفتار آن بر اساس نظریه مولکولی گازها صدق میکند. در زندگی واقعی گازها رفتار ایدهآلی از خود نشان نمیدهند که به این گازها، گازهای حقیقی میگویند. البته گازهای حقیقی در زندگی روزمره تحت شرایطی به این رفتار ایدهآل نزدیک میشوند.
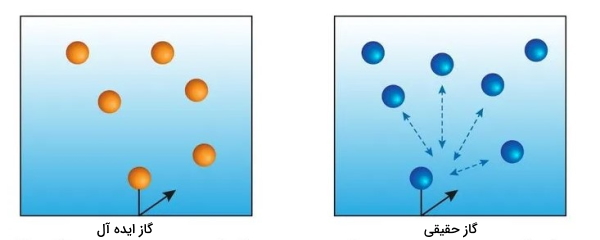
نظریه مولکولی گازها که بر پایه جنبش گازهاست طبق ۵ فرضیه اصلی تعریف میشود:
- گازها شامل تعداد بسیاری از ذرات ریز کرهای شکل هستند که این ذرات به نسبت اندازهای که دارند در فاصلههای نسبتا دوری از هم قرار میگیرند. ذرات گاز ممکن است اتمها یا مولکولها باشند. فاصله بین این ذرات بیشتر از فاصله ذرات در جامدات و مایعات است. بنابراین با توجه به این توضیحات می توان نتیجه گرفت که اکثر حجم گاز را فضای خالی بین ذرات تشکیل میدهد. در حقیقت، حجم خود ذرات در مقایسه با حجم خالی بین آنها به چشم نمیآید.
- ذرات گازی در سرعتهای ثابت اغلب با سرعت بالا در جهتهای تصادفی ارتعاش میکنند. ارتعاش سریع ذرات گازی سبب افزایش انرژی جنبشی آنها میشود. انرژی جنبشی در اثر ارتعاش و جنبش ذرات به وجود میآید. حرکت ذرات گاز در امتداد خط مستقیم تا جایی ادامه دارد که آنها به هم یا به یکی از دیوارههای محفظه برخورد کنند.
- برخورد میان ذرات گاز با هم و با دیوارههای محفظه از نوع برخورد الاستیکی هستند. برخورد الاستیکی برخوردی است که طی آن هیچ افت انرژی جنبشی صورت نمیگیرد. به این صورت که انرژی جنبشی در حین برخورد از یک ذرهای به ذره دیگری انتقال پیدا میکند، اما هیچ تغییری در انرژی کلی ذرات برخوردکننده رخ نمیدهد.
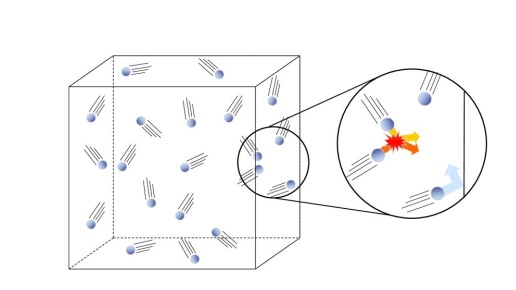
برخورد ذرات در گاز ایدهآل - در بین ذرات گازی هیچ نیروی جاذبه یا دافعهای وجود ندارد. نیروهای جاذبه در گازهای حقیقی وجود دارد و باعث میشود ذرات گازی در اثر اثر متراکم شدن به حالت مایع تبدیل شوند. برای ذرات گازهای ایدهآل فرض بر این است که بین آنها هیچ نیروی جاذبهای وجود ندارد. در گازهای ایدهآل، جنبش هر ذرهای به طور کامل مستقل از جنبش ذره دیگری است.
- میانگین انرژی جنبشی ذرات گازی به دمای گاز بستگی دارد. با افزایش دمای گاز، سرعت ارتعاش ذرات نیز بیشتر میشود در نتیجه انرژی جنبشی ذرات افزایش پیدا میکند. توجه داشته باشید که همه ذرات گاز به یک اندازه ارتعاش نمیکنند به عبارتی سرعت جنبشی همه آنها باهم برابر نیست. به طور کلی دمای گاز متناسب با میانگین انرژی ذرات گاز است.
سرعت جنبشی در نظریه مولکولی گازها
همانطور که گفتیم میانگین انرژی جنبشی در ذرات گاز ایدهآل با دمای مطلق آنها ارتباطی مستقیم دارد. فرمول این مقدار انرژی برابر است با :
$$KE = \dfrac{1}{2}m v^2$$
در رابطه فوق:
- $$KE$$: برابر است با انرژی جنبشی مولکول
- $$m$$: جرم مولکول و
- $$v$$: سرعت مولکول است.
هرچه دمای گاز بیشتر شود سرعت مولکولها نیز افزایش پیدا میکنند، به عنوان مثال با توجه به رابطه فوق اگر دمای مولکولهای گاز دو برابر شود، سرعت آنها چهار برابر میشود.
برخورد ذرات گازی با دیوارهها باعث انتقال بیشتری از انرژی جنبشی به دیوارهها میشود. در دو تصویر زیر تفاوت انرژی جنبشی در دماهای پایین و بالا نشان داده شده است.
اگر دیوارههای محفظه، دمای پایینتری نسبت به گاز داشته باشند در اثر برخورد بین ذرات و دیواره، دیوارهها گرمتر میشوند و انرزی جنبشی کمتری به ذرات گازی برگردانده میشود. این حالت باعث میشود زمانی که تعادل بین دیواره و مولکولهای گازی برقرار میشود دمای گاز پایینتر آید.
قانون گازها از نگاه نظریه جنبشی مولکولی
برای اینکه یاد بگیریم در گازها منظور از نظریه مولکولی چیست در این قسمت از زاویه نظریه جنبشی مولکولی ۴ قانون گاز را بررسی میکنیم.
قانون بویل
قانون بویل به راحتی توسط نظریه مولکولی قابل درک است. فشار گاز به تعداد دفعاتی بستگی دارد که مولکولهای گاز در ثانیه به سطح دیواره برخورد میکنند. اگر حجم گاز را فشردهتر کنیم همان تعداد مولکول در محفظه کوچکتری قرار خواهند گرفت، بنابراین منطقی است که تعداد دفعات برخورد مولکولها در ثانیه با سطح دیواره محفظه بیشتر شود. در این صورت فشار گاز افزایش پیدا میکند.
دقیقا عکس این موضوع برای حالتی رخ میدهد که محفظه گاز را بزرگتر کنیم به عبارتی حجم محفظه افزایش پیدا کند و گاز از حالت فشردگی خارج شود. در این حالت حرکت ذرات گازی آزادانهتر خواهد بود به همین دلیل تعداد برخورد مولکولها در ثانیه کمتر میشود یعنی فشار گاز کاهش پیدا میکند. تصویر هر یک از این دو حالت در زیر آورده شده است.
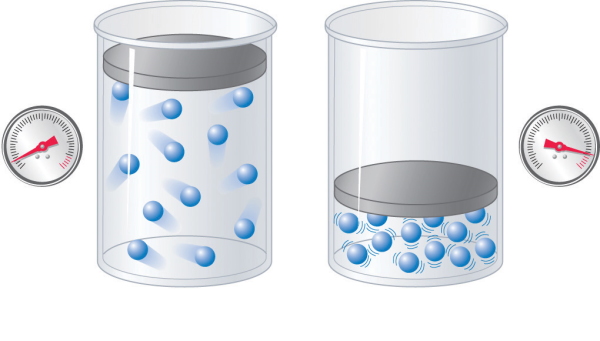
قانون چارلز (شارل)
نظریه جنبشی مولکولی بیان میکند که با افزایش دما میانگین انرزی جنبشی ذرات گازی نیز بیشتر میشود. به عبارتی با افزایش دما در صورتی که فشار گاز تغییر نکند (فشار ثابت) ارتعاش مولکولها و برخورد آنها با سطح محفظه افزایش پیدا میکند. بنابراین در این حالت مولکولها در فاصله بیشتری از هم قرار میگیرند به این صورت گاز انبساط پیدا میکند. بنابراین قانون چارلز بیان میکند حجم گازهای ایدهآل در فشار ثابت با افزایش دما افزایش پیدا میکند که این قانون توسط نظریه مولکولی قابل توجیه است و با آن کاملا تطابق دارد. در تصویر زیر میتوانید تغییر حجم با دما را مشاهده کنید.
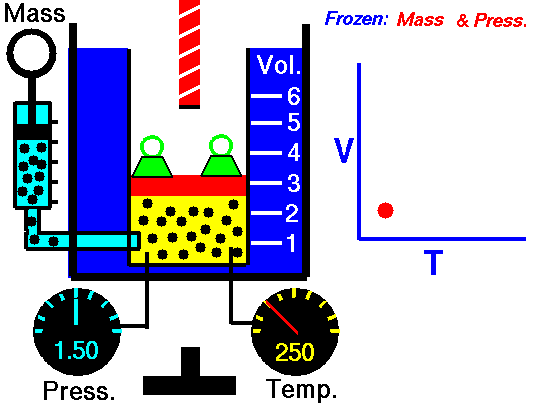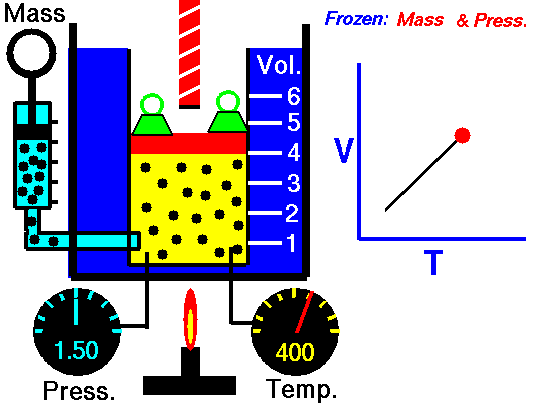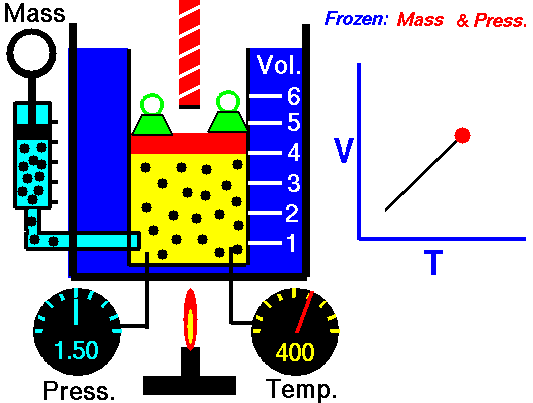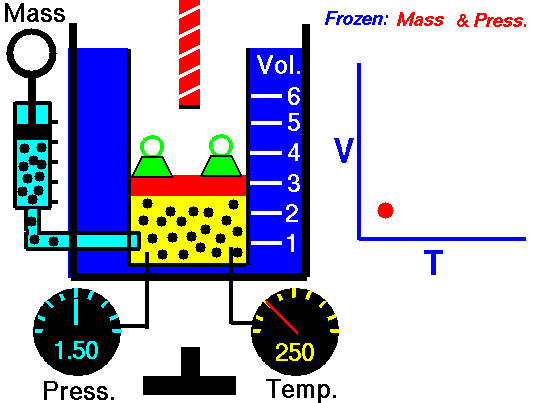
در تصویر فوق رابطه میان دما (Temp) و حجم (Vol) در فشار (Press) ثابت در یک سیستم گازی نشان داده شده است. همانطور که در شکل مشخص است در حالتی که شعله خاموش است درجه حجم گاز در تصویر سمت راست برابر ۳ است. در حالی که بعد از روشن شدن شعله، دمای سیستم گازی افزایش پیدا میکند و به دلیل افزایش ارتعاشات مولکولها درجه حجم محفظه به ۵ میرسد، بنابراین حجم افزایش پیدا کرده است. لازم به ذکر است در تصویر فوق (Mass) به معنای جرم است. همچنین رابطه حجم با دما رابطه خطی است که در تصویر فوق نمودار آن نشان داده شده است.
بنابراین قانون چارلز تناسب مستقیم میان دما و حجم ($$v \propto T$$) را نشان میدهد را که این قانون را می توان به صورت زیر نوشت:
$$\frac{V}{T}= k$$ یا $$V=KT$$
در رابطه فوق:
- $$V$$: حجم گاز
- $$T$$: دمای گاز که بر حسب کلوین است.
- $$K$$: عدد ثابت مخالف صفر
پس به طور کلی طبق رابطه و توضیحات فوق در رابطه با نظریه مولکولی میتوان نتیجه گرفت که حجم مولکولهای گاز در سیستم گازی با افزایش دما افزایش و با کاهش دما حجم گاز نیز کاهش پیدا میکند. رابطه فوق را به صورت زیر نیز میتوان نوشت.
$$\frac{V_1}{T_1}=\frac{V_2}{T_2}$$
قانون آواگادرو
با افزایش تعداد مولکولهای گاز در محفظه بسته بسیاری از آنها در هر واحد زمان با دیواره برخورد میکنند. در صورتی که فشار ثابت باقی بماند حجم باید متناسب با آن افزایش پیدا کند. بنابراین در این حالت مولکولها در تعداد دفعات کمتری و در سطح بزرگتری با هم برخورد دارند. به عبارتی قانون آواگادرو نشان میدهد سیتسمهای گازی با فشار، حجم و دمای برابر تعداد مول گازی برابری دارند.
قانون دالتون
«هر گاز نسبت به گازهای دیگر یک خلأ به حساب میآید» این عبارتی بود که دالتون توسط آن قانون خود را بیان کرد. قانونی که ما اکنون آن را به صورت قانون فشارهای جزئی در مخلوط گازها میشناسیم. این قانون به سادگی بیان می کند هر گاز که در مخلوطی از گازها وجود دارد به طور مستقل از سایر گازها عمل میکند.
پس میتوان از نظریه مولکولی گازها در زمینه جنبش نتیجه گرفت که مولکولهای گاز حجم ناچیزی دارند. بنابراین اگر مخلوطی داشته باشیم که از ترکیب گاز (۱) و گاز (۲) تشکیل شده باشد؛ گاز (۱) در مخلوط (۱) و (۲) همانطور رفتار میکند که اگر گاز (۲) در مخلوط وجود نداشت رفتار میکرد.

همانگونه که گفتیم یکی از دیگر از نظریاتی که پایه آن نظریه مولکولی است، نظریه اوربیتالی مولکول است که در این قسمت به آن میپردازیم.
نظریه اوربیتال مولکولی
این نظریه مولکولی به اوربیتالها و روابط فیزیکی ارتباط دارد و روشی است که به کمک آن میتوان ساختار الکترونی مولکولها را با استفاده از فیزیک کوانتوم نشان داد. در نظریه اوربیتال مولکولی، الکترونها در مولکول تنها به پیوند شیمیایی بین اتمها وابسته نیستند بلکه تحت تاثیر هستههای اتمی در کل مولکول هستند. در حالت کلی پیوند شیمیایی زمانی رخ میدهد که نیروهای جاذبه بین الکترون و هستههای دو اتم از نیروی دافعه میان دو هسته بیشتر باشد.
سواالات متداول در رابطه با نظریه مولکولی
در این قسمت از مطلب سوالات مرتبط با نظریه مولکولی گردآوری و به آنها پاسخ داده شده است.
تعریف نظریه مولکولی چیست؟
در نظریه مولکولی سه اصل مطرح میشود. اصل اول بیان میکند که ماده از ذرات ریزی مانند مولکول یا اتم تشکیل شده است. اصل دوم به فضای میان مولکولها اشاره میکند زیرا برای حجم و به طور کلی حالت ماده، فضای بین موکولها اهمیت دارد و نه فضایی که خود مولکول در ماده اشغال میکند. اصل سوم این نظریه بیان میکند که مولکولهای ماده (جامد، مایع و گاز ) در جای خود ارتعاش دارند یا میتوانند حرکت کنند و با یکدیگر و دیواره ظرف برخورد کنند.
جنبش مولکولها در جامد، مایع و گاز را مقایسه کنید؟
همانطور که میدانیم هر مادهای در طبیعت به سه حالت فیزیکی جامد، مایع و گاز تقسیمبندی میشود. از آنجا که جنبش مولکولها تابعی از فاصله میان مولکولها است بنابراین جامدات، مایعات و گازها همگی دارای جنبش مولکولی یکسانی نیستند زیرا فاصله میان مولکولها در آنها برابر نیست. به عنوان مثال مولکوها در جامدات هیچ فاصلهای با هم ندارند به همین دلیل مولکولها تنها سرجای خود کمی ارتعاش دارند.
همچنین بدین خاطر است جامدات به عنوان موادی با نظم معین شناخته میشوند. در مایعات، مولکولها نسبت به جامدات از هم فاصله بیشتری دارند بنابراین جنبش مولکولها یا به عبارتی انرژی جنبشی آنها بیشتر از جامدات است. اما در گازها مولکولها از هم فاصله بسیاری دارند به همین دلیل به راحتی و آزادانه این مولکولها میتوانند حرکت کنند که در این صورت انرژی جنبشی میان مولکولهای گازی بسیار بالاتر از مولکولهای جامد و مایع خواهد بود.
نظریه های مرتبط با نظریه مولکولی چیست؟
دو نظریه وجود دارند که اصل و اساس آنها بر پایه همان سه اصل نظر مولکولی شکل می گیرد و به آن مرتبط هستند. نام آنها نظریه جنبشی مولکولی گازها و نظریه اوربیتالی مولکولی است.
رابطه دما با حجم در نظریه مولکولی گازها چگونه است؟
رابطه دما با حجم را قانون بویل به کمک نظریه جنبشی مولکولها به این صورت بیان می کند که با افزایش دما در فشار ثابت، ارتعاش مولکولها بیشتر میشود و فاصله بین مولکولها نسبت به هم افزایش پیدا میکند. در این صورت گاز انبساط پیدا میکند و حجم آن بیشتر میشود. بنابراین رابطه بین دما و حجم مستقیم است یعنی با افزایش دما، افزایش حجم و با کاهش آن کاهش حجم خواهیم داشت.










