اوربیتال و آرایش الکترونی – به زبان ساده
پیشتر در وبلاگ فرادرس مدل اتمی بور را توضیح دادیم. مدل اتمی بور مدلی یکبعدی است که تنها از یک عدد جهت توصیف الکترونهای یک اتم استفاده میکند. این عدد همان n است که نشان دهنده لایهای است که الکترون در آن میچرخد. همچنین مدل مذکور تنها میتواند ویژگیهای اتم هیدروژن را توجیه کند.

«اروین شرودینگر» (Erwin Schrödinger)، در سال ۱۹۲۶ با استفاده از محاسبات پیچیده ریاضی نشان داد که الکترونهای یک اتم در مسیرهایی سهبعدی حرکت میکنند؛ از این رو به سه عدد جهت توصیف الکترونها نیازمندیم. البته به عدد چهارمی نیز بهمنظور نشان دادن نحوه حرکت الکترون به دور خودش نیازمند هستیم. هر الکترون در فضایی ابری تحت عنوان اوربیتال در حال حرکت است. نحوه این حرکت و آرایش الکترونها در شکلگیری پیوندهای شیمیایی بسیار تاثیرگذار هستند. با استفاده از اعداد کوانتومی که در ادامه به آنها خواهیم پرداخت، میتوان اوربیتالها را به شکلی دقیقتر توصیف کرد.
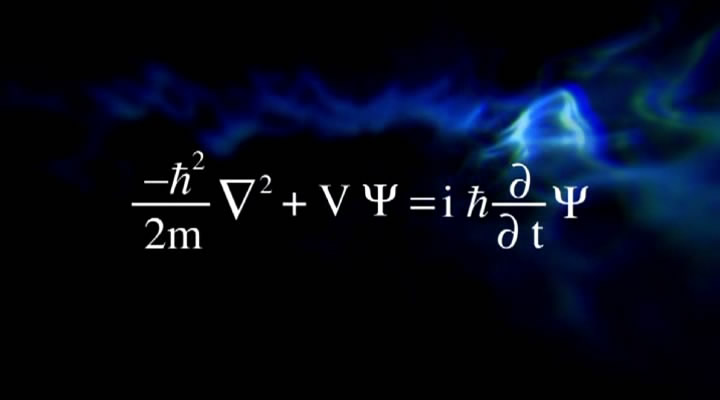
اعداد کوانتومی
شرودینگر با حل معادلاتش سه عدد را جهت توصیف الکترونهای یک اتم ارائه داد. این اعداد عبارتند از:
- n: عدد کوانتومی اصلی
- L: عدد کوانتومی فرعی یا اوربیتالی
- m: عدد کوانتومی مغناطیسی
- s: عدد کوانتومی مغناطیسی اسپینی
عدد کوانتومی اصلی یا n، نشان دهنده اندازه و انرژی اوربیتال است. منظور از اندازه اوربیتال، فاصله الکترونها از هسته اتم است. هرچه اندازه این عدد بیشتر باشد، اندازه و انرژی اوربیتال نیز بزرگتر خواهد بود. تمامی الکترونهایی که n آنها با هم برابر است، در فاصلهای یکسان از هسته اتم قرار میگیرند.
L یا عدد کوانتومی فرعی، نشاندهنده شکل اوربیتال است. یک لایه با عدد کوانتومی n میتواند از n-1 اوربیتال مختلف تشکیل شده باشد. شکلهای یک اوربیتال را با نمادهای نشان میدهند. برای نمونه L=۰ نشان دهنده اوربیتال s یا L=۱ اوربیتال p را نشان میدهد. تصویر ارائه شده، شکل اوربیتالهای مختلف را نمایش میدهد. لایه آخر الکترونی لایه ظرفیت اتم نام دارد که الکترونهای ظرفیت در آن قرار دارند.
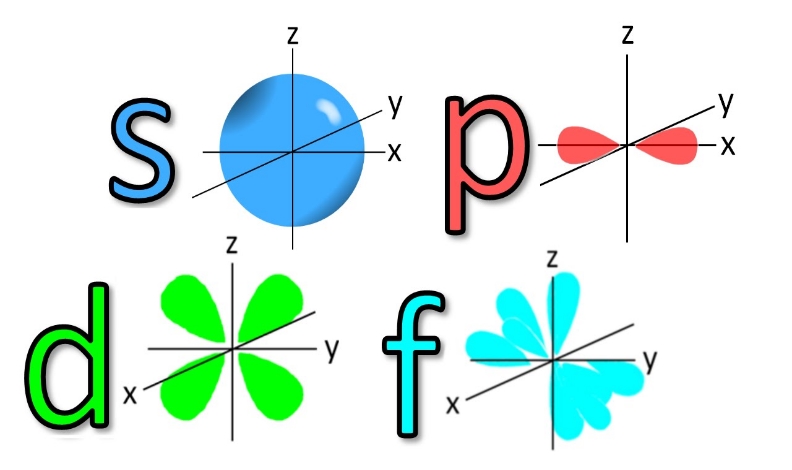
با توجه به شکل فوق، اوربیتال s کروی بوده و تنها به یک صورت میتواند در فضا قرار گیرد. اما مثلا اوربیتال p میتواند هم در راستای محور z و هم در راستای محور x جهتگیری کند. از این رو به عدد سومی تحت عنوان m یا عدد کوانتومی مغناطیسی نیازمندیم تا این جهتگیری اوربیتالها را نشان دهیم. بنابراین عدد m جهتگیری اوربیتال را در فضا نشان میدهد. عدد کوانتومی مغناطیسیِ یک اوربیتال، بین L- و L+ قرار دارد. برای نمونه اعداد کوانتومی مغناطیسی برای اوربیتال p که L مربوط با آن ۱ است، برابر با 1+,1,0- در نظر گرفته میشوند.
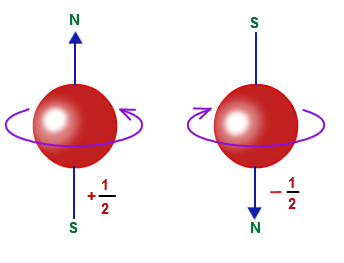
اگر الکترون را به صورت یک کره در نظر بگیریم، با استفاده از ۳ عدد معرفی شده در بالا میتواند جهت حرکت آن را در فضا مشخص کرد. اما این الکترون، به دور خودش نیز در حال چرخش است. این چرخش را با عدد کوانتومی اسپینی یا ms نشان میدهند. بنابراین یک الکترون میتواند تنها ساعتگرد (s=-1/2) و یا پادساعتگرد (s=+1/2) چرخش کند. در شکل زیر چرخش الکترون در این دو حالت نشان داده شده است.
اوربیتالها و الکترونها
همانطور که بیان شد هر اوربیتال دارای شکل مشخصی است که با توجه به اعداد کوانتومی معلوم میشوند. در ادامه اعداد کوانتومی مرتبط با هر اوبیتال و نحوه قرار گرفتن الکترونها در اوربیتالها را بیان خواهیم کرد.
شکل اوربیتال
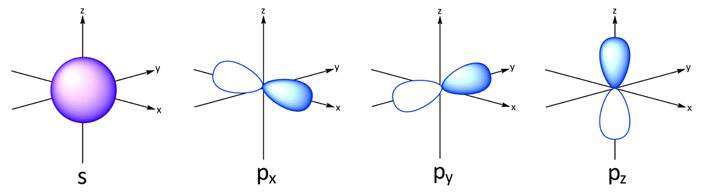
در هر لایه یا به عبارتی در هر n، تعداد n-1 اوربیتال متفاوت میتواند قرار گیرد. برای نمونه در لایه اول تنها اوربیتال l=0 یا همان اوربیتال کروی وجود دارد. در n=2 دو اوربیتالِ کرویِ (l=0) و دمبلی (l=1) میتوانند قرار گیرند. از طرفی اوربیتال کروی تنها به یک شکل میتواند در فضا قرار گیرد، از این رو m آن تنها برابر با ۰ میتواند باشد.
این در حالی است که اوربیتال دمبلی به ۳ شکل میتواند در فضا قرار گیرد، در نتیجه m=-1,0,+1 است. شکل زیر دو اوربیتال s و p را نشان میدهد.
به همین صورت اعداد هر اوربیتال معلوم میشوند. برای نمونه اوربیتال p (یا همان دمبلی) را در نظر بگیرید که در لایه سوم قرار گرفته است. برای این اوربیتال اعداد کوانتومی بهصورت زیر هستند.
- n=3
- m=-1,0,+1
- L=1
توجه داشته باشید که عدد کوانتومی اسپینی برای یک الکترون تعریف میشود، به همین دلیل این عدد در بالا ارائه نشده. اوربیتالهای با l=1 (اوربیتال p) به بالا دارای شکلهایی بسیار پیچیده هستند که بهصورت گوناگونی میتوانند در فضا قرار گیرند. در جدول زیر ترتیب لایهها و زیرلایهها (اوربیتالها) برای چهار لایه اول ارائه شده است.
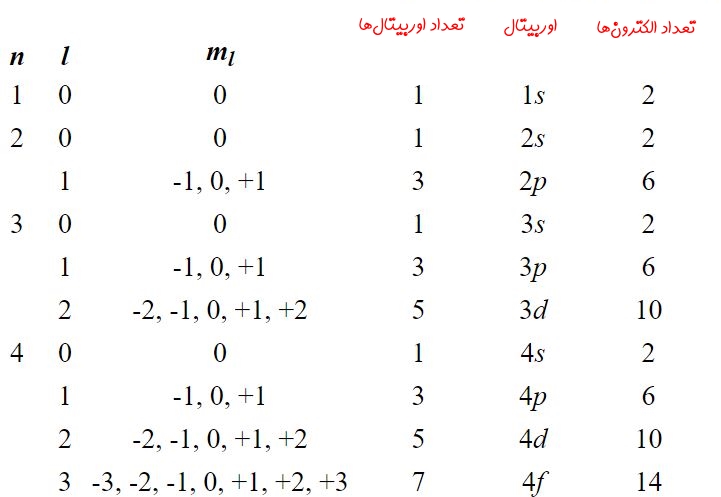
در جدول بالا ستونی تحت عنوان تعداد الکترونها وجود دارد. این ستون ظرفیت تعداد الکترونهای قرار گرفته در هر اوربیتال را نشان میدهد. برای نمونه اوربیتال p در سه جهت میتواند در فضا قرار گیرد. از طرفی در هرکدام از این حالات ۲ الکترون میتواند در اوربیتال مذکور وجود داشته باشد؛ بنابراین ظرفیت این اوربیتال برابر با ۶=۳×۲ است. البته ظرفیت هر اوربیتال با عدد L را میتوان با استفاده از فرمولِ نیز بدست آورد.
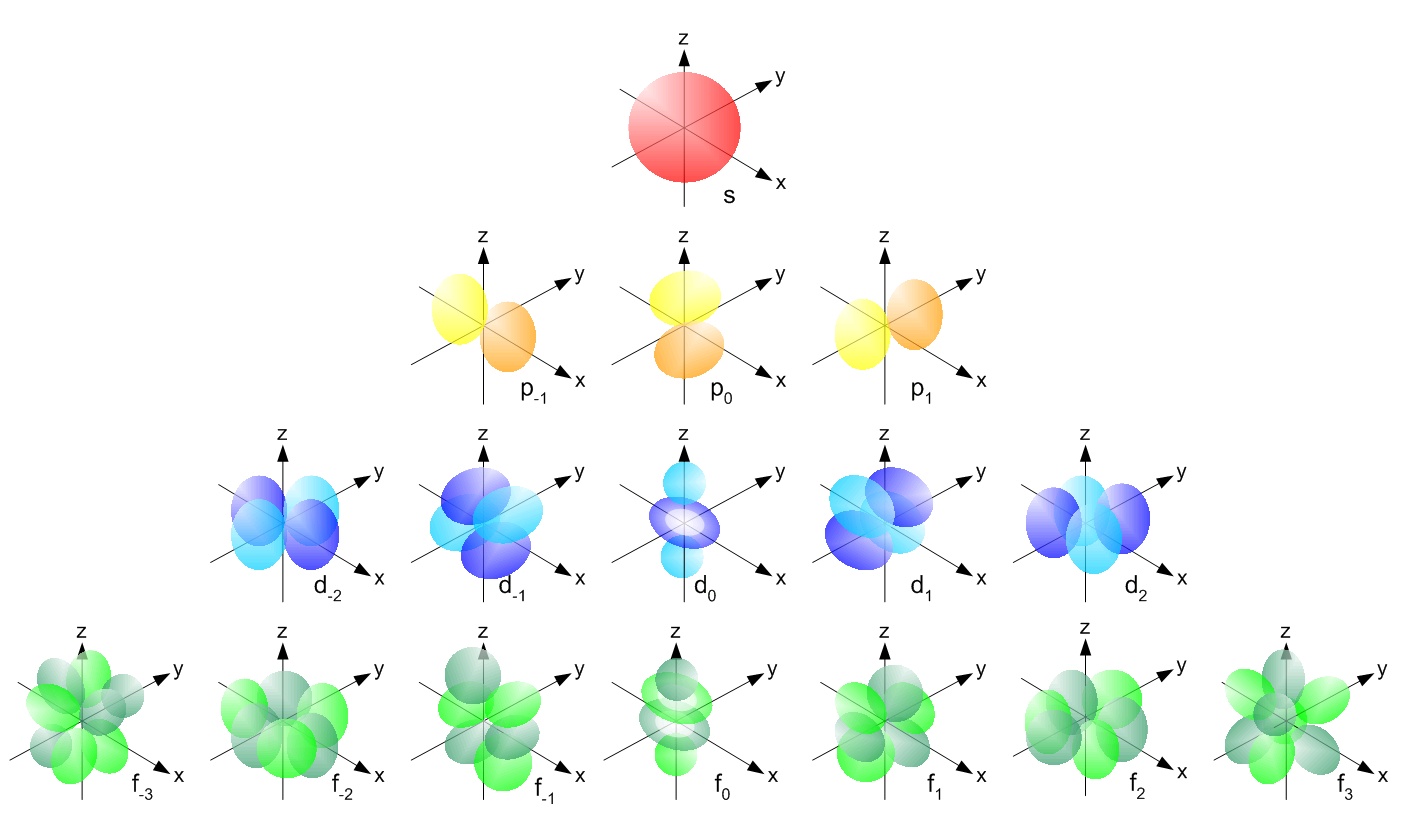
در تصویر زیر، شکل اوربیتالهای s,p,d,f نشان داده شده.
ترتیب قرار گرفتن الکترونها در اوربیتالها
الکترونهای یک اتم با نظم مشخصی در اوربیتالها قرار میگیرند. در ابتدا لایههای با انرژی کمتر توسط الکترونها پر شده و پس از آن لایههای دورتر توسط آنها اشغال میشوند. با استفاده از «اصل آفبا» (Aufbau Principle) میتوان ترتیب الکترونها را در پر کردن اوربیتالها معلوم کرد.
در این اصل در ابتدا لایه با n کمتر توسط الکترونها اشغال میشوند. همچنین در یک لایه، ابتدا اوربیتال با انرژی کمتر پر میشود. برای نمونه در لایه دوم هر دو اوربیتالِ p و s وجود دارند. اما با توجه به انرژی کمتر اوربیتال s، در ابتدا این اوربیتال پر میشود. اما گاهی اوربیتال p در لایهای پایینتر به نسبت اوربیتال s قرار دارد. به نظر شما در این حالت اولویت با شماره لایه یا شکل اوربیتال است؟ در این حالت لایهای زودتر پر میشود که:
- n+L برای آن کمتر باشد.
- اگر n+L برابر باشد، n کمتر، زودتر پر میشود.
بر اساس دو الگوی بالا، الکترونها بهترتیب در اوربیتالهای زیر قرار میگیرند:
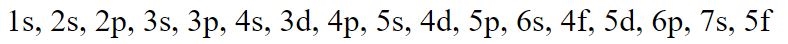
همانطور که در فرمول بالا میبینید در ابتدا شماره لایه و پس از آن حرف مربوط به زیرلایه (یا همان اوربیتال) نوشته میشود. البته بهمنظور به خاطر سپردنِ عبارت فوق میتوانید از تصویر زیر نیز استفاده کنید.
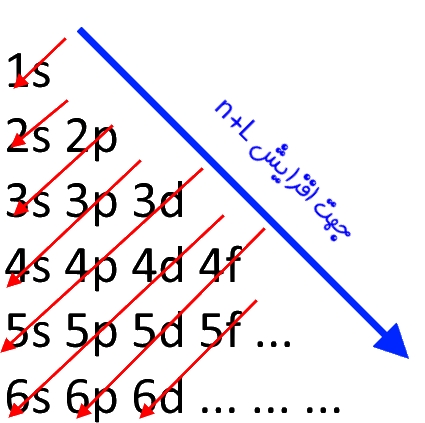
رسم آرایش الکترونی
همانطور که در بالا نیز بیان شد، هر اوربیتال میتواند الکترون را در خود نگه دارد. برای نوشتن آرایش الکترونی یک اتم میتوان بهترتیب پر شدن، اوربیتالها را نوشت. در بالای هر اوربیتال ظرفیت مربوط به آن نوشته میشود. در ادامه آرایش الکترونی چندین اتم برای نمونه ارائه شدهاند.
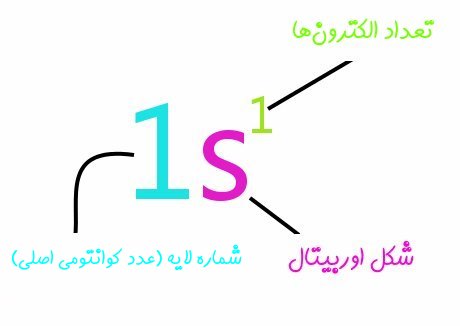
البته بعضی مواقع اوربیتالها را بهصورت مربع نشان میدهند. همچنین الکترونها را با فلشهایی نمایش میدهند که جهت آن، اسپین الکترون را نشان میدهد. جهت درک بهتر به مثالهای زیر توجه فرمایید. نمادهای استفاده شده در نوشتن آرایش الکترونی مطابق با الگوی زیر تعریف میشوند.
مثال ۱
آرایش الکترونی اتم لیتیوم به چه صورت است؟
همانطور که احتمالا میدانید عدد اتمی لیتیوم، ۳ در نتیجه مجموع الکترونهای اشغال شده در اوربیتالهایش نیز برابر با ۳ است؛ مطابق با اصل آفبا، آرایش الکترونی اتم لیتیوم بهصورت زیر خواهد بود.
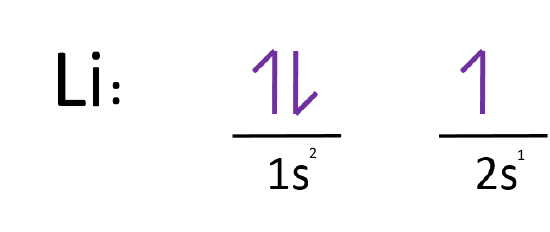
همانطور که میبینید در لایه اول اوربیتال s پر شده، اما در لایه دوم تنها یک الکترون در اوربیتال s قرار گرفته است. توجه داشته باشید که جهت بالا و پایین، جهت چرخش الکترون دور خودش -یا همان اسپین- را نشان میدهد.
مثال ۲
آرایش الکترونی اتم کربن به چه شکل است؟
عدد اتمی کربن برابر با ۶ است. در نتیجه مجموع الکترونهای موجود در اوربیتالها بایستی برابر با ۶ باشد. توجه داشته باشید که در ابتدا یک اوربیتال بایستی پر شده و سپس اوربیتال بعدی را پر کنید. در زیر آرایش الکترونی اتم کربن رسم شده.
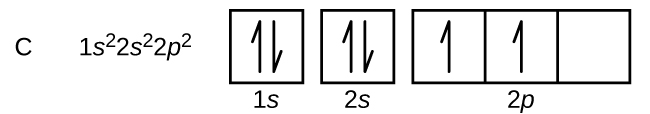
در آرایش بالا هر خانه نشان دهنده یک جهت از اوربیتال است. با توجه به اینکه اوربیتال p به ۳ شکل در فضا قرار میگیرد، بنابراین از سه خانه برای نشان دادن آن استفاده شده است. بهمنظور رسم فلشها، از چپ به راست در هر خانه یک فلش رو به بالا قرار داده و به همین شکل اوربیتال را پر کنید. مجموعِ کل فلشها بایستی برابر با عدد اتمی اتمِ مذکور باشد. پیشنهاد میکنیم چندین آرایش الکترونی را برای اتمهای مختلف نوشته و صحت آن با توجه به جدول زیر مورد بررسی قرار دهید.
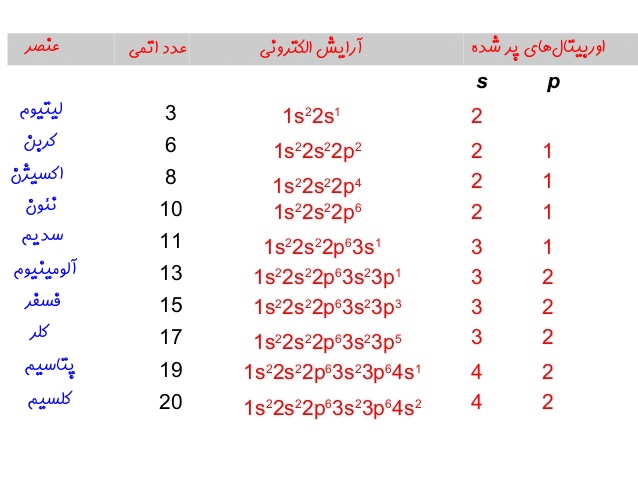
البته با توجه به پایدار بودن عناصر نجیب، میتوان با استفاده از آنها نیز آرایش الکترونی را بیان کرد. برای نمونه در زیر آرایش الکترونی اتم کربن بر اساس آرایش هلیوم ارائه شده است.
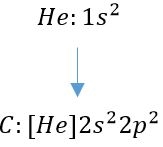
توجه داشته باشید که به منظور نوشتن آرایش الکترونی یونها، عدد اتمی برابر با تعداد الکترونها نیست. برای نمونه در زیر آرایش الکترونی اتم آهن (Fe) و در نتیجه یونِ آهن (2+Fe) ارائه شده است.
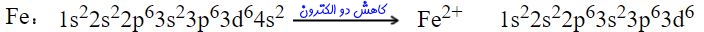
در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک و شیمی، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس فیزیک
- مجموعه آموزشهای فیزیک و ریاضی
- مجموعه آموزشهای دروس دبیرستان و پیشدانشگاهی
- عدد اتمی، جرمی و ایزوتوپ -- به زبان ساده
- پیوند شیمیایی — به زبان ساده
- مدل اتمی بور — به زبان ساده
آزمون اوربیتال و آرایش الکترونی
۱. کدام ویژگی مدل شرودینگر موجب شد این مدل برای بیان آرایش الکترونی دقیقتر از مدل بوهر باشد؟
امکان تشخیص تعداد دقیق لایههای اتمی
تاکید بر عدد کوانتومی اصلی n برای انرژی
توضیح حرکت الکترون به شکل سهبعدی و پیچیدهتر
تاکید بر اهمیت بار هسته در اتمهای چندالکترونی
دلیل برتری مدل شرودینگر نسبت به مدل بوهر در آرایش الکترونی، ارائه توصیف سهبعدی و دقیقتر برای حرکت الکترونها است. در این مدل، حرکت الکترون تنها به شکل مداری ساده در نظر گرفته نمیشود و تعداد بیشتری از ویژگیها مانند عدد کوانتومی و انواع اوربیتال به کار میروند تا توصیفی واقعیتر به دست آید.
۲. عدد کوانتومی L چگونه بر شکل اوربیتال تاثیر میگذارد و اگر مقدار L برابر با ۱ باشد، چه نوع اوربیتال ی خواهیم داشت؟
عدد L شکل اوربیتال را مشخص میکند و با مقدار ۱، اوربیتال p داریم.
عدد L انرژی اوربیتال را تعیین میکند و برای مقدار ۱، اوربیتال d خواهیم داشت.
عدد L تعیین کننده اندازه اوربیتال است و برای مقدار ۱، اوربیتال s خواهیم داشت.
عدد L فقط جهتگیری اوربیتال را مشخص میکند و مقدار ۱ به معنی اوربیتال f است.
عدد کوانتومی L بیانگر شکل اوربیتال در مدل کوانتومی است و زمانی که مقدار آن ۱ باشد، نوع اوربیتال به صورت p شناخته میشود.
۳. دو اوربیتال با n برابر ۲ و ۳ و مقدار L و تعداد الکترون برابر داریم. بر اساس اصل آفبا، کدام اوربیتال زودتر پر میشود و چرا؟
اوربیتال با n=۳ به دلیل تعداد الکترون بیشتر زودتر پر میشود.
اوربیتال با n=۳ چون در لایه خارجیتر است زودتر پر میشود.
اوربیتال با n=۲ به دلیل n کمتر زودتر پر میشود.
اوربیتال با n=۲ چون جمع n+L کمتر دارد زودتر پر میشود.
بر اساس اصل آفبا، ترتیب پر شدن اوربیتال ها توسط الکترون، ابتدا بر اساس جمع n+L تعیین میشود. وقتی مقدار L برای هر دو اوربیتال برابر باشد، n اوربیتال با n=۲ کمتر میماند و جمع n+L هم کمتر از مقدار آن برای n=۳ میشود. طبق توضیح اصل آفبا، هر اوربیتال با جمع n+L کمتر زودتر پر میشود.
۴. برای تعیین حداکثر تعداد الکترون مجاز در یک اوربیتال d بر اساس فرمول ظرفیت اوربیتال (۲(۲L+۱))، چه باید کرد؟
تنها مقدار m را جایگذاری کرده و در دو ضرب میکنیم.
مقدار L را یک واحد کمتر از n میگیریم و عدد را در سه ضرب میکنیم.
مقدار L برای d را ۲ قرار داده و در فرمول قرار میدهیم.
مقدار n را با مقدار m جمع زده و در دو ضرب میکنیم.
برای تعیین ظرفیت اوربیتال d باید مقدار L را که برای d برابر با ۲ است در فرمول ظرفیت جایگذاری کنیم. فرمول ۲(۲L+۱) به این معناست که ابتدا L یعنی ۲ را دو برابر کرده و با یک جمع میکنیم و سپس کل مقدار را در ۲ ضرب میکنیم. به این ترتیب ظرفیت اوربیتال d برابر با ۱۰ الکترون به دست میآید.













سلام
میخواستم بدونم الکترون ها در اوربیتال ها به چه صورت حرکت میکنند ؟؟
متشکرم از پاسخ شما
منشا انرژی اوربیتال چیه؟ همین ک میگن انرژی اوربیتال پیوندی پایین و ضد پیوندی بالاس منظور چه انرژی هست و دلیل این اختلاف چیه؟
دلیل پایین بودن انرژی اوربیتال های پیوندی همون طور که اسمش روشه درگیر پیوند اند پس۱. فضای بیشتری برای جابه جایی الکترون هست و ۲ حرکت دوتا الکترون مخالف همه همیشه (اسپین های مخالف) پس همو خنثی میکنن..
سطح متوسط انرژی اوربیتال های نا پیوندی به خاطر اینه که اون فضای اضافه نسبت به اوربیتال های پیوندی رو ندارن و فقط اسپین مخالف دارن .
انرژی بالای ضد پیوندی به خاطر اینه که دوتا لپ اوربیتال با این حال که خالی آن به هم فشار میارن و فضاش خیلی کمه
سلام میشه لطفا جواب این سوال رو بدهید ممنون
چهار کاربرد اصلی ضرایب اوربیتالهای اتمی که در تشکیل اوربیتال مولکولی نقش دارند ( از تئوری اوربیتال مولکولی ) را با مثال توضیح دهید
ممنونم از آقای عوض زاده خیلی عالی بود، همینکه وقت گذاشتن مطالب رو جمع آوری کردن قابل تقدیر هست. متشکرم
تو تیزهواشان هشتم اینا رو به ما گفتن بنزرم بخونی بهتره
من پایه نهمم.به نظر شما توی آزمون نمونه یا تیزهوشان اینا میاد؟یاد داشته باشم؟
ممنون از آقای عوض زاده
بسیار مفید بود.
ممنونم از آقای عوض زاده و سایت فرادرس
اقا دمتگرم مختصر و مفید بود
سلام خسته نباشید ، ببخشید من دنبال فیلم آموزشی جدول تناوبی که تو همین سایت بود هستم ولی نیستش کجا میتونم پیدا کنم ، خیلی نیاز دارم
با سلام؛
برخی از ویدیوها برای بهروزرسانی حذف شدند و به طور مجدد با کیفیت بهتر بارگذاری خواهند شد.
با تشکر از همراهی شما با مجله فرادرس
خیلی خیلی ممنونم از این سایت 🙂
بسیار عالی و جامع این مطلب علمی را ارائه دادید ……متشکرم و موفق باشید .
لطفا الکترون های ظرفیتی هم اضافه کنید
ببخشید زیرلایه p1 نیم پر حساب میشه؟ تو یه کتابی زیرلایه p1 رو نیم پر حساب کرده
بسیار عالیییی بود خداحفظتون کنه
آرایش الکترونی آهن با اصل آفبا مغایرت داره؟ آخه تو اصل آفبا گفتید لایه 4s زودتر ار 3d پر میشه. ولی آرایش الکترونی آهن برعکس نوشته شده
نه بابا کجا ازمون نمونه و تیزهوشان میاد اینا برای دانشگاهه
درسته 4sزودتر از 3d پر میشه ولی بیاد داشته باشین اگ بخاد الکترون از دست بده از دور ترین لایه خود الکترون از دست میده لایه ۴ از ۳ دورتره
با سلام؛
تصویر نوشته شده برای درک بهتر نحوه یونش آهن آورده شده است. در حقیقت بر اساس اصل آفبا، لایه 4s زودتر از 3d پر میشود. به هنگام یونش نیز این لایه زودتر از بقیه الکترون از دست میدهد. به طور معمول در کتابهای درسی، آرایش الکترونی آهن را به صورت زیر مینویسند:
1s22s22p63s23p64s23d6
اما در سایر منابع بویژه برای نمایش نحوه یونش، آرایش الکترونی را به صورت زیر مینویسند:
1s22s22p63s23p63d64s2
با تشکر از همراهی شما با مجله فرادرس
سلام
بسیار عالی و کامل ممنون از تدریس تان
من یک سوال داشتم: با استفاده از رسم آرایش الکترونی عنصر ها چجوری باید دوره و گروه عنصر را پیدا کرد ؟
با سلام یه سوال دارم:
اوربیتال با زیر لایه چه فرقی داره؟؟
سلام طبق آرایش برای fe۲۶ آرایش میشه 4s2 3d6, حالا برای +fe2 اون دو الکترون از 3d6 کم میشه یا 4s2?
سلام و وقت شما بهخیر؛
زمانی که اتم الکترون از دست میدهد تا تبدیل به یون شود، الکترونهای آن از بیرونیترین لایه از ساختار خارج میشوند. در این مورد دو الکترون 4S2 خارج میشوند و یون Fe2+ را به وجود میآورند. در صورتی که یون مورد نظر به صورت Fe3+ باشد، ۲ الکترون از 4S2 و ۱ الکترون از 3d6 خارج میشود. در زیر آرایش الکترونی عنصر آهن و یونهای متدوال آن را مشاهده میکنید.
Fe:1s22s22p63s23p64s23d6
Fe2+:1s22s22p63s23p63d6
Fe3+:1s22s22p63s23p63d5
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
فک کنم همون زیر لایه باشه مثل s,p,d,f
n+1در کدام زیر لایه برار 5است ؟
بیزحمت اینو جواب بدین
عالی بود ?
سلام کاملا عالی، فقط خواستم بدونم چرا تو اوربیتال مثلا s دو الکترون قرار میگیره؟
و اینکه اوربیتال ی فضاس و ما مکان احتمالی الکترون که احتمال حضورش بیشتره رو تعیین میکنیم و مثلا در اوربیتال p یاf که شکل سه بعدی خواستی دارن چجوریه؟ میشه با رسم شکل بزارین که الکترون مثلا کجاس ممنونم??
با سلام؛
برای پاسخ به این سوال باید با مکانیک کوانتومی آشنا باشید. همچنین بر اساس اصل طرد پائولی هر اوربیتال نمیتواند دو الکترون با چهار عدد کوانتومی مشابه داشته باشد و برای آشنایی بیشتر پیشنهاد میکنیم مطلب «مدل استاندارد ذرات — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
بي نظير بود خيلي ممنون??
واقن فوق العاده درس دادین این مطلبو و کامل یادگرفتم
دستتون درد نکنه واقن مرسی بابت زحماتی ک میکشید .
دمتون گرم
سر کلاس استاد که چیزی نفهمیدم. اما اینجا همه چیز رو متوجه شدم عالی.
لینک مطلب رو برای دوستام هم فرستادم
دستتون درد نکنه
به نام خدا
با سلام و عرض ادب و احترام
برای شما از خداوند متعال آرزوی موفقیت روزافزون دارم. بسیار ممنون، زحمت کشیدید و مطالب مفیدی ارائه دادید.
واقعا درسی ک اقای بهنام محمدیان میدن بهترین و عالیترینه و کاملا بی نقصه و من کلا درسو یاد میگیرم
ب امید موفقیت های بیشتررررررر …ممنونم ازتون
عالی بود،در هیچ کتابی اینقدر کامل و ساده توضیح داده نشده بود. سپاس از شما
خیلی عالی بود.
ممنونم
بعد از سال ها فاصله گرفتن از شیمی دبیرستان، این مطلب به خوبی، خیلی عالی، مطالب رو یادآوری کرد.
ممنون. خیلی خوب بود
خیلی عالی بود بعد از مدت ها یه تدریس خوب واسه این مبحث دیدم?
عالی ممنون واقعا خیلی خوب توضیح دادید. فقط اگه میشه توی اموزشاتتون ، انتهای هر اموزش فرمول ها و رابطه ها و مطالب خیلی مهم رو که توضیح داده شده رو یه جا مثلا توی جدول جمع کنین تا دسترسی بهش سریع تر و راحت تر بشه. مثل همون تقلب نامه هایی که منتشر میکنید. بازم ممنون با تشکر از سایت خوبتون.
با سلام. الان برای اوربیتال 2p طبق شکل هسته در کجای شکل قرار میگیره؟ چون از اونجایی که الکترون به دور هسته می چرخه باید یه شکل کروی داشته باشه و یه مقدار شکل ها غیر عادیه.
مرسی خیلی به من کمک کرد.
خوب ولی کاش با فیلم توضیح میدادید .
بسیار عالی ممنونم
خیلی عالی کامل و بی نقص
تشکرمیکنم ازمجله فرادرس