نام گذاری ترکیبات شیمیایی – از صفر تا صد
نام گذاری ترکیبات شیمیایی (Chemical Compounds Nomenclature) شامل استانداردها و قوانینی است که توسط آیوپاک برای درک و ارتباط آسانتر در نوشتارهای شیمی ایجاد شده است. به طور کلی ترکیبات در شیمی به دو دسته ترکیبات معدنی و آلی تقسیم میشوند. در این مطلب از مجله فرادرس با قواعد نام گذاری ترکیبات آلی و معدنی با مثالهای گوناگون بیشتر آشنا خواهید شد.
- میآموزید سیستم آیوپاک چیست و چگونه به تشخیص مواد شمیایی کمک میکند.
- با تعریف و نامگذاری ترکیبات یونی دوتایی و چندتایی آشنا میشوید.
- ساختار و نام یونهای چنداتمی مانند سولفوریک و نیتریک را مرور میکنید.
- نامگذاری ترکیبات کووالانسی و کوئوردیناسی را یاد میگیرید.
- با نامگذاری ترکیبات آلی و هیدروکربنها آشنا میشوید.
- با بررسی مثالها و تمرینهای این مطلب میتوانید به خوبی ترکیبات شیمیایی را نام گذاری کنید.


نام گذاری ترکیبات شیمیایی
نامگذاری ترکیبات شیمیایی روشی استاندارد برای مشخصکردن نوع و ترکیب مواد شیمیایی است تا دانشمندان در سراسر جهان زبان مشترک داشته باشند. این نامگذاری بر اساس قواعد مشخصی انجام میشود که نوع عنصرها، تعداد آنها و گاهی ساختار ترکیب را نشان میدهد.
تا زمانیکه تعداد کمی از ترکیبات شناخته شده بود و شیمی دانش جوانی بهشمار میآمد، به خاطر سپردن نام آنها کار دشواری به نظر نمیرسید. در گذشته، بیشتر نام ترکیبات از ظاهر فیزیکی، ویژگیها، منشأ یا کاربرد آنها گرفته میشد. نامهایی چون «شیر منیزی» (Milk of Magnesia)، گاز خنده، «سنگ آهک» (Limestone)، سود سوزآور نمونههایی از این نوع نام گذاریِ ترکیبات شیمیایی هستند. پیش از نام گذاری ترکیبات توسط آیوپاک، ترکیبات جدید با توجه به سلیقه کاشف آن نام گذاری میشد.
| نام رایج | رسمی | فرمول | ریشه نام |
| اوره | کربونیل دیآمید | کریستال جدا شده از ادرار | |
| استیک اسید | اتانوئیک اسید | گرفته شده از کلمه لاتین سرکه (acetum) | |
| مرفین | گرفته شده از مورفئوس، نام خدای یونان باستان | |
| کافئین | از واژه آلمانی Kaffebase به معنی بازِ قهوه |
تا به امروز بیش از 20 میلیون ترکیب شناخته شده وجود دارد. برای درک و ارتباط آسانتر در نوشتارهای شیمی، شیمیدانان سالها پیش قوانینی استاندارد برای نام گذاری ترکیبات شیمیایی به وجود آوردهاند که از سوی جامعه جهانی پذیرفته شده است. این سیستم روش مناسبی برای نام گذاری ترکیبات ارائه میدهد. پیش از شروع و توضیح نام گذاری ترکیبات شیمیایی، باید نام گذاری ترکیبات آلی و معدنی را تفکیک کنیم.

اعداد یونانی و رومی
در نام گذاری ترکیبات شیمیایی استفاده از اعداد یونانی و رومی به عنوان استاندارد رایج است.
| عدد | عدد رومی | عدد به یونانی |
| 1 | I | مونو |
| 2 | II | دی |
| 3 | III | تری |
| 4 | IV | تترا |
| 5 | V | پنتا |
| ۶ | VI | هگزا |
| 7 | VII | هپتا |
| 8 | VIII | اکتا |
| 9 | IX | نونا |
| 10 | X | دکا |
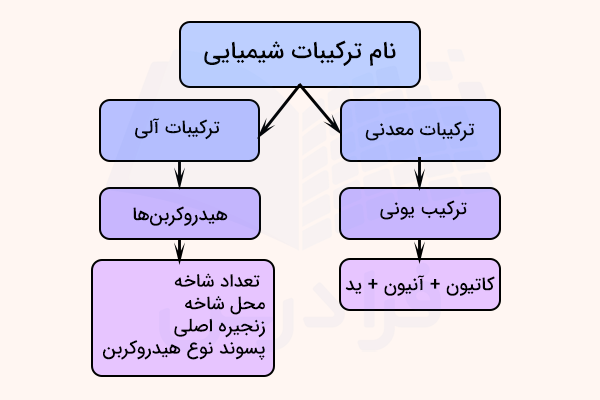
نام گذاری ترکیبات شیمیایی معدنی
«ترکیبات معدنی» (Inorganic Compound)، شامل تمام ترکیبات غیرآلی میشود. برخی ترکیبات که در ساختارشان کربن دارند مانند کربن مونوکسید ، کربن دیاکسید ، کربن دیسولفید ، ترکیبات حاوی گروه سیانید و گروهای کربنات و بیکربنات نیز جز ترکیبات معدنی در نظر گرفته شدهاند.
نام گذاری ترکیبات شیمیایی یونی
در پوسته زمین «ترکیبات یونی» (Ionic Compounds) بسیاری که بخشی از ترکیبات معدنی هستند وجود دارد. سنگ آهک که نوعی سنگ رسوبی است، خاکستر سودا ، که رسوب طبیعی و ژیپسیت که کانی است از جمله ترکیبات یونی هستند.
مواد یونی همچنین در مواد خوراکی و غذاهای ما نیز وجود دارند. سدیم کلرید () یا نمک خوراکی، کلسیم کربنات که به عنوان منبع کلسیم برای سلامت استخوان لازم است، پتاسیم کلرید ، که منبع پتاسیم برای تعادل مایعات در بدن و عملکرد عضلات است نمونههای مشهور از ترکیبات یونی در غذاهای ما هستند. پایداری ترکیبات یونی بهطور کلی بسیار زیاد است. دلیل پایداری این ترکیبات، جاذبه قوی بین کاتیونها و آنیونها در ترکیبات یونی است.

ترکیبات یونی از نظر بار خنثی هستند. از آنجایی که بسیاری از عناصر توانایی تشکیل تنها یک نوع یون با بار قابل پیشبینی را دارند، فرمول بسیاری از این ترکیبات با توجه به عناصر تشکیل دهنده آنها قابل نوشتن است.
برای نمونه در ترکیب سدیم و کلر باید فرمول آن باشد زیرا سدیم در واکنشها تنها کاتیون و کلر آنیون تشکیل میدهند و چون باید ترکیب خنثی باشد پس نسبتها در فرمول به صورت یک به یک خواهد بود یعنی به ازای هر یون سدیم تنها یک یون کلر وجود دارد. با این حال ترکیب عنصر کلسیم و کلر به صورت است زیرا کلر همیشه کاتیونهای و کلر همیشه آنیونهای را تشکیل میدهد و برای خنثی بودن ترکیب یونی مد نظر به ازای هر یون کاتیون کلسیم باید دو یون کلر در ترکیب قرار بگیرد.
به یاد داشته باشید که:
- ترکیبات یونی همیشه شامل یونهای مثبت و منفی هستند.
- در این ترکیبات مجموع بارهای مثبت و منفی باید برابر باشد.
- فرمول ترکیب یونی همیشه کوچکترین نسبت ممکن یونها را بیان میکند.

برخی ترکیبات یونی مانند (نمک خوراکی) و (جوش شیرین) نامهای رایجی دارند که با توجه به نوع شناخت ما از آنها به وجود آمدهاست. با این حال، شیمیٰدانان نامگذاری یکپارچه و قانونمندی را بنا نهاد اند که در صورت ندانستن نام یک ترکیب میتوان نام آن را از فرمول شیمیایی یا برعکس فرمول شیمیایی را از نام آن تعیین کرد.
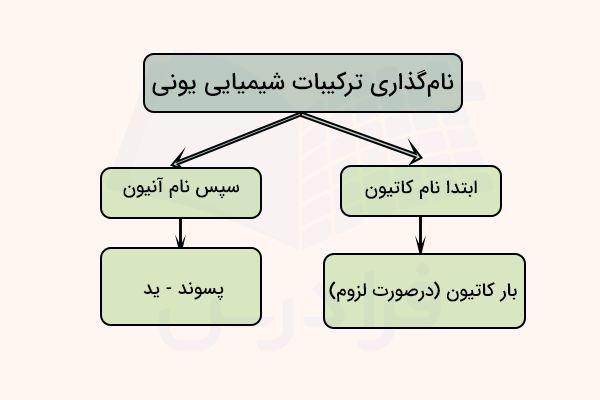
برای نام گذاری ترکیب یونی در ابتدا باید آن را تشخیص داد. ترکیبات یونی معمولاً از ترکیب فلزات و نافلزات تشکیل شدهاند. زمانی که یک فلز و چند نافلز را در یک ترکیب شیمیایی کنار هم در یک فرمول قرار بگیرند، میتوان فرض کرد که یک ترکیب یونی است. ترکیبات یونی بر اساس فلز موجود در ترکیب به دو نوع دستهبندی میشوند.
- نوع اول: در نوع اول، فلز موجود در ترکیب باری ثابت دارد و از ترکیبی به ترکیب دیگر بار آن تغییر نمیکند سدیم با بار نمونهای از این فلزات است که ترکیبات مختلف همیشه بار یکسانی دارد.
- نوع دوم: در نوع دوم، فلز موجود در ترکیب میتواند در ترکیبات بارهای متفاوتی داشته باشد. به عبارت دیگر فلز مورد نظر میتواند کاتیونهایی با بارهای متفاوت داشته باشد و بار آن باید برای ترکیب مورد نظر مشخص شود. برای مثال، برخی از فلزات گروه اصلی مانند سرب و قلع بیش از یک نوع کاتیون را تشکیل میدهند. بیشتر فلزات واسطه از این نوع هستند. هر چند در فلزات واسطه برخی عنصرها مانند روی و نقره در تمام ترکیبات خود کاتیونهایی با بار یکسان تشکیل میدهند.
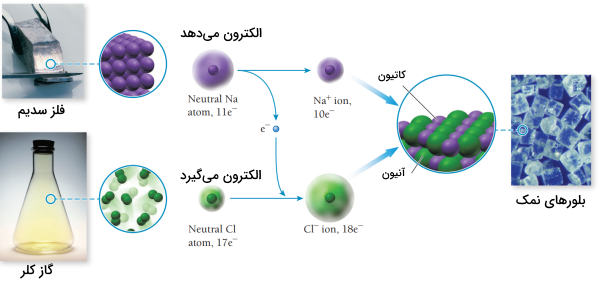
به اتم یا گروهی از اتمها که بار مثبت یا منفی داشته باشند یون گفته میشود. در واکنشهای شیمیایی، تعداد پروتونها که ذراتی بار مثبت هستند ثابت میماند اما اتمها یا ترکیبات با گرفتن الکترون به آنیون که ترکیباتی با بار منفی هستند یا با از دست دادن الکترون به کاتیون که ترکیباتی با بار مثبت هستند تبدیل میشوند.
برای مثال اتم سدیم با از دست دادن یک الکترون به کاتیون سدیم تبدیل میشود و با نمایش داده میشود. همینطور کلر با گرفتن یک الکترون به یون کلرید تبدیل میشود.
ترکیباتی که از کاتیونها و آنیونها به وجود میآیند ترکیبات یونی نامیده میشوند. نمک خوراکی یا سدیم کلرید نمونهای شناخته شده از ترکیباتی یونی است که در زندگی روزمره بهطور مرتب با آن سر و کار داریم.
برخی اتمها میتوانند بیش از یک الکترون بگیرند یا از دست بدهند. یونهایی مانند ، ، و نمونههایی از این دست اتمها هستند. به چنین یونهایی که تنها از یک اتم تشکیل شدهاند یونهای تک اتمی میگویند. در جدول زیر میتوانید برخی از یونهای تک اتمی را مشاهده کنید. بهطور کلی به جز چند مورد استثنا، عناصر فلزی با از دست الکترون، کاتیونها را ایجاد میکنند. نافلزات تمایل بیشتری برای دریافت الکترون دارند و به آنیون تبدیل میشوند.
ترکیب واکنشپذیرترین فلزات (سبز) و واکنشپذیرترین نافلزات (آبی) ترکیبات یونی را تشکیل میدهند.
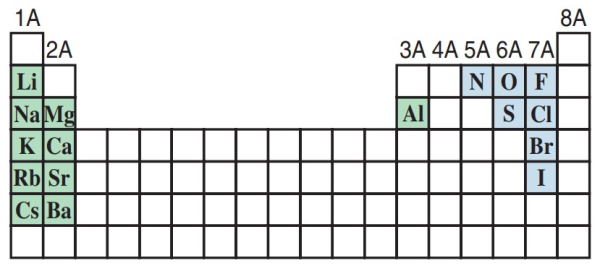
در شکل زیر یونهای تک اتمی بر اساس جایگاهی که در جدول تناوبی دارند مرتب شدهاند. باید توجه داشته باشید که از دو اتم تشکیل شده است.

کاتیون ها
نام کاتیونهای فلزی از نام عنصر سازنده آن گرفته شده است. در بین کاتیونها، یون آمونیوم از این اصل پیروی نمیکند.
| یون + نام عنصر | ||
| کاتیون | عنصر | نام کاتیون |
| سدیم | یون سدیم | |
| پتاسیم | یون پتاسیم | |
| منیزیم | یون منیزیم | |
| آلومینیوم | یون آلومینیوم | |
نام گذاری ترکیبات یونی دوتایی
ترکیبات یونی که تنها از دو عنصر ایجاد شدهاند «ترکیبات دوتایی» (Binary Compounds) نام دارند. نام گذاری در ترکیبات دوتایی به طریق زیر انجام میشود. ابتدا نام عنصر کاتیون فلزی و سپس نام آنیون نافلزی آورده میشود. در این ترکیبات نام آنیون با افزودن پسوند «ید» به نام عنصر ساخته میشود.
| نام عنصر کاتیون + نام عنصر آنیون + ید | |
| ترکیب | نام |
| سدیم کلرید | |
| پتاسیم برمید | |
| روی یدید | |
| آلومینیوم اکسید | |
| کلسیم برمید | |
| لیتیم یدید | |
| آلومینیم نیترید | |
در جدول زیر نام برخی از آنیونهای رایج قرار دارد که نام گذاری آنها با استفاده از پسوند «ید» صورت گرفته و با توجه به موقعیی که در جدول تناوبی دارند فهرست شده است.
| گروه 14 | گروه 15 | گروه 1۶ | گروه 17 |
|---|---|---|---|
| C - کاربید | N - نیترید | O – اکسید | F – فلورید |
| Si – سیلیسید | P - فسفید | S – سولفید | Cl – کلرید |
| Se - سلنید | Br – برمید | ||
| Te- تلورید | I - یدید |
توضیح: برای آنیون نیز از واژه کاربید استفاده میشود.
نام پایه برخی از رایجترین نافلزات و بارهای آنها در ترکیبات یونی در جدول زیر آورده شده است.
| نافلز | نماد یون | نام پایه | آنیون |
|---|---|---|---|
| فلوئور | fluor | فلورید | |
| کلر | chlor | کلرید | |
| برم | brom | برمید | |
| ید | iod | یدید | |
| اکسیژن | ox | اکسید | |
| گوگرد | sulf | سولفید | |
| نیتروژن | nitr | نیترید | |
| فسفر | phosph | فسفید |
ترکیبات یونی دوتایی حاوی فلزی که بیش از یک نوع کاتیون تشکیل میدهند.
برخی از فلزات واسطه مانند آهن، مس، نیکل، کبالت، کروم و منگنز میتوانند بیشتر از یک کاتیون تشکیل دهند. در چنین مواردی برای نام گذاری ترکیبات از اعداد رومی برای مشخص کردن کاتیون استفاده میشود. این روش به عنوان «سیستم استاک» (Stock System) شناخته میشود.
آهن دو کاتیون و دارد. بهطور سنتی به کاتیونی که بار مثبت کمتری دارد پسوند «اوس» (ous) و کاتیونی که بار بیشتری دارد پیوند «یک» (ic) افزوده میشود.
| یون فروس (ferrous ion) | |
| یون فریک (ferric ion) |
ترکیباتی که یون آهن با کلر میسازد به این ترتیب است:
| فروس کلرید (ferrous chloride) | |
| فریک کلرید (ferric chloride) |
برخی از محدودیتهای نام گذاری با استفاده از پسوند «اوس» (ous) و «یک» (ic) عبارتند از:
- پسوندها اطلاعاتی در مورد بارهای واقعی کاتیونها نمیدهد؛ مثلاً پسوند «یک» (ic) برای آهن به و برای مس به اشاره میکند.
فریک:
کوپریک:
- از این روش نام گذاری تنها میتوانستند برای دو کاتیون یک عنصر استفاده کنند. در حالیکه برخی از عناصر بیش از دو کاتیون تشکیل میدهند.
به دلیل وجود چنین محدودیتهایی استفاده از اعداد رومی در نام گذاری ترکیبات شیمیایی رایج شد. در این روش نام گذاری به ازای هر بار مثبت از عدد رومی متناظر با آن استفاده میکنند.
نام کاتیون + (بار کاتیون به شکل عدد رومی داخل پرانتز) + نام آنیون + ید
برای مثال کاتیونهای عنصر منگنز با روش نام گذاری اعداد یونی به صورت زیر انجام میشود. که به ترتیب به صورت منگنز دو اکسید، منگنز سه اکسید، منگنز چهار اکسید خوانده میشوند.
| کاتیون | فرمول | نام ترکیب |
| منگنز (II) اکسید | ||
| منگنز (III) اکسید | ||
| منگنز (IV) اکسید |
به همین ترتیب نام ترکیبات یون آهن با کلر که پیشتر فروس کلرید و فریک کلرید نام داشتند به ترتیب آهن دو کلرید و آهن سه کلرید خوانده میشوند.
| کاتیون | فرمول | نام ترکیب |
| آهن (II) کلرید | ||
| آهن (III) کلرید |
در جدول زیر نام برخی از فلزات که بیش از یک کاتیون تشکیل میدهند آورده شده است تا بیشتر با چنین فلزاتی آشنا شوید.
| فلز | یون | نام |
| کروم | کروم (II) | |
| کروم (III) | ||
| آهن | آهن (II) | |
| آهن (III) | ||
| کبالت | کبالت (II) | |
| کبالت (III) | ||
| مس | مس (I) | |
| مس (II) | ||
| قلع | قلع (II) | |
| قلع (IV) | ||
| جیوه | جیوه (I) | |
| جیوه (II) | ||
| سرب | سرب (II) | |
| سرب (IV) | ||
| بیسموت | بیسموت (III) | |
| بیسموت (V) | ||
| طلا | طلا (I) | |
| طلا (III) | ||
| نیکل | نیکل (II) | |
| نیکل (III) | ||
| منگنز | منگنز (II) | |
| منگنز (III) |
ترکیبات سه تایی
از پسوند «-ید» برای نام گذاری گروهای آنیونی مانند هیدروکسید و سیانید نیز استفاده میشود؛ بنابراین ترکیبات و به ترتیب لیتیم هیدروکسید و پتاسیم سیانید نامیده میشوند. به چنین ترکیباتی که از سه عنصر تشکیل میشوند «ترکیبات سهتایی» (Ternary Compounds) میگویند.
در جدول زیر نام برخی از رایجترین کاتیونها و آنیونها فهرست شده است.
| کاتیون | فرمول | آنیون | فرمول |
|---|---|---|---|
| آلومینیوم | برمید | ||
| آمونیوم | کربنات | ||
| باریم | کلرات | ||
| کادمیم | کلرید | ||
| کلسیم | کرومات | ||
| سزیم | سیانید | ||
| کروم (III) | دی کرومات | ||
| کبالت (II) | دی هیدروژن فسفات | ||
| مس (I) | فلورید | ||
| مس (II) | هیدرید | ||
| هیدروژن | هیدروژن کربنات | ||
| آهن (II) | هیدروژن فسفات | ||
| آهن (III) | هیدروژن سولفات | ||
| سرب (II) | هیدروکسید | ||
| لیتیم | یدید | ||
| منیزیم | نیترات | ||
| منگنز (II) | نیترید | ||
| جیوه (I) | نیتریت | ||
| جیوه (II) | اکسید | ||
| پتاسیم | پرمنگنات | ||
| روبیدیم | پراکسید | ||
| نقره | فسفات | ||
| سدیم | سولفات | ||
| استرانسیم | سولفید | ||
| قلع (II) | سولفیت | ||
| روی | تیوسیانات |
توضیح: همانطور که در جدول نیز آمده است، جیوه (I)، به صورت جفت یون است!
ترکیبات یونی چند اتمی
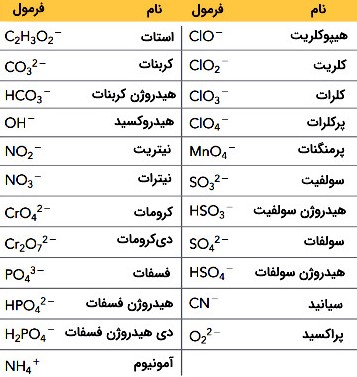
یونها همین چنین میتواند نتیجه ترکیب چند اتم باشند. یونهایی مانند (یون هیدروکسید)، (یون سیانید) و (یون آمونیوم) که بیش از یک اتم دارند «یونهای چند اتمی» (Polyatomic Ions) نام دارند.
در جدول زیر یونهای چند اتمی رایج همراه با فرمول آنها فهرست شده اند. به عنوان مثال، با توجه به کاتیون (سدیم) و آنیون چند اتمی آن، (نیتریت) سدیم نیتریت نام گذاری شده است.
به همین ترتیب ترکیب و آهن به صورت این نوشته میشود به دلیل خنثی بودن ترکیب یونی و اینکه در این ترکیب بار سولفات است پس در نام گذاری کاتیون آهن خواهیم داشت.
: آهن (II) سولفات
اگر ترکیب یونی از یک کاتیون و آنیون چند اتمی تشکیل شده باشد برای نام گذاری از نام هر دو یون استفاده میشود. به عنوان مثال ترکیب و که هر دو یونهای چند اتمی هستند به صورت زیر نوشته میشود.
: آمونیوم نیترات
با توجه به جدول یونهای چند اتمی باید بتوانید در فرمول شیمیایی ترکیبات این یونها را تشخیص دهید. بیشتر یونهای چند اتمی را «اکسیآنیونها» (Oxyanions) شامل میشوند. اکسیآنیونها، آنیونهای حاوی اکسیژن و یک عنصر دیگر هستند. در این دسته از ترکیبات برخی از یونهای چند اتمی همسان بر اساس تعداد اکسیژن نام گذاری میشوند.
اگر در ترکیبهای همسان، یونی که اکسیژن بیشتری دارد پسوند «ات» (-ate) و یونی که تعداد کمتری اکسیژن دارد پسوند «یت» (-ite) میگیرد.
برای مثال ترکیب نیتروژن و اکسیژن در یونهای چند اتمی به شکلهای و است. پس خواهیم داشت:
: تعداد اکسیژن بیشتری دارد پس نیترات نوشته میشود.
: تعداد اکسیژن کمتری دارد پس نیتریت نوشته میشود.
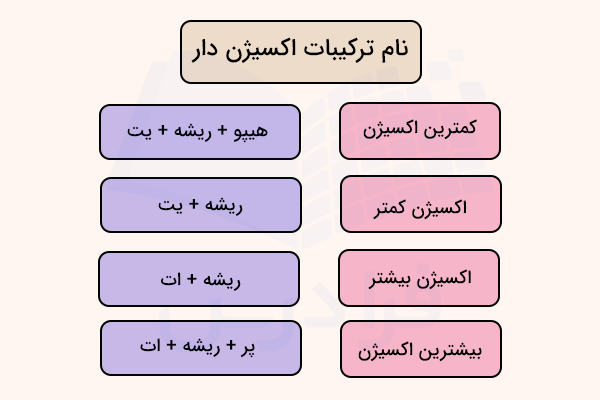
برای یونهایی که تعداد بیشتر یا کمتری اکسیژن در ترکیب خود دارند از پیشوندهای «هیپو» (hypo-) به معنی کمتر از، و «پر» (per-) به معنای بیش از، استفاده میشود. برای مثال ترکیب کلر و اکسیژن یونهای چند اتمی زیر را تشکیل میدهند.
: هیپوکلریت
: کلریت
: کلرات
: پرکلرات
در جدول فرمول و نام برخی از ترکیبات یونی که شامل یونهای چند اتمی هستند و همچنین کاربرد آنها در پزشکی و صنعت فهرست شده است.
| فرمول | نام | کاربرد پزشکی |
| آلومینیوم فسفات | ضداسید | |
| آلومینیوم سولفات | ضدتعریق، ضدعفونت | |
| باریم سولفات | ماده کنتراست زا در X-rays | |
| کلسیم کربنات | ضداسید و مکمل غذایی | |
| کلسیم فسفات | مکمل غذایی کلسیم | |
| کلسیم سولفات | گچ گیری | |
| منیزیم سولفات | کنترل سطح پایین منیزیم خون | |
| پتاسیم کربنات | قلیایی کننده، ادرارآور | |
| نقره نیترات | ضدعفونی موضعی | |
| سدیم بی کربنات | ضداسید معده | |
| روی فسفات | ماده پرکننده دندان |
مثال نام گذاری ترکیبات یونی
مثال1: نام ترکیبهای زیر را مشخص کنید.
الف:
ب:
پ:
باید توجه داشته باشید که موردهای الف و ب ترکیبی از فلز و نافلز هستند پس می توانیم نتیجه بگیریم که ترکیبی یونی هستند. اما ترکیب سوم هیچ عنصر فلزی ندارد اما گروه آمونیوم در این ترکیب نقش کاتیون را دارد و این ترکیب نیز ترکیبی یونی به شمار میآید.
الف: یون نیترات یک بار منفی دارد، بنابراین یون مس باید دو بار مثبت داشته باشد تا ترکیبی خنثی داشته باشیم. با توجه به اینکه مس میتواند و بار داشته باشد پس خواهیم داشت.
: مس (II) نیترات
ب: در این ترکیب کاتیون یون پتاسیم و آنیون یون چند اتمی دیهیدروژن فسفات است. چون پتاسیم تنها یون را ایجاد میکند نیازی به آوردن (I) در نام ترکیب نیست.
: پتاسیم دیهیدروژن فسفات
پ: این ترکیب از دو یون چند اتمی تشکیل شده است که در آن یون آمونیوم نقش کاتیون و کلرات نقش آنیون را دارد.
: آمونیوم کلرات
مثال2: فرمولهای شیمیایی ترکیبات زیر را بنویسید.
| الف | ب | پ |
| جیوه (I) نیتریت | سزیم سولفید | کلسیم فسفات |
در پرسشهایی که نام ترکیبات را میدهند و فرمول ترکیب از شما خواسته میشود باید به اعداد رومی داخل پرانتز توجه کنید و بار عنصر مورد نظر را به دست آورید.
الف:
عدد رومی در نام ترکیب نشان دهنده این است که جیوه بار دارد. با اینحا باید توجه کنید که جیوه (I) یونی دو اتمی به صورت است و یون نیترات نیز به صورت است.
جیوه (I) نیتریت:
ب: سزیم در گروه اول (1A) جدول تناوبی قرار دارد و هر یون سزیم تنها یک ایجاد میکند و گوگرد دارد.
سزیم سولفید:
پ: در کلسیم فسفات، هر یون کلسیم و یون فسفات دارد. ترکیب باید از نظر بار خنثی باشد، پس باید مجموع بارهای مثبت و منفی برابر با صفر شوند.
پس فرمول ترکیب برابر است با:
کلسیم فسفات:
مثال3: ترکیب کروم و برم با فرمول شیمیایی چه نام دارد؟
پاسخ: در ، بار کروم باید باشد تا ترکیب با سه آنیون ترکیبی خنثی شود. نام کروم به صورت کروم (III) و نام کامل ترکیب به صورت زیر نوشته میشود.
: کروم (III) برمید
مثال4: ترکیب کربن و اکسیژن به صورت چه نام دارد؟
پاسخ: در این ترکیب بار مس باید باشد تا با بار ترکیبی خنثی بسازد. بنابراین نام کاتیون، مس (II) خواهد شد و و نام کامل ترکیب به صورت زیر نوشته میشود.
: مس (II) اکسید
مثال 5: ترکیبی با فرمول شیمیایی چه نام دارد؟
پاسخ: با توجه به فرمول شیمیایی کاتیون موجود در ترکیب، عنصر لیتیم است که با یون چند اتمی دیکرومات ترکیب شده است. نام کامل ترکیب به صورت زیر نوشته میشود.
: لیتیم دیکرومات

نام گذاری ترکیبات مولکولی
ترکیبات مولکولی بر خلاف ترکیبات یونی که از شبکه منظمی از یونها ساخته شدهاند، واحدهای مجزایی دارند که معمولاً از عنصرهای نافلزی ساخته میشوند. ترکیبات مولکولی، بیشتر به شکل ترکیبات دوتایی هستند و مانند ترکیبات یونی دوتایی نام گذاری میشوند. ابتدا نام عنصر اول میآید و پسوند «ید» (ide) به نام عنصر دوم افزوده میشود.
| نام عنصر اول + نام عنصر + ید | |
| فرمول | نام |
| هیدروژن کلرید | |
| هیدروژن برمید | |
| سیلیسیم کاربید | |
زمانی که دو عنصر یکسان، ترکیبات متفاوتی تشکیل میدهند برای رفع ابهام از اعداد یونانی برای نشان دادن تعداد عنصرها استفاده میشود.
| تعداد+نام عنصر اول + تعداد + نام عنصر + ید | |
| فرمول | نام |
| کربن مونوکسید | |
| کربن دیاکسید | |
| گوگرد دیاکسید | |
| گوگرد تریاکسید | |
| نیتروژن دیاکسید | |
| دینیتروژن تتراکسید | |
در نام گذاری ترکیباتی که دارای پیشوندِ تعداد هستند به موارد زیر توجه کنید:
- پیشوند «مونو» برای عنصر اول به کار نمیرود و حذف میشود. برای نمونه هنگام نام گذاری ترکیب ، مونو فسفر تریکلرید اشتباه است و باید فسفر تریکلرید نامیده شود. وقتی پیشوندی برای عنصر اول نوشته نمیشود به این معنی است که از آن عنصر در ترکیب تنها یک عدد وجود دارد.
- گاهی اوقات، در نام گذاری اکسیدها حرف «آ» (a) از انتها پیشوند حذف میشود. برای مثال در حرف انتهای تترا حذف میشود و به جای تترااکسید، تتراکسید نوشته میشود.
استثناها
نام برخی از ترکیبات حاوی هیدروژن با این سیستم نام گذاری همخوانی ندارد یا حتی اشارهای به هیدروژن هم نمیکنند و نام رایج آنها استفاده میشود. این بی نظمی حتی در نوشتن فرمول برخی از این ترکیبات نیز وجود دارد؛ مثلاً در آب و هیدروژن سولفید ابتدا نوشته شده در حالیکه در سایر ترکیبات چنین نیست!
| فرمول | نام |
| دیبوران | |
| متان | |
| سیلان | |
| آمونیاک | |
| فسفین | |
| آب | |
| هیدروژن سولفید |
نوشتن فرمول مولکولی
اگر نام ترکیبی مولکولی را داشته باشیم و بخواهیم فرمول آن را بنویسم به سادگی انجام میشود و کار دشوار نیست؛ مثلاً در ترکیب مولکولی آرسنیک تریفلوئورید مشخص است که این ترکیب یک اتم آرسنیک و سه اتم فلوئور دارد و با توجه به ترتیب نام گذاری آرسنیک عنصر اول و فلوئور عنصر دوم خواهد بود در نتیجه فرمول آن به صورت نوشته میشود.
ترکیبات کووالانسی
ترکیب کووالانسی، ترکیباتی مولکولی هستند که عنصرهای تشکیلدهنده آن از طریق پیوند کووالانسی با هم پیوند دارند. نام گذاری ترکیبات کووالانسی نیز به روش نام گذاری ترکیبات مولکولی انجام میشود.
مثال نام گذاری ترکیبات مولکولی
مثال اول: نام ترکیبات زیر را بنویسید.
| فرمول | نام |
| سدیم سولفات | |
| پتاسیم دی هیدروژن فسفات | |
| آهن (III) نیترات | |
| منگنز (II) هیدروکسید | |
| سدیم سولفیت | |
| سدیم کربنات | |
| فسفر پنتاکلرید | |
| فسفر تریکلرید | |
| گوگرد دی اکسید | |
| تترا فسفر دکااکسید | |
| نیوبیم (V) اکسید | |
| لیتیم پراکسید | |
| تیتانیوم (IV) نیترات | |
| کربن تترابرومید | |
| کبالت (II) فسفات | |
| منیزیم کلرید | |
| نیکل (II) استات | |
| کلسیم نیترات |
مثال دوم: فرمول ترکیباتی با نامهای زیر را بنویسید.
| نام | فرمول |
| سدیم هیدروژن کربنات | |
| سزیم پرکلرات | |
| سدیم هیپوکلریت | |
| سدیم سلنات | |
| پتاسیم برمات | |
| گوگرد هگزا فلوراید | |
| گوگرد تری اکسید | |
| کربن دی اکسید | |
| وانادیم (V) فلوراید | |
| دی اکسیژن دی فلوراید | |
| روبیدیم پراکسید | |
| گالیوم اکسید |
نام گذاری ترکیبات کوئوردیناسی
فلزات واسطه تمایل به تشکیل یون کمپلکس دارند. یون کمپلکس از یک یون فلزی که در مرکز قرار دارد و به چند لیگاند متصل است تشکیل شده است. لیگاند ، دهنده جفتالکترون است که با فلز پیوند ایجاد می کند. ترکیب یون کمپلکس با یک یا چند یون با بار مخالف ترکیب خنثی ایجاد می کند که ترکیب کوئوردیناسیون نام دارد.
ترکیب نشان داده شده در زیر با فرمول ترکیب کوئوردیناسیونی است. یون کمپلکس حاوی یک یون فلزی مرکزی متصل به یک یا چند لیگاند است.
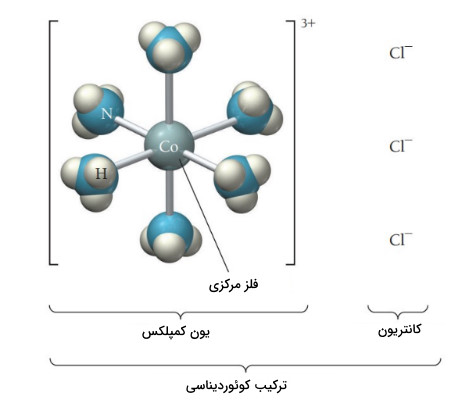
در سال 1893، آلفرد ورنر پیشنهاد کرد که یون فلزی مرکزی دو نوع برهمکنش دارد.
- ظرفیت اولیه: حالت اکسیداسیون روی اتم فلز مرکزی
- ظرفیت ثانویه: تعداد مولکولها یا یونهایی است که مستقیماً به اتم فلز متصل میشوند و با نام عدد کوئوردیناسیون شناخته میشود.
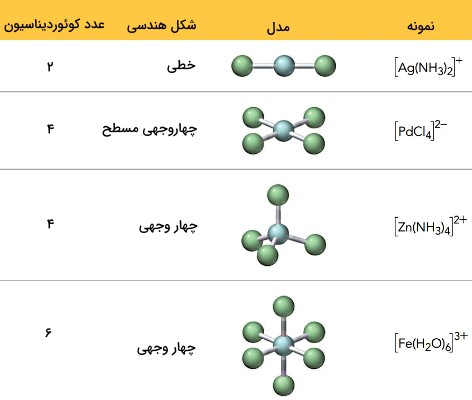
مثلا در ظرفیت اولیه 3+ و عدد کوئوردیناسیون که تعداد مولکولهای آمونیاک است که مستقیما به اتم مرکزی متصل میشوند برابر با ۶ است. اعداد کوئوردینانسی میتواند دربازه 2تا12باشد . رایج ترین اعداد کوئوردینانسی 6 و 4 هستند.
- : عدد کوئوردیناسیون ۶ دارد.
- : عدد کوئوردیناسیون 4 دارد.
تعدادی از رایجترین لیگاندها در جدول زیر فهرست شدهاند.
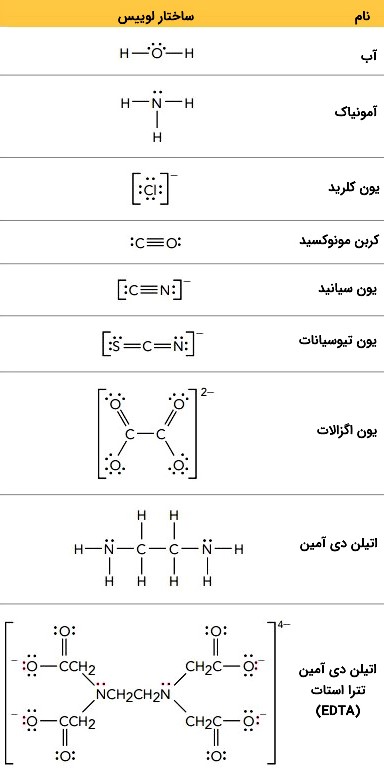
انواع لیگاند
- لیگاند تکدندانه: لیگاندهایی که فقط یک جفتالکترون به فلز مرکزی میدهند.
- لیگاندهای دودندانه: لیگاندهایی که دو جفتالکترون به فلز مرکزی میدهند.
- لیگاندهای چنددندانه: لیگاندهایی که بیش از دو جفتالکترون به فلز مرکزی میدهند. رایج ترین لیگاند پلی دندانه یون «اتیلن دی آمین تترا استات» (Ethylenediaminetetraacetate | EDTA) است.
در شکل زیر لیگاند «اتیلن دیامین» (Ethylenediamine) که به متصل است لیگاندی دو دندانه و لیگاند چنددندانه است.
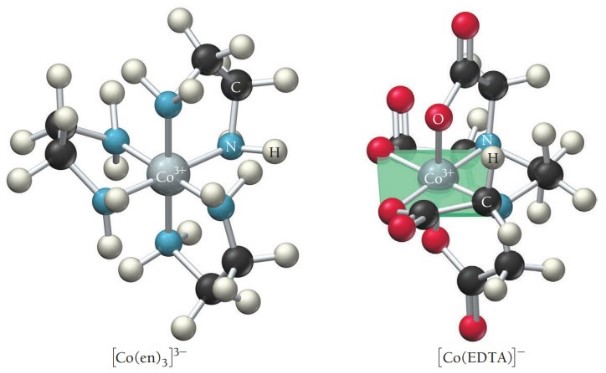
لیگاند EDTA کاملاً پیرامون فلز پوشش می دهد و شش جفتالکترون با فلزی مرکزی به اشتراک می گذارد. به یونهای کمپلکس حاوی لیگاند دو دندانه یا چند دندانه کیلیت (chelate | key-late) می گویند.
شکل فضایی یونهای کمپلکس تا حدی به عدد کوئوردینانسی آنها بستگی دارد. عدد کوئوردینانسی 2، هندسه خطی و عدد کوئوردینانسی 6 منجر به هندسه هشت وجهی میشود.
قواعد نام گذاری ترکیبات کوئوردیناسی
مانند تمام ترکیبات یونی در ترکیبات کوئوردیناسی نیز ابتدا نام کاتیون و سپس نام آنیون می آید.
1. نام گذاری لیگاندها
- برخی از لیگاندها نامهای ویژهای دارند مثلا:
- : اکوا
- : آمین
- : کربونیل
- لیگاندهای آنیونی همراه با پسوند نام گذاری میشوند.
- اگر نام آنیون به «ید» (ide) ختم شود با «و» (o) جایگزین میشود.
- اگر نام آنیون به «ات» (ate) ختم شود با «آتو» (ato) جایگزین میشود.
- اگر نام آنیون به «یت» (ite) ختم شود با «یتو» (ito) جایگزین میشود.
| نام آنیون | نام لیگاند آنیونی |
| کلرید () | کلرو |
| سولفات () | سولفاتو |
| سولفیت () | سولفیتو |
در جدول زیر نام برخی از لیگاندهای رایج آورده شده است.
| لیگاند | نام در یون کمپلکس | فرمول |
|---|---|---|
| آنیون | ||
| برومید | برومو | |
| کلرید | کلرو | |
| هیدروکسید | هیدروکسو | |
| سیانید | سیانو | |
| نیتریت | نیترو | |
| اگزالات | اگزالاتو | |
| اتیلن دی آمین تترا استیک | اتیلن دی آمین تترا استاتو | |
| مولکولهای خنثی | ||
| آب | اکوآ | |
| آمونیاک | آمین | |
| کربن مونواکسید | کربونیل | |
| اتیلن دیآمین | اتیلن دیآمین | |
- اگر در کمپلکس چند لیگاند متفاوت باشد، نام لیگاندها به ترتیب حروف الفبای انگلیسی می آیند.
- آمین > کلرو , > نیترو
- برای لیگاندهای یکسان از اعداد یونانی به عنوان پیشوند برای نشان دادن تعداد لیگاندها استفاده میشود.
- تریکلرو، سه لیگاند را نشان می دهد.
- تتراآمین، چهارلیگاند را نشان می دهد.
- اگر در نام لیگاند پیشوندهای یونانی داشته باشد، نام لیگاند در پرانتز قرار می گیرد و از و از بیس (2)، تریس (3) یا تتراکیس (4) برای نشان دادن عدد استفاده کنید.
استفاده میشود.- مثلا: تریس (اتیلن دی آمین) سه لیگاند اتیلن دی آمین را نشان می دهد.
2. نام گذاری فلز
- هنگامی که یون کمپلکس، کاتیون است به صورت زیر نوشته میشود:
(عدد اکسیداسیون به صورت رومی) + نام فلز
-
- : کبالت (III)
- : پلاتین (II)
- : مس (I)
- هنگامی که یون کمپلکس، آنیون است به صورت زیر نوشته میشود:
(عدد اکسیداسیون به صورت رومی) + پسوند -ات + نام فلز
-
- : کبالتات (III)
- : پلاتینات (II)
- : کوپرات (I)
در جدول زیر نام برخی از فلزات رایج در کمپلکسهای آنیونی فهرست شده است.
| فلز | کمپلکس آنیونی |
|---|---|
| کروم | کرومات |
| کبالت | کبالتات |
| مس | کوپرات |
| طلا | اورات |
| آهن | فرات |
| سرب | پلامپات |
| منگنز | منگنات |
| مولیبدن | مولیبدات |
| نیکل | نیکلات |
| پلاتین | پلاتینات |
| نقره | آرژنتات |
| قلع | استنات |
| روی | زینکات |
3. نام کمپلکس: در نهایت نام کمپلکس به صورت زیر نوشته میشود.
نام فلز + نام لیگاند
- : دی آمین تتراکلروپلاتینات (II) که فلز مرکزی آنیون است.
- : هگزا آمین کبالت (III) که فلز مرکزی کاتیون است.
مثال نام گذاری ترکیبات کوئوردیناسی
مثال اول: ترکیب را نام گذاری کنید.
| راهنما | مرحله |
| مشخص کردن کاتیون و آنیون | کاتیون: |
| آنیون: | |
| نام گذاری لیگاندها | : اکوآ |
| : کلرو | |
| نام گذاری یون فلز | : کروم (III) |
| نام گذاری یون کمپلکس | : پنتا آکواکلروکروم (III) |
| نام کامل | |
| پنتا آکواکلروکروم (III) کلرید | |
لیگاندها بدون توجه به پیشوندها به ترتیب حروف الفبای انگلیسی مرتب میشوند. در این ترکیب اکوآ بر کلرو مقدمتر است.
مثال دوم: ترکیب را نام گذاری کنید.
| راهنما | مرحله |
| مشخص کردن کاتیون و آنیون | کاتیون: |
| آنیون: | |
| نام گذاری لیگاندها | : سیانو |
| نام گذاری یون فلز | : فرات (III) |
| نام گذاری یون کمپلکس | : هگزاسیانوفرات (III) |
| نام کامل | |
| پتاسیم هگزاسیانوفرات (III) | |

مثال سوم: ترکیب را نام گذاری کنید.
| راهنما | مرحله |
| مشخص کردن کاتیون و آنیون | کاتیون: |
| آنیون: | |
| نام گذاری لیگاندها | : آمین |
| : کلرو | |
| نام گذاری یون فلز | : کبالت (III) |
| نام گذاری یون کمپلکس | : پنتا آمین کلروکبالت (III) |
| نام کامل | |
| پنتاآمینکلروکبالت (III) کلرید | |
پیشوند «پنتا» تعداد آمین ترکیب را نشان میدهد. لیگاندها بدون توجه به پیشوندها به ترتیب حروف الفبای انگلیسی مرتب میشوند. در این ترکیب «آمین» بر «کلرو» مقدمتر است.

مثال چهارم: ترکیب را نام گذاری کنید.
| راهنما | مرحله |
| مشخص کردن کاتیون و آنیون | کاتیون: |
| آنیون: | |
| نام گذاری لیگاندها | : نیترو |
| : اتیلندیآمین | |
| نام گذاری یون فلز | : آهن (III) |
| نام گذاری یون کمپلکس | : بیس (اتیلندیآمین) دینیتروآهن (III) |
| نام کامل | |
| بیس (اتیلندیآمین) دینیتروآهن (III) سولفات | |
چون نام اتیلن دیآمین پسوند «دی» دارد، به جای «دی» از «بیس» برای نشان دادن دو لیگاند en استفاده میشود و به دلیل کاتیون بودن کمپلکس از نام لاتین آهن (فرات) استفاده نمیشود و آهن (III) صحیح است.
نام گذاری اسیدها
اسیدها موادی هستند که وقتی در آب حل میشوند یونهای هیدروژن تولید می کنند. در ساختار اسید، یک یا چند یون هیدروژن به آنیونی متصل است. نام گذاری اسیدها براساس اکسیژن داشتن یا نداشتن آنیون انجام میشود.
- اگر نام آنیون به «ید» (ide) ختم شود، اسید با پیشوند «هیدرو» (hydro) و پسوند «یک» (ic) نام گذاری میشود. برای نمونه و محلول در آب به ترتیب اسیدهای هیدروسیانیک و هیدروسولفوریک نامیده میشوند.
- اگر آنیون در ساختارش اکسیژن داشته باشد، نام اسید از ریشه نام آنیون گرفته میشود و پسوند «یک» (ic) یا «اوس» (ous) در انتهای آن میآید.
- اگر نام آنیون به «ات» (ate) ختم شود، پسوند «یک» (ic) می گیرد. به عنوان مثال، حاوی آنیون سولفات است پس سولفوریک اسید نامیده میشود. حاوی آنیون فسفات است و فسفریک اسید نام گذاری میشود.
- اگر نام آنیون «یت» (ite) ختم شود، «یت» با «اوس» (ous) جایگزین میشود. به عنوان مثال، که حاوی سولفیت است و سولفوروس اسید نام می گیرد.
کاربرد این قوانین را می توان در نام اسیدهای اکسیژندار کلر مشاهده کرد.
| اسید | آنیون | نام |
| پرکلرات | پرکلریک اسید | |
| کلرات | کلریک اسید | |
| کلریت | کلرو اسید | |
| هیپوکلریت | هیپوکلرو اسید |
اسامی اسیدهایی که اکسیژن ندارند در جدول زیر فهرست شده است.
| اسید | نام |
| هیدروفلوریک اسید | |
| هیدروکلریک اسید | |
| هیدروبرومیک اسید | |
| هیدرو یدیک اسید | |
| هیدروسیانیک اسید | |
| هیدروسولفوریک اسید |
اسیدهایی که در ساختار خود اکسیژن دارند در جدول زیر فهرست شده است.
| اسید | نام |
| نیتریک اسید | |
| نیترو اسید | |
| سولفوریک اسید | |
| سولفور اسید | |
| فسفریک اسید | |
| استیک اسید |
نام گذاری بازها
مادهای که در محلولهای آبی قادر به تولید یون هیدروکسید باشد به عنوان باز شناخته میشود. در نام گذاری بازها، پسوند هیدروکسید به نامشان افزوده میشود. در زیر نام برخی از بازها آورده شده است.
| نام عنصر+هیدروکسید | |
| فرمول | نام |
| سدیم هیدروکسید | |
| پتاسیم هیدروکسید | |
| باریم هیدروکسید | |
در تعریف باز، نیازی نیست در ساختار ماده مورد نظر یون هیدروکسید وجود داشته باشد تا به عنوان باز در نظر گرفته شود. هر مادهای که در محلولهای آبی یون هیدروکسید تولید کند به عنوان باز طبقهبندی میشود. برای مثال آمونیاک در ساختار خود، یون هیدروکسید ندارد و در حالت گازی و به صورت مایع خالص به عنوان یک باز شناخته میشود. آمونیاک هنگام حل شدن در آب باعث تولید یونهای و میشود.
نام گذاری هیدرات ها
به ترکیباتی که در ساختارشان مولکول آب وجود داشته باشد باشد هیدرات میگویند. مولکولهای آب میتوانند با حرارت دیدن از ساختار هیدراتها خارج شوند که در آن صورت با نام «انهیدرات» (Anhydrous) شناخته میشوند. نام گذاری هیدراتها به روش زیر انجام میشود.
به انگلیسی: نام ترکیب یونی + تعداد مولکول آب به یونانی+هیدرات
به فارسی: نام ترکیب یونی + تعداد مولکول آب + آبه

بهطور معمول 5 مولکول آب در ساختار مس (II) سولفات وجود دارد که با نام مس (II) سولفات پنجآبه شناخته میشود. مس (II) سولفات با حرارت دیدن و خارج شدن مولکولهای آب به نام مس (II) سولفات بدونآب نامیده میشود.
| نام ترکیب یونی + تعداد مولکول آب + آبه | ||
| فرمول | نام انگلیسی | نام فارسی |
| copper(II) sulfate pentahydrate | مس (II) سولفات پنجآبه | |
| barium chloride dihydrate | باریم کلرید دوآبه | |
| lithium chloride monohydrate | لیتیم کلرید یکآبه | |
| magnesium sulfate heptahydrate | منیزیم سولفات هفتآبه | |
| strontium nitrate tetrahydrate | استرانسیوم نیترات چهارآبه | |
نام گذاری ترکیبات آلی
«ترکیبات آلی» (Organic Compound)، ترکیباتی هستند که بر پایه کربن ساخته میشوند و در ساختارشان کربن با عنصرهایی مانند هیدروژن، اکسیژن، نیتروژن و گوگرد پیوند دارد.
هیدروکربن ها
هیدروکربنها سادهترین ترکیبات آلی هستند. در ساختار این دسته از ترکیبات آلی تنها کربن و هیدروژن وجود دارد. از هیدروکربنها به عنوان سوخت برای گرمایش خانگی و صنعتی، تولید الکتریسیته، تامین انرژی موتورهای درونسوز و همچنین به عنوان خوراک صنایع شیمیایی استفاده میکنند. به آلکنها و آلکینها به دلیل هیدروژن کمتری که دارند، هیدروکربنهای غیراشباع میگویند.
برای اشنایی بیشتر با نحوه نام گذاری این ترکیبات شیمیایی، مطلب نام گذاری هیدروکربن ها را در مجله فرادرس مطالعه کنید.
نام گذاری آلکان ها
نام گذاری الکانها براساس زنجیر اصلی انجام میشود. آلکانها سادهترین دسته هیدروکربنها هستند. در جدول زیر 10 آلکان راست زنجیر اول فهرست شده است. به جز چهار آلکان اول یعنی متان، اتان، پروپان و بوتان نام سایر آلکانها با پیشوندهای یونانی شروع میشود و همگی به پسوند ««ان» (ane) ختم میشوند.
نام چهار آلکان اول نیز، از دیگر ترکیبات گرفته شده است.
| ده آلکانها راست زنجیر اول | |
| نام | فرمول |
| متان | |
| اتان | |
| پروپان | |
| بوتان | |
| پنتان | |
| هگزان | |
| هپتان | |
| اکتان | |
| نونان | |
| دکان | |
روش سیستماتیک نام گذاری ترکیبات آلکانها بر اساس آیوپاک با شناسایی زنجیرههای هیدروکربنی است. در نام گذاری آنها تعداد کربن زنجیره اصلی با پیشوند عدد یونانی ابتدا و در انتها پسوند «آن» میگیرد.
نام آلکان: تعداد کربن زنجیره اصلی به یونانی + ان
گروهی از اتمها که جایگزین اتمهای هیدروژن در زنجیره اصلی میشوند شاخه فرعی، جانشین، زنجیر جانبی یا «استخلاف» (Substituent) نام دارند و به گروهای آلکیلی معروف هستند. در جدول زیر برخی از آلکیلها فهرست شدهاند.

قواعد نام گذاری آلکانها
- شمارش تعداد کربن از سمتی شروع میشود که به استخلاف روی زنجیر نزدیکتر باشد.
- اگر از هر سمت دو استخلاف با شماره کربن برابر وجود داشت، نزدیکتر بودن استخلاف دوم را باید بررسی کرد.
- اگر دو یا چند استخلاف روی زنجیر اصلی وجود داشته باشد، هر استخلاف یک عدد میگیرد و به ترتیب حروف الفبای انگلیسی با خط فاصله بین کلمات و اعداد فهرست میشوند.
- تعداد استخلافهای یکسان با استفاده از اعداد یونانی نشان داده میشوند.
- موقعیت اعداد استخلافهای یکسان با استفاده از عدد مشخص میشوند.
- مرتب کردن بر اساس حروف الفبا بدون در نظر گرفتن پیشوندها صورت میگیرد.
در نهایت ترکیب به صورت زیر نام گذاری میشود.
(عدد استخلاف)-(نام استخلاف)(نام زنجیره اصلی)
نام برخی از آلکانهای راست زنجیر در جدول زیر آورده شده است.
| فرمول | نام |
| تریدکان | |
| تترادکان | |
| پنتادکان | |
| ایکوزان | |
| تریاکونتان | |
| تتراکونتان | |
| پنتاکانتان |
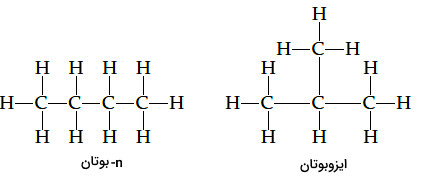
گاهی برای تمایز بین آلکانهای راست زنجیر اصلی از ایزومرهای آن همراه با حرف انگلیسی n کوچک همراه است که از واژه normal گرفته شده است. برای مثال در مبحث ایزومرها به بوتانی که ساختاری خطی دارد «n-بوتان» (n-butane) و به دیگر ایزومر آن که با نام رسمی 2-متیل پروپان شناخته میشود ایزوبوتان» (Isobutane) گفته میشود.
مثال نام گذاری آلکان ها
مثال اول: ترکیب زیر را نام گذاری کنید.

گام اول: تعیین زنجیره اصلی ترکیب، بلندترین زنجیر در این ترکیب پنج اتم کربن دارد. پس در نتیجه پیشوند پنتا می گیرد و در انتها پسوند ان میآید. زنجیر اصلی در اینجا پنتان نام دارد.
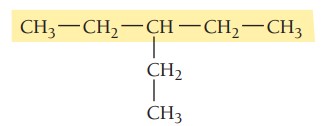
گام دوم: تعیین استخلاف، ترکیب یک استخلاف آلکیلی دارد. با توجه به جدول نام استخلاف اتیل است.

گام سوم: شمارهگذاری زنجیر اصلی، برای تعیین موقعیت استخلافها زنجیر اصلی شمارهگذاری میشود. شمارهکذاری از سمتی شروع میشود که به استخلاف نزدیکتر باشد. در این ترکیب موقعیت گروه آلکیلی روی کربن شماره 3 است.
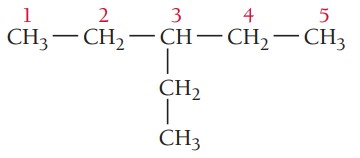
گام چهارم: نام گذاری ترکیبات شیمیایی
3-اتیلپنتان
مثال دوم: ترکیب زیر را نام گذاری کنید.
گام اول: تعیین زنجیره اصلی ترکیب، بلندترین زنجیر در این ترکیب هشت اتم کربن دارد. پس در نتیجه پیشوند اوکت میگیرد و در انتها پسوند ان میآید. زنجیر اصلی در اینجا اکتان نام دارد.
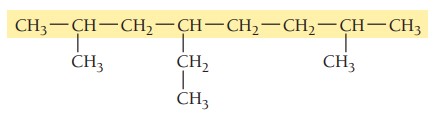
گام دوم: تعیین استخلاف، ترکیب سه استخلاف آلکیلی دارد. با توجه به جدول نام استخلافها اتیل و متیل است.

گام سوم: شمارهگذاری زنجیر اصلی، دو استخلاف متیل از هر دو سمت یک فاصله دارند، پس استخلاف اتیل برای تعیین جهت شمارهگذاری ملاک قرار میگیرد. استخلاف اتیل روی کربن شماره 4 و دو استخلاف متیل روی کربنهای 2 و 7 قرار میگیرند.
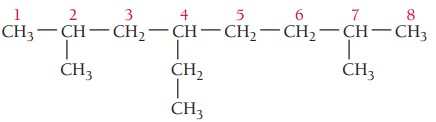
گام چهارم: نام گذاری ترکیب، استخلافها بر اساس حروف الفبای انگلیسی مرتب میشوند و تعداد استخلافهای یکسان با اعداد یونانی مشخص میشوند. در این ترکیب نام اتیل ابتدا و سپس متیل میآید. چون دو استخلاف متیل داریم از پیشوند «دی» برای مشخص کردن تعداد آنها استفاده میشود.
4-اتیل-2 و 7 دیمتیلاکتان
مثال سوم: ترکیب زیر را نام گذاری کنید.
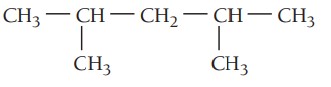
گام اول: تعیین زنجیره اصلی ترکیب، بلندترین زنجیر در این ترکیب پنج اتم کربن دارد. پس در نتیجه پیشوند پنتا می گیرد و در انتها پسوند ان میآید. زنجیر اصلی در اینجا پنتان نام دارد.

گام دوم: تعیین استخلاف، ترکیب دو استخلاف آلکیلی دارد که هر دو استخلاف متیل هستند.

گام سوم: شمارهگذاری زنجیر اصلی، چون استخلافها به یک اندازه از هر سر زنجیر فاصله دارند و هر دو نیز یکسان هستند شروع شمارهگذاری از هر دو سمت یکسان است.
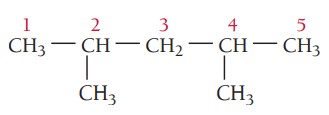
گام چهارم: نام گذاری ترکیب، موقعیت و تعداد استخلافهای یکسان با اعداد یونانی مشخص میشوند.
2 و 4-دیمتیلپنتان
نام گذاری ترکیبات شیمیایی آلکن ها
آلکنها گروه دیگری از هیدروکربنها هستند که در ساختارشان حداقل یک پیوند دوگانه کربن-کرین وجود دارد. سادهترین آلکن، اتن است که اتیلن نیز نامیده میشود. فرمول عمومی الکنهای غیرحلقوی است.
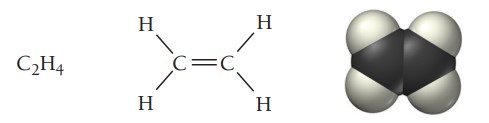
اتن عامل رسیدن برخی میوهها مانند موز است. این میوهها هنگام رسیدن شروع به آزادسازی گاز اتن میکنند که موجب رسیده شدن سایر میوهها میشود. در جدول زیر نام و ساختار چند آلکن فهرست شده است.
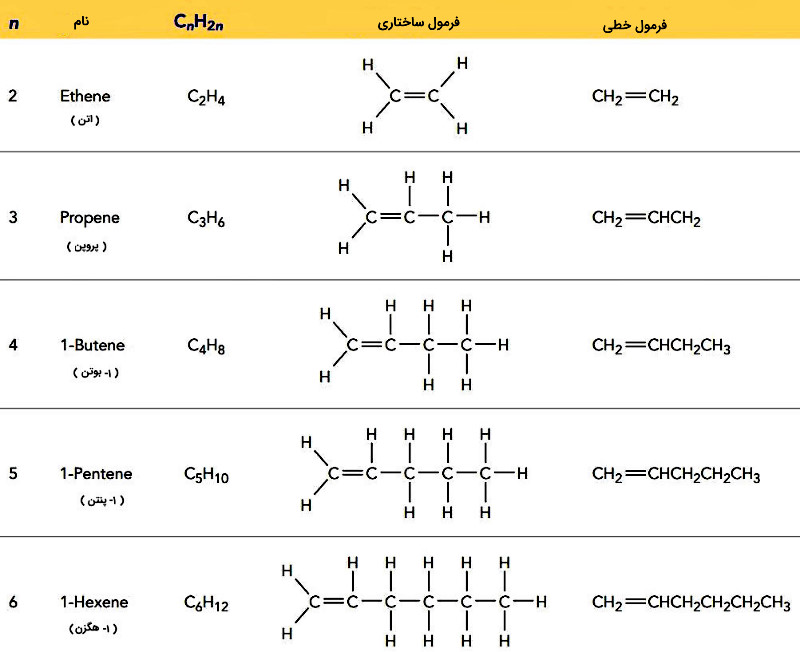
نام گذاری آلکنها از همان قواعد نام گذاری آلکانها پیروی میکنند.
نام آلکن: تعداد کربن زنجیره اصلی به یونانی + ـِن
قواعدنام گذاری ترکیبات شیمیایی آلکنها
- زنجیره اصلی باید شامل پیوند دوگانه باشد.
- نام زنجیره اصلی پیوند «ـِن» (ene) میگیرد.
- شمارهگذاری زنجیر اصلی از سمتی آغاز میشود که پیوند دوگانه کمترین شماره ممکن را بگیرد.
- پیش از نام زنجیر اصلی، موقعیت پیوند دوگانه با عدد مشخص میشود.
مثال چهارم: ترکیب زیر را نام گذاری کنید.
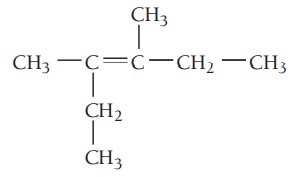
گام اول: تعیین زنجیره اصلی ترکیب، طولانیترین زنجیره کربن باید شامل پیوند دوگانه باشد. زنجیر اصلی در این ترکیب ۶ کربن دارد بنابراین نام آن هگزن است.
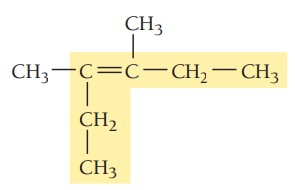
گام دوم: تعیین استخلاف، ترکیب دواستخلاف متیل دارد.
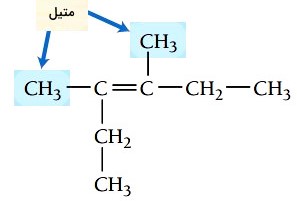
گام سوم: شمارهگذاری زنجیر اصلی، همانطور که بالاتر نیز گفته شد در شمارهگذاری آلکنها، پیوند دوگانه باید کمترین شماره را داشته باشد. پیوند دوگانه در این ترکیب از هر دو سر روی کربن شماره 3 قرار میگیرد. استخلافهای متیل در موقعیتهای 3 و 4 هستند.
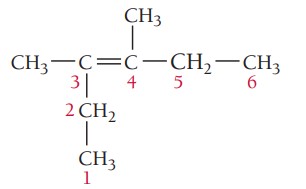
گام چهارم: نام گذاری ترکیب، موقعیت گروههای آلکیلی و پیوند دوگانه با عدد مشخص میشود و چون دو استخلاف یکسان در این ترکیب وجود دارد از اعداد یونانی برای مشخص کردن تعداد آنها استفاده میشود. نام ترکیب به صورت زیر نوشته میشود.
3 و 4-دیمتیل-3-هگزن
نام گذاری آلکین ها
آلکینها گروه دیگری از هیدروکربنها هستند که در ساختارشان حداقل یک پیوند سهگانه کربن-کربن وجود دارد. نام گذاری آلکینها نیز از همان قواعد نام گذاری آلکنها پیروی میکند. سادهترین آلکین، اتین است که به نام استیلن نیز شناخته میشود.
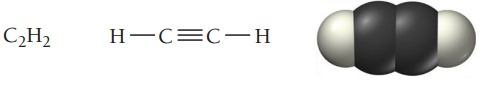
استیلن معمولاً به عنوان سوخت در جوشکاری استفاده میشود. فرمول عمومی آلکینهای غیرحلقوی است. در جدول زیر نام و ساختار چند آلکین فهرست شده است.
نام گذاری آلکینها از همان قواعد نام گذاری ترکیبات شیمیایی آلکانها پیروی میکنند.
نام آلکین: تعداد کربن زنجیره اصلی به یونانی + ین
قواعد نام گذاری آلکینها
- زنجیره اصلی باید شامل پیوند سهگانه باشد.
- نام زنجیره اصلی پیوند «ین» (yne) میگیرد.
- شمارهگذاری زنجیر اصلی از سمتی آغاز میشود که پیوند سهگانه کمترین شماره ممکن را بگیرد.
- پیش از نام زنجیر اصلی، موقعیت پیوند سهگانه با عدد مشخص میشود.
مثال پنجم: ترکیب زیر را نام گذاری کنید.
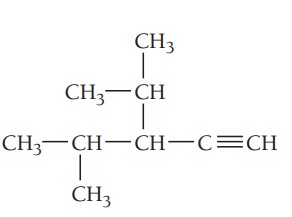
گام اول: تعیین زنجیره اصلی ترکیب، طولانیترین زنجیره کربن باید شامل پیوند سهگانه باشد. زنجیر اصلی در این ترکیب 5 کربن دارد بنابراین نام آن پنتین است.
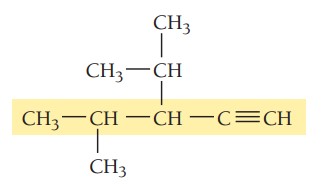
گام دوم: تعیین استخلاف، دو گروه آلکیلی متیل و ایزوپروپیل در ترکیب وجود دارد.
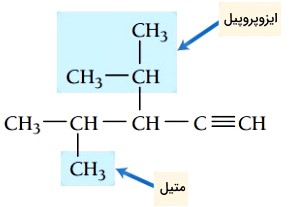
گام سوم: شمارهگذاری زنجیر اصلی، هنگام شمارهگذاری زنجیر اصلی، پیوند سهگانه باید کمترین شماره را داشته باشد. پیوند سهگانه در این ترکیب روی کربن شماره 1 قرار میگیرد. استخلافهای ایزوپروپیل و متیل به ترتیب در موقعیتهای 3 و 4 هستند.
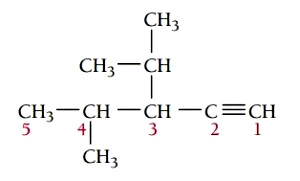
گام چهارم: نام گذاری ترکیب، موقعیت گروههای آلکیلی و پیوند سهگانه با عدد مشخص میشوند. استخلافها به ترتیب حروف الفبای انگلیسی در نام ترکیب قرار میگیرند. نام ترکیب به صورت زیر نوشته میشود.
3-ایزوپروپیل-4-متیل-1-پنتین
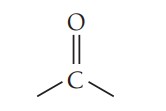
آلدهیدها و کتون ها
آلدهیدها و کتونها گروهی از ترکیبات آلی هستند که در ساختار آنها گروه عاملی کربونیل وجود دارد. گروه کربونیل از پیوند دوگانه کربن-اکسیژن تشکیل شده است که دو گروه اتم به کربن متصل هستند. در کربونیل، اکسیژن الکترونگاتیوی بالاتری نسبت به کربن دارد. قطبیت گروه کربونیل به شدت بر خواص فیزیکی و شیمیایی آلدهیدها و کتونها تأثیر میگذارد. در کربونیل بار جزئی منفی روی اکسیژن و بار جزئی مثبت روی کربن است.
نام گذاری ترکیبات شیمیایی آلدهیدها
فرمالدهید از آشناترین ترکیبات خانواده آلدهیدها، گازی با بوی تند است. از مخلوط فرمالدهید با آب، «فرمالین» (Formalin) تولید میشود که مادهای نگهدارنده و ضدعفونیکننده است. فرمالدهید همچنین در دود چوب نیز وجود دارد و باکتریها را از بین میبرد و به همین دلیل از روش دودی کردن برای نگهداری مواد غذایی استفاده میشود.

آلدهیدهای آروماتیک رایحه خوشایندی دارند. وانیلین علت بوی وانیل، سینامالدهید علت بوی دارچین و بنزآلدهید عامل بوی بادام است.
در آلدهیدها، کربن گروه کربوکسیل حداقل با یک هیدروژن پیوند دارد. آلدهیدهای ساده با توجه به تعداد اتمهای کربن در طولانیترین زنجیره کربن که شامل گروه کربونیل است نامگذاری میشوند. در انتهای نام آلدهیدها که از نام آلکانهای هم کربن گرفته شده، پسوند «ال» (al) میآید.
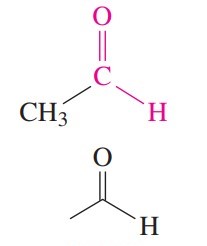
آلدهیدهای با زنجیر یک تا چهار کربن معمولاً با نامهای رایج خود نیز نامیده میشوند و در انتهای نام آنها «آلدهید» میآید. در ساختار آلدهیدها، گروه کربونیل همیشه کربن انتهایی است.

مثال: ترکیب زیر را نام گذاری کنید.
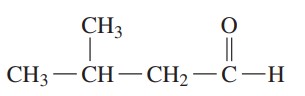
گام اول: طولانیترین زنجیره کربنی حاوی گروه کربونیل چهار کربن دارد. با افزودن پسوند پسوند «ال» (al) به انتهای نام بوتان، نام آن بوتانال است.
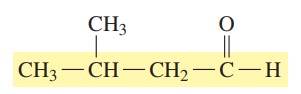
گام دوم: با شروع شمارهگذاری از گروه کربونیل، گروه آلکیلی روی زنجیره روی کربن شماره 3 قرار میگیرد. در این ترکیب تنها یک استخلاف داریم که متیل است.
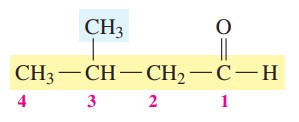
گام سوم: نام گذاری ترکیبات شیمیایی
3-متیلبوتانال
نام گذاری ترکیبات شیمیایی کتون ها
به دلیل نقش مهمی که این دسته از ترکیبات در شیمی آلی داشتهاند نامهای رایج آنها همچنان مورد استفاده قرار میگیرند؛ مثلاً نام استون به عنوان شناخته شدهترین کتون با نام رسمی پروپانون، توسط آیوپاک حفظ شده است. استون جزء اصلی پاک کننده لاک است. کاروون دلیل بوی نعناع، 2-هپتانون دلیل بوی میخک و یونون که بوی تمشک را ایجاد میکند از دیگر ترکیات خانواده کتون هستند.

در کتونها، کربنِ گروه کربوکسیل با دو گروه آلکیل پیوند دارد. برای نام گذاری، طولانیترین زنجیر کربن که شامل گروه کربونیل است تعیین میشود و با توجه به نامِ آلکان زنجیر اصلی، پسوند «اون» (one) در انتهای نام میآید.
برای کتونهای حلقوی، پیشوند «سیکلو» (cyclo) پیش از نام کتون استفاده میشود.

مثال: ترکیب زیر را نام گذاری کنید.
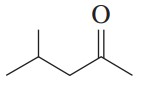
گام اول: طولانیترین زنجیره کربنی حاوی گروه کربونیل پنج کربن دارد. با افزودن پسوند «اون» به انتهای نام پنتان، نام آن پنتانون است.

گام دوم: شمارهگذاری از سمتی شروع میشود که گروه کربونیل کمترین شماره را بگیرد. در این ترکیب گروه کربونیل روی کربن شماره 2 قرار میگیرد.

گام سوم: در این ترکیب تنها یک استخلاف داریم که متیل است و روی کربن شماره 4 قرار دارد.
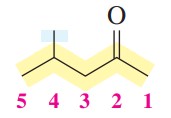
گام چهارم: نام گذاری ترکیب
4-متیل-2-پنتانون
الکل ها، فنول ها، تیول ها و اترها
الکلها و فنولها در ساختاار خود گروهای عاملی هیدروکسیل دارند. تیولها با گروه عاملی مشخص میشوند و اترها نیز در ساختار خود گروه عاملی را دارند.
نام گذاری ترکیبات شیمیایی الکل ها
الکلها دستهای از ترکیبات آلی هستند که در ساختار آنها گروه عاملی هیدروکسیل وجود دارد. اتانول که آشناترین الکل است از از تخمیر گلوکز میوهها و غلات تولید میشود. برای افزایش عدد اکتان، سوختن کامل و همچنین کاهش سطح برخی آلایندهها مانند مونوکسید کربن و پیش سازهای ازن اتانول را به بنزین اضافه میکنند.
ایزوپروپیل الکل یا 2-پروپانول که به شدت سمی است معمولاً به عنوان ضدعفونیکننده و استریل کردن ابزار پزشکی استفاده میشود. متانول دیگر الکل شناخته شده به عنوان حلال در آزمایشگاه کاربرد دارد. از متانول همچنین در سنتز استیک اسید و انواع چسبها، الیاف و پلاستیکها استفاده میشود. مصرف متانول به صورت خوراکی منجر به کوری و مرگ شود.
ترکیباتی که بیش از یک گروه هیدروکسیل در ساختار خود دارند پلی هیدروکسیل نامیده میشوند. 2،1-اتاندیول یا اتیلن گلیکول از شناخته شدهترین ترکیبهای پلی هیدروکسیل، ماده سمی و تشکیل دهنده بیشتر محلولهای ضدیخ خودرو است.
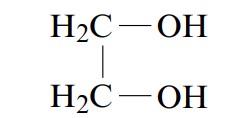
با توجه به تعداد گروهای هیدروکربنی متصل به دسته بندی میشوند.
- الکل نوع اول: به کربن متصل به هیدروکسل یک گروه آلکیل متصل است.
- الکل نوع دوم: به کربن متصل به هیدروکسل دو گروه آلکیل متصل است.
- الکل نوع سوم: به کربن متصل به هیدروکسل سه گروه آلکیل متصل است.
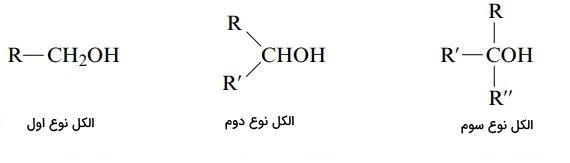
برای نام گذاری الکلها، به انتهای نام زنجیره هیدروکربن اصلی پسوند «اُل» (ol) افزوده میشود. موقعیت گروه هیدروکسیل با کوچکترین عدد ممکن در نام ترکیب میآید. نام رایج الکلهای ساده از نام گروه آلکیل به همراه پسوند الکل ساخته میشوند.
| نام آلکان + اُل | |
| نام الکل | فرمول |
| متانول | |
| اتانول | |
| پروپانول | |
| بوتانول | |
| پنتانول | |
| هگزانول | |
| هپتانول | |
| اکتانول | |
| نونانول | |
| دکانول | |
برای نام گذاری الکل حلقوی از پسوند «سیکلو» پیش از نام الکل استفاده میشود. در صورتیکه روی حلقه استخلافی وجود داشته باشد باید برای تعیین موقعیت آن، حلقه از کربنی که متصل به هیدروکسیل است شمارهگذاری شود.

قواعد نام گذاری ترکیبات شیمیایی الکلها
نام الکل: عدد موقعیت هیدروکسیل + نام زنجیره اصلی + اُل
- نام زنجیر اصلی از نام آلکان متناظر با آن گرفته میشود.
- زنجیره اصلی، بلندترین زنجیر است و باید شامل گروه عاملی باشد.
- پسوند «اُل» در انتهای نام الکل میآید.
- شمارهگذاری زنجیره اصلی از سمتی شروع میشود که گروه هیدروکسیل کمترین عدد را داشته باشد.

مثال: ترکیب زیر را نام گذاری کنید.
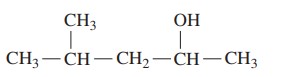
گام اول: تعین زنجیر اصلی، زنجیر اصلی بلندترین زنجیر حاوی گروه است. در این ترکیب زنجیر اصلی 5 کربن دارد. با افزودن پسوند «اُل» به پنتان، نام آن پنتانول است.

گام دوم: شماره گذاری زنجیر، شماره گذاری از سمتی شروع میشود که گروه کمترین عدد را به خود اختصاص دهد. در این ترکیب گروه روی کربن شماره 2 قرار دارد و 2-پنتانول نامیده میشود.

گام سوم: تعیین استخلافها، ترکیب تنها یک استخلاف دارد که گروه متیل است و روی کربن 4 قرار دارد.
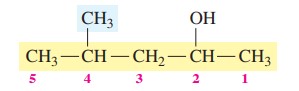
گام چهارم: نام گذاری ترکیب
4-متیل-2-پنتانول
نام گذاری ترکیبات شیمیایی فنول ها
فنولهای دستهای از ترکیبات آلی هستند که در آنها گروه هیدروکسیل به یک حلقه بنزن متصل است. فنولها ترکیباتی شبیه به الکلها هستند ولی خواص آن با الکلها بسیار متفاوت است. فنولها در ساخت چسب و پلاستیک کاربرد دارند.
قواعد نام گذاری فنولها
نام فنول: عدد موقعیت استخلاف + نام استخلاف + فنول
- شماره گذاری از کربن متصل به گروه شروع میشود.
- موقعیت استخلاف با عدد مشخص میشود.
- پسوند «فنول» در انتهای نام ترکیب میآید.
مثال: ترکیب زیر را نام گذاری کنید.
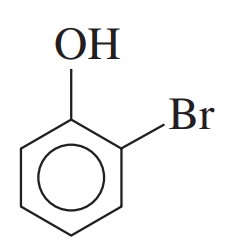
گام اول: وجود یک گروه روی حلقه بنزن یعنی ترکیب مورد نظر فنول است.
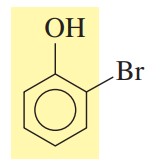
گام دوم: برای تعیین موقعیت استخلافهای رو حلقه بنزن، کربنها باید شمارهگذاری شوند. شمارهگذاری از کربن متصل به گروه شروع میشود.
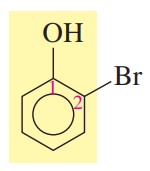
گام سوم: تعیین استخلاف، در این ترکیب عنصر برم روی کربن شماره 2 قرار دارد.
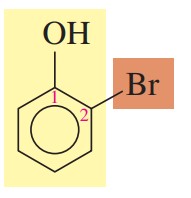
گام چهارم: نام گذاری
2-برموفنول
نام گذاری ترکیبات شیمیایی تیول ها
تیولها دسته از ترکیبات آلی هستند که در ساختار آنها گروه تیول وجود دارد. از ویژگیهای بارز تیولها بوی تند و ناخوشایند آنهاست. از تیولها برای بودار کردن گازهایی مانند متان که بویی ندارند استفاده میشود تا راحت تر تشخیص داده شوند.
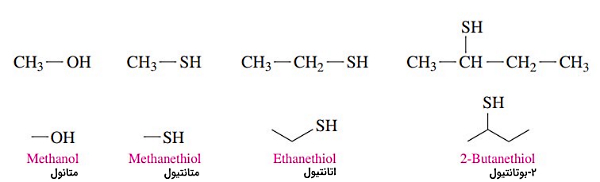
قواعد نام گذاری تیولها
نام تیولها: عدد موقعیت گروه تیول + نام زنجیره اصلی + تیول
- نام زنجیر اصلی از نام آلکان متناظر با آن گرفته میشود.
- زنجیره اصلی، بلندترین زنجیر است و باید شامل گروه عاملی باشد.
- پسوند «تیول» در انتهای نام ترکیب میآید.
- شمارهگذاری زنجیره اصلی از سمتی شروع میشود که گروه تیول کمترین عدد را داشته باشد.
| نام آلکان + تیول | |
| نام آلکان | نام تیول |
| متان | متانتیول |
| اتان | اتانتیول |
| پروپان | پروپانتیول |
| بوتان | بوتانتیول |
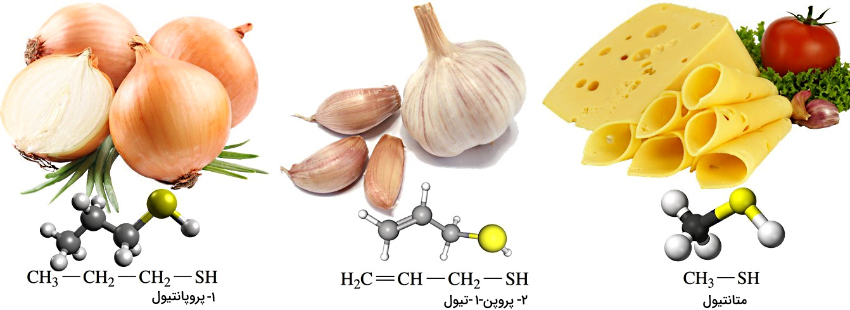
متانتیول عامل بوی پنیر چدار است.
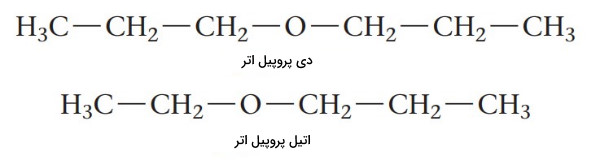
نام گذاری ترکیبات شیمیایی اتر ها
اترها ترکیبات آلی با فرمول عمومی هستند. دو گروه آلکیل ممکن است یکسان یا متفاوت باشند. در زیر برخی از رایجترین اترها نشان داده شده است.
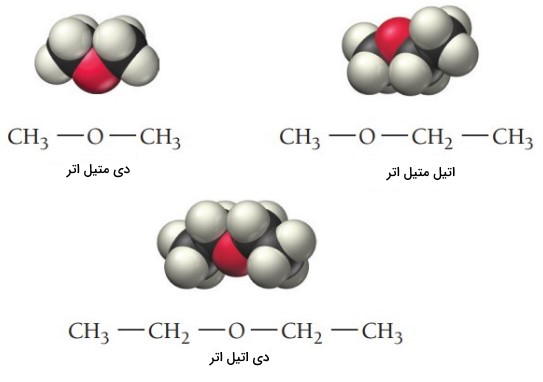
«دی اتیل اتر» (Diethyl Ether) رایجترین ترکیب از خانواده اترهاست. این ماده به دلیل حلالیت بسیاری خوبی که برای ترکیبات آلی دارد و همچنین نقطه جوش پایین (34٫۶ درجه سلسیوس) آن حلال آزمایشگاهی بسیار مفیدی است. نقطه جوش کم، حذف راحت حلال را فراهم میکند. دی اتیل اتر سالها به عنوان داروی بیهوشی عمومی استفاده میشد. نام گذاری ترکیبات شیمیایی اترها به صورت زیر انجام میشود.
(R گروه 1) + (R گروه 2) + اتر
در نام گذاری اترها، اگر دو گروه R متفاوت باشند، نام هر یک از آنها به ترتیب حروف الفبا انگلیسی آورده میشود. اگر دو گروه R یکسان باشند، از پیشوند «دی» استفاده میشود.
کربوکسیلیک اسیدها و استرها
آشناترین کربوکسیلیک اسید اتانوئیک اسید است که بیشتر با نام رایج آن استیک اسید شناخته میشود. استیک اسید ماده فعال سرکه است که با اکسیداسیون اتانول تولید میشود. در ساختار کربوکسیلیک اسیدها و استرها گروه عاملی کربوکسیل با تفاوتی جزیی وجود دارد.
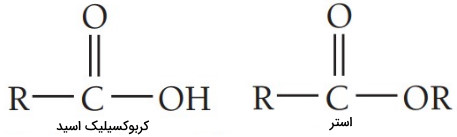
برخی از مخمرها و باکتریها هنگام سوخت و ساز قندهای خمیر نان، استیک اسید تولید میکنند و برای ساخت خمیرمایه نان استفاده میشود.

- فرمیک اسید: در نیش زنبور و نیش مورچه وجود دارد.
- لاکتیک اسید: پس از ورزش شدید در عضلات جمع شده و باعث درد میشود.
- سیتریک اسید: دلیل ترشی لیمو و پرتقال است.
استرها گروهی از ترکیبات آلی هستند که در ساختار آنها گروه عاملی وجود دارد و با فرمول عمومی نشان داده میشوند. استر از واکنش کربوکسیلیک اسید با الکل تولید میشود. در این واکنش یک هیدروژن از اسید خارج شده و یک گروه آلکیل جای آن را میگیرد و استر و آب تولید میشود.
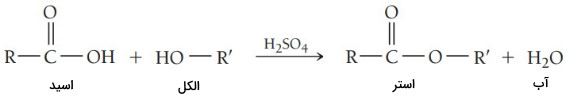
استری شدن یا «استریفیکاسیون» (Esterification) که نخسیتن بار توسط هرمان امیل فیشر توصیف شد به تولید یک استر منجر میشود و نتیجه واکنش کربوکسیلیک اسید با الکل در حضور یک کاتالیزور اسیدی (معمولا ) و گرماست. در این روش یون هیدروکسید از اسید و هیدرون از الکل جدا شده و آب تولید میکنند. مقدار الکل باقی مانده برای حفظ تعادل تبدیل به استر میشود.
چربیها و روغنها از جمله استرهای گلیسرول بلند زنجیر هستند. رایحه بسیاری از عطرها، گلها و طعم میوهها به دلیل وجود استرها است. استرهای کوچک، فراریت بالایی دارند و در آب حل میشوند. در جدول زیر نام برخی از ترکیبات که باعث ایجاد عطر و طعم میوهها میشوند آمده است.

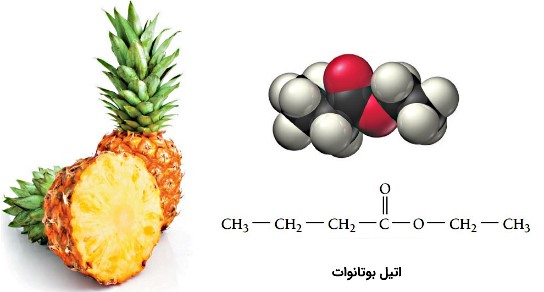
پنتیل پنتانوئات عامل طعم و عطر موز از ترکیب اتانوئیک اسید و 1-پنتانول به صورت تهیه میشود. متیل بوتانوات عامل عطر و طعم سیب و اتیل بوتانوات عامل عطر و طعم سیب در آناناس است. در جدول زیر نام رایج و رسمی برخی از استرها فهرست شده است.
| فرمول | نام رایج | نام گذاری ایوپاک |
| متیل فرمات | متیل متانوات | |
| متیل استات | متیل اتانوات | |
| اتیل استات | اتیل اتانوات | |
| اتیل پروپیونات | اتیل پروپانوات | |
| ایزوپروپیل بوتیرات | ایزوپروپیل بوتانوات |
نام گذاری ترکیبات شیمیایی کربوکسیلیک اسیدها
بسیاری از کربوکسیلیک اسیدها همچنان با استفاده از نامهای رایجی که دارند شناخته میشوند و پیشوندهایی چون «فرم» (form)، «بوتر» (butyr)، «پروپیون» (propion)، «استات» (acet) در نام آنها وجود دارد که به منابع طبیعی این اسیدها مربوط است. به عنوان مثال، بوتیریک اسید عامل بوی بد در «کره» (Butter) فاسد است.
در کربوکسیلیک اسیدها طولانیترین زنجیره حاوی گروه عاملی کربوکسیل برای نامگذاری انتخاب میشود و در انتها، پسوند «اوئیک اسید» (oic acid) میآید.
| نام آلکان + اوئیک اسید | |
| نام آلکان | نام کربوکسیلیک اسید |
| متان | متانویک اسید |
| اتان | اتانویک اسید |
| پروپان | پروپانویک اسید |
| بوتان | بوتانویک اسید |
| پنتان | پنتانویک اسید |
مثال: ترکیب زیر را نام گذاری کنید.
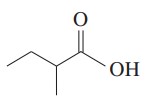
گام اول: بلندترین زنجیر حاوی گروه عاملی انتخاب میشود. انتهای نام زنجیر کربنی پسوند «اوئیک اسید» میآید. در این ترکیب، بلندترین زنجیر 4 کربن دارد پس نام بوتان به بوتانوئیک اسید تبدیل میشود.

گام دوم: برای مشخص کردن موقعیت استخلافها، زنجیر اصلی شمارهگذاری میشود. شمارهگذاری از کربن گروه کربوکسیل به عنوان کربن 1 شروع میشود. در این ترکیب، روی کربن شماره 2 گروه آلکیلی متیل قرار دارد.

گام سوم: نام گذاری ترکیبات شیمیایی
2-متیل بوتانوئیک اسید
نام گذاری ترکیبات شیمیایی استرها
نام گذاری استرها بر اساس نام اجزا تشکیل دهنده آن صورت میگیرد. نام هر استر دو جز دارد که از نام الکل و اسید تشکیل دهنده آن استر گرفته میشود. بخش اول نام آلکیلی است که از الکل آمده و جز دوم، نام کربوکسیلات از کربوکسیلیک اسید است. در تصویر زیر این دو بخش نمایش داده شده است.
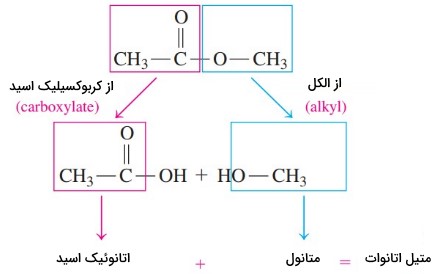
- پسوند «اوئیک اسید» در نام اسید سازنده به «ات» (ate) تبدیل میشود.
- پسوند «اُل» در نام الکل سازنده به «یل» (yl) تبدیل میشود.
نام استر: آلکیل از الکل + کربوکسیلات از اسید
در جدول زیر برخی از استرهای رایج به همراه اجزا تشکیل دهنده آنها فهرست شده است.
| الکل | اسید | استر |
| متانول | فرمیک اسید | متیل فرمات |
| استیک اسید | متیل استات | |
| اکریلیک اسید | متیل آکریلات | |
| بوتریک اسید | متیل بوتیرات | |
| پنتانوئیک اسید | متیل پنتانوات | |
| بنزوئیک اسید | متیل بنزوات | |
| سالیسیلیک اسید | متیل سالیسیلات | |
| فنیلاستیک اسید | متیل فنیلاستات | |
| اتانول | فرمیک اسید | اتیل فرمات |
| استیک اسید | اتیل استات | |
| پروپیونیک اسید | اتیل پروپیونات | |
| لاکتیک اسید | اتیل لاکتات | |
| بوتریک اسید | اتیل بوتیرات | |
| سینامیک اسید | اتیل سینامات | |
| دکانوئیک اسید | اتیل دکانوات | |
| پروپانول | استیک اسید | پروپیل استات |
| پروپیونیک اسید | پروپیل پروپانوات | |
| هگزانوئیک اسید | پروپیل هگزانوات | |
| بوتانول | استیک اسید | بوتیل استات |
| فرمیک اسید | ایزوبوتیل فرمات | |
| بوتریک اسید | بوتیل بوتیرات | |
| پنتانول | استیک اسید | آمیل استات |
| پروپانوئیک اسید | فنیل پروپانوئات | |
| بنزیل الکل | استیک اسید | بنزیل استات |
| گرانیول | گرانیل استات | |
| لینالول | لینالیل استات | |
| ایزوپروپانول | پالمیتیک اسید | ایزوپروپیل پالمیتات |
مثال: ترکیب زیر را نام گذاری کنید.

گام اول: در ابتدا زنجیره کربنی بخش الکلی بر وزن آلکیل نامگذاری میشود. در این ترکیب بخش الکلی 3 کربن دارد، پس نام آلکیلی پروپانول با حذف پسوند «اُل» به پروپیل تبدیل میشود.

گام دوم: بخش اسیدی ترکیب با حذف پسوند «اوئیک اسید» و تبدیل آن به «ات» نامگذاری میشود. پس در اینجا پروپانوئیک اسید به پروپانوات تبدیل میشود.
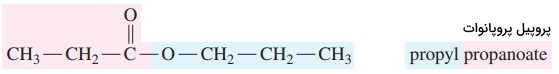
گام سوم: برای نامگذاری ابتدا نام بخش الکل (پروپیل) و سپس نام اسید (پروپانوات) میآید.
پروپیل پروپانوات (پروپیل پروپیونات)
نام گذاری ترکیبات شیمیایی آمین ها
آمینها ترکیبات آلی نیتروژن داری هستند که به عنوان اجزای آمینو اسیدها، پروتئینها و اسیدهای نوکلئیک (DNA و RNA) از نظر زیستی اهمیت بالایی دارند. دوپامین، هیستامین، آدرنالین و آمفتامین نمونههایی از این دسته ترکیبات آلی هستند که نقش فیزیولوژیکی مهمی در بدن انسان ایفا میکنند. از جمله آمینهای طبیعی که از گیاهان استخراج میشوند میتوان به آلکالوئیدهایی مانند کافئین، نیکوتین و کوکائین اشاره کرد. آمینها نیز مانند آمونیاک بازهای ضعیفی هستند.

آمینها بیشتر به خاطر بوی بدشان شناخته میشوند. هنگامی که یک موجود زنده میمیرد، باکتریها هنگام تجزیه پروتئینهای آن آمین آزاد میکنند. به عنوان مثال، «تریمتیل آمین» (Trimethylamine) علت بوی ماهی فاسد و «کاداورین» (Cadaverine) دلیل بوی لاشه حیوانات در حال فاسد شدن است.
بهطور سیستماتیک آمینها را با توجه به گروههای هیدروکربنی متصل به نیتروژن نام گذاری میکنند و در انتهای نام آنها پسوند «آمین» (amine) میآید. در ساختار آمینها که مشتقاتی از آمونیاک هستند، یک یا چند اتم هیدروژن با گروههای آلکیل یا آروماتیک جایگزین میشود. برای مثال، در ساختار متیل آمین یک گروه متیل جایگزین اتم هیدروژن شده است و در دیمتیل آمین، دو گروه متیل وجود دارد.
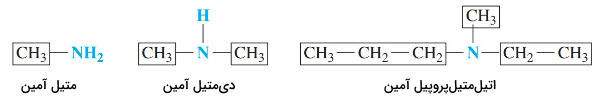
تا زمانی که آلکیلهای متصل به نیتروژن شاخهدار نشده باشند از نامهای رایج آمینها استفاده میشود. برای نامیدن گروههای آلکیلی متصل به نیتروژن به ترتیب حروف الفبای انگلیسی نوشته میشوند. همچنین از پیشوندهای «دی» و «تری» برای چند استخلاف یکسان استفاده میکنند.
انواع آمین
تعداد کربنهایی که مستقیم به نیتروژن در پیوند هستند نوع آمین را مشخص میکند.
| نوع | تعداد کربن متصل به نیتروژن | نشان |
| آمین نوع اول | 1 | (1°) |
| آمین نوع دوم | 2 | (2°) |
| آمین نوع سوم | 3 | (3°) |

برای نام گذاری آمینهای آروماتیک از نام آنیلین استفاده میکنند. در آمینهای آروماتیک اگر گروههای آلکیل به نیتروژن متصل باشند با پیشوند N- مشخص میشوند.
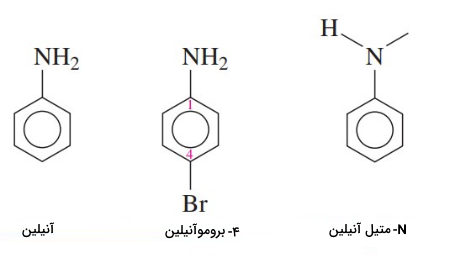
در صنعت رنگسازی برای تولید رنگهای نیلی مانند از آنیلین استفاده میشود. از دیگر کاربردهای آن برای ساخت «پلی اورتان» (Polyurethane) در سنتز استامینوفن است.

مثال: نوع آمینهای زیر را مشخص کنید و نام رایج آنها را بنویسید.
الف:

در این ترکیب یک گروه اتیل به اتم نیتروژن متصل است، پس آمین نوع اول است و اتیل آمین نام دارد.
ب:

در این ترکیب سه گروه آلکیل (دو گروه متیل و یک گروه اتیل) به اتم نیتروژن متصل هستند پس آمین نوع سوم است و اتیلدیمتیل آمین نام دارد.
نام گذاری ترکیبات شیمیایی آمیدها
آمیدها مشتقات کربوکسیلیک اسیدها هستند. در ساختار آمیدها نیتروژن جایگزین گروه هیدروکسیل اسید میشود. آمیدها تحت واکنشی به نام آمیداسیون تولید میشوند. در آمیداسیون کربوکسیلیک اسید با آمونیاک یا یک آمین نوع اول یا دوم واکنش می دهد و آمید تولید میشود. امین نوع سوم چون هیچ هیدروژنی ندارد نمی تواند تحت آمیداسیون قرار گیرد.

اوره ساده ترین آمید طبیعی است. اوره در بدن توسط کلیهها از طریق ادرار دفع میشود و در کودهای کشاورزی برای افزایش نیتروژن در خاک کاربرد دارد.
در نام گذاری ترکیبات شیمیایی آمیدها، پسوند آمید جایگزین پسوند «اوئیک اسید» (oic acid) یا «یک اسید» (oic acid) میشود. اگر به اتم نیتروژن گروه آلکیلی متصل باشد برای یک گروه آلکیلی پیشوند N و برای دو گروه آلکیلی پیشوند N,N پیش از نام آمید میآید.
مثال: ترکیب زیر را نام گذاری کنید.
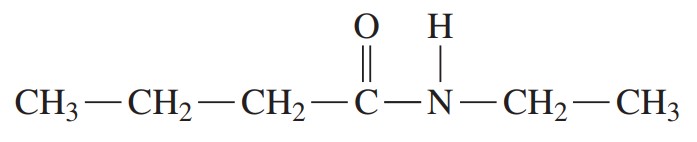
گام اول: در کربوکسیلیک اسید، پسوند «اوئیک اسید» با آمید جایگزین میشود و نام آن بوتانآمید میشود.
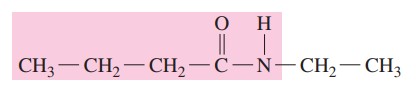
گام دوم: یک استخلاف روی عنصر نیتروژن وجود دارد. پس پیشوند N به همراه نام آلکیل میآید.
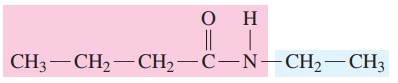
گام سوم: در نهایت نام ترکیب به صورت زیر نوشته میشود.
N-اتیل بوتانآمید
جمع بندی نام گذاری ترکیبات شیمیایی
در این مطلب از مجله فرادرس با نامگذاری انواع ترکیبات شیمیایی آشنا شدیم. اتحادیه بینالمللی شیمی محض و کاربردی (آیوپاک) مجموعه قوانین نامگذاری ترکیبات شیمیایی را در کتابهای اتحادیه که به کتابهای رنگی آیوپاک شهرت دارند منتشر میکنند.
| کتاب | موضوع | پیوند |
| کتاب سبز | کمیتها، واحدها و نمادها در شیمی فیزیک | + |
| کتاب قرمز | نام گذاری در شیمی معدنی | + |
| کتاب آبی | نام گذاری در شیمی آلی | + |
| کتاب بنفش | اصطلاحات و نام گذاری پلیمرها | + |
| کتاب نارنجی | نام گذاری ترکیبات شیمیایی در شیمی تجزیه | + |
| کتاب نقرهای | اصطلاحات و نام گذاری ویژگیهای علوم آزمایشگاهی | + |
| کتاب سفید | نام گذاری ترکیبات در بیوشیمی | + |
| کتاب طلایی | اصطلاحات شیمیایی | + |
هدف از ایجاد چنین قوانینی برای نام گذاری ترکیبات شیمیایی از بین بردن ابهام در نوشتار و گفتار است. هر ترکیب باید نام یکتایی داشته باشد و هر نام تنها به یک ترکیب اشاره کند. هرچند برخی از نامهای رایج به دلایل تاریخی و استفاده راحتتر نسبت به نامهای استاندارد آیوپاک همچنان کاربرد دارند.
آزمون نام گذاری ترکیبات شیمیایی
۱. چرا رعایت قواعد استاندارد مانند سیستم آیوپاک (IUPAC) در نامگذاری ترکیبات شیمیایی اهمیت دارد؟
باعث یکسانسازی و حذف ابهام در نام ترکیبات میشود.
ترکیبات را از نظر خواص فیزیکی تغییر میدهد.
باعث کاهش تعداد عناصر جدول تناوبی میشود.
امکان ساخت ترکیبات جدید را افزایش میدهد.
رعایت قواعد استانداردی مانند سیستم آیوپاک باعث «یکسانسازی و حذف ابهام در نام ترکیبات» میشود، زیرا وجود نامهای جهانی و یکتا ارتباط علمی و آموزش را ساده و موثر میسازد.
۲. کدام تفاوت اصلی بین نامگذاری سنتی و سیستم IUPAC برای ترکیبات شیمیایی مطرح است؟
در سیستم IUPAC همه ترکیبات به دو گروه معدنی و آلی تقسیم نمیشوند.
در نامگذاری سنتی یونها و لیگاندها به ترتیب حروف الفبا نوشته میشوند.
نامگذاری سنتی بر اساس ویژگیها یا کشفکننده بود اما سیستم IUPAC قواعد جهانی و نظاممند دارد.
در روش سنتی فقط از اعداد یونانی استفاده میشود ولی IUPAC فقط اعداد رومی را میپذیرد.
گزینه «نامگذاری سنتی بر اساس ویژگیها یا کشفکننده بود اما سیستم IUPAC قواعد جهانی و نظاممند دارد» صحیح است. زیرا در متن گفته شده روش سنتی به شکل سلیقهای و وابسته به کسانی بود که ترکیب را شناختند یا به ویژگی ماده توجه میکردند، در حالی که سیستم IUPAC ساختارمند و بینالمللی است.
۳. ترکیبات شیمیایی را به چند دسته اصلی تقسیم میکنند و تفاوت مهم بین این دو دسته چیست؟
ترکیبات فلزی و نافلزی. تفاوت در رسانایی الکتریکی
ترکیبات آلی و معدنی. تفاوت در حضور اتم کربن
ترکیبات محلول و نامحلول. تفاوت در حل شدن در آب
ترکیبات ساده و پیچیده. تفاوت در تعداد عناصر
«ترکیبات آلی و معدنی» دو بخش اصلی ترکیبات شیمیایی هستند که تفاوت کلیدی آنها در این است که ترکیبات آلی معمولا شامل اتم کربن هستند، در حالی که ترکیبات معدنی این ویژگی را الزما ندارند. عبارت «فلزی و نافلزی» بر پایه ترکیب عناصر است و رسانایی محور اصلی تمایز آن نیست. تقسیمبندی به «ساده و پیچیده» یا «محلول و نامحلول» هم دستهبندی استاندارد ترکیبات شیمیایی به شمار نمیرود و جنبه فرعی دارد.
۴. برای نامگذاری ترکیبی که چهار اتم کلر در ساختار خود دارد، کدام پیشوند یونانی یا رومی باید قبل از نام آن به کار رود؟
پنتا (penta)
تترا (tetra)
تری (tri)
هگزا (hexa)
در نامگذاری ترکیبات شیمیایی، پیشوند «تترا (tetra)» برای نشان دادن تعداد چهار اتم یا گروه به کار میرود. طبق جدول معادلهای عددی یونانی و رومی در نامگذاری ترکیبات، «تری (tri)» برای سه اتم، «پنتا (penta)» برای پنج اتم و «هگزا (hexa)» برای شش اتم استفاده میشوند.
۵. چرا استفاده از پیشوندهای یونانی و رومی در نامگذاری ترکیبات شیمیایی اهمیت دارد؟
استفاده از این پیشوندها فقط در ترکیبات آلی مجاز است.
این پیشوندها فقط برای زیباسازی نام ترکیبات بهکار میروند.
پیشوندهای مورد استفاده تنها نشانگر بار یون و نه تعداد هستند.
پیشوندهای یونانی و رومی تعداد اتمها یا یونها را در ساختار ترکیب نشان میدهند.
استفاده از پیشوندهای یونانی و رومی مانند «دی»، «تری»، «تترا» یا اعداد رومی، نقش اصلی در نمایش تعداد اتمها یا یونها در ساختار یک ترکیب شیمیایی دارند. این پیشوندها باعث میشوند فرمول و نام هر ترکیب دقیق و بدون ابهام باشد. کاربرد آنها محدود به ترکیبات آلی نیست و در ترکیبات معدنی و مولکولی نیز استفاده میشوند. هدف از این پیشوندها زیباسازی نام نیست و همچنین نشانگر بار یون نمیباشند، بلکه تعداد اجزا را مشخص میکنند.
۶. در نامگذاری ترکیبات شیمیایی، چه زمانی استفاده از پیشوندهای عددی یونانی مانند دی، تری یا تترا ضروری است؟
در همه ترکیبات آلی بدون توجه به نوع عناصر سازنده
زمانی که تعداد اتمها یا یونهای یک عنصر در ترکیب باید مشخص گردد.
هنگامی که ترکیب شامل یونهای فلزی با بار متغیر باشد.
فقط برای ترکیبات ساده یونی با کاتیونهای گروه اول جدول تناوبی
استفاده از پیشوندهای عددی یونانی مانند «دی» یا «تری» هنگامی ضروری است که تعداد اتمها یا یونهای یک عنصر باید بهروشنی در نام ترکیب بیان شود، به ویژه در ترکیبات مولکولی و بعضی ترکیبات چنداتمی.
۷. برای نامگذاری ترکیب یونی ساده با فلزی که بار ثابت دارد، چه باید کرد؟
فقط نام آنیون را همراه با پیشوند عددی یونانی بنویسیم.
نام یونها را به ترتیب الفبا بدون پسوند بنویسیم.
برای هر یون پیشوند عددی بنویسیم و سپس هردو نام را ترکیب کنیم.
نام فلز را به طور کامل بنویسیم و سپس نام آنیون را با پسوند مناسب اضافه کنیم.
در نامگذاری ترکیب یونی ساده با فلز دارای بار ثابت، ابتدا نام کامل فلز آورده میشود و سپس نام آنیون با پسوند مناسب به آن اضافه میگردد. این روش سبب شناسایی صحیح هر جزء ترکیب میشود.
۸. در نامگذاری ترکیبات یونی با روش استاک (Stock system)، اعداد رومی چه کاربردی دارند؟
برای تعیین جایگاه یونهای چنداتمی در فرمول شیمیایی هستند.
برای نمایش تعداد اتمهای هر عنصر بهکار میروند.
برای نشان دادن بار یا عدد اکسایش فلز اصلی استفاده میشوند.
برای مرتب کردن اجزای ترکیب بر اساس الفبا وارد میشوند.
در سیستم استاک، اعداد رومی برای نمایش بار یا عدد اکسایش فلزی که دارای چند حالت اکسایش است، مانند آهن یا مس، در نام ترکیب بهکار میروند. این اعداد رومی در داخل پرانتز بعد از نام فلز قرار میگیرند و به شیمیدانان کمک میکنند نوع دقیق یون فلزی حاضر در ترکیب را تشخیص دهند.
۹. در نامگذاری آنیونهای چنداتمی چه اصلی باید رعایت شود؟
استفاده همزمان از اعداد یونانی و رومی برای تعیین تعداد اتمها
انتخاب پسوند مناسب مانند 'ات' یا 'یت' برای نامگذاری آنیون
همیشه حذف پیشوندها برای یونهای چنداتمی با بار متغیر
قرار دادن نام کاتیون قبل از آنیون چنداتمی در هر ترکیب
برای نامگذاری آنیونهای چنداتمی باید از پسوندهای مشخص مانند 'ات' یا 'یت' استفاده شود که ماهیت و تعداد اکسیژن یا اتمها را بهتر نشان دهند. «استفاده همزمان از اعداد یونانی و رومی» صحیح نیست. تنها اعداد یونانی به صورت پیشوند برای تعداد اتمها بهکار میرود.
۱۰. در نامگذاری ترکیبات مولکولی و ترکیبات یونی، کدام تفاوت اصولی بر اساس قواعد جهانی رعایت میشود؟
در نامگذاری ترکیبات یونی همیشه فقط از نامهای قدیمی استفاده میشود، اما برای ترکیبات مولکولی از نامهای جدید بهره میبرند.
در ترکیبات مولکولی پیشوند یونانی برای تعیین تعداد اتمها به کار میرود، اما در ترکیبات یونی معمولا استفاده نمیشود.
در هر دو نوع ترکیب، همواره محل قرارگیری اتم فلزی در ابتدا ذکر میشود.
برای ترکیبات مولکولی و یونی هر دو، پیشوندهای رومی برای نمایش تعداد اتمها به کار میرود.
در نامگذاری ترکیبات مولکولی، پیشوند یونانی مانند «دی» و «تری» برای نمایش تعداد اتمهای هر عنصر استفاده میشود که این روش در ترکیبات یونی کاربرد ندارد. بر عکس، در ترکیبات یونی معمولا نام فلز و یون بدون پیشوند یونانی ثبت میشود و اگر فلز بار متغیر داشته باشد، از عدد رومی در پرانتز استفاده میگردد، نه پیشوند یونانی.
۱۱. در قواعد نامگذاری ترکیبات مولکولی، حذف پیشوند یونانی «مونو» (mono) برای کدام حالت رخ میدهد؟
اگر هر دو اتم فلز باشند.
وقتی اتم اول ترکیب فقط یکی باشد.
زمانی که هر دو عنصر تعداد برابر داشته باشند.
هنگامی که اتم دوم ترکیب تنها یک عدد باشد.
وقتی پیشوند «مونو» (mono) برای اتم دوم ترکیب حذف میشود که تعداد آن فقط یک عدد باشد، مانند دیاکسید کربن () که اکسیژن دارای پیشوند است اما کربن نه. استفاده از «مونو» برای اتم اول در نامگذاری مرسوم نیست.
۱۲. کدام نوع نامهای غیرسیستمی برای ترکیبات مولکولی در نوشتار استفاده میشود و دلیل توجه به این نامها چیست؟
این نامها تنها در ترکیبات یونی به کار میروند.
همیشه باید فقط از نامهای سیستمی یونانی استفاده کرد.
نامهای پرکاربرد مانند آب و آمونیاک در منابع علمی وجود دارند.
نامهای غیرسیستمی فقط برای فلزات سنگین استفاده میشوند.
نامهایی مانند «آب» و «آمونیاک» به عنوان نامهای غیرسیستمی برای ترکیبات مولکولی رایج هستند و مطالعه آنها اهمیت دارد چون در متون علمی و منابع آموزشی به طور مداوم حضور دارند.
۱۳. در فرآیند نامگذاری یونهای کمپلکس شیمیایی، کدام عامل برای صحیح بودن نام نهایی اهمیت کلیدی دارد؟
انتخاب منبع یون فلزی بر اساس محل استخراج
انتخاب ترتیب صحیح لیگاندها بر اساس حروف الفبا
تعیین عدد کوئوردینانسی یون مرکزی
انتخاب رنگ کمپلکس و درج در نام
در نامگذاری یونهای کمپلکس طبق قواعد آیوپاک، ترتیببندی نام لیگاندها بر اساس حروف الفبا اهمیت اساسی دارد و رعایت این ترتیب باعث میشود نامگذاری رسمی و استاندارد باشد.
۱۴. در نامگذاری یونهای کمپلکس، چه معیاری نشاندهنده تفاوت اصلی میان نامگذاری گونه کاتیونی و آنیونی است؟
در یون کاتیونی، نام لیگاندها پیش از فلز میآید، اما در یون آنیونی برعکس است.
نام عنصر فلزی در یون آنیونی با پسوند «-ات» (ate) میآید، اما در کاتیونی این پسوند استفاده نمیشود.
در یون کاتیونی، ترتیب لیگاندها بر اساس عدد اتمی است ولی در آنیونی بر اساس حروف الفبا.
در یونهای آنیونی، پیشوند یونانی حذف میشود اما در کاتیونی هر دو پیشوند ذکر میشود.
تفاوت اصلی میان نامگذاری یون کمپلکس کاتیونی و آنیونی در آن است که در یون آنیونی باید نام فلز با پسوند «-ات» (ate) بیاید، مانند فریت برای آهن، در حالی که در یون کاتیونی این پسوند رعایت نمیشود و نام فلز به شکل معمول ذکر میشود.
۱۵. در نامگذاری اسیدها، چه نقشی برای حضور یا عدم حضور اکسیژن در آنیون وجود دارد؟
وجود اکسیژن در آنیون تعیینکننده پسوند اسید است.
نداشتن اکسیژن باعث استفاده از پیشوند هیدرو میشود.
تعداد اتمهای اکسیژن فقط فرمول شیمیایی را تغییر میدهد.
اسیدهای دارای اکسیژن بیشتر نام غیرسیستمی میگیرند.
در نامگذاری اسیدها، حضور اکسیژن در آنیون به طور مستقیم بر انتخاب پسوند اسید تاثیر دارد. برای اسیدهایی که آنیون آنها دارای اکسیژن است معمولا پسوندهایی مانند «-یک» یا «-ات» به کار میرود و در نبود اکسیژن پسوند متفاوت به کار میرود.
۱۶. برای نامگذاری یک هیدرات با تعداد معین مولکول آب، کدام روش صحیح است؟
ذکر تعداد آب درون پرانتز پس از نام ترکیب بدون پیشوند.
قراردادن حرف N پیش از نام ترکیب برای تعداد آب مشخص.
اعلام تعداد مولکول آب با پیشوند یونانی و نوشتن کلمه هیدرات پس از نام ترکیب.
استفاده از عدد یونانی قبل از نام اصلی ترکیب و صرفنظر از کلمه هیدرات.
در فرآیند نامگذاری هیدراتها، باید ابتدا نام ترکیب اصلی نوشته شده و سپس با پیشوند یونانی (مانند «دی»، «تری»، «تترا» و...) به تعداد مولکولهای آب اشاره کرد. کلمه «هیدرات» باید بعد از پیشوند و نام ترکیب بیاید تا ساختار را کامل کند.
۱۷. برای انتخاب نام درست یک آلکان با زنجیره شاخهدار، کدام قاعده کلیدی باید رعایت شود؟
باید زنجیرهای با بیشترین تعداد اتم کربن به عنوان اصلی نامگذاری شود.
باید کوتاهترین زنجیره برای شاخه جانبی انتخاب شود.
باید زنجیرهای با بیشترین تعداد شاخه انتخاب شود.
باید زنجیرهای با بیشترین تعداد اتم اکسیژن انتخاب شود.
در نامگذاری آلکانهای شاخهدار، زنجیرهای با بیشترین تعداد اتم کربن به عنوان زنجیره اصلی شناسایی میشود تا نام صحیح بر اساس این ساختار انتخاب گردد. انتخاب زنجیره بر اساس بیشترین تعداد شاخه یا بیشترین اتم اکسیژن صحیح نیست و زنجیره شاخهای جایگاه درجه دوم دارد.
۱۸. در نامگذاری استرها، چه معیاری ترتیب ذکر نام الکل و اسید را مشخص میکند و دلیل اهمیت آن چیست؟
ابتدا نام بخش الکلی و سپس بخش اسیدی در نامگذاری استر ذکر میشود تا منبع هر جزء مشخص باشد.
ابتدا نام بخش اسیدی و سپس نام بخش الکلی در نامگذاری استر نوشته میشود تا اصول یونانی حفظ شود.
ابتدا نام بخش اسیدی و سپس نام بخش الکلی در استر آورده میشود تا ساختار مولکول منعکس شود.
ابتدا نام بخش الکلی و سپس بخش اسیدی ذکر میشود تا ترتیب واکنشدهندهها نمایش یابد.
در نامگذاری استرها، نخست نام بخش الکلی آورده میشود و پس از آن نام بخش اسیدی با پسوند مناسب ذکر میشود. این ترتیب اهمیت دارد چون هویت هر جزء را به روشنی نشان میدهد و مطابق قواعد آیوپاک است.













سلام وقت بخیر
دستتون درد نکنه واقعا مقاله ی جامع و به درد بخوری بود
خیلی خوب بود
فقط استثناها چی؟ اونایی که از قاعده ی فرمول نویسی پیروی نمیکنند مثل جوهر نمک و آهک و…
با سلام؛
مواردی مانند جوهر نمک و آهک استثنا نیستند و نامهای شیمیایی علمی مانند اسید کلریدریک و کلسیم کربنات را دارند. این نامهای قدیمی بیشتر از زبان عامیانه، کیمیاگری قدیم و تجربههای روزمره به دست آمدهاند و سپس با پیشرفت شیمی، نام علمی آنها مشخص شده است.
با تشکر از همراهی شما با مجله فرادرس
برای کبالت دوبار نوشتید +۲
با سلام؛
متن بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
باسلام
بسیار عالی، جامع و مفید
سپاس
سلام. بسیار عالی. دست شما درد نکنه.
بسیار مفید
تشکر
مثال چهارم: ترکیب (پنتا آمین کلروکبالت) را نام گذاری کنید. / یکی از لیگاندها از مثال بالا کپی شده و فراموش کردم اصلاح کنم. اطلاحش کنید لطفا/ نام کاملش درست عنوان شده
سلام و روز شما بهخیر؛
ممنونیم از دقت نظر شما دوست عزیز. متن بازبینی و اصلاح شد.
«به عنوان مثال، بوتیریک اسید باعث بوی بد در «کره» (Butter) فاسد میدهد.» اصلاح شود به «به عنوان مثال، بوتیریک اسید عامل بوی بد در «کره» (Butter) فاسد است.» 🙂
سلام و روز شما بهخیر؛
ممنونیم از دقت نظر شما دوست عزیز. متن بازبینی و اصلاح شد.
سلام میشه نام گذاری ترکیبات مولولی به روش عدد اکسایش هم توضیح بدید.
جامع ، کامل ،مفید
ممنون خیلی کمک کننده بود
دمتون گرم ، خیلی کامل و جامع بود
به خصوص ممنون بابت تمارین و همچنین عکس هایی که بینشون گذاشته بود چون واقعا موجب برطرف شدن خستگی می شدن(: