تیتراسیون پتانسیومتری چیست؟ – پتانسیل سنجی به زبان ساده
«تیتراسیون پتانسیومتری» (Potentiometric Titration) روشی مشابه تیتراسیون مستقیم برای یک واکنش اکسایش و کاهش است که از آن برای مطالعه اسیدها استفاده میشود. تفاوت عمده و اساسی تیتراسیون پتانسیومتری با دیگر روشهای تیتراسیونی در این است که از شناساگر برای تعیین نقطه پایانی تیتراسیون استفاده نمیکند و اختلاف پتانسیل در حین پیشروی واکنش مورد بررسی قرار میگیرد. در این مطلب از مجله فرادرس میخواهیم با چیستی و نحوه انجام تیتراسیون پتانسیومتری آشنا شویم.
- خواهید آموخت که تیتراسیون پتانسیومتری چگونه با روشهای سنتی تفاوت دارد.
- میآموزید اختلاف پتانسیل را برای تعیین نقطه پایانی واکنش بهکار ببرید.
- نقش و عملکرد الکترودها و ابزارهای الکتروشیمیایی را یاد خواهید گرفت.
- با انواع عمده تیتراسیونهای پتانسیومتری و معیار انتخاب آنها آشنا میشوید.
- خواهید توانست دادههای تیتراسیون را تحلیل و منحنی مرتبط را تفسیر کنید.
- دلایل برتری و مزایای استفاده از پتانسیومتری نسبت به سایر روشها را میآموزید.


تیتراسیون پتانسیومتری چیست ؟
تیتراسیون پتانسیومتری که از آن با عنوان «پتانسیل سنجی» نیز یاد میشود، روشی در آنالیز حجمی است که از آن برای یافتن غلظت آنالیت در یک نمونه استفاده میشود. این آنالیت میتواند ترکیبات بسیار متنوعی باشد که توسط یک تیترانت با غلظت مشخص مورد تیتراسیون قرار میگیرد. در این روش غلظت گونه مجهول با اندازهگیری پتانسیل محلول در طی واکنش به دست میآید.
تیتراسیون پتانسیومتری
تیتراسیون روشی است که برای محاسبه غلظت یک محلول مجهول مورد استفاده قرار میگیرد. در هر تیتراسیون اجزا و مفاهیمی وجود دارند که بهتر است پیش از ادامه مطلب، مروری بر آنها داشته باشیم.
تیتراند
«تیتراند» (Titrand) محلولی با غلظت مجهول است که در فرایند تیتراسیون مورد بررسی قرار میگیرد. در واقع هدف از انجام تیتراسیون تعیین همین غلظت مجهول است. به تیتراند معمولا «آنالیت» (Analyte) نیز گفته میشود. این اندازهگیری بهصورت مستقیم یا غیرمستقیم انجام میشود. محلول تیتراند در ارلن مایر ریخته میشود و برای افزودن تیترانت آن را به دقت زیر شیر بورت قرار میدهند.

تیترانت
«تیترانت» (Titrant) محلولی است که به آنالیت افزوده میشود. برای مثال در تیتراسیون اسید و باز، تیترانت اسید یا بازی قوی است که غلظت آن را در اختیار داریم. برای کنترل میزان افزودن تیترانت به نمونه موجود در ارلن از بورت استفاده میشود تا بتوان آن را بهآهستگی و قطرهقطره افزود. در این صورت احتمال وجود خطا در اندازهگیری حجم و به دنبال آن انجام محاسبات مربوط به غلظت مجهول کاهش پیدا میکند. توجه داشته باشید که بهمحض رسیدن به نقطه پایان تیتراسیون که معمولا با شناساگر رنگی مشخص میشود، شیر بورت را باید بست.

شناساگر
«شناساگر» (Indicator) مادهای است که در پاسخ به تغییرات شیمیایی محیطی که در آن قرار دارد، از خود تغییر رنگی واضح نشان میدهد. مثلا میتوان در «تیتراسیون اسید و باز» (Acid And Base Titration) از شناساگر «فنل فتالیین» (Phenolphthalein) برای شناسایی نقطه پایانی تیتراسیون استفاده کرد. در این روش تغییر رنگ با توجه به مقدار رخ میدهد. در هر تیتراسیون با توجه به اجزا، میتوان شناساگر مناسب را انتخاب و استفاده کرد. البته میتوان برای سنجش نقطه پایانی تیتراسیون از روشهایی غیر از استفاده از شناساگر نیز بهره برد.

نقطه همارزی
«نقطه همارزی» (Equivalence Point) نقطهای از تیتراسیون است که در آن تیتراسیون از نظر تئوری به پایان رسیده است. در نقطه همارزی تعداد مولهای تیترانت و تعداد مولهای آنالیت با یکدیگر برابر هستند.
نقطه پایانی
«نقطه پایانی» (End Point) نقطهای است که در تیتراسیونها توسط یک شناساگر به عنوان پایان تیتراسیون مشخص میشود. در واقع در آزمایشهای تجربی، نقطه مبنای اتمام تیتراسیون، نقطه پایانی است. در این نقطه حجم استفاده شده از تیترانت برای انجام محاسبات یادداشت میشود و به کمک آن غلظت مجهول آنالیت به دست میآيد. گرچه در بسیاری موارد نقطه همارزی و نقطه پایانی با یکدیگر یکسان در نظر گرفته میشوند اما باید به تفاوت میان آن دو آگاه باشیم.

روشهای متنوع تیتراسیون با توجه به جزئيات اجرای خود به دستههای مختلفی طبقهبندی میشوند که در زیر تعدادی از آنها را آوردهایم. توجه داشته باشید که تیتراسیون پتانسیومتری نیز یکی از این دستهها است.
- تیتراسیون اسید و باز
- تیتراسیون اکسایش و کاهش
- تیتراسیون برگشتی
پتانسیومتری در شیمی تجزیه
در این روش از یک «پتانسیومتر» (Potentiometer) برای اندازهگیری اختلاف پتانسیل بین دو الکترود (الکترود مرجع و الکترود شناساگر) استفاده میشود. یکی از این الکترودها در ظرف نمونه و دیگری در محلولی استاندارد با غلظت مشخص گذاشته میشود. آنالیت موجود در نمونه تا رسیدن به نقطه همارزی توسط تیترانت، تیتر میشود.
در نقطه همارزی، تفاوت پتانسیل بین دو الکترد به ثبات میرسد. در این صورت میتوان غلظت گونه مجهول را از غلظت محلول استاندارد و اختلاف پتانسیل مورد محاسبه قرار داد. از این روش تیتراسیونی در شیمی تجزیه بهوفور استفاده میشود.
سلول تیتراسیون پتانسیومتری
الکترود شناساگری که به عنوان مرجع مورد استفاده قرار میگیرد معمولا الکترود هیدروژن یا الکترود نقره کلرید است. بنابراین یک نیمسلول شامل الکترود مرجع است. این الکترود پتانسیل را ثابت نگه میدارد و زمانی که در محلول نمونه وارد میشود، پایداری خود را حفظ میکند. نیمسلول دیگر شامل الکترود شناساگر و یونهای آنالیت است که محلول الکترولیت را تشکیل میدهند. این الکترود به تغییر پتانسیل محلول آنالیت پاسخ میدهد.
محاسبات تیتراسیون پتانسیومتری
پتانسیل کلی سلول تیتراسیونی را میتوان از رابطه زیر به دست آورد.
- : پتانسیل کلی سلول
- : پتانسیل نیمسلول شناساگر
- : پتانسیل نیمسلول مرجع
- : افت پتانسیل بین الکترود شناساگر و الکترود مرجع روی محلول الکترولیت. به آن پتانسیل اتصال پل نمکی نیز گفته میشود.
منحنی تیتراسیون پتانسیومتری، شامل محوری عمودی است که اختلاف پتانسیل را بر حسب ولت نشان میدهد. همچنین محور افقی این نمودار حجم افزوده شده تیترانت در هر لحظه را نمایان میکند. نمونهای از این منحنی در زیر آورده شده است.
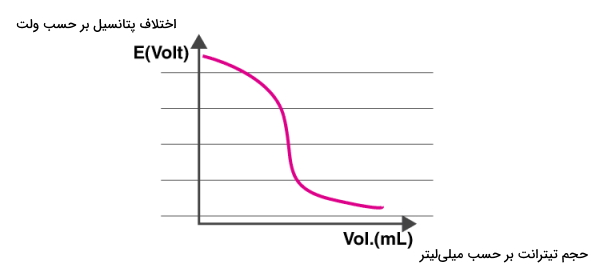
از این منحنی پیداست که پتانسیل الکتریکی سلول وابسته به غلظت یونهایی است که در تماس با الکترود شناساگر قرار دارند. به همین دلیل است که پتانسیل سلول را با اضافه شدن تدریجی تیترانت بررسی میکنیم.
شناساگر تیتراسیون پتانسیومتری
در پتانسیل سنجی از شناساگر شیمیایی استفاده نمیشود. در واقع به هر تیتراسیونی که برای تشخیص نقطه همارزی به جای مواد شیمیایی از اختلاف پتانسیل بهره ببرد، تیتراسیون پتانسیومتری یا پتانسیل سنجی گفته میشود. این تیتراسیون میتواند تیتراسیون اسید و باز، تیتراسیون کمپلکسومتری یا باقی انواع تیتراسیونها باشد. برای مثال در تیتراسیون اسید و باز معمولی از شناساگر اسید و بازی مانند «فنول فتالیین» استفاده میشود که پایان واکنش را با تغییر رنگ نشان میدهد. در ادامه به بررسی تیتراسیونهایی میپردازیم که در این دسته گنجانده میشوند.
انواع تیتراسیون پتانسیومتری
۴ نوع تیتراسیون وجود دارند که میتوانند در دسته تیتراسیون پتانسیومتری گنجانده شوند. در زیر فهرستی از این تیتراسیونها را به همراه توضیح مختصری از چگونگی انجام آنها آوردهایم.
- تیتراسیون اسید و باز: در این تیتراسیون غلظت مجهول یک اسید یا باز را به وسیله خنثی کردن آن با یک باز یا اسید به دست میآورند. این نوع تیتراسیون یکی از رایجترین انواع تیتراسیونها به شمار میآید و استفاده فراوانی نیز دارد.
- تیتراسیون اکسایش و کاهش: این نوع تیتراسیون شامل تیترانت و آنالیتی است که با یکدیگر وارد واکنش اکسایش و کاهش میشوند. مثالی از این مورد تیتراسیون واکنش محلول ید با یک عامل کاهنده است که منجر به تولید یون یدید میشود. در این نوع تیتراسیون از شناساگر نشاسته برای تعیین نقطه پایان تیتراسیون استفاده میشود.
- تیتراسیون کمپلکسومتری: در این نوع تیتراسیون یک کمپلکس رنگی به وجود میآيد و پایان تیتراسیون را نشان میدهد. از این روش میتوان برای اندازهگیری چند عدد یون فلزی در یک محلول واحد استفاده کرد.
- تیتراسیون رسوبی: این نوع تیتراسیون شامل واکنشی بین آنالیت و تیترانتی است که محصول آنها یک رسوب نامحلول در آب است. نقطه پایان این تیتراسیون زمانی به دست میآيد که با افزودن مقدار تیترانت، در مقدار رسوب تغییری مشاهده نشود.
مثال نحوه انجام تیتراسیون پتانسیومتری
حال که با نحوه انجام پتانسیل سنجی آشنا شدیم، مثالی را مورد بررسی قرار میدهیم تا یک تیتراسیون را مرحله به مرحله پیگیری کنیم. در این مورد، تیتراسیون پتانسیومتری از نوع اسید و باز است که طی آن هیدروکلریک اسید را به کمک محلول سدیم هیدوکسید تیتر میکنیم.
- در نیمسلول اول، محلول اسید قرار دارد که الکترود آن «کوین هیدرون» (Quinhydrone) یا «شیشه» (Glass) است. این نیمسلول به نیمسلول الکترود استاندارد کالومل متصل میشود.
- در مرحله اول، محلول تیترانت سدیم هیدروکسید را به کمک یک بورت به بشر اضافه میکنیم. در ابتدا میتوانیم هر بار مقدار زیادی در حد ۰٫۵ میلیلیتر اضافه کنیم اما با پیش روی تیتراسیون، برای افزایش دقت، در هر بار حدود ۰٫۱ میلیلیتر را وارد محلول آنالیت خواهیم کرد.
- بعد از هر بار اضافه کردن حجمی از تیترانت، اختلاف پتانسیل را از پتانسیومتر میخوانیم و یادداشت میکنیم.
- نموداری که در هر نقطه حجم تیترانت اضافه شده را بر اساس پتانسیل خوانده شده در آن نشان بدهد، منحنی این تیتراسیون پتانسیومتری خواهد بود.
پتانسیومتری اکسایش و کاهش
در این بخش میخواهیم مثالی از تیتراسیون پتانسیومتری اکسایش و کاهش را مورد بررسی قرار دهیم. در این پتانسیل سنجی، تیترانت یون پرمنگنات با فرمول شیمیایی است که عاملی اکسنده به حساب میآید. نیمواکنش موازنه شده و پتانسیل الکتروشیمیایی استاندارد آن را تحت شرایط اسیدی در زیر آوردهایم.
همچنین آنالیتی که مورد تیتراسیون قرار میگیرد محلولی از است که میتوان واکنش اکسیداسیون آن را بهصورت زیر نمایش داد.
برای هر کدام از نیمواکنشهای بالا میتوان بهصورت مجزا یک رابطه نرنست نوشت. رابطه نرنست زیر مربوط به نیمواکنش پرمنگنات است.
همچنین اختلاف پتانسیل حاصل از یک سلول را بهصورت زیر نمایش میدهیم.
در ادامه به بررسی الکترود مرجع و الکترود شناساگر در این تیتراسیون میپردازیم.
الکترود مرجع
الکترود مرجع طوری طراحی میشود که مقدار پتانسیل آن در طول زمان ثابت بماند، همچنین به دور از محلول آنالیت و تیترانت و در سلولی جداگانه نگهداری میشود. تماس الکتریکی این دو سلول نیز به وسیله یک «اتصال مایع» (Liquid Junction) برقرار میشود که عملکردی مانند پل نمکی دارد. در این مورد الکترود مرجع، است و نیمواکنش آن را میتوان بهصورت زیر نشان داد.
در این الکترود، نقره کلرید رسوبی نامحلول است که روی سطح فلز نقره قرار میگیرد. این الکترود را میتوان بهصورت خلاصه به شکل زیر نیز نمایش داد.
الکترولیت مورد استفاده در اتصال مایع این الکترود، پتاسیم کلرید بهصورت محلول اشباع است زیرا توانایی کاهش پتانسیل اتصال مایع الکترولیت در الکترود مرجع و محلول مورد آزمایش را دارد. رابطه نرنست برای الکترود را میتوان بهصورت زیر نوشت.
در این مورد پتانسیل استاندارد برای این نیمواکنش برابر با ۰٫۲۲۲ ولت و غلظت یون کلرید در پتاسیم کلرید اشباع در دمای ۲۵ درجه سانتیگراد نیز برابر با ۴ مولار است.
الکترود شناساگر
الکترود شناساگر در این مورد سیمی از جنس پلاتین است. این الکترود منبعی برای الکترونهاست و خود در نیمواکنش شیمیایی الکترود شرکت نمیکند. پتانسیل تعادل مربوط به نیمواکنش در این سلول برقرار میشود. برای مثال، اگر تعادل اکسایش و کاهش در این سلول بهصورت زیر باشد:
پتانسیل الکترود شناساگر را میتوان از رابطه زیر به دست آورد.
در این رابطه پتانسیل استاندارد نیمواکنش را با نماد نشان میدهیم و مقدار آن در محلول غلیظ برابر با ۰٫۶۸ ولت است. اگر غلظت و با یکدیگر برابر باشند، پتانسیل الکترود شناساگر برابر با پتانسیل استاندارد زوج اکسایش و کاهش خواهد بود. با جایگذاری اطلاعات مورد نیاز، مقدار پتانسیل سلول برابر با ۰٫۴۶ ولت به دست میآيد.
انحراف از پتانسیل تعادل سلول
همانطور که پیش از این گفتیم، دو نیمواکنش این تیتراسیون اکسایش و کاهش را میتوان بهصورت زیر نمایش داد.
بنابراین واکنش اکسایش و کاهش را میتوان به شکل تعادل زیر نوشت.
تیتراسیون را با نمونهای از شروع میکنیم. در ابتدا، غلظت بسیار کم است و به همین علت نسبت مقدار بسیار بزرگی خواهد بود. پتانسیل الکترود شناساگر را میتوان از رابطه زیر به دست آورد.
بنابراین پتانسیل الکترود شناساگر در این حالت عددی بسیار منفی خواهد بود. با افزودن تیترانت از بورت به آنالیت، غلظت گونه افزایش پیدا میکند و پتانسیل الکترود شناساگر به سمت اعداد مثبت متمایل میشود. توجه داشته باشید که برای رسم منحنی تیتراسیون، تغییرات پتانسیل شناساگر را با توجه به مقدار تیترانتی که در هر لحطه اضافه میشود، میتوانیم رسم کنیم.
در این تیتراسیون زمانی به نقطه همارزی میرسیم که ۱ مول از تیترانت به ازای هر ۴ مول از آنالیت افزوده میشود. بنابراین میتوان در این نقاط تساوی زیر را برقرار دانست.
با وجود اینکه غلظت و بسیار کم است، تساوی زیر در تمامی نقاط تیتراسیون صدق میکند.
در نقطه تعادل، پتانسیل الکتروشیمیایی نیمواکنش اکسایش و کاهش در محلول تیتر شده، باید تقریبا برابر با یکدیگر باشند. این تساوی را میتوان بهصورت زیر نشان داد.
در تساوی بالا منظور از ، تیترانت این تیتراسیون، پرمنگنات است. در نتیجه میتوان رابطه زیر را نوشت.
از واکنش کلی این اکسایش و کاهش میتوان رابطه زیر را برای به دست آوردن مقدار ثابت تعادل به دست آورد.
همانطور که مشاهده میکنید ثابت تعادل عدد بسیار بزرگی است و طبق اصل لوشاتلیه واکنش اکسایش و کاهش به شدت به سمت محصولات پیشروی میکند و واکنش کامل میشود.
این رابطه را میتوان با توجه به روابط بالا بازآرایی کرد، از آن لگاریتم گرفت و نتیجه بهصورت زیر خواهد بود.
برای برآورد مقدار پتانسیل الکترود شناساگر در نقطه همارزی، آن را با توجه به رابطههای ذکر شده در بالا، به شکل زیر مینویسیم.
با اعمال شرایط تیتراسیون، رابطه به شکل زیر در میآيد.
در صورتd که غلظت یون هیدرونیوم برابر با ۱ باشد، جمله دوم برابر با ۰ خواهد بود و میتوان محاسبات را بهصورت زیر انجام داد و به پاسخ رسید.
در انجام تیتراسیون پتانسیومتری، متوجه خواهید شد که مقدار تغییر پتانسیل در نزدیکی نقطه همارزی بسیار شدید است. توجه به این نکته از اهمیت بهسزایی برخوردار است و باید در نزدیک این نقطه افزایش تیترانت به آنالیت، با سرعت بسیار کندتری صورت گیرد.
پتانسیومتری اسید و باز
در این بخش میخواهیم به بررسی یک مثال از تیتراسیون اسید و باز بپردازیم که درآن از پتانسیومتری برای پیبردن به نقطه پایان تیتراسیون استفاده شده است. در این تیتراسیون از الکترود شیشه و «پیاچ سنج» (pH Meter) کمک میگیریم. توجه داشته باشید که پتانسیل به وجود آمده در این الکترود در تناسب با غلظت یون هیدرونیوم در محلول است.
در این تیتراسیون هدف به دست آوردن جرم مولکولی و ثابت تفکیک اسیدی است. به این صورت میتوانیم تشخیص بدهیم که اسید ضعیف چیست. میتوانیم تفکیک اسید ضعیف در آب را به کمک رابطه زیر نشان دهیم.
در این رابطه، نشاندهنده پروتون اسیدی و نشاندهنده باز مزدوج اسید ضعیف است. ثابت تعادل برای این تفکیک را با نماد نشان میدهند و رابطه آن بهصورت زیر خواهد بود.
با بازآرایی این رابطه با در نظر داشتن یون هیدرونیوم، به رابطه زیر خواهیم رسید.
زمانی که حجم تیترانت افزوده شده به نصف مقداری برسد که برای رسیدن به نقطه همارزی نیاز است، غلظت باقیمانده برابر با غلظت تشکیل شده در واکنش خنثیشدن خواهد بود. این تساوی را میتوان بهصورت زیر نمایش داد.
همچنین تساوی زیر بین غلظت یون هیدرونیوم و مقدار ثابت تفکیک اسیدی صدق خواهد کرد.
با لگاریتم گرفتن از تساوی بالا، غلظت یون هیدرونیوم تبدیل به و مقدار تبدیل به میشود.
در جدول زیر مقدار ثابت تعادل اسیدی تعدادی از اسیدهای ضعیف رایج آورده شده است. در هر مورد میتوان تیتراسیون را انجام داد و از روی اطلاعات این جدول نوع اسید ضعیف مورد تیتراسیون را مشخص کرد.
| نام و فرمول شیمیایی اسید | مقدار | وزن مولکولی |
| استیک اسید/ | ۴٫۷۴ | ۶۰٫۰۵ |
| بنزوئیک اسید/ | ۴٫۲۰ | ۱۲۲٫۱۲ |
| سالیسیلیک اسید/ C_7H_6O_3 | ۲٫۹۸ | ۱۳۸٫۱ |
| سدیم بیکربنات/ | ۱۰٫۳۶ | ۸۴٫۰۱ |
| بوریک اسید/ | ۹٫۲۴ | ۶۱٫۸۴ |
| مندلیک اسید/ | ۳٫۴۰ | ۱۵۲٫۱۵ |
| سدیم سیترات/ | ۶٫۴۰ | ۲۳۶٫۱ |
| سدیم مالونات/ | ۵٫۶۶ | ۱۲۶٫۱ |
| سدیم فسفات/ | ۱۲٫۳۲ | ۱۴۳٫۰ |
پتانسیومتری کلرید و یدید
در برخی تیتراسیونهای پتانسیومتری از «الکترودهای یونگزین» (Ion Selective Electrodes) به عنوان الکترود شناساگر استفاده میشود. این الکترودها را به اختصار با ISE نشان میدهند و در آزمایشگاههای زیستی برای اندازهگیری غلظت یونهای مختلف، از جمله یون کلسیم در خون، مورد استفاده قرار میگیرند. از آنجا که الکترودهای یونگزین به جای غلظت، فعالیت یا اکتیویته را اندازهگیری میکنند، نیاز به مقدار بسیار زیادی از الکترولیتی بیاثر برای ثابت نگه داشتن قدرت یونی داریم، زیرا در صورتی که قدرت یونی محیط ثابت باشد، مقدار فعالیت ثابت میماند و از آن میتوان غلظت را محاسبه کرد.
پتانسیومتری کلرید
الکترود یونگزین به کار رفته در پتانسیومتری کلرید، «الکترود شیشه حالت جامد» (Crystalline Solid State Electrode) که شامل لایهای متشکل از نقره سولفید و نقره کلرید است. این غشا باید در محلول آنالیت نامحلول باشد. این غشا در انتهای لوله پلاستیکی قرار داده میشود و در طول تیتراسیون، در تماس با محلول آنالیت است. درون این لوله یک محلول مرجع قرار دارد که حاوی غلظت ثابتی از آنالیت، در اینجا یون کلرید، است. اختلاف غلظت یونهای کلرید در این محلول و محلول آنالیت باعث مهاجرت گونههای باردار در طول این غشا میشود. این مهاجرت باعث به وجود آمدن اختلاف پتانسیل میشود.
از آنجا که پتانسیل الکترود مرجع و مرجع داخلی ثابت است، تنها اختلاف پتانسیل را به همین مورد میتوان ربط داد. در فهرست زیر تجهیزات و موادی که در این تیتراسیون مورد نیاز هستند را مشاهده میکنید.
- سدیم کلرید
- بافر تنظیمکننده قدرت یونی (Ionic Strength Adjustment Buffer)
- ارلن
- بشر
- لوله پلاستیکی
- همزن مغناطیسی
- پتانسیومتر
محاسبات پتانسیومتری کلرید
برای انجام محاسبات مربوط به پتانسیومتری کلرید از رابطه نرنست استفاده میکنیم که در آن مقدار پتانسیل با واحد ولت مشخص میشود. توجه داشته باشید با وجود اینگه در این رابطه معمولا غلظتها با واحد مولاریته جایگذاری میشوند، میتوان از واحد ppm نیز در آن استفاده کرد و مشکلی به وجود نمیآید.
پتانسیومتری یدید
در تیتراسیون ید، معمولا از نشاسته به عنوان شناساگر استفاده میشود که در حضور ید به زنگ آبی بسیار تیره در میآید. با این حال به دلیل انحلالپذیری بسیار پایین ید در آب، کاربرد این روش محدود شده است.
یکی از روشهای جایگزین برای این تیتراسیون استفاده از پتانسیومتری است که در آن نیازی به حضور شناساگر نداریم. نحوه انجام تیتراسیون پتانسیومتری برای یدید مشابه نحوه انجام آن برای کلرید است که در بخش قبلی به تفضیل به آن پرداختهایم. در این تیتراسیون از سدیم تیوسولفات بهعنوان تیترانت استفاده میشود.
تفاوت پتانسیومتری و ولتامتری
یکی از پرتکرارترین پرسشهایی که پیرامون این روش اندازهگیری در شیمی تجزیه وجود دارد، تفاوت بین پتانسیومتری و ولتامتری است.
در فهرست زیر میتوانید به تعدادی از تفاوتهای موجود بین این دو روش نگاهی بیاندازید.
- از پتانسیومتری معمولا برای به دست آوردن غلظت یک محلول استفاده میشود و روشی متداول در شیمی تجزیه است.
- ولتامتری نیز روشی تحلیلی در شیمی تجزیه است که در بسیاری از فرآيندهای صنعتی و آزمایشگاهی از آن کمک گرفته میشود.
- در پتانسیومتری، اختلاف پتانسیل بین دو الکترود به کمک یک ولتمتر با مقاومت بالا مورد اندازهگیری قرار میگیرد.
- در ولتامتری اطلاعات مورد نیاز آنالیت، با اندازهگیری جریان در زمان تغییر پتانسیل، به دست میآيد.
کاربرد تیتراسیون پتانسیومتری
از تیتراسیون پتانسیومتری در حوزههای مختلف و به اهداف گوناگونی استفاده میشود. در این بخش میخواهیم به برخی از مهمترین این کاربردها اشارهای داشته باشیم.
شیمی بالینی
در «شیمی بالینی» (Clinical Chemistry) از روشهای شیمیایی برای تشخیص بیماریها استفاده میشود. علوم پزشکی با شیمی مایعات بدن مانند خون، ادرار و مایع نخاعی ارتباط تنگاتنگی دارد. همچنین در این حوزه از تجهیزات و روشهای اندازهگیری شیمیایی برای تعیین مولفههای مورد نیاز از آنزیمها، الکترولیتها، پروتئینها و لیپیدها بهره گرفته میشود. در این حوزه آنالیتهایی که به این روش مورد ارزیابی قرار میگیرند، شامل موارد زیر میشوند.
شیمی محیط زیست
«شیمی محیطزیست» (Environmental Chemistry) به مطالعه شیمیایی و بیوشیمیایی پدیدههایی میپردازد که در محیط طبیعی به وقوع میپیوندند. در این علم میزان آلایندههای تولیدشده و روشهایی برای کاهش میزان آنها، بررسی میشود و دانشمندان این حوزه از دانش خود برای حل مشکلات محیطزیستی بهره میبرند. از همین جهت کمیسازی عوامل دخیل از اهمیت بسیاری برخوردار است. در این حوزه آنالیتهایی که در فاضلاب به این روش مورد ارزیابی قرار میگیرند، شامل موارد زیر میشوند.
کشاورزی
کشاورزی همچنان یکی از بزرگترین صنایع موجود در بسیاری از کشورهای جهان است و از روش تیتراسیون پتانسیومتری در آن، برای تعیین موارد زیر در خاک، کود و محصولات بهره گرفته میشود. در زیر فهرستی از آنالیتهای این حوزه را مشاهده میکنید.
- پتاسیم
- کلسیم
- آمونیاک
مزایای تیتراسیون پتانسیومتری
همانطور که پیشتر اشاره کردیم از این روش در حوزههای بسیار متنوعی استفاده میشود. در این بخش میخواهیم بر برخی از مزیتهای این روش که باعث کاربرد گسترده آن شده است، مروری داشته باشیم.
- تیتراسیون پتانسیومتری را میتوان بهراحتی برای محلولهای رنگی به کار برد. در این موارد استفاده از تیتراسیونهای نیازمند به شناساگر، ممکن نخواهد بود.
- از این روش میتوان برای آنالیز ترکیب دو اسید با ثابت تفکیک متفاوت بهره برد، بهصورتی که تنها به یک تیترانت نیاز باشد.
- از تیتراسیون پتانسیومتری میتوان برای آنالیز کلرید، برمید، یدید در یک محلول استفاده کرد.
تاریخچه تیتراسیون پتانسیومتری
اولین تیتراسیون پتانسیومتری در سال ۱۸۹۳ توسط شیمیدان آلمانی، «آنتوان فردریش رابرت برناد» (Anton Friedrich Robert Behrend) به انجام رسید. او این تیتراسیون را روی محلولی جیوهای توسط پتاسیم کلرید ، پتاسیم برمید و پتاسیم یدید اجرا کرد. او در این تیتراسیون از الکترود جیوه به همراهی الکترود مرجع استفاده کرد و متوجه شد که در سلولی حاوی جیوه نیترات و ، ولتاژ اولیه برابر با ۰ است. اگر در یک طرف این سلول پتاسیم کلرید افزوده شود، جیوه(I) کلرید رسوب خواهد کرد. در این حالت فشار اسمزی یونهای جیوه(I) کاهش پیدا میکند و باعث ایجاد اختلاف پتانسیل میشود.

این اختلاف پتانسیل با افزایش مقدار پتاسیم کلرید اضافه شده، افزایش پیدا میکند و سپس با شیب بسیار تندتری پیشروی میکند. او متوجه شد که بیشترین اختلاف پتانسیل زمانی به دست میآید که تمام جیوه نیترات رسوب کرده باشد و همین نقطه را به عنوان نقطه پایانی بر این تیتراسیون پتانسیومتری در نظر گرفت.
بعد از برنارد، «ویلهلم کارل بوتگر» (Wilhelm Carl Bottger) مطالعات پتانسیل سنجی را ادامه داد. او از تیتراسیون پتانسیومتری برای مشاهده تفاوت بین تیتراسیون اسیدهای ضعیف و اسیدهای قوی و همچنین رفتار بازهای چند پروتونی بهره برد. بوتگر پیشنهاد داد که میتوان از تیتراسیون پتانسیومتری برای تیتراسیون اسیدها و بازهایی استفاده کرد که با روشهای متدوال استفاده از شناساگر قابل سنجش نیستند.

سپس شیمیدانی دیگر از این روش تیتراسیون برای واکنشهای اکسایش و کاهش بهره برد. او یونهای هالید را با پتاسیم پرمنگنات و به کمک الکترود پلاتین براق و الکترود کالومل، تیتر کرد. او اینطور بیان کرد که اگر عامل اکسنده به محلولی کاهنده افزوده شود، تعادل بین کاهنده و محصولات واکنش، به سمت محصولات جهتگیری خواهد کرد. این باعث تغییری آهسته در پتانسیل میشود و این تغییر تا مصرف کامل عوامل کاهنده ادامه مییابد. سپس شاهد تغییری چشمگیر در مقدار پتانسیل هستیم. زمانی که مقدار کمی به محلول تیتراسیون افزوده شود، اندک باقیمانده عوامل کاهنده نیز از بین خواهد رفت و پتانسیل تنها به عوامل اکسنده پاسخ میدهد. این تغییر بزرگ در مقدار اختلاف پتانسیل را به عنوان نقطه پایانی تیتراسیون در نظر گرفت.
مثال و حل تمرین از تیتراسیون پتانسیومتری
تا اینجا با مفهوم تیتراسیون پتانسیومتری آشنا شدیم. همانطور که میدانید بخش مهمی از درک هر مطلب، به توانایی پاسخگویی به سوالهای مرتبط و داشتن توانایی انجام محاسبات بستگی دارد. در بخشهای پیش رو، مثالها و تمرینهای متعددی را مورد بررسی قرار میدهیم.
مثال از تیتراسیون پتانسیومتری
در این بخش مثالی از تیتراسیون پتانسیومتری را مورد بررسی قرار میدهیم.
مثال اول
در این مثال تیتراسیون پتانسیومتری ترکیبی که حاوی دو اسید است را مورد بررسی قرار میدهیم. میدانیم که هر دوی این اسیدهای موجود تکپروتونی هستند و از یک اسید واحد، انتظار چند نقطه همارزی را نداریم. یکی از اسیدها قوی و دیگری ضعیف است.
اسیدهای قوی مانند هیدروکلریک اسید بهصورت کامل در آب تفکیک میشوند اما اسیدهای ضعیف مانند استیک اسید تفکیک کاملی ندارند. میزان تفکیک را میتوان از ثابت تعادل و مقدار اسید و باز ضعیف اضافهشده به محلول، به دست آورد. میزان اسیدی بودن یک اسید را معمولا با نمایش میدهند که در آن منظور از ثابت تفکیک برای واکنشی بهصورت زیر است.
تعادل دیگری که در این مثال مفید است، «رابطه هندرسون هسلباخ» (Henderson Hasselbach Equation) است که از آن میتوان برای بافری کردن منطقه تیتراسیون اسید ضعیف بهره گرفت. منحنی تیتراسیون این پتانسیومتری را میتوان بهصورت زیر نمایش داد.
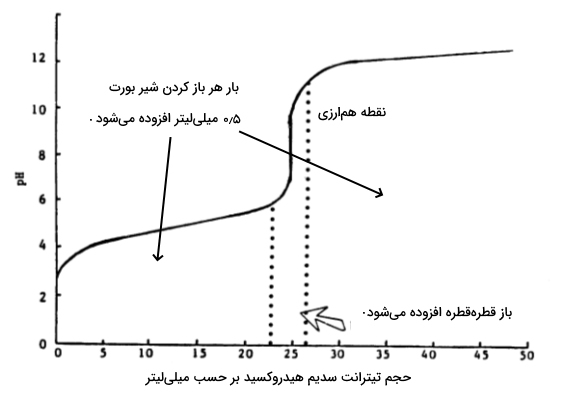
توجه داشته باشید که مقدار زمانی که غلظت اسید و باز مزدوج آن با یکدیگر برابر باشند، با مقدار یکسان خواهد بود.
حل تمرین از تیتراسیون پتانسیومتری
حال که تعدادی مثال را مورد بررسی قرار دادیم، به سراغ چند تمرین با پاسخ چندگزینهای میرویم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
سوالات متدوال
حال که با مفهوم تیتراسیون پتانسیومتری آشنا شدیم و روش انجام آن را مورد بررسی قرار دادیم، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای پیرامون این موضوع، پاسخ دهیم.
مهم ترین مزیت تیتراسیون پتانسیومتری چیست؟
یکی از مهمترین مزایای تیتراسیون پتانسیومتری این است که به مقدار بسیار کمتری از مواد، نسبت به روشهای مشابه نیاز دارد. همچنین این روش بسیار مقرون بهصرفه است.
نقطه پایانی تیتراسیون پتانسیومتری چطور تعیین می شود؟
در این روش از یک الکترود شناساگر و یک الکترود مرجع و اختلاف پتانسیل بین آنها، برای تشخیص نقطه پایانی تیتراسیون استفاده میشود.
چه الکترود هایی به عنوان مرجع در تیتراسیون پتانسیومتری استفاده می شوند؟
الکترود هیدروژن، الکترود نقره کلرید و الکترود کالومل در این تیتراسیون به عنوان الکترود مرجع به کار گرفته میشوند.
از تیتراسیون پتانسیومتری در چه حوزه هایی استفاده می شود؟
از این روش در حوزههای متنوعی مانند کشاورزی، شیمی بالینی و شیمی محیطزیست، برای سنجش مقادیر ترکیبات موجود در یک نمونه، بهره برده میشود.
جمعبندی
در این مطلب از مجله فرادرس با یکی از انواع تیتراسیونها، به نام تیتراسیون پتانسیومتری آشنا شدیم. در این روش بهجای استفاده از شناساگرهای شیمیایی متدوال تیتراسیون، اختلاف پتانسیل دو نیمسلول درگیر در واکنش را به کمک پتانسیومتر مورد بررسی قرار میدهند. از همین روش میتوان به نقطه پایان تیتراسیون پی برد و محاسبات لازم را برای به دست آوردن مقدار غلظت نمونه انجام داد. در این مطلب به اساس این روش و نحوه انجام آن پرداختیم.












