تیتراسیون اسید و باز – به زبان ساده + نمودار و محاسبات
تیتراسیون اسید و باز روشی است که بر مبنای واکنش بین یک اسید و یک باز انجام میشود. در علم شیمی از این روش در بیشتر موارد برای یافتن غلظت اسید و بازی خاص استفاده میشود. در این مطلب میخواهیم بدانیم تیتراسیون اسید و باز چگونه انجام میشود و چه انواعی دارد. همچنین در مورد روشهایی که برای محاسبه مجهولات وجود دارد، صحبت خواهیم کرد.
- میآموزید چگونه غلظت اسید یا باز را با تیتراسیون تعیین کنید.
- با ابزارهای مورد استفاده و مراحل آزمایشگاهی تیتراسیون آشنا خواهید شد.
- یاد خواهید گرفت شناساگر مناسب برای انواع مختلف تیتراسیون را انتخاب کنید.
- با مفاهیم منحنی تیتراسیون، نقطه همارزی و نقطه پایان آشنا میشوید.
- کاربردهای تیتراسیون را در شیمی، زیستشناسی و علوم محیطی بررسی میکنید.
- تفاوت تیتراسیون اسیدهای تکپروتونی و چندپروتونی را خواهید آموخت.


تیتراسیون اسید و باز چیست ؟
«تیتراسیون اسید و باز» (Acid Base Titration) روشی برای آنالیز کمی در گرایش شیمی تجزیه است. از این روش برای محاسبه غلظت اسید یا باز استفاده میشود، به صورتی که نقطه خنثی شدن آن، با بهرهگیری از «محلولی استاندارد» (Standard Solution) از اسید یا بازی با غلظت مشخص، به دست میآيد. برای بررسی تغییرات حاصل از واکنش اسید و باز از یک شناساگر استفاده میشود.

در صورتی که مقدار ثابت تفکیک اسیدی یک اسید یا ثابت تفکیک بازی یک باز در «محلول آنالیت» (Analyte Solution) مشخص باشد، میتوان غلظت یا مولاریته آن را به دست آورد.
از طرفی عکس این محاسبات نیز ممکن است، یعنی میتوان با در دست داشتن مقدار غلظت یک اسید با باز ثابت تفکیک اسیدی یا بازی آن را با رسم منحنی تیتراسیون، تعیین کرد. در ادامه میخواهیم در مورد تمام این مفاهیم بهتفضیل صحبت کنیم.
تیترانت و تیتران
در تیتراسیون علاوه بر شناساگر دو جزء وجود دارند. در این بخش میخواهیم با آنها آشنا شویم.
- تیترانت: محلولی که دارای غلظت مشخص است و از آن به عنوان محلول استاندارد نیز یاد میشود.
- تیتران: محلول آنالیتی که غلظت آن نامشخص است، تیتران یا تیتراند نامیده میشود. در واقع هدف از تیتراسیون اسید و باز، به دست آوردن همین غلظت مجهول است.
مفاهیم مرتبط با تیتراسیون اسید و باز
در بحث تیتراسیون اسید و باز با مفاهیمی روبرو میشویم که نیاز داریم بدانیم به چه معنایی هستند. در این بخش مروری بر آنها خواهیم داشت. به یاد سپردن این اصطلاحات به درک بهتر مطلب کمک بهسزایی خواهد کرد.
- تیتراسیون: فرایندی که در آن از واکنش بین یک جزء با غلظت مشخص، با جز دومی با غلظت مجهول به همراه شناساگر مناسب، برای تعیین غلظت جزء دوم استفاده میشود.
- منحنی تیتراسیون: نموداری که تغییرات را نسبت به حجم تیترانت نشان میدهد. از مطالعه این منحنی میتوان به اطلاعات سودمندی دست یافت.
- نقطه همارزی: نقطهای که در آن واکنش بین تیترانت و تیتران کامل میشود.
- محلول بافر:محلولی که در افزودن اسید و باز، یا رقیق کردن یک محلول، نسبت به تغییرات مقاوم است.
- نقطه پایان تیتراسیون: به نقطهای که در آن رنگ شناساگر تغییر میکند، «نقطه پایان» (Endpoint) گفته میشود. شناساگر مناسب باید طوری انتخاب شود که تغییر رنگ آن نزدیک به نقطه همارزی باشد تا دقت تیتراسیون بالا برود.
قلیایی سنجی و اسید سنجی چیست ؟
«قلیایی سنجی» (Alkalimetry) و «اسید سنجی» (Acidimetry) آنالیزهایی حجمی هستند که مبنای هر دو بر «واکنشهای خنثی شدن» (Neutralization Reaction) است.
در روش قلیایی سنجی از تیتراسیون اسید و باز برای شناسایی و تعیین غلظت یک نمونه اسیدی به کمک باز بهرهگیری میشود. به همین طریق اسید سنجی روشی است که در آن یک باز به کمک اسید استاندارد شناسایی و تعیین غلظت میشود.
شناساگر تیتراسیون اسید و باز
شناساگر مناسب باید به گونهای باشد که توانایی تعیین نقطه پایانی تیتراسیون را داشته باشد. تغییرات نشاندهنده پایان تیتراسیون، مانند تغییر رنگ محلول، باید در نقطهای نزدیک به «نقطه همارزی» (Equivalence Point) نمود پیدا کنند. در این صورت محاسبات دقیقتر خواهد بود. برای تخمین نقطه همارزی میتوان به نکات زیر توجه کرد.
- اسید قوی با باز قوی به گونهای واکنش میدهد که مقدار نزدیک به ۷ و خنثی باشد. مثالی از این نوع تیتراسیون واکنش بین هیدروکلریک اسید و سدیم هیدروکسید است.
- اسید ضعیف با باز قوی به صورتی وارد واکنش میشود که مقدار کوچکتر از ۷ باشد. واکنش بین اتانوییک اسید و سدیم هیدروکسید مثالی از این نوع است.
- اسید قوی با باز ضعیف بهگونهای واکنش میدهد که مقدار بزگتر از ۷ خواهد بود. واکنش بین هیدروکلریک اسید و آمونیاک مثالی از این نوع تیتراسیون است.
همانطور که مشاهده کردید در این دستهبندی واکنش بین اسید ضعیف و باز ضعیف گنجانده نشده است زیرا این مورد حالتهای متفاوتی را به وجود میآورد که در ادامه به آنها خواهیم پرداخت. هنگامی که اسید ضعیف با باز ضعیف وارد واکنش میشود، اگر قدرت باز از اسید بیشتر باشد، نقطه همارزی بازی خواهد بود. برعکس این حالت نیز صادق است، یعنی اگر قدرت اسید از باز بیشتر باشد، نقطه همارزی اسیدی میشود. در این مورد حالت سومی نیز وجود دارد. در حالتی که قدرت اسید ضعیف و باز ضعیف با یکدیگر برابر باشد، نقطه همارزی خنثی به دست میآید.
با این حال باید به این نکته توجه داشته باشید که شرایط گفته شده بهصورت نظری ساده و دستیافتنی است زیرا در عمل به ندرت از تیتراسیون اسید و باز ضعیف استفاده میشود. دلیل این امر آن است که تغییر رنگ شناساگر در نقطه همارزی بسیار سریع است و پیگیری آن مشکل خواهد بود. مثالی از واکنش بین اسید ضعیف و باز ضعیف، تیتراسیون اتانوییک اسید با آمونیاک است.
شناساگری مطللوب است که پررنگ باشد و در نزدیک نقطه به سرعت تغییر رنگ بدهد. در این صورت با افزودن مقدار ناچیزی از شناساگر به محلول، تیتراسیون قابل انجام خواهد بود. اگر مقدار شناساگر افزوده شده به محلول زیاد باشد، روی تاثیر میگذارد و دقت تیتراسیون اسید و باز را کاهش میدهد و ارزش کار را کم میکند. همچنین ثابت تفکیک اسیدی شناساگر باید نزدیک به نقطه پایان تیتراسیون باشد. برای درک بهتر این مورد مثالی را مورد بررسی قرار میدهیم.

تصور کنید آنالیتی داریم که باز ضعیف است. برای این نمونه نیازمند شناساگری با مقدار ثابت تفکیک اسیدی کوچکتر از ۷ داریم. اگر این ثابت تفکیک اسیدی به نقطه پایان تیتراسیون اسید و باز نزدیک باشد، تغییر رنگ سریع و به شدت صورت میگیرد و باعث کاهش خطای محاسباتی میشود.
انواع شناساگر
شناساگرهای بسیار متنوعی برای انجام تیتراسیون اسید و باز وجود دارند و در هر آزمایش باید با توجه به شرایط بهترین مورد را انتخاب کنیم. همانطور که پیشتر گفتیم نزدیک بودن مقدار ثابت تفکیک اسیدی شناساگر به نقطه پایان بسیار مهم است و خطا را کاهش میدهد. در جدول زیر تعدادی از مهمترین و پرکاربردترین شناساگرها به همراه ویژگیهای خود آورده شدهاند.
| نام شناساگر | بازه | رنگ در محیط اسیدی - رنگ در محیط بازی |
| تیمول آبی | ۱٫۲ تا ۲٫۸ | قرمز - زرد |
| متیل نارنجی | ۳٫۱ تا ۴٫۴ | قرمز - نارنجی |
| برموفنول آبی | ۳ تا ۴٫۶ | زرد - آبی یا بنفش |
| متیل زرد | ۲٫۹ تا ۴ | قرمز - زرد |
| تترا برموفنول آبی | ۳ تا ۴٫۶ | زرد - آبی |
| متیل قرمز | ۴٫۴ تا ۶٫۲ | قرمز - زرد |
| پارا نتیترو فنول | ۵ تا ۷ | بیرنگ - زرد |
| فنول فتالیین | ۸ تا ۱۰ | بیرنگ - قرمز |
| نیترامین | ۱۱ تا ۱۳ | بیرنگ - نارنجی یا قهوهای |
| برمو کروزول سبز | ۴ تا ۵٫۶ | زرد - آبی |
در کل برای انتخاب شناساگر مناسب باید به ۳ مورد زیر توجه کرد تا بهترین شناساگر برای یک تیتراسیون انتخاب شود. توجه داشته باشید که انتخاب شناساگر از اهمیت بسیار بالایی برخوردار است زیرا میتواند تمامی محاسبات و در نتیجه غلظت مجهول به دست آمده را تحت تاثیر قرار دهد.
- بازه تیتراسیون: شناساگر باید در بازه تیتراسیون تغییر رنگ را نشان دهد. برای مثال اگر تیتراسیون شامل اسید قوی و باز قوی باشد، بازه تغییر بزرگ است و استفاده از برمو تیمول آبی که بازه بزرگی دارد، مناسب خواهد بود. درصورتی که تیتراسیون شامل اسید ضعیف و باز قوی باشد، بازه کوچک است و شناساگری مانند فنول فتالیین مناسب خواهد بود.
- نقطه همارزی مورد نظر: شناساگر باید در نقطه همارزی دچار تغییر رنگ شود تا با مشاهده آن متوجه پایان واکنش اسید و باز شویم. برای مثال اگر نقطه پایان تیتراسیون جایی باشد که اسید و باز یکدیگر را خنثی میکنند، شناساگری با ثابت تفکیک اسیدی نزدیک به ۷ به کار گرفته میشود. از این مورد میتوان به شناساگر برمو کروزول سبز اشاره کرد. اگر نقطه پایان تیتراسیون نقطهای باشد که اسید و باز در آن با نسبت مشخصی حضور داشته باشند، از شناساگری استفاده میکنیم که به آن نسبت نزدیک باشد.
- حساسیت شناساگر: شناساگر باید در نقطه پایان تیتراسیون از خود تغییر رنگ قابل مشاهدهای نشان دهد. برخی شناساگرها مانند تیمول آبی تغییر رنگ بسیار شدیدی دارند در حالی که برخی دیگر مانند متیل نارنجی تغییر رنگی تدریجی را از خود نشان میدهند.
نحوه عملکرد شناساگر
شناساگرها در واقع ترکیبهایی آلی هستند که در حضور مقدار خاصی از یون هیدرونیوم دچار تغییر رنگ میشوند. برای مثال فنول فتالیین در محلولی که یون هیدرونیوم در آن با غلظتی بیش از مولار باشد، مادهای بیرنگ است اما با حضور در محلولی که یون هیدرونیوم آن کمتر از این مقدار باشد از خود رنگی نارنجی نشان میدهد. تغییر رنگ فنول فتالیین در برابر با ۸٫۳ اتفاق میافتد. اسیدها و بازها خود یا اسید آلی ضعیف یا باز آلی ضعیف هستند.
تعادل شناساگر اسید و بازی مانند متیل نارنجی را میتوان بهصورت زیر نشان داد. در این تعادل شناساگر را به اختصار با نشان میدهند.
با توجه به این رابطه، ثابت تفکیک اسیدی آن نیز به شکل زیر خواهد بود.
آنیون متیل نارنجی، با نماد زرد است، در حالی که خود متیل نارنجی رنگ قرمز دارد. طبق «اصل لوشاتلیه» (Le Chatelier's Principle) در تعادل بالا، افزایش غلظت یون هیدرونیوم و کاهش مقدار ، آن را به سمت چپ میبرد و غلظت فرم غیریونیزه متیل نارنجی بیشتر خواهد شد. با اضافه کردن باز، تعادل به سمت فرم زرد رنگ و یونیزه متیل نارنجی پیشرفت میکند. توجه داشته باشید که رفتار شناساگرهای اسید و باز کاملا شبیه به رفتاری است که محلولهای بافری از خود نشان میدهند.
رنگ شناساگر نتیجهای قابلمشاهده ار تغییر نسبت غلظت دو گونه و است. اگر بیشتر شناساگر موجود در محلول (۶۰٪تا ۹۰٪) به صورت باشند، تغییر رنگ از قرمز به زرد را مشاهده میکنیم. به همین صورت اگر بیشتر شناساگر به صورت گونه باشند، انتظار رنگ قرمز را داریم. با جابهجایی پارامترهای موجود در رابطه بالا میتوانیم آن را به شکل زیر نیز نمایش دهیم.
در این صورت میتوان بهتر به این نکته پی برد که تغییر نسبت گونه بازی و اسیدی شناساگر با تغییر در مقدار یون هیدرونیوم در رابطه است. با کمی تغییر در این را تعادل میتوان به رابطهای جدید دست پیدا کرد که آن را در زیر آوردهایم.
فرمول نهایی مشابه «رابطه هندرسون هاسلباخ» (Henderson Hasselbalvh Equation) است و میتوان از آن برای تشریح تعادل شناساگرها استفاده کرد.
تغییر رنگ شناساگر
زمانی که میزان غلظت یون هیدرونیوم برابر با مقدار ثابت تفکیک اسیدی شناساگر باشد، طبق رابطه بالا نسبت غلظت دو گونه و برابر با ۱ خواهد بود، به این معنا که نیمی از شناساگر به صورت گونه با رنگ قرمز و نیمی دیگر به صورت گونه با رنگ زرد حضور دارد و رنگ محلول نارنجی میشود. وقتی مقدار محیط با تغییر مقدار یون هیدرونیوم به ۳٫۱ میرسد، محلول رنگی قرمز از خود نشان میدهد.
باید به این نکته دقت داشته باشید که بعد از این نقطه هرچه غلظت یون هیدرونیوم افزایش پیدا کند، هیچ تغییری در رنگ شناساگر ایجاد نمیشود. همچنین با کاهش غلظت یون هیدرونیوم افزایش مقدار به ۴٫۴ شناساگر در فرم یونیزه خود خواهد بود و شاهد رنگی زرد هستیم. مانند مورد قبل، بعد از این نقطه هرچه غلظت یون هیدرونیوم کم و مقدار زیاد شود، هیچ تغییر رنگی صورت نمیگیرد. بنابراین میتوان اینطور جمعبندی کرد که بازه تغییر رنگ برای متیل نارنجی بین برابر با ۳٫۱ تا ۴٫۴ است.
این ویژگی در بسیاری از مواد طبیعی از جمله کلم قرمز قابل مشاهده است. آب کلم قرمز شامل موادی است که با تغییر از قرمز به آبی روشن و سپس زرد تغییر رنگ میدهند. در هر حالت یک شناساگر مناسب باید به صورتی انتخاب شود که با اجزای دخیل در انواع تیتراسیون وارد هیچگونه واکنشی نشود زیرا تغییر غلظت هر جزء، تعادل را بر هم میزند و باعث ایجاد خطا در محاسبات میشود.

رفتار شناساگر اسید و باز
نکتهای که باید به آن توجه شود این است که شناساگر در مقدار خاص، بهطور ناگهانی دچار تغییر رنگ نمیشود و در واقع آن نیز دستخوش تیتراسیون اسید و باز خواهد شد. در ادامه به بررسی این مورد میپردازیم. با کاهش غلظت گونه و افزایش غلظت گونه ، رنگ محلول بهآهستگی از رنگی که که مشخصه است، به رنگی که مشخصه است، تغییر پیدا میکند.
پیشتر اشاره کردیم که ثابت تفکیک اسیدی شناساگر باید نزدیک به مورد انتظار برای نقطه همارزی باشد. با این حال انتخاب شناساگر مناسب برای تیتراسیون اسید و باز قوی حساسیت بالایی ندارد، زیرا در این مورد تغییر مقدار در نزدیکی نقطه همارزی بسیار شدید است. در مقابل، انتخاب شناساگر نامناسب برای تیتراسیون اسید و باز ضعیف میتواند خطای بسیار زیادی را منجر شود.
منحنی تیتراسیون اسید و باز
همانطور که در تصویر زیر مشاهده میکنید، منحنی تغییرات را نسبت به حجم، برای تیتراسیون ۵۰ میلیلیتر از اسید قوی هیدروکلریک اسید ۰٫۱ مولار و اسید ضعیف استیک اسید ۰٫۱ مولار به کمک باز سدیم هیدروکسید ۰٫۱ مولار نشان میدهد.
همچنین بازه که در آن دو شناساگر متدوال، متیل قرمز و فنول فتالیین، تغییر رنگ میدهند، مشخص شده است. خطوط افقی نشان دهنده بازه هستند که در آن هر دو شناساگر در منحنی تیتراسیون هیدروکلریک اسید دچار تغییر رنگ میشوند و هر دو تقریبا عمودی هستند. این نشاندهنده این نکته است که هر دوی این شناساگرها، زمانی که مقدار یکسانی از سدیم هیدروکسید اضافه شده باشد، که در این مورد برابر با ۵۰ میلیلیتر است، تغییر رنگ دادهاند و نقطه همارزی مشخص شده است.
در نقطه مقابل، تیتراسیون استیک اسید با توجه به نوع شناساگر، نتایج بسیار متفاوتی را به دست میدهد. گرچه بازه که در آن رنگ فنول فتالیین تغییر میکند از همتای خود در مورد متیل نارنجی بزرگتر است، خطای آن به دلیل شیب منحنی، غیرقابل اغماض است. مانند تیتراسیون هیدروکلریک اسید در این مورد نیز با افزودن حدود ۵۰ میلیلیتر از سدیم هیدروکسید، محلول به رنگ صورتی در میآید.با این حال، رنگ متیل قرمز در نزدیک به ۵ از قرمز به زرد تغییر مییابد که نزدیک به نیمهراه تیتراسیون است و بنابراین نمیتواند نقطه همارزی را به صورت صحیح نشان دهد. در این صورت تنها با افزودن ۲۵ تا ۳۰ میلیلیتر از سدیم هیدروکسید شناساگر متیل قرمز دستخوش تغییر رنگ میشود و از این مقدار خطا نمیتوان صرف نظر کرد.
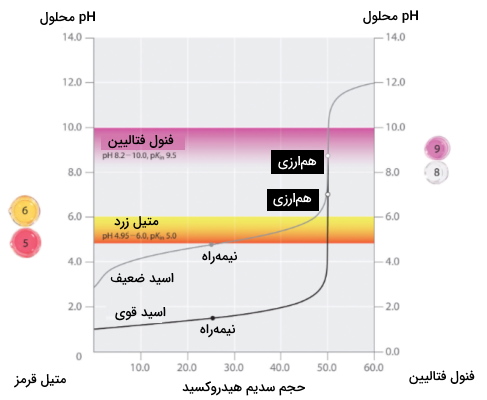
میتوان در حالت کلی اینطور جمعبندی کرد که برای تیتراسیون اسیدهای قوی با بازهای قوی یا بازهای قوی با اسیدهای قوی، شناساگری با ثابت تفکیکی بین ۴ تا ۱۰، قابل استفاده خواهد بود. برای تیتراسیون اسیدهای ضعیف، از آنجا که نقطه همارزی بالای ۷ است، میتوان از شناساگرهای تیمول آبی و فنول فتالیین با ثابت تفکیک اسیدی بالا ۷، استفاده کرد. برای تیتراسیون بازهای ضعیف که در آن نقطه همارزی دارای کمتر از ۷ است، از شناساگرهایی مانند متیل قرمز و برمو کروزول آبی با مقدار ثابت تفکیک اسیدی کمتر از ۷ بهره گرفت.
مثال انتخاب شناساگر تیتراسیون اسید و باز
در زیر ۳ شناساگر متفاوت برای تیتراسیون اسید و باز آورده شده است. کدام یک از آنها برای تیتراسیونی شامل اسید ضعیف و باز قوی بهترین انتخاب خواهد بود؟
- متیل نارنجی
- برمو کروزول سبز
- فنول فتالیین
پاسخ
در تیتراسیون اسید ضعیف با باز قوی، حضور باز مزدوج اسید ضعیف باعث افزایش مقدار به بیش از ۷ میشود. بنابراین برای شناسایی نقطه پایان نیاز به شناساگری داریم که در این بازه تغییر رنگ بدهد. متیل نارنجی و برمو کروزول سبز طبق جدول شناساگرها، هر دو در بازه اسیدی دچار تغییر رنگ میشوند. اما فنول فتالیین در ۸ تا ۱۰ از بیرنگ به نارنجی یا قهوهای تبدیل میشود. بنابراین شناساگر مناسبی برای انجام تیتراسیون اسید ضعیف با باز قوی به شمار میآيد.
نحوه انجام تیتراسیون
تا اینجا با مفهوم تیتراسیون اسید و باز و اجزایی که در آن دخیل هستند، آشنا شدیم. در این بخش میخواهیم بدانیم تیتراسیون به صورت عملی چگونه قابل انجام است و شامل چه لوازم آزمایشگاهی و مراحلی میشود.
در تیتراسیون اسید و باز ابتدا باید محلول آنالیت که به نام تیتران نیز نامیده میشود، را آماده کنیم. این محلول همانطور که پیشتر اشاره کردیم، دارای غلظت مشخص است و میتوان آن را به کمک روشهای محلولسازی از ترکیب مورد نظر، تهیه کرد. این محلول را برای انجام تیتراسیون به یک ارلن منتقل میکنند. در مرحله بعد باید شناساگر مناسب را نیز به مقدار مورد نیاز به همین ارلن اضافه کنند.
در مرحله بعد تیترانت را که محلولی با غلظت نامشخص است به یک بورت منتقل میکنند. توجه داشته باشید که برای انجام محاسبات مورد نیاز برای تعیین غلظت تیترانت، حجم تیتران و تیترانت باید مشخص باشد. سپس ارلن را به زیر شیر خروج بورت منتقل میکنند و تیترانت را قطرهقطره و بهآهستگی به محتویات ارلن اضافه میکنند. تیترانت را به این دلیل قطرهقطره اضافه میکنند تا فرصت کافی برای بررسی تغییر رنگ وجود داشته باشد. این کار را تا جایی ادامه میدهند که محتویات ارلن تغییر رنگ بدهد و حجم تیترانت استفاده شده را برای محاسبات یادداشت میکنند.

محاسبات تیتراسیون اسید و باز
با در دست داشتن حجم مورد نیاز از تیترانت برای انجام واکنش در تیتراسیون اسید و باز، از آنجا که غلظت را داریم، میتوان تعداد مولهای موجود در نمونه را محاسبه کرد. نسبت مولهای اجزای تیتراسیون را با نوشتن و موازنه کردن واکنش اسید و باز مییابیم. سپس با در دست داشتم حجم نمونه، غلظت مجهول به راحتی توسط رابطه زیر به دست میآيد.
- : مولاریته تیترانت مشخص
- : حجم تیترانت مشخص
- : مولاریته آنالیت مجهول
- : حجم آنالیت مشخص
به کمک رابطه بالا میتوان مولاریته مجهول آنالیت را به صورت زیر به دست آورد.
توجه داشته باشید که در این رابطه باید مقادیر حجم هر دو دارای یک واحد باشند، در غیر اینصورت محاسبات اشتباه خواهد بود و باید تبدیل واحد پیش از جایگذاری مقادیر انجام شود.
مثال نحوه انجام تیتراسیون
در بخش قبلی با نحوه انجام تیتراسیون اسید و باز آشنا شدید. در این بخش میخواهیم مثالی را مرحله به مرحله مورد بررسی قرار دهیم.
۵۰ میلیلیتر نمونهای از با غلظت نامشخص در دست داریم. میخواهیم آن را به کمک باز سدیم هیدروکسید ۰٫۱ مولار تیتر کنیم. از آنجا که اسید و باز هر دو قوی هستند، نقطه پایانی در ۷ خواهد بود، بنابراین از شناساگر لیتموس برای این تیتراسیون استفاده میکنیم زیرا دارای ثابت تفکیک اسیدی برابر با ۶٫۵ است.
نمونه را داخل یک ارلن میریزیم و زیر شیر بورتی که با سدیم هیدروکسید پر شده است، قرار میدهیم. سپس قطرهقطره از آن روی محلول میریزیم تا زمانی که تغییر رنگ در محلول مشاهده شود. تا رسیدن به نقطه پایانی تیتراسیون، ۱۰ میلیلیتر از مصرف شده است. برای محاسبه غلظت نمونه میتوانیم به روش زیر عمل کنیم.
ابتدا واکنش صورت گرفته بین اسید و باز را یادداشت میکنیم.
البته میتوان تنها به معادله خالص یونی نیز اکتفا کرد. آن را در زیر مشاهده میکنید.
در مرحله بعد برای به دست آوردن غلظت نمونه به روش استوکیومتری عمل میکنیم.
با در دست داشتن تعداد مولهای ، از آنجا که حجم نمونه در صورت سوال داده شده است، میتوانیم غلظت را به روش زیر محاسبه کنیم.
تیتراسیون اسید و باز برای اسیدهای چند پروتونی
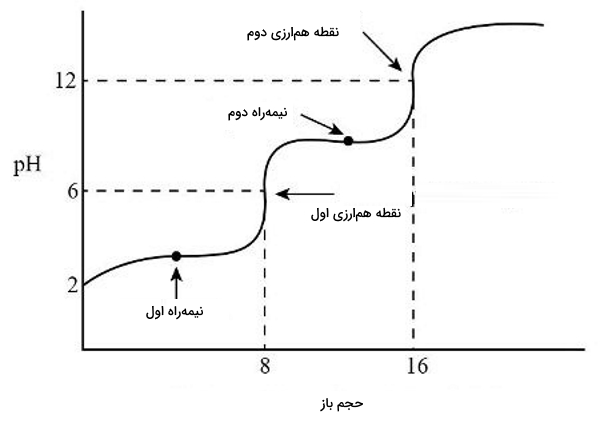
تا اینجا تعدادی مثال را از تیتراسیونها مورد بررسی قرار دادیم. همانطور که میدانید اسیدهایی وجود دارند که در ساختار خود بیش از یک پروتون داشته باشند. در این بخش میخواهیم مثالی را از این نوع اسیدها بررسی کنیم. منحنی تیتراسیون این اسیدهای چندپروتو نیز به دلیل داشتن چند نقطه همارزی با منحنیهای اسیدهای تک پروتونی متفاوت خواهد بود.
در این تیتراسیون اسید چند پروتونی است که میخواهیم آن را با محلولی استاندارد از سدیم هیدروکسید تیتر کنیم. این واکنش اسید و باز به صورت زیر در دو مرحله انجام میشود و در هر کدام یکی از پروتونهای اسید منتقل میشود.
(مرحله اول)
(مرحله دوم)
در هر دو نقطه همارزی غلظت اسید و باز موجود با یکدیگر برابر میشود و میتوان برای هر مورد اینطور نوشت:
(نقطه همارزی اول)
(نقطه همارزی دوم)
در این تیتراسیون دو نقطه دیگر نیز وجود دارند که بررسی آنها اهمیت دارد. به این دو «نقطه نیمهراه تیتراسیون» (Half Equivalance Point) گفته میشود و طبق تعریف نقطهای است که در آن غلظت اسید برابر با غلظت باز مزدوج خود میشود. در این مورد میتوان این دو نقطه را به صورت زیر مشخص کرد.
(نقطه نیمهراه تیتراسیون اول)
(نقطه نیمهراه تیتراسیون دوم)
نکتهای که باید به یاد داشت این است که اسیدهای چند پروتونی همیشه به خانواده اسیدهای ضعیف تعلق دارند و با از دست دادن هر یک از پروتونهای خود ضعیفتر نیز میشود. این باعث میشود که پرش آن در نقطه همارزی با پیش روی کمتر شود.
در ادامه میخواهیم به بررسی تیتراسیونی بپردازیم که طی آن باز با پذیرش بیش از یک پروتون تبدیل به اسید چند پروتونی مزدوج خود میشود. برای مثال باز را در نظر بگیرید. اگر این باز را به کمک هیدروکلریک اسید تیتر کنیم، واکنش اسید و باز بین آنها در دو مرحله و بهصورت زیر قابل انجام خواهد بود.
(مرحله اول)
(مرحله دوم)
مشاهده میکنید که برعکس مثال پیشین که شامل اسیدی بود که در هر مرحله پروتون خود را از دست میداد، در این واکنش بازی وجود دارد که با گرفتن پروتون تبدیل به اسیدی چند پروتونی میشود. از آنجا که قدرت اسیدی هیدروکلریک اسید از اسید خیلی بیشتر است، این فرایند ممکن خواهد بود.
کاربرد تیتراسیون اسید و باز
اهمیj تیتراسیون اسید و باز از این جهت است که میتواند غلظت نامشخص اسید یا باز مجهول را به دست دهد. این فرایند در زمینههای مختلفی از جمله مطالعات شیمی، زیستشناسی و «علوم محیطی» (Enviromental Science) کاربرد دارد.
- کاربرد در شیمی: در علم شیمی از تیتراسیون اسید و باز برای یافتن غلظت اسید یا باز مجهول استفاده میشود که در درک و مطالعه واکنشهای شیمیایی و آمادهسازی محلولهای استاندار اهمیت بسیار دارد.
- کاربرد در زیستشناسی: در زیستشناسی از تیتراسیون اسید و باز برای یافتن محلولها استفاده میشود که در درک و مطالعه رفتار آنزیمها و مولکولهای زیستی ضروری است.
- کاربرد در علوم محیطی: در این زمینه از تیتراسیون اسید و باز برای یافتن مقدار اسیدی بودن و بازی بودن آب استفاده میشود. این مورد برای بررسی تاثیری که بارانهای اسیدی روی زیستبوم نیاز است.
ابزارهای مورد نیاز برای انجام تیتراسیون
در آزمایشگاههای تحقیقاتی و صنعتی از روش تیتراسیون اسید و باز بهوفور استفاده میشود. این روش نیازمند ابزارهایی است که در زیر لیستی از آنها را آوردهایم.
- ارلن
- بورت
- همزن
- قطرهچکان یا پیپت
توجه داشته باشید که پیش از استفاده از ابزارها باید تمامی آنها را با آب مقطر شستشو دهیم و خشک کنیم. محلول استاندارد که اسید یا بازی با غلظت مشخص است درون بورت ریخته میشود. استفاده از بورت به آزمایشگر کمک میکند تا بتواند حجم اسید یا باز استفاده شده را با دقت بخواند تا در انجام محاسبات کمترین خطای ممکن وجود داشته باشد. همچنین تنظیم شیر بورت به افزودن قطرهقطره محلول استاندارد به ارلن کمک میکند تا بتوان زمان رسیدن به نقطه همارزی و مشاهده تغییر رنگ را کنترل کرد.
محلول با غلظت مجهول و حجم مشخص درون ارلن ریخته میشود و با استفاده از پیپت چند قطره شناساگر به آن افزوده میشود. در برخی موارد برای بررسی صحت حجم خوانده شده، مراحل تیتراسیون را تا ۳ بار نیز انجام میدهند. در این صورت میتوانیم اطمینان داشته باشیم که خطا به حداقل خواهد رسید.
مثال و حل تمرین از تیتراسیون اسید و باز
تا اینجا در مورد مفهوم تیتراسیون اسید و باز و نحوه انجام عملی آن صحبت کردیم. در این بخش با استفاده از مثالها و تمرینهایی متنوع و متعدد، هم درک خود را از مطلب عمیقتر میکنیم و هم به روشهای محاسباتی تسلط پیدا خواهیم کرد.
مثال از تیتراسیون اسید و باز
تیتراسیون اسید و باز یکی از مهمترین مباحث شیمی تجزیه است و از همین جهت تسلط بر قوانین آن و توانایی حل سوالات مرتبط بسیار ضروری خواهد بود. در این بخش به بررسی تعدادی مثال به همراه پاسخ تشریحی خواهیم پرداخت.
مثال اول
برای رسیدن به نقطه همارزی نمونهای شامل ۲۳٫۶ میلیلیتر هیدروکلریک اسید، به ۱۵٫۲ میلیلیتر باز با غلظت مشخص ۰٫۲۱ مولار نیاز است. غلظت را محاسبه کنید.
پاسخ
در این مثال هیدروکلریک اسید دارای غلظتی مجهول است و با تیتراسیون توسط یک باز میخواهیم این مقدار را به دست بیاوریم. در ابتدا نیاز داریم که واکنش خنثی شدن بین این دو را بنویسیم. توجه داشته باشید که محصول این واکنش یک نمک و آب خواهد بود. این واکنش به صورت زیر است.
در مرحله بعد برای داشتن نسبتهای استوکیومتری اسید و باز، واکنش نوشته شده را به صورتی موازنه میکنیم که تعداد اتمهای هر عنصر در دو سمت معادله با یکدیگر برابر باشند. نتیجه به صورت زیر خواهد بود.
همانطور که مشاهده میکنید نسبت اسید به باز ۲:۱ است و باید در رابطه زیر لحاظ شود.
از آنجا که هر دو مقدار حجم بر اساس واحد میلیلیتر داده شدهاند، نیازی به تبدیل واحد به لیتر نداریم. در مرحله بعد مقادیر در دست را در رابطه بالا جایگذاری میکنیم.
در این مرحله غلظت هیدروکلریک اسید به دست میآيد.
روش دیگری نیز برای حل این مثال وجود دارد. در این روش از استوکیومتری اجزای واکنش برای رسیدن به پاسخ استفاده میکنیم. به مراحل زیر توجه کنید.
مثال دوم
فرمول مولکولی باز ضعیف اتیل آمین بهصورت است. در آزمایشی برای تیتراسیون محلول هیدروکریک اسید با غلظت نامشخص از ۱۲٫۵ میلیلیتر اتیل آمین ۱ مولار استفاده میشود. تغییرات این واکنش اسید و باز در طی تیتراسیون اندازهگیری و مانند منحنی زیر رسم شده است. با توجه به منحنی تیتراسیون غلظت هیدروکلریک اسید را محاسبه کنید.
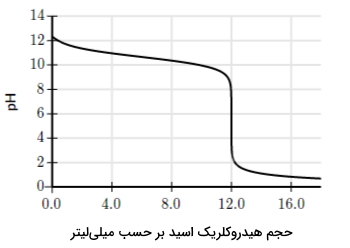
پاسخ
برای رسیدن به پاسخ صحیح ابتدا باید مقدار مول هیدروکلریک اسید مورد نیاز تا رسیدن به نقطه همارزی در تیتراسیون را داشته باشیم. سپس با تقسیم آن بر حجم مورد استفاده تا نقطه همارزی، غلظت مولار اسید به دست خواهد آمد.
برای این کار میتوانیم تعداد مولهای اتیل آمین را محاسبه کنیم و با توجه به نسبت استوکیومتری بین آنها، تعداد مول اسید را نیز به دست آوریم. این محاسبه به شکل زیر قابل انجام خواهد بود.
از آنجا که نسبت این دو جز در واکنش خنثی شدن بهصورت ۱:۱ است، تعداد مولهای اسید در نقطه همارزی نیز برابر با ۰٫۰۱۲۵ خواهد بود. در مرحله بعد با توجه به منحنی تیتراسیون حجم استفاده شده از آن را در نقطه همارزی پیدا میکنیم که برابر با ۱۲ میلیلیتر است. همانطور که مشاهده میکنید در این مرحله مقدار به شدت کاهش یافته است.
در پایان نیز تعداد مول اسید را بر حجم آن تقسیم میکنیم تا غلظت مولار آن به دست بیاید.
بنابراین غلظت نمونه مجهول برابر با ۱٫۰۴ مولار است.
حل تمرین از تیتراسیون اسید و باز
حال که با نحوه محاسبه در تیتراسیون اسید و باز آشنا شدیم و مثالهایی را حل کردیم، میخواهیم تعدادی تمرین چندگزینهای را مورد بررسی قرار دهیم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
تمرین یازدهم
تمرین و آزمون
تمرین دوازدهم
تمرین و آزمون
تمرین سیزدهم
تمرین و آزمون
تمرین چهاردهم
تمرین و آزمون
تمرین پانزدهم
تمرین و آزمون
سوالات متدوال
در این بخش میخواهیم به تعدادی از مهمترین و پرتکرارترین سوالات موجود پیرامون مبحث تیتراسیون اسید و باز، پاسخ دهیم.
نقطه هم ارزی در تیتراسیون اسید و باز چیست ؟
به نقطهای که تمامی اسید یا باز افزوده شده به نمونه مصرف شده و واکنش تکمیل شده باشد، نقطه همارزی نام دارد.
کاربرد تیتراسیون اسید و باز چیست ؟
از تیتراسیون اسید و باز برای یافتن غلظت اسید یا بازی مجهول استفاده میشود. در این فرایند اسید یا باز را به کمک باز یا اسیدی دیگر خنثی میکنند. سپس با در دست داشتن حجم استفاده شده از محلول استاندارد و به کمک قوانین استوکیومتری، این غلظت مجهول محاسبه میشود.
آیا از روش تیتراسیون فقط برای اسیدها و بازها استفاده میشود ؟
خیر، از روش تیتراسیون برای به دست آوردن غلظت بسیاری از مواد میتوان بهره برد. علاوه بر تیتراسیون اسید و باز، تیتراسیونهایی مانند تیتراسیون اکسایش و کاهش وجود دارند که پرکاربرد هستند.
چرا استفاده از شناساگر فنول فتالیین برای تیتراسیون اسید ضعیف با باز قوی مناسب است ؟
دلیل مناسب بودن شناساگر فنول فتالیین برای این تیتراسیون این است که بازه تغیر محدودی درد و شاهد تغییر رنگ شدیدی در آن هستیم.
هدف اصلی تیتراسیون اسید و باز چیست ؟
هدف اصلی استفاده از تیتراسیون اسید و باز محاسبه غلظت اسید یا باز مجهول است.
چهار نوع تیتراسیون اسید و باز کدام هستند ؟
چهار نوع تیتراسیون اسید و باز بسته به قدرت اسیدی و بازی از این قرار هستند:
- اسید قوی با باز قوی
- اسید قوی با باز ضعیف
- اسید ضعیف با باز قوی
- اسید ضعیف با باز ضعیف
نقطه نیمه راه هم ارزی در تیتراسیون اسید و باز برای اسیدهای چند پروتونی چیست ؟
به نقطهای گفته میشود که در آن غلظت اسید با غلظت باز مزدوج خود برابر میشود.
جمع بندی
هدف از این مطلب این بود که بدانیم تیتراسیون اسید و باز چیست و به چه روشهایی انجام میشود. همچنین با اجزای این روش و نحوه انجام آن آشنا شدیم. بخش مهمی از این مطلب به توانایی حل مسئله مربوط است که تلاش کردیم با بررسی تعدادی مثال، مهارت پاسخگویی را تقویت کنیم.













سلام در بخش شناساگر تیتراسیون اسید و باز به جای اسید ضعیف ،اسیدی قوی(هیدروکلریک اسید) و به جای اسید قوی، اسیدی ضعیف(اتانوییک اسید) نوشتید. این موضوع در مورد باز ها در همان بخشی نیز صادق است لطفاً اصلاح نمایید
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. متن بازبینی و اصلاح شد.
با تشکر