پروتئین هیستون چیست؟ – به زبان ساده
مولکول DNA سلولهای یوکاریوتی از دو رشته نوکلئوتیدی بسیار بلند تشکیل شده است. در هر هسته چند میکرومتری یوکاریوتی چند مولکول DNA وجود دارد که طول هر کدام ممکن است بیش از یک متر باشد. قرار گرفتن این مولکولها در هسته بدون فشردگی امکان پذیر نیست. به همین دلیل DNA یوکاریوتی بهوسیله پروتئینها و تشکیل پیچهای فراوان به رشتههای کوچکی تبدیل میشود که تنها زیر میکروسکوپ میتوان آنها را مشاهده کرد. پروتئین هیستون از آمینواسیدهای بازی با بار مثبت تشکیل شده است و به فشردگی DNA کمک میکند. پروتئینهای هیستون ساختاری اوکتامری تشکیل میدهند که حدود دو دور DNA اطراف آن میپیچد. به ساختار تشکیل شده نوکلئوزوم گفته میشود.
- یاد میگیرید ساختار نوکلئوزوم و نقش هیستونها را توضیح دهید.
- نقش تغییرات اپیژنتیک هیستونها را در تنظیم بیان ژن میآموزید.
- خواهید آموخت چگونه متیلاسیون و استیلاسیون هیستون بیان ژنها را تغییر میدهد.
- نقش پروتئینهای غیرهیستونی در بازآرایی و عملکرد کروموزوم را یاد میگیرید.
- با آنزیمهای مهم همانندسازی و ترمیم و نقش آنها آشنا میشوید.
- روشهای بررسی و آنالیز تغییرات هیستون را یاد خواهید گرفت.
بین دو نوکلئوزوم توالی چند بازی رابط وجود دارد. اضافه شدن گروههای عاملی ازجمله متیل، استیل و فسفات به هیستونها پس از ترجمه سبب تغییر برهمکنش بار منفی فسفات DNA و بار مثبت آمینواسیدهای لیزین و آرژنین هیستون میشود. تغییر برهمکنش این دو مولکول برهمکنش آنزیمهای رونویسی و در نتیجه بیان ژنها را تغییر میدهد. در این مطلب از مجله فرادرس توضیح میدهیم پروتئین هیستون چیست و تغییرات آن چه اثری بر بیان ژنها دارد. به علاوه در انتهای مطلب پروتئینهای شبه هیستونی در ژنوم باکتریها و پروتئینهای غیرهیستونی همراه کروماتین یوکاریوتها را بررسی میکنیم.
پروتئین هیستون چیست؟
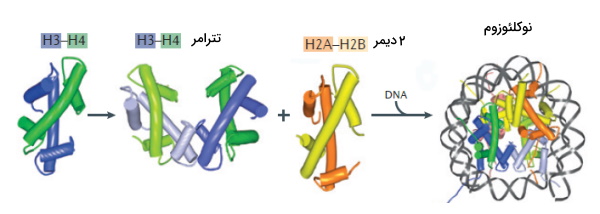
ماده ژنتیکی یوکاریوتها مولکولهای DNA است که طول آن به بیش از ۱ متر میرسد. این DNA بهوسیله پروتئینهای هستهای به ساختارهای بسیار فشردهای به نام کروماتین تبدیل میشود. هیستونها، پروتئینهایی بازی با آمینواسیدهای لیزین و آرژنین فراوان هستند که در فشردهسازی DNA شرکت میکنند. برهمکنش بار مثبت این پروتئینها با بار منفی فسفات DNA به تشکیل کروماتین کمک میکند. H2A، H2B، H3، H4 وH1 پروتئینهای هیستونی انسان هستند. پروتئین هیستون از انتهای کربوکسی کروی (هسته) و انتهای آمینی خطی (دم) تشکیل شده است. دم هیستونها از شیار کوچک DNA خارج میشود. تمام هیستونها ساختار مشابه دارند که از سه هلیکس آلفا تشکیل شده که دو لوپ آنها را از هم جدا میکند. دیمرهای H2A-H2B و H3-H4 از برهمکنش این دومینها تشکیل میشود. لوپهای این دومین در ساختارهایی به نام نوکلئوزوم با DNA برهمکنش میدهد. نوکلئوزومها DNA را به رشتههایی با قطر ۳۰nm تبدیل میکند.
هر نوکلئوزوم از حدود ۱۴۷ جفتباز تشکیل شده است که دور اوکتامر هیستونها (۸ پروتئین هیستون) میپیچد. برهمکنش پروتئینهای H3 سبب اتصال دو دیمر H3-H4 تشکیل تترامر هیستونی میشود. در مرحله بعد برهمکنش آلفا هلیکسهای H4 در تترامر H3-H4 با آلفا هلیکسهای H2B با در دو دیمر H2A-H2B سبب تشکیل ساختار اوکتامری هیستونها میشود. تترامر H3-H4 هسته این اوکتامر را تشکیل میدهد که در دو طرف آن دیمرهای H2A-H2B قرار دارند. بین نوکلئوزومها توالی DNA رابط قرار دارد. پروتئینهای H1 خارج از نوکلئوزوم قرار میگیرد. این پروتئین پایداری نوکلئوزوم را افزایش میدهد و در تشکیل ساختارهای فشردهتر کروماتینها شرکت میکند.
هیستون های متفاوت
H3.3 و H2A.Z نوع دیگری از هیستونهای H3 و H2A هستند. H3.3 در ۵ آمینواسید با H3 اختلاف دارد. اما این آمینواسیدهای ساختار چهارم پروتئین را تغییر نمیدهند. پروتئینهای H3.3 در نوکلئوزومهای پروموتر، توالی افزاینده و ناحیه کدکننده ژن قرار دارند. H2A.Z از توالی آمینواسیدی تشکیل شده است که در تمام یوکاریوتها ازجمله کپکها و مژکداران مشابه است. با وجود اختلاف آمینواسیدها بین H2A.Z و H2A، ساختار نوکلئوزوم ایجاد شده مشابه است. دیمر H2A.Z یا H2A.Z-H2B برهمکنش مناسبی با تترامرهای H3-H4 ندارد. به همین دلیل ساختار نوکلئوزوم آنها ناپایدارتر است. این ویژگی به فعال شدن رونویسی، ترمیم DNA و جدا شدن نواحی هتروکروماتینی از یوکروماتینی کمک میکند. H2A.Z بیشتر در نوکلئوزومهای پروموتر ژن قرار دارد. مهمترین تفاوت H2AX با H2A وجود چهار آمینواسید در انتهای کربوکسی H2AX است که در ترمیم DNA شرکت میکند.
تغییرات اپی ژنتیک هیستون
ضعیف شدن برهمکنش DNA-هیستونها و هیستون-هیستون اولین قدم در همانندسازی، رونویسی و تنظیم بیان ژن است. در این حالت فضای کافی برای برهمکنش آنزیمها و پروتئینهای تنظیمی با DNA ایجاد میشود. اضافه شدن گروههای عاملی مختلف ازجمله استیل، متیل، فسفات، سیترولین و یوبیکوئینیتین برهمکنش DNA-هیستون را به شکل برگشتپذیر تغییر میدهد. به علاوه اضافه شدن بعضی از این گروهها با تقویت برهمکنش DNA-هیستون، افزایش فشردگی کروماتین و خاموش شدن ژنها همراه است. همین تغییرات سبب تغییر بیان ژنها در سلولهای مختلف انسان و تمایز بافتها میشود. این تغییرات اپیژنتیک بدون تغییر توالی نوکلئوتیدهای DNA صفات ایجاد شده و بیان ژن را تغییر میدهند.
متیلاسیون هیستون
متیلاسیون پروتئین هیستون یکی از تغییرات پس از ترجمه است که بر اساس نوع آمینواسید متیله شده و محل DNA ممکن است سبب فعال یا غیرفعال شدن ژن شود. گروههای متیل به آمینواسیدهای بازی آرژنین، لیزین و هیستیدین اضافه میشوند. یک تا سه گروه متیل به آمین و یک گروه متیل، دو گروه متیل متقارن یا دو گروه متیل نامتقارن به گروه گوانیدیل هر آرژنین اضافه میشود. یک گروه متیل به هیستیدین اضاقه میشود، اما فراوانی متیله شدن هیستیدین بسیار کمتر از دو آمینواسید دیگر است.
فراوانی متیلاسیون لیزینهای چهارم (H3K4)، نهم (H3K9)، بیستم (H3K20)، بیستوهفتم (H3K27)، سیوششم (H3K36) و هفتادونهم (H3K79) پروتئین H3 و آرژنینهای دوم (H3R2)، سوم (H3R3)، هشتم (H3R8)، هفدهم (H3R17) و بیستوششم (H3R26) پروتئین H3 از سایر هیستونها بیشتر است. آنزیمهای متیلترانسفراز گروه متیل را از S-آدنوزین متیونین (SAM) به هیستونها منتقل و آنزیمهای متیلاز این گروهها را جدا میکنند. آنزیمهای دارای دومین SET و دومین شبه DOT-1 گروههای متیل را به لیزین و آنزیمهای عضو خانواده N-متیلاز گروههای متیل را به آرژنین اضافه میکنند. این آنزیمها به توالی پروتئینهای پلیکام DNA قرار میگیرند. به علاوه RNAهای غیرکدکننده بلند (lncRNAs) اتصال متیلترانسفرازها به DNA را تسهیل میکنند.
آنزیم آمین داکسیژناز و داکسیژناز وابسته به آهن حاوی دومین جومانجی (JMJD) گروههای متیل را از هیستون جدا یا به گروههای عاملی دیگر تبدیل میکنند. اضافه شدن گروههای عاملی دیگر به هیستونها، فراخوانی و اتصال آنزیمها به DNA و متیلاسیون را تغییر میدهد. برای مثال دیمتیلاسیون H3R2، اضافه شدن گروههای متیل به H3K4me3 را مهار میکند. همچنین فسفوریلاسیون H3S10، از متیلاسیون H3K9 جلوگیری میکند.
متیلاسیون هیستون و DNA
متیلاسیون DNA مثل تغییرات پس از ترجمه هیستونها، بیان ژنها را به شکل برگشتپذیر تغییر میدهد. در این فرایند آنزیمهای متیلتراسفراز گروه متیل را از SAM به سیتوزینها منتقل میکنند. بر اساس محل متیلاسیون ژن ممکن است فعال یا غیرفعال شود. متیلاسیون هیستون میتواند الگوی متیلاسیون DNA و متیلاسیون DNA الگوی اضافه شدن انواع گروههای عاملی به هیستون را تعیین کند. بعضی از آنزیمهای متیلترانسفراز در این همانندسازی با استفاده از رشته الگو، گروههای متیل را به رشته در حال سنتز اضافه میکنند و بعضی از این آنزیمها بدون داشتن الگو گروه متیل را توالیهای غنی از CpG در پروموتر، افزاینده، مهارکننده و توالیهای غیرکدکننده اضافه میکنند.
آنزیمهای متیلترانسفراز DNA از دیمر DNmT3A یا DNmT3B با DNmT3L تشکیل میشود. DNmT3L پس از اتصال به H3 متیلتراسفرازهای DNA را فرامیخواند. اما اضافه شدن یک، دو یا سه گروه متیل به H3 اتصال DNmT3L به هیستون و متیلاسیون DNA را مهار میکند. فشردگی بخشهای متیله DNA از بخشهای غیرمتیله بیشتر است. اضافه شدن گروههای استیل به هیستون بخشهای غیرمتیله در کاهش فشردگی نقش دارد. به علاوه متیلاسیون DNA با متیلاسیون H3K9 و مهار اضافه شدن گروههای متیل به H3K4 همراه است.
جهش ژن متیلترانسفرازهای DNA، آنزیمهای تغییر هیستون و ژن هیستونها الگوی فشردگی DNA و بیان ژنها را تغییر میدهد. در نبود این آنزیمها بیان ژنهای تنظیم چرخه سلولی تغییر کرده و احتمال ابتلا به سرطان را افزایش میدهد. به علاوه افزایش متیلاسیون پروموتر ژنهای مهارکننده تومور و کاهش متیلاسیون توالیهای بین ژنی احتمال ابتلا به سرطان را افزایش میدهد.
استیلاسیون هیستون
استیلاسیون هیستونهای یکی دیگر از تغییرات اپیژنتیکی است. در این فرایند آنزیمهای استیلترانسفراز (HATs) گروههای استیل را از استیل کوآنزیم A به آمین لیزین دم هیستون منتقل میکند. اضافه شدن گروههای استیل بار مثبت هیستونها و برهمکنش آن با DNA را کاهش میدهد. هیستون داستیلازها با برداشتن گروه استیل یا تبدیل آن به گروه عاملی دیگر، کروماتین را به حالت فشرده برمیگردانند. فراوانی استیلاسیون لیزین نهم، چهاردهم (H3K14)، هجدهم (H3K18) و بیستوهفتم پروتئین H3 و لیزینهای شانزدهم (H4K16) H4 از سایر هیستونها بیشتر است.
استیلترانسفرازها بر اساس جایگاه سلولی به انواع هستهای و سیتوپلاسمی تقسیم میشوند. استیلترانسفرازهای هسته در همانندسازی و استیلترانسفرازهای سیتوپلاسم در رونویسی نقش دارند. آنزیمهای خانواده GNAT، خانواده MYST و p300/CBP استیلترانسفرازهای اصلی هستند.
- خانواده GNAT: جایگاه استیلترانسفرازی پروتئینهای این خانواده از ۱۶۰ آمینواسید و دومین بروم تشکیل شده است. این آنزیمهات گروه استیل را به لیزین H3 اضافه میکنند.
- خانواده MYST: جایگاه استیل ترانسفرازی پروتئینهای این خانواده از ۲۵۰ آمینواسید تشکیل شده است که ساختارهای دوم غنی از سیستئین، دومین اتصالی به انگشت روی و کرومودومینهای انتهای آمینی را تشکیل میدهند.
- خانواده p300/CBP: جایگاه استیل ترانسفرازی این پروتئینها از ۵۰۰ آمینواسید با دومینهای بروم و سه دومین هیستیدین-سیستئین تشکیل شده است. این پروتئینها به تمام هیستونها گروه استیل اضافه میکنند.
هیستون داستیلازهای انسان به چهار گروه تقسیم میشوند. کلاس اول این آنزیمها اول، دوم و چهارم این آنزیمها برای فعالیت خود به روی و آنزیمهای کلاس سوم برای فعالیت خود به نیکوتین آمید آدنین دینوکلئوتید (NAD) نیاز دارند. این آنزیمها غیراختصاصی عمل کرده و استیل جایگاههای مختلف هیستون را جدا میکنند. بیان این آنزیمها در بیماران مبتلا به سرطانهای مختلف افزایش مییابد. در سلولهای مسیر هوایی افراد مبتلا به آسم و بیماریهای انسدادی مزمن ریه، بیان استیلترانسفرازها افزایش و داستیلازها کاهش مییابد. در این حالت افزایش بیان ژنهای مسیر التهاب علائم آسم را ایجاد میکند.
سیترولیناسیون هیستون
در سیترولناسیون هیستون، لیزین بهوسیله آنزیم پپتیدیل آرژنین دآمیناز به سیترولین تبدیل میشود. در این فرایند ابتدا گروه کتین آمین () به کتون آمین () و آمونیاک تبدیل میشود. در مرحله بعد هیدرولیز زنجیره جانبی و آزاد شدن اوره سبب خنثی شدن بار الکتریکی آرژنین میشود. در نتیجه برهمکنش هیستون با DNA منفی کاهش مییابد. سیترولیناسیون H3 نقش مهمی در آزاد شدن کروماتین دام خارج سلولی نوتروفیلها (NETs) دارد. تعداد هیستونهای سیترولینه در افراد مبتلا به سرطان مجاری پانکراس به دلیل افزایش NETs، افزایش مییابد.
فسفوریلاسیون هیستون
فسفوریلاسیون هیستون نقش مهمی در فراخوانی آنزیمها و پروتئینهای تنظیمی ترمیم DNA دارد. آنزیمهای پروتئین کیناز گروههای فسفات ATP به باقیماندههای سرین، تروئونین و تیروزین اضافه و فسفوریلازها این گروهها را جدا میکنند. بار منفی فسفات، بار مثبت پروتئینهای هیستون را خنثی کرده و برهمکنش هیستون-DNA را کاهش میدهد. فسفوریلاسیون سرین ۱۳۹ H2AX پستانداران نقش مهمی در ترمیم آسیب DNA (ترمیم اتصال انتهای غیر همولوگ، نوترکیبی همولوگ و ترمیم همزمان با همانندسازی) دارد.
یوبی کوئیتیلاسیون هیستون
اضافه شدن پروتئین یوبیکوئینیتین به هیستونها بر اساس نوع هیستون و توالی DNA ممکن است با فعال یا غیرفعال شدن ژن همراه باشد. یوبیکوئینیتین بهوسیله کمپلکسهای آنزیمی یوبیکوئینیتین لیگاز به هیستون اضافه و بهوسیله آنزیمهای دیوبیکوئیتیلاسیون از آن جدا میشود. در این فرایند یوبیکوئینیتین ابتدا با مصرف ATP به مولکول فعال تبدیل و در مرحله بعد به آمین باقیماندههای لیزین در انتهای آمینی متصل میشود. اضافه شدن یوبیکوئینیتین به H2A متیلاسیون H3K4 را مهار و ژن را غیرفعال میکند. اما اضافه شدن گروههای یوبیکوئینیتین به H2B برای متیلاسیون H3K4 ضروری است. اضافه شدن یوبیکوئینیتین به H2AX در شناسایی شکست ۲ رشته DNA به پروتئینهای مسیر ترمیم کمک میکند.
سروتونیلاسیون هیستون
سروتونین (۵-هیدروکسی تریپتامین) مولکول کوچکی است که در مغز پیام عصبی را بین نورونها منتقل میکند. اضافه شدن این مونوآمین به پنجمین آمینواسید گلوتامین انتهای آمینی H3 یکی دیگر از تغییرات اپیژنتیک پروتئینهای هیستون است که بهوسیله آنزیم ترانسگلوتامیناز ۲ کاتالیز میشود. این فرایند با افزایش اتصال فاکتورهای رونویسی به DNA و افزایش بیان ژن در نورونها همراه است.
ریبوزیلاسیون هیستون
پلی ADP-ریبوز پلیمراز ۱، از آنزیمهای همراه کروماتین است. این آنزیم در پاسخ به شکست دو رشتهای DNA فعال شده و با هیدرولیز گروههای ADP-ریبوز را به پروتئینهای هیستون اضافه میکند. اضافه شدن ADP-ریبوز به هیستونها، بیان ژنهای مسیر التهاب ازجمله فاکتور نکروز تومور (NF-κB) را افزایش میدهد.
پروتئین های غیرهیستونی چیست؟
پروتئینهای غیرهیستونی مجموعه گستردهای از پروتئینها با ساختار و توالی آمینواسیدی متفاوت است که به فشرده شدن کروماتین و تشکیل کروموزومها در کمک میکنند. پروتئینهای ساختار کروموزوم، DNA پلیمرازها، پروتئین هتروکروماتین و «پلیکام» (Polycomb) ازجمله پروتئینهای غیرهیستونی هستند.
پروتئین های غیر هیستونی کروموزوم
«کاندنسین» (Condensin) یکی از پروتئینهای داربستی و مجموعهای از پروتئینهای بزرگی است که در میتوز و میوز به کنارهم قرار گرفتن و جدا شدن کروموزومها کمک میکنند. این پروتئینها با مصرف ATP لوپهایی در کروماتین تشکیل میدهند که به فشردهتر شدن این ساختار کمک میکند. هر کاندنسین از دو زیرواحد پروتئینی SMC (پروتئینهای پایداری ساختار کروموزوم) تشکیل شده که سر آن یک ATPase است و ساختاری V شکل تشکیل میدهد. کاندنسین II در هسته پروفازی و کاندنسین I در سیتوپلاسم اینترفازی قرار دارد. این پروتئینها در متافاز، کروماتیدهای خواهری را به هم متصل میکند.
کوهسینها گروه دیگری از پروتئینهای داربستی کروموزم هستند که در اتصال کروماتیدهای خواهری به هم و اتصال کروموزوم به رشتههای دوک نقش دارند. این پروتئینها علاوه بر ساختار کروموزوم، به ترمیم شرکت دورشتهای DNA و تنظیم بیان ژن کمک میکنند. این پروتئین از زیرواحدهای مشابه کاندنسین تشکیل شده است. ساختار حلقهای این پروتئین دور دو رشته DNA قرار میگیرد. با جدا شدن کوهسینها از کروموزوم در آنافاز دو کروماتید خواهری از هم جدا میشود. توپوایزومراز II پروتئین داربستی است که با برش دو رشته DNA و باز کردن پیچها، ساختار DNA را تغییر میدهد. در همانندسازی این آنزیم جلوی DNA پلیمراز حرکت کرده و پیچها را برای شروع همانندسازی باز میکند.
DNA پلیمرازها
DNA پلیمرازها آنزیمهایی هستند که وظیفه همانندسازی DNA را بر عهده دارند. این آنزیمهای از رشته به عنوان الگو استفاده و دئوکسیریبونوکلئوتیدهای مکمل این رشته را در جهت اضافه میکنند. این آنزیمها برای همانندسازی نیاز به پرایمرهای RNA دارند. پرایماز، پرایمر RNA را سنتز میکند. پنج DNA پلیمراز در همانندسازی سلولهای یوکاریوتی شرکت میکند.
- DNA پلیمراز آلفا: این آنزیم رشته جدید را از جهت ۵ به ۳ همانندسازی میکند. بخش اگزونوکلئازی این آنزیم نوکلئوتیدها را از انتهای ۳ رشته جدا میکند. این آنزیم فعالیت پرایمازی نیز دارد.
- DNA پلیمراز بتا: این آنزیم در مسیرهای ترمیم جایگاههای بدون باز را پر میکند.
- DNA پلیمراز گاما: این آنزیم رشته جدید DNA میتوکندری را در جهت ۵ به ۳ همانندسازی و بخش اگزونوکلئازی این آنزیم نوکلئوتیدها را از انتهای ۳ رشته جدا میکند.
- DNA پلیمراز دلتا: این آنزیم رشته مکمل، رشته ۵ به ۳ والدی (رشته پیرو) را در جهت ۵ به ۳ همانندسازی و بخش اگزونوکلئازی آن نوکلئوتیدها را از انتهای ۳ رشته جدا میکند.
- DNA پلیمراز اپسیلون: این آنزیم رشته جدید را در ۵ به ۳ همانندسازی و ترمیم میکند. بخش اگزونوکلئازی این آنزیم نوکلئوتیدها را از انتهای ۳ و ۵ رشته جدا میکند و فعالیت پرایمازی دارد.
پروتئین هتروکروماتین و پلی کام
پروتئین هتروکروماتین ۱ (HP1) خانوادهای از پروتئینها است که با تشکیل هتروکروماتینها در تنظیم بیان ژن نقش دارد. به علاوه این پروتئین به فعال شدن رونویسی، تنظیم اتصال کوهسین به سانترومر، مهار ترجمه و ترمیم DNA نقش دارد. HP1 با هیستونها، آنزیمهای هیستون متیلترانسفراز، DNA متیل ترانسفرازها، پروتئینهای اتصالی به سیتوزین متیله و کمپلکس شناسایی همانندسازی برهمکنش دارد. پروتئینهای پلیکام (PcG) گروهی از فاکتورهای رونویسی هستند که در مهار بیان ژنها نقش دارند.
پروتئین های شبه هیستونی چیست؟
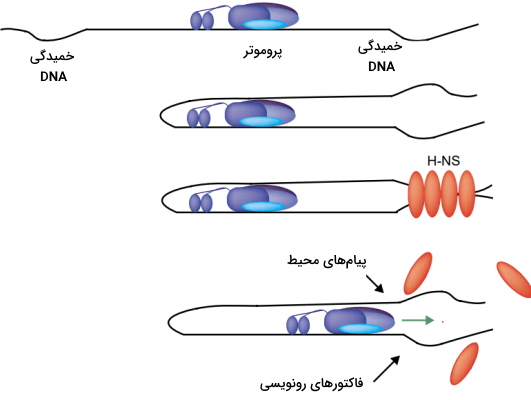
پروتئینهای شبه هیستونی یا پروتئینهای همراه نوکلئوئید، پروتئینهای کوچک و بازی هستند که در به حفظ ساختار DNA و تنظیم همانندسازی، ترمیم و رونویسی باکتری کمک میکنند. توالی آمینواسیدی و ساختار این پروتئینها با هیستونها تفاوت دارد، اما عملکرد تقریبا مشابهی دارند. «فاکتور تحریک وارونگی» (Factor for Inversion Stimulation | Fis)، «پروتئین شبه هیستون سازماندهنده هسته» (Histone-like Nucleoid Structuring | H-NS)، «پروتئین حساس به گرما» (Heat Unstable | HU) و «فاکتور ادغام با میزبان» (Integration Host Factor | IHF) از انواع پروتئینهای شبه هیستونی هستند. IHF به طور اختصاصی به توالی مشخص DNA متصل و این مولکول را خم میکند. سایر پروتئینهای شبه هیستونی به طور غیراختصاصی و به توالیهای متفاوت DNA متصل میشود. بیان این پروتئینها در مراحل مختلف رشد باکتری متفاوت است. برای مثال بیان Fis در مراحل اولیه رشد لگاریتمی افزایش و در مراحل دیگر کاهش مییابد. اما بیان IHF در مرحلهای بیشتر است که رشد باکتری متوقف میشود.
H-NS و HU عملکرد مخالف هم دارند. H-NS در فشرده شدن DNA و مهار ژنها نقش دارد. اما HU رشتههای DNA حلقوی را از هم باز، در DNA سوپرکویل ایجاد و بیان ژنها را فعال میکند. مکانیسم مهار ژنها بهوسیله H-NS متفاوت است، اما چهار اصل مشترک دارد. H-NS درمرحله اول به پروموتر ژن متصل میشود. در هر ژن بیش از یک جایگاه اتصال پروتئین وجود دارد. لوپ DNA نزدیک حداقل دو ناحیه متصل به پروتئین ایجاد میشود و در نهایت آنزیم ANA پلیمراز در لوپ متوقف میشود.
آنالیز پروتئین های هیستون
آنالیز تغییرات ایجاد شده در هیستونهای یک ژن خاص برای مثال ژن انواع تومورها، به بررسی عملکرد ژن در مراحل مختلف سلولی، میزان تاثیر پروتئینهای هیستون در بیان ژن و تعیین روش درمانی مناسب کمک میکند. این تغییرات را میتواند با روشهای «رسوبگذاری ایمنی» (Immunoprecipitation)، «الایزا» (ELISA)، «طیفسنجی جرمی» (MAS Spectroscopy)، «آرایه پپتدی» (Peptide Array) و تست استیل ترانسفراز بررسی کرد.
- رسوبگذاری ایمنی: رسوبگذاری ایمنی روشی است که از برهمکنش آنتیژن-آنتیبادی برای جدا کردن یک آنتیژن استفاده میکند. به کمک روش رسوبگذاری ایمنی کروماتین میتوان برهمکنش DNA-پروتئین و تغییرات هیستونها را بررسی کرد.
- ELISA: این روش مثل رسوبگذاری ایمنی بر اساس برهمکنش آنتیژن-آنتیبادی طراحی شده است. در این روش معمولا آنتیبادیهای پروتئین مورد نظر به سطح یک پلیت متصل میشوند. د مرحله بعد آنتیبادی متصل به آنزیم و اختصاصی آنتیژن به محلول اضافه میشود. عملکرد این آنزیم سوبسترا به به ماده رنگی تبدیل میکند. هر چه مقدار آنتیژن در یک محلول باشد، شدت رنگ افزایش خواهد یافت.
- طیفسنجی جرمی
- آرایه پپتدی: در روش آرایه پپتیدی مثل بیشتر روشهای آنالیز پروتئینها بر اساس برهمکنش آنتیبادی-آنتیژن طراحی شده است. در این روش پروتئینهای هیستون تغییریافته و بدون تغییر روی صفحه کوچک پلاستیکی قرار میگیرند. در مرحله اول آنتیبادی ویژه این پروتئینها به ترکیب اضافه میشود. در مرحله دوم آنتیبادی مخصوص آنتیبادی قبلی (متصل به ترکیب فلورسنت) به ترکیب اضافه میشود.
- تست استیل ترانسفراز: فعالیت آنزیم استیلترانسفراز را میتوان با بررسی هیستونهای استیله شده یا مقدار استیل کوآنزیم آزاد در محلول را با استفاده از نشاگرهای آنزیمی، فلورسنت و رادیواکتیو شناسایی کرد.
جمعبندی
در این مطلب از مجله فرادرس توضیح دادیم که هیستونها پروتئینهایی با بار مثبت هستند که با تشکیل نوکلئوزومها در فشرده کردن DNA یوکاریوتی نقش دارند. هر نوکلئوزوم از ۸ زیرواحد هیستونی تشکیل شده است و بهوسیله توالی رابط به نوکلئوزوم دیگر متصل میشود. این پروتئینها DNA را به رشتههایی با قطر ۳۰ nm تبدیل میکنند. اضافه شدن گروههای متیل، فسفات، استیل، سروتونین و سیترولین به انتهای آمینی هیستونها برهمکنش پروتئین-DNA و بیان ژنها را تغییر میدهد. اضافه شدن گروههای متیل با غیرفعال شدن و اضافه شدن گروههای استیل با فعال شدن ژن همراه است. پروتئینهای غیرهیستونی، مجموعه از پروتئینها و آنزیمها هستند که در تشکیل ساختار کروموزمها نقش دارند. همچنین توضیح دادیم که هیستون همراه ژنوم یوکاریوتی هستند.در باکتریها پروتئینهایی شبیه به هیستون با توالی و ساختار متفاوت اما عملکرد مشابه به فشرده شدن DNA حلقوی و تنظیم بیان ژنها کمک میکند.












