واکنش پذیری فلزات با چه ترتیبی انجام می شود؟ – به زبان ساده + جدول
سری واکنش پذیری فلزات، فهرستی است که فلزات در آن با توجه به مقدار واکنشپذیری و رفتاری که در برابر مواد شیمیایی دیگر از خود نشان میدهد، مورد دستهبندی قرار گرفتهاند. از این سری میتوان اطلاعات بسیاری در مورد نحوه انجام واکنشهای شیمیایی فلزات به دست آورد، بنابراین برای تشخیص محصول یک واکنش نیاز داریم تا با سری واکنش پذیری فلزات آشنایی خوبی داشته باشیم.
- مفهوم سری واکنشپذیری فلزات را میآموزید.
- میتوانید عوامل موثر بر تفاوت واکنشپذیری فلزات را تشخیص دهید.
- یاد خواهید گرفت رفتار شیمیایی فلزات مختلف را مقایسه کنید.
- با جدول واکنشپذیری برای پیشبینی واکنشها آشنا خواهید شد.
- بر کاربرد سری واکنشپذیری در متالورژی و خوردگی تسلط پیدا میکنید.
- با روند واکنش فلزات با آب، اسید و باز آشنا میشوید.


در این مطلب مجله فرادرس ابتدا با مفهوم واکنشپذیری فلزات آشنا میشویم و به معرفی سری میپردازیم که برای بیان این واکنشپذیری به کار میرود. سپس مروری بر جدول واکنشپذیری فلزات داریم که در آن ویژگیهای فلزات را بررسی میکنیم و مقایسه بین آنها انجام میدهیم. مورد دیگری که به آن میپردازیم کاربرد این واکنشپذیری در زمینههای گوناگون بهخصوص در پیشبینی انجام واکنشهای شیمیایی است. در نهایت نیز تعدادی مثال و تمرین را به همراه پاسخ تشریحی حل میکنیم.
واکنش پذیری فلزات چیست؟
واکنشپذیری فلزات که بهطور معمول با عنوان «سری واکنش پذیری فلزات» (Reactivity Series of Metals) از آن یاد میشود، چیدمان و آرایشی از فلزها است که با توجه به واکنشپذیری آنها صورت میگیرد. در این جدول به ترتیب از فلزاتی با واکنشپذیری بالا به فلزاتی با واکنشپذیری پایین میرسیم. بنابراین سری واکنشپذیری به سری از فلزها گفته میشود که به ترتیب کاهش واکنشپذیری ردیف شده باشند.
دلیل واکنش پذیری فلزات چیست؟
واکنشپذیری فلزات به دلیل ناقص بودن «آرایش الکترونی» (Electronic Configuration) یا اوربیتالهای خارجی آنها است که میتوانند آنها را با از دست دادن الکترون لایه ظرفیت تکمیل کنند. فلزها با از دست دادن الکترون، یونهایی با بار مثبت به وجود میآورند.

فلزهایی که عدد اتمی بزرگتری دارند دارای واکنشپذیری بیشتری نیز هستند زیرا الکترون لایه ظرفیت خود را به سادگی از دست میدهند. دلیل این امر این است که در آنها، لایه ظرفیت بسیار دور از هسته اتم با بار مثبت وجود دارد و میزان کشش توسط آن کاهش و آزادی عمل افزایش پیدا میکند.
سری واکنش پذیری فلزات چیست؟
مشاهده شده است که برخی فلزها به شدت و با سرعت زیادی با واکنشدهنده وارد واکنش میشوند در حالی که برخی دیگر این واکنشها را به آهستگی انجام میدهند و برخی به هیچ وجه وارد واکنش نمیشوند. دلیل این تفاوت، واکنشپذیری متفاوت فلزات نسبت به یکدیگر است.
در اینجا منظور از واکنشپذیری توانایی ماده شیمیایی برای تولید محصولاتی مشخص است.
جدول واکنش پذیری فلزات
در این سری فلز پلاتین با نماد عنصر در انتهای جدول وجود دارد و به این معناست که واکنشپذیری آن از تمام فلزات کمتر است. همچنین جایگاه اول جدول به فلز پتاسیم با نماد تعلق دارد که واکنش پذیرترین فلز موجود در جدول تناوبی عناصر است.
در صورتی که فلزی بتواند در «واکنش جانشینی» (Displacement Reaction) جایگزین فلزی دیگر شود، از آن واکنشپذیری بیشتری دارد. برای تشخیص این مورد میتوان به جدول واکنش پذیری فلزات مراجعه کرد. توجه داشته باشید که میتوان از این جدول برای پی بردن به واکنش فلزها در مواجه با اسید و آب نیز استفاده کرد.
| نام فلز | نماد فلز | واکنشپذیری |
| پتاسیم | با آب وارد واکنش میشوند. | |
| کلسیم | ||
| روی | با اسید وارد واکنش میشوند. | |
| آهن | ||
| هیدروژن | برای مقایسه آورده شده است. | |
| مس | واکنشپذیری پایینی دارند. | |
| پلاتین |
در جدول بالا به تعداد محدودی از فلزها اشاره شده است. توجه داشته باشید که قرارگیری هیدروژن در این جدول برای انجام مقایسه است. برای مشاهده جدول کامل واکنش پذیری فلزات به انتهای این مطلب مراجعه کنید.
ویژگیهای جدول واکنش پذیری فلزات
در این بخش میخواهیم به برخی از ویژگیهای جدول واکنش پذیری فلزات اشاره کنیم.
- تمایل «کاهشی» (Reduction) در فلزهایی که در بالای جدول قرار دارند بالا است، به همین دلیل میتوان به راحتی آنها را اکسید کرد. این فلزها به سادگی دچار خوردگی میشوند. برای مثال سدیم به محض قرارگیری در مجاورت هوا یا آب، منفجر میشود، بنابراین باید همیشه دور از هوا و رطوبت قرار داده شود. این فلز را باید داخل ظرفی پر از پارافین یا نفت سفید نگهداری کرد.
- ویژگی «الکتروپوزیتیوی» (Electropositivity) این فلزها در جدول از بالا به پایین کاهش پیدا میکند. الکتروپوزیتیوی به تمایل عنصر برای از دست دادن الکترون گفته میشود. بنابراین هر چه به سمت پایین پیش میرویم، از دست دادن الکترون برای فلزها دشوارتر است و این باعث کاهش واکنش پذیری آنها میشود.
- با حرکت به سمت پایین جدول از تمایل آنها به کاهش فلزات کاسته میشود.
- تمامی فلزهایی که در جدول واکنش پذیری فلزات بالای عنصر هیدروژن قرار دارند، در واکنش با رقیق یا اسید سولفوریک رقیق از خود گاز هیدروژن آزاد میکنند. در این واکنش محصول نمکی نیز به دست میآید.
- برای جداسازی فلزهایی که در بالای جدول واکنش پذیری فلزات قرار دارند از سنگ معدن و ترکیبات دیگر، به انرژی بیشتری نیاز است.
مقایسه واکنش پذیری فلزات
با توجه به سری واکنش پذیری فلزات میتوان برای گروههای مختلف روندهایی را تعیین کرد که در ادامه به آنها میپردازیم.
واکنش پذیری فلزات قلیایی
«فلزات قلیایی» (Alkali Metals) مانند پتاسیم، سدیم و کلسیم، عنصرهایی به شدت واکنشپذیر هستند و به دلیل انرژی یونش پایینی که دارند، به راحتی الکترونهای لایه بیرونی خود را از دست میدهند و یونهایی با بار مثبت به وجود میآورند. با حرکت به سمت پایین این گروه واکنشپذیری افزایش پیدا میکند زیرا قدرت فلزی که الکترونها را در اتم نگه میدارد، رو به کاهش مینهد.
واکنش پذیری فلزات واسطه
«فلزات واسطه» (Transition Metals) با واکنشپذیری ملایم، شامل فلزهایی مانند آهن و روی میشوند. این فلزها میتوانند با تعداد زیادی از عناصر، ترکیباتی را تشکیل دهند و حالتهای اکسایشی متنوعی نیز دارند. این فلزها میتوانند به انجام واکنشهای شیمیایی کمک کنند بهطوری که خود مصرف نشوند، به همین دلیل نیز از آنها به عنوان کاتالیزور استفاده میشود.

واکنش پذیری فلزات نجیب
«فلزات نجیب» (Noble Metals) مانند طلا و پلاتین با واکنشپذیری بسیار کم خود شناخته میشوند. این فلزها، آرایش الکترونی پایداری دارند که در آن اوربیتالهای لایه بیرونی پر یا نیمهپر و در نتیجه پایدار است که توجیهکننده واکنشپذیری پایین آنهاست. این پایداری بالا باعث میشود فلزات نجیب در طبیعت در برابر خوردگی از خود مقاومت خوبی نشان دهند.
کاربرد سری واکنش پذیری فلزات
از سری واکنشپذیری فلزات میتوان به اطلاعات بسیاری در مورد رفتار آنها در واکنشها و همچنین ویژگیهای آنها دست پیدا کرد. در فهرست زیر به تعدادی از این کاربردها اشاره کردهایم.
پیشبینی واکنشهای شیمیایی
از ترتیب واکنش پذیری فلزات میتوان در مورد واکنشهای شیمیایی آنها اظهار نظر کرد. ترکیباتی که واکنشپذیری بالایی دارند تمایل بیشتری به واکنش با ترکیبات دیگر دارند و این قضیه در مورد ترکیبات با واکنشپذیری کمتر برعکس است.
متالورژی و استخراج فلزات
دانستن روند واکنش پذیری فلزات در علم متالورژی از اهمیت بالایی برخوردار است زیرا از آن فلزات را از سنگهای معدنی اسخراج میکنند. برای به دست آوردن فلزهای بسیار واکنشپذیر مانند سدیم و پتاسیم از روشهای الکترولیز استفاده میشود. از طرف دیگر برای استخراج فلزهایی با واکنشپذیری کمتر مانند نقره و مس از فرآيند ذوب شدن و کاهش استفاده میشود.
جلوگیری از خوردگی
اطلاعات به دست آمده از سری واکنش پذیری فلزات در پیشگیری از خوردگی آنها کمک بهسزایی میکند بهصورتی که میتوان اقدامات مورد نیاز را برای آنها انجام داد. برای مثال «آندهای فداشونده» (Sacrificial Anodes) از فلزهای با واکنشپذیری بالا مانند روی تولید میشوند و از قطعات استیل یا آهنی مراقبت میکنند تا دچار زنگزدگی نشوند.
واکنش فلزات
از این جدول میتوان برای کاربردهای دیگری نیز استفاده کرد. برای مثال میتوان در مورد واکنش هر کدام از فلزها با اسید، با آب و در واکنش جانشینی یگانه پیشبینیهایی انجام داد. در ادامه به برخی از این واکنشها اشاره میکنیم.
واکنش پذیری فلزات با آب
کلسیم و تمامی فلزهایی که در جدول واکنشپذیری بالای آن قرار دارند و در نتیجه واکنشپذیری بیشتری دارند، با آب سرد وارد واکنش میشوند و علاوه بر هیدروکسید فلز مربوطه، از خود گاز هیدروژن نیز آزاد میکنند. برای مثال واکنش بین پتاسیم و آب به تولید پتاسیم هیدروکسید با فرمول شیمیایی و گاز میانجامد. در زیر میتوانید این واکنش را مشاهده کنید.
واکنش جانشینی یگانه بین فلزات
فلزاتی که واکنشپذیری بالایی دارند میتوانند فلزهایی با واکنشپذیری کمتر را کاهش دهند. در این واکنش فلز با واکنشپذیری کمتر باید بهصورت نمک خود در محلول آبی باشد. این واکنش از طریق «واکنش جانشینی یگانه» (Single Displacement Reaction) انجام میشود.
در این مورد مثالی را مورد بررسی قرار میدهیم. مس میتواند به راحتی جایگزین نقره در محلول نقره نیترات شود زیرا واکنشپذیری مس از نقره بسیار بیشتر است. واکنش موازنه شده این جانشینی را میتوان بهصورت بالا نشان داد. همانطور که مشاهده میکنید در نتیجه این واکنش نقره جامد به دست میآيد.
واکنش پذیری فلزات با اسید و باز
تمام فلزهایی که واکنشپذیرتر از هیدروژن باشند، میتوانند جایگزین آن در اسیدهای رقیق شوند. در نتیجه این واکنش نمک فلز مربوطه و گاز هیدروژن به وجود میآيد. برای مثال به واکنش زیر توجه کنید.
در این واکنش سدیم فلزی تمایل دارد تا جایگزین هیدروژن در هیدروژن کلرید شود. با انجام این واکنش سدیم کلرید و گاز هیدروژن به وجود میآيد.
مثال دیگری را در واکنش زیر مشاهده میکنید که در آن اسید سولفوریک رقیق حضور دارد. در این واکنش آهن جایگزین هیدروژن در ساختار اسید سولفوریک میشود و محصول آهن سولفات و هیدروژن گازی را به دست میدهد. واکنش موازنه شده این جانشینی را میتوانید در زیر مشاهده کنید.
در مثال بعدی میخواهیم جانشینی یگانه را در حضور باز مورد بررسی قرار دهیم. زمانی که روی با سدیم هیدروکسید وارد واکنش میشود، محلول آبی زینکات سدیم و گاز هیدروژن به وجود میآید زیرا روی به دلیل واکنشپذیری کمتر، نمیتواند جایگزین سدیم شود. این واکنش را بهصورت موازنه شده در زیر مشاهده میکنید.
واکنش پذیری فلزات با اکسیژن
برخی از فلزات واکنشپذیر مانند فلزات قلیایی به راحتی با اکسيژن وارد واکنش میشوند. همچنین فلزهایی مانند مس، نقره و آهن نیز به آهستگی با اکسیژن واکنش میدهند. در نتیجه واکنش فلز با اکسیژن، اکسید فلز به وجود میآید. نمونهای از این واکنش را در زیر با فلز مس آوردهایم.
اکسیژن روی فلزی مانند طلا هیچ تاثیری نمیگذارد، به همین دلیل طلا در طبیعت از پایداری بسیار زیادی برخوردار است.
خوردگی فلز آهن چیست؟
در این بخش میخواهیم بدانیم خوردگی یا زنگزدگی آهن چه پدیدهای است و باعث تولید چه ترکیب شیمیایی میشود. «زنگ آهن» (Rust) زمانی تشکیل میشود که آهن با اکسیژن، چه در هوا چه در آب، وارد واکنش شود و محصول اکسید آهن (III) آبدار را به وجود بیاورد. فرمول شیمیایی این ماده بهصورت است. فرآیند تشکیل زنگ آهن شامل واکنشی اکسایش است زیر ا طی آن آهن، الکترون میگیرد و اکسیژن الکترون از دست میدهد.
در ادامه میخواهیم با انجام آزمایشی ثابت کنیم که آهن در غیاب هوا و آب، زنگ نمیزند. در لوله اول شاهد حضور میخ آهنی در آب هستیم که منجر به تشکیل زنگ روی آن شده است. در لوله دوم، اکسيژن محلول آب حذف شده است و سپس میخ را در داخل آن گذاشتهایم. همانطور که مشاهده میکنید هیچ زنگی روی آن تشکیل نشده است. همچنین وجود لایهای روغن روی آب از ورود اکسیژن هوا در آب جلوگیری میکند.
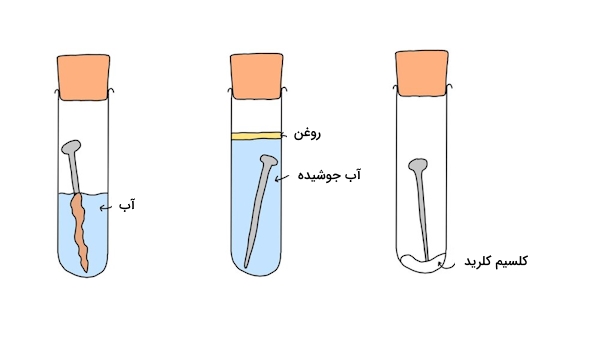
در لوله سوم کمی کلسیم کلرید در ته ظرف وجود دارد. این ماده جاذب رطوبت است و از زنگ زدن میخ آهنی جلوگیری میکند. همانطور که مشاهده کردید در لوله دوم و سوم که در هر کدام به طریقی از واکنش اکسيژن با آهن جلوگیری شد، میخ آهنی دچار زنگ زدگی نشد.
مثال و حل تمرین از واکنش پذیری فلزات
حال که با سری واکنشپذیری فلزات آشنا شدیم، میخواهیم با بررسی تعدادی مثال و تمرین، درک خود را از این مفهوم عمق ببخشیم.
مثال از واکنش پذیری فلزات
در این بخش تعدادی مثال را به همراه پاسخ تشریحی آنها مورد بررسی قرار میدهیم. با دقت به این مثالها، میتوان به سوالهای مشابه نیز پاسخ داد.
مثال اول
طرف دوم واکنش زیر را با توجه به سری واکنش پذیری فلزات بنویسید و آن را موازنه کنید.
پاسخ
با توجه به اینکه واکنشپذیری روی از مس بیشتر است، وارد واکنش جانشینی یگانه میشود و مس جامد به دست میآید. واکنش موازنه این جانششینی بهصورت زیر است.
مثال دوم
چرا در سری واکنش پذیری فلزات هیدروژن را نیز میگنجانند؟
پاسخ
علاوه بر امکان مقایسه، هیدروژن مانند فلزها الکترون از دست میدهد و تبدیل به یون مثبت میشود.
مثال سوم
کدام خانواده از فلزها بیشترین واکنشپذیری را دارند؟
پاسخ
همانطور که در سری واکنش پذیری فلزات نیز مشاهده میکنید، فلزات قلیایی از باقی گروهها واکنشپذیرتر هستند.
مثال چهارم
اگر مفتولی مسی را در ظرفی حاوی محلول قرار دهیم، چه اتفاقی میافتد؟
پاسخ
از آنجا که مس در سری واکنشپذیری فلزات در زیر منیزیم قرار دارد، از آن واکنشپذیری کمتری دارد و نمیتواند در واکنش جانشینی یگانه جایگزین آن شود. بنابراین در این مورد شاهد هیچ تغییری نخواهیم بود.
مثال پنجم
چرا آهن در حضور مس دچار زنگزدگی میشود اما در حضور روی خیر؟
پاسخ
مس در سری واکنش پذیری فلزات در زیر آهن قرار دارد بنابراین واکنشپذیری آهن از آن بیشتر است. به همین دلیل آهن در حضور مس زنگ میزند اما جایگاه روی بالاتر از آهن است، در نتیجه به دلیل واکنشپذیری بیشتر روی، آهن مصون میماند.
مثال ششم
فلزاتی مانند فرانسیم، سزیم و روبیدیم در سری واکنش پذیری فلزات چه جایگاهی دارند؟
پاسخ
ترتیب واکنش پذیری فلزات بهصورت زیر است:
فرانسیم > سزیم > روبیدیوم
فرانسیم به دلیل اینکه عنصری مصنوعی است در جدول گنجانده نمیشود. همچنین بهطور معمول از آوردن سزیم و روبیدیوم در ابتدای جدول نیز خودداری نیز میشود زیرا یا در طبیعت به مقدار بسیار اندکی وجود دارند یا به روش مصنوعی تولید میشوند.
مثال هفتم
نمک فلز به چه ترکیبی گفته میشود؟
پاسخ
نمک فلز وقتی تشکیل میشود که هیدروژن یک اسید با فلز جایگزین شده باشد. برای مثال در ، روی فلز و اسید سولفوریک ترکیبی اسیدی است. روی با این اسید وارد واکنش میشود و روی سولفات را به وجود میآورد. این واکنش را میتوان بهصورت زیر نمایش داد.
تمرین از واکنش پذیری فلزات
در این بخش به بررسی تعدادی تمرین چند گزینهای در رابطه با واکنش پذیری فلزات میپردازیم.
تمرین اول
تمرین دوم
تمرین سوم
تمرین چهارم
تمرین پنجم
تمرین ششم
سوالات متدوال واکنش پذیری فلزات
حال که میدانیم واکنش پذیری فلزات چیست و چگونه قابل تشخیص است، میخواهیم به برخی از مهمترین و پرتکراترین سوالهای پیرامون آن پاسخ دهیم.
سری واکنش پذیری فلزات به چه معناست؟
سری واکنش پذیری فلزات، سری است که فلزات در آن به ترتیب کاهش تمایل به انجام واکنش، قرار داده شدهاند، بهصورتی که واکنشپذیرترین فلز در بالای این فهرست و فلز با کمترین واکنشپذیری در پایین آن حضور دارد.
واکنش پذیرترین فلز در سری واکنشپذیری فلزات کدام است؟
پتاسیم در بالای این سری قرار دارد و دارای بیشترین واکنشپذیری است.
کدام فلز در سری واکنش پذیری فلزات در انتها قرار دارد؟
فلز پلاتین آخرین فلز این سری است و دارای کمترین واکنشپذیری است.
چه عواملی برمقایسه واکنش پذیری فلزات تاثیرگذار هستند؟
عوامل متفاوتی از جمله شعاع اتمی، بار هسته، آرایش لایههای الکترونی و اثر پوشانندگی بر میزان واکنش پذیری فلزات موثر هستند.
کاربرد ترتیب واکنش پذیری فلزات چیست؟
به کمک این سری میتوان پیشبینی کرد که فلزی توانایی جایگزینی با فلز دیگر را در واکنش جانشینی یگانه دارد یا خیر.
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با سری واکنش پذیری فلزات و استخراج اطلاعات از آن بود. با اطلاعات به دست آمده از این سری میتوان در مورد نحوه رفتار فلزها در واکنشها اظهار نظر کرد. در ادامه نیز با بررسی چند مثال و تمرین درک خود را از این مفهوم عمق بخشیدیم.
جدول واکنش پذیری فلزات
این جدول بهطور کامل سری واکنش پذیری فلزات را نشان میدهد. در این جدول هر چه به سمت پایین میرویم از واکنشپذیری فلزات کاسته میشود. توجه داشته باشید که هیدروژن صرفا جهت مقایسه در این فهرست آورده شده است.
| نام فلز | نماد فلز | واکنش پذیری |
| پتاسیم | با آب واکنش میدهند. | |
| سدیم | ||
| لیتیم | ||
| باریم | ||
| استرانسیم | ||
| کلسیم | ||
| منیزیم | با اسید واکنش میدهد. | |
| بریلیوم | ||
| آلومینیوم | ||
| تیتانیوم | ||
| روی | ||
| منگنز | ||
| کروم | ||
| آهن | ||
| کادمیم | ||
| کبالت | ||
| نیکل | ||
| قلع | ||
| سرب | ||
| هیدروژن | برای مقایسه گنجانده شده است. | |
| آنتیموان | واکنش پذیری بسیار پایینی دارند. | |
| بیسموت | ||
| تنگستن | ||
| مس | ||
| جیوه | ||
| نقره | ||
| طلا | ||
| پلاتین |
آزمون ترتیب واکنش پذیری فلزات
۱. سری واکنشپذیری فلزات چه مفهومی دارد و دلیل اصلی تفاوت واکنشپذیری فلزات چیست؟
سری واکنشپذیری فقط ویژگی ظاهری فلزات را نمایش میدهد و تفاوت واکنشپذیری به رنگ فلزات مرتبط است.
سری واکنشپذیری جدولی برای مقایسه جرم فلزات است و علت تفاوت واکنشپذیری به جرم اتمی بستگی دارد.
سری واکنشپذیری ترتیب فلزات براساس کاهش تمایل به واکنش است و دلیل تفاوت به ساختار الکترونی لایه ظرفیت مربوط میشود.
سری واکنشپذیری میزان چگالی فلزات را مقایسه میکند و اختلاف در چگالی موجب تفاوت واکنشپذیری است.
مفهوم «سری واکنشپذیری» به چیدمان فلزات بر اساس کاهش واکنشپذیری اشاره دارد و تفاوت اصلی رفتار آنها به ساختار الکترونی لایه ظرفیت بازمیگردد. دلیل تفاوت واکنشپذیری، آسانی یا دشواری از دست دادن الکترون وابسته به آرایش الکترونی است.
۲. چه رابطهای میان آرایش الکترونی لایه ظرفیت فلزات و میزان واکنشپذیری آنها وجود دارد؟
فلزاتی با لایه ظرفیت نزدیک به هسته، همیشه واکنشپذیری بالایی دارند.
هرچه الکترونهای لایه ظرفیت راحتتر جدا شوند، واکنشپذیری بیشتر است.
فلز با آرایش پر در لایه ظرفیت، واکنشپذیری زیادی دارد.
تعداد لایههای الکترونی فقط در واکنشپذیری فلزات نجیب موثر است.
در فلزاتی که الکترونهای لایه ظرفیت را به آسانی از دست میدهند، یعنی فاصله این لایه از هسته بیشتر است و نیروی نگهدارنده هسته کمتر است، واکنشپذیری افزایش مییابد. جمله «هرچه الکترونهای لایه ظرفیت راحتتر جدا شوند، واکنشپذیری بیشتر است» این نکته را بهدرستی بیان میکند.
۳. با توجه به جدول واکنشپذیری، فلزی که جایگاهی بالاتر از هیدروژن دارد، هنگام واکنش با اسید چه اتفاقی رخ میدهد؟
فلز به آرامی رسوب کرده و تغییر شیمیایی چندانی نمیکند.
اکسید فلز تشکیل میدهد و گاز تولید نمیشود.
در برابر اسید کاملا مقاوم باقی میماند و واکنشی رخ نمیدهد.
گاز هیدروژن تولید میکند و فلز حل میشود.
فلزی که در جدول واکنشپذیری بالاتر از هیدروژن قرار دارد، میتواند هیدروژن را از اسید بیرون کند و به راحتی با اسید واکنش داده و گاز هیدروژن آزاد میکند. این رفتار برگرفته از تمایل بالاتر فلز به از دست دادن الکترون است. «تولید گاز هیدروژن و حل شدن فلز» دقیقا رفتاری است که در این شرایط رخ میدهد.
۴. کدام مورد بیشترین تاثیر را در واکنشپذیری بالای فلزات قلیایی نسبت به فلزات نجیب دارد؟
فلزات قلیایی معمولا دچار خوردگی سریعتر از فلزات نجیب میشوند.
فلزات قلیایی انرژی یونش بسیار پایین داشته و الکترون ظرفیت خود را راحتتر از دست میدهند.
فلزات قلیایی نسبت به آب و اسید واکنش سریعتری نشان میدهند.
در فلزات نجیب آرایش الکترونی پایدار مانع از واکنشپذیری بالای آنها میشود.
«فلزات قلیایی انرژی یونش بسیار پایین داشته و الکترون ظرفیت خود را راحتتر از دست میدهند» مهمترین عامل واکنشپذیری بالای آنهاست. پایین بودن انرژی یونش باعث میشود این فلزات به آسانی الکترون از دست داده و وارد واکنش شوند.
۵. برای افزایش مقاومت یک قطعه آهنی در برابر خوردگی، کدام فلز باید به عنوان آند فداشونده براساس سری واکنشپذیری استفاده شود؟
نقره در کنار آهن برای کاهش زنگزدگی است.
پلاتین راهکار اصلی جلوگیری از خوردگی است.
مس برای محافظت به عنوان آند قرار میگیرد.
روی به عنوان آند فداشونده کاربرد دارد.
برای جلوگیری از خوردگی آهن، باید فلزی انتخاب شود که واکنشپذیری بالاتری نسبت به آهن داشته باشد تا به عنوان آند فداشونده عمل کند. طبق سری واکنشپذیری، «روی به عنوان آند فداشونده کاربرد دارد» چون روی فعالتر از آهن است و پیش از آن دچار خوردگی میشود. فلزهایی مثل «مس»، «نقره» و «پلاتین» واکنشپذیری پایینتری نسبت به آهن دارند، در نتیجه نمیتوانند نقش آند فداشونده را ایفا کنند و در حفاظت کاتدی آهن موثر نیستند.
۶. برای تشخیص امکان وقوع واکنش جانشینی بین دو فلز با استفاده از سری واکنشپذیری، کدام اصل باید مد نظر قرار گیرد؟
هر دو فلز باید در یک گروه جدول تناوبی باشند تا واکنش انجام شود.
تنها در حضور آب واکنش جانشینی میان دو فلز ممکن است.
فلزی با واکنشپذیری بیشتر میتواند یون فلز دیگر را در ترکیب جانشینی کند.
فلز با عدد اتمی پایینتر همیشه باعث واکنش جانشینی میشود.
وقتی یک فلز در سری واکنشپذیری جایگاه بالاتری نسبت به فلز دیگر داشته باشد، میتواند یون آن را از ترکیب خارج و جانشینی کند. جمله «فلزی با واکنشپذیری بیشتر میتواند یون فلز دیگر را در ترکیب جانشینی کند» کاملا صحیح است زیرا واکنش جانشینی فقط زمانی رخ میدهد که فلز واردکننده فعالتر از فلز موجود در ترکیب باشد.
۷. روند واکنشپذیری فلزات واسطه نسبت به فلزات قلیایی و نجیب چگونه است و چه نقش مهمی در فرآیندهای شیمیایی دارند؟
فلزات واسطه تقریبا واکنشپذیری ندارند و همواره در برابر اکسایش پایدار میمانند.
فلزات واسطه واکنشپذیری بسیار بیشتری از قلیاییها و مقاومت کمتری در برابر خوردگی نسبت به نجیبها دارند.
واکنشپذیری فلزات واسطه کمتر از قلیاییها ولی مشابه فلزات نجیب است و نقش اندکی در واکنشها دارند.
فلزات واسطه واکنشپذیری متوسط داشته و توانایی انجام واکنشهای کاتالیزوری متنوعی دارند.
فلزات واسطه دارای واکنشپذیری متوسط هستند و برخلاف فلزات قلیایی که واکنشپذیری بسیار بالایی دارند یا فلزات نجیب که تقریبا واکنش نمیدهند، این گروه نقش مهمی بهویژه در کاتالیز واکنشهای شیمیایی ایفا میکنند.













خیلی کامل و مفید بود سپاس
عالی
کامل ،عالی و مفید بود