اسید لوییس چیست؟ – به زبان ساده + مثال
«اسید لوییس» (Lewis Acid) و «باز لوییس» (Lewis Base) دو مفهوم بسیار مهم و حیاتی در علم شیمی هستند. طبق تعریف اسید لوییس گونهای است که گیرنده الکترون و باز لوییس گونهای است که دهنده الکترون باشد. در این مطلب میخواهیم بدانیم اسید لوییس چیست و از چه طریقی قابل تشخیص است. همچنین در مورد انواع آن و نحوه تشخیص و سنتز آن صحبت خواهیم کرد.
- خواهید آموخت چگونه اسید و باز لوییس را در واکنشهای شیمیایی تشخیص دهید.
- یاد میگیرید تفاوت اسید و باز لوییس با نظریههای برونستد و آرنیوس را تحلیل کنید.
- میآموزید نحوه اثر LUMO و HOMO را در واکنشهای اسیدی-بازی بررسی کنید.
- خواهید توانست بازهای لوییس را با تکیه بر زوجالکترونهای آزاد شناسایی کنید.
- درک میکنید چگونه دستهبندی سختی و نرمی بر رفتار اسید و باز تاثیر میگذارد.
- با کاربردهای صنعتی اسید لوییس، مانند واکنش Friedel–Crafts، آشنا میشوید.


اسید لوییس چیست ؟
برای آنکه بدانیم اسید لوییس چیست و چه انواعی دارد، باید مبنای تشخیص این خانواده از ترکیبات را مورد مطالعه قرار دهیم. مبنای تشخیص اسید لوییس برخلاف تعاریف دیگر، الکترونها هستند. طبق این تعریف اسید گونهای است که پذیرنده زوجالکترون باشد.
به همین صورت میتوان باز لوییس را نیز بهصورت گونهای تعریف کرد که دهنده زوجالکترون باشد. بهصورت دقیقتر میتوان آنها را به این شکل تعریف کرد.
- اسید لوییس: گونهای که پذیرنده زوجالکترون، مانند یک الکتروندوست، و دارای اوربیتال با ظرفیت خالی است.
- باز لوییس: گونهای که دهنده زوجالکترون، مانند هسته دوست، و دارای زوجالکترون تنها است.
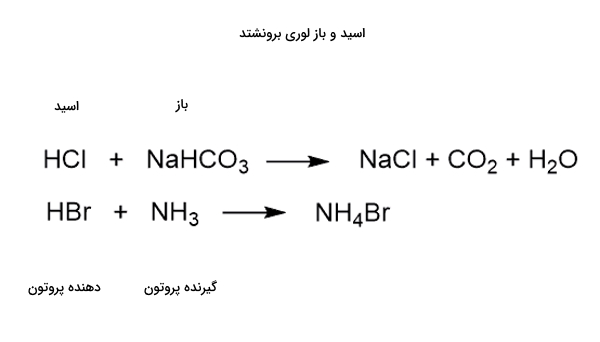
این گفتهها را میتوانید در معادله تصویر زیر بهخوبی مشاهده کنید.
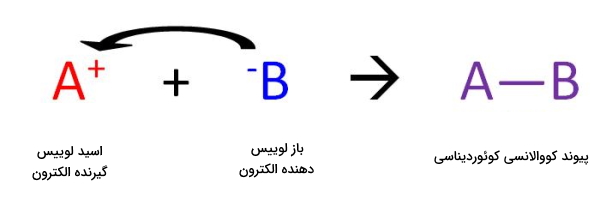
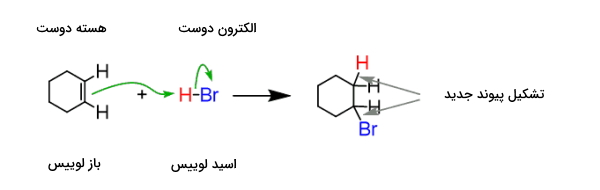
واکنش بین اسید و باز لوییس به تولید یک پیوند کوئوردینه کووالانسی میانجامد. پیوند کوئوردینه کوالانسی نوعی از پیوند کووالانسی است که در آن یکی از اجزای واکنشدهنده زوجالکترون خود را به جزء دیگر میدهد.
در این مورد باز لوییس الکترون خود را به اسید لوییس میدهد. نتیجه واکنش این دو را فراورده افزایشی مینامند. برای درک بهتر به انتقال الکترون در تصویر زیر دقت کنید.
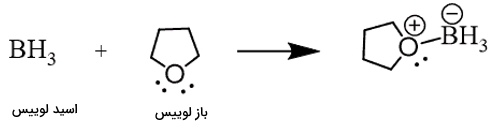
مکانیسم انجام واکنش بین اسید و باز لوییس را که منجر به تشکیل یک ترکیب با پیوند کووالانسی کوئوردیناسی میشود را در زیر مشاهده میکنید. فلش سبز جهت انتقال الکترون بین دو گونه مختلف را طی واکنش نشان میدهد.
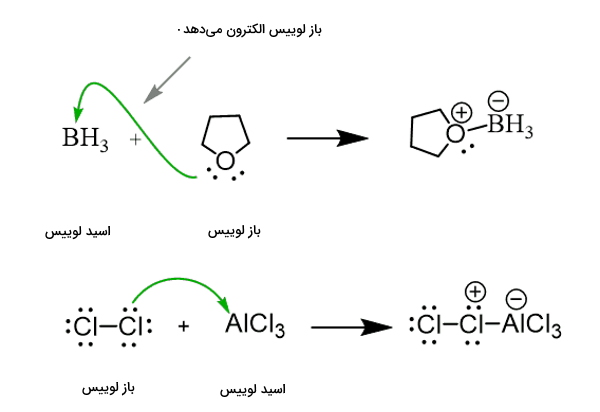
مثالی از اسید و باز لوییس
اسید لوییس الکترون را از باز لوییس دریافت میکند. در زیر واکنش دیگری را مشاهده میکنید که میتوان نحوه انجام آن را با کمک تعریف لوییس از اسید و باز توضیح داد. در این واکنش آمونیاک با کاتیون روی وارد واکنش میشود.
در این واکنش کاتیون روی، اسید لوییس و آمونیاک باز لوییس است. توجه داشته باشید که انجام این واکنش را با تعریف برونستد نمیتوان بیان کرد زیر ا در آن هیچ کاتیون و تبادل نمیشود. بنابراین میتوان اینطور نتیجهگیری کرد که یکی از مزایایی تعریف اسید و باز لوییس این است که در تشریح واکنشهای فاقد یون هیدرونیوم و هیدروکسید مفید است.
از طرفی به دلیل عدم وجود و تشخیص اسید و باز بودن مولکولهای فاقد آن دشوار خواهد بود. در این مواقع میتوان دنبال گونهای گشت که پذیرنده الکترون باشد و آن را اسید لوییس دانست. به همین صورت میتوان به گونهای که گیرنده الکترون است، باز لوییس را نسبت داد.
تعاریف دیگر اسید
لوییس تنها شیمیدانی نبود که تلاش کرد با تعریفی دقیق به مفهوم اسید و باز بپردازد. اسید و بازها خانواده بسیار مهم و پرکاربردی در علم شیمی هستند و به همین دلیل در طول تاریخ مطالعات بسیاری برای شناسایی و توجیه رفتار آنها صورت گرفته است. در این بخش میخواهیم بدنیم تفاوت نظریه اسید لوییس با تعاریف دیگر در چیست و سپس با تعدادی نظریه دیگر برای تشخیص این دسته از مواد آشنا میشویم.
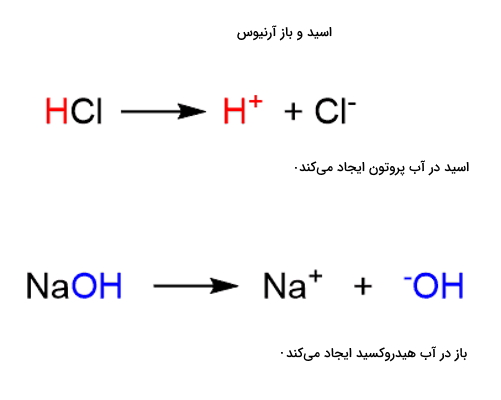
اسید و باز آرنیوس
نظریه اسید و باز آرنیوس اولین نظریهای بود که در قرن نوزدهم برای طبقهبندی اسیدها و بازها بیان شد. طبق این نظریه اسیدها در محلول آبی پروتون و بازها در محلول آبی یون هیدروکسید را تولید میکنند. این نظریه را میتواند در دو واکنش زیر بهخوبی مشاهده کنید.
مشکل این نظریه زمانی مشخص میشود که مولکولی با اسید وارد واکنش میشود و خاصیت بازی دارد اما فاقد یون هیدروکسید است. برای مثال به واکنش زیر توجه کنید. در این واکنش جوش شیرین با فرمول شیمیایی با اسید وارد واکنش میشود.
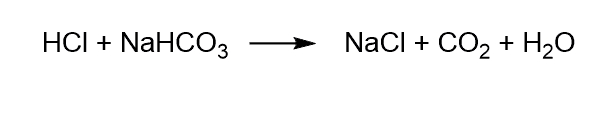
با در نظر گرفتن عدم پاسخگویی این نظریه در برخی موارد از جمله این واکنش، نظریه لوری-برونستد برای داشتن تعریف جامعتر و بهتری از مفهوم اسید و باز ارائه شد.
اسید و باز برونستد
نظریه اسید و باز برونستد در تاریخچه علم شیمی بسیار پرکاربرد بوده است با این حال به دلیل محدودیتهایی که دارد، امروزه خیلی مورد استقبال دانشمندان قرار نمیگیرد. این نظریه اسیدها و بازها را بهصورت دهنده و گیرنده پروتون در نظر میگیرد. این محدودیت کارایی این نظریه را محدود میکند، برای مثال نمیتوان از این نظریه در مورد مواد به شکل فیزیکی گاز و جامد استفاده کرد. برای درک بهتر مفهوم اسید و باز طبق این نظریه به تصویر زیر توجه کنید.
با در نظر گرفتن این توضیحات متوجه شدیم که این نظریه نیز کامل نیست. هرچند نسبت به نظریه آرنیوس مزایایی دارد اما برای رفع نواقص آن نظریه اسید و باز لوییس مطرح شد.
تشابه نظریه لوری-برونستد و لوییس
در این بخش میخواهیم بدانیم تفاوت اسید برونستد و اسید لوییس چیست و برای این کار نگاهی به این دو نظریه میاندازیم. پروتونها ذراتی با بار مثبت هستند و هیدروکسید دارای باز منفی است. پس میتوان آن ها را مانند زیر با دو علامت مثبت و منفی نمایش داد. از این نظر در این دو نظریه تشابه مشاهده میشود.
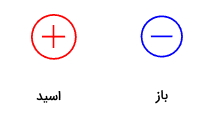
همچنین بازهای لوییس فراهم آورنده الکترون هستند و آن را در اختیار گونه اسیدی قرار میدهند.
انواع اسید لوییس
در این بخش میخواهیم بدانیم انواع اسید لوییس چیست و این اسیدها چه تفاوتهایی با یکدیگر دارند. تعدادی از مولکولها به دلیل ساختاری که دارند، میتوانند به عنوان اسید لوییس عمل کنند.
میدانیم که اسید لوییس گیرنده زوجالکترون و بنابراین الکتروندوست است. الکتروندوستها گونههایی هستند که تمایل به جذب الکترون دارند. توجه داشته باشید که در هنگام همراهی اسید لوییس با باز لوییس، اسید از پایینترین اوربیتال مولکولی اشغال نشده خود استفاده میکند. این اوربیتال را به نام (Lowest Unoccupied Molecular Orbital) یا به اختصار میشناسیم.
در لیست زیر میتوانید تعدادی از گونههایی که میتوانند اسید لوییس باشند را مشاهده کنید.
- تمامی کاتیونها به دلیل توانایی در پذیرش الکترون اسید لوییس هستند. از این مورد میتوان به کاتیونهای ، و اشاره کرد.
- هر اتم، یون یا مولکولی که فاقد الکترونهای اکتت باشد، میتواند به عنوان یک اسید لوییس عمل کند. از این مورد میتوان به و اشاره کرد.
- مولکولهایی که اتمهای مرکزی آنها میتواند بیش از ۸ الکترون ظرفیت داشته باشد، پذیرنده الکترون است و باز لوییس در نظر گرفته میشود. و مثالهایی از این مورد هستند.
- مولکولهایی که بین دو اتم با مقدار الکترونگاتیوی متفاوت دارای بیش از یک پیوند باشند، اسید لوییس هستند. از این مورد میتوان و را نام برد.
اسیدهای لوییس ساده
برخی از اسیدهای لوییس بسیار مورد مطالعه قرار گرفتهاند و پرکاربرد نیز هستند. در این بخش به تعدادی از این اسیدهای لوییس ساده میپردازیم. یکی از این اسیدهای لوییس «بور تری فلوئورید» است.
توجه داشته باشید که هر دوی و فراورده افزایشی باز لوییسی از «بور تری فلوئورید» هستند. بسیاری از فراوردههای افزایشی «قانون اکتت» (Octet Rule) را نقض میکنند. از این مورد میتوان به آنیون «تری یدید» اشاره کرد. نحوه تشکیل آن را در واکنش زیر مشاهده میکنید.
تنوع رنگ محلول ید نشان دهنده توانایی گسترده محلول برای تشکیل فراوردههای افزایشی با اسید لوییس است. برخی از اسیدهای لوییس هستند که با دو باز لوییس همراه میشوند. از این مورد میتوان به «هگزافلورو سیلیسم» اشاره کرد. واکنش تشکیل آن را در زیر آوردهایم.
اسیدهای لوییس کمپلکس
بسیاری از ترکیباتی که از آنها با عنوان اسید لوییس یاد میشود، پیش از وارد واکنش شدن با باز لوییس برای تشکیل فراورده افزایشی نیاز به یک مرحله فعالسازی دارند. ترکیبات کمپلکس مانند و را مولکولها تخت و سهگوشه در نظر میگیریم در حالی که به شکل توده یا پلیمر وجود دارند و باید پیش از واکنش با باز لوییس تجزیه شوند. یک مثال سادهتر تشکیل فراورده افزایشی از بور است. اسید لوییس به صورت تکپار حضور ندارد، بنابراین نیاز به تجزیه آن است. در این راستا به واکنش زیر توجه کنید.
در این مورد میتوان از حد واسطی به شکل استفاده کرد.
بسیاری از کمپلکسهای فلزی میتوانند به عنوان اسید لوییس در نظر گرفته شوند اما باید از باز لوییس همراه خود، بهطور معمول آب، جدا شوند. این مورد را با حضور فلز منیزیم در واکنش زیر مشاهده میکنید.
هیدروژن به عنوان اسید لوییس
هیدروژن بهصورت یکی از قویترین اسیدهای لوییس است. واکنش اسیدی-بازی این گونه را میتوان به شکلهای زیر نمایش داد.
انواع باز لوییس
همانطور که گفتیم بازهای لوییس دهنده زوجالکترون هستند. این مواد گونههایی هسته دوست هستند، به این معنا که به بار مثبت از سمت زوجالکترون ناپیوندی خود حمله میکنند. آنها در این فرایند از «بالاترین اوربیتال مولکولی اشغال شده» خود (Highest Occupied Molecular Orbital) استفاده میکنند. این اوربیتال را با حروف اختصاری بهصورت نشان میدهند. بنابراین اتم، یون یا مولکولی که دارای زوجالکترون ناپیوندی باشد، باز لوییس است. در زیر تعدادی از آنها را آوردهایم.
واکنش اسید و باز لوییس
تا اینجا دانستیم اسید لوییس چیست و چه انواعی دارد. در این بخش میخواهیم به واکنشهایی بپردازیم که اسید و باز با یکدیگر انجام میدهند. زمانی که یک اسید با یک باز لوییس همراه میشود، بالاترین اوربیتال مولکول اشغال شده باز با پایینترین اوربیتال مولکولی اشغال نشده اسید، برهمکنش میکند و اوربیتال مولکولی پیوندی را به وجود میآورد. توجه داشته باشید که هم اسید هم باز لوییس دارای هر دو اوربیتال و هستند اما تنها آنهایی را که در برهمکنش دخیل هستند، مورد بررسی قرار میدهیم.
تعداد بسیار زیادی از واکنشها را میتوان به عنوان واکنش اسید و باز لوییس در نظر گرفت. درواقع هر واکنشی که در آن جریان الکترون از جزئی به جز دیگر در جریان باشد در این دسته میگنجد. از آنجا که اسید لوییس کمبود الکترون دارد به آن الکتروندوست نیز میگوییم و به همین صورت به باز لوییس، هسته دوست نیز اطلاق میشود. واکنش زیر نمونهای از این نوع است.
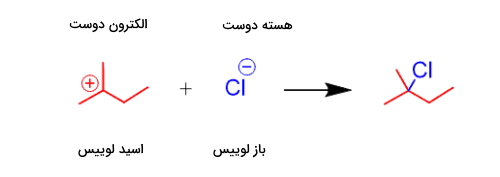
با این حال بسیاری از این واکنشها در دسته جامعتر «واکنشهای جانشینی هستهدوستی» (Nucleophilic Substitution Reaction) طبقهبندی میشوند. همچنین در برخی از واکنشهای اسید و باز لوییس، پیوندهای از بین میروند و پیوندهای جدیدی به وجود میآیند. در این راستا به مثال زیر توجه کنید.
در این مثال پیوند دوگانه مانند باز لوییس عمل میکند و دهنده الکترون و اسید لوییس است. توجه داشته باشید که به دلیل ماهیت اجزای این واکنش میتوان هم آن را در دسته واکنشها اسید و باز لوییس، هم در واکنشهای جانشینی هستهدوستی گنجاند.
مثال واکنش اسید و باز لوییس
در این بخش میخواهیم تعدادی مثال از واکنش اسید و باز لوییس را بررسی کنیم. به هر واکنش دقت کنید و بگویید کدام ترکیب باز و کدام اسید لوییس است؟
واکنش ۱
رویکردی که در چنین پرسشهایی باید در پیش بگیریم این است که در هر مورد واکنشدهنده با کمبود الکترون و واکنشدهنده الکتروندهنده را پیدا کنیم. طبق تعریف جزئی که کمبود الکترون دارد، اسید لوییس و جزئی که الکتروندهنده است، باز لوییس نامیده میشود.
در ، بور تنها ۶ الکترون در لایه ظرفیت خود دارد و از همین رو کمبود الکترون خواهد داشت و میتواند پذیرای زوجالکترون باشد. مانند اتم عنصر اکسیژن، اتم گوگرد در دو زوجالکترون ناپیوندی دارد. بنابراین بین این دو گونه انتقال الکترون صورت میگیرد. از آنجا که الکترون از به منتقل میشود، اولی باز لوییس و دومی اسید لوییس نامیده میشود.
واکنش ۲
در این واکنش از در زوجالکترون دریافت میکند و یون کربنات را تشکیل میدهد. اکسیژن دهنده الکترون است، بنابراین آن را باز لوییس مینامیم. همچنین که الکترون میپذیرد، اسید لوییس خواهد بود.
واکنش ۳
در این مثال یون کلرید دارای ۴ زوجالکترون ناپیوندی است و آنها را به میدهد. بنابراین یون کلرید باز لوییس و اسید لوییس خواهد بود.
واکنش ۴
از واکنش اسید و باز لوییس میتوان برای درک چرایی انحلالپذیری اکسیدهای نافلزی مانند در آب استفاده کرد. به این واکنش که در زیر آورده شده است، توجه کنید.
در این واکنش مولکول آب دهنده زوجالکترون است و نقش باز لوییس را ایفا میکند. همچنین گیرنده این الکترون اتم کربن موجود در کربن دیاکسید است. میخواهیم مکانیسم این واکنش را مورد مطالعه قرار دهیم. وقتی اتم کربن زوجالکترون را از مولکول آب بپذیرد، نیازی به پیوند دوگانه با هر دو اتم اکسیژن در ساختار خود ندارد. این را میتوانید در تصویر زیر مشاهده کنید.
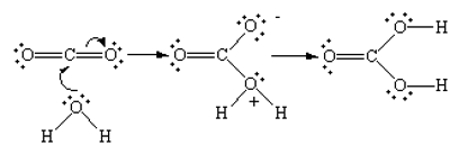
همانطور که مشاهده میکنید یکی از اتمهای اکسیژن در حد واسط تشکیل شده از افزایش مولکول آب به کربن دیاکسید، دارای بار مثبت است. بعد از اینکه یکی از به اکسیژن دیگر منتقل میشود، تمامی اتمهای اکسیژن موجود در ساختار از نظر بار الکتریکی خنثی خواهند شد. بنابراین فراورده این واکنش بهصورت کربونیک اسید با فرمول به دست میآید.
ترکیبات یون کمپلکس یا کوئوردیناسیونی
یونهای چند اتمی که آنها را با نام یونهای کمپلکس نیز میشناسیم، از یک فلز مرکزی تشکیل شدهاند که از اطراف به یونهای کوچک دیگر متصل است. واکنش پیش رو را نمیتوان به کمک تعریف برونستد توضیح داد اما تعریف لوییس این مشکل را حل میکند. باز لوییس معمولا لیگاند ترکیب کوئوردیناسیونی است و فلز مرکزی نیز نقش اسید لوییس را بازی میکند. به واکنش زیر توجه کنید.
یون آلومینیوم فلز و کاتیونی دارای لایه ظرفیت پرنشده است و به همین دلیل اسید لوییس شمرده میشود. آب نیز آنیونی با زوجالکترون غیرپیوندی است و باز لوییس خواهد بود. در این مورد به تصویر زیر دقت کنید.
آمفوتر چیست ؟
تا اینجا برای اسید و باز دو تعریف جداگانه بیان کردیم اما ترکیباتی وجود دارند که میتوانند هم اسید هم باز باشند. احتمالا پیش از این به آب با این ویژگی برخورد کرده باشید. آب در جایی به عنوان اسید و در جای دیگر به عنوان باز عمل میکند. به مولکولهایی که دارای این ویژگی باشند، آمفوتر گفته میشود.
آب نمونه بارزی از یک مولکول آمفوتر است. آب میتواند پروتون خود را به باز دیگری اهدا کند و تبدیل به اسید مزدوج خود یعنی شود. از طرفی همین مولکول میتواند با پذیرش پروتون به عنوان باز عمل کند و تبدیل به باز مزدوج خود بهصورت شود.
- آب به عنوان یک اسید وارد واکنش میشود.
- آب به عنوان یک باز وارد واکنش میشود.
از دو مثال بالا میتوان اینطور برداشت که نحوه رفتار یک مولکول بستگی زیادی به محیطی دارد که در آن قرار دارد. برای مثال آب در محیط اسیدی نمیتواند به عنوان یک اسید رفتار کند. به همین شکل در محیطی بازی نیز نمیتوانیم از آب انتظار رفتار بازی داشته باشیم. بنابراین میتوان اینطور نتیجهگیری کرد که نوع محیط روی رفتاری که یک مولکول از خود نشان میدهد، تاثیرگذار خواهد بود.
این نکته را با بررسی مثالی روشنتر خواهیم کرد. به دو واکنش زیر توجه کنید.
- در این واکنش به عنوان باز لوییس نقش بازی میکند.
- در این واکنش به عنوان اسید لوییس نقش بازی میکند.
انواع اسید لوییس چیست ؟
علاوه بر موارد گفته شده پیش از این، دستهبندی دیگری نیز وجود دارد که اسیدها و بازهای لوییس را بر مبنای سختی و نرمی آنها طبقهبندی میکند. در ادامه به بررسی مفهوم هر کدام از این دو تعریف خواهیم پرداخت و برای هر یک مثالهایی را مورد بررسی قرار میدهیم.
- اسید و باز سخت: به اتمهایی که کوچک و قطبشناپذیر باشند، گفته میشوند. کاتیون ، کاتیون فلزهای قلیایی و فلزهای قلیایی خاکی، بورانها و کاتیون روی از جمله اسیدهای سخت هستند. همچنین آمونیاک و آمینها، آب، کربوکسیلاتها، فلوئورید و کلرید مثالهایی از بازهای سخت هستند.
- اسید و باز نرم: به اتمهای بزرگتر که قطبشپذیری بیشتری دارند، اطلاق میشود. از اسیدهای نرم میتوان به ، ، و اشاره کرد. یدید، تیواترها و کربن مونوکسید نیز مثالهایی از بازهای نرم هستند.
موارد دیگری نیز وجود دارند، برای مثال بازهایی که زوجالکترون اهدایی خود را از اتم اکسیژن تامین میکنند از بازهایی که زوجالکترون خود را از اتم نیتروژن تامین میکنند، سختتر هستند. از این دستهبندیها میتوان برای پیشبینی در مورد فراورده افزایشی حاصل از واکنش بین اسید و باز لوییس بهره برد. همچنین میتوان به اطلاعات مفیدی در مورد خود واکنشها نیز دست یافت.
توجه داشته باشید که واکنش بین اسید سخت با باز سخت و اسید نرم با باز نرم قویتر از واکنش بین اسید سخت با باز نرم و اسید نرم با باز سخت است. همچنین مطالعاتی این نتیجه را به دست داده است که برهمکنش سخت-سخت از نظر آنتالپی نامطلوب است در حالی که برهمکنش نرم-نرم آنتروپی مطلوبتری دارد.
اندازه گیری اسیدیته لوییس
برای اندازهگیری اسیدیته لوییس روشهای متنوعی طراحی شده است که بسیاری از آنها بر مبنای روشهای طیفسنجی از جمله nmr و IR هستند. مدل ، مدلی کمی است که از آن برای توصیف و پیشبینی برهمکنش اسید و باز لوییس استفاده میشود. در این مدل به هر اسید دو پارامتر و و به هر باز دو پارامتر و نسبت داده میشود. این دو به ترتیب نشان دهنده سهم الکتروستاتیکی و کووالانسی هر کدام در پیوند تشکیل شده بین اسید و باز هستند. معادله این مدل را میتوان بهصورت زیر نمایش داد.
همچنین پارامتر نشان دهنده انرژی ثابتی است که در واکنش اسید و باز در فرایندهایی مانند شکستن اسید و باز دیمری دخیل است. این واکنش تغییر در آنتالپی را نشان میدهد و میتوان از آن برای فاز گازی و محلول استفاده کرد. برای روشن شدن این مفهوم به مثال زیر توجه کنید.
آنتالپی شکست توسط باز شامل دو مرحله است. در مرحله اول شکست دیمر اتفاق میافتد و مقدار را به دست میدهد. مقدار این پارامتر با واحد کیلوژول بر مول بیان میشود.
مرحله دوم شامل اتصال به مونومر است. به عبارتی میتوان اینطور بیان کرد که آنتالپی مورد نیاز برای شکست پیوندهای هیدروژن داخلی اسید است.
در مثال دوم آنتالپی تشکیل فراورده افزایشی حاصل از واکنش پیریدین با فرمول شیمیایی و را مورد بررسی قرار میدهیم. در این مورد پارامتر برابر با ۰ است زیرا نه اسید و نه باز به فرم دیمری وجود ندارند. پارامترهای مورد نیاز را میتوان در منابع مرتبط با مدل پیدا کرد. با جایگذاری آن در رابطه بهصورت زیر خواهیم داشت:
کاربرد اسید لوییس چیست ؟
از اسیدهای لوییس به دلیل ویژگیهایی که دارند در زمینههای مختلفی استفاده میشود. یکی از این موارد استفاده از آن در «واکنش آلکیلاسیون فریدل کرافتس» (Friedel-Crafts Alkylation Reaction) است. در مرحله کلیدی این واکنش با پذیرش یک یون کلرید تبدیل به میشود و طی آن یک یون کربانیون که اسیدی قوی و الکترن دوست است، به جا میماند. این واکنش را میتوانید در زیر مشاهده کنید.
تاریخچه اسید لوییس
گفتیم که در گذشته نظریه اسید و باز برونستد که با محدودیتهایی جدی روبرو است، سر کار بود. در سال ۱۹۲۳ شیمیدانی به نام «گیلبرت نیوتن لوویس» (Gilbert Newton Lewis) تعریف جدیدی از اسید و باز ارائه کرد. این تعریف اسید و بازهای بیشتری را در بر میگرفت و بر پایه ساختار و پیوندهای درون هر ماده بود. همین تعریف امروزه به شیمیدانها کمک میکند تا با طیف بیشتری از اسیدها و بازها کار کنند. همچنین توانایی پیشبینی در مورد امکانپذیری بسیاری از واکنشهای اسیدی و بازی را نیز به آنها میدهد. لوویس تعاریف پیشین از این دو ماده را کنار گذاشت و مبنای تعریف خود را بر پایه الکترونها به جای پروتونها قرار داد. او بیان کرد که اسید، گونه پذیرنده زوجالکترون و باز، دهنده زوجالکترون است.

تمرین و حل مثال اسید لوییس
حال که میدانیم اسید لوییس چیست و چگونه قابل تشخیص است، به سراغ تعدادی مثال و تمرین میرویم تا مفهوم آن را بیشتر و بهتر درک کنیم.
مثال اسید لوییس
در ابتدا تعدادی مثال را به همراه پاسخ تشریحی آنها مورد بررسی قرار میدهیم. در این بخش تلاش بر این است تا از اطلاعات داده شده در این مطلب برای رسیدن به پاسخ سوالات، کمک گرفته شود.
مثال اول
در هر مورد، مشخص کنید که مولکول دادهشده اسید لوییس است یا باز لوییس؟
مولکول ۱

در هر مورد میتوانیم تعداد الکترونهای لایه ظرفیت اتمهای هر مولکول را مورد بررسی قرار دهیم. در کربن مونوکسید، اتم مرکزی کربن است و به گروه ۴ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که کربن دارای ۴ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که کربن تنها سه پیوند برقرار کرده است. یعنی اتم کربن همچنان یک زوجالکترون ناپیوندی روی خود دارد و میتوان به عنوان الکتروندهنده نقش ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که کربن مونوکسید باز لوییس است.
مولکول ۲
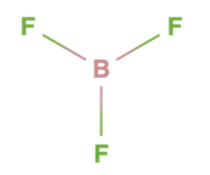
در بور تری فلوئورید، اتم مرکزی بور است و به گروه ۳ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که دارای ۳ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که بور سه پیوند برقرار کرده است. یعنی اتم بور الکترون آزاد دیگری ندارد تا به عنوان الکتروندهنده نقش ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که بور تری فلوئورید اسید لوییس است.
مولکول ۳
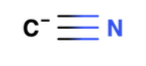
در مولکول سیانید، اتم مرکزی کربن است و به گروه ۴ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که کربن دارای ۴ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که کربن تنها یک پیوند سهگانه برقرار کرده است. یعنی اتم کربن همچنان یک زوجالکترون ناپیوندی روی خود دارد و میتوان به عنوان الکتروندهنده نقش ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که سیانید باز لوییس است.
مولکول ۴
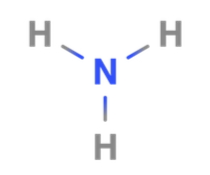
در مولکول آمونیاک، اتم مرکزی نیتروژن است و به گروه ۵ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که نیتروژن دارای ۵ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که این اتم تنها سه پیوند برقرار کرده است. یعنی نیتروژن همچنان یک زوجالکترون ناپیوندی روی خود دارد و میتوان به عنوان الکتروندهنده نقش ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که آمونیاک نیز باز لوییس است.
مولکول ۵
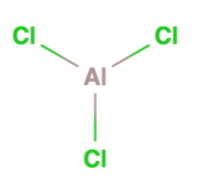
در این مولکول ، اتم مرکزی آلومینیوم است که به گروه ۳ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که این اتم دارای ۳ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که این اتم سه پیوند نیز برقرار کرده است و الکترونی باقی نمانده تا نقش الکتروندهنده را ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که آلومینیوم کلرید اسید لوییس است.
مولکول ۶
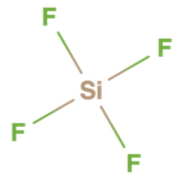
در این مولکول ، اتم مرکزی سیلیسیم است و به گروه ۴ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که این اتم دارای ۴ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که این اتم چهار پیوند نیز برقرار کرده است. بنابراین میتواند پذیرنده الکترون باشد و در نتیجه اسید لوییس شمرده میشود.
مولکول ۷
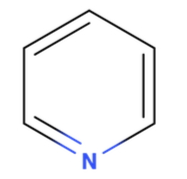
در مولکول حلقوی این مثال، اتم مرکزی نیتروژن است و به گروه ۵ جدول تناوبی عناصر تعلق دارد. بنابراین میتوان گفت که نیتروژن دارای ۵ الکترون در لایه ظرفیت خود است. با نگاه به مولکول متوجه میشویم که این اتم تنها سه پیوند برقرار کرده است. یعنی نیتروژن همچنان یک زوجالکترون ناپیوندی روی خود دارد و میتوان به عنوان الکتروندهنده نقش ایفا کند. بنابراین میتوان اینطور نتیجهگیری کرد که پیریدین باز لوییس است.
تمرین اسید لوییس
حال که تعدادی مثال را با پاسخ تشریحی بررسی کردیم، به سراغ تعدادی تمرین چندگزینهای خواهیم رفت.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
سوالات متداول در رابطه با اسید لوییس
حال که میدانیم اسید لوییس چیست و چه تفاوتی با باز لوییس دارد، میخواهیم به تعدادی از مهمترین و پرتکرارترین سوالهایی که پیرامون مفهوم اسید لوییس وجود دارد، پاسخ دهیم.
تفاوت باز و اسید لوییس چیست ؟
اسید لوییس گیرنده و باز لوییس دهنده الکترون است.
ویژگی اسید لوییس چیست ؟
به هر مادهای که بتواند به عنوان گیرنده الکترون عمل کند، اسید لوییس میگوییم.
یک فلز چطور اسید لوییس قویتری خواهد بود؟
هرچه فلزی روی خود بار مثبت بزرگ تری داشته باشد، اسید لوییس قوی تری نیز خواهد بود.
در بین اسیدهای بور تری هالیدی، کدام از همه قویتر است؟
بور تری برمید در بین خانواده بور تری هالیدها قوی ترین اسید است.
آیا اسیدهای لوییس خورنده هستند؟
اسیدهای لوییس می توانند خورنده باشند. از این مورد می توان به روی کلرید اشاره کرد.
آیا مولکول نیتروژن اسید لوییس است؟
خیر، نیتروژن غنی از الکترون است و تمایل به الکترون دهندگی دارد. از همین رو آن را باز لوییس میدانیم.
رابطه بین باز و اسید لوییس چیست ؟
هرچه اسید لوییسی ضعیفتر باشد، باز لوییس آن قویتر خواهد بود. به همین شکل هرچه اسید لوییسی قویتر باشد، اسید لوییس آن ضعیفتر خواهد بود.
جمعبندی
هدف از این مطلب این بود که بدانیم اسید لوییس چیست و چگونه قابل تشخیص است. در این تعریف، اسید لوییس گیرنده الکترون و باز لوییس دهنده آن است و از همین ویژگی میتوان برای ایجاد تمایز بین آنها استفاده کرد. در ادامه در مورد تعاریف دیگر از اسید و باز، از قبیل اسید و باز برونستد صحبت کردیم. در ادامه نیز با بررسی تعدادی مثال و تمرین درک خود از این مفهوم را عمق بخشیدیم.












