اسید و باز مزدوج چیست؟ – آموزش اسید و باز به زبان ساده
در بسیاری از مواقع اسیدها و بازها بهصورت زوج اسید-بازی وجود دارند که آنها را با نام «اسید و باز مزدوج» (Conjugate Acid-Base) میشناسیم. در طول تاریخ از تئوریهای متنوعی برای درک ساختار و رفتار این خانواده از مواد استفاده شده است. طبق تعریف لوری-برونستد، تفاوت اسید و باز مزدوج در یک یون هیدرونیوم است. در این مطلب میخواهیم به سراغ این مفاهیم برویم و در مورد انواع آن صحبت کنیم. همچنین با آوردن مثالها و تمرینهای متعددی توانایی تشخیص اسید و باز مزدوج را پیدا خواهیم کرد.
- یاد میگیرید اسید و باز مزدوج را طبق نظریه برونستد تعریف کنید.
- خواهید توانست تفاوت اسید و باز قوی و ضعیف را تشخیص دهید.
- یاد میگیرید قدرت اسیدی و بازی را با ثابتهای تفکیک هریک تحلیل کنید.
- میآموزید چگونه قدرت یک اسید به باز مزدوج آن وابسته است.
- با اثر تسطیح آب و یکسان شدن قدرت اسیدها آشنا میشوید.
- یاد میگیرید «pH» محلولهای بافر را با معادله هندرسون هاسلباخ محاسبه کنید.


اسید و باز مزدوج چیست ؟
اسید و باز مزدوج به آن دسته از ترکیبات گفته میشود که به شکل یک زوج حضور دارند. نام این ترکیبات از کلمهای لاتین به معنای «متصل به یکدیگر» گرفته شده است که به مفهوم «اسید و بازهای لوری-برونستد» (Bronsted-Lowry Theory Of Acid And Base) بسیار نزدیک هستند.
در ادامه به بررسی این مفهوم با در نظر گرفتن همین نظریه خواهیم پرداخت.
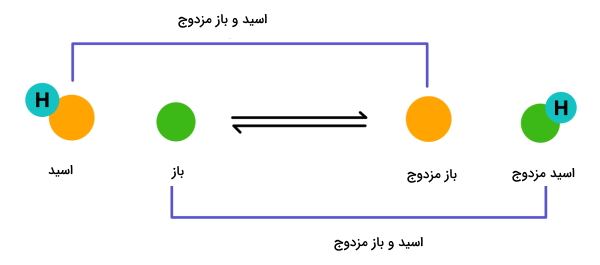
در این تعریف اسید را به عنوان گونهای در نظر میگیرند که بتواند یک پروتون به مولکول دیگری بدهد. همچنین باز گونهای است که به عنوان گیرنده پروتون عمل کند. در تصویر بالا این انتقال پروتون بین زوج اسید و باز را بهخوبی مشاهده میکنید.
اسید و باز مزدوج برونستد
هنگامی که اسید برنستد نقش خود را به عنوان دهنده کاتیون بازی میکند، یک باز مزدوج تولید میشود. یک اسید عمومی با فرمول شیمیایی را در نظر بگیرید. زمانی که این اسید یون خود را به آب میدهد، یکی از محصولات واکنش بهصورت یون خواهد بود که گیرنده یون هیدرنیوم است.
این یون را میتوان درواقع باز برونستد دانست. به واکنش زیر که به خوبی این مفهوم را نمایش میدهد، دقت کنید.
- : اسید
- : باز
همین نکته برای باز نیز صدق میکند، یعنی هر زمان که بازی به عنوان گیرنده هیدروژن وارد واکنش میشود، از خود اسید مزدوجی بر جا میگذارد. این واکنش را میتوان بهصورت زیر نمایش داد.
بنابراین میتوان اینطور نتیجهگیری کرد که اسید و باز برونستد بهصورت زوج وجود دارند و با انتقال یک پروتون به یکدیگر قابل تبدیل خواهند بود.
استفاده از برای اسید و برای باز نباید ما را دچار این برداشت اشتباه کند که تمامی اسیدها خنثی و تمامی بازها دارای بار منفی هستند. از این نمادها برای این استفاده میشود تا نشان دهیم که اسیدهای مزدوج دارای کاتیون و بازهای مزدوج فاقد آن هستند. در حالت کلی اسیدها و بازهای برونستد میتوانند مولکولهایی خنثی، با بار مثبت یا منفی باشند. در جدول زیر میتوانید تعدادی از مهمترین و پرکاربردترین اسیدها و بازهای مزدوج برونستد را مشاهده کنید.
| اسید | باز |
همانطور که در جدول بالا نیز مشاهده کردید، برخی از ترکیبات را میتوان هم در ستون اسید و هم در ستون باز گنجاند. از این دسته از ترکیبات میتوان به موارد زیر اشاره کرد.
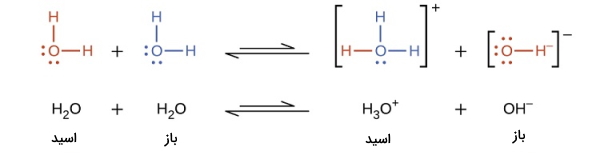
میخواهیم به علت این مورد پی ببریم. آب نمونه بسیار خوبی از ترکیبات این دسته است زیرا میتواند همزمان به عنوان باز و اسید برونستد عمل کند و یونهای و را به وجود بیاورد. این حالت را میتوان توسط تعادلی نمایش داد که در آن دو جفت اسید و باز مزدوج وجود دارد. اسید و باز مزدوج آن است. همچنین باز مزدوج اسید نیز است. این را در تصویر زیر نیز میتوانید بهخوبی مشاهده کنید.
اسیدها و بازهای قوی و ضعیف
در ابتدای این بخش برای درک مفهوم اسید و باز قوی و ضعیف از مثال بسیار ساده و روزمرهای استفاده میکنیم. از مواد با ویژگی اسیدی دو ماده بسیار متفاوت میتوان به دست آورد. یکی «موریاتیک اسید» (Muriatic Acid) نامیده میشود و محلول ۶ مولار هیدروکلریک اسید با فرمول شیمیایی است.
دیگری را با نام سرکه میشناسیم و محلول ۱ مولار استیک اسید است.

گرچه هر دوی اینها اسید هستند اما نمیتوان آنها را به جای یکدیگر به کار گرفت. مورتاتیک اسید بسیار قوی و خورنده است و از آن برای تمیزی سطوح بتنی از آن استفاده میشود و سرکه مادهای است که در آشپزی مورد استفاده قرار میگیرد.
تفاوت این دو اسید این است که موریاتیک اسید، اسیدی قوی و سرکه اسیدی ضعیف است. توانایی موریاتیک اسید در انتقال یون به آب بسیار بیشتر از سرکه است. بهصورتی که در محلول ۶ مولار هیدروکلریک اسید، ۹۹٫۹۹۶٪ از مولکولهای آن با آب وارد واکنش میشوند و دو یون و را ایجاد میکنند. این واکنش را میتوان به شکل زیر نشان داد.
به همین صورت میتوان دریافت که سرکه اسید ضعیفی است زیرا در انتقال یون به آب عملکرد خیلی خوبی ندارد. در یک محلول ۱ مولار آن چیزی کمتر از ۰٫۴٪ از مولکولهای آن با آب وارد واکنش میشوند و دو یون و را به وجود میآورند. این واکنش تعادلی را میتوان بهصورت زیر نشان داد.
درواقع میتوان اینطور بیان کرد که طی این واکنش ۹۹٫۶٪ از مولکولها استیک اسید بهصورت دستنخورده در محلول باقی میمانند.
ثابت تفکیک اسیدی
قوی و ضعیف بودن یک اسید را معمولا با «ثابت تفکیک تعادل اسیدی» (Acid Dissociation Equilibrium Constant) میسنجند و با نماد نشان میدهند. برای درک بهتر این مفهوم واکنش کلی اسید و آب را با معادله زیر نشان میدهیم و این مفهوم را روی آن مورد بررسی قرار خواهیم داد.
به عبارت دیگر برخی از مولکولهای وارد واکنش میشوند و یون های و را به وجود میآورند. برای درک بهتر این مطلب به تصویر زیر و مولکولهای نشان داده شده در آن دقت کنید.
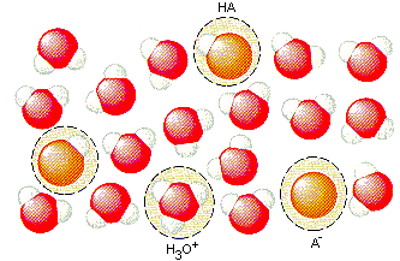
طبق قرارداد غلظت این یونها در واحد مول بر لیتر را با نمادهای و نمایش میدهند. به این دو نماد برای راحتتر نوشتن معادلات پیش رو نیاز خواهیم داشت. همچنین غلظت مولکولهای باقیمانده در محلول را نیز با نماد نشان میدهند. در این صورت برای به دست آوردن مقدار این اسید میتوان از رابطه زیر بهره برد.
مقدار ثابت تفکیک اسیدی برای اسید قوی
هنگامی که یک اسید قوی در آب حل میشود، به مقدار بسیار زیادی با آب واکنش میدهد و یونهای و را ایجاد میکند. در این واکنش تنها مقادیری جزئی از اسید بهصورت دستنخورده در محلول باقی خواهد ماند. بنابراین حاصلضرب غلظت در از غلظت مولکولهای باقیمانده بسیار بزرگتر خواهد بود و مقدار ثابت تفکیک برای این اسید از ۱ عدد بزرگتری به دست می آید. برای مثال ثابت تفکیک اسیدی هیدروکلریک اسید به شکل زیر خواهد بود.
مقدار ثابت تفکیک اسیدی برای اسید ضعیف
از طرف دیگر اسیدهای ضعیف تنها اندکی با آب واکنش میدهند. بنابراین برای آنها حاصلضرب غلظت در از غلظت مولکولهای باقیمانده کوچکتر خواهد بود و در نتیجه مقدار ثابت تعادل تفکیک اسید کوچکتر از ۱ دارند. این مورد یکی از عوامل موثر بر قدرت اسید و باز است. برای مثال میتوان ثابت تعادل تفکیک اسیدی استیک اسید را بهصورت زیر به دست آورد.
بنابراین میتوان برای مقدار ثابت تفکیک اسیدی اسیدهای قوی و ضعیف به یک جمعبندی رسید و اینطور بیان کرد که ثابت تفکیک اسیدی برای اسیدهای قوی مقداری بیش از ۱ و برای اسیدهای ضعیف مقداری کوچکتر از ۱ خواهد بود.
ثابت تفکیک بازی
پیشتر در مورد ثابت تفکیک اسیدی که با نشان داده میشود، صحبت کردیم. کمیت مشابهی میتوان برای بازها در شیمی در نظر گرفت که آن را ثابت تفکیک بازی مینامیم و با نمایش میدهیم. همانطور که ثابت تفکیک اسیدی نشاندهنده میزان تفکیک یک اسید است، از مقدار ثابت تفکیک بازی میتوان به میزان تفکیک آن و تشکیل یون توسط آن و در نتیجه قوی یا ضعیف بودن باز پی برد.
برای درک بهتر این مفهوم آن را با بررسی واکنشی عمومی برای بازها مورد بررسی قرار میدهیم. این واکنش را میتوان به صورت زیر نشان داد که در آن باز و اسید مزدوج آن است.
در این مورد میتوان رابطه زیر را برای ثابت تفکیک بازی نوشت. پارامترهای آن در زیر مشخص شده است.
- : غلظت اسید
- : غلظت باز
مقدار نشان دهنده این است که باز چقدر تمایل به پذیرش پروتون دارد تا دو یون و صورت کسر بالا افزایش پیدا خواهد کرد. در نتیجه این امر غلظت مولکولهای باز و مخرج این کسر کاهش پیدا میکند. بنابراین مقدار ثابت تفکیک بازی نیز افزایش خواهد داشت.
هرچه بازی قویتر باشد غلظت دو یون تولید شده توسط آن، یون هیدروکسید و اسید مزدوج خود، افزایش خواهد داشت. این باعث میشود که واکنش تعادلی بالا بیشتر به سمت راست پیش روی داشته باشد. در واقع عکس آن واکنش را میتوان به صورت زیر نوشت که احتمال وقوع کمتری خواهد داشت.
این یعنی تمایل باز برای یونیزه شدن مانع از این میشود تا مولکولهای پروتون خود را از دست بدهند. بنابراین دهنده پروتون خوبی نیست و اسید مزدوج ضعیفی خواهد بود.
حال میخواهیم حالتی را در نظر بگیریم که باز ضعیف و اسید مزدوج آن قوی باشد. در این حالت واکنش تعادلی بیشتر به سمت چپ پیش روی دارد و این یعنی اسید مزدوج تمایل زیادی دارد تا پروتون خود را از دست بدهد و تبدیل به باز شود. در این صورت اسید مزدوج قوی خواهد بود.
بنابراین هرچه مقدار ثابت تفکیک بازی کوچکتر باشد، درجه یونیزاسیون باز نیز کمتر خواهد بود و به این معناست که مولکولهای باز تمایل دارند که به صورت غیر یونیزه در محلول آبی باقی بمانند و با به دست آوردن پروتون تبدیل به نشوند.
رابطه اسید و باز مزدوج
خوشبختانه میتوان با در دست داشتن اطلاعاتی در مورد قوی یا ضعیف بودن یک اسید در مورد باز مزدوج آن نیز پیشبینی کرد. برعکس آن نیز صادق است، یعنی میتوان از روی اطلاعات یک باز به نتایجی در مورد اسید مزدوج آن رسید. در ادامه به بررسی بیشتر رابطه حاکم بین زوج اسیدها و بازها خواهیم پرداخت.
اسیدهای قوی و بازهای مزدوج ضعیف
اسیدهایی که در دسته قوی گنجانده میشوند، بازهای مزدوجی دارند که ضعیف هستند. برای درک بهتر این مفهوم در ادامه مثالی را بررسی میکنیم. پیش از این از روی مقدار ثابت تفکیک اسیدی متوجه شدیم که هیدروکلریک اسید بازی قوی است. در این صورت باید پروتوندهنده خوبی نیز باشد. با توجه به تعادل موجود، یون تنها در حالتی میتواند دهنده پروتون خوبی باشد که پروتون گیرنده خوبی نباشد. بنابراین میتوان اینطور برداشت کرد که باز ضعیفی است. به معادله تعادلی زیر در این راستا توجه کنید.
اسیدهای ضعیف و بازهای مزدوج قوی
عکس رابطه ذکر شده در بالا نیز صادق است. این بخش را با در نظر گرفتن اسید آمونیوم با فرمول شیمیایی و باز مزدوج آن، آمونیاک با فرمول شیمیایی ادامه میدهیم. یون آمونیوم اسید ضعیفی است زیرا آمونیاک بازی قوی است. در زیر میتوانید تعادل بین این دو را مشاهده کنید.
مثال اسید و باز قوی و ضعیف
از روی مقدار ثابت تعادل تفکیک میتوان در مورد قوی و ضعیف بودن یک اسید نتیجهگیری کرد. همچنین میتوان مقادیر آن را برای دو اسید در مقام مقایسه مورد بررسی قرار داد. در ادامه مثالی از این مورد را مشاهده میکنید. هیدروکلریک اسید و یون را در نظر بگیرید. مقدار ثابت تعادلی اسیدی برای آنها بهصورت زیر است.
از آنجا که هر دو ثابت تعادل تفکیک اسیدی عددهایی بزرگتر از ۱ هستند، میدانیم که هر دو اسید قوی به شمار میآیند. اما هیدروکلریک اسید از اسید قویتری است. مقدار بسیار زیادی از مولکولهای در محلول آبی تفکیک میشوند و دو یون و را ایجاد میکنند. طبق نکاتی که پیشتر گفتیم در هر واکنش اسید و باز، هر اسید، باز مزدوج خود و هر باز، اسید مزدوج خود را به وجود می آورد. برای درک بهتر به تصویر زیر که بهخوبی بیانگر این نکته است، دقت کنید.
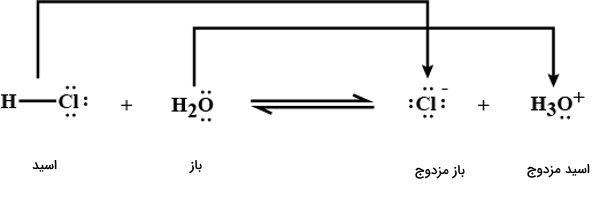
در این واکنش دو اسید و دو باز وجود دارد و اسید قویتر در سمت راست واکنش مشاهده میشود. یعنی از قویتر است. بنابراین توقع داریم که باز مزدج اسید ضعیفتر از باز مزدوج اسید قویتر، قویتر باشد. یعنی باز از آب قویتر است. بنابراین میتوان رابطه اسیدها و بازهای این واکنش را بهصورت زیر نوشت.
- قدرت اسیدی:
- قدرت بازی:
بنابراین جای تعجب نیست که ۹۹٫۹۹۶٪ از مولکولهای در محلول ۶ مولار با آب وارد واکنش میشوند و یونهای و را به وجود میآورند.
در مثال بعد میخواهیم به مقدار ثابت تعادل تفکیک استیک اسید و یون نگاهی بیندازیم. این مقادیر بهصورت زیر هستند.
از مقادیر ثابت تعادل تفکیک آنها متوجه میشویم که استیک اسید از یون اسید بسیار ضعیفتری است و این میتواند ضعیف بودن استیک اسید در آب را توجیه کند. مانند مثال پیشین، واکنش آنها را به شکلی مینویسیم که اسید، تبدیل به باز مزدوج خود و باز نیز تبدیل به اسید مزدوج خود شود. این تعادل را میتوانیم بهصورت زیر نشان دهیم.
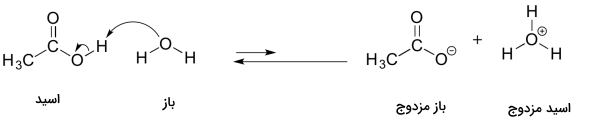
این مثال با مثال پیش تفاوتی دارد، بهصورتی که اسید و باز قوی هر دو در سمت راست واکنش قرار گرفتهاند. بنابراین تنها تعداد محدودی از مولکولهای استیک اسید، خود را به آب میدهند و دو یون و را ایجاد میکنند.
بزرگی ثابت تعادل تفکیک میتواند توضیحی برای این مسئله باشد که چرا اسید و بازهایی که در آب حل میشوند، رفتاری مانند اسیدها و بازها از خود نشان نمیدهند. هنگامی که مقدار ثابت تعادل تفکیک برای اسیدی بزرگ باشد، با آب وارد واکنش میشود تا تمامی مولکولهای اسید مصرف شوند. برای مثال سولفوریک اسید دارای ثابت تفکیکی بهصورت زیر است.
این اسید با آب وارد واکنش میشود تا ۹۹٫۹٪ از مولکولها آن در محلول ۱ مولار، تمامی پروتونهای خود را به آب بدهد و یون را تولید کند. این واکنش را میتوان بهصورت زیر نمایش داد.
با کوچک شدن مقدار ، اسید به مقدار کمتری با آب وارد واکنش میشود. تا زمانی که مقدار برای یک اسید به میزان قابلتوجهی از آب بزرگتر باشد، اسید در آب یونیزه میشود. برای فهم بهتر به مثال زیر توجه کنید.
استیک اسید که اسیدی ضعیف است مقادیری با آب واکنش میدهد و یونهای و استات با فرمول شیمیایی را ایجاد میکند. این واکنش را در زیر آوردهایم.
هرچه مقدار برای اسیدی به مقدار آب نزدیکتر باشد، در ویژگیهای اسیدی خود به آب شباهت بیشتری خواهد داشت. گرچه این اسید را میتواند همچنان اسید برونستد به شمار آورد اما آنچنان ضعیف است که نمیتوان اسیدیته آن را در محلولهای آبی تشخیص داد. برخی ترکیبات وجود دارند که پتانسیل حضور به عنوان یک اسید را دارند اما به حدی ضعیف هستند که مقدار آنها از آب نیز کوچکتر است. از این مورد میتوان به آمونیاک اشاره کرد. مقدار این ماده را در زیر مشاهده میکنید.
آمونیاک پتانسیل این را دارد که دهنده هیدروژن باشد و بنابراین میتواند به عنوان اسید برونستد در نظر گرفته شود اما در عمل از این ماده هیچ اسیدیتهای در انحلال با آب مشاهده نشده است.
مثال اسید و باز مزدوج
در این مثال دو دسته ترکیب داده شده است. گروه یک شامل تعدادی اسید برونستد و گروه دو شامل تعدادی باز برونستد است. با کمک تعادل شیمیایی، حالتهایی را نشان دهید که اسیدهای گروه یک با آب وارد واکنش شوند و باز مزدوج خود را تولید کنند. همچنین در مورد بازهای گروه دو، واکنش آنها را با استیک اسید به عنوان اسید بنویسید.
- گروه یک: ، ،
- گروه دو: ، ،
پاسخ گروه یک: در هر مورد واکنش اسید داده شده را بهصورتی مینویسیم که با آب وارد واکنش شود و در سمت دوم واکنش، باز مزدوج خود را به وجود بیاورد.
واکنش آب و
برای درک بهتر در هر مورد باز و اسید مزدوج آن را در دو طرف واکنش مشخص میکنیم.
- اسید و باز مزدوج
- باز آب و اسید مزدوج
واکنش آب و
- اسید و باز مزدوج
- باز آب و اسید مزدوج
واکنش آب و
- اسید و باز مزدوج
- باز آب و اسید مزدوج
پاسخ گروه دو: در هر مورد واکنش باز داده شده را بهصورتی مینویسیم که با استیک اسید وارد واکنش شود و در سمت دوم واکنش، اسید مزدوج خود را به وجود بیاورد.
واکنش استیک اسید و
- باز و اسید مزدوج آب
- اسید و باز مزدوج
واکنش استیک اسید و
- باز و اسید مزدوج
- اسید و باز مزدوج
واکنش استیک اسید و
- باز و اسید مزدوج
- اسید و باز مزدوج
مثال دوم
یون فرمات یک باز برونستد است. این را به کمک ساختار لوویس آن نشان دهید.
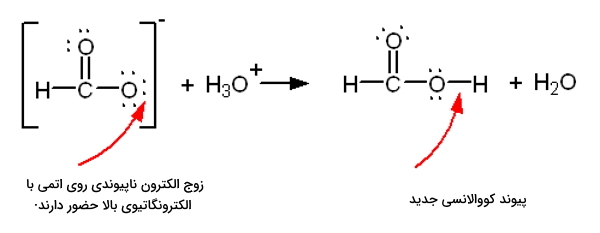
در تصویر بالا نحوه انتقال هیدروژن و تشکیل پیوند کووالانسی جدید بهخوبی نشان داده شده است. یون فرمات به عنوان باز برونستد، پذیرنده هیدروژنه خواهد بود.
اثر تسطیح آب
اینطور به نظر میرسد که تمامی اسیدها و بازها در هنگام انحلال در آب، فارغ از مقدار که دارند، قدرت یکسانی از خود نشان میدهند. این اصل را به نام «اثر تسطیح آب» (The Leveling Effect Of Water) میشناسیم و در واقع به تمایل آب برای محدود کردن قدرت اسیدی و بازی گفته میشود.
این مفهوم را میتوان با توجه به تولید یون توسط اسیدهای قوی در واکنش با آب توضیح داد. بیش از ۹۹٪ مولکولهای هیدروکلریک اسید با آب وارد واکنش میشوند و دو یون و را مانند زیر به وجود میآورند.
همچنین بیش از ۹۹٪ مولکولهای در یک محلول 1 مولار نیز با آب وارد واکنش میشوند و یونهای و را به وجود میآورند. این واکنش در زیر نشان داده شده است.
بنابراین قدرت اسید قوی توسط قدرت اسید تولید شده محدود میشود. همانطور که میدانید این یون از همراهی یون با مولکولهای آب به وجود میآید. همین پدیده برای بازهای قوی نیز اتفاق میافتد. بازهای قوی با آب وارد واکنش میشوند و یونهای را تولید میکنند. بعد از آن، محلول نمیتواند حد بیشتری از بازی بودن را به وجود بیاورد و قدرت بازهای قوی توسط یون بازی محدود میشود. این یون با از دست دادن یون از مولکولهای آب به وجود میآید.
معادله هندرسون هاسلباخ
از «معادله هندرسون هاسلباخ» (Henderson Hasselbalch Equation) برای اندازهگیری مقدار pH یک محلول بافر استفاده میشود. ابتدا تعریف کوتاهی از بافر ارائه میدهیم. محلول «بافر» (Buffer) محلولی است که توانایی حفظ محیط را دارد و در دو حالت میتواند وجود داشته باشد. یکی از این حالات حضور اسید ضعیف به همراه باز مزدوج خود است. در حالت دوم در محیط یک باز ضعیف به همراه اسید مزدوج خود وجود دارد.
برای درک بهتر مثالی را مورد بررسی قرار میدهیم. اگر در محیطی استیک اسید با فرمول شیمیایی که اسیدی ضعیف است به همراه نمکی از آنیون استات وجود داشته باشد، محلول بافری خواهد بود. این نمک استاتی میتواند به شکل باشد.
بررسی این معادله در این مطلب از آنجا اهمیت دارد که میتوان با بهرهگیری از آن به مقدار ثابت تفکیک اسیدی و بازی، مقدار اسید و باز و غلظت آنها پی برد. این معادله را میتوان به صورت زیر نمایش داد. در این رابطه صورت کسر نشاندهنده غلظت باز مزدوج و مخرج کسر نشاندهنده غلظت اسید ضعیف است.
در ادامه میخواهیم برای درک بهتر به این نکته بپردازیم که این رابطه چگونه به دست آمده است. اساس این رابطه بر تعریف تفکیک یک اسید، استوار است. این واکنش را در زیر مشاهده میکنید که در آن اسید و باز مزدوج آن است.
پیشتر گفتیم که رابطه ثابت تعادل تفکیک را برای چنین واکنشی میتوانیم به صورت زیر بنویسیم.
با مرتبط کردن این رابطه آن را بر مبنای غلظت یون هیدرونیوم مینویسیم.
در مرحله بعد برای تبدیل غلظت یون هیدرونیوم به از دو طرف رابطه لگاریتم میگیریم و نتیجه به شکل زیر خواهد بود.
سپس باید دو طرف رابطه را در ۱- ضرب کنیم تا و به دست بیاید. این کار را مانند زیر در دو مرحله انجام میدهیم.
با جابهجا کردن عبارات این معادله، میتوان آن را بر اساس مقدار به صورت زیر مرتب کرد.
به معادله به دست آمده در بالا، معادله هندرسون هاسلباخ گفته میشود. با کمی توجه به آن متوجه میشویم که در صورتی که غلظت اسید و باز مزدوج با یکدیگر برابر باشد، یعنی درصد تفکیک اسید ۵۰ باشد، مقدار محیط برابر با مقدار ثابت تفکیک اسیدی آن خواهد بود. این گفته را میتوان به صورت زیر نمایش داد.
در این صورت با جایگذاری مقدار عددی ۱ در رابطه هندرسون هاسلباخ داریم:
و از آنجا که مقدار عددی لگاریتم ۱ برابر با ۰ است، میتوان معادله را به صورت زیر ساده کرد.
از این رابطه برای اندازهگیری مقدار به صورت تجربی استفاده میشود.
محدودیت معادله هندروسن هاسلباخ
این معادله کاربرد فراوانی دارد و به کمک آن میتوان به اطلاعات سودمندی دست یافت، با این حال در برخی موارد با محدودیتهایی نیز روبرو است که بهتر است در هنگام کار با آن، به این محدودیتها آگاهی داشته باشیم. در زیر تعدادی از این موارد را مشاهده میکنید.
- هنگامی که از رابطه هندرسون هاسلباخ برای تهیه محلول بافری استفاده میکنیم، غلظت اسید و باز مزدوج باید به یکدیگر نزدیک باشند. این کار باعث میشود که پایداری محلول بیشتر شود زیرا با افزایش تفاوت غلظت بین این دو، توانایی بافری کاهش پیدا میکند و این باعث تغییر در مقدار خواهد شد.
- این معادله تفکیک خودبهخودی آب را در لحاظ نمیکند. در غلظتهای پایین مقدار تفکیک آب میتواند روی اثرگذار باشد.
- اگر اسیدی بتواند بیش از یک یون هیدرونیوم را از خود جدا کند، رابطه کارکرد درستی نخواهد داشت زیرا این مسئله در آن نادیده گرفته شده است.
- در عمل بهتر است که برای داشتن مقدار مشخصی، مقدار به آن نزدیک باشد تا عملکرد بافر تقویت شود.
مثال معادله هندروسن هاسلباخ
در این بخش با بررسی تعدادی مثال، نحوه استفاده از معادله هندرسون هاسلباخ را برای به دست آوردن اطلاعات مورد نیاز، بررسی خواهیم کرد.
مثال اول
مقدار بافری که از به صورت ۰٫۲ مولار و به صورت ۰٫۵ مولار تشکیل شده است را به کمک رابطه هندرسون هاسلباخ محاسبه کنید. مقدار ثابت تفکیک اسیدی در زیر آورده شده است.
پاسخ
این سوال بسیار ساده است و در واقع تنها نیاز به جایگذاری مقادیر داده شده در رابطه هندرسون هاسلباخ دارد. برای این کار به روش زیر عمل میکنیم.
ابتدا اسید و باز داده شده را در رابطه میگذاریم که نتیجه به شکل زیر خواهد بود.
همانطور که مشاهده میکنید تمام مقادیر مورد نیاز در صورت مثال داده شده است. پس به شکل زیر ادامه میدهیم.
ابتدا جواب کسر را به دست میآوریم.
و در نهایت خواهیم داشت:
مقدار بافری با اسید و باز داده شده، برابر با ۵٫۱ خواهد بود.
مثال دوم
در این مثال میخواهیم مقدار را برای بافری حاوی هیدروفلوریک اسید ۳ مولار و فلورید ۲٫۵ مولار محاسبه کنیم. مقدار آن در زیر آورده شده است.
پاسخ
مراحل این مثال مانند قبل است، با این تفاوت که ابتدا باید مقدار را از رابطه زیر محاسبه کنیم.
در ادامه مقادیر را به ترتیب زیر در رابطه هندرسون هاسلباخ جایگذاری میکنیم.
ابتدا اسید و باز داده شده را در رابطه میگذاریم که نتیجه به شکل زیر خواهد بود.
همانطور که مشاهده میکنید تمام مقادیر مورد نیاز در صورت مثال داده شده است. پس به شکل زیر ادامه میدهیم.
و در نهایت خواهیم داشت:
مقدار بافری با اسید و باز داده شده، برابر با ۳٫۰۹ خواهد بود.
مثال سوم
مقدار برای داروی ایبوپروفن برابر با ۴٫۹۱ است. در صورتی که مقدار خون برابر با ۷٫۴ باشد، نسبت غلظت به چقدر خواهد بود؟
پاسخ
با جایگذاری مقادیر داده شده در رابطه هندسون هاسلباخ به پاسخ مورد نظر میرسیم. بنابران بهصورت زیر خواهیم داشت:
نسبت باز مزدوج به اسید به این صورت به دست خواهد بود.
مزایای مفهوم اسید و باز برونستد
مفهوم اسید و باز به دلیل ماهیتی که دارد نسبت به مفهوم آرنیوس مزایای زیادی دارد. در این بخش میخواهیم به تعدادی از این مزایا بپردازیم.
- طبق تعریف برونستد، تعداد ترکیبهایی که پتانسیل اسیدی بودن دارند، افزایش پیدا میکند و این شامل یونهای مثبت، منفی و ترکیبهای خنثی میشود.
- همچنین تعداد ترکیبهایی که پتانسیل بازی دارند نیز افزایش مییابد. این ترکیبها شامل یک زوج الکترون ناپیوندی در لایه ظرفیت خود هستند.
- مفهوم آرنیوس نقش آب در واکنشهای اسیدی و بازی را بهخوبی تشریح میکند. در این واکنشها آب پذیرنده یون از اسیدها است و از این طریق یون را به وجود میآورد.
- با بسط و گسترش این مفهوم میتوان واکنشهایی که حلالهای غیر از آب دارند را نیز توضیح داد. همچنین برای واکنشهایی که در فاز گازی و جامد صورت میگیرند نیز کاربرد دارد.
- مفهوم اسید و باز برونستد این دو خانواده از ترکیبها را بهصورت زوج اسید و باز به یکدیگر مرتبط میکند.
- از این مفهوم برای تشریح رابطه بین اسیدهای قوی و بازهای مزدوج آنها استفاده میشود. همچنین این مورد برای بازهای قوی و اسیدهای مزدوج آنها نیز صدق میکند.
- در این تعریف میتوان به تفاوت بین قدرت دو اسید یا دو باز پی برد و آنها را با یکدیگر مقایسه کرد.
- در این مفهوم میتوان اثر تسطیح آب را مورد بررسی قرار داد و پی برد که اسیدها و بازهای قوی همگی در انحلال در آب قدرت یکسانی خواهند داشت.
توجه داشته باشید که در علم شیمی به دلیل همین مزایا در مواقع بسیاری وقتی صحبت از اسید و باز باشد، منظور مفهوم اسید و باز طبق تعریف برونستد است.
مقدار اسید و باز
از مقدار کمیت برای اندازهگیری میزان حضور یون اسیدی در محلولها استفاده میشود. همانطور که پیشتر اشاره کردیم آب خالص هم اسید و هم بازی ضعیف است و میزان بسیار کمی از از یونهای و که به وجود آورنده اسید و باز قوی هستند را در محلول آبی ایجاد میکند.
این واکنش تفکیک را میتوان به صورت زیر نمایش داد. توجه داشته باشید که آب هم اسیدی و هم بازی است بهصورتی که یون اسیدی و یون بازی است.
غلظت دو یون و در آب را میتوان با اندازهگیری دقیق توانایی آب در انتقال جریان الکتریکی به دست آورد. در دمای ۲۵ درجه سانتیگراد، غلظت این یونها در آب خالص برابر با مقدار زیر است. این مقدار در واحد مولار ( مول بر لیتر) با نماد آورده شده است.
با افزودن اسید قوی به آب، غلظت یون افزایش پیدا میکند. در واقع واکنش زیر به سمت راست، پیش روی خواهد کرد.
همچنین در همین حین غلظت یون کاهش پیدا میکند زیرا یونهای تولیدشده در این واکنش بخشی از یونهای موجود در آب را خنثی میکنند. این واکنش خنثیشدن را میتوان بهصورت زیر نشان داد.
محصول غلظتهای مختلف یونهای و فارغ از مقادیر آنها یکسان خواهد بود. در دمای ۲۵ درجه سانتیگراد غلظت محصول را میتوان بهصورت زیر نمایش داد.
بازه غلظت یونهای و آنچنان زیاد است که در عمل کار کردن با آنها بسیار مشکل خواهد بود.
در سال ۱۹۰۹ یک زیست شیمیدان هلندی استفاده از لگاریتم را برای تسهیل این امر پیشنهاد داد و نام آن را گذاشت. از آنجا که غلظت یون در آب در بیشتر موارد از ۱ کمتر است، لوگاریتم آن عددی منفی خواهد بود. بنابراین برای جلوگیری از داشتن اعداد منفی، از منفی لگاریتم به جای لگاریتم استفاده شد. بنابراین میتوان رابطه زیر را بین میزان و غلظت یونهای برقرار کرد.
به این وسیله میتوانیم با روش سادهتر و اعداد کوچکتری به میزان حضور یونهای در محلولها پی ببریم. در این مقیاس اعدادی بین ۰ تا ۱۴ را اتخاد میکند. در این مورد مثالی را مورد بررسی قرار خواهیم داد.
میخواهیم به کمک این رابطه و با در دست داشتن مقدار غلظت یون ، مقدار آب را به دست بیاوریم. برای این کار میتوانیم به روش زیر عمل کنیم. این محاسبات برای دمای ۲۵ درجه سانتیگراد انجام شده است.
با جایگذاری این مقدار در رابطه زیر خواهیم داشت:
بازههای متفاوت نشاندهنده میزان حضور یون در محلول است و این باعث به وجود آمدن ویژگیهای متفاوتی میشود. در این مورد میتوان به دو نکته زیر توجه کرد.
- مقدار بیشتر از ۷: به این معناست که محلول خاصیت بازی دارد.
- مقدار کمتر از ۷: به این معناست که محلول خاصیت اسیدی دارد.
مقدار اسیدهای و بازهای متداول
مقدار یک محلول به قدرت اسید و باز موجود در آن بستگی دارد. از همین روی اندازهگیری محلولهای رقیق بهخوبی قدرت اسید و باز آن را نشان میدهد. در جدول زیر مقدار را برای تعدادی از اسیدها و بازهای پرتکرار در محلول 1 مولار آنها مشاهده میکنید.
| نام اسید یا باز | فرمول شیمیایی | مقدار |
| هیدروکلریک اسید | ۱٫۱ | |
| سولفوریک اسید | ۱٫۲ | |
| سدیم هیدروژن سولفات | ۱٫۴ | |
| سولفورو اسید | ۱٫۵ | |
| فسفریک اسید | ۱٫۵ | |
| هیدروفلوریک اسید | ۲٫۱ | |
| استیک اسید | ۲٫۹ | |
| کربونیک اسید | ۳٫۸ | |
| هیدروژن سولفید | ۴٫۱ | |
| سدیم دی هیدروژن فسفات | ۴٫۴ | |
| آمونیوم کلرید | ۴٫۶ | |
| هیدروسیانید اسید | ۵٫۱ | |
| سدیم سولفات | ۶٫۱ | |
| سدیم کلرید | ۶٫۴ | |
| سدیم استات | ۸٫۴ | |
| سدیم بیکربنات | ۸٫۴ | |
| سدیم هیدروژن فسفات | ۹٫۳ | |
| سدیم سولفیت | ۹٫۸ | |
| سدیم سیانید | ۱۱ | |
| آمونیاک | ۱۱٫۱ | |
| سدیم کربنات | ۱۱٫۶ | |
| سدیم فسفات | ۱۲ | |
| سدیم هیدروکسید | ۱۳ |
مثال و حل تمرین از اسید و باز مزدوج
حال که با مفهوم اسید و باز مزدوج و نحوه تشخیص آنها آشنا شدیم، ابتدا با بررسی تعدادی مثال با پاسخ تشریحی آموختههای خود را مرور میکنیم و سپس تعدادی تمرین چندگزینهای را مورد بررسی قرار میدهیم.
مثال از اسید و باز مزدوج
در این بخش برای درک بهتر و بیشتر مفهوم اسید و باز مزدوج تعدادی مثال را به همراه پاسخ تشریحی مورد بررسی قرار میدهیم.
مثال اول
با توجه به مقدار ثابت تعادل اسیدی دو اسید دادهشده در مورد قوی یا ضعیف بودن بازهای مزدوج آنها اظهار نظر کنید.
پاسخ: میدانیم که ثابت تعادل تفکیک اسیدهای قوی بزرگتر از ۱ و ثابت تعادل تفکیک اسیدهای ضعیف کوچکتر از ۱ است. بنابراین هر دو اسید داده شده در این سوال از نوع ضعیف هستند. همچنین اشاره کردیم که باز مزدوج اسیدهای ضعیف، خود قوی هستند. در نتیجه بازهای و قوی هستند.
مثال دوم
اسید مزدوج باز به چه صورت خواهد بود؟
پاسخ
طبق تعریف اسید مزدوج ترکیبی است که از دریافت پروتون توسط باز به وجود میآید. بنابراین برای یافتن اسید مزدوج یک باز باید آن را در واکنشی با یون وارد کنیم. در این مورد باز داده شده هیدروژن کربنات با فرمول شیمیایی است و میتوان این واکنش را برای آن به صورت زیر نوشت.
بنابراین اسید مزدوج هیدروژن کربنات، کربونیک اسید با فرمول شیمیایی است.
مثال سوم
باز مزدوج اسید چه ترکیبی است؟
پاسخ
این اسید در محلول آبی با اهدای یک یون ، یون هیدرونیوم را به وجود میآورد و خود تبدیل به باز مزدوج میشود. این اسید با از دست دادن پروتون، باز مزدوج را تولید میکند.
مثال چهارم
واکنش زیر نمونهای از واکنش بین اسید و باز است. به اجزای شرکتکننده در آن دقت کنید و اسید و باز را مشخص کنید.
پاسخ
برای پاسخ به این سوال باید بدانیم تعریف اسید و باز چیست. به صورت خلاصه میتوان اینطور بیان کرد که اسید دهنده پروتون و باز گیرنده آن است. با دقت به واکنش تعادلی بالا میتوانیم ببینیم که پروتون خود را از دست داده و تبدیل به شده است. این پروتون با انتقال به مولکول آب، یون هیدرونیوم را به وجود آورده است. بنابراین زوج اسید و باز موجود در واکنش زیر را میتوان به صورت زیر مشخص کرد.
- اسید و باز مزدوج
- باز آب و اسید مزدوج
مثال پنجم
در واکنش زیر کدام گونهها اسیدی و کدام گونهها بازی هستند؟
پاسخ
با دقت به واکنش تعادلی بالا متوجه میشویم که یون اسیدی است زیرا به عنوان دهنده پروتون عمل کرده و باز مزدوج خود، را به وجود آورده است. در این صورت آب در سمت چپ، بازی است که با گرفتن پروتون یون هیدرونیوم اسیدی را تولید کرده است. اسید و بازهای تعادل بالا را به صورت زیر خلاصه میکنیم.
- آب باز و اسید مزدوج آن
- اسید و باز مزدوج
مثال ششم
میخواهیم برای گونه اسید و باز مزدوج را تعیین کنیم. هر کدام از آنها چه ساختاری را خواهند داشت؟
پاسخ
میتوان با افزودن یک پروتون اسید مزدوج و با کاستن یک پروتون باز مزدوج این گونه را به دست آورد. به این صورت اسید مزدوج آن خواهد بود. همچنین با کاستن یک پروتون باز مزدوج آن به صورت به دست خواهد آمد.
مثال هفتم
چرا آمونیاک را یک باز به شمار میآوریم؟
پاسخ
خاصیت بازی آمونیاک را میتوان به مثالی از یک واکنش اسید و باز توضیح داد. طبق تعریف باز گونهای است که پروتون گیرنده باشد. به واکنش زیر توجه کنید.
همانطور که مشاهده میکنید، آمونیاک با پذیرش یک پروتون به اسید مزدوج خود یعنی تبدیل شده است. این پروتون از آب به عنوان یک اسید منتقل شده و خود آب یون هیدرونیوم را به وجود آورده است.
مثال هشتم
با بهرهگیری از معادله هندرسون هاسلباخ مقدار را برای بافری از استیک اسید با مشخصات داده شده، محاسبه کنید.
- غلظت استیک اسید ۰٫۲ مولار
- غلظت باز مزدوج استات ۰٫۱۵ مولار
پاسخ
با جایگذاری مقادیر داده شده در رابطه هندرسون هاسلباخ میتوان به پاسخ مورد نظر رسید.
ابتدا اسید و باز داده شده را در رابطه میگذاریم که نتیجه به شکل زیر خواهد بود.
همانطور که مشاهده میکنید تمام مقادیر مورد نیاز در صورت مثال داده شده است. پس به شکل زیر ادامه میدهیم.
و در نهایت خواهیم داشت:
مقدار بافری با اسید و باز داده شده، برابر با ۴٫۶۳ خواهد بود.
مثال نهم
مقدار را برای محلولی حاوی ۱۰ میلیلیتر استیک اسی ۰٫۰۳ مولار و ۱۵ میلیلیتر استات ۰٫۰۲۵ مولار محاسبه کنید. مقدار برای استیک اسید برابر ۴٫۷۵ است.
پاسخ
تفاوت این مثال با مثالهای پیشین در این است که حجم اسید و باز مزدوج ذکر شده است و باید به جای غلظت هر کدام از آنها، مقدار مول را محاسبه و جایگذاری کنیم. برای این کار از روش استوکیومتری استفاده میکنیم.
- نحوه محاسبه مقدار مول استیک اسید
- نحوه محاسبه مقدار مول استات
در این مرحله سراغ رابطه هندرسون هاسلباخ میرویم.
مقدار محیطی با شرایط ذکر شده برابر با ۴٫۸۵ خواهد بود.
تمرین از اسید و باز مزدوج
حال که تعدادی مثال را مورد بررسی قرار دادیم، برای تکمیل اطلاعات خود، به سراغ چند تمرین با پاسخ چندگزینهای میرویم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
سوالات متدوال
حال که با مفهوم اسید و با مزدوج آشنایی پیدا کردیم، میخواهیم به تعدادی از مهمترین و پرتکرارترین سوالهای پیرامون این موضوع، پاسخ دهیم.
تفاوت بین یک اسید و باز مزدوج آن در چیست ؟
اسید و بازی که با یکدیگر مزدوج باشند، در یک یون هیدرونیوم با یکدیگر متفاوت هستند. بهصورتی که اسید دارای این پروتون و باز فاقد آن است.
آیا باز مزدوج اسیدی ضعیف نیز ضعیف است ؟
خیر، در صورتی که اسیدی ضعیف باشد، باز مزدوج آن قوی خواهد بود.
چرا بازهای مزدوج ضعیف، پایدارتر هستند ؟
بازهای ضعیفتر پایدارتر هستند زیرا روی اتمهایی با الکترونگاتیوی بیشتر، دارای بار منفی هستند.
آیا بازهای مزدوج همیشه هسته دوستهای بهتری هستند ؟
بله، این گزاره برای بازهای مزدوج صادق است.
جمع بندی
هدف از این مطلب این بود که بدانیم اسید و باز مزدوج طبق تعریف برونستد به چه ترکیبهایی اطلاق میشود. در ادامه به بررسی ویژگیهای این دسته از ترکیبهای شیمیایی و نحوه تشخیص آنها پرداختیم. همچنین در مورد نحوه محاسبه میزان اسیدی و بازی بودن یک محلول صحبت کردیم. در ادامه با بررسی تعدادی مثال با پاسخ تشریحی و تمرینهای چند گزینهای درک خود را از این موضوع عمیقتر کردیم.












