مایع چیست؟ – تعریف و خواص حالت مایع به زبان ساده
ماده حالتهای مختلفی مانند جامد، مایع و گاز دارد. مایع یکی از این سه حالت ماده است. فاصله ذرات در ماده جامد بسیار نزدیک به یکدیگر است و به همین دلیل، جسم جامد، شکل و حجم مشخصی دارد. ذرات در مایع هنوز نزدیک یکدیگر قرار دارند، اما پیوند آنها به اندازهای محکم نیست که به مایع، همانند جسم جامد، شکل و حجم مشخصی بدهد. به بیان دیگر، ذرات در مایع آزادانهتر از ذرات در ماده جامد حرکت میکنند و بر روی یکدیگر میلغزند. در این مطلب، ابتدا به پرسش مایع چیست به زبان ساده پاسخ میدهیم. سپس، در مورد ویژگیهای مایع صحبت میکنیم.
- یاد میگیرید تفاوتهای ساختاری و رفتاری مایع، جامد و گاز را تحلیل کنید.
- میآموزید ویژگیهایی همچون گرانروی، چسبندگی و کشش سطحی چه نقشی در رفتار مایع دارند.
- یاد خواهید گرفت چگونه حجم و چگالی مایعات را بهطور دقیق اندازهگیری و محاسبه کنید.
- با فرایند تغییر حالت مایعات و عوامل مؤثر بر آنها آشنا میشوید.
- میآموزید اثر نیروهای بین مولکولی بر شکل، حجم و رفتار مایع را بررسی کنید.
- روشهای علمی برای کاهش خطا در آزمایشهای مرتبط با مایعات را به کار میبرید.


مایع چیست ؟
حالتهای ماده به سه دسته کلی جامد، مایع و گاز تقسیم میشوند. مایع حالتی از ماده با ویژگیهای مخصوص به خود است. ویژگیهای مایع سبب میشود که سختی آن نسبت به جامد کمتر و در مقایسه با گاز بیشتر باشد. مایع میتواند جریان یابد و شکل مشخصی مانند جامد ندارد. در واقع مایع شکل ظرفی را که داخل آن ریخته میشود به خود میگیرد. گرچه این ویژگی مایع به گاز شباهت دارد، اما مایع همانند گاز نمیتواند به طور کامل در ظرف پخش شود و تمام آن را پر کند.
آب، نفت، الکل و جیوه، مثالهایی از مایع در دمای اتاق (۲۰ درجه سلسیوس یا ۶۸ درجه فارنهایت) هستند. عبارت مایع، یکی از حالتهای ماده، از سه حالت نام برده شده، را نشان میدهد. به عنوان مثال، آب رایجترین مایع روی زمین است و در حالت مایع، درصد قابلتوجهی از سطح زمین را میپوشاند. آب، تنها در بازه دمایی صفر درجه سلسیوس (۳۲ درجه فارنهایت) تا ۱۰۰ درجه سلسیوس (۲۱۲ درجه فارنهایت) مایع است. آب در دماهای پایینتر از این بازه دمایی به حالت جامد (یخ) و در دماهای بالاتر از بازه دمایی گفته شده به حالت گاز (بخار آب) تبدیل میشود.

ساختار مولکولی آب چه در حالت جامد (یخ)، چه در حالت گاز (بخار آب) همانند ساختار مولکولی آن در حالت مایع است. یخ و بخار آب، هنوز آب هستند، اما در حالتهای متفاوتی از ماده قرار دارند. ذرات تشکیلدهنده ماده در حالت جامد در فاصله بسیار نزدیکی نسبت به یکدیگر قرار دارند. از اینرو، ذرات نمیتوانند از جایگاه خود تا فاصله زیادی حرکت کنند. در مقابل، فاصله ذرات تشکیلدهنده مایع نسبت به جامد بیشتر است و ذرات، آزادی بیشتری برای حرکت به اطراف دارند.

به بیان دیگر، پیوند بین اتمها و مولکولهای ماده در حالت جامد بسیار محکمتر از حالتهای مایع یا گاز است. شاید با خود بگویید ماده جامد، چگالی بزرگتری نسبت به مایع دارد. اما این برداشت اشتباه است. تفاوت چگالی بین ماده جامد و مایع بسیار کوچک است و تقریبا میتوان چگالی آنها را یکسان در نظر گرفت. فاصله ذرات تشکیلدهنده گاز در مقایسه با حالتهای مایع و جامد بسیار بیشتر است، به گونهای که راحتتر میتوانند در فضای در دسترس حرکت کنند.
هنگامی که به مایعی، مانند آب، گرما داده میشود، مولکولها و اتمهای تشکیلدهنده آن انرژی جنبشی بهدست میآورند. اگر دما را به اندازه کافی افزایش دهیم، مایع به گاز تبدیل میشود یا با مواد شیمیایی موجود در محیط واکنش میدهد. به عنوان مثال، آب در اثر گرمای تدریجی به گاز یا بخار آب تبدیل میشود، اما الکل در اثر گرمای ناگهانی و ترکیب شدن با اکسیژن هوا، خواهد سوخت. اگر مایع سرد شود، مولکولها یا اتمهای تشکیلدهنده آن انرژی جنبشی خود را از دست میدهند. بنابراین، اگر دما به اندازه کافی پایین بیاید، مایع به جامد تبدیل خواهد شد.
ویژگی های کلی مایع چیست ؟
ویژگیهای کلی مایع، به عنوان یکی از حالتها ماده، عبارت هستند از:
- مایع مادهای است که ذرات آن هنوز در فاصله نزدیکی نسبت به یکدیگر قرار گرفتهاند، اما پیوند بین آنها به محکمی پیوند بین ذرات تشکیلدهنده جامد نیست.
- آزادی ذرات مایع به گونهای است که به راحتی روی یکدیگر میلغزند و از کنار هم رد میشوند.
- انرژی ذرات تشکیلدهنده مایع کمی بیشتر از انرژی ذرات تشکیلدهنده مایع است. این بدان معنا است که ذراتِ داخل مایع راحتتر به اطراف حرکت میکنند.
- مایعات میتوانند به داخل ظرفها با شکلهای مختلف ریخته شوند و شکل ظرف موردنظر را به خود بگیرند.
ویژگی های مایع چیست ؟
در بخش قبل به پرسش مایع چیست به زبان ساده پاسخ دادیم و برخی از ویژگیهای کلی مایعات را بیان کردیم. همانطور که در مطالب بالا اشاره شد مایع حجم مشخص، اما شکل نامشخصی دارد و شکل آن به ظرفی که مایع درون آن ریخته شده است، بستگی دارد.
به بیان دیگر، مایعات شکل ظرفی که داخل آن ریخته شدهاند را به خود میگیرند، اما حجم آنها ثابت میماند. به عنوان مثال، یک لیتر آب را در نظر بگیرید. حجم این مقدار آب، چه در پارچ ریخته شود یا داخل کاسهای بزرگ، ثابت میماند، اما شکل آن با تغییر ظرف، تغییر خواهد کرد.

گرانروی مایع چیست ؟
به مقاومت مایع در برابر جریان، گرانروی گفته میشود. مایعات، سیال یا شاره هستند و میتوانند جریان داشته باشند. ویسکوزیته یا گرانروی یکی دیگر از ویژگیهای مهم مایعات است. نیروهای بینمولکولی در مایعات تقریبا قوی است. مقدار این نیرو از گازهای قویتر، اما در مقایسه با ماده جامد، ضعیفتر است. اگر گرانروی مایعی زیاد باشد، آن مایع به سختی جاری میشود. در مقابل، اگر ویسکوزیته مایعی کوچک باشد، به راحتی جریان مییابد. عسل و آب به ترتیب، دو مایع با گرانروی زیاد و کم هستند

شاید از خود بپرسید چرا گرانروی برخی مایعات کم و برخی دیگر زیاد است. این موضوع به نیروهای بینمولکولی در آنها مربوط میشود. هرچه نیروی جاذبه بینمولکولی یا نیروهای بینمولکولی در مایعی قویتر باشد، گرانروی مایع بیشتر خواهد بود. مقدار گرانروی هر مایع به نیروهای بینمولکولی آن وابسته است. به عنوان مثال، روغن موتور به دلیل نیروی جاذبه قوی بینمولکولی، گرانروی بالایی دارد.
مقایسه گرانروی مایعات
پنج مایع مختلف با حجم یکسان را داخل استوانههای مدرج میریزیم. سپس پنج توپ پلاستیکی یکسان را همزمان داخل هر مایع رها میکنیم. از آنجا که گرانروی مایعات با یکدیگر متفاوت است، توپها با سرعتهای متفاوت در هر مایع حرکت میکنند. بنابراین، زمان رسیدن هر توپ به کف استوانههای مدرج متفاوت خواهد بود. به بیان دیگر، هرچه نیروهای بینمولکولی در مایعی قویتر باشد، گرانروی آن بیشتر است. در نتیجه، توپ با سرعت کمتری در آن حرکت خواهد کرد. گرانروی را میتوان به صورت کیفی با اندازهگیری آهنگ حرکت توپ فلزی در مایعی دلخواه بهدست آورد. همانطور که گفتیم، هرچه آهنگ حرکت توپ کمتر باشد، ویسکوزیته مایع بیشتر خواهد بود.

عوامل موثر بر گرانروی در مایع چیست ؟
عوامل مختلفی میتوانند بر گرانروی مایع اثر بگذارند. این موارد در ادامه نام برده شده است.
- دما
- نیروهای بین مولکولی
- شکل مولکول
- اندازه مولکول
اثر هریک از این موارد در ادامه توضیح داده میشود.
اثر دما بر گرانروی
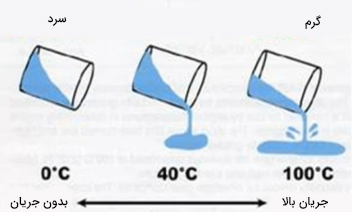
گرانروی در مایعات با افزایش دما، کاهش مییابد. افزایش دمای مایع به معنای افزودن انرژی به مولکولهای آن است. از اینرو، مولکولها، آسانتر بر نیروی بینمولکولی غلبه میکنند و مایع راحتتر جاری میشود. به تصویر زیر دقت کنید. مایعی در سه دمای متفاوت صفر، ۴۰ و ۱۰۰ درجه سلسیوس نشان داده شده است. همانطور که مشاهده میشود، گرانروی مایع در دمای صفر درجه بسیار زیاد است و مایع از درون ظرف خارج نمیشود.
با افزایش دما به ۱۰۰ درجه سلسیوس، مایع به راحتی جریان مییابد و از ظرف خارج میشود. این بدان معنا است که گرانروی آن با افزایش دما، افزایش یافته است. دمای بالاتر به معنای افزایش انرژی جنبشی مولکولها است. با افزایش انرژی جنبشی مولکولها، نیروی بینمولکولی و در نتیجه گرانروی مایع، کاهش مییابد.
اثر نیروی بین مولکولی بر گرانروی
در مطالب بالا گفتیم، دما بر گرانروی مایعات تاثیر میگذارد و با افزایش دما، گرانروی مایع کاهش مییابد. علاوه بر دما، پارامترهای دیگری نیز وجود دارند که بر گرانروی مایع تاثیر میگذارند. قدرت نیروهای بین مولکولی عامل موثر دیگری بر میزان گرانروی در مایعات است. هرچه نیروهای جاذبه بین مولکولهای مایع قویتر باشند، گرانروی مایع بزرگتر خواهد بود. بنابراین، مایع سختتر جاری میشود.
اثر شکل و اندازه مولکول بر گرانروی
علاوه بر دما و نیروهای بینمولکولی، اندازه و شکل مولکول نیز عامل موثری بر گرانروی است. مایعی با مولکولهای بسیار کوچک، گرانروی کمتری دارد. زیرا در این حالت مولکولها راحتتر حرکت میکنند. در مقابل، حرکت مولکولهای بزرگ نسبت به یکدیگر بسیار سختتر خواهد بود. از اینرو، مایع به آسانی جاری نمیشود و گرانروی آن افزایش مییابد.
پیوند بین مولکولهای آب از نوع پیوند هیدروژنی و بسیار قوی است. در نتیجه، نیروی بینمولکولی بین مولکولهای آب بسیار قوی خواهد بود. اما گرانروی آب بسیار کوچک است. چرا؟ دلیل این موضوع به کوچک بودن مولکولهای تشکیلدهنده آب مربوط میشود. تا اینجا میدانیم گرانروی مایع چیست و چگونه با دما تغییر میکند. در ادامه، در مورد ویژگی مهم دیگری در مایعات صحبت میکنیم.
چسبندگی مایع چیست ؟
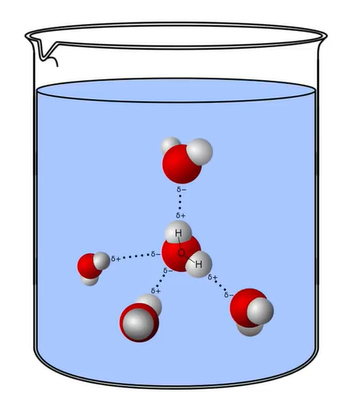
چسبندگیِ مایع به معنای چسبیدن آن به چیزی نیست، بلکه مولکولهای مایع به دلیل نیروهای جاذبه بین آنها در کنار یکدیگر قرار میگیرند و حالتِ مایع را تشکیل میدهند. مایعات، کشش سطحی دارند. شاید از خود بپرسید کشش سطحی چیست و چگونه تعریف میشود. به تمایل سطح مایع به کوچک شدن در سطح مقطع کمینه، کشش سطحی گفته میشود. علت ایجاد کشش سطحی، نیروهای جاذبه بین مولکولهای مایع است.
به بیان دیگر، ذرات داخلی مایع، ذرات سطحی (ذرات قرار گرفته در مرز بین هوا و مایع) را برای رسیدن به سطح مقطع کمینه به سمت داخل میکشند. هرچه نیروهای بینمولکولی قویتر باشد، کشش سطحی مایع نیز بزرگتر خواهد بود. آب، یکی از مایعاتی است که کشش سطحی بزرگی دارد. پیوند بینمولکولی در آب از نوع پیوند هیدروژنی است. دو مولکول آب در تصویر زیر نشان داده شدهاند. مولکول A، مولکول حجمی و مولکول B، مولکول سطحی هستند.
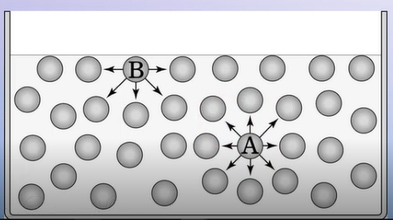
مولکول A نیروی کششی را از طرف تمام مولکولهای اطراف خود احساس میکند. اما مولکول B کمی با مولکول A متفاوت است، زیرا در سطح قرار دارد. بنابراین، تعداد مولکولهای آبِ اطراف آن کمتر است. همچنین، این مولکول در مرز آب و هوا قرار دارد. از آنجا که تعداد مولکولهای اطراف B نسبت به A کمتر است، این مولکول، نیروی کشش کمتری نسبت به مولکول A احساس خواهد کرد. همانطور که در تصویر دیده میشود، نیروی کششی وارد شده بر ذره B به سمت پایین قرار دارد و این نیرو توسط نیروی دیگری خنثی نمیشود.
در نتیجه، مولکول B به سمت پایین حرکت میکند. مولکول B تنها مولکول سطحی آب نیست و مولکولهای زیادی در سطح قرار گرفتهاند. نیروی کششی وارد شده بر این مولکولها، آنها را به سمت پایین میکشاند. بنابراین، مولکولهای سطحی به یکدیگر نزدیک میشوند و به سمت پایین حرکت میکنند. در این حالت، سطح مایع (آب) شبیه پوستی کشیده شده میشود. به این حالت، کشش سطحی میگوییم. حشرات بسیاری با کمک کشش سطحی روی سطح آب میایستند یا راه میروند.

به هنگام شیرجه زدن به داخل استخر، به طور حتم کشش سطحی آب را احساس کردهاید. نوعی مارمولک وجود دارد که با سرعت زیادی روی سطح آب حرکت میکند. دلیل این موضوع به کشش سطحی آب و نیروی آستانهای مربوط میشود که مارمولک بر سطح آب وارد میکند. اگر جسمی، مانند حشره، بخواهد به داخل آب نفوذ کند، برخی پیوندهای هیدروژنی باید شکسته شوند. بنابراین، قسمتی از حجم آب توسط چیزی به غیر از مولکولهای آب اشغال میشود.

نیروهای بینمولکولی نقش مهمی در تعیین خواص مایعات ایفا میکنند. این نیروها، دو نیروی دیگر را به نامهای «نیروی پیوستگی» (Cohesive force) و «نیروی چسبندگی» (Adhesive force) تعیین میکنند. کشش سطحی مایع به قدرت نیروهای چسبندگی در آن بستگی دارد. هرچه این نیرو قویتر باشند، کشش سطحی نیز قویتر خواهد بود. کشش سطحی از مایعی به مایع دیگر تفاوت دارد.
تا اینجا میدانیم گرانروی در مایع چیست و چه عواملی بر آن تاثیر میگذارند. در ادامه، در مورد نیروهای چسبندگی و پیوستگی صحبت میکنیم.
نیروی پیوستگی در مایع چیست ؟
به نیروهای بینمولکولی بین مولکولهای تشکیلدهنده مایع، نیروهای پیوستگی گفته میشود. این نیرو، نوعی نیروی جاذبه بین مولکولهای داخلی مایع است که سبب ایجاد پیوستگی داخل مایع میشود. این نیرو در مایعی با گرانروی بالا، بسیار قوی است. داخل مایع، بیشتر مولکولهای داخلی، نیروهای پیوستگی را به طور یکسان احساس میکنند. این مورد درباره مولکولهای سطحی صدق نمیکند. زیرا این مولکولها با مولکولهای کمتری احاطه شدهاند و در مرز بین مایع و هوا قرار دارند.
به همین دلیل مایعات برای کمینه کردن سطح مقطع، منقبض میشوند و شکلهای خاصی را تشکیل میدهند. این حالت را به خوبی میتوان در قطره آب مشاهده کرد. اگر با دقت به قطرههای آب روی سطوح آبگریز نگاه کرده باشید، آنها را به شکل کره خواهید دید. کره شکلی است که در آن سطح مقطع، کمینه میشود. از اینرو، قطرات آب برای بیشینه کردن پیوند هیدروژنی به شکل کره تشکیل میشوند. در این حالت، انرژی سیستم کمینه میشود. اگر قطرههای آب بزرگتر شوند، نیروهای دیگری مانند نیروی وزن و نیروی مقاومت هوا نیز وارد بازی میشوند. از اینرو، قطرههای بزرگتر نمیتوانند برای مدت طولانی به شکل کره باقی بمانند. این اثر در قطرههای کوچکِ آب به خوبی مشاهده میشود.

نیروی چسبندگی مایع چیست؟
به برهمکنش بین مولکولهای تشکیلدهنده مایع و سطح جامد (سطح ظرف) نیروی چسبندگی میگوییم. چسبندگی مایع به سطح به دلیل وجود این نیرو است. اگر قطره آب کوچکی را روی قطعهای پلاستیکی یا سطحی غیرقطبی قرار دهیم، هیچ یک از این سطح تر نخواهند شد. زیرا مولکولهای آب با سطوح غیرقطبی برهمکنش ندارند. از اینرو، شکل کروی قطره به خوبی حفظ میشود. دلیل این موضوع آن است که نیروهای پیوستگی (پیوندهای هیدروژنی بین مولکولهای آب) قویتر از نیروهای چسبندگی (نیروی بین مولکولهای آب و سطح غیرقطبی) هستند.
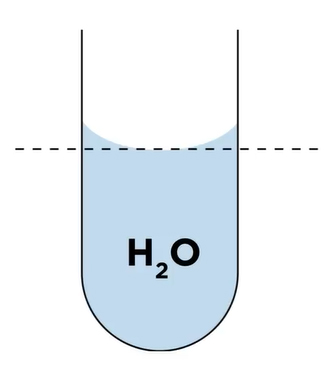
اگر قطره آب را روی شیشه یا سطحی قطبی قرار دهیم، روی آنها پخش میشود و سطح را تر میکند. دلیل این موضوع به برهمکنش قطره آب (مولکولهای آب) با سطح قطبی برمیگردد. همچنین، در این حالت نیروهای چسبندگی بزرگتر از نیروهای پیوستگی بین مولکولهای آب هستند. هنگامی که مایعی مانند آب را داخل لولهای شیشهای، مانند استوانه مدرج، میریزیم چه اتفاقی رخ میدهد؟ از آنجا که آب و شیشه یکدیگر را جذب میکنند، سطح آب به شکل مقعر درمیآید. دلیل این موضوع آن است که سطح مقعر شکل سبب بیشینه شدن برهمکنش مولکولهای آب با سطح لوله شیشهای میشود.
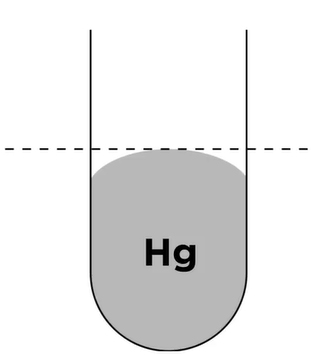
اگر لوله شیشهای را به جای آب با جیوه پر کنیم، به حالت کاملا متفاوتی روبرو میشویم. نیروهای پیوستگی بین مولکولهای تشکیلدهنده جیوه بزرگتر از نیروی چسبندگی بین جیوه و سطح شیشه است. از این رو سطح جیوه به شکل محدب (گنبدیشکل) درمیآید. دلیل این موضوع آن است که سطح محدب شکل سبب کمینه شدن برهمکنش مولکولهای جیوه با سطح لوله شیشهای میشود. در این حالت، برهمکنش بین مولکولهای جیوه بیشینه خواهد شد.
پس از آشنایی با نیروهای چسبندگی و پیوستگی در مایعات، اثر مویینگی در مایعات را توضیح میدهیم.
اثر مویینگی در مایع چیست ؟
اگر نوک دستمال کاغذی را در آب فرو ببرید، آب برخلاف نیروی جاذبه زمین، از آن بالا خواهد رفت. این پدیده اثر مویینگی نام دارد. این مورد مثالی از اثر مویینگی در مایعات است. مایعات به دلیل جاذبه بین مایع و سطح مادهای مشخص، در آن ماده جریان مییابند. در این حالت، ترکیب نیروهای چسبندگی و پیوستگی در مایع میتواند بر نیروی جاذبه وارد شده از سمت زمین، غلبه کند و سبب بالا رفتن مایع در دستمال کاغذی شود. دستمال کاغذی از مادهای به اسم سلولز ساخته شده است که مولکولهای آب را جذب میکند.

اثر مویینگی را همچنین میتوانیم به هنگام فرو بردن لولهای باریک داخل ظرفی پر از آب مشاهده کنیم. از آنجا که مولکولهای آب و مولکولهای شیشه یکدیگر را جذب میکنند، آب به به صورت طبیعی و بدون اعمال نیروی خارجی از لوله بالا میرود. توجه به این نکته مهم است که نیروهای چسبندگی بین مولکولهای آب و شیشه قویتر از نیروی جاذبه وارد شده از سمت زمین است. هرچه لوله باریکتر باشد، آب تا ارتفاع بیشتری داخل لوله بالا میرود.
فرمول مویینگی
اثر مویینگی را حتی در طبیعت نیز میتوان مشاهده کرد. به عنوان مثال، گیاهان با استفاده از اثر مویینگی، آب را از خاک جذب میکنند و به ساقهها و برگها میرسانند. اثر مویینگی را میتوانیم به صورت کمی و با استفاده از فرمول ریاضی بیان کنیم:
در رابطه بالا:
- کشش سطحی مایع است.
- زاویه تماس بین مایع و لوله است.
- شعاع لوله است.
- چگالی مایع است.
- شتاب جاذبه زمین است.
تا اینجا میدانیم مایع چیست و ویژگیهای کلی مایع را بیان کردیم. در ادامه، برای داشتن درک بهتری از مفهوم مایع، چند آزمایش ساده را با یکدیگر انجام میدهیم. پیشنهاد میکنیم برای یادگیری بیشتر نیروهای بین مولکولی در مایعات، فیلم آموزش پدیدههای سطحی بین مولکولی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
حجم مایع چگونه اندازه گرفته می شود؟
تا اینجا میدانیم مایع چیست و چه ویژگیهای مهمی دارد. یکی از ویژگیهای مهم مایعات آن است حجم مشخصی دارند، اما شکل مشخصی ندارند. اندازهگیری حجم مایع بسیار مهم است. در این بخش در مورد این موضوع صحبت میکنیم. مایع ممکن است داخل ظرفی با شکل منظم یا داخل ظرفی با شکل نامنظم قرار بگیرد. بنابراین، باید بدانیم حجم مایع قرار گرفته داخل هر یک از این ظرفها را چگونه اندازه بگیریم.
به مقدار فضای اشغال شده توسط ماده یا هر جسم دلخواهی، حجم گفته میشود. واحد اندازهگیری حجم در سیستم استاندارد بینالمللی (International Standard of Units | SI) برابر مترمکعب یا است. توجه به این نکته مهم است که اندازهگیری حجم در سه بعد انجام میگیرد. واحدهای دیگری نیز برای اندازهگیری حجم وجود دارند:
- سانتیمتر مکعب یا
- میلیلیتر یا
نکته: یک میلیلیتر برابر یک سانتیمتر مکعب است.
برای اندازهگیری مایع از وسیلهای به نام استوانه مدرج استفاده میکنیم. همانطور که در تصویر زیر مشاهده میشود، خطوطی روی استوانه قرار گرفته است که از آنها برای اندازهگیری حجم استفاده میشود. توجه به این نکته مهم است که درجهبندیهای قرار گرفته روی استوانههای مدرج یکسان نیستند. قبل از اندازهگیری حجم مایع، به فاصله بین هر درجهبندی دقت کنید. فرض کنید مایعی با حجم نامشخص داخل استوانه مدرج ریختهاید. چگونه حجم مایع را میتوان اندازه گرفت؟

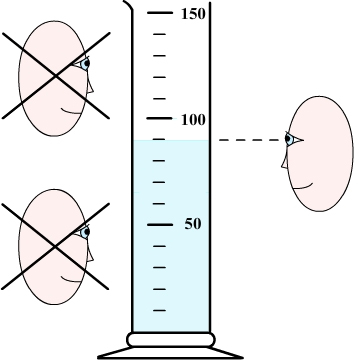
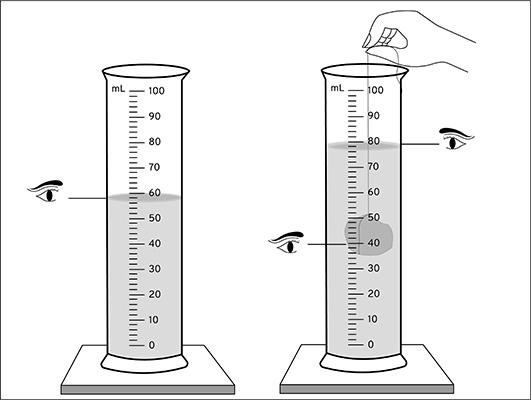
آیا تاکنون به سطح بالای مایعات دقت کردهاید، سطح برخی مایعات مقعر و سطح برخی دیگر به شکل محدب است. بنابراین، برای اندازهگیری مایع، ابتدا باید به شکل سطح آن دقت کنیم. فرض کنید مقداری آب داخل استوانه مدرج ریختهایم. در نخستین گام، به شکل سطح آب دقت میکنیم. سطح آب به شکل مقعر است (تصویر نشان داده شده در ادامه). برای بهدست آوردن حجم آب به کدام قسمت سطح آن توجه میکنیم؟ پایینترین نقطه.

در گام دوم، سعی میکنیم چشم خود را همتراز با پایینترین سطح مایع قرار دهیم. به این نکته توجه داشته باشید که برای اندازهگیری حجم مایع، چشم نباید بالاتر یا پایینتر از سطح موردنظر قرار بگیرد. از اینرو، بهتر است قبل از خواندن عدد از روی استوانه مدرج، آن را روی سطح بدون حرکت، مسطح و محکمی قرار دهید.
اندازهگیری حجم اجسامی با شکل مشخص و منظم، مانند استوانه، کره یا مکعب، بسیار راحت است. به عنوان مثال، برای اندازهگیری حجم مکعبمستطیل، طول، عرض و ارتفاع آن را در یکدیگر ضرب میکنیم. برای اندازهگیری حجم کره، ابتدا شعاع آن را اندازه میگیریم و آن را در معادله قرار میدهیم. همچنین، برای محاسبه حجم استوانهای به شعاع از رابطه استفاده میکنیم. در این رابطه، ارتفاع استوانه است.
اگر شکل جسمی نامنظم باشد، حجم آن را چگونه اندازه میگیریم؟ اندازهگیری طول، ارتفاع یا عرض چنین جسمی بسیار سخت است. حتی در بیشتر موارد نمیتوانیم با تقریب خوبی شکل جسم را کروی در نظر بگیریم و شعاع آن را برای محاسبه حجم بهدست آوریم. برای محاسبه حجم به صورت زیر عمل میکنیم.
اندازه گیری حجم جسمی با شکل نامنظم
در راه اول، مقداری مایع، مانند آب، داخل استوانه مدرج میریزیم. فرض کنید حجم آب ریخته شده داخل استوانه مدرج برابر ۱۵۰ میلیلیتر است. این عدد را به عنوان حجم اولیه آب و قبل از قرار دادن جسم با شکل نامنظم داخل آن، یادداشت میکنیم. سپس، جسم موردنظر را با دقت و به آرامی داخل آب قرار میدهیم. اگر به حجم آب داخل استوانه به هنگام قرار دادن جسم داخل آن دقت کنیم، متوجه خواهیم شد که سطح آب پس از قرار دادن جسم در آن به سمت بالا حرکت میکند.
فرض کنید حجم آب به ۲۰۰ میلیلیتر افزایش مییابد. برای بهدست آوردن حجم جسم موردنظر باید حجم مایع قبل از انداختن جسم در آن را از حجم مایع پس از انداختن جسم در آن کم کنیم:
بنابراین، حجم جسم با شکل نامنظم برابر ۵۰ میلیمتر خواهد بود.
تا اینجا با تعریف مایع، ویژگیها و چگونگی اندازهگیری حجم آن آشنا شدیم. در ادامه آزمایش سادهای را برای اندازهگیری حجم مایع با استفاده از استوانه مدرج انجام میدهیم.
آزمایش اندازهگیری حجم مایع
مایعی رنگی (آب) را داخل بِشِر میریزیم. همانطور که در تصویر زیر مشاهده میشود بِشِر درجهبندی شده است. شاید با خود بگویید به جای استوانه مدرج میتوان از بِشر برای اندازهگیری حجم مایع استفاده کرد. این فکر کاملا اشتباه است. همانطور که در تصویر مشاهده میکنید، کوچکترین واحد تقسیمبندی شده رو بِشِر برابر ۲۵ میلیلیتر است. بنابراین، حجم بهدست آمده دقیق نخواهد بود. بنابراین، برای بهدست آوردن حجم مایع باید از استوانه مدرج استفاده کنیم.

در مطالب بالا، در مورد چگونگی اندازهگیری حجم مایع با استفاده از استوانه مدرج صحبت کردیم. هنگامی که مایعی را داخل ظرفی مانند استوانه مدرج میریزیم، سطح مایع به دو شکل مقعر یا محدب درمیآید. به عنوان مثال، اگر مایع موردنظر آب باشد، سطح آن به شکل مقعر در میآید. برای اندازهگیری حجم آب باید به پایینترین قسمت منحنی شکل گرفته در سطح آب دقت کنیم. آبِ رنگی داخل بِشِر را داخل استوانه مدرج میریزیم.

همانطور که گفتیم برای اندازهگیری حجم آب باید چشم و پایینترین قسمت سطح آب (خط آبیرنگ نشان داده شده در تصویر بالا) باید در یک راستا قرار بگیرند. آیا میدانید حجم آب چه مقدار است؟ برای بهدست آوردن حجم آب، ابتدا باید بدانیم کوچکترین درجهبندی روی استوانه چند میلیلیتر است. برای این کار باید تعداد تقسیمبندی بین ۶۰ تا ۷۰ میلیلیتر را بهدست آوریم. این فاصله به ۱۰ قسمت مساوی تقسیم شده است. بنابراین، کوچکترین درجهبندی برابر یک میلیمتر خواهد بود.
در نتیجه، حجم آب ریخته شده در استوانه مدرج برابر ۷۵ میلیلیتر است. اگر از بِشِر مدرج برای اندازهگیری حجم آب استفاده میکردیم، حجم آب را به طور دقیق نمیتوانستیم اندازه بگیریم و تنها میتوانستیم محدوده آن را تخمین بزنیم. چرا؟ زیرا درجهبندی روی بِشِر دقیق نیست. شاید از خود بپرسید اگر از پایین یا بالای خط آبیرنگ به آن نگاه میکردیم، چه اتفاقی رخ میدادی. فرض کنید از پایین به خط آبیرنگ نگاه میکردید. در این حالت، حجم آب را در حدود ۷۶ میلیمتر بهدست میآوردید.

حالتی را در نظر بگیرید که باید آزمایشی انجام دهید و مقدار آبِ لازم برای انجام این آزمایش برابر ۷۷ میلیلیتر باشد. نخستین راهی که به نظرتان میرسد آن است که ابتدا مقداری آب، داخل بِشِر میریزید. سپس، آبِ داخل بِشِر را داخل استوانه میریزید و در نزدیکی حجم ۷۷ میلیلیتر آب را بسیار آهسته اضافه میکنید. با این حال، دقت در این روش بسیار کم است. برای انجام این کار از وسیلهای به نام «پیپت» (Pipet) استفاده میکنیم.

پیپت را با مقداری آب پر میکنیم و آب را به صورت قطرهای و بسیار آهسته به آبِ داخل استوانه مدرج اضافه میکنیم. به هنگام چکاندن قطرهای آب، باید چشم خود را نیز همتراز با پایینترین قسمت سطحی آب قرار دهیم و افزودن آب را با رسیدن این سطح به عدد ۷۷، متوقف کنیم. شاید از خود بپرسید برای کم کردن حجم آب از چه روشی باید استفاده شود. بهترین روش آن است که آب اضافی داخل استوانه را به ظرف اصلی برگردانیم و برای رسیدن به حجم موردنظر، آب را با استفاده از پیپت به آب داخل استوانه مدرج اضافه کنیم.
تبدیل واحدهای حجم به یکدیگر
تبدیل واحدهای حجم با انجام ضرب و تقسیمهای ضروری برای تبدیل واحدهای میلیلیتر به لیتر و سیسی و ... انجام میشود. در مطالب بالا در مورد اندازهگیری حجم مایع و واحدهای اندازهگیری حجم صحبت کنیم. رایجترین واحدها برای بیان حجم مایع عبارت هستند از:
- میلیلیتر
- سانتیمتر مکعب
- سیسی
شاید از خود بپرسید چه تفاوتی بین میلیلیتر و سانتیمترمکعب وجود دارد. این دو واحد اندازهگیری حجم، یکسان هستند.تفاوت اصلی این دو واحد در ان است که میلیلیتر برای اندازهگیری حجم مایع و سانتیمترمکعب برای اندازهگیری حجم مواد جامد، استفاده میشوند. مهم نیست حجم چه چیزی را اندازه گرفته باشیم، نکته مهم آن است که یک سیسی همواره برابر یک میلیلیتر است. اگر حجم مایع زیاد باشد، به جای میلیلیتر یا سیسی از لیتر استفاده میکنیم.
- پرسش ۱: ۷ سانتیمتر مکعب چند سیسی است؟
- پاسخ: ۷ سانتیمتر مکعب برابر ۷ سیسی است.
- پرسش ۲: ۲۲ سیسی چند سانتیمتر مکعب است؟
- پاسخ: ۲۲ سیسی برابر ۲۲ سانتیمتر مکعب است.
- پرسش ۳: یک لیتر چند سانتیمتر مکعب است؟
- پاسخ: یک لیتر برابر ۱۰۰۰ سانتیمتر مکعب و یک سانتیمتر مکعب، برابر لیتر است. از اینرو، برای تبدیل از لیتر به سانتیمتر مکعب عدد موردنظر را در ۱۰۰۰ ضرب و برای تبدیل از سانتیمتر مکعب به لیتر، عدد موردنظر را بر ۱۰۰۰ تقسیم میکنیم.

مثال اول تبدیل حجم مایع
۳ لیتر آب برابر چند سیسی آب است؟ این مقدار برابر چند سانتیمتر مکعب و چند میلیلیتر آب است؟
پاسخ
در این مثال میخواهیم حجم بزرگتر را به حجم کوچکتر تبدیل کنیم. برای این تبدیل حجم باید واحد بزرگتر را در عدد تبدیل ضرب کنیم. از آنجا که یک لیتر برابر ۱۰۰۰ سانتیمتر مکعب است، ۳ لیتر برابر یا ۳۰۰۰ سانتیمتر مکعب خواهد بود. همچنین، یک سانتیمتر مکعب برابر یک میلیلیتر است. از اینرو، ۳۰۰۰ سانتیمتر مکعب، برابر ۳۰۰۰ میلیلیتر خواهد بود.
مثال دوم تبدیل حجم مایع
۰/۵ لیتر آب برابر چند سیسی آب است؟ این مقدار برابر چند سانتیمتر مکعب و چند میلیلیتر آب است؟
پاسخ
در این مثال حجم بزرگتر، یعنی لیتر، را به حجم کوچکتر، یعنی میلیلیتر، تبدیل میکنیم. برای انجام این کار باید واحد بزرگتر را در عدد تبدیل ضرب کنیم. از آنجا که یک لیتر برابر ۱۰۰۰ سانتیمتر مکعب است، ۰/۵ لیتر برابر یا ۵۰۰ سانتیمتر مکعب خواهد بود. همچنین، یک سانتیمتر مکعب برابر یک میلیلیتر است. از اینرو، ۵۰۰ سانتیمتر مکعب، برابر ۵۰۰ میلیلیتر خواهد بود.
مثال سوم تبدیل حجم مایع
۱۰۰ سیسی آب برابر چند لیتر آب است؟ این مقدار برابر چند سانتیمتر مکعب و چند لیتر آب خواهد بود؟
پاسخ
در این مثال حجم کوچکتر، یعنی سیسی، را به حجم بزرگتر، یعنی لیتر، تبدیل میکنیم. برای انجام این کار باید واحد کوچکتر را در عدد تبدیل ضرب کنیم. از آنجا که یک سیسی برابر سانتیمتر مکعب است، ۱۰۰ سیسی برابر یا ۰/۱ لیتر خواهد بود. همچنین، یک سانتیمتر مکعب برابر یک میلیلیتر است. از اینرو، ۱۰۰ سانتیمتر مکعب، برابر ۱۰۰ میلیلیتر خواهد بود.
مثال چهارم تبدیل حجم مایع
۴۵۰ سیسی نفت برابر چند لیتر نفت است؟ این مقدار برابر چند سانتیمتر مکعب و چند لیتر خواهد بود؟
پاسخ
در این مثال حجم کوچکتر، یعنی سیسی، را به حجم بزرگتر، یعنی لیتر، تبدیل میکنیم. برای انجام این کار باید واحد کوچکتر را در عدد تبدیل ضرب کنیم. از آنجا که یک سیسی برابر سانتیمتر مکعب است، ۴۵۰ سیسی برابر یا ۰/۴۵ لیتر خواهد بود. همچنین، یک سانتیمتر مکعب برابر یک میلیلیتر است. از اینرو، ۴۵۰ سانتیمتر مکعب، برابر ۴۵۰ میلیلیتر خواهد بود.
برای آنکه بدانیم مایع چیست و با ویژگیهای آن بهتر آشنا شویم، باید تغییر حالتهای مختلف در مایع را بشناسیم. در ادامه، انواع تغییر حالتهای فیزیکی در مایعات را توضیح میدهیم.
تبدیل مایع به جامد چیست ؟
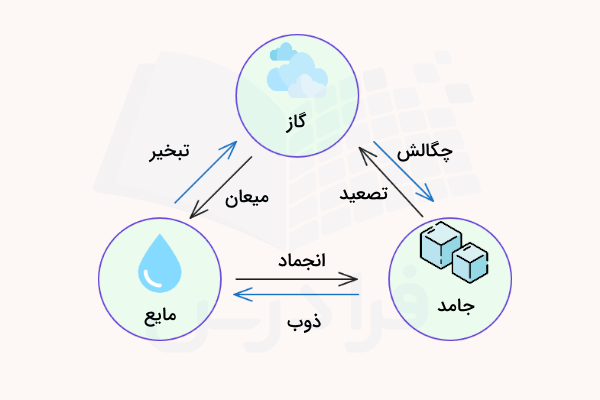
قبل از آنکه در مورد تبدیل مایع به گاز یا جامد صحبت کنیم، ابتدا در مورد تغییر حالت ماده در حالت کلی صحبت میکنیم. تغییر حالت، تغییری فیزیکی در ماده است. تغییر حالتهای فیزیکی، تغییراتی برگشتپذیر هستند و هیچ تغییر شیمیایی در ماده ایجاد نمیکنند. تغییر حالتهای رایج و معمول عبارت هستند از:
- ذوب
- انجماد
- تصعید
- چگالش
- میعان
- تبخیر
قبل از آنکه بدانیم تبدیل مایع به جامد یا جامد به مایع چیست، ابتدا باید بدانیم چرا ماده تغییر حالت میدهد.
چرا تغییر حالت رخ می دهد ؟
هنگامی که دما یا فشار سیستمی تغییر میکند، تغییر حالت یا فاز رخ میدهد. هنگامی که فشار یا دما افزایش مییابد، برهمکنش بین مولکولها نیز افزایش خواهد یافت. به طور مشابه، هنگامی که دما کاهش مییابد، مولکولها و اتمها آسانتر در ساختاری محکم قرار میگیرند.
در ادامه، تغییر حالت از حالتهای گازی و جامد به مایع یا تغییر حالت از مایع به حالتهای گاز و جامد را توضیح میدهیم.
تبدیل حالت مایع به جامد
به فرایند تبدیل آب مایع به یخ جامد، انجماد گفته میشود. به دمای تبدیل مایع به جامد، دمای انجماد میگوییم. نقطه انجماد، دمایی است که در آن مایع در فشار اتمسفر، از حالت مایع به جامد تبدیل میشود. از اینرو، گرما از آب داخل ظرف با دمای بالاتر به هوای سرد داخل فریزر منتقل میشود. انتقال گرما تا جایی ادامه مییابد که هیچ انرژی برای حرکت ذرات نسبت به یکدیگر وجود نداشته باشد. از اینرو، ذرات در مکان خود ثابت و با استفاده از نیروی جاذبه بین یکدیگر، در مکانهای خود ثابت میمانند. در این حالت، آب مایع به یخ جامد تبدیل شده است.
به طور حتم در گرمای تابستان برای نوشیدن آب خنک از قالبهای کوچک یخ استفاده کردهاید. سوالی که ممکن است مطرح شود آن است که قالبهای جامد یخ چگونه تشکیل شدهاند؟ برای انجام این کار، ظرفی را از آب پر میکنید و آن را داخل یخچال فریزر با دمای بسیار کم قرار میدهید. چه اتفاقی رخ میدهد؟ گرما بین آب داخل ظرف و هوای سرد داخل فریزر مبادله میشود. آیا جهت انتقال گرما را میدانید؟ بر طبق دومین قانون از قوانین ترمودینامیک، گرما از جسمی با دمای بالاتر به جسمی با دمای پایینتر منتقل میشود.
مواد مختلف به دلیل مولکولهای سازنده متفاوت، در دماهای متفاوتی منجمد میشوند. نیروی بینمولکولی در برخی مواد قویتر از این نیرو در مواد دیگر است. به عنوان مثال، پیوند بین مولکولهای آب از نوع پیوند هیدروژنی است و این مایع در دمای صفر درجه سلسیوس یخ میزند. جیوه مایعی سمی در دمای اتاق است و در دمای ۳۸/۸۷- درجه سلسیوس منجمد میشود. همانطور که ملاحظه میکنید دمای انجماد جیوه بسیار کمتر از دمای انجماد آب است.
اگر مقداری نمک داخل آب بریزیم، چه اتفاقی برای دمای انجماد آن رخ میدهد؟ دمای انجماد آبِ نمک کمتر از دمای انجماد آبِ خالص است. تبدیل مایع به جامد یا انجماد در گامهای زیر رخ میدهد:
- پیوند بین مولکولهای مایع به نسبت ضعیف است. از اینرو، نیروهای جاذبه بینمولکولی در مایع، کمتر از این نیروها در مواد جامد است.
- گرمای منتقل شده به مولکولها به هنگام انجماد، بزرگتر از انرژی پتانسیل نگهدارنده مولکولها در ساختار کریستالی جامد است.
- این انرژی پتانسیل، انرژی شبکهای ماده جامد را نیز نشان میدهد.
- هنگامی که گرما به دلیل کاهش دما یا فشار از مادهای گرفته میشود، انرژی جنبشی مولکولهای تشکیلدهنده آن کاهش مییابد و مولکولها در فاصله نزدیکتری نسبت به یکدیگر قرار میگیرند.
- مولکولها به تدریج انرژی پتانسیل بهدست میآورند و پایدار میشوند. در این حالت، مایع به جامد تبدیل خواهد شد.
در نقطه انجماد، دو فاز مایع و جامد در کنار یکدیگر و در حالت تعادل وجود دارند. نقطه انجماد ماده به فشار اتمسفر وابسته است.
چه عواملی بر نقطه انجماد تاثیر می گذارند ؟
نوع مولکولهای تشکیلدهنده مایع، مهمترین عامل موثر بر نقطه انجماد است:
- اگر نیروهای بینمولکولی بین مولکولها قوی باشند، نقطه انجماد بالا است.
- اگر نیروهای بینمولکولی ضعیف باشند، نقطه انجماد نسبتا پایین است.
نقطه انجماد چند مایع در فشار یک اتمسفر در جدول زیر نشان داده شدهاند. دماها برحسب درجه سلسیوس هستند.
| مایع | نقطه انجماد برحسب درجه سلسیوس |
| آب | صفر |
| بنزن | ۵/۵ |
| اتانول | ۱۱۷/۳- |
| استیک اسید | ۱۶/۶ |
پرسش مایع چیست و تبدیل حالت آن به گاز یا جامد یکی از مبحثهای مهم فیزیک پایه است. در مطالب بالا، در مورد ویژگیهای مهم مایعات و تبدیل حالت مایع به جامد صحبت کردیم. در ادامه، میخواهیم بدانیم تبدیل جامد به مایع چیست و چه عاملهایی بر این تغییر حالت تاثیر میگذارند.
تبدیل جامد به مایع چیست ؟
در بخش قبل در مورد تبدیل مایع به جامد توضیح دادیم و انجماد و نقطه انجماد را تعریف کردیم. در این قسمت، در مورد تبدیل حالت جامد به مایع یا فرایند ذوب صحبت میکنیم. فرایندی که در آن ماده جامد با اضافه کردن گرما به آن به مایع تبدیل میشود، ذوب نام دارد. به عنوان مثال، تکههای کوچک یخ با قرار گرفتن در دمای اتاق، به آبِمایع تبدیل میشوند. هنگامی که تکهای یخ در دمای اتاق قرار میگیرد، تبادل گرمایی بین یخ و هوای اتاق رخ میدهد.
از آنجا که دمای هوای اتاق بیشتر از دمای یخ است، گرما از هوای اتاق به یخ منتقل و سبب ذوب شدن آن میشود. به دمایی که در آن ماده جامد با گرفتن گرما به مایع تبدیل میشود، نقطه ذوب میگوییم. این اتفاق در فشار یک اتمسفر رخ میدهد. در نقطه ذوب، دو فاز مایع و جامد در حالت تعادل در کنار یکدیگر قرار دارند. نقطه ذوب نام به فشار بستگی دارد و معمولا در فشار استاندارد بیان میشود. نقطه ذوب در مقابل نقطه انجماد قرار دارد. برای تبدیل ماده جامد به مایع باید به آن گرما بدهیم. افزودن گرما به ماده جامد تا رسیدن آن به نقطه ذوب ادامه مییابد.

به عنوان مثال، آهن در حالت عادی فلزی جامد است. اما در دمایی در حدود ۳۰۰۰ درجه فارنهایت به مایع تبدیل میشود (به نقطه ذوب میرسد). جیوه در دماهای بسیار پایین، جامد است، اما در دمایی در حدود ۱۰ درجه فارنهایت ذوب میشود. بنابراین، نقطه ذوب جیوه پایین، بسیار پایینتر از آهن، است.
مثال نقطه ذوب
نقطه ذوب کدام یک از مواد زیر کمتر است؟
- کلسیم فلورید
- کلسیم یدید
- کلسیم کلرید
- کلسیم برمید
پاسخ
هرچه اندازه آنیون بزرگتر باشد، قطبشپذیری آن نیز بیشتر خواهد بود. بنابراین، پیوند کووالانسی ضعیفتر است. از میان گزینههای داده شده، کلسیم یدید به دلیل اندازه بزرگ یون ید، ضعیفترین پیوند کووالانسی را دارد. بنابراین، نقطه ذوب پایینتری نسبت به ترکیبهای دیگر کلسیم خواهد داشت. نقطه ذوب برخی مواد جامد در جدول زیر نشان داده شدهاند.
| نام ماده | نقطه ذوب برحسب کلوین |
| آلومینیوم | ۲۷۴۰ |
| مس | ۱۴۶۰ |
| طلا | ۲۹۳۳ |
| جیوه | ۶۳۰ |
همانطور که در جدول بالا دیده میشود، نقطه ذوب برخی مواد بسیار بالا و نقطه ذوب برخی دیگر به نسبت بالا است. حتی نقطه ذوب دستهای از مواد بسیار کم است. سوالی که ممکن است مطرح شود آن است که چرا برخی مواد نقطه ذوب بالا و برخی دیگر، نقطه ذوب پایینی دارند. نقطه ذوب هر ماده به نیروی جاذبه بین مولکولهای تشکیلدهنده و تفاوت آن بستگی دارد.
تا اینجا میدانیم تعریف مایع چیست و تبدیلهای مایع به جامد و جامد به مایع چگونه انجام میشوند. در ادامه، در مورد تبدیل گاز به مایع و مایع به گاز صحبت میکنیم.
تبدیل مایع به گاز چیست ؟
به فرایندی که طی آن مایع میجوشد و به گاز تبدیل میشود، تبخیر میگوییم. اگر آب را به اندازه کافی گرم کنیم، شروع به جوشیدن میکند. حبابهای بخار آب در آب جوش تشکیل میشوند. این حالت به این دلیل رخ میدهد که مولکولهای تشکیلدهنده آب، انرژی کافی برای غلبه بر نیروی جاذبه بین یکدیگر بهدست میآورند به حالت گازی (بخار) تبدیل میشوند. حبابها تشکیل شده از سطح آب بلند میشوند و به صورت بخار، ظرف را ترک میکنند.
نقطه جوش مایع به دمایی گفته میشود که در آن فشار بخار مایع برابر فشار اتمسفر محیط اطراف مایع میشود. در این دما، مایع به بخار تبدیل میشود. آب در دمای ۱۰۰ درجه سلسیوس به جوش میآید. نقطه جوش آب برابر ۱۰۰ درجه سلسیوس است. در این دما، فشار بخار آبِ مایع برابر با فشار محیط اطراف میشود. نقطه جوش برخی مواد جامد در جدول زیر نشان داده شدهاند.
| نام ماده | نقطه جوش برحسب کلوین |
| آلومینیوم | ۹۳۲ |
| مس | ۱۳۵۹ |
| طلا | ۱۳۳۶ |
| جیوه | ۲۳۴ |
همانطور که در جدول بالا دیده میشود، نقطه جوش برخی مواد بسیار بالا و نقطه ذوب برخی دیگر به نسبت بالا است. حتی نقطه جوش دستهای از مواد بسیار کم است. سوالی که ممکن است مطرح شود آن است که چرا برخی مواد نقطه جوش بالا و برخی دیگر، نقطه جوش پایینی دارند. نقطه جوش مولکول به ساختار آن بستگی دارد. برای تعیین نقطه جوش مولکولهای مختلف به گروههای عاملی آن توجه میکنیم. نقطه جوش نقش بسیار مهمی در تعیین ویژگیهای ساختاری و فیزیکی ترکیبات آلی ایفا میکند.
همانطور که گفتیم در نقطه جوش، فشار بخار مایع با فشار محیط اطراف آن برابر میشود. بنابراین، فشار محیط اطراف نقش بسزایی در تعیین نقطه جوش مایع دارد. به هنگام جوشیدن، پرانرژیترین مولکولها به گاز تبدیل میشوند و پس از پخش شدن، حبابها شکل میگیرند. این حبابها به سطح مایع میآیند و وارد اتمسفر میشوند. تبدیل از حالت مایع به گاز به انرژی نیاز دارد. به علاوه، مولکولهای گاز با ترک مایع، انرژی گرمایی را از مایع خارج میکنند. بنابراین، دمای مایع به هنگام جوشیدن، ثابت باقی میماند.
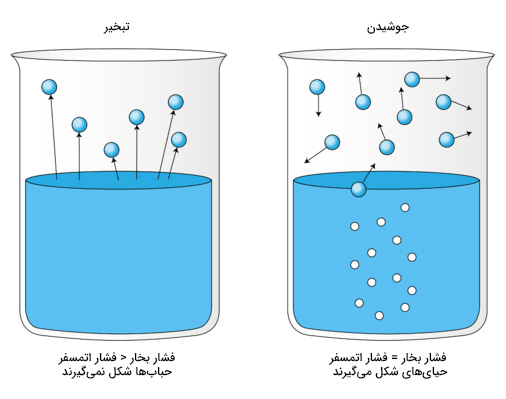
پس از پاسخ به پرسش مایع چیست، با انواع تغییر حالتهای مایع مانند ذوب یا تبخیر آشنا شدیم. در ادامه، در مورد تبدیل گاز به مایع صحبت میکنیم.
تبدیل گاز به مایع چیست ؟
به فرایند تبدیل گاز به مایع، میعان گفته میشود. به هنگام دوش آبِ گرم در حمام بسته، آینه داخل حمام مهآلود میشود. شاید برایتان سوال پیش بیاید که چرا این اتفاق رخ میدهد. قسمتی از آبِ داغِ دوش به بخار تبدیل و در تماس با سطوح سرد، مانند آینه داخل حمام، سرد میشود و انرژی از دست میدهد. ذرات آبِ سرد شده دیگر انرژی لازم برای غلبه بر نیروی جاذبه را ندارند. بنابراین به یکدیگر نزدیک و قطرات آب را تشکیل میدهند.

تا اینجا میدانیم مایع چیست و تبدیل آن به گاز یا جامد چگونه است. در ادامه، چگالی مایع و چگونگی محاسبه آن را با انجام آزمایشی ساده، توضیح میدهیم.
محاسبه چگالی مایع
اندازهگیری چگالی مایع مشابه اندازهگیری چگالی ماده جامد است:
- جرم مایع را بهدست میآوریم.
- حجم آن را بهدست میاوریم.
- جرم بهدست آمده را بر حجم تقسیم و چگالی را محاسبه میکنیم.
برای بهدست آوردن جرم مایع، ابتدا ظرف به همراه مایع درون آن را وزن میکنیم. سپس، آب درون ظرف را به ظرف دیگری منتقل و ظرف خالی را بار دیگر وزن میکنیم. جرم مایع برابر تفاضل جرم مایع و ظرف و ظرفِ خالی است. برای بهدست آوردن حجم مایع، از استوانه مدرج استفاده میکنیم. در مطالب بالا، چگونگی محاسبه حجم مایع را با استفاده از استوانه مدرج توضیح دادیم.
پرسش: برای محاسبه چگالی، ابتدا حجم مایع را بهدست آوریم یا جرم آن را؟
پاسخ: دو انتخاب وجود دارد:
- بِشِر به همراه مایع درون آن را وزن میکنیم. مایع را داخل استوانه مدرج میریزیم و بِشِرِ تنها را وزن میکنیم. جرم مایع برابر تفاضل جرم بِشِر و مایع درون آن و بِشِرِ تنها است. حجم مایع را نیز با استفاده از استوانه مدرج بهدست میآوریم. به این نکته توجه داشته باشید که در این روش، باقیمانده مایعِ چسبیده به دیوارههای بِشِر را به هنگام بهدست آوردن جرم، در نظر نمیگیریم. باقیمانده مایع حتی در اندازهگیری حجم نیز در نظر گرفته نمیشوند.
- مایع را داخل استوانه مدرج میریزیم و حجم آن را یادداشت میکنیم. سپس، استوانه مدرج را وزن میکنیم. در ادامه، مایع داخل استوانه را داخل ظرف دیگری میریزیم و استوانه خالی را وزن میکنیم. جرم مایع برابر تفاضل جرم استوانه و مایع درون آن و استوانه خالی است. به این نکته توجه داشته باشید که در این روش، اندازهگیری حجم با تمام مایع انجام شده است، اما در اندازهگیری جرم، قسمتی از مایع پس از انتقال آن به ظرفی دیگر به دیوارههای استوانه چسبیده است و این باقیماندهها در محاسبه جرم وارد نشدهاند.
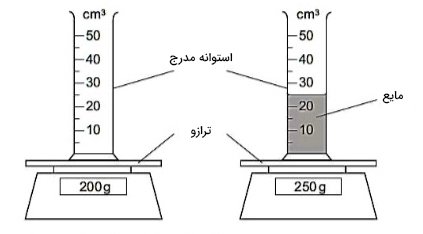
روش یک، روش صحیح است. هنگام بهدست آوردن جرم یا اندازهگیری حجم مایع، مایع چسبیده به ظرف خالی پس از ریختن مایع در ظرفی دیگر را به حساب نمیآوریم. بنابراین، ابتدا باید جرم را بهدست بیاوریم.
جمعبندی
در این مطلب سعی کردیم به پرسش مایع چیست به زبانی ساده پاسخ دهیم و برخی ویژگیهای مهم مایعات را توضیح دهیم. همانطور که گفتیم، مایع یکی از حالتهای ماده است که در آن نیروهای بینمولکولی از گاز قویتر و از جامد ضعیفتر است. برخی از مهمترین ویژگیهای مایع که در مورد آنها صحبت کردیم عبارت هستند از:
- پیوستگی: مولکولهای تشکیلدهنده مایع یکدیگر را جذب میکنند. اندازه نیروی جاذبه به نیروهای بینمولکولی پیونددهنده مولکولها وابسته است. پیوستگی را میتوان در کشش سطحی مایع مشاهده کرد.
- چسبندگی: نیروی جاذبه نهتنها بین مولکولهای مایع، بلکه بین مولکولهای مایع و مولکولهای ماده دیگری نیز میتواند وجود داشته باشد. اندازه این نیرو به نوع مایع و ماده در تماس با آن بستگی دارد. با استفاده از چسبندگی میتوانیم چسبیدن مایع به سطوح مختلف را توضیح داد. اثر مویینگی را نیز میتوانیم با استفاده از چسبندگی توضیح دهیم.
- حجم: گرچه مایع شکل مشخصی ندارد و به شکل ظرفهای مختلف درمیآید، حجم آن نسبتا ثابت باقی میماند و مهم نیست در چه ظرفی با چه شکلی ریخته شده باشد. تغییرات در فشار یا دما ممکن است حجم مایع را بسیار اندک، تغییر دهد. اما در حالت کلی حجم ثابت باقی میماند.
- تراکمپذیری: مایعات تراکمناپذیر هستند. این رفتار مایعات در مقایسه با گازها بسیار متفاوت است.
- بیشکلی: مایع، شکل ثابتی ندارد. مایعات، همانند گازها، شکل ظرفی را که در آن ریخته شدهاند به خود میگیرند.
- گرانروی: یکی دیگر از ویژگیهای مهم مایعات، گرانروی نام دارد. اندازه گرانروی در مایعات مختلف، متفاوت است و به نیروهای بینمولکولی، اندازه و نوع ذرات تشکیلدهنده مایع بستگی دارد.
- تبخیر: مولکولها در مایع، نسبتا آزادانه حرکت میکنند و با مولکولهای اطراف و دیواره ظرف برخورد میکنند. در اثر این برخوردها، انرژی بین مولکولها منتقل میشود. هنگامی که انرژی کافی به سطح مایع منتقل میشود، پیوندهای کشش سطحی شکسته و مایع تبخیر میشود.
آزمون سنجش
۱. کدام ویژگی ساختار مولکولی آب در حالت مایع آن را از جامد و گاز متمایز میکند؟
بین مولکولها فاصله بسیار زیادی وجود دارد و در تمام فضا پخش میشوند.
ذرات به طور نسبتا نزدیکاند و آزادی نسبی برای لغزش دارند.
مولکولها کاملا به هم چسبیدهاند و تقریبا بیحرکتاند.
شکل کلی مولکولها نسبت به حالتهای دیگر تغییر میکند.
در حالت مایع، ذرات آب نسبتا نزدیک به هم هستند اما آزادی نسبی برای لغزش و حرکت روی هم دارند. این وضعیت نه مانند حالت جامد با ترتیب منظم و نزدیکی حداکثری است و نه مانند گاز با فاصله زیاد بین مولکولها. شکل کلی مولکولها در سه حالت ثابت میماند و فقط فاصله و آزادی حرکت فرق میکند.
۲. در حالت مایع، آزادی حرکت ذرات نسبت به جامد چگونه است؟
ذرات مایع فقط در یک جهت مشخص حرکت میکنند.
ذرات مایع آزادانه روی هم میلغزند و فاصله آنها کمی بیشتر از جامد است.
ذرات مایع کاملا ثابت و بدون حرکت باقی میمانند.
ذرات مایع مانند گازها بهسرعت و کاملا آزادانه پخش میشوند.
در حالت مایع، ذرات نسبت به جامد آزادی بیشتری دارند زیرا به هم نزدیکاند اما پیوندشان ضعیفتر است و روی یکدیگر میلغزند. برخلاف حالت جامد که ذرات نظم مشخص و حرکت بسیار محدودی دارند، در مایع این لغزش سبب شکلپذیری و آزادی نسبی حرکت میشود. اما حرکت ذرات کاملا آزادانه و سریع مثل گاز نیست.
۳. مایع چه تفاوتی از نظر شکل و حجم با جامد و گاز دارد؟
مایع شکل ظرف را میگیرد اما حجمش ثابت است.
مایع حجم و شکل ثابتی مانند جامد دارد.
مایع مانند گاز کل ظرف را پر میکند.
مایع کاملا بدون حجم و شکل است.
در حالت مایع، مولکولها نزدیک یکدیگرند اما آزادی حرکت بیشتری نسبت به جامد دارند، بنابراین مایع شکل ظرف را به خود میگیرد اما حجم مشخصی دارد و مانند گاز کل ظرف را پر نمیکند. این موضوع مایع را از جامد (که هم حجم و هم شکل ثابت دارد) و از گاز (که شکل و حجم ظرف را به طور کامل میگیرد) متمایز میکند.
۴. گرانروی (ویسکوزیته) یک مایع به چه عواملی بستگی دارد؟
تنها به نوع ظرف و رنگ مایع وابسته است.
نیروهای بینمولکولی، دما و اندازه مولکولها در آن تاثیرگذارند.
فقط به وجود گاز محلول در مایع بستگی دارد.
صرفا به فشار محیط و مقدار جرم مایع وابسته است.
گرانروی (ویسکوزیته) تحت تاثیر نیروهای بینمولکولی، دمای مایع و اندازه مولکولها قرار دارد. هرچه نیروهای بینمولکولی قویتر یا مولکولها بزرگتر باشند، گرانروی بیشتر است و با افزایش دما معمولا گرانروی کاهش مییابد.
۵. برای اندازهگیری حجم مایع در هنگام فرو بردن جسمی نامنظم درون ظرف، کدام روش مناسب است؟
استفاده از استوانه مدرج و محاسبه اختلاف حجم پیش و پس از غوطهوری جسم
تخمین حجم با توجه به وزن جسم و مایع
اندازهگیری حجم ظرف پیش از ریختن مایع
استفاده تنها از جدول تبدیل واحدهای حجم
در روش درست، با استفاده از استوانه مدرج ابتدا حجم مایع سنجیده میشود و پس از فرو بردن جسم نامنظم به طور کامل در داخل استوانه، حجم جدید یادداشت میشود. اختلاف این دو مقدار، حجم واقعی جسم است. روشهایی مانند تخمین براساس وزن یا اکتفا به جدول واحدها نمیتوانند حجم جسم نامنظم را تعیین کنند.
۶. وقتی دمای یک مایع افزایش مییابد، گرانروی (ویسکوزیته) آن چه تغییری میکند و دلیل این رخداد چیست؟
گرانروی کاهش مییابد، چون جرم مایع کم میشود.
گرانروی تغییری نمیکند، چون حجم مایع ثابت میماند.
گرانروی افزایش پیدا میکند، چون نیروی بینمولکولی بیشتر میشود.
گرانروی کاهش پیدا میکند، زیرا جنبش مولکولها بیشتر میشود.
افزایش دما موجب کاهش گرانروی (ویسکوزیته) مایع میشود، چون با گرمتر شدن، مولکولها آزادانهتر و سریعتر حرکت میکنند و مقاومت مایع در برابر جاری شدن کمتر میشود.
۷. تفاوت کلیدی بین نیروهای چسبندگی و پیوستگی در مایعات چیست؟
پیوستگی خاصیت کشش سطحی را کاهش میدهد، چسبندگی باعث افزایش کشش سطحی میشود.
چسبندگی تنها در دماهای بالا رخ میدهد اما پیوستگی مستقل از دما است.
پیوستگی باعث پهن شدن قطره روی شیشه میشود و چسبندگی منجر به کروی ماندن قطره روی سطوح میشود.
پیوستگی مربوط به جاذبه بین مولکولهای خود مایع و چسبندگی مربوط به جاذبه بین مولکولهای مایع و سطح جامد است.
پیوستگی به معنی جاذبه و ارتباط بین مولکولهای خود مایع است که عامل اصلی ایجاد کشش سطحی نیز است. در مقابل، چسبندگی به نیروهای بین مولکولهای مایع و سطح جامد اشاره دارد و تاثیر آن را میتوان در رفتار مایع روی سطوح مختلف مشاهده کرد، مانند پهن یا کروی باقی ماندن قطره آب روی سطح.
۸. تفاوت کشش سطحی آب و جیوه چه اثری بر ظاهر سطح این دو مایع در لوله شیشهای دارد؟
هر دو مایع سطحی صاف و افقی در لوله شیشهای ایجاد میکنند.
سطح آب و جیوه در لوله شیشهای هر دو به شکل کروی تشکیل میشود.
سطح آب در لوله شیشهای به صورت مقعر و سطح جیوه به صورت محدب دیده میشود.
در لوله شیشهای سطح آب محدب و سطح جیوه مقعر ظاهر میشود.
در لوله شیشهای، کشش سطحی و نوع نیروها باعث میشود آب با شیشه پیوستگی بیشتری داشته باشد و سطح آن به شکل مقعر دیده شود، یعنی لبهها بالاتر از مرکز باشند. در حالی که جیوه به دلیل چسبندگی کمتر و پیوستگی قویتر بین مولکولی خودش، سطحش به صورت محدب دیده میشود (مرکز بالاتر از لبه).
۹. برای خواندن حجم دقیق مایع با استوانه مدرج، کدام نکته اهمیت بیشتری دارد؟
هم زدن مایع قبل از اندازهگیری
نگاه کردن به سطح مقعر یا محدب مایع از بالا
تراز بودن چشم با پایینترین سطح مایع
افزودن مایع تا بالاترین خط استوانه
برای خواندن درست حجم مایع، باید چشم دقیقا همتراز با پایینترین نقطه سطح مایع (قسمت مقعر در آب، یا محدب در جیوه) باشد تا خطای دید رخ ندهد. نگاه کردن از بالا یا زاویهدار باعث اشتباه میشود و افزودن تا بالاترین خط یا هم زدن مایع، تاثیری در دقت خواندن حجم ندارد.
۱۰. برای کاهش خطا هنگام تعیین چگالی مایع در آزمایشگاه، ترتیب مناسب مراحل انجام کار کدام است؟
ابتدا حجم مایع را تعیین، سپس جرم ظرف تنها را اندازهگیری کنیم.
ابتدا جرم ظرف و مایع را میسنجیم سپس حجم مایع را با استوانه مدرج اندازه میگیریم.
اول حجم مایع را مشخص میکنیم سپس وزن ظرف و مایع را میسنجیم.
همزمان جرم و حجم مایع را در ظرف محاسبه و ثبت میکنیم.
برای اندازهگیری دقیق چگالی مایع، باید ابتدا جرم ظرف حاوی مایع را بسنجیم و سپس حجم مایع را با استوانه مدرج تعیین کنیم. دلیل این ترتیب آن است که اگر ابتدا حجم مایع برداشته شود و بعد جرم ظرف سنجیده شود، ممکن است بخشی از مایع به ظروف قبلی بچسبد و جرم واقعی مایع در نظر گرفته نشود. در نتیجه، سنجش جرم پیش از حجم به افزایش دقت و کاهش خطا کمک میکند.
۱۱. برای تبدیل حجم مایع از میلی لیتر (ml) به سانتی متر مکعب (cm³) و لیتر (L)، باید به چه نکته ای توجه کرد؟
هر میلی لیتر، معادل ده سانتی متر مکعب است.
هر میلی لیتر، معادل صد لیتر است.
هر میلی لیتر، معادل یک لیتر است.
هر میلی لیتر، برابر با یک سانتی متر مکعب است.
حجم یک میلی لیتر دقیقا برابر با یک سانتی متر مکعب است و تبدیل آنها مستقیم انجام میشود.
۱۲. اگر هنگام اندازهگیری حجم مایع با استوانه مدرج با خطای دید مواجه شوید، بهترین کار برای افزایش دقت چیست؟
حجم مایع را در چند ظرف مختلف اندازه بگیرید و معدل بگیرید.
مقدار حجم را از بالای استوانه مدرج بخوانید.
چشم را با پایینترین نقطه سطح مایع همتراز قرار دهید.
در هنگام خواندن عدد، به شکل مقعر یا محدب بودن سطح مایع توجهی نداشته باشید.
قرار دادن چشم در خط افق همتراز با پایینترین نقطه سطح مایع باعث میشود مقدار واقعی حجم بدون خطای دید خوانده شود. اگر چشم بالاتر یا پایینتر از این نقطه باشد، مقدار بیشتر یا کمتر از واقعیت دیده میشود. خواندن عدد از بالای استوانه یا توجه نکردن به مقعر یا محدب بودن سطح مایع هر دو خطا ایجاد میکنند، و اندازهگیری چندباره در ظروف متفاوت لزوما مشکل خطای دید را رفع نمیکند.
۱۳. کدام عامل اصلی تفاوت در شکل سطح آب و جیوه در لوله شیشهای را توضیح میدهد؟
قدرت بالای نیروهای پیوستگی درون آب
تفاوت نیروهای چسبندگی مایع و سطح شیشه
اندازه کوچکتر مولکولهای آب نسبت به جیوه
گرانروی (ویسکوزیته) متفاوت بین آب و جیوه
دلیل اصلی تفاوت شکل سطح آب (مقعر) و جیوه (محدب) تفاوت در نیروهای چسبندگی بین مایع و سطح شیشه است. آب تمایل به چسبیدن به شیشه دارد و سطح آن پایین کنارهها کشیده میشود (سطح مقعر)، اما جیوه کشش سطحی بالاتری میان مولکولهایش دارد و کمتر به شیشه میچسبد، در نتیجه لبه سطح بالا میرود (سطح محدب). قدرت نیروهای پیوستگی یا کوچکی مولکولها و حتی گرانروی، این تفاوت را ایجاد نمیکنند. آنچه مهم است چگونگی تعامل مایع با سطح جامد (یعنی چسبندگی) است.
۱۴. اگر یک مایع با دمای بالا را به طور ناگهانی سرد کنیم، چه تغییری در چگالی آن حاصل میشود و دلیل این امر چیست؟
چگالی مایع افزایش مییابد چون ذرات به هم نزدیکتر میشوند.
چگالی مایع کاهش مییابد چون جرم مایع کم میشود.
چگالی مایع ثابت میماند چون حجم آن تغییری نمیکند.
چگالی مایع کاهش مییابد چون فاصله ذرات بیشتر میشود.
هنگام سرد شدن ناگهانی مایع، حرکات مولکولی کندتر و فاصله ذرات کمتر میشود. به همین دلیل، حجم مایع اندکی کاهش یافته و با ثابت ماندن جرم، چگالی بیشتر میشود.
۱۵. در آزمایش افتادن توپ در مایعات مختلف، اگر توپ سریعتر به کف برسد، کدام ویژگی مایع بیشتر نشان داده میشود؟
کشش سطحی بیشتر در سطح مایع
شکل سطح مقعرتر مایع در ظرف
چگالی بالاتر مایع نسبت به جامد
نیروی بینمولکولی ضعیفتر میان مولکولهای مایع
سریعتر رسیدن توپ به کف ظرف نشاندهنده مقاومت کمتر مایع در برابر جاری شدن است که به معنای گرانروی پایینتر و در نتیجه نیروهای بینمولکولی ضعیفتر در مایع است. «نیروی بینمولکولی ضعیفتر میان مولکولهای مایع» باعث میشود حرکت ذرات آسانتر شود و توپ سریعتر پایین برود.
۱۶. کدام عامل، علاوه بر دما، در تعیین نقطه جوش یک مایع موثر است؟
قدرت نیروهای بینمولکولی در مایع
شکل ظرف استفاده شده در آزمایش
رنگ ظاهری مایع
میزان نور محیط هنگام جوشیدن
قدرت نیروهای بینمولکولی در مایع بر نقطه جوش آن تاثیر میگذارد. هرچه این نیروها قویتر باشند، مایع برای تبدیل به بخار به دمای بیشتری نیاز دارد و نقطه جوش بالاتر میرود.