جامد چیست؟ – تعریف و انواع حالت جامد + مثال
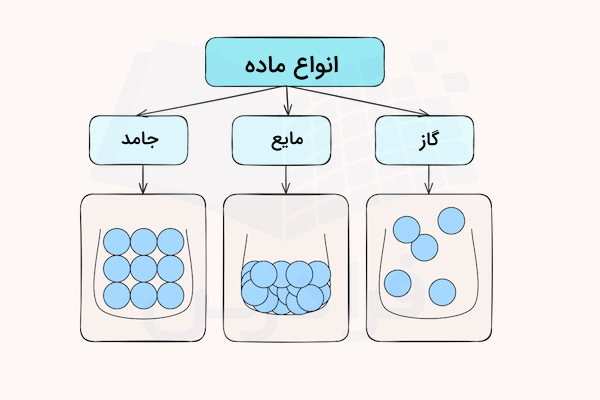
هر چیزی در جهان، حتی من و شما، صندلی که بر روی آن مینشینیم، غذایی که میخوریم، نوشیدنی که مینوشیم، فضا را اشغال میکند که به آن ماده گفته میشود. به این نکته باید توجه داشته باشیم که هوایی که نفس میکشیم نیز فضا را اشغال میکند، اما آن را نمیبینیم. ماده حالتهای مختلفی مانند جامد، مایع و گاز دارد. در این مطلب از مجله فرادرس به پرسش جامد چیست به زبان ساده پاسخ میدهیم. پس از آشنایی با مفهوم جامد، در مورد انواع جامد و ویژگیهای آنها صحبت خواهیم کرد.
- میآموزید جامد چیست و آزمایشهایی را برای درک مواد جامد بررسی میکنید.
- با انواع مختلف مواد جامد آشنا میشوید.
- میتوانید ساختارهای مختلف جامدهای بلوری را تشخیص دهید.
- با انواع سلولهای واحد در جامد آشنا میشوید و جامدهای بلورین را میشناسید.
- میتوانید تفاوت جامد یونی و مولکولی را تشخیص دهید.
- با جامدهای شبکه کووالانسی آشنا میشوید.


جامد چیست ؟
جامد یکی از حالتهای ماده است. جامدها، همیشه شکلهای مشخص و اندازههای مختلفی دارند. آنها میتوانند نرم، زبر یا سخت باشند. اگر جسم جامد کوچک و سبک باشد، به راحتی میتوانید آن را در دست خود نگه دارید.
ماده جامد شکل مشخص خود را دارد. با کمی دقت به اطراف خود مثالهای مختلفی از مواد جامد را مشاهده خواهید کرد:
- لپتاپ یا کامپیوتری که استفاده میکنید.
- ماشین یا اتوبوسی که در خیابان سوار میشوید.
- کفشی که میپوشید.
- کتابی که میخوانید یا کاغذی که بر روی آن مینویسید.
- مداد یا خودکاری که برای نوشتن استفاده میکنید.
- صندلی که بر روی آن مینشینید.
- لیوانی که داخل آن چای یا آب مینوشید.
- عینکی که به هنگام مطالعه استفاده میکنید.
- کلیدی که برای قفل کردن در خانه از آن استفاده میکنید.
ماده جامد، شکل و حجم مشخصی دارد. به مقدار ماده موجود، حجم آن ماده گفته میشود. برای آشنایی بهتر با مواد جامد آزمایش ساده زیر را انجام میدهیم.
آزمایش آشنایی با مواد جامد
برای اینکه یاد بگیرید جامد چیست میتوانید آزمایش زیر را بهآسانی در خانه انجام دهید. میدانیم ماده از سه حالت اصلی جامد، مایع و گاز تشکیل شده است. قبل از شروع آزمایش، کمی به اطراف خود دقت کنید. مواد جامد بسیاری، مانند خودکار، لباس، موبایل و عینک، را مشاهده خواهید کرد. پس از لمس این مواد متوجه میشوید که شکل آنها ثابت میماند. شاید از خود بپرسید که چگونه میتوان شکل ماده جامد را تغییر داد.
برای پاسخ به پرسش جامد چیست و پرسش مطرح شده، مواد زیر را انتخاب میکنیم:
- کاغذ
- گیره کاغذ
- بطری پلاستیکی
- فلفل
برای انجام این آزمایش ساده، به سه نکته زیر دقت کنید:
- مواد انتخاب شده را قبل و بعد از انجام آزمایش به دقت مشاهده کنید.
- عمل انجام شده برای تغییر اندازه، شکل یا بافت مواد داده شده را مشخص کنید.
- مشاهدات خود را یادداشت کنید.
برای راحتی کار و درک بهتر آزمایش جدولی به شکل زیر تهیه کنید.
| مواد | کار انجام شده | اثر/تغییر |
| کاغذ | ||
| گیره کاغذ | ||
| بطری پلاستیکی | ||
| فلفل |
آزمایش را با کاغذ شروع میکنیم. ابعاد کاغذ قبل از انجام آزمایش برابر ۲۰ در ۴۰ سانتیمتر است. آن را با استفاده از قیچی به شکل مثلثهای کوچکی میبریم.

در ادامه، گیره کاغذ را با استفاده از دست، باز میکنیم و آن را به شکل دلخواهی مانند قلب، درمیآوریم.

اکنون یکی از بطریهای آب معدنی که مصرف کردهاید را انتخاب کنید و شکل ظاهری آن را با استفاده از یکی از روشهای زیر، تغییر دهید:
- بطری پلاستیکی را زیر پای خود با تمام قدرت فشار دهید.
- بطری را بین دو دست خود با تمام قدرت فشار دهید.
همانطور که در تصویر زیر مشاهده میکنید، شکل ظاهری بطری به طور کامل تغییر کرده است.

در پایان، دانه فلفل را با استفاده از هاون بکوبید و به شکل دانههای با اندازه بسیار کوچکتر درآورید. به هنگام کوبیدن دانههای فلفل بسیار مواظب باشید.

اکنون جدول داده شده در بالا را با پاسخ دادن به پرسشهای مطرح شده در ادامه، کامل میکنیم.
کاغذ
- کاغذ را قیچی کردیم.
- آیا شکل کاغذ تغییر کرد؟ بله، کاغذ به مثلثهای کوچک بریده شد.
- آیا اندازه کاغذ تغییر کرد؟ بله، اندازه آن کوچکتر شد.
گیره کاغذ
- گیره کاغذ را باز و آن را به شکل قلب درآوردیم.
- آیا شکل گیره تغییر کرد؟ بله، به شکل قلب درست شد.
- آیا اندازه گیره تغییر کرد؟ خیر، تنها به شکل متفاوتی در آمد.
بطری پلاستیکی
- بطری پلاستیکی از طریق فشردن به شکل دیگری در آمد.
- آیا شکل بطری پلاستیکی تغییر کرد؟ بله
- آیا اندازه بطری تغییر کرد؟ بله، اندازه آن کوچکتر شد.
- آیا بافت بطری تغییر کرد؟ بله
فلفل
- دانههای فلفل با استفاده از هاون کوبیده شدند.
- آیا اندازه دانههای فلفل تغییر کرد؟ بله، کوچکتر شدند.
- آیا شکل دانههای فلفل تغییر کرد؟ بله
با توجه به پرسشهای پاسخ داده شده، جدول بالا به شکل زیر کامل میشود.
| مواد | کار انجام شده | اثر / تغییر |
| کاغذ | بریدن | شکل و اندازه |
| گیره کاغذ | خم کردن | شکل |
| بطری پلاستیکی | فشار دادن | شکل، اندازه و بافت |
| فلفل | خرد کردن | شکل و اندازه |
تغییر فیزیکی در جامد چیست ؟
اندازه، شکل و بافت مواد جامد را میتوانیم با کارهای مختلف مانند فشردن یا بریدن، تغییر دهیم. به این نکته توجه داشته باشید که ماده جدیدی پس از تغییر شکل ماده جامد، تشکیل نخواهد شد. به این تغییر، تغییر فیزیکی گفته میشود.
تغیرات فیزیکی زیادی مانند کشیدن، فشردن و ذوب شدن وجود دارند که با استفاده از آنها میتوان اندازه یا شکل ماده جامد را تغییر داد. شاید از خود بپرسید که ذوب شدن به چه معنا است. در ادامه، با انجام آزمایشی ساده، آن را توضیح خواهیم داد.
به طور قطع شکلات کاکائویی خوردهاید و از طعم آن بسیار لذت بردهاید. مقداری شکلات کاکائویی تختهای را با استفاده از دست خرد کنید و آن را داخل ظرفی فلزی قرار دهید. ظرف را بر روی اجاق گاز بگذارید و شعله آن را روشن کنید. پس از گذشت مدت زمان مشخصی خواهید دید که تکه شکلاتهای سفت، نرم و روان شدهاند. در واقع، شما با انجام این کار، شکلات را از حالت جامد به مایع تبدیل کردهاید که به آن ذوب شدن گفته میشود.

در این آزمایش ساده، اندازه و شکل مواد جامد مختلف را از طریق فشردن، بریدن، ذوب کردن یا خرد کردن، تغییر دادیم.
اکنون میتوانیم به پرسش جامد چیست به زبان ساده پاسخ دهیم. همچنین، فهمیدیم که تغییر شکل در جامد چیست و این تغییر را با روشهای مختلف فیزیکی بررسی کردیم. در ادامه، با انواع مواد جامد، ویژگیها و چگونگی تشخیص آنها با یکدیگر آشنا خواهیم شد.
انواع مواد جامد چیست ؟
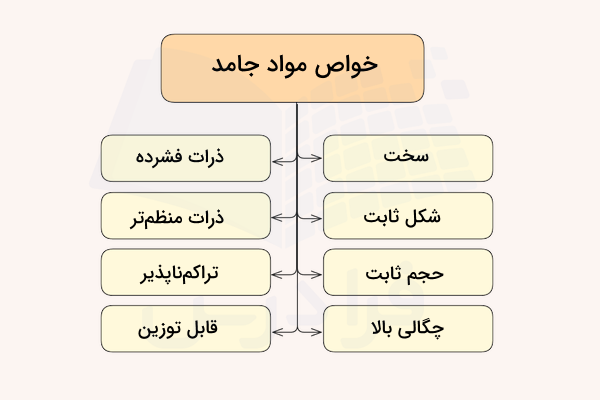
مواد جامد در حالت کلی به دو دسته آمورف (بینظم یا بیشکل) و بلوری (کریستالی) تقسیم میشوند. هنگامی که مایعی سرد شود، منجمد و جامدی بلوری را تشکیل میدهد. در جامدات بلوری، اتمها، یونها یا مولکولها در الگوی تکرار شونده مشخصی قرار گرفتهاند. اما همیشه اینطور نخواهد بود. اگر مولکولهای مایع به هنگام منجمد شدن نتوانند به صورت الگویی منظم کنار یکدیگر قرار بگیرند، به جامد تشکیل شده، جامد آمورف یا بینظم گفته میشود. ذرات داخل چنین جامدی فاقد ساختار منظم داخلی هستند و به صورت تصادفی مرتب شدهاند.

همانطور که در تصویر فوق مشخص است، مولکولها، اتمها یا یونها در جامد بلوری بر طبق الگویی منظم در کنار یکدیگر قرار گرفتهاند. اما چیدمان ذرات در جامد بینظم، به طور کامل تصادفی است.
نیروهای بین مولکولی در جامدات بلوری یکسان هستند. این نوع جامدات ناهمسانگرد و دارای نقطه ذوب مشخصی هستند. الماس یکی از مهمترین مثالهای جامد بلوری است. در مقابل، نیروهای بین مولکولی در جامدات بیشکل یا آمورف یکسان نیستند. همچنین، فاصله بین هر دو ذره این نوع جامد، متغیر است. شکل هندسی مشخصی ندارند. جامدات آمورف به عنوان مایعات فوق سرد نیز شناخته میشوند و همسانگرد هستند.
شیشه، یکی از مهمترین مثالهای جامد بینظم است. کاربردهای شیشه عبارت هستند از:
- به طور گسترده در ساختمانسازی استفاده میشود.
- از آن در بستهبندی محصولات آرایشی و بهداشتی یا غذایی استفاده میشود.
به منظور درک بهتر تفاوت بین جامدات بلوری و آمورف، به جدول زیر دقت کنید.
| جامدات بلوری | جامدات آمورف یا بینظم |
| هندسه منظم و مشخص، ذرات تشکیلدهنده دارای نظم بلندبرد و کوتاهبرد | ذرات تشکیلدهنده نامنظم و تصادفی، شکل هندسی نامشخص |
| دمای ذوب بالا و مشخص | دمای ذوب پایین |
| شکلهای خارجی کریستالها به هنگام تشکیل، تمایل به تکرار دارند. | جامدات آمورف به هنگام تشکیل، نظم خارجی ندارند. |
| کریستالها پس از برش به وسیله چاقو، سطح تمیز و درخشانی دارند. | لبههای برشی جامدات آمورف، نامنظم است. |
| نیروهای متوسط وارد شده به این نوع جامدات قادر به تغییر شکل آنها نیستند، زیرا کریستالها بسیار محکم هستند. | سختی جامدات بینظم به اندازهای کم است که با کوچکترین نیروی وارد شده بر آنها، تغییر شکل خواهند داد. |
| کریستالها، جامدات حقیقی هستند. | آمورفها، مایعات فوق سرد یا شبه جامد هستند. |
| کریستالها، ناهمسانگرد هستند. | جامدات آمورف، همسانگر هستند. |
| پتاسیم، نیترات و مس نمونههایی از جامدات بلوری هستند. | سلفون یا شیشه نمونههایی از جامدات آمورف هستند. |
پس از پاسخ به پرسش جامد چیست و آشنایی با دستهبندی اصلی مواد جامد، انواع جامدهای بلوری را توضیح میدهیم. لازم به ذکر است که برای یادگیری بیشتر در مورد جامدات میتوانید از مجموعه آموزش جامدات فرادرس نیز استفاده بکنید.
جامدهای بلوری
جامدات بلوری براساس نوع پیوند حاکم بر آنها به چهار نوع تقسیم میشوند:
- جامدهای یونی
- جامدهای فلزی
- جامدهای مولکولی
- جامدهای شبکه کووالانسی
پیوندهای حاکم بر این جامدها، یونها، مولکولها و اتمها را در شبکه بلوری در کنار یکدیگر نگه میدارد.
در ادامه، در مورد ساختارهای جامدات بلوری و انواع آنها توضیح خواهیم داد.
ساختار جامد بلوری
ذرات تشکیلدهنده جامد بلوری در شبکه بلوری قرار دارند. کوچکترین واحد سازنده شبکه بلوری، سلول واحد نامیده میشود.
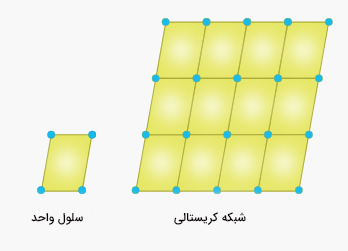
شبکه بلوری، مکان ذرات تشکیلدهنده جامد (اتمها، یونها یا مولکولها) را در سهبعد، نشان میدهد. این مکانها توسط دایرههایی توپر به نام نقطههای بلوری، در شکل بالا نشان داده شدهاند.
سلول واحد از یک اتم یا یون در هر گوشه تشکیل شده است. گاهی، یک اتم یا یون داخل سلول واحد قرار دارد. سلولهای واحد به دو دسته اصلی مرکز پر و سلولهای اولیه تقسیم میشوند.
- به سلول واحد دارای یک نقطه داخلی، سلول مرکز پر گفته میشود.
- اگر هیچ نقطهای درون سلول واحد قرار نداشته باشد، به آن سلول اولیه میگوییم.
انواع سلول های واحد در جامد چیست ؟
ساختار کلی و شکل جامد بلوری به نوع سلول واحد آن بستگی دارد. ریاضیدانی فرانسوی به نام «آگوست براویس» (August Bravais) هفت سلول واحد را معرفی کرد. این سلولهای واحد به عنوان سلولهای واحد براوه نیز شناخته میشوند. این هفت سلول واحد در دو مورد با یکدیگر تفاوت دارند:
- طولهای نسبی لبهها در امتداد سه محور
- زاویه بین لبهها
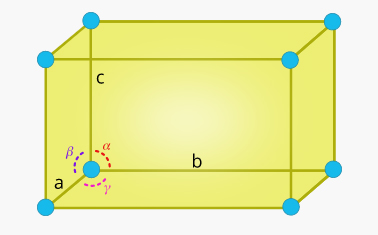
هفت نوع سلول واحد عبارت هستند از:
- سلول واحد مکعبی
- سلول واحد تتراگونال (چهارگوشه)
- سلول واحد اورتورومبیک (راستلوزی)
- سلول واحد رومبوهدرال
- سلول واحد هگزاگونال (ششگوشه)
- سلول واحد مونوکلینیک (تکشیب)
- سلول واحد تریکلینیک (سهشیب)
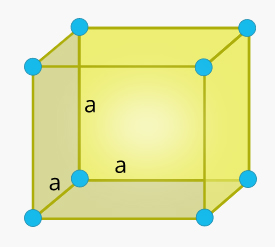
سلول واحد مکعبی در جامد چیست ؟
شکل این سلول واحد مکعبمربع و تمام ضلعهای آن با یکدیگر برابر هستند. همچنین، زاویه بین هر دو ضلع برابر ۹۰ درجه است.
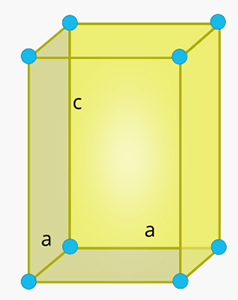
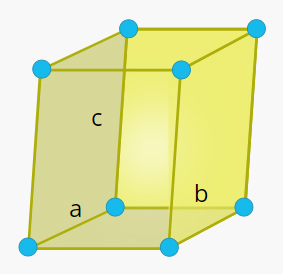
سلول واحد چهار گوشه در جامد چیست ؟
شکل این سلول واحد مکعبمستطیل و دو ضلع و آن با یکدیگر برابر هستند. همچنین، زاویه بین هر دو ضلع برابر ۹۰ درجه است.
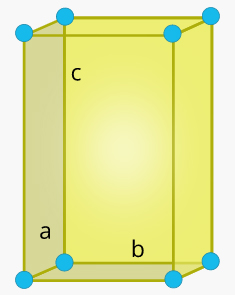
سلول واحد راست لوزی در جامد چیست ؟
شکل این سلول واحد مکعبمستطیل است، اما ضلعهای و و آن با یکدیگر برابر نیستند. همچنین، زاویه بین هر دو ضلع برابر ۹۰ درجه است.
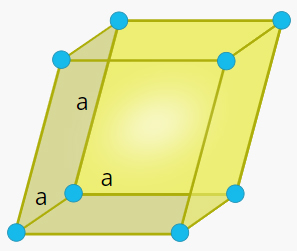
سلول واحد رومبوهدرال در جامد چیست ؟
شکل این سلول واحد متوازیالاضلاع سهبعدی و تمام ضلعهای آن با یکدیگر برابر هستند. همچنین، زاویههای و و با یکدیگر برابر و مخالف ۹۰ درجه هستند.
سلول واحد شش گوشه در جامد چیست ؟
قاعده این سلول واحد ششگوشه و طول هر ضلع برابر و ارتفاع آن برابر است. همچنین، زاویه بین و برابر ۹۰ درجه و زاویه برابر ۱۲۰ درجه است.
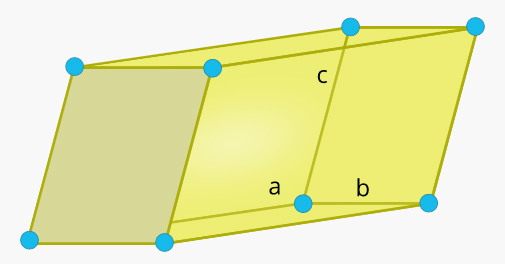
سلول واحد تک شیب در جامد چیست ؟
قاعده این سلول واحد متوازیالاضلاع و طول هر یک از ضلعهای آن برابر و و ارتفاع آن برابر خواهد بود. همچنین، زاویه بین و برابر ۹۰ درجه و زاویه مخالف ۹۰ درجه است.
سلول واحد سه شیب در جامد چیست ؟
قاعده این سلول واحد متوازیالاضلاع و طول هر یک از ضلعهای آن برابر و و ارتفاع آن برابر خواهد بود. همچنین، سه زاویه و و با یکدیگر برابر نیستند و مخالف ۹۰ درجه هستند. .
جدول زیر مشخصات هر یک از این سلولهای واحد به همراه مثال را نشان میدهد.
| سلول واحد | طول نسبی هر ضلع | زاویهها | مثال |
| مکعبی | |||
| چهارگوشه | |||
| راستلوزی | |||
| رومبوهدرال | |||
| ششگوشه | |||
| تکشیب | |||
| سهشیب |
پس از آشنایی با مفهوم جامد چیست و انواع آن، در ادامه در مورد انواع جامدهای بلوری توضیح میدهیم.
انواع جامدهای بلورین چیست ؟
جامدهای بلورین براساس پیوند حاکم بر آنها به چهار نوع جامد فلزی، یونی، مولکولی و کووالانسی تقسیم میشوند. در ادامه، در مورد هر یک از انواع این جامدها صحبت خواهیم کرد.
جامدهای یونی
جامد یونی از یون تشکیل شده است. گروه اول جدول تناوبی و عنصرهایی مانند لیتیوم یا سدیم را در نظر بگیرید. این عنصرها، یک الکترون در بیرونیترین لایه الکترونی خود دارند، بنابراین تمایل زیادی به از دست دادن آن و رسیدن به حالت پایدار خواهند داشت. به بیان دیگر، آرایش الکترونی این عناصر پس از دست دادن الکترون لایه بیرونی، به آرایش الکترونی گاز نجیب تبدیل میشود. همچنین، عناصر گروه دوم جدول تناوبی نیز تمایل به از دست دادن دو الکترون لایه بیرونی و رسیدن به ساختار الکترونی گازهای نجیب دارند.
اکنون عنصرهای گروه هفتم جدول تناوبی یا هالوژنها، مانند کلر یا فلوئور، را در نظر بگیرید. این عناصر هفت الکترون در بیرونیترین لایه خود دارند، بنابراین با گرفتن تنها یک الکترون به ساختار الکترونی پایدار خواهند رسید. همچنین، عنصرهای گروه ششم، مانند اکسیژن و گوگرد، تمایل به گرفتن دو الکترون و رسیدن به آرایش الکترونی پایدار دارند. بنابراین، عنصرهای گروههای اول و دوم (فلز) جدول تناوبی تمایل به گرفتن الکترون و عنصرهای گروه ششم و هفتم (نافلز) تمایل به از دست دادن الکترون دارند. آیا عناصر این دو گروه با قرار گرفتن در کنار یکدیگر، به خواسته خود میرسند؟
فرض کنید سدیم و کلر را با یکدیگر مخلوط میکنیم. در این حالت، سدیم ممکن است الکترون از دست بدهد و کلر، الکترون آزاد شده را دریافت کند. در این صورت، کاتیونهای سدیم یا یونهای سدیم با بار مثبت خواهیم داشت. در مقابل، کلر با دریافت الکترون سدیم به آنیون کلرید تبدیل میشود. اکنون تعدادی کاتیونهای مثبت و آنیونهای منفی در کنار یکدیگر قرار گرفتهاند. همانطور که میدانیم بارهای مثبت و منفی یکدیگر را جذب میکنند، بنابراین این یونهای مثبت و منفی جذب یکدیگر خواهند شد و ساختاری شبکهای به صورت زیر را تشکیل میدهند. به ساختار نشان داده شده در تصویر زیر، سدیم کلرید یا همان نمک طعام گفته میشود.
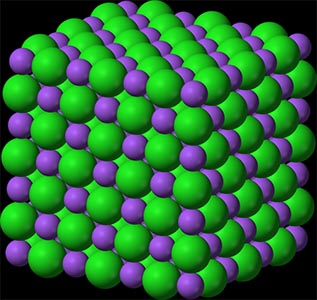
علاوه بر نمک طعام، ساختارهای یونی بسیاری وجود دارند. بسیاری از آنها، مانند پتاسیم کلرید یا سدیم فلوئورید، به عنوان نمک طبقهبندی میشوند. تاکنون ساختارهای یونی گفته شده، از کنار هم قرار گرفتن عنصرهای گروه یکم و هفتم جدول تناوبی در کنار یکدیگر، تشکیل شدهاند. اکنون دو عنصر منیزیم از گروه دوم و اکسیژن از گروه ششم جدول تناوبی را در نظر بگیرید. در این حالت، منیزیم دو الکترون از دست میدهد، بنابراین به یونی با دو بار مثبت تبدیل خواهد شد. دو الکترون آزاد شده توسط اکسیژن جذب میشوند. در نتیجه، اکسیژن به یونی با دو بار منفی تبدیل خواهد شد. در پایان، این دو یون یکدیگر را جذب میکنند و جامد یونی را تشکیل میدهند.
ویژگیهای جامد یونی
در ابتدا در مورد نقطه ذوب جامدهای یونی صحبت میکنیم. یونهای مثبت و منفی در این جامدات با استفاده از نیروی الکترواستاتیکی قوی، یکدیگر را جذب میکنند. بنابراین، نقطه ذوب بالایی دارند. اکنون سوالی که ممکن است مطرح شود آن است که نقطه ذوب کدام یک از جامدهای یونی بالاتر است؟
دو جامد یونی کلرید سدیم () و اکسید منیزیم () را در نظر بگیرید. برای مقایسه نقطه ذوب آنها باید به مقدار نیروی الکترواستاتیکی بین یونهای مثبت و منفی توجه کنیم. مقدار این نیرو به دو عامل بستگی دارد:
- بزرگی بار
- شعاع اتمهای تشکیلدهنده ساختار شبکه
در اکسید منیزیم، بار یونها ۲- و ۲+، در حالیکه در کلرید سدیم مقدار بار یونها برابر ۱- و ۱+ است. بنابراین، مقدار نیروی الکترواستاتیکی و نقطه ذوب در اکسید منیزیم بزرگتر از کلرید سدیم خواهد بود. نقطه ذوب برابر ۲۸۲۵ درجه سلسیوس و برابر ۸۰۱ درجه سلسیوس است.
مثال مقایسه نقطه ذوب
دو جامد یونی و را در نظر بگیرید. نقطه ذوب کدام یک از این دو ساختار، بزرگتر است؟
پاسخ:
فلوئور از کلر کوچکتر است. این دو عنصر با دریافت الکترون از سدیم، به یون با بار منفی یک تبدیل میشوند. در این حالت، یون فلوئور باز هم از یون کلر کوچکتر خواهد بود. هر چه اندازه یونهای تشکیلدهنده جامد یونی کوچکتر باشد، مقدار نیروی الکترواستاتیکی بزرگتر خواهد بود. در نتیجه، نقطه ذوب بالاتر از و برابر ۹۹۶ درجه سلسیوس است. برای درک بهتر این مفهوم به رابطه نیروی کولن توجه کنید:
همانطور که در رابطه بالا میبینیم، هر چه فاصله بین دو بار الکتریکی (یا یونهای مثبت و منفی) کمتر باشد، نیروی الکترواستاتیکی وارد شده بین آنها، بزرگتر خواهد بود.
با مقایسه نقطه ذوب سه جامد یونی ، و با یکدیگر متوجه میشویم که از بین دو عاملِ اندازه بار و شعاع یونی، اندازه شعاع یونی در تعیین نقطه ذوب جامد، نقش کلیدیتری خواهد داشت.
سوال دیگری که ممکن است در مورد این جامدها برای شما مطرح شود آن است که آیا آنها به راحتی شکسته یا خم میشوند. برای پاسخ به این سوال، به تصویر دوبعدی زیر از کلرید سدیم توجه کنید.

به قسمت بالا و پایین این جامد یونی در سمت راست و چپ، فشار وارد کنید. اگر مقدار فشار وارد شده در قسمت پایین و سمت راست جامد به اندازه کافی زیاد باشد، این قسمت شروع به تکان خوردن و حرکت به سمت بالا خواهد کرد.

همانطور که در عکس بالا دیده میشود، پس از اعمال فشار، یونهای مثبت در کنار یونهای مثبت و یونهای منفی نیز در کنار یونهای منفی قرار گرفتهاند. بنابراین، جامد یونی به راحتی میشکند و برخلاف فلزات که چکشخوار هستند و به راحتی تغییر شکل میدهند، این جامدها شکننده خواهند بود.
میدانیم فلزات به راحتی جریان الکتریکی را از خود عبور میدهند. آیا جامدهای یونی رسانای جریان الکتریکی هستند؟
فلزات رسانای خوب جریان الکتریکی هستند، زیرا الکترونها در ساختار فلز، آزادانه به اطراف حرکت میکنند. اما یونها در ساختار جامد یونی آزادانه به اطراف حرکت نمیکنند، بنابراین این جامدها رسانای خوب جریان الکتریکی نیستند. اگر جامد یونی مانند نمک طعام را در محلولی مانند آب حل کنیم، یونها به راحتی به اطراف حرکت خواهند کرد. در این صورت، جریان الکتریکی را به راحتی از خود عبور میدهند. همچنین، اگر نمک طعام را تا دمایی بالاتر از دمای ذوب آن گرم کنیم، به مایع و رسانای خوب جریان الکتریکی تبدیل میشود.
اکنون میدانیم رابطه نقطه ذوب و ماده جامد چیست، در ادامه در مورد جامدهای متشکل از فلزات و ویژگیهای آنها صحبت خواهیم کرد.
جامدهای فلزی
جامدهای فلزی درخشان و براق هستند. عنصری مانند سدیم که با کلر تشکیل جامد یونی را میدهد، میتواند از طریق پیوندهای فلزی، با سدیم دیگری ترکیب و جامد فلزی را تشکیل دهد. اما سوالی که ممکن است برای شما مطرح شود آن است که پیوند فلزی چیست. برای پاسخ به این پرسش به جدول تناوبی نگاهی میاندازیم.
بیشترین عنصرهای جدول تناوبی، فلزات، مانند فلزات قلیایی خاکی، هستند. عناصر فلزی گروه اول جدول تناوبی را در نظر بگیرید. لایه ظرفیت آنها یک الکترون دارد، بنابراین به راحتی آن را از دست میدهند. بنابراین، بیشتر عنصرهای این گروه در پیوندهای یونی شرکت میکنند. اگر مخلوطی از عنصرهای فلزی مانند سدیم در کنار یکدیگر داشته باشیم، هر یک از آنها یک الکترون لایه ظرفیت خود را به دریای الکترون میدهند.
فلزات قلیایی خاکی (عناصر گروه دوم جدول تناوبی) دو الکترون در لایه ظرفیت دارند، بنابراین هر یک از آنها دو الکترون به دریای الکترون میدهند. فلزات واسطه نیز مشابه فلزات گرول اول و دوم، الکترونهای لایه ظرفیت خود را در پیوند فلزی دخالت میدهند. بنابراین، جامدات فلزی را میتوان به صورت یونهای مثبت در دریای الکترونها در نظر گرفت.
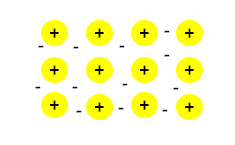
ویژگیهای جامدات فلزی
در ابتدا، رسانندگی الکتریکی یا گرمایی جامد فلزی را در نظر میگیریم. سیمهای حامل جریان الکتریکی از فلزاتی مانند مس ساخته شدهاند. بنابراین، جامد فلزی رسانای خوب جریان الکتریکی است. با توجه به عکس نشان داده شده در بالا، الکترونها در جامد فلزی آزادانه به اطراف حرکت میکنند. اگر به دو سر جامد فلزی، ولتاژی با اندازه مشخص اعمال کنیم، الکترونها در راستای معینی حرکت خواهند کرد. همچنین، جامدهای فلزی گرما را به خوبی انتقال میدهند.
فلزات چکشخوار هستند، آیا این ویژگی در جامد فلزی دیده میشود؟ آیا جامد فلزی را میتوان به آسانی خم کرد؟ به تصویر زیر توجه کنید. جامد فلزی را با اعمال دو نیرو، به سمت چپ و راست فشار میدهیم.
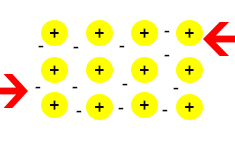
فرض کنید قسمت بالای جامد فلزی کمی به سمت چپ جابجا شود. یونهای مثبت هنوز در دریای الکترون قرار دارند، بنابراین جامدات فلزی بسیار چکشخوار هستند و به راحتی شکسته نمیشوند.
گاهی با افزودن عنصرهای دیگر به شبکه جامد فلزی، آن را سختتر میکنیم. به عنوان مثال، آهن خالص بسیار چکشخوار است. بنابراین، اتم کربن را به ساختار آن اضافه میکنند.
تا اینجا دیدیم که مفهوم رسانایی در جامد چیست و چه ارتباطی با پیوندهای فلزی دارد. در ادامه، با جامد مولکولی آشنا میشویم.
جامدهای مولکولی
با جامد یونی و فلزی آشنا شدیم. جامد یونی از یک فلز و یک نافلز و جامد فلزی از فلز خالص مانند سدیم یا کلسیم، تشکیل شده است. شاید این سوال برایتان پیش آمده باشد که اگر عنصرهای غیرفلزی فعال، مانند کلر، داشته باشیم چه اتفاقی میافتد. این عناصر با یکدیگر تشکیل مولکول میدهند. به عنوان مثال، یک ید با ید دیگر از طریق پیوند کووالانسی، پیوند برقرار میکند. بنابراین، مولکولی مانند خواهیم داشت.
ترکیبی مانند دیاکسیدکربن را در نظر بگیرید. در این ترکیب، هر کربن با دو اکسیژن پیوند برقرار کرده است. هر مولکول، از طریق پیوندهای کووالانسی بین غیرفلزات، تشکیل شده است. وقتی از جامد مولکولی صحبت میکنیم، در واقع گروهی از این مولکولها را کنار یکدیگر قرار میدهیم. به عنوان مثال، در جامد یونی ، دستهای از مولکولهای از طریق نیروهای بین مولکولی در دمایی پایین، در کنار یکدیگر قرار گرفتهاند. دما باید به اندازهای پایین باشد که این مولکولها به صورت جامد در کنار یکدیگر قرار بگیرند. برای درک بهتر این مفهوم به مثالهای زیر توجه کنید.
ید جامد را در نظر بگیرید. همانطور که گفتیم این جامد از مولکولهای ید تشکیل شده است. هر مولکول ید از پیوند کووالانسی بین دو اتم ید تشکیل میشود. این ترکیب به دلیل وجود نیروی پراکندگی لاندن، جامد است. برای درک بهتر مفهوم جامد و آشنایی بهتر با جامد مولکولی، کمی در مورد نیروی پراکندگی لاندن صحبت خواهیم کرد.
نیروی پراکندگی لاندن
به جاذبه ناشی از دوقطبیهای القا شده، نیروی پراکندگی لاندن میگوییم. اندازه و بزرگی این نیرو به قطبشپذیری مولکول یا اتم بستگی دارد. در حالت کلی، هر چه تعداد الکترونها بیشتر و ابر الکترونی بزرگتر باشد، قطبشپذیری بیشتر خواهد بود. اتم از هسته و ابر الکترونی به دور آن، تشکیل شده است. دو اتم خنثی در کنار یکدیگر را در نظر بگیرید. این اتمها میتوانند یکسان یا با یکدیگر تفاوت داشته باشند. آیا دو اتم خنثی و بدون بار میتوانند یکدیگر را جذب کنند؟ برای پاسخ به این پرسش باید با نیروی پراکندگی لاندن آشنا شویم.
الکترونها به صورت ابر الکترونی به دور هسته قرار گرفتهاند. الکترون، در هر لحظه از زمان میتواند هر جایی داخل ابر قرار داشته باشد. به طور معمول، الکترونها به صورت یکنواخت به دور هسته توزیع نشدهاند. لحظهای را تصور کنید که الکترونهای یکی از اتمها بیشتر در سمت چپ آن توزیع شدهاند. بنابراین، برای لحظه بسیار کوتاهی، بار جزئی منفی () در سمت چپ و بار جزئی مثبت () در سمت راست اتم داریم.
میدانیم بارهای همنام یکدیگر را دفع و بارهای ناهمنام یکدیگر را جذب میکنند. بار جزئی مثبت در اتم سمت چپ، الکترونهای اتم سمت راست را به سمت خود میکشاند. بنابراین، اتم سمت راست بار جرئی منفی بهدست میآورد و دو قطبی الکتریکی خواهیم داشت. دو قطبی در مولکول هنگامی به وجود میآید که بارهای مثبت و منفی در دو قسمت جداگانه در مولکول قرار گرفته باشند.
بار جزئی مثبت در الکترون سمت چپ توسط بار جزئی منفی در الکترون سمت راست، یکدیگر را جذب میکنند. در نتیجه، الکترونها به سمت یکدیگر کشیده میشوند.
ويژگیهای جامدهای مولکولی
با نیروی پراکندگی لاندن آشنا شدیم. همچنین، این نیرو مولکولهای ید را به صورت جامد در کنار یکدیگر نگه داشته است. به یاد داشته باشید که نیروی بین اتمهای ید، نیروی کووالانسی و نیروی بین مولکولهای ید، نیروی پراکندگی لاندن است. بنابراین، نقطه ذوب جامدهای مولکولی پایین است. به عنوان مثال، نقطه ذوب جامد ید در حدود ۱۱۳٫۷ درجه سلسیوس است. این مقدار به عنوان دمای ذوب برای جامد، بسیار کوچک است.
برای آنکه مادهای رسانای خوب جریان الکتریکی باشد، بارهای الکتریکی در آن باید بتوانند آزادانه به اطراف حرکت کنند. برخلاف جامد فلزی، جامد مولکولی، دریای الکترون ندارد. بنابراین، این جامدها رسانای خوبی برای هدایت جریان الکتریکی نیستند.
دیاکسیدکربن جامد یا یخ خشک را در نظر بگیرید. این جامد از مولکولهای دیاکسیدکربن تشکیل شده است که توسط نیروی پراکندگی لاندن، در کنار یکدیگر قرار گرفتهاند. این نیرو به اندازهای ضعیف است که با کمی افزایش دما، جامد به طور مستقیم به گاز تبدیل خواهد شد. در هر مولکول ، اتم کربن از طریق پیوند دوگانه کووالانسی به دو اتم اکسیژن، متصل شده است.

سوال دیگری که باید به آن پاسخ دهیم آن است که چرا جامدهای مولکولی مختلف، دمای ذوب متفاوتی دارند. به عنوان مثال، دو جامد مولکولی کلر و ید را با یکدیگر مقایسه کنید. مولکولهای ید و کلر از طریق نیروی کووالانسی بین اتمهای ید و کلر، تشکیل شدهاند. جامد آنها از طریق نیروی پراکندگی لاندن بین مولکولها تشکیل میشود. گفتیم اندازه نیروی لاندن به قطبشپذیری اتمها و قطبشپذیری اتم به اندازه آن بستگی دارد. هرچه اتم بزرگتر باشد، قطبشپذیری آن بیشتر خواهد بود.
با مقایسه مولکولهای ید و کلر با یکدیگر مشاهده میکنیم که مولکول ید از اتمهای بزرگتری تشکیل شده است. بنابراین، مولکولهای ید از مولکولهای کلر، بزرگتر و قطبشپذیری آنها بیشتر است. در نتیجه، نیروی پراکندگی بین مولکولهای ید قویتر و نقطه ذوب آن بالاتر خواهد بود.
جامدهای شبکه کووالانسی
تاکنون میدانیم رابطه دمای ذوب یا سختی با نوع ماده جامد چیست. در ادامه، با جامدهای شبکه کووالانسی یا جامد کووالانسی آشنا خواهیم شد.
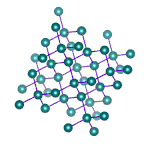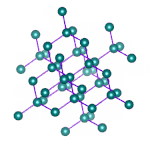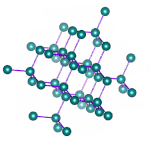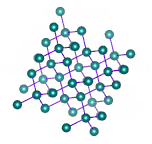
در جامدهای کووالانسی، تمام شبکه از پیوندهای کووالانسی تشکیل شده است. به عنوان مثال، سیلیکون کرباید را در نظر بگیرید. شبکه این جامد از کربن و سیلیکون تشکیل شده و نیروی حاکم بر آن، نیروی کووالانسی است. برای ذوب کردن این جامد، باید بر پیوندهای کووالانسی غلبه شود. ذکر این نکته مهم است که نیروی کووالانسی قویتر از نیروی پراکندگی لاندن است، بنابراین نقطه ذوب جامد کووالانسی بالاتر از نقطه ذوب جامد مولکولی است. همچنین، این جامدها، رسانای خوبی برای هدایت جریان الکتریکی نیستند.
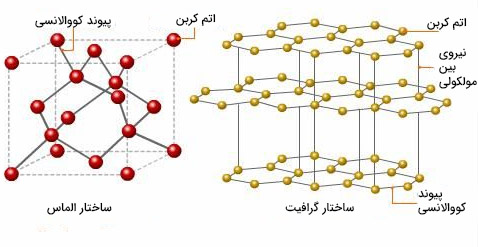
الماس، مثال دیگری از جامدهای کووالانسی است. الماس از اتمهای کربن تشکیل شده است که از طریق پیوند کووالانسی به یکدیگر متصل شدهاند. الماس یکی از محکمترین جامدهای شناخته شده است. شکستن این جامد بسیار سخت خواهد بود. نکته جالب توجه آن است که کربن جامدهای کووالانسی مختلفی را تشکیل میدهد. به عنوان مثال، گرافیت را در نظر بگیرید. ساختار شبکه گرافیت و الماس در تصویر زیر با یکدیگر مقایسه شدهاند. همانطور که در تصویر دیده میشود، گرافیت از صفحههای شبکه کووالانسی تشکیل شده است. هر صفحه، صفحه دیگر را از طریق نیروهای بینمولکولی جذب میکند، بنابراین به راحتی نسبت به یکدیگر حرکت میکنند. اما برای ذوب کردن گرافیت باید بر پیوندهای کووالانسی غلبه شود.
ویژگیهای هر یک از انواع جامد توضیح داده شده در بالا، در جدول زیر به صورت خلاصه بیان شده است.
| جامدهای یونی | جامدهای مولکولی | جامدهای کووالانسی | جامدهای فلزی |
| رسانای ضعیف جریان الکتریکی و گرما | رسانای ضعیف جریان الکتریکی و گرما | رسانای ضعیف جریان الکتریکی و گرما | رسانای خوب جریان الکتریکی و گرما |
| دمای ذوب به نسبت بالا | دمای ذوب پایین | دمای ذوب بالا | دمای ذوب به پیکربندی الکترونی بستگی دارد. |
| سخت اما شکننده | نرم | بسیار سخت و شکننده | به آسانی تغییر شکل میدهند و چکشخوار و شکلپذیر هستند. |
| چگالی به نسبت بالا | چگالی پایین | چگالی پایین | چگالی بالا |
| سطح کدر | سطح کدر | سطح کدر | درخشان |
نمونه سوالات انواع جامد
تا اینجا یاد گرفتیم که معنی جامد چیست و در مورد انواع پیوندهای حاکم بر مواد جامد صحبت کردیم. در ادامه، برای درک بهتر این مفاهیم، به پرسشهایی در این زمینه پاسخ میدهیم.
مثال ۱
کدام یکی از دو جامد و دمای ذوب بالاتری دارند؟
- ، زیرا قطبشپذیری مولکولهای نسبت به مولکولهای بیشتر است.
- ، زیرا پیوندهای قویتر از پیوندهای است.
- ، زیرا قطبشپذیری مولکولهای نسبت به مولکولهای بیشتر است.
- ، زیرا پیوندهای قویتر از پیوندهای است.
پاسخ:
در حالت کلی، نقطه ذوب ماده جامد به نیروهای جاذبه نگهدارنده آن بستگی دارد. هر چه اندازه این نیرو بیشتر باشد، نقطه ذوب جامد بالاتر خواهد بود. در ابتدا، نیروی جاذبه نگهدارنده جامدهای و را تعیین میکنیم. هر دو مورد، جامدهای مولکولی هستند. بنابراین، از مولکولهای جدا از هم تشکیل شدهاند و نیروی حاکم بر آنها نیروهای بینمولکولی یا نیروی پراکندگی لاندن است.
در ادامه، باید بدانیم نیروی بینمولکولی در کدام ساختار قویتر است. هر دو ساختار غیرقطبی هستند، بنابراین برهمکنش بین آنها از طریق نیروی پراکندگی لاندن خواهد بود. مولکولهای نسبت به مولکولهای سنگینتر و در نتیجه، قطبشپذیرتر هستند. از این رو، نیروهای پراکندگی لاندن در جامد ، قویتر خواهند بود.
گزینه ۳، پاسخ صحیح است.
مثال ۲
جامدی بلوری و سفید در دمای ۱۵۳ درجه سلسیوس ذوب میشود. این جامد نه در حالت جامد و نه به عنوان محلول آبی، جریان الکتریکی را از خود عبور نمیدهد. کدام یک از گزینههای زیر، جامد مورد نظر است؟
- Cu
پاسخ:
برای پاسخ به این سوال باید نوع جامد توصیف شده را مشخص کنیم. بر طبق صورت سوال، رنگ جامد سفید و نقطه ذوب آن پایین است. بنابراین، جامد کووالانسی یا یونی نخواهد بود، زیرا نقطه ذوب این جامدها بسیار بالاتر از عدد داده شده است. همچنین، این جامد رسانای جریان الکتریکی نیست، در نتیجه جامد مولکولی خواهد بود.
اکنون، باید بدانیم کدام یک از گزینههای داده شده، جامد مولکولی است. گزینه یک، تنها از عناصر غیرفلزی تشکیل شده است، بنابراین به احتمال زیاد جامد مولکولی است. برای اطمینان از این موضوع، گزینههای دیگر را نیز بررسی میکنیم:
- : این جامد، یکی از رایجترین مثالهای جامد کووالانسی است.
- : این جامد از عنصری فلزی، کلسیم، و عنصری غیرفلزی، کلر، تشکیل شده است. بنابراین، جامد یونی است.
- : این جامد تنها از فلز مس ساخته شده و جامدی فلزی است.
پاسخ صحیح، گزینه یک است.
مثال ۳
مشخصات جامدی سفید و مات در ادامه داده شده است:
- به طور مستقیم در دمای ۷۸٫۵- درجه سلسیوس از حالت جامد به مایع تبدیل میشود.
- رسانای ضعیف جریان الکتریکی و گرما است.
- تقریبا نرم است.
کدام یک از شکلهای زیر، ساختار کلی این جامد را نشان میدهد؟
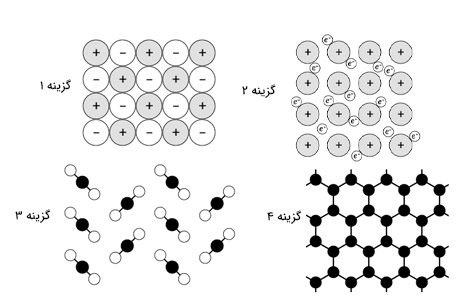
پاسخ:
با توجه به ویژگیهای بیان شده برای هر یک از انواع جامد، نوع جامد سفید و مات داده شده در پرسش فوق را به راحتی مشخص میکنیم.
بر طبق مشخصات داده شده در پرسش، جامد مورد نظر در دمای بسیار پایینی به گاز تبدیل میشود. بنابراین، این جامد با احتمال بسیار کمی جامد یونی یا کووالانسی است، زیرا دمای ذوب این جامدها به نسبت بالا است. همچنین، بر طبق صورت سوال، این جامد جریان الکتریکی را به خوبی از خود عبور نمیدهد و جامد فلزی نخواهد بود. در نتیجه، جامد مورد نظر، جامد مولکولی است.
اکنون باید بدانیم کدام یک از ساختارهای داده شده در تصویر بالا، ساختار جامد مولکولی را نشان میدهد. جامد مولکولی از مولکولهای جداگانهای تشکیل شده است که با استفاده از نیروهای بینمولکولی، جامد را تشکیل میدهند. بنابراین، باید به دنبال ساختاری متشکل از مولکولهای تکی باشیم که با استفاده از نیروهای پراکندگی لاندن، جامد را تشکیل میدهند.
پاسخ صحیح، گزینه ۳ است.

مثال ۴
کدام یک از گزینههای زیر، ویژگیهای را به درستی بیان میکند؟
- این جامد رسانای ضعیف جریان الکتریکی است، زیرا الکترونهای آن در پیوندهای کووالانسی و جفتهای تکی، محکم نگه داشته شدهاند.
- جامد سختی است، زیرا یونهای آن توسط نیروهای جاذبه الکترواستاتیکی بسیار قوی کنار یکدیگر نگه داشته شدهاند.
- دمای ذوب بالایی دارد، زیرا مولکولهای آن از طریق نیروهای بینمولکولی قوی با یکدیگر برهمکنش دارند.
- این جامد چکشخوار است، زیرا اتمهای آن بدون وارد کردن اختلالی به پیوندها، میتوانند به راحتی نسبت به یکدیگر حرکت کنند.
پاسخ:
جامد از عنصر فلزی و عنصر غیرفلزی تشکیل شده است، بنابراین جامد یونی است. جامدهای یونی از طریق جاذبه قوی الکترواستاتیکی بین کاتیونها و آنیونها، تشکیل میشوند. در نتیجه، جامدهای یونی سخت و شکننده هستند و دمای ذوب بالایی دارند. بنابراین، پاسخ صحیح گزینه ۴ است.
مثال ۵
به جدول زیر دقت کنید:
| یون | شعاع یونی () |
| ۱۳۳ | |
| ۹۹ | |
| 133 | |
| ۱۸۱ | |
| 140 |
بر طبق دادههای جدول بالا، کدام یک از گزینهها ترتیب جامدها را براساس افزایش دمای ذوب به درستی نشان میدهد؟
پاسخ:
در حالت کلی، هر چه نیروی جاذبه نگهدارنده جامد بزرگتر باشد، دمای ذوب آن بالاتر خواهد بود.
و و جامدهای یونی هستند، بنابراین با استفاده از جاذبه الکترواستاتیکی بین آنیونها و کاتیونها تشکیل شدهاند. نیروی الکترواستاتیکی با استفاده از قانون کولن محاسبه میشود. بر طبق این قانون، این نیرو با اندازه بارهای یونها نسبت مستقیم و با فاصله بین آنها نسبت معکوس دارد. یعنی هرچه بار یونها بیشتر و فاصله آنها کمتر باشد، اندازه نیروی الکترواستاتیکی بزرگتر خواهد بود.
اکنون، قدرت نیروی الکترواستاتیکی را در سه جامد یونی داده شده با یکدیگر مقایسه میکنیم. بر طبق جدول بالا، بزرگترین بارهای یونی (۲+ و ۲-) و کوچکترین فاصله بین مرکز یونها (۲۳۹ پیکومتر) را دارد. بنابراین، نیروی جاذبه الکترواستاتیکی در این جامد قویتر است. در مقابل، کوچکترین بارهای یونی (۱+ و ۱-) و بزرگترین فاصله بین مرکز یونها (۳۱۴ پیکومتر) را دارد. در نتیجه، اندازه نیروی جاذبه الکترواستاتیکی آن از دو جامد دیگر کوچکتر خواهد بود.
پاسخ صحیح، گزینه ۳ است.
مثال ۶
جامدی سخت و درخشان در دمای ۲۸۳۰ درجه سلسیوس ذوب میشود. این جامد رسانای خوبی برای جریان الکتریکی نیست و در آب حل نمیشود. کدام یک از گزینههای زیر، جامد مورد نظر است؟
- Pt
پاسخ:
با توجه به اطلاعات داده شده در سوال، نوع جامد را مشخص میکنیم. بر طبق صورت سوال، جامد درخشان است و نقطه ذوب بالایی دارد، بنابراین گزینه جامد مولکولی حذف میشود. همچنین، این جامد رسانای خوبی برای جریان الکتریکی نیست، در نتیجه جامد فلزی نیز حذف خواهد شد. در پایان، این جامد در آب حل نمیشود، بنابراین جامد یونی نیز از بین گزینهها حذف میشود. از این رو، جامد درخشان و سخت، جامد شبکه کووالانسی است.
از بین گزینههای داده شده، تنها به عنوان جامد کووالانسی شناخته میشود. بنابراین، پاسخ صحیح گزینه ۳ است.
مثال ۷
کدام یک از گزینههای زیر، ویژگیهای را به درستی بیان میکند؟
- دمای ذوب پایینی دارد، زیرا مولکولهای آن از طریق نیروهای ضعیف بینمولکولی در کنار یکدیگر قرار گرفتهاند.
- رسانای ضعیف جریان الکتریکی است، زیرا الکترونهای ظرفیت به یونها مقید هستند.
- چکشخوار است، زیرا یونهای آن بدون ایجاد اختلال در پیوندها، به راحتی نسبت به یکدیگر حرکت میکنند.
- جامد سختی است، زیرا اتمهای آن در شبکه سهبعدی کووالانسی مرتب شدهاند.
پاسخ:
جامد از عنصر فلزی پتاسیم و عنصر غیرفلزی ید تشکیل شده و جامد یونی است. جامدهای یونی متشکل از آنیونها و کاتیونها، از طریق نیروی جاذبه قوی الکترواستاتیکی بین یونها تشکیل میشوند. از آنجایی که الکترونها در جامدهای یونی نمیتوانند آزادانه به اطراف حرکت کنند، این جامدها رسانای ضعیف جریان الکتریکی هستند. بنابراین، پاسخ صحیح گزینه ۲ است.
جمعبندی
در این مطلب از مجله فرادرس یاد گرفتیم که جامد چیست و چه دستهبندیهایی دارد. مواد جامد در حالت کلی به دو دسته جامدهای بلوری و آمورف تقسیم میشوند. جامدهای بلوری نیز به چهار نوع جامدهای یونی، فلزی، کووالانسی و مولکولی تقسیم شدهاند. در پایان، برای درک بهتر مفهوم جامد چیست به پرسشهایی در این زمینه پاسخ دادیم.
آزمون مطلب مواد جامد
۱. برای اینکه یک ماده جزء جامدات محسوب شود، باید چه ویژگیهایی داشته باشد؟
همواره فاقد حجم باشد و تنها سطح داشته باشد.
بتواند به راحتی تغییر شکل دهد و جریان یابد.
به راحتی با تغییر دما به گاز تبدیل شود.
شکل و حجم ثابت در شرایط معمول داشته باشد.
مواد جامد در شرایط عادی نه مانند مایعها جاری میشوند و نه مانند گازها فاقد حجم یا شکل مشخص هستند. گزینههایی که به تغییر آسان شکل، فقدان حجم یا تبدیل سریع به گاز اشاره دارند، به ویژگیهای مایعات یا گازها اشاره دارند.
۲. از نظر شکل و حجم، جامد، مایع و گاز چه تفاوتهایی دارند؟
جامد شکل و حجم ثابت دارد، مایع شکل ظرف را میگیرد ولی حجم ثابت دارد، گاز شکل و حجم ظرف را میگیرد.
جامد فقط شکل ثابت دارد و حجمش تغییر میکند، مایع و گاز هر دو شکل ثابتی ندارند اما حجم آنها همیشه ثابت است.
جامد و مایع هردو شکل ثابتی دارند ولی گاز شکل ظرف را میگیرد، حجم در همه حالتها ثابت است.
جامد حجم و شکلش تغییر میکند، مایع فقط حجمش تغییر میکند، گاز همیشه حجم و شکلش ثابت است.
در حالت جامد، هم شکل و هم حجم ماده تغییر نمیکند و همیشه ثابت است. در حالت مایع، حجم ماده ثابت میماند اما شکل آن متناسب با ظرف تغییر میکند. در حالت گاز، هم حجم و هم شکل ماده بسته به ظرف تغییر میکند و شکل و حجم آن ثابت نیست.
۳. اگر قطعهای کاغذ را طوری ببریم که شکل و اندازهاش عوض شود اما جنس آن همان کاغذ باقی بماند، این نوع تغییر از چه نوعی است و دلیل آن چیست؟
تغییر فیزیکی، چون ماهیت شیمیایی ماده حفظ شده است.
تغییر هستهای، چون ساختار اتمی دگرگون شده است.
تغییر شیمیایی، چون ترکیب مولکولی عوض شده است.
تغییر مغناطیسی، چون نیرو وارد شده است.
وقتی قطعهای از جامد را ببریم یا شکل آن را بدون تغییر جنس ماده عوض کنیم، مثل بریدن کاغذ، فقط شکل یا اندازه تغییر میکند و هیچ ترکیب شیمیایی جدیدی ایجاد نمیشود. این نوع تغییر را «تغییر فیزیکی» مینامند چون ویژگیهای شیمیایی ماده مثل قبل باقی میماند و تنها حالت ظاهری متفاوت میشود.
۴. نیروهای بین ملکولی ضعیف چه تاثیری بر ویژگیهای جامدات مولکولی دارند؟
سبب رسانایی بالای برق در جامدات مولکولی میشوند.
باعث میشوند جامدات مولکولی همسانگرد نباشند.
باعث افزایش نقطه ذوب و سختی بیشتر جامدات مولکولی میشوند.
باعث میشوند جامدات مولکولی نرم و با نقطه ذوب پایین باشند.
در جامدات مولکولی، نیروهای بین ملکولی مانند نیروهای لاندن بسیار ضعیفاند و همین ضعف باعث میشود این جامدات معمولا نرم و دارای نقطه ذوب پایین باشند. گزینه «باعث افزایش نقطه ذوب و سختی بیشتر» نادرست است چون این ویژگیها معمولا مربوط به جامدات یونی یا کووالانسی است. گزینه «سبب رسانایی بالای برق» اشتباه است زیرا رسانایی در جامدات مولکولی بسیار پایین است. عبارت «باعث همسانگرد نبودن» هم صحت ندارد، چون همسانگرد یا ناهمسانگرد بودن بیشتر به ساختار هندسی ماده بستگی دارد.
۵. در یک آزمایشگاه، چگونه میتوان بدون دانستن ماهیت شیمیایی، مواد جامد را صرفا با مشاهده ویژگیهای فیزیکی از مایعات و گازها تشخیص داد؟
بررسی داشتن شکل و حجم ثابت در ماده
اندازهگیری میزان انحلال ماده در آب
اندازهگیری سرعت تبخیر ماده در محیط
بررسی قابلیت انتشار آزادانه مولکولها در هوا
مواد جامد با داشتن شکل و حجم ثابت از مایعات و گازها متمایز میشوند، زیرا جامد حتی بدون ظروف خاص شکل و مقدارش تغییر نمیکند.
۶. اگر برای یک کاربرد صنعتی به جامدی با نقطه ذوب بسیار بالا نیاز داشته باشیم، کدام نوع جامد انتخاب بهتری است؟
جامد شبکه کووالانسی با پیوندهای سهبعدی
جامد فلزی با دریای الکترونها
جامد مولکولی با نیروی لاندن
جامد یونی با ساختار شبکهای قوی
در میان انواع جامدات، «جامد شبکه کووالانسی با پیوندهای سهبعدی» مانند الماس یا سیلیکون کرباید معمولا بالاترین نقطه ذوب را دارند، زیرا در ساختار آنها، همه اتمها توسط پیوندهای کووالانسی بسیار قوی در سراسر شبکه به هم متصلند. در مقابل، «جامد یونی با ساختار شبکهای قوی» دارای نقطه ذوب بالا است اما معمولا از جامد کووالانسی کمتر است، «جامد فلزی با دریای الکترونها» اگرچه رسانا و مقاوم است اما نقطه ذوبش معمولا پایینتر از کووالانسی شبکهای است و «جامد مولکولی با نیروی لاندن» به علت نیروهای ضعیف بین مولکولی کمترین نقطه ذوب را دارد.
۷. کدام یک مقایسه درستی از ساختار مواد جامد بلوری و آمورف است؟
جامد آمورف مانند بلوری دارای ساختار شبکهای منظم است و نقطه ذوب ثابتی دارد.
هر دو جامد بلوری و آمورف دارای نقطه ذوب دقیق هستند و نظم داخلی کامل دارند.
جامد بلوری ساختار منظم و تکرارشونده دارد و آمورف نظم داخلی مشخصی ندارد.
شبکه بلوری بینظم است اما آمورف نظم داخلی دارد و مثل بلوریها نقطه ذوب بالایی دارد.
در مواد جامد بلوری، نظم و ترتیب مشخصی در آرایش ذرات وجود دارد و این ساختار تکرارشونده دلیل مهمی برای ویژگیهایی مثل نقطه ذوب دقیق است. اما جامد آمورف فاقد نظم درونی منظم است و ساختار بینظمی دارد.
۸. کدام دستهبندی برای جامدات بلوری براساس نوع پیوند غالب و یک ویژگی فیزیکی شاخص آن درست است؟
جامد یونی، رسانایی پایین در حالت جامد
جامد شبکه کووالانسی، چکشخواری زیاد
جامد فلزی، نقطه ذوب بسیار پایین
جامد مولکولی، سختی و استحکام بالا
جامد یونی دارای پیوند یونی و ساختار شبکهای است و به دلیل ثابت بودن یونها در جای خود، در حالت جامد رسانایی بسیار کمی دارد. در مقابل، فلزات رسانا و چکشخوارند و معمولا نقطه ذوب بالایی دارند. جامد مولکولی معمولا نرم و ضعیف است، نه اینکه دارای سختی بالا باشد. جامد شبکه کووالانسی هم بسیار سخت است ولی چکشخواری ندارد و شکننده است.
۹. وقتی یک جامد بر اثر فشار مکانیکی خرد شود و همزمان هیچ ذوب یا دگرگونی شیمیایی رخ ندهد، این تغییر چه نام دارد و تفاوت آن با تغییر شیمیایی چیست؟
تغییر شیمیایی است چون ساختار ماده به کلی عوض میشود و خاصیتهای آن تغییر میکند.
فرایند ذوب شدن رخ داده، پس تغییر فقط در حالت ماده ایجاد شده است و نه ویژگیها.
تغییر فیزیکی است چون ماهیت ماده تغییر نمیکند، بر خلاف تغییر شیمیایی که ماده جدید بهوجود میآید.
تغییر فیزیکی است چون ساختار ماده از هم میپاشد اما نوع پیوندهای شیمیایی عوض میشود.
زمانی که جامد فقط خرد یا کوچکتر شود و هیچ ذوب یا دگرگونی شیمیایی رخ ندهد، این فرآیند تغییر فیزیکی نامیده میشود. در تغییر فیزیکی، ماده همچنان همان ماده قبلی باقی میماند و فقط شکل یا اندازه آن فرق میکند. در مقابل، در تغییر شیمیایی مانند سوختن یا زنگزدن، مادهای کاملا جدید حاصل میشود و ویژگیهای شیمیایی آن متفاوت میگردد.
۱۰. ساختار «دریای الکترونها» در جامدات فلزی چه نقشی در رفتار چکشخواری و رسانایی آنها دارد؟
دریای الکترونها باعث حرکت آزاد الکترونها و شکلپذیری بالای فلز میشود.
دریای الکترونها فلزات را شکننده و غیررسانا میسازد.
دریای الکترونها فقط باعث استحکام ساختار بلورین میشود.
دریای الکترونها الکترونها را ساکن و جامد را سختتر میکند.
عبارت «دریای الکترونها» نشان میدهد که الکترونها در ساختار فلزی آزادانه بین یونها جابهجا میشوند، بنابراین فلزات هم چکشخوار و شکلپذیر هستند و هم رسانایی بالای الکتریکی و گرمایی دارند. این ویژگی باعث میشود در برابر ضربه یا فشار فلز خم شود یا شکل بگیرد و الکترونها جریان برق را به راحتی منتقل کنند.
۱۱. چرا جامد یونی دارای سختی و نقطه ذوب بالاست؟
بین یونها تنها نیروهای ضعیف لاندن وجود دارد.
یونها در شبکه منظمی کنار هماند و نیروهای الکترواستاتیکی قوی دارند.
اتمها به شکل آزاد در سراسر ساختار حرکت میکنند.
آرایش یونها نامنظم است و پیوند کووالانسی دارند.
در جامد یونی، یونهای مثبت و منفی به طور منظم کنار هم قرار میگیرند و نیروهای الکترواستاتیک قوی بین آنها برقرار است. این نیروها باعث میشود یونها به سختی از هم جدا شوند و جامد نقطه ذوب و سختی بالایی داشته باشد.
۱۲. کدام مورد درباره تاثیر شعاع یونی و بار یون بر نقطه ذوب جامدات یونی درست است؟
بار و شعاع یون در تعیین نقطه ذوب تاثیری ندارند.
یونهایی با بار بیشتر، نقطه ذوب بالاتری دارند.
افزایش شعاع یونی باعث افزایش نقطه ذوب میشود.
کاهش بار یون، نقطه ذوب را زیاد میکند.
در ساختار جامدات یونی، هرچه بار یونها بیشتر باشد، جاذبه الکترواستاتیکی قویتر میشود و همین موضوع باعث بالا رفتن نقطه ذوب است. مانند آنچه در ترکیبات یونی با یون دو بار مثبت دیده میشود. در مقابل، افزایش شعاع یونی جاذبه را کم میکند و عامل کاهش نقطه ذوب خواهد بود.
۱۳. اگر بخواهید براساس ساختار داخلی، یخ خشک و شیشه را از هم جدا کنید، کدام ویژگی کلیدی را باید مقایسه نمایید؟
بررسی وجود ساختار بلوری منظم در هر کدام
مقایسه نقطه ذوب پایین آنها
تشخیص قابلیت نفوذپذیری نور در هر کدام
بررسی رسانایی الکتریکی هر دو ماده
ویژگی اصلی که باعث جداسازی یخ خشک و شیشه به دو دسته مختلف جامد میشود، وجود یا نبود ساختار بلوری منظم است. یخ خشک ساختار بلوری و نظم تکرارشونده دارد، بنابراین جزو جامدات بلوری محسوب میشود. در مقابل، شیشه فاقد نظم داخلی است و ساختار مولکولی نامنظم دارد، پس در گروه جامدات آمورف قرار میگیرد. نقطه ذوب پایین یا قابلیت عبور نور و همچنین رسانایی الکتریکی، مواردی هستند که برای تفکیک ساختاری مطابق تقسیمبندی علمی کفایت نمیکنند.
۱۴. بر اساس تفاوت ساختار شبکه و نوع پیوند، چرا جامدات مولکولی معمولا رسانایی الکتریکی بسیار کم و نقطه ذوب پایینی دارند؟
شبکه جامدات مولکولی از مولکولهای جدا تشکیل شده و نیروهای بینمولکولی ضعیف عامل نگهداری آنهاست.
ساختار شبکه جامد مولکولی مانند فلزات، آزادانه الکترونها را انتقال میدهد.
در این جامدات، مولکولها با پیوندهای قوی یونی کنار هم نگه داشته میشوند.
همهی اجزای شبکه جامد مولکولی با پیوند کووالانسی سهبعدی به هم متصل شدهاند.
در جامدات مولکولی، ساختار از مولکولهای جداگانه تشکیل شده که با نیروهای ضعیف بینمولکولی مانند پراکندگی لاندن کنار هم قرار گرفتهاند. به همین دلیل، انرژی لازم برای شکستن این ساختار کم است که نقطه ذوب پایین را توضیح میدهد. همچنین نبود پیوند محکم یا الکترونهای آزاد برای انتقال بار، علت رسانایی بسیار کم است.
۱۵. سلول واحد در جامدات چه چیزی را تعیین میکند؟
انواع سلول واحد تنها برای رسم مدل سهبعدی بلور کاربرد دارند.
سلول واحد فقط اندازه بلور را تعیین میکند، نه نوع آن را.
طبقهبندی بلورها بر اساس نظم و زاویههای سلول واحد انجام میشود و ساختار هندسی مولکولها را مشخص میکند.
سلول واحد رنگ ماده جامد را تعیین میکند.
ویژگیهای هندسی مانند نظم و زاویههای سلول واحد باعث میشود بتوان انواع بلور را به روش علمی و دقیق طبقهبندی کرد. الگوی تکرارشونده سلول واحد ساختار بلوری را شکل میدهد و این ویژگیها بین گروههای بلوری اصلی تفاوت دارد.
۱۶. کدام عامل باعث تفاوت اصلی سختی و رسانایی بین الماس و گرافیت به عنوان جامدات شبکه کووالانسی میشود؟
پیوند یونی قوی در الماس و پیوند ضعیف واندروالس در گرافیت
تعداد مولکولهای موجود در هر شبکه بلوری
آرایش سهبعدی پیوندهای کووالانسی در الماس و لایهای بودن ساختار گرافیت
وجود یونهای فلزی در شبکه گرافیت و نبود آن در الماس
تفاوت اصلی سختی و رسانایی میان الماس و گرافیت مربوط به ساختار آنهاست. در الماس، هر اتم کربن با چهار پیوند کووالانسی قوی و آرایش سهبعدی محکم به اتمهای دیگر متصل شده، که این موضوع باعث سفتی و سختی بسیار زیاد میشود. در مقابل، در گرافیت، اتمهای کربن در لایههایی با پیوند قوی کنار هم قرار دارند، اما بین این لایهها فقط نیروهای ضعیف عمل میکند. بنابراین، گرافیت نرمتر است و لایهها بهراحتی روی هم سر میخورند، که رسانایی بیشتری درون لایهها ایجاد میکند.