یدومتری چیست؟ – تیتراسیون به زبان ساده

«یدومتری» (Iodometry) که با نام «تیتراسیون یدومتری» (Iodometry Titration) نیز نامیده میشود، روشی در آنالیز حجمی است که در آن مشاهده یا عدم مشاهده رنگ ناشی از عنصر ید، نقطه پایانی واکنش را تعیین میکند. این تیتراسیون به خانواده تیتراسیونهای اکسایش کاهش تعلق دارد. در این مطلب میخواهیم در مورد مفهوم این تیتراسیون و نحوه انجام آن صحبت کنیم. همچنین به بررسی محاسباتی میپردازیم که برای رسیدن به پاسخ مورد نظر در این روش، ضروری هستند.
تیتراسیون یدومتری چیست ؟
تیتراسیون غیرمستقیم یدومتری نوعی از تیتراسیون اکسایش کاهش است که در آن برای پی بردن به نقطه پایانی تیتراسیون از عنصر ید و تغییر رنگ ناشی از حضور یا غیاب آن استفاده میشود. توجه داشته باشید که نباید «یدومتری» (Iodometry) را با «یدیمتری» (Iodimetry) اشتباه گرفت. یدومتری «تیتراسیونی غیرمستقیم» (Indirect Titration) است که در آن در واکنش حاصل از تیترانت و آنالیت، ید آزاد میشود و از تغییر رنگ حاصل، به انجام واکنش پی میبرند.
به تیتراسیون غیرمستقیم، «تیتراسیون برگشتی» نیز گفته میشود. در حالیکه یدیمتری «تیتراسیونی مستقیم» (Direct Titration) است که در آن از ید به عنوان یکی از اجزای تیتراسیون، تیترانت، استفاده میشود. در بخشهای بعدی در مورد تفاوت این دو روش به تفصیل صحبت خواهیم کرد.
اجزای تیتراسیون
روشهای بسیار متنوعی برای انجام تیتراسیون وجود دارد و هر کدام شامل مواد و اجزای اولیه بهخصوصی است که برای موارد مشخصی کاربرد دارند. با اینحال در هر تیتراسیون اجزایی وجود دارند که باید با مورد استفاده آنها آشنا شویم. در ادامه میخواهیم این اجزا را مورد بررسی قرار دهیم.
تیترانت
«تیترانت» (Titrant)، محلولی استاندارد با غلظت معلوم است و از آن برای تکمیل واکنش با تیتراند استفاده میشود. توجه داشته باشید که از حجم استفاده شده از تیترانت، میتوان برای انجام محاسبات در تیتراسیونها بهره برد.

برای آنکه روی حجم اضافهشده از تیترانت کنترل وجود داشته باشد و بتوان آن را بهآهستگی و قطرهقطره افزود، آن را داخل بورت میریزند و با تنظیم شیر بورت، به ارلن حاوی نمونه اضافه میکنند.
تیتراند
«تیتراند» (Titrand) که از آن به نام «آنالیت» (Analyte) نیز نام برده میشود، محلولی با غلظت نامشخص است و هدف از تیتراسیون نیز، به دست آوردن همین مقدار است. در ابتدای هر تیتراسیونی، حجم مشخصی از نمونه شامل تیتراند در اختیار است.

شناساگر
«شناساگر» (Indicator) مادهای است که در پاسخ به تغییرات شیمیایی از خود تغییر رنگی خاص را نشان میدهد. مثلا میتوان در «تیتراسیون اسید و باز» (Acid And Base Titration) از شناساگر «فنول فتالیین» (Phenolphthalein) برای شناسایی نقطه پایانی تیتراسیون استفاده کرد.

در این روش تغییر رنگ با توجه به مقدار pH رخ میدهد. در هر تیتراسیون با توجه به اجزا، میتوان شناساگر مناسب را انتخاب و استفاده کرد.
نقطه همارزی
«نقطه همارزی» (Equivalence Point)، نقطهای است که در آن از نظر تئوری واکنش بین تیترانت و آنالیت، تکمیل میشود. در نقطه همارزی تعداد مولهای تیترانت برابر با تعداد مولهای آنالیت یا ضریبی از آن خواهد بود. با نوشتن واکنش انجامشده بین آنالیت و تیترانت میزان نسبت آنها را به دست آورد. مثلا در تیتراسیون کمپلکسومتری، نسبت یون فلزی و عامل کمپلکسکننده EDTA در اکثر موارد بهصورت ۱:۱ است.
نقطه پایانی
«نقطه پایانی» (End Point) نقطهای است که در واقع در محاسبات مربوط به تیتراسیون در نظر گرفته میشود. در این نقطه تغییرات ایجاد شده ناشی از پایان واکنش، به روشی اندازهگیری و قابل مشاهده میشود. از این روشها میتوان به استفاده از شناساگر یا استفاده از پتانسیومتر اشاره کرد.

تیتراسیون اکسایش کاهش چیست ؟
«تیتراسیون اکسایش کاهش» (Redox Titration) نوعی از تیتراسیون است که بر مبنای واکنش اکسایش و کاهشی بین تیرانت و آنالیت، انجام میشود. در این تیتراسیون بسته به نیاز از شناساگر اکسایش کاهش استفاده میشود.
با این حال در تیتراسیونهای اکسایش کاهشی مانند «منگانومتری» (Manganometry) نیازی به استفاده از شناساگر وجود ندارد.
در جدول زیر به تعدادی از انواع تیتراسیونهای اکسایش کاهش اشاره کردهایم. این تیتراسیونهای با توجه به نوع تیترانت مورد استفاده، نامگذاری میشوند.
| نوع تیتراسیون | نام تیترانت | فرمول شیمیایی تیترانت |
| یدومتری | ید | $$I_2$$ |
| برمومتری | برم | $$Br_2$$ |
| سریمتری | نمک سریم (IV) | $$Ce$$ |
| منگانومتری | پتاسیم پرمنگنات | $$KMnO_4$$ |
| دیکرومتری | پتاسیم دیکرومات | $$K_2Cr_2O_7$$ |
تیتراسیون غیر مستقیم چیست ؟
«تیتراسیون غیرمستقیم» (Indirect Titration) زمانی مورد استفاده قرار میگیرد که شناساگر مناسبی وجود نداشته یا سرعت انجام واکنش بسیار کند باشد. در این روش تیترانت مورد نظر به مقدار مشخص به نمونه افزوده میشود. مقدار این تیترانت باید بیشتر از مقدار اکیوالانسی باشد، بهصورتی که در پایان واکنش، مقدار مازادی از آن در محیط واکنش باقی بماند.
در مرحله بعد این مقدار باقیمانده، خود به کمک تیترانتی دیگر مورد تیتراسیون قرار میگیرد. مقدار آنالیت را میتوان از کم کردن مقدار مازاد از مقدار اولیه تیترانت اول، محاسبه کرد. یدومتری یکی از انواع تیتراسیونهای غیرمستقیم است.
نحوه انجام تیتراسیون یدومتری
تا اینجا در مورد مفهوم تیتراسیون یدومتری و اجزای آن صحبت کردیم. در ادامه میخواهیم بدانیم این تیتراسیون به چه صورتی قابل انجام است. تیتراسیون اکسایش کاهش که در آن از سدیم تیوفسفات با فرمول شیمیایی $$Na_2S_2O_3$$ به عنوان «عامل کاهنده» (Reducing Agent) استفاده شود، تیتراسیون یدومتری نام دارد زیرا از آن اختصاصا برای تیتر کردن ید استفاده میشود.
تیتراسیون یدومتری روشی عمومی برای محاسبه غلظت یک «عامل اکسنده» (Oxidising Agent) در محلول است. در این نوع تیتراسیون از نشاسته به عنوان شناساگر استفاده میشود زیرا این ماده توانایی جذب $$I_2$$ آزادشونده را دارد. این جذب باعث تغییر رنگ محلول از آبی به زرد میشود که نشاندهنده نقطه پایانی تیتراسیون است.
واکنش های تیتراسیون یدومتری
در تیتراسیون غیرمستقیم یدومتری، به حجم مشخصی از نمونه، مقدار مشخص و مازادی از یون یدید افزوده میشود. یدید عاملی اکسنده است و به ید تبدیل میشود. سپس ید در محلولی که همچنان حاوی یدید است، حل میشود و یونهای ترییدید را با فرمول شیمیایی $$I_3^-$$ تولید میکند. این گونه دارای رنگ قهوهای تیره است. در مرحله بعد این گونه توسط محلول استاندارد تیترانت تیوسولفات، تیتر میشود. تبدیل این گونه به یدید توسط شناساگر نشاسته مورد ارزیابی قرار میگیرد. در زیر واکنشهایی که طی این مراحل به وقوع میپیوندند را آوردهایم.
$$I_3^-+ 2 e^− \rightleftharpoons 3 I^− (E^0 = +0.54\; V)$$
همچنین واکنش کاهش تیوسولفات را نیز میتوان بهصورت زیر نشان داد.
$$S_4O_6^{2-}+ 2 e^− \rightleftharpoons 2 S_2O_3^{2-}(E^0 = +0.08 \;V)$$
همچنین برایند این دو واکنش را میتوان بهصورت زیر آورد.
$$I_3^-+ 2 S_2O_3^{2−}\rightarrow S_4O_6^{2−}+ 3 I^− (E_{reaction} = +0.46 \;V)$$
از بین رفتن رنگ آبی، نشاندهنده تخریب ید-نشاسته است و برای یافتن نقطه پایانی تیتراسیون از آن بهره گرفته میشود.
همانطور که میدانید ید فرار است و این میتواند در روند تیتراسیون یدومتری باعث ایجاد خطا شود. مقدار خطای این مورد را میتوان با سرد کردن مخلوط تیتراسیون کاهش داد. همچنین باید از وجود مقدار مازاد یدید نیز اطمینان حاصل کنیم. همچنین عواملی مانند نور شدید و وجود یونهای نیتریت $$(NO_2^-)$$ و مس میتواند باعث تبدیل یدید به ید شود. بنابراین باید پیش از افزودن یدید به نمونه تیتراسیون، آنها را در صورت وجود با دقت و کاملا حذف کنیم.
در صورتی که تیتراسیون یدومتری به درازا بینجامد، توصیه میشود به مخلوط تیتراسیون اندکی یخ خشک افزوده شود تا جایگزین هوا در ارلن تیتراسیون شود، زیرا هوا توانایی اکسید کردن یدید و تبدیل آن به ید را دارد.

محلول ید استاندارد این تیتراسیون از پتاسیم یدات $$(KIO_3)$$ و پتاسیم یدید $$(KI)$$ تهیه میشود که هر دو استانداردهای اولیه هستند.
$$IO_3^-+ 8 I^− + 6 H^+ → 3 I_3^-+ 3 H_2O$$
توجه داشته باشید که ید نیز مانند «دیاتیل اتر» $$((CH_3CH_2)_2O)$$ و «کربن تتراکلرید» $$(CCl_4)$$ حلالی آلی است و ممکن است بتوان آن را با سدیم تیوسولفات حل شده در استون، تیتر کرد.
عوامل کاهنده دیگر
در این تیتراسیون، لزوما نباید از تیوسولفات به عنوان عامل کاهنده استفاده شود. در زیر تعدادی از جایگزینهای تیوسولفات در مقدار $$pH$$ بالای ۸ را مشاهده میکنید.
- استانوس کلرید $$(SnCl_2)$$
- نمک سولفیت $$(SO_3^{2-})$$
- نمک سولفید $$(S^{2-})$$
- نمک آرسنیک
- نمک آنتیموان
دلیل تعیین مقدار $$pH$$ به بالای ۸ این است که در مقادیر پایینتر، امکان وقوع واکنش زیر با تیوسولفات وجود دارد.
$$S_2O_3^{2−}+ 2 H^+ \rightarrow SO_2 + S + H_2O$$
همچنین برخی واکنشها در حضور ترکیباتی خاص، در مقدار $$pH$$ مشخصی، «برگشتپذیر» (Reversible) هستند و از همین رو باید مقدار $$pH$$ را پیش از انجام مراحل تیتراسیون به دقت تنظیم کرد. برای مثال واکنش زیر را در نظر بگیرید. این واکنش در مقدار $$pH$$ کمتر از ۴ بهصورت برگشتپذیر انجام میشود.
$$H_3AsO_3 + I_2 + H_2O → H_3AsO_4 + 2 H^+ + 2 I^−$$
کاربرد تیتراسیون یدومتری
از تیتراسیون یدومتری برای آنالیز و تعیین غلظت گونههای اکسنده در نمونههای آب استفاده میشود. از این مورد میتوان به تعیین میزان اشباع بودن اکسیژن در زیستبومها اشاره کرد. همچنین برای تعیین مقدار کلر فعال در آب استخرهای شنا نیز از این روش بهره میبرند.

از این روش تیتراسیون میتوان برای سنجش مس، کلرات $$(ClO_3^-)$$، هیدروژن پرکسید $$(H_2O_2)$$ و اکسیژن محلول استفاده کرد.
در این راستا به واکنشهای زیر توجه کنید.
- تیتراسیون مس
$$2 Cu^{2+} + 4 I^− → 2 CuI + I_2$$
- تیتراسیون کلرات
$$6 H^+ + ClO^−_3+ 6 I^− → 3 I_2 + Cl^− + 3 H_2O$$
- تیتراسیون هیدروژن پروکسید
$$2 H^+ + H_2O_2 + 2 I^− → I_2 + 2 H_2O$$
- تیتراسیون منگنز
$$2 H_2O + 4 Mn(OH)_2 + O_2 → 4 Mn(OH)_3$$
$$2 Mn^{3+} + 2 I^− → I_2 + 2 Mn^{2+}$$
کلر موجود در محیط را معمولا به کلر آزاد شده از واکنش اسیدهای رقیق بر هیپوکلریت $$(ClO^-)$$ نسبت میدهند. از تیتراسیون یدومتری معمولا برای یافتن میزان هیپوکلریت فعال در مواد سفیدکننده، استفاده میشود. در این روش مقدار مشخص و مازادی از یدید به مقدار مشخصی از نمونه افزوده میشود. توجه داشته باشید که در این نمونه تنها هیپوکلریت فعال (الکتروندوست) توانایی اکسید کردن یدید به ید را دارد. به این صورت میتوان مقدار ید و متعاقبا کلر فعال را به کمک تیتراسیون یدومتری مورد محاسبه قرار داد.

اندازهگیری ترکیبات آرسنیک خلاف استاندارد کردن محلول ید به کمک سدیم آرسنیت $$(NaAsO_2)$$ است. در این مورد مقدار مشخص و مازادی از یدید به نمونه اضافه میشود. به واکنش زیر دقت کنید.
$$As_2O_5 + 4 H^+ + 4 I^− \rightleftharpoons As_2O_3 + 2 I_2 + 2 H_2O$$
برای آنالیز ترکیبات آنتیموان، مقدار کمی از تارتاریک اسید برای افزایش انحلالپذیری محصولات به محیط تیتراسیون افزوده میشود.
چند مثال کاربردی از تیتراسیون یدومتری
تا اینجا با نحوه انجام تیتراسیون یدومتری و جزئيات آن آشنا شدیم. در این بخش میخواهیم تعدادی تیتراسیون یدومتری را با مثال و مرحله به مرحله مورد بررسی قرار دهیم.
تیتراسیون یدومتری هیدروژن سولفیت و سولفیت
سولفیتها با فرمول شیمیایی $$ SO^{2−}_3$$ و هیدروژن سولفیتها با فرمول شیمیایی $$ HSO^−_3$$ در محیط اسیدی به راحتی ید را میکاهند. بنابراین وقتی مقداری مشخصی از ید استاندارد رقیق بهصورت مازاد به حجم مشخصی از نمونه حاوی آنها افزوده میشود، سولفیت و هیدروژن سولفید باعث کاهش آن میشود. این دو واکنش را میتوانید در زیر مشاهده کنید.
$$SO^{2−}_3+ I_2 + H_2O → SO^{2−}_4+ 2 H^+ + 2 I^−$$
تیتراسیون یدومتری سولفیت
$$HSO^{−}_3+ I_2 + H_2O → SO^{2−}_4+ 3 H^+ + 2 I^−$$
تیتراسیون یدومتری هیدروژن سولفیت
تیتراسیون یدومتری هیدروژن سولفید و سولفید
گرچه میتوان سولفیدها را نیز مانند سولفیتها، که در بخش قبلی آورده شده است، بهصورت مستقیم تیتر کرد، با این حال در این مورد نتایج قابل قبولی به دست نخواهد آمد. در عوض میتوان از روش دیگری استفاده کرد که نتایج بسیار دقیقی خواهد داشت. در این روش مقدار مازاد و مشخصی از سدیم آرسنیت به نمونه افزوده میشود. طی این روش، همانطور که در واکنش زیر نشان داده شده، آرسنیک سولفید تشکیل رسوب خواهد داد.
$$As_2O_3 + 3 H_2S → As_2S_3 + 3 H_2O$$
در مرحله بعد آرسنیک تریاکسید مازاد، در مقابل محلول استاندارد ید در حضور شناساگر نشاسته، تیتر میشود. توجه داشته باشید که در این تیتراسیون برای داشتن نتایج دقیقتر، محلول سولفید باید رقیق باشد و هچنین غلظت آن بیش از ۰٫۰۱ مولار نباشد.
تیتراسیون یدومتری هگزاسیانو فرات (III)
با افزودن یدید به محلول هگزاسیانو فرات (III)، شاهد تعادل زیر خواهیم بود.
$$2 [Fe(CN)_6]^{3−} + 2 I^− \rightleftharpoons 2 [Fe(CN)_6]^{4−} + I_2$$
در محیط اسید قوی، تعادل به مقدار زیادی به سمت راست پیشروی خواهد کرد اما در محیط خنثی برعکس آن اتفاق میافتد. این مورد آنالیز هگزاسیانو فرات (III) را دشوار میسازد زیرا یدید و تیوسولفات در محیطی با اسیدیته بالا تخریب میشوند.
برای پیشبرد این واکنش و کامل شدن آن، مقدار مازادی از نمک روی را میتوان به محیط واکنش حاوی یونهای پتاسیم، افزود. در این مورد واکنش زیر صورت میگیرد و هگزاسیانو فرات (III) تولید رسوب میکند.
$$2 [Fe(CN)_6]^{3−} + 2 I^− + 2 K^+ + 2 Zn^{2+} \rightarrow 2 KZn[Fe(CN)_6]^− + I_2$$
این رسوب در محیطی با اسیدیته ملایم به وجود میآید و مشکل تخریب یدید و تیوسولفات برطرف خواهد شد. سپس میتوان هگزاسیانو فرات (III) را بهصورتی که پیش از این توضیح دادیم، توسط تیتراسیون یدومتری مورد سنجش قرار داد.
اندازه گیری ویتامین ث به روش یدومتری
از این روش تیتراسیون برای سنجش میزان «ویتامین ث» (Vitamin C) موجود در ترکیبات خوراکی استفاده میشود. در این بخش میخواهیم چگونگی انجام این فرایند را مورد بررسی قرار دهیم.
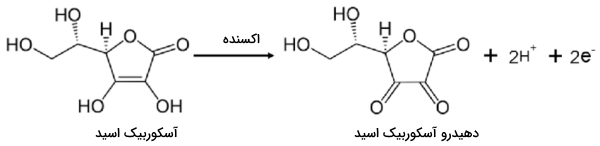
ویتامین ث یا همون «آسکوربیک اسید» (Ascorbic Acis) از طریق یک عامل اکسنده ملایم مانند ید تبدیل «دهیدرو آسکوربیک اسید» (Dehydroascorbic Acid) میشود. نحوه انجام این واکنش را میتوانید در تصویر زیر مشاهده کنید.
ویتامین ث در محلول آبی به سرعت توسط اکسیژن، به دهیدرو آسکوربیک اسید تبدیل میشود. بنابراین برای انجام تیتراسیون یدومتری برای آن، باید آن را در لحظه و فوری در آب حل کرد و از نگهداری طولانی مدت آن خودداری کرد. البته توجه داشته باشید که در طول تیتراسیون نیز مقداری اکسیداسیون توسط اکسیژن صورت میگیرد که غیرقابل اجتناب است.
با این حال نباید ارلن حاوی ویتامین ث را خیلی تکان دهیم تا حجم زیادی از هوا و در نتیجه اکسیژن وارد آن نشود. در این تیتراسیون یدومتری از شناساگر نشاسته بهره گرفته میشود.
اندازه گیری مس به روش یدومتری
در تیتراسیون یدومتری مس، یونهای یدید توسط $$Cu^{2+}$$ تبدیل به ید میشوند. در این تیتراسیون خود مس نیز تبدیل به $$Cu^+$$ خواهد شد. برای بهبود نتایج حاصل از این تیتراسیون بهتر است که محیط اسیدی باشد، بنابراین قبل از شروع کار مقدار $$pH$$ آن را در حدود ۴٫۵ تنظیم میکنیم.
محلول این تیتراسیون باید عاری از ترکیبات جانبی باشد که میتواند یدید را اکسید کنند. از این مورد میتوان به نیتراتها و $$Fe^{3+}$$ اشاره کرد. در این تیتراسیون واکنشهای زیر به وقوع میپیوندند.
$$2Cu^{2+} + 4I^- → 2CuI(s) + I_2$$
در مرحله بعد نیز خواهیم داشت:
$$2S_2O_3^{2-} + I_2 → S_4O_6^{2-} + 2I^-$$
در این تیتراسیون نیز از شناساگر نشاسته، طبق گفتههای قبلی، استفاده خواهیم کرد. در نهایت با در دست داشتن مقدار مصرف شده از تیترانت، میتوانیم محاسبات مربوط به غلظت مجهول را انجام دهیم. توجه داشته باشید که میتوانیم برای این کار از واکنشی سادهشده استفاده کنیم، زیرا تنها در دست داشتن نسبت استوکیومتری اجزا کافیست. این واکنش را میتوانید در زیر مشاهده کنید.
$$2Cu^{2+} + 2S_2O_3^{2-} + 2I^- → 2CuI(s) + S_4O_6^{2-}$$
تفاوت تیتراسیون یدومتری و یدیمتری در چیست ؟
توجه به تفاوت دو تیتراسیون «یدومتری» (Iodometry) و «یدیمتری» (Iodimetry) از اهمیت زیادی برخوردار است. ممکن است در برخی موارد این دو روش به جای یکدیگر گرفته شوند. برای پرهیز از هرگونه اشتباه، در این بخش میخواهیم به تفاوتهای موجود بین این دو روش تیتراسیونی اشاره کنیم.
یدیمتری چیست ؟
تیتراسیون یدیمتری نوعی تیتراسیون مستقیم است که در آن عامل کاهنده، آنالیت است. برای این تیتراسیون باید از محلول استاندارد ید و شناساگری مناسب و قوی استفاده کرد. در این روش ید را به کمک یک عامل کاهنده، تیتر میکنند. در طی این تیتراسیون، ید کاهش مییابد و یدید را تولید میکند. همچنین باعث اکسید شدن گونه دیگر خواهد شد. از آنجا که داشتن محلول ید به تنهایی کاری دشوار است، معمولا آن را با پتاسیم یدید و پتاسیم یدات همراه میکنند. در نهایت محلول استاندارد یک تیتراسیون یدیمتری بهصورت زیر به کار میرود.
$$KI+I_2 → KI_3$$
در برخی موارد از نشاسته نیز به عنوان شناساگر تیتراسیون یدیمتری استفاده میشود. در نهایت واکنش تیتراسیون را میتوان به این شکل نشان داد.
$$I_2 + reducing\; agent → 2 I$$
تفاوت یدومتری و یدیمتری
در توضیح تفاوت این دو تیتراسیون، به موارد زیر باید توجه داشت.
- یدومتری روش تیتراسیونی است که در آن از عامل کاهنده برای تیتر کردن ید تولید شده در مرحله ابتدایی، واکنش اکسایش-کاهش، استفاده میشود اما از یدیمتری تیتراسیونی است که در آن از یک عامل کاهنده برای تیتر کردن محلول ید بهصورت مستقیم بهره گرفته میشود.
- یدیمتری تیتراسیونی مستقیم است درحالی که در تیتراسیون یدومتری از روش غیرمستقیم برای انجام فرایند کمک گرفته میشود.
- در تیتراسیون یدومتری دو واکنش اکسایشی-کاهشی به وقوع میپیوندد اما در تیتراسیون یدیمتری تنها یک واکنش وجود دارد.
- در تیتراسیون یدومتری، ید ابتدا اکسید میشود و متعاقبا به وسیله یک عامل کاهنده، کاهش پیدا میکند اما در یدیمتری ید فورا کاهش مییابد.
- از تیتراسیون یدومتری در آزمایشهای بسیاری استفاده میشود اما تیتراسیون یدیمتری چندان پرکاربرد نیست.
- از تیتراسیون یدومتری برای تعیین ترکیبات اکسنده استفاده میشود در حالی که تیتراسیوت یدیمتری برای تعیین ترکیبات کاهنده به کار میرود.
در جدول زیر به برخی از مهمترین تفاوتها، بهصورت تیتروار اشاره کردهایم.
| ویژگی | تیتراسیون یدومتری | تیتراسیون یدیمتری |
| نوع تیتراسیون | تیتراسیون غیرمستقیم | تیتراسیون مستقیم |
| تعداد واکنشهای کاهشی | ۲ | ۱ |
| ید | در ابتدا اکسید میشود و سپس کاهش مییابد. | کاهش مییابد. |
| رواج | زیاد | کم |
| کاربرد | تعیین عامل اکسنده | تعیین عامل کاهنده |
شناساگر نشاسته
«نشاسته» (Starch) در تیتراسیونهای اکسایش کاهش که در آن ترییدید حضور دارد، بهعنوان شناساگر به کار گرفته میشود. این ماده با ترییدید کمپلکسی به رنگ مشکی/ آبی بسیار تیره تشکیل میدهد. با اینحال توجه داشته باشید که اگر تنها ید یا یدید در محیط حضور داشته باشند، این کمپلکس تشکیل نخواهد شد. رنگ این کمپلکس چنان شدید است که میتوان آن را در غلظت ۲۰ میکرومولار از ید، با چشم تشخیص داد.

در تیتراسیون یدومتری، محلول غلیظ ید با تیترانتی مانند تیوسولفات وارد واکنش میشود. در این مرحله بیشتر مقدار ید از محیط حذف و سپس نشاسته افزوده میشود. این کار به این دلیل است که کمپلکس نشاسته با ترییدید ناملحلول است و میتواند جلوی مقادیری از ید را بگیرد تا وارد واکنش نشود. در نزدیکی نقطه پایانی، نشاسته به محیط افزوده میشود و فرایند تیتراسیون با در نظر گرفتن مقدار تیوسولفات افزوده شده، از سر گرفته میشود.
خطا در تیتراسیون یدومتری
بسیاری از روشهای عملی در شیمی و علوم پایه اگر با دقت لازم اجزا نشوند، نه تنها مفید نیستند بلکه باعث ایجاد خطا و گمراهی خواهند شد. در این بین روشهایی وجود دارند که دارای حساسیت بیشتری هستند. تیتراسیون یدومتری به این دسته تعلق دارد. در زیر لیستی از مواردی که میتواند در این تیتراسیون باعث به وجود آمدن خطا شود را مشاهده میکنید.
- شناساگر نشاستهای که تازه نباشد، نمیتواند بهخوبی عمل کند. استفاده از این شناساگر در تعیین نقطه پایان تیتراسیون ایجاد خطا میکند و محاسبات تعیین غلظت آنالیت نیز نادرست خواهد بود.
- یدید در محیط اسیدی اکسید میشود، به همین دلیل در شرایطی که ناگزیر به اسیدی کردن محیط هستیم، باید تیتراسیون را با سرعت بالایی انجام دهیم تا میزان خطا به حداقل برسد.
- ید فرار است و در اثر تبخیر از دست میرود و برای جلوگیری از این مورد باید مقدار مازاد مناسبی از آن را در نظر داشته باشیم. همچنین تبخیر ید در محلولهای سرد کمتر خواهد بود، بنابراین باید تا حد ممکن از داشتن محلول تیتراسیون با دمای بالا خودداری کرد.
مثال و حل تمرین از تیتراسیون یدومتری
حال که با مفهوم تیتراسیون یدومتری آشنا شدیم، میخواهیم در ادامه به بررسی تعدادی مثال و تمرین بپردازیم. با دقت به پاسخهای تشریحی، میتوانید توانایی حل مسائل محاسباتی تیتراسیون کمپلکسومتری را کسب کنید.
مثال از تیتراسیون یدومتری
در ابتدا تعدادی مثال را به همراه پاسخ تشریحی بهطور کامل بررسی خواهیم کرد.
مثال اول
قصد تیتراسیون نمونهای حاوی آسکوربیک اسید با فرمول شیمیایی $$C_6H_8O_6$$ را داریم. مقدار آسکوربیک اسید در نمونه ۱۰ میلیگرم است. چند مول از $$KIO_3$$ برای تکمیل واکنش با نمونه مورد نیاز است؟
پاسخ
این تیتراسیون طی دو واکنش زیر انجام میشود.
$$KIO_3 + 5KI + 6H^+ → 3I_2 + 6K^+ + 3H_2O$$
$$C_6H_8O_6 + I_2 → C_6H_6O_6 + 2I^- + 2H^+$$
با توجه به این واکنشها نسبت تعداد مولهای آسکوربیک اسید به مولهای پتاسیم یدات ۳:۱ است، یعنی به ازای هر ۳ مول از آسکوربیک اسید، ۱ مول از پتاسیم یدات مصرف میشود.
در مرحله بعد باید تعداد مولهای موجود در نمونه را بیابیم. همانطور که در صورت سوال آورده شده است، نمونه اولیه ۱۰ میلیگرم است. جرم مولکولی آسکوربیک اسید برابر با ۱۷۶٫۱ گرم بر مول است. میتوانیم تعداد مولها را بهصورت زیر محاسبه کنیم.
$$ 0.010\; g \times 176.1frac{g}{mol} = 5.6786times10^{-5}\;mol_{ascorbic\; acid}$$
با توجه به اینکه نسبت آسکوربیک اسید و پتاسیم یدات ۱ به ۳ است، مقدار مولهای پتاسیم یدات برابر با $$۱٫۸۹times۱۰^{-۵}$$ خواهد بود.
مثال دوم
با توجه به مثال پیشین، غلظت $$KIO_3$$ را بهصورتی محاسبه کنید که مقدار مول به دست آمده در آن، در ۲۵ میلیلیتر از نمونه موجود باشد.
پاسخ
با توجه به محاسبات مثال قبل میدانیم که برای رسیدن به نقطه همارزی به $$۱٫۸۹times۱۰^{-۵}$$ مول از پتاسیم یدات در تیتراسیون ۱۰ میلیگرم نمونه آسکوربیک اسید، نیاز است. میتوانیم برای رسیدن به پاسخ، به روش زیر عمل کنیم.
$$ 1.89times10^{-5}\; mol \times 0.025\;L = 7.57times10^{-4}\;M_{KIO_3}$$
مثال سوم
با توجه به دو مثال قبل، به این سوال پاسخ دهید. میخواهیم بدانیم برای تهیه محلول استاندارد به چه مقداری از پتاسیم یدات نیاز داریم. در واقع میخواهیم محلول آن را از فرم جامدش به دست آوریم. حجم نمونه استاندارد را ۲۵ میلیلیتر در نظر بگیرید.
پاسخ
در مرحله اول تعداد مولهای مورد نیاز برای تهیه این محلول استاندارد را محاسبه میکنیم. یعنی باید بدانیم برای داشتن ۲۵۰ میلیلیتر محلول استاندارد پتاسیم یدات با مولاریته $$۷٫۵۷times۱۰^{-۴}$$ به چه مقدار مول از آن نیاز داریم. این کار را به روش زیر انجام میدهیم.
$$ 7.57times10^{-4}\; M \times 0.25\;L = 1.89times10^{-4}\;mol_{KIO_3}$$
در مرحله بعد با در دست داشتن تعداد مولها، جرم مورد نیاز از پتاسیم یدات برای تهیه محلول را محاسبه میکنیم. با توجه به اینکه جرم مولکولی پتاسیم یدات برابر با ۲۱۴ گرم بر مول است، میتوانیم اینطور بنویسیم.
$$ 1.89times10^{-4}\; mol \times 214\;frac{g}{mol} = 0.04\;g_{KIO_3}$$
تمرین از تیتراسیون یدومتری
حال که تعدادی مثالها را به همراه پاسخ تشریحی مورد بررسی قرار دادیم، به سراغ تعدادی تمرین چندگزینهای برای عمیقتر کردن درک خود از مفهوم تیتراسیون یدومتری میرویم.
تمرین اول
مواد غذایی حاوی نشاسته، زمانی که در معرض ید قرار میگیرند، از خود رنگی ... به جای میگذارند.
نارنجی
صورتی
سبز
آبی/ مشکی
تمرین دوم
یدهای ترییدید از واکنش ید با یونهای یدید به وجود میآید. چرا محلول ید باید برای استفاده به عنوان تیترانت حاوی یک نمک یدید باشد؟
یونهای ترییدید در واکنش اکسایش و کاهش تغییر رنگ واضحتری از خود به نمایش میگذارند.
نمکهای ترییدید در آب، انحلالپذیری بیشتری نسبت به ید دارند.
یونهای ترییدید بیشتر از ید اکسید میشوند.
یونهای یدید نسبت به ید در برابر هوا پایداری و مقاومت بیشتری از خود بروز میدهند.
تمرین سوم
کدام یک از عبارتهای زیر در مورد تیتراسیون یدومتری صادق است؟
ید به عنوان تیترانت برای آنالیتی کاهنده به کار میرود.
ید به عنوان تیترانت برای آنالیتی اکسنده به کار میرود.
یدید مازاد با آنالیت وارد واکنش میشود و ید حاصل از آن، با سدیم تیوسولفات تیتر میشود.
تیوسولفات مازاد با آنالیت وارد واکنش میشود و باقیمانده آن با ید تیتر میشود.
تمرین چهارم
کدام یک از عبارتهای زیر باعث افزایش دقت تیراسیون یدومتری نمیشود؟
کاهش مقدار $$pH$$ محلول آنالیت اسیدی
افزودن شناساگر نشاسته به محلول ید
استفاده از محلول یدید تازه
بهکارگیری مقدار مازاد یدید در محلول ید
تمرین پنجم
در یک تیتراسیون یدومتری واکنشهای متوالی زیر به وقوع میپیوندد.
$$2Cu^{2+}+4I^−→Cu_2I_2+I_2+2Na_2S_2O_3→2NaI+Na_2S_4O_6$$
۰٫۱۲ مول از $$Cu_2SO_4$$ به محلول مازاد $$KI$$ افزوده میشود. ید آزاد شده نیاز به ۱۲۰ میلیلیتر از $$Na_2S_2O_3$$ دارد. مولاریته $$Na_2S_2O_3$$ را محاسبه کنید.
۲ مولار
۰٫۲ مولار
۰٫۱ مولار
۱ مولار
واکنشهای دخیل در این تیتراسیون را میتوان بهصورت زیر و جدا از هم نوشت.
$$2Cu^{+2}+4I^−→Cu_2I_2+I_2$$
$$I_2+2Na_2S_2O_3→2NaI+Na_2S_4O_6$$
میتوانیم مولاریته مورد نیاز را بهصورت زیر به دست آوریم.
$$M_{Na_2S_2O_3}=\frac{0.12\;moles}{0.120\;L}=1\;M_{Na_2S_2O_3}$$
سوالات متدوال
حال که با مفهوم تیتراسیون یدومتری آشنا شدهایم، میخواهیم به تعدادی از مهمترین و پرتکرارترین سوالهای پیرامون این مفهوم، بپردازیم.
تفاوت یدومتری و یدیمتری در چیست؟
یدومتری تیتراسیونی غیرمستقیم است که برای تعیین ترکیبات اکسنده به کار میرود اما از تیتراسیون مستقیم یدیمتری برای تعیین ترکیبهای کاهنده استفاده میشود.
دلیل استفاده از پتاسیم یدید در تیتراسیون یدومتری چیست ؟
یدید به تنهایی در حضور عامل اکسنده، تبدیل به ید میشود، بنابراین میتوان به جای آن از پتاسیم یدید استفاده کرد.
تفاوت تیتراسیون مستقیم و تیتراسیون برگشتی در چیست؟
در تیتیراسیون برگشتی یا غیرمستقیم به دلایلی مانند کند بودن واکنش یا نبود شناساگر مناسب، مقدار مازادی از تیترانت افزوده میشود و خود مورد تیتراسیون قرار میگیرد. با در دست داشتن این مقدار مازاد، میتوان آنالیت اولیه را تعیین کرد.
چرا آزمایش یدومتری باید در تاریکی صورت گیرد؟
بهتر است اجزای واکنش پیش از انجام تیتراسیون در محیطی تاریک باشند زیرا نور باعث سرعت بخشیدن به واکنشی جانبی میشود که طی آن یونهای یدید توسط اکسیژن هوا به ید تبدیل میشوند.
جمع بندی
هدف از این مطلب آشنایی با تیتراسیون یدومتری به عنوان عضوی از خانواده تیتراسیونهای اکسایش کاهش بود. در این تیتراسیون از روش غیرمستقیم برای سنجش آنالیت استفاده میشود و مقدار مازادی از تیترانت به محیط اضافه میشود و خود مورد تیتراسیون قرار میگیرد و از این طریق میتوان به غلظت مجهول آنالیت دست پیدا کرد. در ادامه روشهای انجام این تیتراسیون و محاسبات مورد نیاز آن را مورد مطالعه قرار دادیم.










