گاز چیست؟ – توضیح به زبان ساده + مثال و تمرین
گاز یکی از حالتهای ماده است. گازها حجم و شکل مشخصی ندارند. به بیان دیگر، گازها میتوانند به داخل محفظهای با شکل و حجم مشخص بروند و در آن گسترده شوند و شکل محفظه را به خود بگیرند. ذرات تشکیلدهنده گاز چیدمان واقعی ندارند. در واقع این ذرات به راحتی میتوانند از کنار یکدیگر حرکت کنند و فاصله بین آنها میتواند افزایش یا کاهش یابد. گازهای زیادی در طبیعت وجود دارند، اما تمام آنها تنها در تعداد کمی ویژگی با یکدیگر اشتراک دارند. مولکولهای داخل گاز با یکدیگر برخورد میکنند و سرعت آنها با توجه به دما و فشار ممکن است کاهش یا افزایش یابد. در بیشتر مواقع، مولکولها برای پر کردن محفظه به طور یکسان در آن پخش میشوند. در این مطلب از مجله فرادرس به پرسش گاز چیست به زبان ساده پاسخ میدهیم و مهمترین ویژگیهای آن را بیان میکنیم.
- یاد خواهید گرفت که ویژگیها و تعریف علمی گاز چیست.
- میآموزید که تفاوتهای کلیدی میان جامد، مایع و گاز چیست.
- مهارت بهکارگیری روشهای ساده برای اندازهگیری حجم گاز را پیدا میکنید.
- قوانین بویل، شارل و معادله گاز ایدهآل را یاد میگیرید.
- روش انجام آزمایشهای عملی درباره رفتار گازها را میآموزید.
- با فرآیندهای ایجاد، مزایا و معایب زیستگاز آشنا میشوید.


گاز چیست ؟
گاز یکی از حالتهای ماده است که بسته به سرعت و فاصله مولکولهای ماده از هم میتواند تعریف شود. مولکولهای گاز فاصله بیشتر از یکدیگر نسبت به مایعات و جامدات دارند. این مواد شکل ظرف را به خود نمیگیرند و سرعت حرکت بالایی دارند. به راحتی در محیط پخش میشوند و معمولا قابل فشرده سازی هستند و با واحد حجم (لیتر، میلیمتر مکعب، سانترمتر مکعب و ...) اندازهگیری میشوند.
به طور حتم در دوران کودکی از کف صابون، حبابهای رنگی ساختهاید و از پرواز آنها در اطراف خود لذت بردهاید. حبابهای ساخته شده چیزی جز لایه نازکی از صابون نیستند که هوا داخل آنها حبس شده است. هوا چیست؟ هوا گاز است. سوال مهمی که ممکن است مطرح شود آن است که گاز چیست. هر چیزی در کیهان یا انرژی است یا ماده. انرژی شکلهای مختلفی دارد:
- نور
- گرما
- صوت
- الکتریسیته
- هستهای
در این بخش، در مورد ماده صحبت میکنیم. ماده فضا اشغال میکند و میتواند به سه شکل کلی جامد، مایع یا گاز باشد. گاز مادهای است که شکل و حجم مشخصی ندارد. به بیان دیگر، گاز میتواند وارد محفظه با شکلی معین شود و شکل محفظه را به خود بگیرد. ذرات تشکیلدهنده گاز پس از ورود به محفظه پخش میشوند و تمام محفظه را پر میکنند. گازهای زیادی در طبیعت وجود دارند، اما تمام آنها تنها در تعداد کمی ویژگی با یکدیگر اشتراک دارند. مولکولهای داخل گاز به طور مداوم با یکدیگر برخورد میکنند و سرعت آنها با توجه به دما و فشار ممکن است کاهش یا افزایش یابد. اما این مولکولها برای پر کردن محفظه در بیشتر مواقع به طور یکسان در آن پخش میشوند.
ویژگی گاز چیست؟
حرکت مولکولهای ذرات تشکیلدهنده گاز بدان معنا است که گاز، انرژی جنبشی زیادی دارد. انرژی جنبشی به دلیل حرکت ذرات در گاز ایجاد میشود. همچنین، گازها میتوانند فشرده شوند. مولکولهای گاز میتوانند تحت فشار زیاد به یکدیگر نزدیک شوند. به بیان دیگر، با تحت فشار دادن گاز، مولکولهای آن را مجبور میکنیم در فاصله نزدیکتری نسبت به یکدیگر قرار گیرند. علاوه بر داشتن انرژی جنبشی زیاد و قابلیت فشرده شدن تحت فشار زیاد، مولکولهای گاز میتوانند از ناحیهای به ناحیه دیگر بروند. به این نکته توجه داشته باشید که نیروی جاذبه تاثیری بر جهت جریان گاز ندارد.
با توجه به آنکه گازها میتوانند از ناحیهای به ناحیه دیگر جریان داشته باشند، آنها را میتوانیم به عنوان ماده سیال نیز در نظر بگیریم. ویژگی مهم دیگر گازها آن است که دمای ذوب و دمای جوش آنها کمتر از دمای اتاق (۲۵ درجه سانتیگراد) است. گازها به دلیل فاصله بین ذرات آنها دیده نمیشوند. شاید از خود بپرسید پس چگونه میتوانیم گازهای مختلف را شناسایی کنیم. برای شناسایی گازها از ویژگیهایی مانند فشار، حجم، تعداد ذرات بر واحد حجم و دما استفاده میکنیم. گازها کاربردهای مهمی در زندگی روزمره دارند و در آشپزی، تحقیقات علمی یا پزشکی از آنها استفاده میشود. پس از خواندن این مطلب میدانیم:
- مهمترین ویژگیهای گاز چیست و چه تفاوتی با مایع و جامد دارد.
- زیستگاز چیست و چگونه تولید میشود.
- گاز ایدهآل چیست.
- گاز طبیعی چیست و چگونه تولید میشود.
تفاوت مایع و جامد با گاز چیست ؟
تا اینجا میدانیم مهمترین ویژگیهای گاز چیست و چه مشخصههای مهمی دارد. همانطور که در بخش قبل گفتیم ماده سه حالت کلی جامد، مایع و گاز دارد. در این بخش، در مورد هر یک از حالتهای ماده صحبت میکنیم و تفاوت دو حالت مایع و جامد را با گاز توضیح میدهیم. سه حالت ماده را میتوان براساس چهار ویژگی مهم زیر با یکدیگر مقایسه کنیم:
- شکل و حجم
- تراکمپذیری
- صلب یا سیال
- آیا محفظه را کامل پر میکند؟
برای آنکه تفاوت میان گاز با مایع و جامد را بدانیم، ابتدا در مورد هر یک از سه حالت ماده به طور جداگانه صحبت میکنیم.
جامد چیست ؟
با کمی دقت به اطراف خود، مواد جامد زیادی را مشاهده میکنیم. کتاب، مداد، کیف و بسیاری از وسایل دیگر که به صورت روزمره از آنها استفاده میکنیم، جامد هستند. مواد جامد شکل مشخصی دارند. این مواد ممکن است شکل منظم یا نامظمی داشته باشند. شکل ماده جامد در حالت عادی تغییر نمیکند. به بیان دیگر، شکل ماده جامد در فشار و دمای ثابت، یکسان باقی میماند. آیا ماده جامد حجم مشخصی دارد؟ بله. زیرا حجم اشغال شده توسط مواد جامد تغییر نمیکند. حجم اشغال شده توسط ماده جامد را میتوانیم به راحتی بهدست آوریم.
اگر شکل جامد مشخص باشد، به راحتی میتوانیم حجم آن را اندازه بگیریم. حجم جسمی جامد با شکل نامشخص مانند ساعت را چگونه اندازه میگیریم؟ برای انجام این کار از روش جابجایی مایع ارشمیدس استفاده میکنیم. بِشِری به حجم ۲۵۰ میلیلیتر بردارید و آن را تا حجم ۱۵۰ میلیلیتر از آب پر کنید. سپس ساعت خود را درون آب قرار دهید. حجم آب پس از قرار دادن ساعت در آن افزایش مییابد. با استفاده از مقدار افزایش حجم آب میتوانیم حجم ساعت را بهدست آوریم.
به طور معمول، فشرده کردن مواد جامد بسیار سخت است. به عنوان مقال، اجسام جامدی مانند ساعت یا لیوان بلوری را نمیتوانیم فشرده کنیم. اما استثناهایی مانند اسفنج نیز وجود دارند. اسفنج را میتوان به راحتی و با کمی فشار، فشرده کرد. ماده جامد سیال است یا سخت؟ سخت. زیرا ماده جامد شکل مشخصی دارد. اما سیال به راحتی میتواند جریان داشته باشد. سوال مهمی دیگری که ممکن است مطرح شود آن است که آیا مواد جامد، محفظه خود را به طور کامل پر میکنند. به تصویر زیر توجه کنید. توپی پلاستیکی را داخل بِشِر قرار میدهیم. آیا توپ، ظرف را به طور کامل پر میکند. همانطور که در تصویر زیر مشاهده میکنید توپ، بِشِر را به طور کامل پر نمیکند.

بنابراین، ویژگیهای ماده جامد را میتوان به صورت زیر خلاصه کرد:
- شکل و حجم مشخصی دارد.
- تراکمناپذیر است.
- صلب است.
- محفظه را پر نمیکند.
مایع چیست ؟
مایعات حجم مشخص و شکل نامشخصی دارند. این ویژگی را با آزمایشی بسیار ساده اثبات میکنیم. بِشِری به حجم ۲۰۰ میلیلیتر برمیداریم و آن را با ۱۰۰ میلیلیتر آب پر میکنیم. بنابراین، حجم آب برابر ۱۰۰ میلیلیتر است.
همانطور که در تصویر زیر مشاهده میکنید، سه محفظه با شکلهای مشخص انتخاب و آبِ داخلِ بِشِر را به ترتیب داخل هر یک از آنها میریزیم و تغییر حجم و شکل آب را به دقت بررسی میکنیم. ابتدا آبِ داخلِ بِشِر را داخل بطری پلاستیکی آب معدنی میریزیم. سپس، آب را از بطری به لیوان بلوری با شکل مشخص میریزیم.

در پایان، آب را از لیوان، داخل استوانه مدرج میریزیم. حجم آب را با استفاده از استوانه مدرج اندازه میگیریم و برابر ۱۰۰ میلیلیتر بهدست میآوریم. بنابراین، حجم آب ثابت مانده و تغییر نکرده است.

از این آزمایش ساده چه نتیجهای میتوان گرفت؟ مایع، حجم ثابتی دارد، اما شکل مشخصی ندارد و شکل آن از انتقال از ظرفی به ظرف دیگر تغییر میکند. به بیان دیگر، مایع، شکل ظرف را به خود میگیرد. آیا مایعات تراکمپذیر هستند؟ بطری پلاستیکی بردارید و مقدار آب داخل آن بریزید. اکنون بطری پلاستیکی را از طرفین فشار دهید. اینگونه به نظر میرسد که میتوانیم آب را فشرده یا متراکم کنیم. اما نکتهای که باید به آن دقت کنیم آن است که با فشردن بطری پلاستیکی از طرفین، آب داخل آن را فشرده نمیکنیم. در واقع، هوای داخل بطری را فشرده میکنیم.
اکنون اگر بطری پلاستیکی را به طور کامل با آب پر کنیم، برای فشردن بطری باید نیروی بسیار زیادی بر آن وارد کنیم. بنابراین، مایعات همانند مواد جامد، تراکمناپذیر هستند. سوال مهم دیگر که باید به آن پاسخ دهیم آن است که آیا مایعات سیال هستند یا صلب. مایعات، شاره یا سیال هستند. این بدان معنا است که مایع میتواند به آسانی جاری شود. به عنوان مثال، به راحتی میتوانید آب را از بطری به داخل لیوان بریزید. مایعات، همانند مواد جامد، محفظه خود را نمیتوانند به طور کامل پر کنند. بنابراین، ویژگیهای مایع را میتوان به صورت زیر خلاصه کرد:
- شکل مشخصی ندارد.
- حجم مشخص دارد.
- تراکمناپذیر است.
- سیال است.
- محفظه را به طور کامل پر نمیکند.
در ادامه، در مورد حالت سوم ماده، یعنی گاز صحبت میکنیم. در مطالب بالا فهمیدیم گاز چیست، در این بخش تفاوتهای آن با مایع و جامد را توضیح میدهیم.
تفاوت مایع و گاز چیست ؟
گاز، حجم و شکل مشخصی ندارد. اما حجم مایع مشخص است. گاز همانند مایع، شکل محفظه را به خود میگیرد. یکی از تفاوتهای مهم مایع و گاز در آن است که گاز، تنها میتواند داخل محفظهای بسته قرار داشته باشد. گاز حجم مشخصی ندارد و حجم آن برابر حجم محفظه است. به عنوان مثال، اگر گاز را از محفظهای با حجم کمتر به محفظهای با حجم بزرگتر منتقل کنیم، حجم آن نیز افزایش خواهد یافت. ویژگی مهم دیگر گازها، تراکمپذیری بالای آنها است. به عنوان مثال، بادکنک را میتوانیم به راحتی فشار دهیم. به طور معمول، گازها تحت فشار زیاد ذخیره میشوند، زیرا تراکمپذیری بالایی دارند. به عنوان مثال، «گاز طبیعی فشرده» (Compressed Natural Gas | CNG) در کپسولهایی با حجم مشخص و تحت فشار بالا نگهداری میشوند.

گازها مانند مایعات، سیال هستند و به راحتی میتوانند از نقطهای به نقطه دیگر منتقل شوند. مایعات را میتوانیم به راحتی مشاهده کنیم، اما گاز دیده نمیشوند. از کلمه سیال یا شاره برای گازها و مایعات استفاده میکنیم. همانطور که در مطالب بالا اشاره شد، گازها دوست دارند محفظه خود با هر حجمی را به طور کامل پر کنند. به عنوان مثال، اگر گازِ داخل محفظهای بسته به حجم را به محفظه با حجم بزرگترِ منتقل کنیم، گاز منتقل شده باز هم محفظه با حجم بزرگتر را به طور کامل پر میکند.
هنگامیکه درپوش عطری را داخل اتاق برمیدارید، بوی عطر در تمام اتاق میپیچد. عطر، گاز و اتاق همانند محفظهای برای آن است. بنابراین، ذرات تشکیلدهنده گاز برای پر کردن حجم اتاق در آن پخش میشوند و ما بوی عطر را حس میکنیم. ویژگیهای گاز به صورت خلاصه عبارت هستند از:
- شکل و حجم مشخصی ندارد.
- تراکمپذیر است.
- سیال است.
- محفظه را به طور کامل پر میکند.
تفاوتهای مهم مایع و گاز را در جدول زیر مشاهده میکنید.
| ویژگی | مایع | گاز |
| شکل | شکل مشخصی ندارد. | شکل مشخصی ندارد. |
| حجم | حجم مشخصی دارد. | حجم مشخصی ندارد. |
| تراکمپذیری | تراکمناپذیر است. | تراکمپذیر است. |
| سیال یا صلب | سیال است. | سیال است. |
| پر کردن محفظه | محفظه را به طور کامل پر نمیکند. | محفظه را به طور کامل پر میکند. |
تفاوت جامد و گاز چیست ؟
در مطالب بالا با مهمترین ویژگیهای جامد و گاز آشنا شدیم. مهمترین تفاوتهای این دو حالت از ماده به صورت خلاصه در جدول زیر نوشته شده است.
| ویژگی | جامد | گاز |
| شکل | شکل مشخصی دارد. | شکل مشخصی ندارد. |
| حجم | حجم مشخصی دارد. | حجم مشخصی ندارد. |
| تراکمپذیری | تراکمناپذیر است. | تراکمپذیر است. |
| سیال یا صلب | صلب است. | سیال است. |
| پر کردن محفظه | محفظه را به طور کامل پر نمیکند. | محفظه را به طور کامل پر میکند. |
تا اینجا میدانیم گاز چیست و چه تفاوتهایی با دو حالت دیگر ماده، یعنی جامد و گاز دارد. آب میتواند در هر سه حالت ماده وجود داشته باشد:
- یخ
- آب (مایع)
- بخار آب
چگونه آب میتواند در سه حالت جامد، مایع و گاز وجود داشته باشد؟ برای پاسخ به این پرسش باید ماده را از نزدیک بررسی کنیم. تمام مواد، در هر حالتی که باشند، از ذرات بسیار ریزی ساخته شدهاند. به عنوان مثال، یخ، آب و بخار آب هر سه از ذرات بسیار ریز مشابهی ساخته شدهاند. این ذرات کوچک، مولکولهای آب نامیده میشوند. در ادامه، سه حالت ماده را در مقیاس مولکولی با یکدیگر مقایسه میکنیم.
بررسی حالت های ماده در مقیاس مولکولی
سه حالت ماده را در مقیاس مولکولی و براساس سه نکته زیر با یکدیگر مقایسه میکنیم:
- فاصله بین ذرات
- نیروی جاذبه بین ذرات
- انرژی جنبشی ذرات
برای داشتن درکی شهودی از مواد در مقیاس مولکولی، دستان خود را به شکل نشان داده شده در تصویر زیر روبروی یکدیگر قرار دهید و ناخن هر انگشت را به عنوان یک مولکول در نظر بگیرید.

ذرات تشکیلدهنده مواد جامد در فاصله بسیار کمی از یکدیگر قرار گرفتهاند و نیروی جاذبه بین آنها بسیار قوی است. در این حالت، ناخنهای انگشتها (ذرات تشکیلدهنده ماده) به صورت نشان داده شده در تصویر زیر قرار میگیرند. فاصله ذرات در ماده جامد بسیار کم است. برای تغییر شکل جامد باید نیروی بسیار بزرگی را بر آن وارد کنیم. در ماده جامد ذرات در اطراف جایگاه خود حرکت میکنند. انرژی جنبشی ذرات تشکیلدهنده ماده جامد بسیار کوچک است.

ذرات تشکیلدهنده مایع در فاصله بیشتری از یکدیگر قرار گرفتهاند و نیروی جاذبه بین آنها ضعیفتر است. همچنین، ذرات در مایع آزادانهتر حرکت میکنند، بنابراین انرژی جنبشی آنها بزرگتر است.
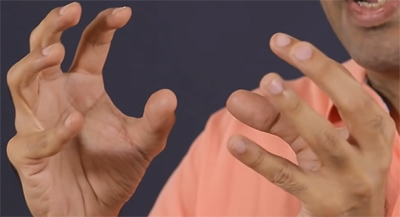
ذرات تشکیل دهنده گاز در فاصله بسیار زیادی از یکدیگر قرار دارند و نیروی جاذبه بین آنها بسیار ضعیف است. ذرات در گاز با سرعت زیادی به اطراف حرکت میکنند و محدود به نقطه مشخصی نیستند. بنابراین، انرژی جنبشی ذرات در گازها بیشینه است. تفاوت بین گاز، مایع و جامد در مقیاس مولکولی در جدول زیر به صورت خلاصه نوشته شده است.
| ویژگی | جامد | مایع | گاز |
| فاصله بین ذرات | کوچک | متوسط | بزرگ |
| نیروی جاذبه بین ذرات | قوی | ضعیف | بسیار ضعیف |
| انرژی جنبشی ذرات | کم | متوسط | زیاد |
در مطالب بالا گفتیم ماده جامد تراکمناپذیر است، اما اسفنج، که به عنوان مادهای جامد در نظر گرفته میشود، به راحتی فشرده میشود. چرا؟ اگر به اسفنج از نزدیک نگاه کنید، حفرههایی متعددی با اندازههای مختلف در آن میبینید. داخل حفرهها هوا به عنوان گاز قرار دارد. بنابراین، به هنگام فشردن اسفنج، هوای بین حفرهها به عنوان گاز فشرده میشود.
گازها همه جا هستند. گازها در فضا و در سیارههای مختلف وجود دارند. گازهای مختلفی در خون ما حل شدهاند. برای توصیف رفتار گازها از مفهومی به نام گاز ایدهال استفاده میشود. در ادامه، در مورد قانون گاز ایدهال و روابط ریاضی حاکم بر آن صحبت میکنیم.
مهم ترین ویژگی های گاز چیست ؟
با مطالعه گازها می توانیم با رفتار ماده در سادهترین شکل آن آشنا شویم. ذرات تکی که مستقل از یکدیگر عمل میکنند. با درک ویژگی گازها میتوانیم با ویژگیهای حالتهای پیچیدهتر ماده مانند مایعات و جامدات نیز آشنا شویم. همانطور که در مطالب بالا اشاره شد گازها شکل و حجم مشخصی ندارند. گاز، هر محفظهای با هر حجم و شکلی را به طور کامل پر میکند. ویژگی مهم دیگر گازها، چگالی کم آنها در مقایسه با مواد مایع و جامد است. یک مول آب در دمای ۲۹۸ کلوین و فشار یک اتمسفر، حجمی برابر ۱۸/۸ سانتیمتر مکعب اشغال میکند. در حالیکه مقدار برابر بخار آب در دما و فشار یکسان، حجمی برابر ۳۰۲۰۰ سانتیمتر مکعب دارد. این حجم در حدود ۲۰۰ برابر حجم اشغال شده توسط آب در حالت مایع است.
یکی دیگر از ویژگیهای بسیار مهم گازها آن است که آنها پاسخ یکسانی در برابر تغییرات فشار و دما از خود نشان میدهند. این رفتار با رفتار مایعات و جامدات بسیار متفاوت است. در مواد مایع و جامد، رفتار مایعات و جامدات بسته به نوع ماده متغیر است. مهمترین ویژگیهای گاز در ادامه نام برده شده است.
- ذرات تک و مستقل
- بدون شکل و حجم مشخص
- پر کننده محفظه
- چگالی پایین
- حجم بسیار بیشتر از مایع
- پاسخ یکسان برابر تغییرات دما و فشار
فشار گاز چیست ؟
برای نگه داشتن گاز داخل محفظه باید جرمی مشخص (دقیقا نیرویی برابر f) را روی پیستون متحرک قرار دهیم. مقدار این نیرو باید برابر نیروی اعمال شده توسط گاز بر زیر پیستون باشد. فشار گاز برابر است که در آن A برابر سطح مقطع پیستون است. واحد یا یکای اندازهگیری فشار در سیستم SI پاسکال است و آن را به صورت نیروی یک نیوتنی که بر سطحی به مساحت یک مترمربع وارد میشود، تعریف میکنیم.
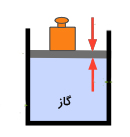
مولکولهای تشکیلدهنده گاز به دنبال حرکت مداوم خود درون گاز، به دیوارههای داخلی محفظه برخورد میکنند. این ذرات بلافاصله پس از برخورد به دیوارهها با تغییر مسیر، ۱۸۰ درجهای برمیگردند. ذرات به هنگام برخورد با دیوارهها هیچ انرژی جنبشی از دست نمیدهند، بنابراین برخورد آنها از نوع برخورد کشسان است. اما تغییر جهت ۱۸۰ درجهای ذرات پس از برخورد با دیوارهها نیرویی به دیوارههای محفظه وارد میکند. این نیرو تقسیم بر سطح برابر فشار گاز است. فشار گاز را میتوانیم توسط اندازهگیری مقدار فشار اعمال شده از سمت خارج به منظور جلوگیری از منبسط یا منقبض شده گاز مشاهده کنیم. برای تصویرسازی این صحنه استوانهای حاوی گازی مشخص را فرض کنید. یک انتهای این استوانه بسته و انتهای دیگر پیستونی متحرک قرار دارد.
دمای گاز چیست ؟
اگر دو جسم با دماهای متفاوت را در کنار یکدیگر قرار دهیم، گرما از جسمی با دمای بالاتر به جسمی با دمای پایینتر تا رسیدن دو جسم به دمای یکسان جریان مییابد. دمای جسم را به صورت غیرمستقیم با قرار دادن وسیلهای کالیبره شده به نام دماسنج در تماس با آن اندازه میگیریم. هنگامیکه جسم و دماسنج به تعادل گرمایی میرسند، دمای نشان داده شده توسط دماسنج برابر دمای جسم است. بنابراین، دمای گازها را نیز با استفاده از دماسنج میتوانیم اندازه بگیریم.
حجم گاز چیست ؟
حجم اشغال شده توسط گاز فضایی است که در آن مولکولهای تشکیلدهنده گاز میتوانند آزادانه حرکت کنند. اگر مخلوطی از گازهای مختلف، مانند هوا، داشته باشیم، گازهای مختلف در حجم یکسانی در کنار یکدیگر قرار گرفتهاند. از این نظر، گازها تفاوت بسیاری نسبت به مایعات و جامدات دارند. حجم گاز را میتوان با به دام انداختن گاز بالای جیوه در لولهای کالیبره شده به نام بورت، اندازهگیری کرد. واحد اندازهگیری حجم در سیستم SI برابر مترمربع است، اما در شیمی بیشتر از دو واحد لیتر و میلیلیتر استفاده میشود.
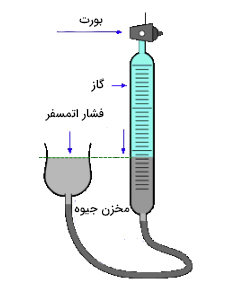
به این نکته توجه داشته باشید که حجم گاز با دما و فشار تغییر میکند. بنابراین، گزارش حجم گاز به تنهایی خیلی مفید و دقیق نیست. یکی از بهترین شرایط برای اندازهگیری حجم گاز آن است که حجم آن را در دمای اتاق و فشار جو اندازه بگیریم. در ادامه با انجام سه روش ساده حجم گاز را با یکدیگر اندازه میگیریم.
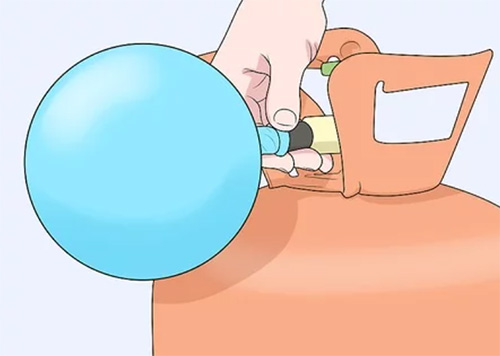
روش اول اندازه گیری حجم گاز چیست ؟
در این روش، بادکنکی را برمیداریم و آن را با استفاده از گازی دلخواه باد میکنیم. برای باد کردن بادکنک میتوانیم از گازهای مختلفی مانند هلیوم یا حتی هوا استفاده کنیم. اگر از هلیم برای باد کردن بادکنک استفاده میکنیم، تنها کافی است لبه بادکنک را به دور دهانه خروجی گاز هلیوم از محفظه، محکم و بادکنک را تا حجم دلخواه باد کنیم. پس از اتمام کار و برای جلوگیری از خروج گاز از بادکنک، انتهای آن را با استفاده از نخ محکم میبندیم.
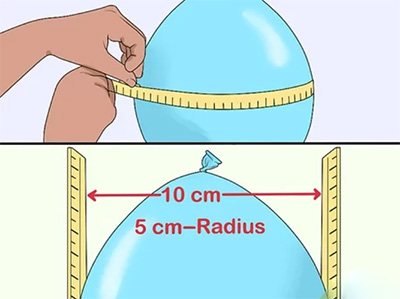
پس از باد کردن بادکنک، محیط و شعاع آن را اندازه بگیرید. برای انجام این کار متری پارچهای را به دور مرکز بادکنک بپیچید و و محیط آن را اندازه بگیرید. برای بهدست آوردن شعاع، دو خطکش را در دو طرف و مرکز بادکنک به صورت نشان داده شده در تصویر زیر قرار دهید. سپس فاصله دو خطکش را اندازه بگیرید و آن را بر دو تقسیم کنید. به عنوان مثال، اگر فاصله دو خطکش از یکدیگر برابر ۱۰ سانتیمتر باشد، شعاع بادکنک برابر ۵ سانتیمتر میشود.
در ادامه، فرض میکنیم بادکنک به شکل کره است و برای اندازهگیری حجم آن از فرمول حجم برای کره استفاده میکنیم:
شعاع بهدست آمده را در رابطه بالا قرار میدهیم و حجم بادکنک را بهدست میآوریم. به عنوان مثال، اگر شعاع برابر ۵ سانتیمتر باشد، حجم بادکنک برابر ۵۲۳/۳۳ سانتیمتر مکعب بهدست میآید.
برای مقایسه نتیجه بهدست آمده، بادکنک دیگری را با آب پر میکنیم. بادکنک دوم را تا جایی با آب پر میکنیم که حجم آن برابر حجم بادکنک پر شده از گاز شود. به این نکته توجه داشته باشید که بهدست آوردن حجمِ برابر برای دو بادکنک کار به نسبت سختی است. برای بهدست آوردن اندازه دقیقتر بهتر است متر پارچهای را به دور بادکنک پر شده از آب بپیچیم و بادکنک دوم را تا جایی از آب پر کنیم که محیط آن برابر محیط بادکنک اول شود. پس از رسیدن به حجم موردنظر، آب درون بادکنک را داخل ظرف مدرج، خالی و حجم آن را اندازه میگیریم. حجم آبِ داخل بادکنک دوم برابر حجم گاز درون بادکنک اول است.
روش دوم اندازه گیری حجم گاز چیست ؟
در این روش، ابتدا بادکنکی را با گاز پر میکنیم و پس از رسیدن به حجم دلخواه، انتهای بادکنک را محکم میبندیم. دو محفظه با اندازههای متفاوت پیدا میکنیم، به گونهای که هر دو از بادکنک باد شده بزرگتر باشند و یکی از محفظهها درون محفظه دیگر جا شود. محفظه کوچکتر را درون محفظه بزرگتر قرار میدهیم. به عنوان مثال، محفظهای با حجم ۱۹ لیتر را میتوانیم درون وان پلاستیکی با حجم ۷۵ لیتر قرار دهیم.

محفظه کوچکتر را تا لبه با آب پر میکنیم. باید توجه داشته باشیم که آب از محفظه کوچکتر به داخل محفظه بزرگتر نریزد. سپس، بادکنک را داخل محفظه کوچکتر قرار و آن را با استفاده از درپوشی صاف به داخل محفظه و درون آب فشار میدهیم. بادکنک را تا جایی فشار دهید که به طور کامل درون آب قرار گیرد و درپوش صاف به لبه محفظه برخورد کند. در اثر این کار مقداری آب از محفظه کوچکتر به درون محفظه بزرگتر میریزد.

محفظه کوچکتر را از ظرف بزرگتر خارج میکنیم و آب ریخته شده در محفظه بزرگتر را داخل بِشِر میریزیم. حجم آب ریخته شده در ظرف بزرگتر برابر حجم گاز درون بادکنک است. برای اندازهگیری دقیقتر فلاسکی همراه با درپوش به شکل نشان داده شده در تصویر زیر برمیداریم. فلاسک را با گازی که میخواهیم حجم آن را اندازه بگیریم پر میکنیم. درپوش را در دهانه فلاسک قرار میدهیم و با محکم کردن آن، مانع از خروج گاز از داخل فلاسک میشویم. در ادامه، بِشِر را با آب پر میکنیم و حجم آن را با استفاده از درجهبندی نوشته شده روی بِشِر اندازه میگیریم. به این نکته توجه داشته باشید که این روش برای گازهای نامحلول قابل استفاده است.
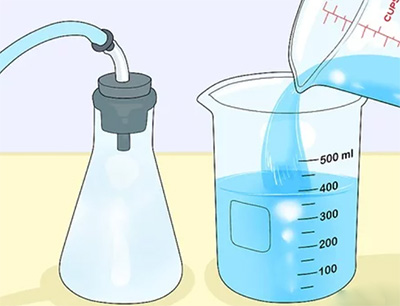
لوله خارج شده از دهانه فلاسک را درون آبِ داخلِ بِشِر قرار میدهیم. گازِ درون فلاسک از طریق لوله از آن خارج و به درون آب وارد میشود. در این هنگام، حبابهایی داخل آب مشاهده میکنیم و سطح آب داخل بِشِر بالا میآید. سطح آب را برای بار دوم میخوانیم. تفاوت سطح آب، قبل از ورود گاز و پس از ورود گاز به آن برابر حجم گازِ درون فلاسک است.

روش سوم اندازه گیری حجم گاز چیست ؟
در این روش، با محاسبه جرم گاز، حجم آن را بهدست میآوریم. اگر جرم گازی برابر m، حجم آن برابر و چگالی گاز برابر d باشد، حجم گاز با استفاده از رابطه زیر بهدست میآید:
برای بهدست آوردن چگالی گاز از جدولهای استاندارد در کتابهای مختلف استفاده میکنیم. با استفاده از ترازویی دقیق وزن بادکنک باد شده و خالی را اندازه میگیریم و عددهای بهدست آمده را از یکدیگر کم میکنیم. با داشتن جرم گاز و چگالی آن، حجم آن به راحتی با استفاده از رابطه نوشته شده بهشدت میآید.
گاز ایده ال چیست ؟
تا اینجا فهمیدیم تفاوت مایع و جامد با گاز چیست. در این بخش، در مورد قانون گاز ایدهال و فرمولهای حاکم بر آن توضیح میدهیم. نخستین رابطه ریاضی مهم برای توصیف رفتار گاز ایدهال، رابطه بین فشار و حجم است. اگر حجم سیستم بستهای را کاهش دهیم، فشار داخل آن افزایش مییابد. در مقابل، اگر حجم سیستم بستهای حاوی گاز افزایش یابد، فشار داخل آن کاهش خواهد یافت. اگر فشار و حجم را در یکدیگر ضرب کنیم، به عدد ثابتی میرسیم. این ثابت در صورتی تغییر نمیکند که دما و مقدار گاز ثابت باقی بمانند.
به رابطه فوق، قانون بویل میگوییم. سوالی که ممکن است مطرح شود آن است که این ثابت از کجا میآید و چرا مقدار آن با ثابت نگه داشتن مقدار گاز و دمای آن تغییر نمیکند. ۱۰۰ سال قبل از پاسخ به این پرسش، دانشمندی فرانسوی به نام «ژاک شارل» (Jacques Charles) و دانشمندی ایتالیایی به نام «آمادئو آووگادرو» (Amedeo Avogadro) رابطهای همانند رابطه بویل بهدست آوردند. بر طبق دو رابطه نوشته شده توسط این دو دانشمند، دو ویژگی مهم گازها به صورت مستقیم و توسط کمیتی ثابت به یکدیگر مربوط میشوند. شارل به این نتیجه رسید که حجم و دما به صورت مستقیم و توسط کمیتی ثابت به یکدیگر مربوط میشوند.
در رابطه فوق، C ثابت است. همچنین، بر طبق رابطه نوشته شده توسط آووگادرو، حجم و تعداد مولهای گاز توسط کمیتی ثابت و به صورت زیر به یکدیگر مربوط میشوند:
در رابطه فوق، C ثابت و n تعداد مولهای گاز است. نکته جالب آن است که سه دانشمند با سه شکل مختلف با یک معادله روبرو شدند. این معادله هرگز نباید فراموش شود و باید در ذهن به صورت ماندگار بماند:
به معادله فوق، معادله گاز ایدهآل میگوییم. R در رابطه فوق ثابت جهانی گازها نام دارد و n تعداد مولهای داخل گاز است. دانشمندانی مانند شارل، بویل و آووگادرو، رابطه گاز ایدهال را به صورت تجربی بهدست آوردند. اما نکته بسیار جالب آن است که این معادله را میتوانیم به صورت نظری بهدست آوریم و درک کنیم. ابتدا باید معنای هر یک از کمیتهای نوشته شده در این معادله را بدانیم. مولکولها و ذرات تشکیلدهنده گاز با برخورد به دیواره محفظه به آن فشار وارد میکنند. فشار را به صورت نسبت نیرو به سطحی که نیرو بر آن وارد میشود، تعریف میکنیم.

واحد اندازهگیری فشار، پاسکال نام دارد. از آنجا که پاسکال واحد بسیار کوچکی است، از یکاهایی مانند کیلوپاسکال یا اتمسفر برای اندازهگیری فشار استفاده میکنیم. در تعریف گاز ایدهال تعدادی فرض در نظر میگیریم:
- ذرات تشکیلدهنده گاز نقاطی بدون بعد هستند که به صورت تصادفی حرکت میکنند.
- ذرات تشکیلدهنده گاز با یکدیگر برهمکنشی ندارند.
دو فرضیه فوق کاملا صحیح نیستند، اما ریاضیات را آسانتر و حتی رفتار گازها را به درستی پیشبینی میکنند. همانطور که در مطالب بالا اشاره شد، به هنگام مطالعه گاز ایدهال، چهار ویژگی آن را بررسی میکنیم:
- فشار: نیرویی که گاز بر محفظه خود وارد میکند یا ضربه وارد شده از سمت ذرات گاز بر دیوارههای محفظه چه مقدار است.
- دما: مقدار گرمای در دسترس که میتواند به انرژی جنبشی تبدیل شود. هرچه دما بالاتر باشد، ذرات تشکیلدهنده گاز با سرعت بیشتری حرکت میکنند.
- حجم: بزرگی محفظه چه مقدار است.
- مول: تعداد ذرات داخل محفظه چه مقدار است.
بنابراین، به هنگام صحبت در مورد گاز ایدهال باید بدانیم:
-
- چه تعداد ذره داخل محفظه است.
- بزرگی محفظه چه مقدار است.
- ذرات با چه سرعتی حرکت میکنند.
- ذرات چندبار به دیوارههای محفظه برخورد میکنند.
قانون بویل چیست ؟
متغیرهای فوق توسط رابطه گاز ایدهال، ، به یکدیگر مربوط میشوند. محفظهای استوانهای را در نظر بگیرید که پیستونی متحرک روی آن قرار دارد. گازی با حجم مشخص درون محفظه قرار دارد. در این حالت تعداد مول و دمای گاز را ثابت نگه میداریم. به بیان دیگر، فرض میکنیم تعداد ذرات یکسانی با سرعت برابر به اطراف حرکت میکنیم. سپس، پیستون را به سمت پایین فشار میدهیم. با فشردن پیستون به سمت پایین، فشار افزایش خواهد یافت. تعداد برخوردهای ذرات تشکیلدهنده گاز به دیوارههای محفظه افزایش مییابد، زیرا فاصله کمتری را برای برخورد به دیوارهها طی میکنند. این بدان معنا است که فشار و حجم با یکدیگر نسبت عکس دارند.
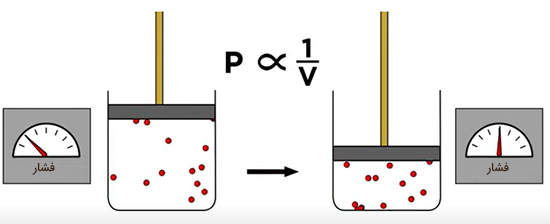
به این حالت قانون بویل گفته میشود. اگر حجم و فشار سیستم در حالت یک به ترتیب برابر و و در حالت دوم برابر و باشد، داریم:
به عنوان مثال، اگر فشار سیستم دو برابر شود، برای آنکه رابطه فوق برقرار باشد، حجم سیستم را باید نصف کنیم.
قانون شارل چیست ؟
قاون شارل میگوید که حجم و دما به صورت مستقیم و توسط کمیتی ثابت به یکدیگر مربوط میشوند. اگر دمای بادکنکی پر شده از گاز را افزایش دهیم، ذرات تشکیلدهنده گاز با سرعت بیشتری حرکت میکنند. برای آنکه فشار ثابت نگه داشته شود، حجم بادکنک باید افزایش یابد. بنابراین، با افزایش دمای گاز، حجم آن نیز افزایش خواهد یافت. از اینرو، حجم و دما به صورت مستقیم با یکدیگر رابطه دارند.
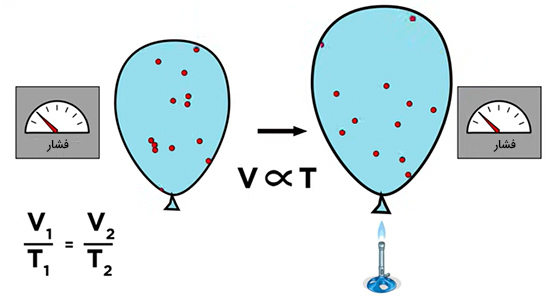
به این نکته توجه داشته باشید که در ترمودینامیک به هنگام کار با دما از مقیاس مطلق دما به نام کلوین استفاده میکنیم. یک کلوین برابر یک درجه سانتیگراد است. اما صفر کلوین برابر ۲۷۳- درجه سانتیگراد است و صفر مطلق نامیده میشود. صفر مطلق کمترین دمای ممکن است و در این دما هیچ انرژی گرمایی وجود ندارد. کلوین و سلسیوس با استفاده از رابطههای زیر به یکدیگر تبدیل میشوند:
با ترکیب کردن قانونهای بویل و شارول به رابطه زیر میرسیم:
قانون آووگادرو چیست ؟
بر طبق قانون آووگادرو، حجمهای مساوی از گاز در دمای یکسان، تعداد مولکولهای یکسانی دارند:
رابطههای نوشته شده در سه قانون بویل، شارول و آووگادرو در رابطهای به نام معادله گاز ایدهال به یکدیگر مربوط میشوند:
R، ثابت جهانی گازها نام دارد و بسته به آنکه چه واحدهایی برای فشار، حجم و دما انتخاب شود، مقدار آن متفاوت است. به عنوان مثال، اگر واحد حجم، لیتر، واحد فشار، اتمسفر و واحد دما، کلوین انتخاب شود، مقدار R برابر است.
مثال اول گاز ایده ال
فشار بالونی به حجم ۵/۱۵ لیتر برابر ۱/۳۵ اتمسفر است. اگر بالون، فشرده شود و حجم آن به مقدار ۳/۴۳ لیتر کاهش یابد، فشار آن چه مقدار میشود؟
پاسخ
در این مثال، حجم و فشار اولیه و حجم ثانویه داده شدهاند و باید فشار ثانویه را بهدست آوریم. برای حل این مثال میتوانیم از قانون بویل استفاده کنیم:
P _ 1 V _ 1 = P _ 2 V _ 2$$$$
مقدارهای داده شده را در رابطه فوق قرار میدهیم و مقدار فشار ثانویه را بهدست میآوریم:
مثال دوم گاز ایده ال
بالونی با ۰/۷۸۵ مول گاز نیتروژن در فشار ۱/۵ اتمسفر و دمای ۳۰۱ کلوین پر شده است. حجم بالون چه مقدار است؟
پاسخ
برای حل این مثال از رابطه کلی گاز ایدهال استفاده میکنیم:
از آنجا که در این مثال باید حجم گاز را بهدست آوریم، رابطه فوق را برحسب حجم گاز مرتب میکنیم:
با قرار دادن مقدارهای داده شده در مثال در رابطه فوق، مقدار فشار را برابر ۱۳ لیتر بهدست میآوریم. به این نکته توجه داشته باشید، مقدار R در این مثال برابر ۰/۰۸۲۱ است.
تا اینجا میدانیم قانونهای بویل، شارول و آووگادرو در گاز چیست. در ادامه، چند آزمایش ساده در مورد گازها با یکدیگر انجام میدهیم.
آزمایش گاز ایده ال
در مطالب بالا به پرسش گاز چیست به زبان ساده پاسخ دادیم و با تعریف گاز ایدهال و قانون حاکم بر آن آشنا شدیم. در این بخش، چند آزمایش ساده در مورد گاز ایدهال را با یکدیگر انجام میدهیم. در تمام آزمایشهای انجام شده از رابطه استفاده میکنیم.
آزمایش شماره یک
در بخشهای قبل فهمیدیم کمیتهای دما، فشار و حجم و مفهوم آنها در گاز چیست. در این بخش، ارتباط این کمیتها با یکدیگر را بررسی میکنیم. اگر همزمان فشار و حجم را افزایش دهیم، مانند باد کردن بادکنک، باید تعداد مولکولهای گاز را نیز افزایش دهیم تا رابطه برقرار باشد. بنابراین، اگر تعداد مولکولها گاز افزایش یابد، فشار و حجم نیز برای جبران باید افزایش یابند. اگر فشار داخل دهان را افزایش دهیم، به راحتی میتوانیم با فوت کردن به داخل بادکنک، آن را باد کنیم. در این حالت، حجم بادکنک افزایش مییابد. اکنون فشار داخل بادکنک ثابت و برابر فشار یک اتمسفر است. اگر دمای هوای داخل بادکنک را به طور ناگهانی تغییر دهیم، حجم آن نیز تغییر خواهد کرد. برای تغییر دمای هوای داخل بادکنک از هوای فشرده با دمای بسیار کم استفاده میکنیم.

برای تغییر دمای بادکنک به صورت ناگهانی، قوطی هوای فشرده را در نزدیکی آن قرار میدهیم و هوای فشرده با دمای کم را به سطح بادکنک افشانه میکنیم.

با کاهش دمای هوای داخل بادکنک، حجم آن کاهش مییابد. در ادامه، با استفاده از سشوار، دمای بادکنک را افزایش میدهیم. چه اتفاقی رخ میدهد؟ با افزایش دما، حجم بادکنک افزایش خواهد یافت.
آزمایش شماره دو
برای انجام این آزمایش باید ابتدا وسیلهای ساده بسازیم. بطری خالی پلاستیکی آب را بردارید و در قسمت درپوش بطری حفره کوچکی ایجاد و نی پلاستیکی را درون حفره قرار دهید. برای ثابت نگه داشتن نی داخل حفره میتوانید از چسب حرارتی استفاده کنید. سپس درپوش را روی بطری قرار دهید و آن را محکم ببندید. با استفاده از چسب حرارتی، اطراف نی را به طور کامل بپوشانید، به گونهای که هوا نتواند از بطری خارج یا به آن وارد شود. مقداری آب داخل لیوان بریزید و آن را روی میز قرار دهید. سپس، قوطی هوای فشرده را در نزدیکی بطری پلاستیکی قرار میدهیم و هوای فشرده با دمای کم را به سطح بطری افشانه میکنیم. سپس بطری را به صورت وارونه و به صورت نشان داده شده در تصویر زیر بالای لیوان آب قرار میدهیم، به گونهای که نی داخل آب قرار بگیرد. در ادامه، دستان خود را اطراف بطری قرار میدهیم و با مالش آهسته، دمای بطری پلاستیکی را افزایش میدهیم. چه اتفاقی رخ میدهد؟

حبابهای هوا در آب ظاهر میشوند. چرا؟ بطری آب ابتدا سرد است. با قرار دادن دستان خود در اطراف آن، دمای بطری را افزایش میدهیم. با افزایش دما، فشار نیز تغییر میکند. حال این آزمایش را به صورت دیگری انجام میدهیم. پس از قرار دادن بطری به صورت وارونه بالای لیوان آب، قوطی هوای فشرده را در نزدیکی بطری پلاستیکی قرار میدهیم و هوای فشرده با دمای کم را به سطح بطری افشانه میکنیم. چه اتفاقی رخ میدهد؟ در این حالت، آب از داخل لیوان و از طریق نی به داخل بطری میرود. در این آزمایش، رابطه بین فشار و دما را بررسی کردیم.
آزمایش شماره سه
در این آزمایش، رابطه میان فشار و حجم را بررسی میکنیم. وسایل موردنیاز برای انجام این آزمایش عبارت هستند از:
- سرنگ بدون سوزن
- خطکش یا نوار اندازهگیری
- آب به میزان لازم
- محفظه (بطری پلاستیکی آب)
- لوله انعطافپذیر (استفاده از این وسیله کاملا اختیاری است)
- فشارسنج برای اندازهگیری فشار
ابتدا بطری پلاستیکی را تا ارتفاع مشخصی با آب پر میکنیم. سپس، سرنگ را برمیداریم و با کشیدن پیستون آن به سمت خارج، داخل سرنگ را از هوا پر میکنیم.
در ادامه، بطری پلاستیکی پر شده از آب را برمیداریم و حفرهای را در درپوش آن ایجاد میکنیم. سرنگ را از قسمت سر آن که سوزن وصل میشود داخل حفره ایجاد شده قرار میدهیم، به گونهای که سر سرنگ بالای سطح آب قرار بگیرد. سپس، به آرامی و با دقت سر سرنگ را داخل آب فرو میبریم. سرنگ باید محکم باشد و هیچ هوایی نباید از حفره ایجاد شده در سرپوش بطری عبور کند. برای آنکه مطمئن شویم حفره از عبور هوا جلوگیری میکند، با استفاده از چسب حرارتی اطراف حفره و سرنگ را میپوشانیم. با اتصال سرنگ به درپوش بطری پلاستیکی و فرو بردن قسمت اتصال سوزن به داخل آب، سیستمی ساختهایم که در آن میتوانیم گاز یا هوای داخل سرنگ را فشرده یا منبسط کنیم. از این طریق، تغییرات فشار را میتوانیم اندازه بگیریم.
در ادامه، حجم اولیه هوای داخل سرنگ را با استفاده از مکان اولیه پیستون اندازه میگیریم. روی هر سرنگ درجهبندی وجود دارد که حجم هوای داخل سرنگ را میتوانیم با استفاده از آن بهدست آوریم. پس از اندازهگیری حجم اولیه، انگشت اشاره خود را روی پیستون سرنگ قرار میدهیم و نیروی ثابت و کمی بر پیستون وارد میکنیم و آن را به سمت داخل فشار میدهیم. با انجام این کار، حجمِ هوای محبوس شده داخل سرنگ کاهش مییابد. پس از هر تغییر حجم باید فشار گاز محبوس شده را اندازه بگیریم. به طور معمول، فشار را با استفاده از فشارسنج اندازه میگیریم. برای بهدست آوردن رابطه دقیق بین فشار و حجم باید، مقدارهای هر یک از این دو کمیت را با دقت بهدست آوریم.
پیستون سرنگ را با نیروی بیشتری به سمت داخل فشار میدهیم و حجم و فشار جدید را دوباره اندازه میگیریم. این مرحله را چندین بار تکرار میکنیم. مقدارهای حجم و فشار را در جدولی کوچک یادداشت میکنیم. برای رسم نمودار فشار برحسب حجم، حجم سرنگ را برابر ۱۰ میلیلیتر فرض میکنیم و آزمایش فوق را با این سرنگ انجام میدهیم. دادههای فرضی بهدست آمده پس از انجام آزمایش در جدول زیر نوشته شدهاند.
| حجم برحسب میلیلیتر | فشار برحسب اتمسفر |
| ۱۰ | ۱/۰ |
| ۸ | ۱/۲ |
| ۶ | ۱/۵ |
| ۴ | ۲/۵ |
| ۲ | ۳/۰ |
در این آزمایش، حجم و فشار اولیه به ترتیب برابر ۱۰ میلیلیتر و یک اتمسفر است. با کاهش حجم گاز، فشار را با استفاده از فشارسنج اندازه میگیریم. همانطور که در جدول مشاهده میشود، فشار با کاهش حجم، افزایش مییابد. بنابراین، فشار و حجم با یکدیگر رابطه معکوس دارند و افزایش/کاهش یکی سبب کاهش/افزایش دیگری میشود. برای تحلیل بهتر دادهها نمودار فشار برحسب حجم را داخل اکسل رسم میکنیم.
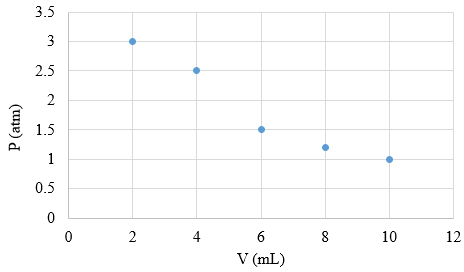
به این نکته توجه داشته باشید که به هنگام انجام آزمایش، دما و سایر شرایط محیطی را پایدار و ثابت نگه دارید. زیرا تغییر دما یا هر یک از شرایط محیطی بر نتایج بهدست آمده تاثیر میگذارد. با انجام این آزمایش، قانون بویل را تایید میکنیم. بر طبق قانون بویل، در دما و تعداد مول ثابت، فشار و حجم با یکدیگر رابطه معکوس دارند.
آزمایش شماره چهار
آزمایش ساده دیگری را در تایید قانون بویل با یکدیگر انجام میدهیم. به طور حتم به هنگام باز کردن در نوشابه یا هر نوشیدنی گازداری با این صحنه روبرو شدهاید، نوشابه یا نوشیدنی گازدار به سرعت و به صورت کف از بطری خارج میشود.

چرا این اتفاق رخ میدهد؟ این اتفاق به دلیل وجود دیاکسید کربنی است که به مایع اضافه میشود. باز کردن در نوشابه یا نوشیدنیهای گازدار دیگر سبب آزاد شده فشار محبوس در بطری میشود. بنابراین، مخلوط مایع و گاز به سرعت خارج میشوند.
آزمایش شماره پنج
برای انجام این آزمایش به وسایل زیر نیاز داریم:
- حداقل دو بادکنک کوچک مانند بادکنک آبی
- سرنگ پلاستیکی بزرگ (سرنگی با حجمی در حدود ۶۰ میلیلیتر) بدون سوزن
- قیچی
- آب به میزان لازم
مراحل انجام آزمایش
مراحل انجام این آزمایش عبارت هستند از:
- بادکنک کوچک را از هوا پر کنید و آن را از انتهای باز سرنگ داخل محفظه استوانهای قرار دهید. پیستون سرنگ را در جای خود قرار دهید و سعی کنید بادکنک را به نوک سرنگ هدایت کنید. آیا فشار دادن پیستون به سمت داخل سخت است؟ برای هوای داخل سرنگ چه اتفاقی رخ میهد؟
- پیستون را به سمت خارج بکشانید و بادکنک را به سمت میانه محفظه سرنگ هدایت کنید. سپس، نوک سرنگ را با انگشت خود بپوشانید. بار دیگر پیستون را به داخل سرنگ فشار دهید. چه اتفاقی رخ میدهد؟ به هنگام فشار دادن پیستون به سمت داخل، بادکنک چه شکلی میشود یا چه تغییری میکند؟
- انگشت خود را از نوک سرنگ بردارید. بادکنک را نوک سرنگ قرار دهید و پیستون را تا جایی که بادکنک را لمس کند به سمت داخل فشار دهید. سپس، نوک سرنگ را با انگشت خود بپوشانید و پیستون را تا انتها به بیرون بکشانید. آیا شکل بادکنک تغییر میکند؟ چگونه تغییر میکند؟
در ادامه انجام این آزمایش، بادکنک پر شده از هوا را از محفظه سرنگ خارج کنید و بادکنک پرشده از آب را به جای آن قرار دهید و مرحلههای زیر را به ترتیب انجام دهید:
- پس از قرار دادن بادکنک پر شده از آب داخل محفظه سرنگ، پیستون را در جای خود قرار دهید. سر باز سرنگ را با انگشت خود بپوشانید و پیستون را تا جایی که میتوانید به سمت داخل فشار دهید. بادکنک چگونه تغییر میکند؟
- انگشت خود را بردارید و پیستون را تا جایی که بادکنک را لمس کند به سمت داخل فشار دهید. سپس، نوک سرنگ را با انگشت خود بپوشانید و پیستون را تا جایی که میتوانید به سمت خارج بکشانید. چه اتفاقی برای بادکنک پر شده با آب رخ میدهد؟ آیا این بادکنک رفتاری متفاوت از بادکنک پر شده از هوا از خود نشان میدهد؟
مرحله زیر را میتوانید به صورت تکمیلی انجام دهید. در ادامه آزمایش میتوانید داخل محفظه سرنگ آب بریزید و یکبار بادکنک پر شده از هوا و بار دیگر بادکنک پر شده از آب را داخل محفظه قرار دهید. سپس، نوک سرنگ را با انگشت بپوشانید و سعی کنید پیستون را به داخل محفظه فشار دهید و از آن خارج کنید. در این حالت چه اتفاقی رخ میدهد؟ وجود آب داخل محفظه سرنگ چه تفاوتی را ایجاد میکند؟ تا اینجا با مراحل انجام آزمایش آشنا شدیم. در ادامه، نتیجه هر مشاهده را با یکدیگر بررسی میکنیم.
اگر نوک سرنگ را با انگشت نپوشانیم، به راحتی میتوانیم پیستون را داخل محفظه به عقب و جلو حرکت دهیم. در این حالت، هوا میتواند از انتهای باز سرنگ خارج شود. اما اگر انتهای بازِ سرنگ را با انگشت بپوشانیم، هوا نمیتواند از محفظه خارج شود و داخل آن محبوس خواهد شد. در این حالت، با فشار دادن پیستون به سمت داخل، فشارِ هوای داخل پیستون را افزایش میدهیم. بنابراین، هوای داخل پیستون منقبض میشود یا حجم آن کاهش مییابد. در این حالت، بادکنک پر شده از هوا چروک و اندازه آن کوچکتر میشود. در مقابل، اگر نوک سرنگ را با انگشت بپوشانیم و پیستونِ سرنگ را به سمت خارج بکشیم، فشار هوای داخل محفظه کاهش و حجم آن افزایش مییابد. در نتیجه، بادکنک پر شده از هوا منبسط و اندازه آن بزرگتر میشود. قانون بویل به خوبی کار میکند.
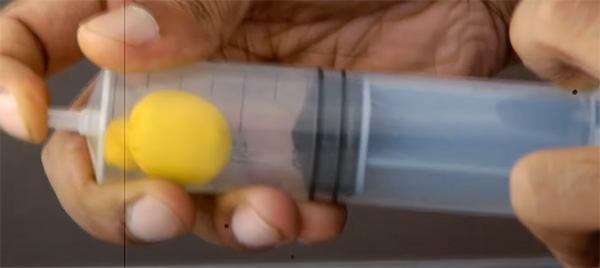
نتایج مشاهده شده برای بادکنک پر شده از آب متفاوت است. گرچه هوای داخل سرنگ با فشردن پیستون به سمت داخل، متراکم میکنید، آب داخل بادکنک فشرده نمیشود. چرا؟ زیرا مایعات تراکمناپذیر هستند. بنابراین، اندازه بادکنک تغییر نمیکند. همچنین، اگر نوک باز سرنگ را با انگشت بپوشانیم و پیستون را همزمان به سمت بیرون بکشانیم، بادکنک پر شده از آب تغییر شکل نمیدهد. مایعات، برخلاف گازها، تراکمناپذیر هستند. بنابراین، قانون بویل را نمیتوانیم برای مایعات استفاده کنیم. این قانون، تنها برای گازها صحیح است.
در ادامه، محفظه سرنگ را با آب پر میکنیم. در این حالت باز هم با فشردن پیستون به سمت داخل، بادکنک پر شده از هوا کوچک میشود. همچنین، اگر نوک سرنگ را با انگشت بپوشانیم و پیستون را به سمت خارج بکشیم، بادکنک پر شده از هوا منبسط خواهد شد. در این حالت نمیتوانیم پیستون را تا جایی که میخواهیم به داخل محفظه فشار دهیم یا از آن خارج کنیم، زیرا مایعات، همانند گازها، نمیتوانند متراکم شوند.
در بخش قبل با انجام چند آزمایش ساده فهمیدیم مهمترین ویژگیهای گاز چیست. در ادامه، در مورد گاز طبیعی و زیستگاز صحبت میکنیم.
گاز طبیعی چیست؟
در مطالب بالا فهمیدیم گاز چیست و چه تفاوتی با مایع و جامد دارد. در این بخش، در مورد گاز طبیعی صحبت میکنیم. گاز طبیعی، همانند ذغالسنگ و نفت، سوخت فسیلی است. گاز طبیعی از گیاهان و حیواناتی که میلیونها سال قبل روی زمین میزیستند، شکل میگیرد. نظریههای مختلفی در مورد چگونگی تشکیل سوختهای فسیلی وجود دارند. یکی از رایجترین و پذیرفته شدهترین نظریهها آن است که سوختهای فسیلی زیرِ زمین و تحت شرایط شدید تشکیل شدهاند. گیاهان و حیوانات پس از تجزیه شدن، به تدریج توسط لایههای خاک، رسوب و سنگها پوشانده میشوند. ماده آلی طی میلیونها سال فشرده خواهد شد. ماده آلی با حرکت به اعماق زمین، در معرض دماهای بالاتر قرار میگیرد. هرچه به مرکز زمین نزدیکتر میشویم، دما زیادتر میشود.
پیوندهای کربنی در ماده آلی به دلیل تراکم زیاد و دمای بالا میشکنند. این تجزیه و شکست، گاز طبیعی متان را تولید میکند. متان () یکی از فراوانترین ترکیبات آلی روی زمین و از دو عنصر کربن و هیدروژن ساخته شده است. به طور معمول، رسوبهای گاز طبیعی در نزدیک رسوبهای نفتی یافت میشوند. مقدار رسوبهای گاز طبیعی که در نزدیکی سطح زمین قرار دارند به دلیل وجود رسوبهای نفتی چندان زیاد نیست. اما مقدار گاز طبیعی در رسوبهای عمیقتر که در دماها و فشارهای بالاتر شکل گرفتهاند، بیشتر از مقدار نفت است. عمیقترین رسوبها میتوانند به طور کامل از گاز طبیعی تشکیل شده باشند. این موضوع بدان معنا نیست که گاز طبیعی باید حتما در عمق بسیار زیاد تشکیل شود. گاز طبیعی نهتنها توسط گیاهان و حیوانات تولید میشود، بلکه میکرواورگانیسمهایی به نام متانوژنها نیز میتوانند گاز طبیعی تولید کنند.

متانوژنها در روده حیوانات (حتی انسانها) و در نواحی کم اکسیژن نزدیک به سطح زمین زندگی میکنند. به عنوان مثال، مکانهای دفع زباله پر از مواد تجزیه شدهای هستند که در آنها متانوژنها به نوعی متان به نام متان بیوژنیک تجزیه میشوند. به فرایند تولید گاز طبیعی از متانوژنها، متانزایی میگوییم. گرچه بیشتر متان بیوژنیک وارد جو میشوند، تکنولوژیهای جدیدی برای نگهداری این منبع انرژی ساخته شدهاند.
گاز طبیعی چگونه تشکیل می شود؟
میلیونها و صدها میلیون سال قبل، باقیماندههای گیاهان و حیوانات (مانند آغازیان) لایههای ضخیمی روی سطح زمین و بستر اقیانوسها تشکیل دادند. برخی از این لایهها با کلسیمکربنات و ماسه ترکیب شده بودند. با گذر زمان، لایههای تشکیل شده زیر ماسهها و سنگها مدفون شدند. برخی مواد غنی از کربن و هیدروژن در اثر فشار و گرما به ذغالسنگ، برخی به نفت و برخی دیگر به گاز طبیعی تبدیل شدند.
پیشنهاد می کنیم برای آشنایی بیشتر با فرآیند استخراج و تولید گاز طبیعی، فیلم آموزش فرآیندهای گاز فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
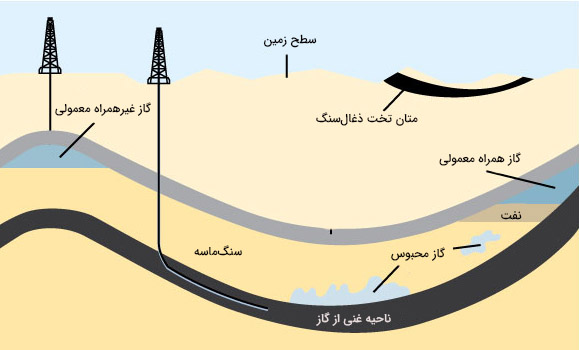
گاز طبیعی در کجا یافت می شود؟
در برخی مکانها، گاز طبیعی به شکافها و فضاهای بزرگ بین لایههای سنگهای پوشاننده حرکت کرد. به گاز طبیعی کشف شده در این نوع سازند، گاز طبیعی رایج گفته میشود. در بخشهایی دیگر، گاز طبیعی در حفرهها یا فضاهای کوچک برخی از سازندهای شیلی، ماسهسنگی و سایر سنگهای رسوبی پیدا میشود.
زیست گاز چیست ؟
زیستگاز نوعی سوخت زیستی است که به طور طبیعی از تجزیه زبالههای آلی تولید میشود. هنگامیکه ماده آلی، مانند باقیماندههای غذا و کودهای حیوانی در محیط بیهوازی (بدون اکسیژن) تجزیه میشوند، مخلوطی از گازهای مختلف مانند متان و دیاکسیدکربن آزاد میشوند. به این نکته توجه داشته باشید که این تجزیه و آزادسازی گازها، تنها میتواند در محیط بیهوازی رخ دهد. بنابراین، به فرایند تولید زیستگاز، هضم بیهوازی گفته میشود. در این فرایند، زباله آلی با استفاده از تخمیر و بدون حضور اکسیژن به انرژی تبدیل میشود. در این فرایند میتوان از مواد آلی مانند کودهای حیوانی، باقیماندههای غذا و زبالههای مختلف استفاده کرد. زیستگاز حاوی مقدار زیادی متان (در حدود ۵۰ تا ۷۰ درصد)است، بنابراین قابلیت اشتعالزایی بالایی دارد. از اینرو، از زیستگاز میتوانیم به عنوان یکی از منابع انرژی استفاده کنیم.
زیستگاز یکی از منابع انرژی تجدیدپذیر است، زیرا مواد آلی استفاده شده در تولید زیستگاز میتوانند دوباره با مواد آلی جدید جایگزین شوند. از زیستگاز میتوان برای هدفهای مختلفی مانند آشپزی، گرمایش و تولید برق استفاده کرد. این منبع انرژی، جایگزین خوبی برای سوختهای فسیلی مانند نفت است، زیرا گاز گلخانهای کمتری تولید میکند. از آنجا که زیستگاز در فرایندی طبیعی و در محیطی کاملا بسته تولید میشود، کنترل ترکیب سازنده آن بسیار چالشبرانگیز خواهد بود. به همین دلیل، نسبت متان به دیاکسیدکربن میتواند تغییر کند. رایجترین نسبت برابر ۶۰ درصد متان و ۴۰ درصد دیاکسیدکربن است. با این وجود مقدار متان و دیاکسیدکربن در متان میتواند به ترتیب بین ۴۵ تا ۷۵ درصد و ۵۵ تا ۲۵ درصد تغییر کند.
به این نکته توجه داشته باشید که در زیستگاز علاوه بر متان و دیاکسید کربن، گازهای دیگری با درصد کمتر نیز وجود دارند. ترکیب دقیق زیستگاز به نوع مواد اولیه و مسیر تولید بستگی دارد. سه روش اصلی برای تولید زیستگاز وجود دارند که در ادامه در مورد آنها صحبت میکنیم. تا اینجا میدانیم زیست گاز چیست. در ادامه با مهمترین روشهای تولید زیست گاز آشنا میشویم.
روش های تولید زیست گاز
تکنولوژیهای استفاده شده در تولید زیستگاز عبارت هستند از:
- هضمکنندههای زیستی: در این روش از محفظهها یا تانکهای عایقبندی شده استفاده میکنند. مواد آلی در محفظههای استفاده شده داخل آب رقیق میشوند و به صورت طبیعی و با استفاده از ریزجانداران تجزیه میشوند. به این نکته توجه داشته باشید که آلایندهها و رطوبت موجود در زیستگاز قبل از استفاده از آن باید جدا شوند.
- سیستمهای بازیابی گاز: زیستگاز همچنین میتواند از تجزیه زباله جامد شهرداریها تحت شرایط بیهوازی در زمینهای دفن زباله تولید شود. زیستگاز تولید شده به این روش میتواند توسط لولهها و چاههای استخراج جمعآوری شود.
- تصفیهخانههای فاضلاب: این تصفیهخانهها میتوانند برای بازیابی مواد آلی، جامدات و مواد مغذی مانند نیتروژن و فسفر از لجن فاضلاب، مجهز شوند. در صورت تصفیه بیشتر میتوانیم از لجن فاضلاب به عنوان ماده ورودی به هضمکننده بیهوازی برای تولید زیستگاز استفاده کنیم.
همانطور که در مطالب بالا اشاره شد مقدار متان موجود در زیستگاز میتواند از مقدار ۴۵ تا ۷۵ درصد حجمی تغییر کند. تغییر حجم متان به معنای تغییر مقدار انرژی در آن است.
مزایا و معایب استفاده از زیست گاز
در بخش قبل فهمیدیم مهمترین روشهای تولید زیستگاز چیست. در این بخش با مهمترین مزایا و معایب زیست گاز آشنا میشویم. تولید و استفاده از زیستگاز، مانند دیگر منابع انرژی، مزایا و معایبی دارد. به هنگام سرمایهگذاری در نیروگاههای تولید زیستگاز باید به این مزایا و معایب توجه کنیم. مهمترین مزیتهای استفاده از زیستگاز عبارت هستند از:
- زیستگاز منبع انرژی تمیزی است که بر فرایند عاری از کربن تکیه دارد. این بدان معنا است که به هنگام استفاده از زیستگاز هیچ کربنی وارد جو نمیشود.
- یکی از روشهای تولید زیستگاز استفاده از زبالههای غذایی و زبالههای دفن شده در محلهای دفن زباله است. با انجام این کار میتوانیم محیط زیست را از تعداد زیادی زباله پاکسازی کنیم و همچنین، این روش از نظر اقتصادی میتواند بسیار موثر باشد.
- از آنجا که زیستگاز را میتوان از کودهای حیوانی یا مدفوع انسان نیز تهیه کرد، خاک و آب کمتر آلوده خواهند شد. بنابراین، محیطی امن و سالم برای زندگی در دسترس خواهد بود.
- مقدار متان وارد شده به جو کاهش خواهد یافت.

برخی از مهمترین معایب استفاده از زیستگاز به عنوان منبع انرژی در ادامه آمده است:
- تولید زیستگاز متکی به فرایند زیستی است، بنابراین کنترل کامل آن ممکن نیست.
- زیستگاز در هوای گرمسیر بهتر کار میکند، بنابراین امکان دسترسی به این منبع انرژی به صورت برابر در سراسر جهان وجود ندارد.
چه زباله هایی می توانند زیست گاز تولید کنند؟
از تمام زبالههای آلی میتوانیم برای تولید زیستگاز استفاده کنیم. از مواد خام مانند زبالههای کشاورزی، زبالههای شهرداری، مدفوع انسان، لجن یا زبالههای غذایی میتوان زیستگاز تولید کرد. به طور حتم تاکنون از خود پرسیدهاید با تمام این توضیحات آیا زیستگاز خوب است یا بد. همانطور که در مطالب بالا اشاره شد زیستگاز منبع انرژی تمیزی است. این بدان معنا است که تاثیر آن بر محیط زیست در مقایسه با سوختهای فسیلی کمتر خواهد بود. گرچه زیستگاز عاری از هرگونه کربن است، تاثیر آن بر زیستبوم به طور کامل برابر صفر نیست.
اکولوژی زیست گاز
تا اینجا فهمیدیم زیستگاز چیست، چگونه تولید میشود و چه مزایا و معایبی دارد. همانطور که در مطالب بالا اشاره شد زیستگاز منبع انرژی تمیز و دوستدار محیط زیست است، زیرا همزمان میتواند دو مشکل اساسی محیط زیست را حل کند:
- اپیدمی جهانی زباله که روزانه مقادیر زیادی گاز متان را آزاد میکند.
- امروزه، سوختهای فسیلی منبع اصلی انرژی در جهان هستند. استفاده از این منبع انرژی آلودگی زیستمحیطی زیادی را به همراه دارد.

تبدیل گاز به مایع چیست؟
در مطالب بالا فهمیدیم تفاوتهای اصلی مایع و جامد با گاز چیست. ماده سه حالت اصلی جامد، مایع و گاز دارد که میتوانند طی فرایندهای مختلف به یکدیگر تبدیل شوند. در این بخش، در مورد تبدیل گاز به مایع صحبت میکنیم. به تبدیل گاز به مایع میعان میگوییم. سوال مهمی که ممکن است مطرح شود آن است که گاز تحت چه شرایطی میتواند به مایع تبدیل شود. به عنوان مثال، تشکیل قطرههای آب از هوا روی شیشه مثالی از تبدیل گاز به مایع است. برای آنکه بدانیم تحت چه شرایطی گاز میتواند به مایع تبدیل شود باید شرایط بهینه تبدیل گاز به مایع را بررسی کنیم.
برای آنکه بتوانیم گاز را به مایع تبدیل کنیم، باید دمای آن را کاهش دهیم. به عنوان مثال، هنگامیکه بطری آبی را از یخچال بیرون میآوریم، قطرههای آب روی سطح بطری را میتوانیم مشاهده کنیم. این قطرههای به دلیل چگالش مولکولهای آب موجود در هوا و به شکل رطوبت روی سطح بطری تشکیل شدهاند. در واقع مولکولهای آب موجود در هوا با نزدیک شدن به سطح بطری با دمای پایین، به حالت مایع تبدیل میشوند. همانطور که در مطالب بالا اشاره شد نیروی جاذبه بینمولکولی در گازها بسیار ضعیفتر از مواد مایع است. بنابراین، برای تبدیل گاز به مایع باید به گونهای نیروی بینمولکولی در ماده گازی را افزایش دهیم.
گاز مایع، گازی است که با فشرده شدن یا سرد شدن به مایع تبدیل میشود. گازها با استفاده از دو روش میتوانند به مایع تبدیل شوند:
- کاهش دما: با کاهش دما و سرد کردم مولکولهای گاز میتوانیم به آسانی گاز را به مایع تبدیل کنیم. در دماهای بسیار پایین، گار به مایع تبدیل میشود.
- اعمال فشار بالا: مولکولهای تشکیلدهنده گاز در فاصلهای مشخص از یکدیگر قرار گرفتهاند. این فاصله، فاصله بینمولکولی نامیده میشود. بنابراین، هنگامیکه ذرات را با اعمال فشار زیاد متراکم میکنیم، نیروهای بینمولکولی افزایش و فاصله بینمولکولی کاهش خواهند یافت. در نتیجه، گاز به مایه تبدیل میشود.
بنابراین، گازها در دماهای بسیار کم و در فشارهای بسیار بالا به مایع تبدیل میشوند. به این نکته توجه داشته باشید که بسیاری از گازها، تنها میتوانند با کاهش دما به مایع تبدیل شوند. از مایع شدن گازها میتوانیم برای مطالعه ویژگیهای بنیادی ماده مانند نیروهای بینمولکولی استفاده کنیم.
تبدیل مایع به گاز چیست ؟
در بخشهای قبل فهمیدیم گاز چیست و چگونه به به مایع تبدیل میشود. مایع نیز میتواند به گاز تبدیل شود. به تبدیل مایع به گاز تبخیر گفته میشود. فرض کنید حیاط خانه خود را در یک روز گرم تابستان شستهاید. یک ساعت بعد وقتی وارد حیاط میشوید، اثری از زمین خیس نمیبینید. زمین کاملا خشک شده است؟ چرا؟ آب به دلیل گرما تبخیر و از حالت مایع به بخار (گاز) تبدیل شده است.
تبدیل گاز به جامد چیست؟
به تبدیل گاز به جامد، چگالش میگوییم. در این حالت، ذرات تشکیلدهنده گاز توسط نیروی بیمولکولی قوی به یکدیگر میچسبند و بدون گذر از حالت مایع، مستقیم به حالت جامد تبدیل میشوند. این تغییر حالت به طور معمول در دماهای پایین و تحت فشارهای خاص رخ میدهد. تشکیل برف یا شبنم از مهمترین مثالهای چگالش یا تبدیل گاز به جامد هستند.
تبدیل جامد به گاز چیست ؟
به تغییر حالت ماده از جامد به گاز، بدون عبور از حالت مایع، تصعید میگوییم. به عنوان مثال، نفتالین در دمای اتاق خودبهخود از حالت جامد به گاز تبدیل میشود. در این حالت، ماده جامد با جذب گرما از محیط اطراف، به گاز تبدیل خواهد شد.
دریچه گاز چیست ؟
دریچه گاز وسیلهای که از آن برای تنظیم کردن جریان گاز یا نفت استفاده میشود. باز کردن یا بستن دریچه گاز، مقدار گاز یا مایع ورودی به لولهها را کنترل میکند.
جمعبندی
در این مطلب، ابتدا به پرسش گاز چیست به زبان ساده پاسخ دادیم. گاز یکی از سه حالت ماده است که شکل و حجم مشخصی ندارد. ماده گازی، شکل محفظه را به خود میگیرد و حجم آن برابر حجم محفظه میشود. برخلاف دو حالت مایع و جامد که محفظهای که داخل آن قرار گرفتهاند را پر نمیکنند، گازها وارد هر محفظه با هر اندازهای شوند، تمام آن را پر میکنند. در ادامه، در مورد مهمترین ویژگیهای گازها یعنی فشار، حجم و دما صحبت کردیم. مولکولهای تشکیلدهنده گاز میتوانند آزادانه به اطراف حرکت و به هنگام حرکت به دیواره ظرف برخورد کنند و تغییر مسیر دهند. فشار گاز از برخورد مولکولهای گاز به دیواره ظرف ناشی میشود.
سپس، دما و حجم گاز را تعریف کردیم. حجم اشغال شده توسط گاز فضایی است که در آن مولکولهای تشکیلدهنده گاز میتوانند آزادانه حرکت کنند. در ادامه، گاز ایدهال و رابطه حاکم بر آن را توضیح دادیم. فشار، دما و حجم گاز ایدهال با استفاده از رابطه به یکدیگر مربوط میشوند. در پایان زیستگاز چیست و در مورد مزایا و معایب آن به عنوان یکی از منابع انرژی تجدیدپذیر صحبت کردیم.
آزمون سنجش
۱. کدام گزینه رفتار معمول ذرات گاز را بهتر نشان میدهد؟
ذرات گاز فقط در یک مسیر حرکت میکنند و ثابت میمانند.
ذرات گاز همه کنار هم فشرده هستند و حرکت ندارند.
ذرات گاز به طور آزادانه و بدون نظم مشخص حرکت میکنند.
ذرات گاز همواره سرعت یکسانی دارند و به دما حساس نیستند.
عبارت «ذرات گاز به طور آزادانه و بدون نظم مشخص حرکت میکنند» بهدرستی رفتار ذرات گاز را نشان میدهد، زیرا در این حالت ذرات گاز آزادانه حرکت میکنند و چیدمان منظمی ندارند.
۲. مهمترین تفاوت گاز با جامد و مایع از نظر شکل و حجم چیست؟
گازها شکل و حجم ثابت ندارند و هر محفظهای را پر میکنند.
گازها شکل و حجم ثابت دارند مانند جامدات.
گازها فقط حجم ثابتی دارند ولی شکلشان عوض میشود.
گازها فقط شکل ثابتی دارند اما حجمشان متغیر است.
تفاوت اصلی این است که گازها مانند«گازها شکل و حجم ثابت ندارند و هر محفظهای را پر میکنند»، برخلاف جامدات و مایعات که یا شکل یا حجم ثابتی دارند. جامد شکل و حجم ثابت دارد و مایع شکل ظرف را میگیرد اما حجم ثابتی دارد. گاز بر حسب ظرف، هم شکل و هم حجمش تغییر میکند.
۳. از بین ویژگیهای زیر، کدام دلیل اصلی تراکمپذیری بیشتر گازها نسبت به جامد و مایع است؟
نزدیک بودن ذرات به یکدیگر
آزاد بودن فاصله بین ذرات
استحکام زیاد نیروهای جاذبه
حرکت کند و منظم ذرات
«آزاد بودن فاصله بین ذرات» باعث میشود فضای بیشتری بین ذرات گاز نسبت به جامد و مایع وجود داشته باشد و گازها هنگام فشار به راحتی فشرده شوند. در مقابل، «حرکت کند و منظم ذرات» و «نزدیک بودن ذرات به یکدیگر» ویژگی مواد جامد و مایع است که تراکمپذیری آنها را کم میکند. همچنین «استحکام زیاد نیروهای جاذبه» باعث محدود شدن جابجایی و فشرده شدن ذرات میشود، که این ویژگی در گاز وجود ندارد.
۴. افزایش دما یا فشار چه تغییری در رفتار ذرات گاز ایجاد میکند؟
کاهش دما باعث افزایش حجم گاز میشود.
افزایش فشار حجم گاز را بدون تغییر عدد مول کم میکند.
افزایش دما باعث افزایش انرژی ذرات و حرکت سریعتر آنها میشود.
افزایش فشار باعث افزایش فاصله بین ذرات گاز میشود.
بر اساس ویژگیهای گاز، افزایش دما موجب افزایش انرژی جنبشی و حرکت سریعتر ذرات میشود؛ در حالی که مواردی مانند «کاهش دما باعث افزایش حجم گاز» یا «افزایش فشار باعث افزایش فاصله بین ذرات» با علم شیمی و رفتار واقعی گاز مطابقت ندارند.
۵. دلیل اینکه گازها میتوانند هر ظرفی را بدون داشتن شکل و حجم ثابت پر کنند چیست؟
حجم گازها همواره کمتر از حجم ظرف است.
نیروی جاذبه بین ذرات گاز بیشترین مقدار را دارد.
گازها فقط در فشار کم میتوانند ظرف را پر کنند.
ذرات گاز بسیار دور از هم و آزادانه حرکت میکنند.
ویژگی اصلی گازها این است که ذرات آنها بسیار دور از هم و آزادانه حرکت میکنند، بنابراین به راحتی پخش شده و هر فضایی را پر میکنند.
۶. بر اساس جدول مقایسهای سه حالت ماده، کدام مورد یکی از تفاوتهای کلیدی رفتار جامد، مایع و گاز است؟
در گاز ذرات کاملا آزادانهتر از جامد و مایع حرکت میکنند.
ذرات گاز نسبت به جامد نیروی جاذبه بیشتری دارند.
همه حالات ماده شکل و حجم ثابتی دارند.
جامد و مایع به راحتی متراکم میشوند اما گاز اینطور نیست.
در گاز ذرات نسبت به جامد و مایع آزادانهتر حرکت میکنند و فاصلهی بیشتری دارند، این موضوع در جدول مقایسهای توضیح داده شده است. «شکل و حجم ثابت» فقط در مورد جامد مطرح است و نه همه حالات. بر خلاف یک ادعا، گازها نسبت به جامد و مایع «بسیار متراکمپذیرتر» هستند. همچنین نیروی جاذبه بین ذرات در گاز بسیار کمتر از جامد است.
۷. زمانی که دمای محیط افزایش مییابد، رفتار حجم گاز را چگونه میتوان با یک مثال ساده توضیح داد؟
حجم گاز با افزایش دما ناپدید میشود، مانندناپدید شدن بخار آب
حجم گاز با افزایش دما کاهش مییابد، مانندجمع شدن بادکنک در یخچال
حجم گاز با افزایش دما بیشتر میشود، مانند بزرگتر شدن بادکنک روی بخاری
حجم گاز با افزایش دما ثابت میماند، مانندهوای درون یک کپسول
وقتی دما افزایش پیدا میکند، ذرات گاز سریعتر حرکت میکنند و باعث افزایش فاصله بین آنها میشود. در این حالت، اگر گاز در محفظه قابلانعطاف باشد مانند بادکنک، حجم گاز نیز بیشتر میشود و بادکنک بزرگتر میشود. برخلاف این حالت، کاهش حجم یا ناپدید شدن گاز ناشی از افزایش دما نیست. همچنین، حجم گاز در این شرایط ثابت نمیماند. مگر اینکه محفظه غیرقابلانعطاف باشد. رشد اندازه بادکنک روی بخاری نمونهای از اثر افزایش دما بر حجم گاز است.
۸. برای توصیف دقیق رفتار یک گاز، چه کمیتهایی باید اندازهگیری شوند؟
حجم، فشار و دما
نقطه ذوب و نقطه جوش
شکل و رنگ گاز
جرم مولکولی و حالت فیزیکی
برای توصیف رفتار گاز لازم است کمیتهایی مانند «حجم، فشار و دما» اندازهگیری شوند، چون رفتار ذرات گاز و روابط آنها با این سه عامل تعیین میشود.
۹. در یک ظرف بسته، رابطه بین فشار و حجم گاز چگونه قابل توضیح است؟
افزایش فشار فقط دمای گاز را تغییر میدهد.
افزایش فشار باعث کاهش حجم گاز میشود.
افزایش فشار حجم گاز را تغییر نمیدهد.
افزایش فشار موجب افزایش حجم گاز میشود.
وقتی فشار گاز در یک ظرف بسته افزایش یابد، مولکولهای گاز به دیوارهها نزدیکتر میشوند و فضای اشغالشده توسط گاز کاهش مییابد. به همین دلیل، در شرایط ثابت بودن دما و تعداد ذرات، افزایش فشار منجر به کاهش حجم گاز میشود که این رابطه طبق قانون بویل در بخشهای مربوط به ویژگیهای فیزیکی و قوانین گازها توضیح داده شده است.
۱۰. افزایش حجم یک بادکنک با گرمشدن آن چه رابطهای با ویژگیهای گاز دارد؟
با افزایش دما، فشار گاز کاهش یافته و بادکنک کوچکتر میشود.
افزایش دما، موجب افزایش نیروی جاذبه میان ذرات و سفت شدن بادکنک میشود.
با افزایش دما، مولکولهای گاز سریعتر حرکت میکنند و بادکنک بزرگتر میشود.
افزایش دما باعث میشود مولکولها به هم نزدیکتر شوند و حجم بادکنک کم شود.
هنگامی که دمای گاز داخل بادکنک بالا میرود، ذرات گاز انرژی بیشتری میگیرند و سریعتر حرکت میکنند. این رفتار طبق رابطه بین حجم و دما در گازها باعث میشود که مولکولها به دیوارههای بادکنک فشار بیشتری وارد کنند و در نهایت حجم بادکنک افزایش پیدا کند. یعنی افزایش دما با افزایش حجم همراه است.
۱۱. در هنگام بادکردن بادکنک، بهترین روش اندازهگیری حجم گاز داخل بادکنک چیست؟
استفاده از مقدار آبی که بادکنک جابهجا میکند.
محاسبه وزن بادکنک پر شده با ترازو.
تخمین حجم بادکنک با مقایسه آن با جسم جامد همحجم.
استفاده از فشارسنج برای سنجش فشار داخلی بادکنک.
روش جابهجایی آب روشی کاربردی برای اندازهگیری حجم گاز در بادکنک است زیرا میتوان بادکنک را در ظرف آب قرار داد و میزان آبی که جابهجا میشود برابر با حجم گاز داخل بادکنک است. استفاده از فشارسنج فقط میزان فشار را مشخص میکند، سنجش وزن نیز با توجه به چگالی کم گاز و وزن سبک بادکنک نتیجه دقیق نمیدهد. مقایسه با جسم جامد مشابه نیز به دلیل تفاوت چگالی و شکل معمولا دقیق نیست.
۱۲. بر اساس قانون آووگادرو، اگر در مخزنی با دما و فشار ثابت تعداد مول گاز افزایش یابد، حجم گاز چه تغییری خواهد کرد؟
حجم گاز به دو برابر افزایش مییابد.
حجم گاز نصف میشود.
حجم گاز به نصف کاهش مییابد.
حجم گاز تغییری نمیکند.
بر طبق قانون آووگادرو، با ثابت بودن دما و فشار، حجم گاز رابطه مستقیمی با تعداد مول (n) دارد. در این شرایط اگر تعداد مول گاز دو برابر شود، حجم آن نیز به همان نسبت افزایش پیدا میکند. بنابراین، افزایش تعداد مول گاز سبب میشود حجم گاز دو برابر گردد.
۱۳. معادله PV=nRT برای توصیف رفتار گازها در چه شرایطی به کار میرود و چه رابطه فیزیکی را نمایش میدهد؟
معادله PV=nRT بیشتر برای مایعها تحت دما و فشار بالا به کار میرود و وابسته به ضریب انبساط حرارتی است.
معادله PV=nRT برای همه حالات ماده و هر نوع فشار و دما کاربرد دارد و تنها دما و حجم را مرتبط میسازد.
این معادله فقط به گازهایی با ساختار مولکولی منظم و ترتیبی اختصاص دارد و وابسته به انرژی جنبشی نیست.
این معادله فقط برای گازهای ایدهال در شرایط فشار و دمای معمولی معتبر است و رابطه بین فشار، حجم، دما و تعداد مول را بیان میکند.
عبارت «این معادله فقط برای گازهای ایدهال در شرایط فشار و دمای معمولی معتبر است و رابطه بین فشار، حجم، دما و تعداد مول را بیان میکند» صحیح است چون معادله PV=nRT رفتار گاز ایدهال را نشان میدهد و فقط در شرایط فرضی بدون برهمکنش و ابعاد ذرهای قابل استفاده است.
۱۴. قوانین بویل، شارل و آووگادرو هر کدام رابطه میان کدام دو متغیر را در رفتار گازها شرح میدهند؟
قانون بویل: فشار و دما، قانون شارل: حجم و انرژی، قانون آووگادرو: فشار و تعداد مول
قانون بویل: حجم و دما، قانون شارل: تعداد مول و فشار، قانون آووگادرو: دما و فشار
قانون بویل: دما و حجم، قانون شارل: فشار و دما، قانون آووگادرو: حجم و انرژی
قانون بویل: فشار و حجم، قانون شارل: دما و حجم، قانون آووگادرو: تعداد مول و حجم
هرکدام از این سه قانون رفتار ویژهای میان دو متغیر گازی روشن میکند. «قانون بویل» رابطه میان فشار و حجم گاز را زمانی که دما و تعداد مول ثابتاند توضیح میدهد. «قانون شارل» رابطه حجم و دما را با ثابت بودن فشار و مقدار گاز توصیف میکند؛ و «قانون آووگادرو» ارتباط تعداد مول و حجم گاز را هنگام ثابت بودن فشار و دما بیان میکند.
۱۵. اگر در یک آزمایش علمی فشار محیط افزایش یابد، حجم گاز موجود در یک ظرف بسته چگونه تغییر میکند و علت این تغییر چیست؟
حجم گاز افزایش مییابد چون ذرات آزادانهتر حرکت میکنند.
حجم گاز ثابت میماند چون گاز شکل و حجم مشخص ندارد.
حجم گاز ابتدا افزایش و سپس کاهش مییابد چون انرژی جنبشی تغییر میکند.
حجم گاز کاهش مییابد چون برخورد ذرات بیشتر شده و به هم نزدیکتر میشوند.
وقتی فشار محیط روی یک گاز در ظرف بسته افزایش پیدا کند، حجم گاز کاهش مییابد، زیرا فشار بیشتر باعث نزدیکتر شدن ذرات به هم میشود و فضای بین آنها کمتر میشود. طبق روابط شناختهشده مانند قانون بویل، فشار و حجم گاز نسبت معکوس دارند، بنابراین افزایش فشار به کاهش حجم منجر میشود.
۱۶. کدام گزینه به طور دقیق بیان میکند که تبخیر، میعان و تصعید در چه شرایطی بین حالات مختلف ماده رخ میدهند؟
تبخیر زمانی رخ میدهد که فشار کاهش یابد، میعان با افزایش فشار و دما، تصعید با افزایش حجم.
میعان زمانی اتفاق میافتد که دما یا فشار کاهش یابد، تبخیر با افزایش دما، تصعید هنگام کاهش فشار.
میعان با افزایش سرعت ذرات، تبخیر با کاهش سرعت ذرات و تصعید با کاهش انرژی جنبشی رخ میدهد.
تبخیر با افزایش دما، میعان با کاهش دما و تصعید با افزایش انرژی بین مولکولی رخ میدهد.
تبدیل گاز به مایع (میعان) زمانی رخ میدهد که دما یا فشار کاهش پیدا کند. در چنین شرایطی ذرات به یکدیگر نزدیکتر میشوند و به حالت مایع تبدیل میشوند. تبخیر هنگامی اتفاق میافتد که دما زیاد شود، که انرژی جنبشی ذرات را افزایش داده و آنها را به حالت گازی میبرد. فرایند تصعید نیز معمولا زمانی رخ میدهد که فشار کم باشد یا دما به اندازه کافی بالا برود تا یک ماده جامد مستقیما به گاز تبدیل شود.
۱۷. کدام مورد تفاوت اصلی میان زیستگاز و گاز طبیعی از نظر فرایند تولید و اثر زیستمحیطی را بیان میکند؟
هر دو گاز از ترکیب مواد نفتی تولید میشوند و تفاوتی در اثر زیستمحیطی ندارند.
گاز طبیعی عمدتا از بقایای گیاهان و جانوران قدیمی تشکیل میشود و زیستگاز از مواد آلی و زائدات شهری قابل تولید است و زیستگاز اثرات زیستمحیطی مثبتتری دارد.
زیستگاز و گاز طبیعی هر دو تنها از گاز متان ساخته شدهاند اما زیستگاز همواره اثر مخربتری بر محیط زیست دارد.
زیستگاز از سوختن بقایای گیاهان تازه و گاز طبیعی از نفت خام تولید میشود و هر دو اثری یکسان بر محیط زیست دارند.
«گاز طبیعی» از بقایای گیاهان و جانوران قدیمی طی مدت طولانی، و «زیستگاز» از مواد آلی و زبالههای شهری با فناوریهای نوین به دست میآید. زیستگاز چون از مواد تجدیدپذیر و بازیافتی تولید میشود و به کاهش زباله کمک میکند،
۱۸. کدام مورد درباره مزایا یا معایب زیستگاز به عنوان یک منبع انرژی، بر اساس شرایط تولید و مصرف صحیح است؟
زیستگاز به دلیل تجدیدپذیری و کمک به کاهش زباله محیط زیست مزیت دارد.
زیستگاز امکان تجدید شدن ندارد و فقط از مواد معدنی تولید میشود.
زیستگاز به علت فسیلی بودن منابع خود آلودگی شدید ایجاد میکند.
زیستگاز نسبت به گاز طبیعی ناپایدار است و نمیتوان برای کاهش زباله از آن استفاده کرد.
زیستگاز به دلیل تولید از مواد آلی و زائدات شهری، یک سوخت تجدیدپذیر است و نقش موثری در کاهش زباله و اثرات منفی محیطزیستی دارد. برخلاف گزینههای دیگر که اشاره به فسیلی بودن، تولید فقط از مواد معدنی یا عدم ناپایداری و محدودیت کاربرد در کاهش زباله دارند، این موارد مرتبط با زیستگاز نیستند. استفاده از زیستگاز به دلیل ویژگیهای گفتهشده یک مزیت مهم در انرژیهای پاک به حساب میآید.












