قدرت اسید و ثابت تفکیک اسید — از صفر تا صد

ثابت تفکیک اسید $$(K_a)$$، معیاری برای تعیین قدرت اسید در یک محلول است. در حقیقت، بمنظور تعیین قدرت نسبی اسید و باز میتوان از مقدار ثابت تعادل در یک واکنش یونش (یونیزاسیون) استفاده کرد. به طور مثال، واکنش کلی برای یونش (تفکیک) اسید ضعیف در آب، به صورت زیر است. در این رابطه HA، اسید و $$A^-$$، باز مزدوج آن است.
$$HA_{(aq)}+H_2O_{(l)} \rightleftharpoons H_3O^+_{(aq)}+A^−_{(aq)} $$
ثابت تفکیک اسید
ثابت تعادل برای معادله بالا به صورت زیر تعریف میشود.
$$K=\dfrac{[H_3O^+][A^−]}{[H_2O][HA]} $$
توجه داشته باشید که غلظت آب خالص، در تمام واکنشهای محلول در آب، مقدار ثابتی است، بنابراین غلظت آب در معادله بالا را میتوان با یک کمیت جدید موسوم به ثابت تفکیک اسید یا «ثابت یونش اسید» (Acid Ionization Constant)، به صورت زیر تعریف کرد:
$$K _ a = K [H _ 2O]=\dfrac{[ H _ 3O ^ +][A ^ − ]}{[H A]}$$
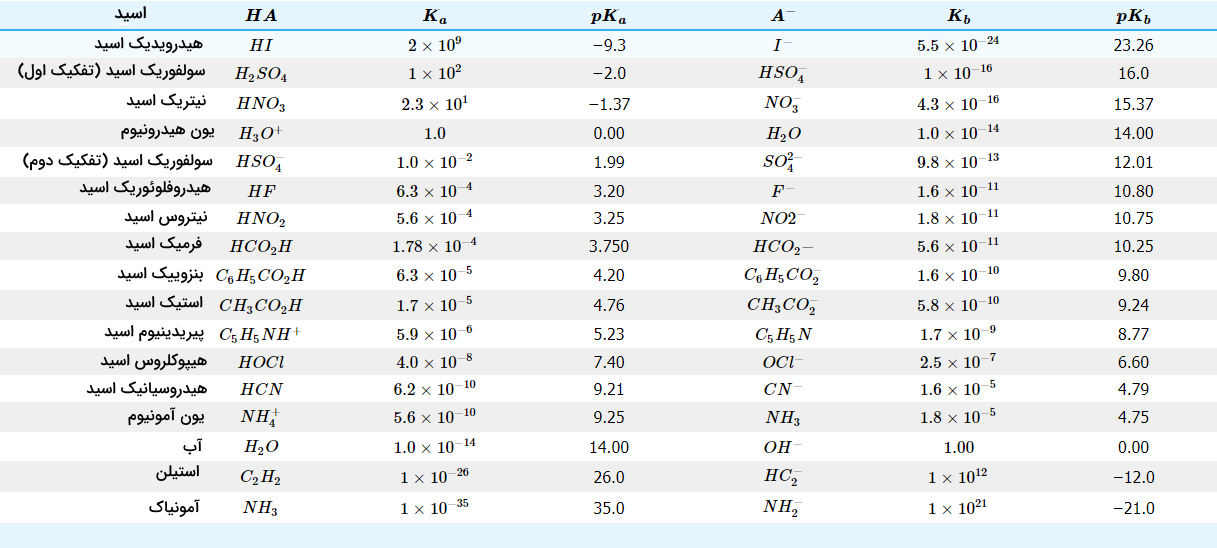
در نتیجه، مقادیر عددی $$K$$ و $$K_a$$، با یکدیگر به میزان غلظت آب (55/3 مولار) تفاوت دارند. برای سادگی کار میتوان عبارت $$H^+$$ را به جای عبارت $$H_3O^+$$ بکار برد. توجه داشته باشید که $$H ^ +$$ آزاد در هیچیک از محلولهای آبی وجود ندارد بلکه، پروتونی است که در واکنشهای یونش به $$H_2$$ منتقل میشود تا یون هیدرونیوم $$(H_3O^+)$$ تشکیل شود. هر قدر میزان $$K_a$$ بیشتر باشد، قدرت اسید و همینطور غلظت $$H^ +$$ در حالت تعادل، بیشتر است. همانند تمامی ثابتهای تعادل، ثابتهای تفکیک اسید و باز را هم بر اساس فعالیت (اکتیویته) $$H ^ +$$ یا $$OH^-$$ اندازهگیری میکنند و بنابراین، این مقادیر، بدون واحد هستند. مقادیر $$K_a$$ برای برخی از اسیدها در جدول زیر آورده شده است:
| نام اسید | $$HA$$ | $$K_a$$ | $$pK_a$$ |
| هیدرو یدیک اسید | $$HI$$ | $$2 \times 10 ^ {9}$$ | $$-9.3$$ |
| سولفوریک اسید (تفکیک اول) | $$H_2SO_4$$ | $$1 \times 10 ^ {2}$$ | $$-2$$ |
| نیتریک اسید | $$HNO_3$$ | $$2.3 \times 10 ^ {1}$$ | $$-1.37$$ |
| یون هیدرونیوم | $$H_3O^+$$ | $$1$$ | $$0$$ |
| سوفلوریک اسید (تفکیک دوم) | $$HSO_4^-$$ | $$1 \times 10 ^ {-2}$$ | $$1.99$$ |
| فرمیک اسید | $$HCO_2H$$ | $$1.78 \times 10 ^ {-4}$$ | $$3.750$$ |
| آب | $$H_2O$$ | $$1 \times 10 ^ {-14}$$ | $$14$$ |
| استیلن | $$C_2H_2$$ | $$1 \times 10 ^ {-26}$$ | $$26$$ |
| آمونیاک | $$NH_3$$ | $$1 \times 10 ^ {-35}$$ | $$35$$ |
تفکیک بازهای ضعیف
بازهای ضعیف در واکنش با آب، یون هیدروکسید تولید میکنند. واکنش تفکیک آنها در زیر آورده شده که در آن، $$B$$ نقش باز دارد و $$BH ^ +$$، اسید مزدوج آن است.
$$B _ {(a q)} + H _ 2 O _ {( l ) } \rightleftharpoons BH^+_{(aq)}+ O H ^ − _{(a q)}$$
ثابت تعادل در این واکنش موسوم به ثابت یونش باز یا ثابت تفکیک باز است:
$$K _ b = K [ H _ 2 O ] = \frac{[ B H ^ +][O H ^ − ]}{[ B]}$$
خودیونش آب
بار دیگر مشاهده میکنید که غلظت آب، ثابت است و در نتیجه، در تعریف ثابت تعادل جای نمیگیرد اما در تعریف $$K_b$$ وجود دارد. هرقدر مقدار $$K_b$$ بزرگتر باشند، باز قویتری داریم و همچنین غلظت $$OH ^ -$$ در تعادل، بیشتر است.
رابطه سادهای بین مقدار $$K_a$$ برای یک اسید و $$K_b$$ برای باز مزدوج آن برقرار است. به طور مثال، یونش هیدروسیانیک اسید با فرمول $$HCN$$، در آب، یک محلول اسیدی و واکنش $$CN^-$$ با آب، یک محلول بازی تولید میکند.
$$H C N _ {(a q)} \rightleftharpoons H ^ + _ {(a q)} + C N ^ − _ {(aq)}$$
$$C N ^ − _{( a q )} + H _ 2 O _ {( l)} \rightleftharpoons O H ^ − _ {(a q)} + H C N _ {(aq)} $$
رابطه ثابت تفکیک اسید برای $$HCN$$ به صورت زیر است:
$$K _ a = \dfrac{[ H ^ + ][C N ^ − ]}{[H C N ]}$$
رابطه متناظر برای واکنش سیانید با آب نیز به شکل زیر تعریف میشود:
$$K _ b = \dfrac{[ O H ^ − ][H C N ]}{[ C N ^ −]} $$

در این حالت، مجموع واکنشها، معادلهای را بدست داد که به «خودیونش آب» (Autoionization of Water) معروف و رابطه آن به صورت حاصلضرب ثابت تفکیک اسید و باز است:
$$K _ a K _ b = K _ w $$
بنابراین، با داشتن ثابت تفکیک اسید $$(K_a)$$ یا ثابت تفکیک باز، میتوان سایر مقادیر ثابت تعادل را محاسبه کرد. برای اینکه در محاسبات قدرت اسید و ثابت تفکیک اسید نیازی به نوشتن عبارات تواندار نداشته باشیم، همچون محاسبات pH میتوانیم از لگاریتم منفی به شکل زیر استفاده کنیم که در اینصورت، عبارت $$pK_a$$ تعریف خواهد شد.
$$p K a = − \log _ {1 0}K _ a $$
$$K _ a = 1 0 ^ { − p K _ a} $$
به همین شکل میتوان روابط زیر را برای $$pK_b$$ تعریف کرد:
$$\begin{array}{c}
{p K _ { b} = - \log _ {1 0} K _ { b}} \
{K _ { b} = 1 0 ^ {- p K _ {b}}}
\end{array}$$
به طور مشابه، روابط زیر نیز قابل تعریف خواهند بود:
$$p K_{a}+p K_{b}=p K_{w}$$
این رابطه در دمای ۲۵ درجه سانتیگراد به شکل زیر نوشته میشود:
$$p K_{a}+p K_{b}=14.00$$

مقایسه قدرت اسید با $$pK_a$$
از آنجایی که در محاسبات $$pK_a$$ از لگاریتم منفی استفاده میکنیم، مقادیر کم از $$pK_a$$ بیانگر ثابت تفکیک اسید بزرگتر و به دنبال آن، قدرت اسید بالاتر هستند. به طور مثال، نیتروس اسید با فرمول $$HNO_2$$ دارای $$pK_a$$ برابر با 3/25 است. این اسید در حدود یک میلیون بار قویتر از هیدروسیانیک اسید (HCN) با $$pK_a$$ برابر با 9/21 خواهد بود. به همین شکل، مقادیر کم $$pK_b$$ متناظر با بازهای قوی و ثابت تفکیک بازی بیشتر ذکر میشود.
در تصویر زیر، قدرت اسیدها و بازهای مزدوج آنها نشان داده شده است. قویترین اسید در پایین و سمت چپ تصویر قرار دارد و قویترین باز در بالا و سمت راست. همانطور که در تصویر هم دیده میشود، بازِ مزودجِ یک اسید قوی، یک باز بسیار ضعیف و به عکس، اسید مزدوج یک باز قوی، اسیدی بسیار ضعیف است.
تعیین جهت واکنش با ثابت تفکیک اسید
از قدرتهای نسبی اسیدها و بازها میتوان بمنظور پیشبینی جهت یک واکنش اسید و باز استفاده کرد. برای اینکار کافی است تا از قانون ساده زیر بهره بگیریم:
یک واکنش تعادلی اسید و باز همواره به سمتی پیششروی میکند که اسید و باز ضعیف داشته باشیم. به یاد داشته باشید که در یک واکنش اسید باز، پروتون همواره با باز قوی وارد واکنش میشود. به طور مثال، هیدروکلریک اسید، نوعی اسید قوی به شمار میآید که عموما، در محلولهای رقیق به طور کامل تفکیک میشود و $$H_3O^+$$ و $$Cl^ -$$ تولید میکند و تنها مقادیر بسیار کمی از مولکولهای $$HCl$$، تفکیک نشده باقی میمانند. در نتیجه، جهت واکنش، به طور کامل به طرف راست خواهد بود و همانطور که در زیر نشان داده شده است، معادله این واکنش با یک فلش نشان داده میشود.
$$H C l _ {(a q ) } + H _ 2 O _ {( l )} \rightarrow H _ 3 O ^ + _ {(a q)}+C l ^ − _ {(a q)} $$
در مقابل، استیک اسید از جمله اسیدهای ضعیف و آب نیز یک باز ضعیف است.
در نتیجه، محلولهای آبی استیک اسید، بیشتر شامل مولکولهای استیک اسید در تعادل با غلظتهای کم از $$H_3O^+$$ و یونهای استات هستند و جهت پیشرفت واکنش تعادلی به طرف چپ خواهد بود.

به طور مشابه، در واکنش آمونیاک با آب، یون هیدروکسید، یک باز قوی و آمونیاک، باز ضعیف است درحالیکه یون آمونیوم، اسید قویتری از آب به شمار میآید، به همین دلیل، تعادل در این واکنش نیز به طرف چپ خواهد بود

مثال برای قدرت اسید و ثابت تفکیک اسید
1. $$K_b$$ و $$pK_b$$ یون بوتیرات را با فرمول $$\begin{equation} C H_{3} C H_{2} C H_{2} C O_{2} ^ - \end{equation}$$ محاسبه کنید. $$pK_a$$ بوتیریک اسید در دمای 25 درجه سانتیگراد برابر با 4/83 است.
2. مقادیر $$K_a$$ و $$pK_a$$ را برای یون دیمتیل آمونیوم با فرمول $$\begin{equation} \left(\left(C H_{3}\right)_{2} N H_{2}^{+}\right)\end{equation}$$ محاسبه کنید. ثابت تفکیک باز $$(K_b)$$ برای دیمتیلآمین در دمای 25 درجه سانتیگراد برابر با $$5.4 \times 10 ^ {-4}$$ است.
روش حل مساله
مقدار $$pK_a$$ برای بوتریک اسید را داریم و میخواهیم مقادیر $$pK_b$$ و $$K_b$$ را برای باز مزدوج آن محاسبه کنیم. از آنجایی که کمیت داده شده به صورت $$K_b$$ است، از رابطه $$K_aK_b = K_w$$ کمک میگیریم. در نتیجه خواهیم داشت:
$$\begin{equation}
\begin{aligned}
p K_{a}+p K_{b} &\;=p K_{w}=14.00 \
4.83+p K_{b} &\;=14.00 \
p K_{b} &\;=14.00-4.83=9.17
\end{aligned}
\end{equation}$$
$$pK_b = −log K_b$$
$$K _b = 10 ^ {-9.17} = 6.8times10^ {-10}$$
در حالت دوم، مقدار $$K_b$$ برای دیمتیل آمین را داریم و باید $$K_a$$ و $$pK_a$$ برای اسید مزدوج آنرا محاسبه کنیم. با توجه به رابطه $$K_aK_b = K_w$$ و جایگذاری مقادیر برای دمای ۲۵ درجه سانتیگراد، $$K_a$$ بدست خواهد آمد.
$$\begin{equation}
p K _ { a } + p K _ { b} = p K _ {w } = 14.00
\end{equation}$$
$$K_a(5.4 \times 10^{−4})=1.01 \times 10^{−14}$$
$$K _ a = 1. 9 \times 10 ^ { − 11}$$
با استفاده از روابط لگاریتمی ثابت تفکیک اسید خواهیم داشت:
$$\begin{equation}
p K_{a}=-log K_{a}
\end{equation}$$
$$pK _ a = − \log( 1 . 9 \times 10 ^ {− 11 }) = 10.72$$
همچنین، با تبدیل $$K_b$$ به $$pK_b$$، به همین جواب برسیم:
$$\begin{equation}
\begin{array}{c}
{p K _ { b} = - \log \left( 5 . 4 \times 10 ^ { - 4}\right) = 3.27} \
{p K a+p K _ { b } = 14.00} \
{p K _ { a } = 10.73} \
{K _ { a} = 10 ^ { -p K _ {a}} = 10 ^ { - 1 0.7 3}=1.9 \times 10 ^ { - 11}}
\end{array}
\end{equation}$$

محلولهای قوی از اسید و باز: اثر همتراز کنندگی
در جدول ابتدایی این آموزش، میبینید که اسیدهایی همچون $$H_2SO_4$$ و $$HNO_3$$ بالاتر از یون هیدرونیوم قرار دارند. این بدان معنی است که چنین اسیدهایی، $$pK_a$$ کمتر از صفر دارند و اسیدهایی قویتر از یون $$H_3O^+$$ هستند. با وجود اینکه قدرت اسید $$(K_a)$$ در $$HI$$ در حدود 108 بار بیشتر از قدرت اسید در $$HNO_3$$ اما واکنش $$HI$$ یا $$HNO_3$$ با آب، به طور معمول، محلول استوکیومتری از $$H_3O^+$$ و $$I^-$$ یا $$NO_3^-$$ بدست میدهد.
در حقیقت، 0/1 مولار محلول آبی از هر اسید قوی، فارغ از نوع اسید، شامل 0/1 مولار $$H_3O^+$$ است. به این پدیده، اثر «همتراز کنندگی» (Leveling Effect) میگویند. اثر همتزار کنندگی بیان میکند که هر اسیدی که قویتر از اسید مزدوج آب $$(H_3O^+)$$ باشد، در محلولهای آبی، با قدرت $$H_3O^+$$ همتراز میشود چراکه $$H_3O^+$$ قویترین اسیدی است که میتواند در تعادل با آب قرار داشته باشد. در نتیجه، نمیتوان قدرت اسید بین اسیدهایی همچون $$HI$$ و $$HNO_3$$ در محلولهای آبی را تشخیص داد. به همین دلیل باید از روشهای نسبی برای تعیین قدرت نسبی این اسیدها استفاده کرد.
یکی از این روشها، استفاده از حلالی همچون آنیدروس استیک اسید است. از آنجایی که استیک اسید، اسید قویتری از آب به شمار میآید، باز ضعیفتری نیز خواهد بود که تمایل کمتری نسبت به $$H_2O$$ برای پذیرش پروتون دارد. اندازهگیری هدایت الکتریکی محلولهای 0/1 مولار $$HI$$ و $$HNO_3$$ در استیک اسید نشان میدهد که $$HI$$ به طور کامل تفکیک میشود اما $$HNO_3$$ تنها به صورت جزئی تفکیک خواهد شد و رفتاری همچون اسید ضعیف در چنین حلالی نشان میدهد. این نتیجه به طور واضح بیان میکند که $$HI$$ اسید قویتری از $$HNO_3$$ است. پس همواره توجه داشته باشید که در محلولهای آبی، $$H_3O^+$$ قویترین اسید و $$OH^-$$ قویترین باز به شمار میآیند که در تعادل با $$H_2O$$ قرار دارند.
اثر همتراز کنندگی در بازهای قوی نیز صدق میکند به گونهای که در محلولهای آبی، هر باز قویتر از $$OH^-$$، با قدرت $$OH^-$$ همتراز میشود زیرا $$OH^-$$ قویترین بازی است که در تعادل با آب قرار دارد. نمکهایی همچون $$K_2O$$، سدیم متوکسید $$(NaOCH_3)$$ و سدیم آمید $$(NaNH_2)$$، همگی بازهایی هستند که به شدت و به طور کامل با آب واکنش میدهند که واکنشهای آنها در زیر آورده شده است:
$$K _ 2 O _{( s )} + H _ 2 O _ {( l)} \rightarrow 2 O H ^ − _ {( a q )}+2 K ^ + _ {(aq)}$$
$$Na O C H _ {3 ( s )}+ H _ 2 O _{( l )} \rightarrow O H ^ − _ {( a q )} + N a ^ + _ {( a q )}+C H _ 3 O H _ {( a q)}$$
$$N a N H _ { 2 ( s ) }+H _ 2 O _ { ( l )} \rightarrow O H ^ − _ {( a q )}+N a ^ + _ {(a q )} + N H _ {3 (a q)}$$
اسیدها و بازهای چند پروتونه
همانطور که میدانید، اسیدهای چند پروتونه همچون $$H_2SO_4$$، $$H _ 3 PO_4$$ و $$H_2CO_3$$، شامل بیش از یک پروتون قابل تفکیک هستند و این پروتونها را به صورت مرحلهای از دست میدهند.
در اسیدهای چند پروتونه، اگر مولکولی، پروتونی از دست نداده باشد، اسید قویتری به شمار میآید چراکه حذف یک پروتون از مولکول خنثی، سادهتر از حذف آن از یون با بار منفی است. قدرت اسید در هر مرحله با از دست دادن پروتون کاهش و به دنبال آن، $$pK_a$$ افزایش پیدا میکند. به طور مثال، $$H_2SO_4$$ را در نظر بگیرید.
$$\begin{equation}
H _ { 2 } S O _ { 4} \longrightarrow H ^ { + }( a q ) + H S O _ { 4 } ^ { -}(a q)
\end{equation}$$
$$\begin{equation}
H S O _ {4} ^ { - }(a q) \longrightarrow H ^ { + }(a q) + S O _ { 4} ^ {- 2 }(a q)
\end{equation}$$
جهت تعادل در واکنش اول، به طرف راست خواهد بود چراکه $$H_2SO_4$$ یک اسید قوی به شمار میآید. در مقابل، در واکنش دوم، مقادیر قابل توجهی از $$H_2SO_4$$ و $$SO_4 ^ {2 -}$$ در تعادل قرار دارند. یون هیدروژن سولفات $$HSO_4^-$$، باز مزدوج سولفوریک اسید و اسید مزدوج $$SO_4 ^ {2 -}$$ است. همچون آب، بسته به این که واکنشدهنده دیگر، اسید قوی یا باز قوی باشد، $$HSO_4^-$$ میتواند به صورت باز یا اسید عمل کند. در مقابل، یون سولفات $$(SO_4 ^ {2 -})$$ یک باز چند پروتونه است که میتواند به صورت مرحلهای، دو پروتون را بپذیرد.

همانند سایر اسیدها و بازهای مزدوج، قدرت اسید و بازهای مزدوج با رابطه $$\begin{equation}p K_{a}+p K_{b}=p K wend{equation}$$ به یکدیگر مرتبط میشوند.
مثال
جهت تعادل را برای هریک از واکنشهای زیر پیشبینی کنید.
$$N H ^ + _ { 4 ( a q )} + P O ^ {3 −} _ { 4 (a q)} \rightleftharpoons N H _ { 3( a q )} + H P O ^ {2 − } _ { 4 ( a q )}$$
$$C H _ 3 C H _ 2 C O _ 2 H _ {( a q )} + C N ^ − _ {(a q)} \rightleftharpoons C H _ 3 C H _ 2 C O ^ − _ {2 ( a q)} + H C N _ {(a q)}$$
استراتژی حل مساله
اسید و بازهای مزدوج در هر واکنش را پیدا کنید. سپس با توجه به جداول و تصاویر، قدرت اسید و باز هرکدام را مشخص کنید. در نهایت، تعادل همواره به طرفی خواهد بود که اسید و باز ضعیف به تولید برسند. در واکنش اول، جفتهای اسید و باز مزدوج به صورت $$NH_4^+/NH_3$$ و $$HPO_4^{2−}/PO_4^{3−}$$ هستند. مقادیر $$pK_a$$ برای $$NH_4^+$$ و $$HPO_4^{2−}$$ به ترتیب برابر با 9/25 و 12/32 است در نتیجه، $$NH_4^+$$ اسید قویتری به شمار میآید. همچنین، به همین شکل، مقادیر $$pK_b$$ برای $$PO_4^{3−}$$ و $$NH_3$$ به ترتیب برابر با 1/68 و 4/75 خواهد بود که یعنی، $$PO_4^{3−}$$ باز قویتری است. بنابراین، برای تولید اسید و باز ضعیفتر، تعادل به طرف راست خواهد بود.
در واکنش دوم، اسید و باز مزدوج به صورت $$CH_3CH_2CO_2H/CH_3CH_2CO_2^−$$ و $$HCN/CN^−$$ هستند. در این میان، $$HCN$$ اسید ضعیف و $$CN^-$$ یک باز تقریبا ضعیف است. ممکن است در شرایطی، مقادیر قدرت اسید را به صورت جدول در اختیار نداشته باشیم. در این موارد، بهترین راهکار این است که به دنبال ترکیباتی باشیم که خواص مشابهی داشته باشند. فرض میکنیم که مقادیر قدرت اسید و ثابت تفکیک اسید را برای پروپیونیک اسید $$(CH_3CH_2CO_2H)$$ نداشته باشیم، در اینصورت، میبینیم که پروپیونیک اسید و استیک اسید مشابه یکدیگر هستند و تنها در گروههای متصل به اتم کربن کربوکسیلیک اسید تفاوت دارند. بنابراین، انتظار داریم که این دو ترکیب، خواص اسید و باز مشابهی داشته باشند. در نهایت، پروپیونیک اسید باید کمی قویتر از $$HCN$$ باشد. با توجه به اینکه اسید قویتر، باز ضعیفتری را تشکیل میدهد، میتوان پیشبینی کرد که سیانید، باز قویتری از پروپیونات باشد. در نتیجه، تعادل به طرف راست خواهد بود تا اسید و باز ضعیفتری به تولید برسند.

جمعبندی
واکنشهای اسید و باز همواره دارای جفتهای اسید باز مزدوج هستند. هر اسید و باز دارای ثابت یونش یا ثابت تفکیک هستند که متناظر با قدرت بازی یا اسیدی آنها است. از مقدار ثابت تعادل برای یک واکنش تفکیک (یونش) میتوان جهت تعیین نسبی قدرت اسید و باز استفاده کرد. در یک محلول آبی از اسید ضعیف، ثابت تفکیک اسید را با $$K_a$$ نشان میدهند. به طور مشابه، ثابت تعادل برای واکنش باز ضعیف با آب را با نام ثابت یونش (تفکیک) باز میشناسند و آنرا با $$K_b$$ تعریف میکنند. برای هر جفت مزدوج از اسید و باز، عبارت زیر برقرار است:
$$K_aK_b = K_w$$
در دمای ۲۵ درجه سانتیگراد: $$K_aK_b = 14$$
لازم به ذکر است که مقادیر کم از $$pK_a$$ متناظر با ثابت تفکیک اسید بزرگتر و به دنبال آن، اسید قویتر است. همچنین به یاد داشته باشید که در واکنشهای اسید و باز، جهت پیشرفت واکنش، همواره به طرفی است که اسید و باز ضعیف به تولید برسند. در این آموزش آموختیم که در محلولهای آبی، هیچ اسیدی قویتر از $$H_3O^+ $$ و هیچ بازی قویتر از $$OH^-$$ نداریم که این امر موجب معرفی پدیدهای به نام اثر همتراز کنندگی شد. در نهایت، یادگرفتیم که در اسیدها و بازهای چند پروتونه، بیشترین قدرت اسید و باز متعلق به موادی است که پروتون جذب نکرده یا از دست ندادهاند. در جدول زیر، روابط و فرمولهای مهم در خصوص قدرت اسید و ثابت تفکیک اسید و باز ارائه شدهاند:
| تعریف | فرمول |
| ثابت تفکیک اسید | $$K _ a = K [ H _ 2 O ] = \dfrac{[ H _ 3 O ^ + ][A ^− ]}{[H A]}$$ |
| ثابت تفکیک باز | $$K _ b = K [ H _ 2 O] = \dfrac{[B H ^ + ][O H ^ − ]}{[ B]}$$ |
| رابطه بین ثابت تفکیک اسید و باز | $$K _ a K _ b = K _ w$$ |
| $$pK_a$$ | $$\begin{equation} \begin{array}{c} {p K a = - \log _{10} K _ {a}} \ {K _ { a } = 10 ^ { - p K _ { a}}} \end{array}\end{equation}$$ |
| $$pK_b$$ | $$\begin{equation} \begin{array}{c} {p K _ { b } = - \log _ {1 0 } K _ {b }} \ {K _ { b } = 10 ^ { - p K _ { b}}} \end{array} \end{equation}$$ |
| رابطه بین $$pK_a$$ و $$pK_b$$ | $$\begin{equation} \begin{array}{c} {p K _ { a } + p K _ { b} = p K _ { w }} \ {p K _ { a} + p K _ { b} = 14.00 \text { @ } 25^{\circ} \mathrm{C}} \end{array}\end{equation}$$ |
در نهایت، با مراجعه به تصویر زیر میتوانید اطلاعات کاملی در خصوص قدرت اسیدهای معروف بدست آورید:
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- تیتراسیون اسید باز — از صفر تا صد
- انرژی فعالسازی (اکتیواسیون) — از صفر تا صد
^^












ممنون از زحماتتون
میشه مطلبی در مورد تغییرات ثابت یونش هم بفرمایید؟ ممنون میشم.
با سلام؛
در داخل متن توضیحاتی کامل در رابطه با تفکیک و یونش آورده شده است.
با تشکر از همراهی شما با مجله فرادرس
ممنون از زحمات شما
با سلام؛
خوشحالیم از اینکه مطالعه این مطلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
سلام وقتتون بخیر، اگر نمودار ها رو هم برای مباحث اسیدباز قرار بدید یا بفرمایید چطو میتونم پیدا کنم ممنون میشم.
سلام.
چه زمانی میتونیم بگیم که یک اسید به طور کامل با یک باز واکنش میده؟
این موضوع چه ارتباطی با مقدار pka آب و اسید داره؟
با سلام؛
این موضوع به طور کامل در مطلب «واکنش خنثی شدن در شیمی — به زبان ساده» بررسی شده است. علاوه بر این، برای مطالعه بیشتر میتوانید مطلب «تیتراسیون اسید باز — از صفر تا صد» را نیز مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام اقاي مهندس. من المان درس مي خونم و يك بخشي از اين مبحث اينجا است كه من به كل متوجه نمي شوم. در واكنش هاي اسيد يا باز ما مقاديري مثل +H يا -OH يا اسيد يا باز را اضافه يا كم مي كنيم و سپس جهت واكنش را بايد پيدا كنيم. مثلا:
2H2O2 + -OH –––> O2 +2 H2O
حالا اگر مثلا H3O+ اضافه كنيم واكنش به كدام سمت مي رودو چرا؟
خيلي ممنون
با سلام؛
برای درک بهتر این مطلب باید با تعادل شیمیایی و اصل لوشاتلیه آشنا باشید. به بیان خیلی ساده، زمانی که تغییری در یک سیستمِ در حال تعادل بوجود بیاید، سیستم برای خنثی کردن اثر این تغییر، تغییرات جدیدی در خود ایجاد میکند و این تغییرات برای خنثی کردن تغییرات قبل ایجاد میشود. پیشنهاد میکنیم در ابتدا اصل لوشاتلیه را مطالعه کنید و سپس سایر مطالب زیر را مورد توجه قرار دهید.
اصل لوشاتلیه — به زبان ساده
محلول بافر — از صفر تا صد
تعادل شیمیایی — از صفر تا صد
با تشکر از همراهی شما با مجله فرادرس
آقای مهندس گرانقدر، در کنکور تجربی 99 سوالی امده بود از قدرت اسیدی یک اسید مثل HA که در پاسخنامه تشریحی آن رابطه زیر به چشم میخورد:
Ka=x^2/(Cm-x
که در آن x همان غلظت (H+) یا همان (A-) است
این رابطه از کجا آمده؟! چراباید به جای (HA) در مخرج از (Cm – x) استفاده کنیم؟ یعنی اون x اضافی از کجا امده است؟
با سلام؛
رابطه فوق در حقیقت نتیجه تشکیل جداول ICE برای تفکیک یک اسید ضعیف است. برای اینکه به طور دقیق، نحوه محاسبه این رابطه را ببینید، مثال ۱ از مطلب «محلول بافر — از صفر تا صد» را مطالعه کنید.
با تشکر