گاز اکسیژن چیست؟ – به زبان ساده + کاربرد و مثال
گاز اکسیژن با نماد شیمیایی گازی بیرنگ، بدون بو و بدون مزه است که در طبیعت به شکل مولکول دواتمی وجود دارد. گاز اکسیژن حدود ۲۱ درصد از اتمسفر را تشکیل میدهد و پس از گاز نیتروژن فراوانترین گاز اتمسفر است. گاز اکسیژن یکی از اساسیترین عوامل برای انجام بسیاری از واکنشهای شیمیایی است. این گاز که یکی از مهمترین مولکولهای طبیعت زنده است، هنگامی که با اتمهای هیدروژن ترکیب میشود، مولکولهای آب را تشکیل میدهد که اساسیترین عامل حیات موجودات زنده است. مولکول آب از دو اتم هیدوژن و مولکول اکسیژن تشکیل شده است. حدود ۸۸ درصد وزنی آب موجود در طبیعت را مولکول اکسیژن تشکیل داده است. ارگانیسمهای زنده نیز درصد زیادی اکسیژن درون خود دارند. برای مثال، ۶۵ درصد بدن انسان از اکسیژن تشکیل شده است. این مسئله اهمیت وجود این عنصر را برای فرایندهای بیوشیمیو تولید انرژی نشان میدهد. در این مطلب از مجله فرادرس یاد میگیریم که گاز اکسیژن چیست و با خواص، کاربردها و واکنشهای این عنصر مهم و فراوان آشنا میشویم.
- با ویژگیهای فیزیکی و شیمیایی گاز اکسیژن آشنا میشوید.
- نقش اکسیژن در حیات، اتمسفر و چرخه زیستی را درک میکنید.
- کاربردهای صنعتی و پزشکی اکسیژن را یاد میگیرید.
- با خطرات ناشی از کمبود یا غلظت زیاد اکسیژن آشنا میشوید.
- نحوه تولید و ذخیرهسازی گاز اکسیژن را میآموزید.
- با شکلهای مختلف اکسیژن مانند اوزون و کاربردهای خاص آن آشنا میشوید.


آشنایی با عنصر و مولکول اکسیژن به دلیل کاربردهای بسیار آن در محیط زیست و زندگی انسان بسیار اهمیت دارد. در این مطلب درباره این عنصر و ویژگیهای فیزیکی و شیمیایی آن توضیح میدهیم. همچنین تاثیر اکسیژن را در اتمسفر و زندگی گیاهان و جانوران درمییابیم و بررسی میکنیم گرمایش زمین و دیگر مشکلات محیط زیستی چگونه بر غلظت این گاز تاثیر میگذارد. سپس با فایده گاز اکسیژن در صنایع مختلف مانند صنایع فلزی، پزشکی، صنایع شیشه و صنایع غذایی آشنا میشویم. در ادامه خطرات کم یا زیاد بودن غلظت اکسیژن در محیطهای مختلف را بررسی میکنیم و درباره تاریخچه کشف گاز و اتم اکسیژن میخوانیم. با مطالعه این مطلب تا انتها با این عنصر حیاتی و کاربردهای آن آشنا شوید.
تعریف گاز اکسیژن چیست؟
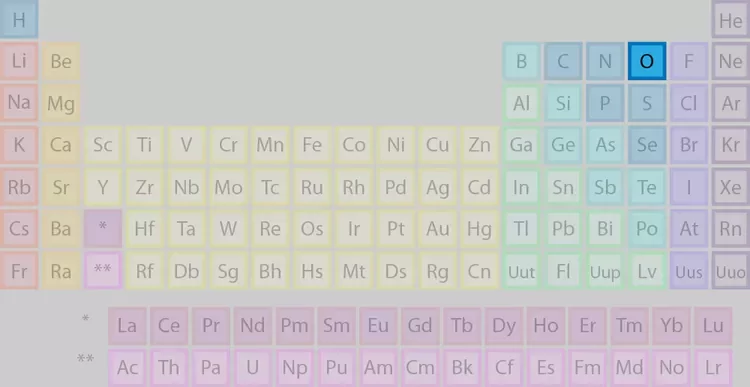
اکسیژن نام یکی از عناصر جدول تناوبی با عدد اتمی ۸ است. این عنصر در گروه ۱۸ جدول تناوبی که گروه اکسیژن ( کالکوژنها) است قرار دارد. این عنصر یک نافلز بسیار فعال است که به سرعت با بسیاری از مواد واکنشداده و آنها را اکسید میکند. گاز اکسیژن که ۲۱ درصد اتمسفر را به خود اختصاص داده است، به فرمهای متفاوتی در طبیعت وجود دارد. این گاز به صورت حل شده در آب اقیانوسها، رودخانهها و دریاچهها وجود دارد. همچنین در پوسته زمین، خاک، سنگها و گیاهان نیز وجود دارد. وجود گاز اکسیژن در محیطهای مختلف نقشی مهم در بسیاری از پدیدههای شیمیایی و زیستی را ایفا میکند.

بسیاری از فلزات استخراج شده از معادن پوسته زمین، به فرم اکسید شده یافت میشوند. اکسیژن نقش اصلی را در اکسید شدن فلزات ایفا میکند. در صنعت نیز از گاز اکسیژن بسیار استفاده میشود. فرایندهای تولید اکسیژن بنا به استفادههای گوناگون از این گاز بسیار گسترده هستند. این گاز در صنایعی مانند متالورژی، شیمی، خدمات درمانی و آب و فاضلاب استفاده میشود.
یادگیری بخش شیمیعلوم پایه نهم با فرادرس
در این مطلب با گاز اکسیژن که یکی از مهمترین ترکیبات کووالانسی موجود در طبیعت است آشنا میشویم. برای شناخت ترکیبات کووالانسی ابتدا باید با مفهوم اتم و عنصر و چگونگی تشکیل مواد آشنا شویم. سپس جدول تناوبی و جایگیری هرکدام از عناصر را در آن فراگیریم. همچنین در ادامه این مطلب میآموزیم که اکسیژن نقشی حیاتی در زندگی انسان و محیط زیست ایفا میکند. برای آشنایی بیشتر با این مفاهیم پیشنهاد میکنیم از مجموعه فیلمهای آموزشی پایه نهم، خصوصا آموزش علوم تجربی در بخش شیمی بهره ببرید که با زبانی ساده ولی کاربردی این مطالب را توضیح میدهد. در فهرست زیر به چند مورد از این آموزشها اشاره کردهایم.
فرادرس فیلمهای آموزشی متنوعی را منتشر کرده است که در فهرست زیر به چند مورد آنها اشاره کردهایم:
- فیلم آموزش علوم تجربی پایه نهم بخش شیمی
- فیلم آموزش مهندسی محیط زیست
- مجموعه فیلم آموزش محیط زیست
- فیلم آموزش سوخت و احتراق Fuels and Combustion سطح مقدماتی
ویژگی های گاز اکسیژن
گاز اکسیژن مانند دیگر مولکولها از ویژگیهای فیزیکی و شیمیایی منحصر به فردی تشکیل شده است که در زیر به توضیح آنها میپردازیم.
ویژگیهای فیزیکی اکسیژن
مولکول اکسیژن در دمای اتاق به صورت گاز اکسیژن یافت میشود. اتم اکسیژن نقطه ذوبی برابر ۲۱۸٫۷۹- درجه سانتیگراد و نقطه جوشی برابر ۱۸۲٫۹۶- درجه سانتیگراد دارد. این گاز بدون بو و رنگ و مزه است و همواره در دمای اتاق به صورت گاز دو اتمیاکسیژن یافت میشود. در دماهای بسیار پایین اکسیژن میتواند به فرم مایع نیز وجود داشته باشد.

ویژگیهای شیمیایی اکسیژن
اتمهای اکسیژن با پیوندهای کووالانسی به یکدیگر متصل میشوند و مولکول دواتمیاکسیژن را تولید میکنند. اتم اکسیژن در گروه ۱۶ جدول تناوبی و ردیف دوم قرار دارد. عدد اتمیآن ۱۵٫۹۹۹ و آرایش الکترونی آن به صورت است. اکسیژن به سه فرم ایزوتوپ ، و وجود دارد.
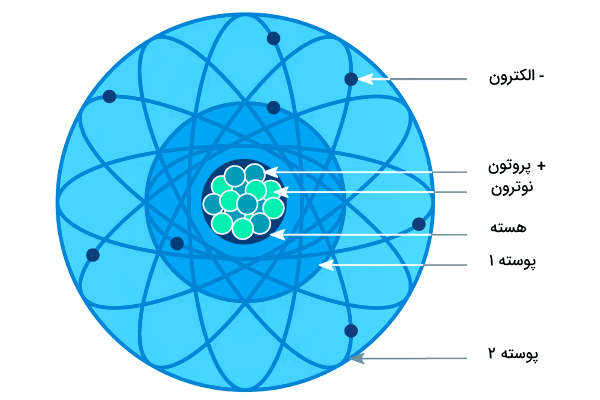
اکسیژن در جدول تناوبی
اتم اکسیژن در گروه ۱۶ جدول تناوبی (گروه اکسیژن) قرار دارد. این اتم هشتمین اتم جدول تناوبی است و در ردیف دوم جدول جای گرفته است. علامت شیمیایی این اتم با حرف انگلیسی O نشان دادهمیشود و عدد اتمی آن ۱۶ است.
اهمیت گاز اکسیژن در زندگی
گاز اکسیژن اساس زندگی بسیاری از جانوران و گیاهان را تشکیل داده است همچنین بسیاری از پدیدههای شیمیایی تنها در حضور گاز اکسیژن صورت میگیرند. همانطور که اشاره شد بیشتر درصد اتمسفر زمین را اکسیژن تشکیل داده است و اساس بسیاری از پدیدههای بیولوژی مانند تنفس سلولی اکسیژن است. در ادامه به توضیح این نقشهای اکسیژن میپردازیم.
نقش گاز اکسیژن در اتمسفر
همانطور که اشاره شد، گاز اکسیژن یکی از کلیدیترین ترکیبات موجود در هوا برای ادامه زندگی گیاهان و جانوران است. حال میخواهیم بدانیم در هوایی که اطراف زمین را گرفته است، نقش گاز اکسیژن چیست. گاز اکسیژن یکی از مولکولهای کلیدی برای دستیابی به اطلاعات اجزای تشکیل دهنده هوایی است که استشمام میکنیم. اکسیژن به صورت سنگین و سبک در فرم ایزوتوپهای مختلف وجود دارد. مانند همه اتمها، اکسیژن از هسته و الکترون تشکیل شده است. همه اتمهای اکسیژن از ۸ الکترون تشکیل شدهاند اما هسته آنها میتواند ۸، ۹ یا ۱۰ نوترون داشته باشد. اکسیژن سبک ۱۶ با ۸ پروتون و ۸ نوترون بیشترین فراوانی را بین ایزوتوپهای اکسیژن دارد. حدود ۲۱ درصد گازهای اتمسفر را گاز اکسیژن تشکیل داده است. برای بسیاری از موجودات بین ۱۷ تا ۲۵ درصد اکسیژن برای بقا نیاز است. گیاهان در طبیعت با استفاده از فرایند فوتوسنتز با مصرف انرژی خورشید و به همراه مصرف آب و کربن دی اکسید، همواره در حال دوباره تامین کردن اکسیژن هستند.
واکنش فرایند فوتوسنتز در ادامه آورده شده است.

برای مطالعه بیشتر درباره جو زمین و لایههای آن میتوانید با مطالعه مطلب جو زمین چیست؟ — به زبان ساده در مجله فرادرس با این مطلب بیشتر آشنا شوید.
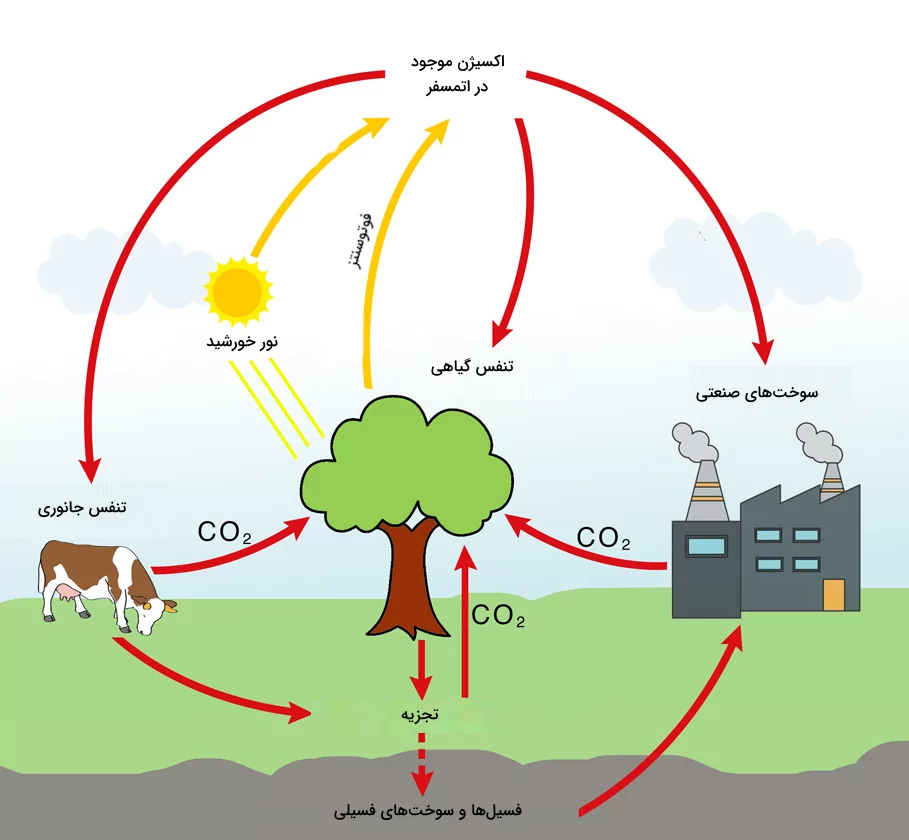
چرخه گاز اکسیژن چیست
چرخه اکسیژن به جریان اکسیژن به شکلهای متفاوت در طبیعت گفته میشود. این شکلها میتواند فرم اکسیژن حل شده در آب و آزاد در هوا به شکل گازی باشد. همانطور که اشاره شد اکسیژن پس از نیتروژن دومین گاز فراوان اتمسفر است. گیاهان و جانوران اکسیژن را برای تنفس مصرف میکند و آن را به شکل کربن دی اکسید به هوا و آب بازمیگردانند. کربن دی اکسید سپس توسط جلبکها و برخی از گیاهان سبز موجود در خشکی مصرف شده و طی فرایند فوتوسنتز به کربوهیدرات تبدیل شده و اکسیژن به عنوان محصول جانبی تولید میشود. فرمول واکنش شیمیایی این فرایند در ادامه آورده شده است.
منابع آب روی زمین بزرگترین منابع تولید کننده اکسیژن بیوسفر هستند. تخمینهای انجام شده نشان میدهد جلبکهای موجود در این آبها حدود ۹۰ درصد اکسیژن مصرفی زمین را تامین میکنند. اکسیژن همچنین در برخی دیگر از فعالیتهای چرخهای زیست گیاه شناسی شیمیایی نیز شرکت میکند.
با وجود استفاده فراوان از سوختهای فسیلی و کاهش پوششهای گیاهی روی زمین و داخل آبهای طبیعی، میزان اکسیژن اتمسفر کاهش نیافته و تقریبا ثابت مانده است. این پدیده به دلیل افزایش تولید گیاهان در فرایندهای کشاورزی است.
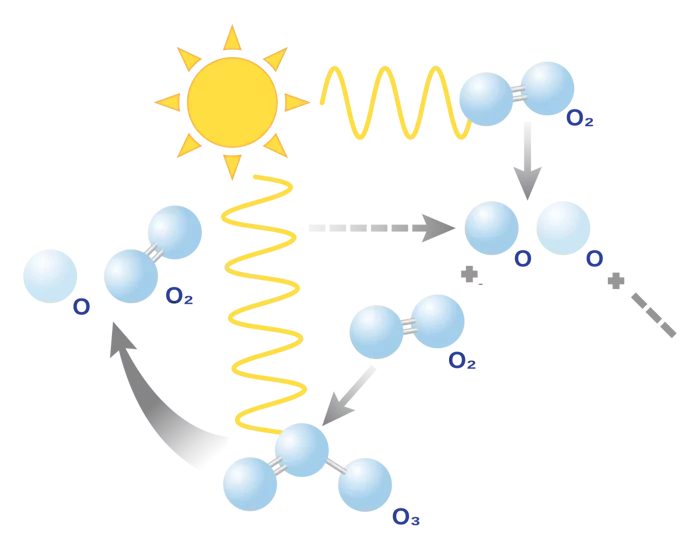
اوزون: فرم دیگر گاز اکسیژن
گاز اکسیژن به فرممولکول دو یا سه اتمیدر اتمسفر یافت میشود. اوزون فرم دیگر اکسیژن خالص است که از سه اتم اکسیژن تشکیل شده است. این مولکول در تروپوسفر جو زمین وجود دارد. اشعه فرابنفش مولکولهای گاز اکسیژن را به دو تک اتم اکسیژن تقسیم میکنند. تک اتمهای اکسیژن به مولکولهای دواتمیاکسیژن متصل شده و مولکولهای اوزون را تشکیل میدهند.
در معادله زیر واکنش تشکیل مولکولهای اوزون آورده شده است.
یک لایه از مولکولهای اوزون در اتمسفر وجود دارد که به آن لایه اوزون گفته میشود. لایه اوزون زمین را از ورود اشعههای فرابنفش که برای انسانها و برخی موجودات مضر هستند، محافظت میکند.
نقش گاز اکسیژن در سطح زمین
علاوه بر هوای اطراف زمین، گاز اکسیژن در سطح زمین نیز فراوانی بالایی دارد. درصد بالایی از پوسته زمین از ترکیبات معدنی سیلیکون-اکسیژن تشکیل شده است و باقی مواد نیز در بیشتر موارد به فرم اکسیدهایشان هستند. اکسیژن به راحتی در آب قابل حل است به همین دلیل به فرایندهای زیستی درون رودها و اقیانوسها جریان میبخشد.
تاثیر مشکلات زیست محیطی بر گاز اکسیژن چیست؟
همانطور که اشاره شد اکسیژن نقشی حیاتی در زندگی جانوری روی زمین و در آبهای طبیعی دارد. میزان اکسیژن موجود در اتمسفر و آب بسته به عوامل محیطی میتواند تغییر کند. برای مثال افزایش استفاده از سوختهای فسیلی که اکسیژن را مصرف میکند و کربن دی اکسید آزاد میکند میتواند درصد اکسیژن را کاهش دهد. برای مثال در زیر معادله سوختن متان آورده شده است. فراوردههای این واکنش آب و کربن دی اکسید هستند. با اینکه اکسیژن به شکل ترکیب در این دو فراورده وجود دارد اما از فرم اکسیژن آزاد موجود در هوا خارج میشود و از درصد غلظت اکسیژن آزاد محیط کاسته میشود.
همچنین کاهش پوشش گیاهی نیز یکی دیگر از عواملی است که میتواند درصد اکسیژن موجود در اتمسفر را کاهش دهد. هرچند این عوامل هنوز به اندازهای نیست که بر فرایندهای بیولوژیکی وابسته به اکسیژن تاثیر بگذارد. کاهش اکسیژن اتمسفر تا حدود زیادی با تولید دوباره اکسیژن توسط گیاهان جبران میشود.

در آبهای طبیعی، کاهش درصد اکسیژن حل شده در آب، که بر اثر دخالتهای انسان شکل میگیرد، میتواند خطر حیاتی برای زندگی جانوری موجودات آبزی داشته باشد و جمعیت این جانوران را کاهش دهد. بیشتر اکسیژن موجود در محیطهای آبی زمین از اتمسفر به آنها وارد میشود یا در سطح آب تولید شده و به درون آنها منتتقل میشود. به همین دلیل چرخش آب مناسب برای انتقال اکسیژن به سطحهای پایینتر آب برای ادامه حیاط موجودات لازم است. اگر به دلیل تغییرات زیست محیطی این چرخه به درستی شکل نگیرد، ادامه حیات این جانوران به خطر میافتد. همچنین، دما نیز بر انحلال اکسیژن در آب تاثیرگذار است. هرچه دمای آب پایینتر باشد، اکسیژن بیشتری در آن حل میشود. به همین دلیل افزایش دمای زمین و به دنبال آن افزایش دمای آبهای طبیعی یکی دیگر از عواملی است که باعث کاهش اکسیژن موجود در این آبها شده و جمعیت موجودات آبزی را کاهش میدهد.

یکی دیگر از عواملی که میتواند باعث کاهش غلظت اکسیژن موجود در آب شود، وجود ترکیباتی مانند نیتروژن و فسفر است. این ترکیبات در اثر فعالیتهای کشاورزی و صنعتی انسانها میتواند به آبهای طبیعی وارد شود و بر غلظت گاز اکسیژن موجود در آنها تاثیر بگذارد.
نقش گاز اکسیژن در فرایندهای زیستی
مسئولیت گاز اکسیژن در بدن انسان تنها به استشمام محدود نمیشود. اکسیژن برای شکستن مولکولهای غذای مصرف شده توسط موجودات استفاده میشود به همین دلیل در متابولیسم آنها نقشی بسیار مهم دارد. وقتی یک موجود زنده نفس میکشد، اکسیژن را مصرف میکند و کربن دی اکسید تولید میکند. از آنجایی که گاز اکسیژن مولکولی بسیار مهم برای تنفس انسانها و حیوانات است، آنرا به عنصری بسیار مهم در طبیعت تبدیل میکند. همچنین گاز اکسیژن مولکول اصلی برای انجام گرفتن واکنشهای سوختن است. حشرات نیز اکسیژن را برای رشد کردن، تولید مثل، و ذخیرهی انرژی غذا استفاده میکنند. سلول تمام موجودات زنده، فرایند تنفس سلولی را انجام میدهند. این فرایند توسط گاز اکسیژن انجام میشود. واکنش شیمیایی این فرایند در ادامه آورده شده است. به طور میانگین انسانها، در طول روز ۶۰۰ لیتر اکسیژن را برای زنده ماندن تنفس میکنند.
درون سلولها، قند موجود در غذا (گلوگز) به کربن دی اکسید و آب شکسته میشود. این فرایند همانطور که گفته شد توسط گاز اکسیژن انجام میگیرد. هنگامی که گلوکز به وسیله گاز اکسیژن شکسته میشود، به آن تنفس هوازی میگویند.
واکنش های گاز اکسیژن چیست؟
عدد اکسایش اکسیژن در بیشتر موارد است که به صورت است. اما میتواند یونهای دیگری مانند پراکسید و سوپراکسید نیز تشکیل دهد. با وجود حالتهای اکسیداسیون مختلف مواد و اکسیژن، ترکیبات مولکولی متعددی میتوانند هنگام واکنش با اکسیژن، شکل بگیرند. بسیاری از واکنشهای مربوط به اکسیژن در فرآیندهای بیولوژیکی، از جمله تنفس سلولی و فتوسنتز، رخ میدهند.
اکسیدها ترکیبات شیمیایی هستند که حداقل شامل یک اتم اکسیژن و حداقل یک اتم از عنصر دیگر باشند. چهار عدد اکسایش اصلی برای اکسیژن وجود دارد که عبارتند از -۲، -۱، -۱/۲ و ۰.
- یون اکسید، ، دارای عدد اکسایش -۲ است.
- یون پراکسید، ، دارای عدد اکسایش -۱ است.
- یون سوپراکسید، ، دارای عدد اکسایش -۱/۲ است. در واکنش با فلزات، اکسیژن اکسیدهایی را تشکیل میدهد که به طور عمده به صورت یونی هستند.
روندهای عمومیدر واکنشهای بین عناصر گروه اصلی و اکسیژن به شرح زیر است.
- بیشتر نافلزات (به استثنای هالوژنها) اکسیدهایی با بالاترین حالت اکسیداسیون ممکن را تشکیل میدهند.
- بیشتر فلزات اکسیدهایی با عدد اکسایش -۲ تشکیل میدهند.
- به طور کلی، اکسیدهای فلزی بازی و اکسیدهای نافلزات اسیدی هستند. میزان بازی بودن یک اکسید با افزایش خصوصیات یونی (فلزی) افزایش مییابد. اکسیدهای فلزی، پراکسیدها و سوپراکسیدها در آب حل شده و با آب واکنش میدهند تا محلولهای بازی تشکیل دهند.
- اکسیژن همچنین اکسیدهای کووالانسی با نافلزات تشکیل میدهد که با آب واکنش داده و محلولهای اسیدی تشکیل میدهند.
- اکسیژن با بیشتر گازهای نجیب واکنش نمیدهد.

واکنش گاز اکسیژن با هیدروژن
اکسیژن با هیدروژن واکنش داده و دو ترکیب تولید میکند. آب و هیدروژن پراکسید این دو ترکیب هستند. آب یک ترکیب چندمنظوره است و در تعادل اسید-باز و واکنشهای اکسایش-کاهش شرکت میکند. آب میتواند بهعنوان اسید، باز، عامل کاهنده یا عامل اکسیدکننده عمل کند. قابلیتهای چندگانه آب، آن را به یکی از مهمترین ترکیبات روی زمین تبدیل کرده است. واکنش بین هیدروژن و اکسیژن برای تشکیل آب به صورت زیر است.
قدرت اکسیدکنندگی قوی هیدروژن پراکسید، آن را برای کاربردهای صنعتی بسیار مهم میکند. معادله زیر واکنش هیدروژن و اکسیژن برای تشکیل هیدروژن پراکسید را نشان میدهد.
محصول این واکنش یک پراکسید نامیده میشود زیرا اکسیژن در حالت قرار دارد (عدد اکسایش هیدروژن +1 است).
واکنش گاز اکسیژن با گروه فلزات قلیایی
اکسیژن به سرعت با عناصر گروه ۱ (فلزات قلیایی) واکنش میدهد و اکسیدهای آنها در حالت محلول در آب، محلولهای بازی تولید میکنند. فراورده اصلی این واکنشها پایدارترین ترکیب نسبت به واکنشدهندهها است. به عنوان مثال، اکسید(که M نشاندهنده هر فلز قلیایی است) با کنترل میزان اکسیژن تشکیل میشود. فلزات گروه ۱ مانند لیتیوم، سدیم، پتاسیم، روبیدیوم و سزیم در واکنشهای احتراقی با اکسیژن میسوزند.
- لیتیوم : لیتیوم با اکسیژن واکنش داده و را تولید میکند و با شعله قرمز میسوزد. اگر اکسیژن اضافی وجود داشته باشد، مقدار کمیاز (پراکسید) نیز ممکن است تشکیل شود.
- سدیم : سدیم با شعله نارنجی در هوا میسوزد. با مقدار بیشتر سدیم یا در حضور اکسیژن خالص، شعلهای قویتر ایجاد میشود و ترکیبی از اکسید و پراکسید سدیم تولید میشود.
- پتاسیم : قطعات کوچک پتاسیم در هوا ذوب شده و مخلوطی از پراکسید و سوپراکسید پتاسیم تشکیل میدهند. قطعات بزرگتر با شعله بنفش میسوزند.
- سایر فلزات قلیایی : فلزات قلیایی دیگر (روبیدیم، سزیم، فرانسیم) سوپراکسید تشکیل میدهند که محصول اصلی احتراق است. این ترکیبات به دلیل تمایل بالای یون به جذب الکترون، اکسیدکنندههای قوی هستند.

واکنش گاز اکسیژن با گروه فلزات قلیایی خاکی
عناصر گروه ۲ شامل برلیم، منیزیم، کلسیم، استرانسیم، باریم و رادیم هستند. فلزات قلیایی خاکی با اکسیژن واکنش میدهند اما سرعت آنها به اندازه سرعت واکنش فلزات گروه ۱ نیست. این واکنشها نیاز به گرما دارند. مشابه اکسیدهای گروه ۱، اکثر اکسیدها و هیدروکسیدهای گروه ۲ در آب کممحلول هستند و محلولهای بازی تولید میکنند.
همه فلزات گروه ۲ به طور مشابه واکنش داده و با سوختن، اکسیدهایی (حاوی یون ) تشکیل میدهند.
پس از شروع، این واکنشها با اکسیژن شدید هستند. تنها پراکسیدهایی که از فلزات قلیایی خاکی تشکیل میشوند، پراکسید استرانسیم و باریم هستند که نیاز به گرما و اکسیژن اضافی دارند.
که در آن M نشاندهنده استرانسیم یا باریم است.
- برلیم : برلیم با هوا و آب واکنش نمیدهد. این رفتار شیمیایی برلیم به اندازه کوچک و انرژی یونش بالای اتمهای آن نسبت داده میشود.
- سایر فلزات گروه ۲ : به جز برلیم، سایر فلزات قلیایی خاکی در دمای اتاق در هوا اکسید تشکیل میدهند.
که در آن M نشاندهنده برلیم، منیزیم، کلسیم، استرانسیم، باریم یا رادیم است.
پراکسیدهایی به فرم برای تمامیاین عناصر به جز برلیم تشکیل میشوند.
اکسیدهای منیزیم، کلسیم، استرانسیم و باریم با آب واکنش داده و هیدروکسیدها تشکیل میدهند.
همه اکسیدها و هیدروکسیدهای فلزات گروه ۲، به جز برلیم، خاصیت بازی دارند.
در تصویر زیر واکنش اکسید شدن نوار منیزیم را در مجاورت اکسیژن مشاهده میکنید.

واکنش گاز اکسیژن با گروه ۱۳ و ۱۴
عناصر گروه ۱۳ شامل بور، آلومینیوم، گالیوم، ایندیم و تالیم هستند. بور تنها عنصر غیرفلزی در این گروه است. این عناصر در واکنشهایشان با اکسیژن تفاوت دارند. اکسیدهای فلزی خاصیت بازی و اکسیدهای غیرفلزی خاصیت اسیدی دارند. این امر برای تمامیعناصر گروه ۱۳ به جز آلومینیوم و گالیوم صدق میکند.
همه عناصر گروه ۱۳ ترکیباتی از نوع تولید میکنند و از قوانین اسید و باز نیز در مورد اکسیدهای فلزی و غیرفلزی پیروی میکنند.
در دماهای بالا، تالیم با اکسیژن واکنش داده و تولید میکند.
بور
معمولترین فرم اکسید بور، است که از حرارت دادن اسید بوریک به دست میآید.
آلومینیوم
آلومینیوم در حالت اکسایش قرار دارد و با اکسیژن واکنش میدهد و پوششی از تشکیل میدهد که مانع خوردگی بیشتر آن میشود.

اکسید آلومینیوم () یک آمفوتر است و میتواند به عنوان اسید و باز عمل کند.
برای تالیم، حالت اکسایش پایدارتر از است، اما سایر عناصر گروه ۱۳ اکسیدهای سهظرفیتی تشکیل میدهند.
واکنش گاز اکسیژن با عناصر گروه ۱۴
گروه ۱۴ شامل فلزات، شبهفلزات و غیرفلزات است. اکسیدهای عناصر بالای این گروه کمیاسیدی هستند و اسیدیته با حرکت به سمت پایین گروه کاهش مییابد.
- غیرفلزات: کربن، به عنوان غیرفلز گروه ۱۴، با اکسیژن واکنش داده و و مقادیر کمتری تولید میکند که هر دو اسیدی هستند.
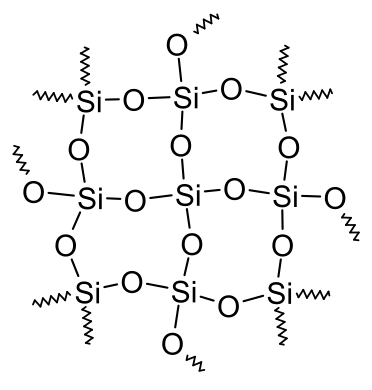
- شبهفلز: سیلیکون تنها یک ترکیب پایدار، ، تشکیل میدهد که کمیدر آب حل شده و اسیدی ضعیف است.
- فلزات: سه فلز این گروه (ژرمانیم، قلع و سرب) اکسیدهای مختلفی تولید میکنند که آمفوتریک هستند.
ژرمانیم: ،
قلع: ،
سرب: ، ،
تصویر زیر شکل مولکولهای سیلیکون دی اکسید را نشان میدهد.
واکنش گاز اکسیژن با گروه ۱۵
گروه ۱5 شامل نیتروژن، فسفر، آرسنیک، آنتیموان و بیسموت است. نیتروژن و فسفر غیرفلزی، آرسنیک و آنتیموان شبهفلز و بیسموت فلزی هستند.
نیتروژن
نیتروژن با اکسیژن واکنش داده و اکسیدهایی با حالات اکسایش تا تشکیل میدهد. تمامی این اکسیدها به جز در دمای اتاق به حالت گاز هستند.
، ، ، ،
این واکنشها گرماگیر بوده و برای واکنش مستقیم اکسیژن با به انرژی نیاز است. اکسیدهای نیتروژن به دلیل غیرفلزی بودن، اسیدی هستند. و با آب واکنش داده و محلولهای اسیدی از اکسیاسیدها تولید میکنند.
واکنش اسید نیترو به شرح زیر است.
واکنش تولید اسید نیتریک به شرح زیر است.
فسفر
فسفر در دو شکل آلوتروپ سفید و قرمز وجود دارد. فسفر قرمز کمتر از فسفر سفید واکنشپذیر است. فسفر با اکسیژن واکنش داده و بسته به میزان اکسیژن موجود، دو اکسید اصلی تشکیل میدهد. اکسید در شرایط کمبود اکسیژن و اکسید در شرایط اضافی بودن اکسیژن تشکیل میشوند.
در شرایط خاص، اکسیدهای ، و نیز به مقدار کم تشکیل میشوند. هر دو اکسید و با آب واکنش داده و اکسیاسید تولید میکنند.
واکنش تولید اسید فسفروس و اسید فسفریک به شرح زیر است.
تصویر زیر واکنش فسفر قرمز را با اکسیژن نشان میدهد. که به آن آزمایش خورشید قرمز یا خورشید اکسیژنی نیز گفته میشود.

سایر عناصر گروه ۱۵
آرسنیک، آنتیموان و بیسموت هنگام سوختن با اکسیژن واکنش میدهند. حالات اکسایش رایج برای این عناصر +۳و +۵ است. دو نوع اصلی اکسید برای هر عنصر وجود دارد که در ادامه آورده شده است.
- آرسنیک: ،
- آنتیموان: ،
- بیسموت: ،
برخی اکسیدها مانند مستقیماً از واکنش با اکسیژن تشکیل نمیشوند. اکسید آرسنیک(III) و آنتیموان(III) آمفوتریک هستند، در حالی که اکسید بیسموت(III) به دلیل خاصیت فلزی بیشتر، تنها به عنوان یک باز عمل میکند.
واکنش های گاز اکسیژن با عناصر گروه ۱۶
عناصر گروه ۱۶ جدول تناوبی شامل خود عنصر اکسیژن، سولفور، سلنیم، تلریوم و پولنیوم است. اکسیژن با عناصر گروه خود اکسیدهای متنوعی تولید میکند که بیشتر به فرم اکسیدهای دو و سه ظرفیتی هستند.
اکسیژن
اکسیژن به دلیل قدرت واکنشپذیری زیاد توانایی برقراری پیوند با مولکولهای خود و تشکیل مولکول اوزون را دارد. این واکنش به وسیله تابش نور فرابنفش انجام میشود. واکنش تولید اوزون به شکل زیر است.
سولفور
سولفور دی اکسید، و سولفور تری اکسید، ، اکسیدهای سولفور رایج در طبیعت هستند. واکنش اکسیداسیون سولفور به وسیله گرما انجام میشود.
واکنش سولفور با اکسیژن مانند مواردی که پیشتر اشاره شد اکسیاسید تولید میکند. سولفور دی اکسید تولید شده از واکنش بالا برای تولید سولفور تری اکسید و سپس تولید سولفوریک اسید طی واکنش آن با آب مورد استفاده قرار میگیرد.
تصویر زیر شعله سوختن سولفور را در اکسیژن نشان میدهد.

واکنش گاز اکسیژن با عناصر گروه ۱۷
عناصر گروه ۱۷ جدول تناوبی شامل فلوئور، کلر، برم و ید هستند. این عناصر کههالوژنها نامیده میشوند با اکسیژن واکنش داده و اغلب محصولات ناپایداری تولید میکنند. فرم این ترکیبات بیشتر به صورتهای و است که در آنها X نشاندهنده عنصر هالوژن است.
فلوئور
فلوئور در کنار اکسیژن مرتبه اکسایش را میپذیرد. این عنصر ترکیب اکسیژن فلوئورید را تشکیل میدهد که واکنش تشکیل آن به فرم زیر است.
سایر هالوژنها بجای تولید اکسید، اکسیاسید تولید میکنند. در جدول زیر برخی از این ترکیبات مشخص شده است.
| عدد اکسایش هالوژن | کلر | برم | ید |
| ---- | ---- | ||
واکنش گاز اکسیژن با عناصر گروه ۱۸
عناصر گروه ۱۸ جدول تناوبی که به آنها گازهای نجیب گفته میشود عموما واکنشناپذیر هستند. بجر زنون که با اکسیژن واکنش داده و ترکیبات و را تشکیل میدهد. این واکنشها در دمای بسیار پایین و فشار بسیار بالا انجام میشوند.
کاربردهای صنعتی گاز اکسیژن چیست؟
حال که با خواص و کاربردهای زیستی اکسیژن آشنا شدیم، میخواهیم بدانیم در صنعت کاربرد گاز اکسیژن چیست. گاز اکسیژن علاوه بر فرایندهای زیستی در بسیاری از صنایع به فرمهای مختلف استفاده میشود. این گاز به دلیل واکنشپذیری زیاد، بسیار اکسید کننده است و از این ویژگی آن در صنعتهای مختلف استفاده میشود. اکسیدکنندگی بالای اکسیژن اگر به درستی در صنایع استفاده شود میتواند در افزایش بازده فرایندها، کاهش هزینهها، بهبود عملکرد فرایندها، و کاهش فراوردههای کربنی موثر باشد. جایگزینی اکسیژن با هوا در بسیاری از واکنشهای شیمیایی نیز میتواند سرعت و بازده بسیاری از آنها را بهبود ببخشد. کاربردهای گاز اکسیژن در فرایندهای سوختن، اکسیداسیون، تخمیر، فرایندهای سیستمهای آب و فاضلاب، و آبزی پروری بسیار زیاد است. این گاز اگر با استیلن یا گازهای دیگر مانند آرگون و مولکول کربن دی اکسید ترکیب شود، کارایی زیادی در این صنایع پیدا میکند. گاز اکسیژن همچنین برای بریدن، جوشکاری، لایه برداری، سخت کاری فلزات، و شستن فلزات استفاده میشود.

در ادامه به توضیح هریک از این کاربردها میپردازیم.
استفاده از گاز اکسیژن در صنایع پزشکی
یکی از مهمترین کاربردهای گاز اکسیژن، کمک به تنفس بیماران است. در بیمارستانها، از گاز اکسیژن به عنوان منبعی برای کمک به تنفس برای قبل و بعد از عملهای جراحی استفاده می شود.
اکسیژن استفاده شده در موارد پزشکی باید خلوصی حدود ۹۹٫۵ درصد داشته باشد. بر اساس اعلام سازمان بهداشت جهانی این اکسیژن باید با جریانی کم، مداوم، پاکیزه و متمرکز استفاده شود. اکسیژن مورد نیاز مصارف پزشکی معمولا در کپسول اکسیژن جابهجا میشود. جریان اکسیژن برای کمک به تنفس در مواردی که بیمار دچار مشکلات ریوی، حملات عصبی، آسم و... شده باشد استفاده میشود. همچنین تحقیقات علمیدرباره اکسیژن میتواند کمک شایانی به بهبود درمانهای شامل اکسیژن برای بیماریهای مختلف شود.
در مطلب زیر از مجله فرادرس روش انجام حمل اکسیژن در خون به طور ساده به همراه مثال توضیح داده شده است.

استفاده از گاز اکسیژن در صنایع متالورژی (صنایع فلزی)
علاوه بر کاربردهای اشاره شده، اکسیژن در صنایع فلزی نیز کاربرد دارد. در فرایند تولید استیل و دیگر فلزات، اکسیژن نقش بسزایی در تامین دمای بالای مورد نیاز این فرایندها دارد. از این گاز همچنین در فرایندهای خالصسازی، گرم کردن، جوشکاری، ریختهگری، ذوب کردن، فرایندهای پساسوختن «Post combustion»، دیکربنه کردن «Decarburization» و لیچینگ «Leaching» (فروشویی) فلزات استفاده میشود.

استفاده از گاز اکسیژن در آبزی پروری
گاز اکسیژن نه تنها برای تنفس انسانها و حیوانات، بلکه برای تنفس آبزیان نیز مادهای حیاتی به شمار میآید. در صنایع آبزی پروری از گاز اکسیژن برای افزایش غلظت اکسیژن حل شده در آب استفاده میشود. تحقیقات نشان داده است که افزودن مقادیری از اکسیژن با خلوص بالا به جای هوا به محل زندگی آبزیان پرورشی باعث افزایش تولیدمثل و کاهش مرگ و میر آنها میشود.

استفاده از گاز اکسیژن در صنایع شیمیایی
در بسیاری از فرایندهای شیمیایی، وجود گاز اکسیژن یکی از نیازهای کلیدی رسیدن به فراوردهها است. آلومینیوم در سنگ بوکسیت (هیدروکسید آلومینیوم) یا آهن در سنگهای هماتیت (اکسید آهن) کربناتهای موجود در سنگهای مختلف مانند سنگ آهک، همگی این ترکیبات طبیعی از اکسیژن تشکیل شدهاند. واکنشهای اکسیداسیون در شیمی پرتکرارترین واکنشهایی هستند که در حضور گاز اکسیژن انجام میشوند. هم چنین از گاز اکسیژن برای تولید بسیاری از مواد مهم مانند اتیلن یا پروپیلن اکسید استفاده میشود.
واکنش تولید اتیلن اکسید به وسیله اکسیژن در زیر آورده شده است.
واکنش تولید پروپیلن اکسید به وسیله اکسیژن در زیر آورده شده است.
در تحقیقات علمی، اکسیژن یکی از مهمترین عناصر مورد مطالعه محققان است. محققان با استفاده از اکسیژن به مطالعه و تحقیق درباره سادهترین واکنشهای شیمیایی تا پیچیدهترین فرایندهای بیولوژیکی میپردازند. برای مثال مطالعه درباره اینکه تاثیر دیگر عناصر بر گاز اکسیژن چیست به نتایجی درباره روش بهبود سلولهای سوختی یا دستیابی به روشهای سوخت تمیزتر میانجامد.
استفاده از گاز اکسیژن در صنایع آب و فاضلاب
علاوه بر صنایع اشاره شده، گاز اکسیژن در فرایندهای تصفیه اب نیز کاربردهای فراوانی دارد. در صنایع اب و فاضلاب از اکسیژن برای تسریع روند شکستن میکروارگانیسمها به مواد آلی استفاده میشود. برای آشنایی بیشتر با اصول و روند سیستمهای تصفیه آب پیشنهاد میکنیم مطلب زیر از مجله فرادرس را مطالعه کنید.
استفاده از اکسیژن در صنایع هوافضا
همانطور که میدانید یکی از اصلیترین مشکلات فضانوردان، تامین هوایی برای تنفس در خارج از جو زمین است. گاز اکسیژن یکی از مهمترین منابعی است که فضانوردان برای سفرهای فضایی باید برای تامین هوای مورد نیاز تنفس خود به همراه داشته باشند.
استفاده از گاز اکسیژن در صنایع غذایی
گاز اکسیژن همچنین به عنوان افزودنی برای تازه نگهداشتن برخی از مواد غذایی استفاده میشود. در صنایع غذایی، اکسیژن برای دستیابی یه رنگ طبیعی و تازه مواد برای مثال گوشت تازه استفاده میشود.
استفاده از گاز اکسیژن در صنایع تولید شیشه
در صنایع شیشه از گاز اکسیژن برای افزایش دما استفاده میشود. این افزایش دما برای ذوب و نرم کردن فراوردههای شیشه، بریدن، پولیش شیشه و حالت دادن به این فراوردهها استفاده میشود. همچنین از اکسیژن میتوان به جای هوا برای ایجاد حباب در فراوردههای شیشه استفاده کرد و از آن جا که اکسیژن از هوا در شیشه انحالالپذیرتر است، میتواند نتایج بهتری بدست آورد.

دیگر کاربردهای گاز اکسیژن در صنایع مختلف
تا اینجا با برخی از کاربردهای گاز اکسیژن در صنایع مختلف آشنا شدیم. حال میخواهیم بدانیم دیگر کاربردهای گاز اکسیژن چیست. این کاربردها شاملفرایندهای مختلفی است که این فرایندها شامل بهبود و تولید استیل و دیگر فلزات، برش لیزری، تولید و بهبود داروها، تولید و بهبود فراوردههای نفتی، شیشه، سرامیک، و کاغذ است. در ادامه این کابردها با مثال بیشتر توضیح داده شدهاند.
استفاده از گاز اکسیژن در فرایند لیزر کات (برش لیزری)
از اکسیژن برای بریدن استیلهای کربنی استفاده میشود. در این فرایند مواد مورد نظر تا دمای احتراق توسط تابش لیزری گرم شده و در مخزن اکسیژن میسوزند.

ذوب کردن، خالص سازی و تولید استیل و دیگر فلزها
دمیدن اکسیژن در برخی فرایندهای تولید استیل باعث کاهش میزان کربن آنها شده و استیل خالصتری به دست میاید.
تولید مواد شیمیایی به وسیله واکنش اکسیداسیون
اکسیداسیون فرایندی است که طی آن یک ماده با اکسیژن واکنش داده و اکسید میشود. یکی از مهمترین واکنشهای اکسیداسیون تولید زنگ آهن است.

راندن موشکها
از گاز اکسیژن به عنوان سوخت موشکها نیز استفاده میشود. هنگام شروع پرواز موشکها، اکسیژن مایع و هیدروژن به درون موتور موشک رانده میشوند و با یکدیگر مخلوط میشوند. از سوختن این دوگاز با یکدیگر انرژی مورد نیاز راندن موشک تامین میشود.
خطرات گاز اکسیژن
همانطور که اشاره شد یکی از ویژگیهای گاز اکسیژن واکنشپذیری بسیار بالای آن است. گاز اکسیژن مولکولی بسیار فعال است به همین دلیل کار کردن با آن خطراتی به همراه دارد و نیازمند دقت بالایی است. در ادامه بررسی میکنیم خطرات کار کرن با گاز اکسیژن چیست.
خطر اشتعال و انفجار گاز اکسیژن
گاز اکسیژن در مجاورت مواد مشتعل شونده (آتشگیر) به سرعت باعث به وجود آمدن آتش یا شروع فرایند سوختن میشود. فرایند سوختن فرایندی است که در آن یک ماده با اکسیژن واکنشدهد و مقادیر زیادی از انرژی را به صورت نور، گرما و در مواردی آتش آزاد کند. به همین دلیل باید از نگهداری مواد مشتعل شونده در محیطهایی که غلظت گاز اکسیژن زیاد است، خودداری شود. فرایندهای سوختن در محیطهایی که غلظت اکسیژن زیاد است میتواند با سرعت و شدت بسیار بیشتری نسبت به شرایط عادی اتفاق بیافتد. هرچند گاز اکسیژن باعث اشتعال مواد مشتعل شونده میشود اما خود به تنهایی و در شرایط عادی آتش نمیگیرد.

کمبود گاز اکسیژن در محیط چیست؟
در قسمت قبل درباره خطرات زیاد بودن غلظت گاز اکسیژن در محیط صحبت کردیم. حال میخواهیم بدانیم کمبود گاز اکسیژن در محیط چیست و چه خطراتی دارد. کمبود اکسیژن محیط میتواند برای سلامت انسانها و دیگر موجودات زنده بسیار آسیب زننده باشد. به همین علت، ضروری است که همواره مقدار غلظت اکسیژن محیط اندازهگیری شود. کمبود اکسیژن در محیطهای صنعتی، میتواند باعث کاهش تمرکز کارکنان، سرگیجه و سردرد آنها شود.

مسمومیت ناشی از گاز اکسیژن چیست
تنفس مقدار بیش از اندازه گاز اکسیژن باعث آسیب به ششها و سیستم اعصاب مرکزی میشود. به این اتفاق مسمومیت ناشی از اکسیژن گفته میشود و نیاز به مراقبتهای درمانی دارد. میزان غلظت گاز اکسیژن موجود در هوا میزان مناسب برای تنفس انسانها و سایر جانوران است. اگر غلظت گاز اکسیژن هوا زیر پایینتر از ۱۹ درصد شود خطر کمبود اکسیژن و اگر بالاتر از ۲۴ درصد شود خطر مسمویت ناشی از اکسیژن و همچنین انفجار و اشتعال بسیاری از مواد آتشگیر بالا میرود.
تولید اکسیژن
علاوه بر فرایندهای تولید طبیعی گاز اکسیژن مانند فوتوسنتز که به آن اشاره شد، روشهای شیمیایی نیز برای تولید این گاز وجود دارد. در ادامه بررسی میکنیم روش آزمایشگاهی تولید گاز اکسیژن چیست. علاوه بر فرایند فوتوسنتز، اکسیژن میتواند از واکنشهای شیمیایی دیگری نیز به دست بیاید. برای مثال از واکنش تجزیه آب اکسیژنه ( هیدروژن پراکسید)، اکسیژن به دست میآید.
سرعت انجام این واکنش میتواند توسط منگنز (IV) اکسید کاتالیز شود. منگنز (IV) اکسید جامدی سیاهرنگ است. هنگامی که این ماده به هیدروژن پر اکسید اضافه میشود، حبابهای اکسیژن قابل مشاهده هستند. با استفاده از یک سرنگ گاز میتوان اکسیژن آزادشده را جمع آوری کرد.
همچنین با مایع کردن و تقطیر هوا نیز میتوان اکسیژن به دست آورد. یکی دیگر از راههای بدست آوردن اکسیژن در آزمایشگاه، فرایند الکترولیز آب است. فرمول این واکنش در زیر نوشته شده است.
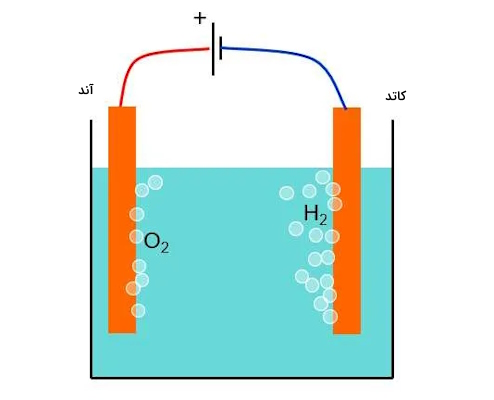
تاریخچه کشف گاز اکسیژن
گاز اکسیژن از هزاران سال پیش در اثر فعالیت گیاهان و میکروارگانیسمها روی زمین وجود داشته است و اساس زندگی انسانها و جانوران را روی زمین تشکیل داده است. اولین مطالعات راجع به اتم اکسیژن مربوط به قرن ۱۸ میلادی است. دانشمند انگلیسی، جوزف پریستلی گاز اکسیژن را به تنهایی و بدون ترکیب شدن با عنصر دیگری در ترکیب نور خورشید با اکسید جیوه جداسازی کرد. مشاهدات او همچنین شامل مطالعات راجع به شدت شعله سوختن شمع در این گاز نسبت به هوای آزاد نیز میشد.
پس از او، آنتوان لاوازیه (پدر علم شیمی) اولین کسی بود که عنصر اکسیژن را کشف کرد و عنصر را چیزی تعریف کرد که نمیتواند به اجزای شیمیایی کوچکتری (اتم) شکسته شود. اون پس از کشف اینکه گاز اکسیژن چیست، این نام را بر روی آن گذاشت که به معنی تولید اسید است. به این علت که او فکر میکرد این عنصر پایه تمامیمواد اسیدی است.

جمع بندی
این مطلب را فراگرفتیم تا بدانیم اتم و گاز اکسیژن چیست و چه کاربردی دارد. در این مطلب از مجله فرادرس آموختیم گاز اکسیژن مولکولی دواتمی تشکیل شده از اتم اکسیژن با عدد اتمی ۸ است. در دما و فشار نرمال اتاق، این ماده به فرم گاز بی رنگ، بی بو و بدون مزهای است که بیشتر به شکل مولکول یافت میشود. این مولکول کاربردهایی بسیار زیاد و مهم دارد که با آنها در زندگی و صنایع مختلف آشنا شدیم. به طور خلاصه، اکسیژن تنها مهمترین مولکول هوایی نیست که ما استشمام میکنیم. بلکه مادهای بسیار اساسی است که پایه بسیاری از فعالیتهای روزمره و صنعتی و پزشکی را در زندگی ما تشکیل میدهد. اکسیژن از کمک به تنفس انسانها، حیوانات و گیاهان گرفته تا کمک به تصفیه آب، تولید انرژی و حتی در سفرهای فضایی کاربرد دارد. درک بهتر کاربردها و ویژگیهای این مولکول، به ما کمک میکند تا از اهمیت آن باخبر شویم و به پایداری آن در محیط زیست با حفظ پوشش گیاهی و کاهش مصرف سوختهای فسیلی و جایگزینی آنها با سوختهای پاکیزه بکوشیم.