کمپلکسومتری چیست؟ – تیتراسیون به زبان ساده
«تیتراسیون کمپلکسومتری» (Complexometric Titration) که از آن با عنوان «تیتراسیون پیچیدهسنجی» نیز یاد میشود، نوعی آنالیز حجمی است که نقطه پایان آن با تشکیل کمپلکسی رنگی، مشخص میشود. این روش برای مطالعه روی محلولی که حاوی یونهای فلزی متفاوت است، سودمند خواهد بود. در این مطلب میخواهیم با مفهوم تیتراسیون کمپلکسومتری و نحوه انجام آن آشنا شویم. همچنین به بررسی روشهایی میپردازیم که میتوان از آنها برای محاسبات این تیتراسیون استفاده کرد.
- با اصول و ساختار شیمیایی تیتراسیون کمپلکسومتری آشنا میشوید.
- یاد میگیرید چگونه از EDTA برای تعیین یونهای فلزی استفاده کنید.
- توانایی انتخاب شناساگر و کنترل pH جهت دقت بیشتر را کسب میکنید.
- فرمولبندی و محاسبه دادههای تیتراسیون کمپلکسومتری را میآموزید.
- روشهای تعیین نقطه پایان در شرایط گوناگون را یاد خواهید گرفت.
- تجزیه و تحلیل منحنیهای تیتراسیون و تفسیر دادهها را میآموزید.


کمپلکسومتری چیست ؟
کمپلکسومتری نوعی تیتراسیون است که نقطه پایان آن با تشکیل کمپلکس قابل تشخیص است. در تیتراسیون کمپلکسومتری معمولا از شناساگری با تغییر رنگ واضح در نقطه همارزی استفاده میشود. معروفترین تیتراسیون کمپلکسومتری از «اتیلن دیآمین تترا استیک اسید» (EDTA) به عنوان تیترانت بهره میبرد.
اولین آزمایشهای مرتبط با تیتراسیون کمپلکسومتری در سالهای دهه ۵۰ قرن ۱۹، انجام شده است. در این تیتراسیونها از دو یون و به عنوان تیترانت برای اندازهگیری سیانید و کلر استفاده شد.
با این حال روند پیشرفت این تیتراسیون و استفاده از آن در حوزههای مرتبط به طول انجامید زیرا بسیاری از یونهای فلزی کمپلکسهای متعددی را در همراهی با لیگاندهای مختلف تشکیل میدهند. اولین تیتراسیونها نیز به این دلیل موفقیتآمیز بود که و تنها یک کمپلکس بهصورت تشکیل میدهند و برای یک گونه، تشخیص نقطه پایان همارزی دشوار نخواهد بود.
برخی کمپلکسهای یون-لیگاند هستند که گونههای بیشتری تشکیل میدهند و تیتراسیون کمپلکسومتری برای آنها کارایی ندارد. مثلا از کمپلکس گونههایی بهصورت ، ، و مشاهده میشود. در ادامه برخی مفاهیم را که در تمامی انواع تیتراسیونها حائز اهمیت هستند، مورد بررسی قرار خواهیم داد.
اجزای تیتراسیون
هدف از انجام تیتراسیونهای مختلف در بیشتر موارد، یافتن غلظت جزئی است که مجهول است. در این روش به کمک محلولی با حجم و غلظت مشخص، محلول با غلظت مجهول را وارد واکنش میکنند و با توجه به نقطه پایانی واکنش و انجام محاسبات، غلظت به دست میآید. در این بخش میخواهیم تعدادی اصطلاح را در این راستا مورد بررسی قرار دهیم.
- «تیترانت» (Titrant): تیترانت محلولی است با غلظت مشخص که به محلول مجهول اضافه میشود. معمولا برای افزایش دقت تیتراسیون، تیترانت را به آهستگی و قطرهقطره از بورت به محلول مجهول اضافه میکنند. در این صورت کوچکترین تغییر ناشی از افزایش مقدار تیترانت قابل مشاهده است و خطای محاسباتی برای نقطه پایان واکنش را کاهش میدهد.
- «تیتراند» (Titrand): تیتراند که از آن با نام «آنالیت» (Analyte) نیز یاد میشود، محلولی است با غلظت مشخص که در تیتراسیون به کمک تیترانت، در تلاش برای یافتن آن هستیم. در تیتراسیونهای مختلف نوع تیتراند متفاوت خواهد بود. مثلا در تیتراسیون اسید و باز، تیتراند اسید یا بازی با غلظت نامعلوم است.
- نقطه همارزی (Equivalence Point): نقطه همارزی جایی است که در آن واکنش بین تیترانت و تیتراند به پایان رسیده است و حجم مصرف شده تیترانت را در آن نقطه برای انجام محاسبات یادداشت میکنیم.
- «شناساگر» (Indicator): شناساگر مادهای است که به میزان بسیار کم به ظرف واکنش اضافه میشود و به دلیل داشتن دو رنگ متفاوت در فرمهای مختلف خود، میتوان از آن برای تعیین نقطه پایان واکنش بهره برد. مثلا شناساگر تیتراسیون اسید و باز باید به گونهای باشد که در حضور اسید و باز از خود رنگهای مختلفی نشان دهد.
طبقه بندی لیگاندها
تعداد زوج الکترونهایی که یک لیگاند در اختیار فلز مرکزی قرار میدهد، مبنایی برای دستهبندی اعضای این خانواده از ترکیبات است. در ادامه به این لیگاندها میپردازیم.
«لیگاند تکدندانه» (Monodentate or Unidentate Ligand)
به لیگاندی گفته میشود که تنها یک زوج الکترون در اختیار فلز قرار میدهد. در جدول زیر تعدادی لیگاند تکدندانه را مشاهده میکنید.
«لیگاند چنددندانه» (Multidentate Ligand)
به لیگاندی گفته میشود که بیش از یک زوج الکترون را در اختیار فلز مرکزی قرار میدهد. در جدول زیر تعدادی از انواع این لیگاندها را مشاهده میکنید.
| نام فارسی | نام انگلیسی | تعداد زوج الکترون اشتراکی |
| لیگاند دودندانه | Bidentate | ۲ |
| لیگاند سهدندانه | Tridentate | ۳ |
| لیگاند چهاردندانه | Tetradentate | ۴ |
| لیگاند پنجدندانه | Pentadentate | ۵ |
| لیگاند ششدندانه | Hexadentate | ۶ |
بیشترین تعداد زوج الکترونی که یک فلز میتواند بپذیر برابر با عدد کوئوردیناسیون آن است. در زیر تعدادی مثال آوردهایم.
- با عدد کوئوردیناسیون ۲، مانند کمپلکس
- با عدد کوئوردیناسیون ۴، مانند کمپلکس
- با عدد کوئوردیناسیون ۶، مانند کمپلکس
ماهیت اتصال در کمپلکسهای یونی
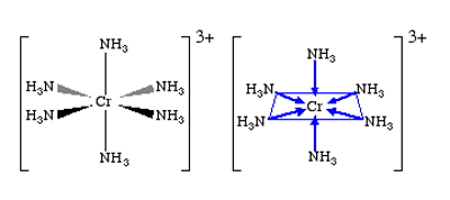
یک یون فلز مرکزی با لیگاندی که تنها از یکی از اتمهای خود زوج الکترون میدهد، پیوندی یگانه تشکیل خواهد داد. مثالی که در بالا از فلز مرکزی کروم آورده شده است، به این گروه تعلق دارد. ساختار آن را میتوانید در تصویر زیر مشاهده کنید. در این ساختار هر ۶ ظرفیت پیوند کروم، با یک آمونیاک مجزا است.
در لیگاندهای چنددندانه، فلز مرکزی به بیش از یک محل لیگاند متصل میشود و میتواند ساختاری حلقوی ایجاد کند. در این حالت معمولا پایداری ساختار افزایش پیدا میکند. به گونهای که بهطور همزمان به بیش از ۱ محل در لیگاند متصل باشد، «کیلیت فلزی» (Metal Chelate) گفته میشود. فرایند تشکیل این ترکیب نیز «کیلیت سازی» (Chelation) نامیده میشود. ترکیبات کمپلکس با EDTA معروفترین اعضای این خانواده هستند. در ادامه به این ماده بیشتر خواهیم پرداخت.
EDTA چیست ؟
در تیتراسیون کمپلکسومتری وجود لیگاندی که کار با آن آسان و در دسترس باشد، از اهمیت فراوانی برخوردار است. اتیلن دیآمین تترا استیک اسید که به اختصار با EDTA نشان داده میشود، با بسیاری از یونهای فلزی به نسبت ۱:۱ کمپلکس پایداری تشکیل میدهد و از آن میتوان برای آزمایشهای متفاوتی بهره برد. EDTA به خانواده آمینوکربوکسیلیک اسیدها تعلق دارد.
در زیر میتوانید تصویر این مولکول را در حالتی که کاملا پروتونزدایی شده است، مشاهده کنید.
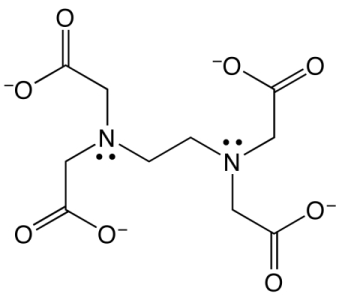
این مولکول یک اسید لوییس است و میتواند از ۶ نقطه، ۴ گروه کربوکسیلاتی با بار منفی و ۲ گروه آمین نوع دوم، اتصال ایجاد کند.این سه گروه قادر هستند با در اختیار قرار دادن زوج الکترونهای خود به یون فلزی به آن متصل شوند. در نتیجه ساختاری قفسمانند تشکیل میشود که یونفلزی در مرکز این کمپلکس قرار خواهد داشت.
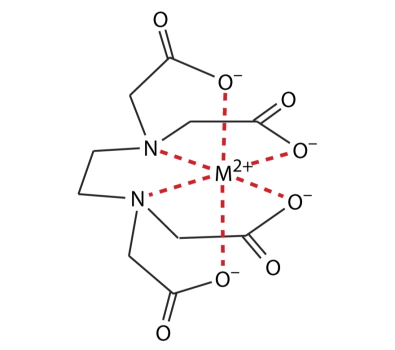
تصویر این کمپلکس بسیار پایدار را در همراهی با یون فلزی با نماد مشاهده میکنید. توجه داشته باشید که EDTA با تمامی یونهای فلزی، کمپلکسی با نسبت ۱:۱ تشکیل میدهند.
ثابت تشکیل کمپلکس فلز و EDTA
یونهای فلزی برای اینکه با EDTA تشکیل کمپلکس دهند با آن وارد واکنش میشوند، در این بخش برای بررسی نمونهای از آنها، واکنش بین یون فلزی و EDTA را در نظر میگیریم و آن را بهصورت زیر مینویسیم.
در این واکنش نمادی برای EDTA در حالتی است که بهصورت کامل پروتونزدایی شده باشد. از آنجا که ثابت تشکیل واکنش بزرگ است، تعادل به سمت راست پیشروی میکند. ثابت تشکیل این واکنش بهصورت زیر مشاهده میکنید.
خاصیت اسیدی EDTA
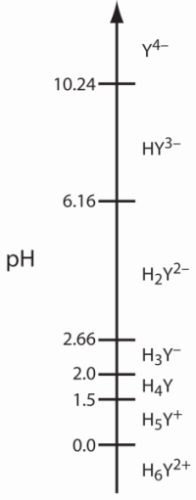
این مولکول علاوه بر اینکه لیگاندی بسیار کاربردی است، به خانواده اسیدهای ضعیف نیز تعلق دارد. EDTA را بهصورتی که تماما دارای پروتون باشد با نماد نشان میدهند. این ماده اسید ضعیف ۶ پروتونه است و مقادیر ثابت تفکیک آن در زیر آورده شده است.
| ثابت تفکیک | مقدار |
| ۰ | |
| ۱/۵ | |
| ۲ | |
| ۲/۶۶ | |
| ۶/۱۶ | |
| ۱۰/۲۴ |
چهار تفکیک اسیدی ابتدایی برای پروتونهای کربوکسیلیک اسید و دوتای دیگر برای گروههای آمینی هستند. در نمودار زیر میتوانید گونههای مختلف EDTA را در مقادیر متفاوت مشاهده کنید. گونه تنها در مقادیر بالای غالب است.
ثابت تعادل مشروط تشکیل فلز و لیگاند
پیشتر واکنش تشکیل کمپلکس را مورد بررسی قرار دادیم. توجه داشته باشید واکنش آن با این فرض نوشته شده است که EDTA بهطور عمده در فرم خود حضور داشته باشد زیرا EDTA با توجه به مقدار pH فرمهای مختلفی دارد. هنگامی که محلولی از EDTA تهیه میکنیم، غلظت معلوم آن به همه این فرمها برمیگردد و نمیتوان از آن به عنوان غلظت یاد کرد. بنابراین باید در این مورد احتیاط به خرج دهیم و رابطهای برای نشان دادن غلظت EDTA بنویسیم. بنابراین در هر مقدار ، غلظت EDTA برابر با مجموع غلظت تمام گونههای موجود آن است. به رابطه زیر دقت کنید.
برای تصحیح ثابت تشکیل باید آن را بهصورت زیر که نشاندهنده مقدار موجود در گونه است، محاسبه کنیم.
این ثابت تصحیحشده در مقادیر مختلف محاسبه شده و در جدول زیر قابل مشاهده است.
| مقدار | |
| ۱ | |
| ۲ | |
| ۳ | |
| ۴ | |
| ۵ | |
| ۶ | |
| ۷ | |
| ۸ | |
| ۹ | |
| ۱۰ | ۰/۳۷ |
| ۱۱ | ۰/۸۵ |
| ۱۲ | ۰/۹۸ |
| ۱۳ | ۱/۰۰ |
| ۱۴ | ۱/۰۰ |
در این مرحله میخواهیم رابطه (۲) را به کمک رابطه (۴) بازآرایی کنیم. نتیجه بهصورت زیر خواهد بود.
در رابطه (۶) ثابت تشکیل مشروطی را به دست آوردهایم که به مقدار وابسته است و با نماد نشان داده میشود. مقادیر این مولفه را در مختلف در جدول زیر آوردهایم. همانطور که مشاهده میکنید در محیط اسیدی، ثابت تشکیل مشروط کوچکتر و در نتیجه کمپلکس دارای پایداری کمتری است.
| مقدار | مقدار |
| ۱ | |
| ۲ | |
| ۳ | |
| ۴ | |
| ۵ | |
| ۶ | |
| ۷ | |
| ۸ | |
| ۹ | |
| ۱۰ | |
| ۱۱ | |
| ۱۲ | |
| ۱۳ | |
| ۱۴ |
رقابت EDTA با سایر لیگاندها
در فرایند تیتراسیون کمپلکسومتری برای ثابت نگه داشتن مقدار محیط، معمولا به محیط، بافری افزوده میشود. در این حالت اگر یکی از اجزای این بافر، لیگاندی باشد که توانایی اتصال به یون را داشته باشد، رقابتی در میگیرد. برای روشن شدن این مورد مثالی را مورد بررسی قرار میدهیم.
اگر بافری که به محیط اضافه میشود باشد، آمونیاک آن میتواند با یون کادمیوم، کمپلکسهای پایدار متنوعی تشکیل دهد. اما به دلیل اینکه کمپلکس یون کادمیوم با EDTA قویتر است، جایگزین آمونیاک میشود با این حال اندکی از پایداری کمپلکس کم خواهد شد. در این حالت به لیگاند دومی که در محیط وجود دارد و وارد رقابت میشود، «عامل کمپکسکننده فرعی» (Auxiliary Complexing Agent) گفته میشود.
این مورد را نیز میتوان در رابطه ثابت تفکیک اسیدی، مانند تاثیر مقدار ، لحاظ کرد. در این حالت، پیش از افزودن EDTA جرم کادمیوم برابر با رابطه زیر است.
همچنین یون کادمیومی که درگیر کمپلکس نشده است بهصورت زیر قابل نمایش است.
با حل معادله بالا و جایگذاری آن در رابطه (۶)، رابطه زیر به دست میآید.
از آنجا که غلظت آمونیاک در بافر ثابت است، میتوان رابطه بالا را بازآرایی کرد و نتیجه بهصورت زیر خواهد بود.
در این صورت رابطهای خواهیم داشت که ثابت مشروط تشکیل را بهصورتی به دست میدهد که تاثیر غلظت یون هیدرونیوم و عوامل کمپلکسکننده دیگر را در خود دارد.
در جدول زیر مقدار برای دو یون فلزی در غلظتهای متفاوت آمونیاک آورده شده است.
| غلظت آمونیاک (مولار) | ||
| ۱ | ||
| ۰/۵ | ||
| ۰/۱ | ||
| ۰/۰۵ | ||
| ۰/۰۱ | ||
| ۰/۰۰۵ | ||
| ۰/۰۰۱ |
منحنی تیتراسیون کمپلکسومتری با EDTA
تا اینجا در مورد ویژگیهای لیگاند EDTA صحبت کردیم، حال میخواهیم بدانیم این ماده با ارزش در تیتراسیون کمپلکسومتری چگونه نقش خود را ایفا میکند. منحنی تیتراسیون در تیتراسیون اسید و باز تغییرات را بر حسب مقدار تیترانت افزودهشده نشان میدهد. در این تیتراسیون منحنی بر اساس تغییرات که در آن یون فلزی است، با حجم افزودهشده از EDTA، رسم میشود. در این بخش میخواهیم به این موضوع بپردازیم که چطور میتوانیم با منحنی تیتراسیون کار کنیم و از آن نقطه همارزی را به دست بیاوریم. برای فهم بهتر، این مورد را با ذکر مثالی مورد بررسی قرار میدهیم.
محاسبات تیتراسیون کمپلکسومتری
در تیتراسیونی از EDTA با مولاریته ۰/۰۱ برای رساندن ۵۰ میلیلیتر با مولاریته به نقطه همارزی استفاده شده است. همچنین محیط تیتراسیون را به کمک محلول بافری از آمونیاک ۰/۰۱ مولار، روی مقدار برابر با ۱۰ تنظیم کردهاند. برای انجام محاسبات لازم مراحل زیر را طی میکنیم.
- مرحله اول: محاسبه ثابت تشکیل مشروط برای کمپلکس فلز با EDTA
از آنجا که مقدار برابر با ۱۰ است، بخشی از EDTA بهصورت گونههایی غیر از حضور خواهند داشت. به علاوه EDTA باید با آمونیاک برای به دست آوردن یونهای کادمیوم رقابت کند. بنابراین برای داشتن منحنی تیتراسیون، باید در ابتدا ثابت تشکیل مشروط برای را محاسبه کنیم. در جدولهای بالا دو مقدار زیر در برابر با ۱۰ و غلظت آمونیاک برابر با ۰/۰۱ مولار، داده شدهاند.
با استفاده از این دو مقدار، ثابت تشکیل مشروط را میتوانیم به شکل زیر مورد محاسبه قرار داد.
از آنجا که مقدار این ثابت بسیار بزرگ است، میتوان اینطور در نظر بگیریم که واکنش تیتراسیون تکمیل میشود.
- مرحله دوم: محاسبه حجم EDTA مورد نیاز برای رسیدن به نقطه همارزی
در مرحله دوم باید مقدار مورد نیاز از EDTA برای رسیدن به نقطه همارزی تیتراسیون را به دست بیاوریم. میدانیم که در نقطه همارزی روابط زیر صدق میکنند.
با جایگذاری حجم و غلظت معلوم، نتیجه بهصورت زیر خواهد بود.
بنابراین برای رسیدن به نقطه همارزی به ۲۵ میلیلیتر از EDTA نیاز خواهیم داشت.
- مرحله سوم: محاسبه مقدار پیش از نقطه همارزی با به دست آوردن مقدار یونهای فلزی واکنشنداده
پیش از نقطه همارزی، بهصورت مازاد وجود دارد و میتوان مقدار واکنشنداده را محاسبه کرد. البته از آنجا که تمامی واکنش نداده، آزاد نیست و بخشی با آمونیاک تشکیل کمپلکس داده است، باید حضور آمونیاک را نیز مد نظر داشت. برای مثال بعد از افزودن ۵ میلیلیتر از EDTA، غلظت کل کادمیوم بهصورت زیر خواهد بود.
برای محاسبه غلظت کادمیوم آزاد، به کمک رابطه (۸) خواهیم داشت:
برای به دست آوردن مقدار ، از مقدار به دست آمده، منفی لگاریتم میگیریم و نتیجه بهصورت زیر به دست میآید.
- مرحله چهارم: محاسبه مقدار در نقطه همارزی. برای این کار از ثابت تشکیل مشروط کمک میگیریم.
در نقطه همارزی تمامی اولیه بهصورت حضور دارد، بنابراین غلظت یون کادمیوم با تفکیک به دست میآید. در مرحله اول محاسبات مقدار غلظت را محاسبه میکنیم.
در ادامه، غلظت یون کادمیوم بهصورت زیر به دست میآید.
به این نکته توجه داشته باشید که در نقطه همارزی تعداد مولهای با تعداد مولهای EDTA برابر هستند و از همین رو غلظت کل یون کادمیوم، و غلظت کل EDTA یا نیز با یکدیگر برابر خواهد بود.
مانند قبل برای محاسبه غلظت یون کادمیوم، باید حضور آمونیاک را در نظر داشته باشیم و خواهیم داشت:
بنابراین مقدار در نقطه همارزی برابر با ۹/۷۷ خواهد بود.
- مرحله پنجم: محاسبه غلظت کادمیوم پس از نقطه همارزی به کمک ثابت تشکیل مشروط.
بعد از نقطه همارزی، EDTA بهصورت مازاد وجود دارد و غلظت کادمیوم را با تفکیک کمپلکس به دست میآوریم. ابتدا غلظت و EDTA واکنشنداده را محاسبه میکنیم. برای مثال پس از افزودن ۳۰ میلیلیتر از EDTA، خواهیم داشت:
با جایگذاری این مقادیر در رابطه (۱۰)، مقدار غلظت به شکل زیر قابل محاسبه است.
مقدار برابر با ۱۵/۳۲ خواهد بود.
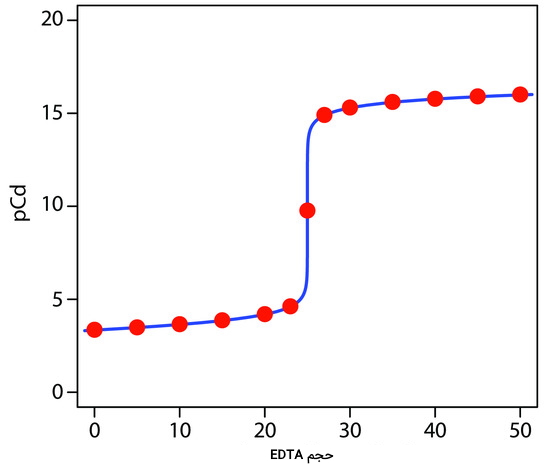
با استفاده از همین روش محاسباتی، تعدادی نقطه دیگر را در این تیتراسیون محاسبه کردهایم که در جدول زیر قابل مشاهده هستند.
| حجم EDTA (میلیلیتر) | |
| ۰ | ۳/۳۶ |
| ۵ | ۳/۴۹ |
| ۱۰ | ۳/۶۶ |
| ۱۵ | ۳/۸۷ |
| ۲۰ | ۴/۲ |
| ۲۳ | ۴/۶۲ |
| ۲۷ | ۱۴/۹۵ |
| ۳۰ | ۱۵/۳۳ |
| ۳۵ | ۱۵/۶۱ |
| ۴۰ | ۱۵/۷۶ |
| ۴۵ | ۱۵/۸۶ |
| ۵۰ | ۱۵/۹۴ |
نقاط محاسبه شده در جدول بالا، در منحنی زیر با رنگ قرمز مشخص شدهاند.
توجه داشته باشید که بعد از رسیدن به نقطه همارزی غلظت و EDTA را میدانیم. و میتوانیم برای به دست آوردن غلظت از ثابت تشکیل مشروط استفاده کنیم، زیرا در تمامی محاسبات از یک ثابت تشکیل مشروط واحد بهره میبریم.
برای انجام این محاسبات میتوان از روش دیگری نیز استفاده کرد که آن را در ادامه بررسی میکنیم. از آنجا که در این محاسبات تنها از غلظت و استفاده میشود، میتوانیم به جای از استفاده کنیم و در این صورت خواهیم داشت:
با حل این معادله مقدار غلظت یون کادمیوم برابر با مقدار زیر خواهد بود.
در نتیجه مقدار برابر با ۱۵/۳۳ میشود.
مثال محاسبات منحنی تیتراسیون
در این مثال میخواهیم محاسبات تیتراسیونی شامل ۵۰ میلیلیتر از با مولاریته را به کمک EDTA با مولاریته ۰/۰۱ انجام دهیم. این محاسبات را در دو مقدار مختلف برابر با ۱۰ و ۷ بررسی میکنیم. در هیچکدام از این دو تیتراسیون عامل کمپلکسکننده دیگری حضور ندارد.
پاسخ
این محاسبات را ابتدا برای حالتی انجام میدهیم که مقدار برابر با ۱۰ باشد. در این نقطه، بخشی از EDTA به فرمهایی غیر از گونه حضور دارند. برای محاسبات لازم، نیاز به مقدار ثابت تشکیل مشروط برای داریم که در جدول بالا برابر با آورده شده است. توجه داشته باشید که ثابت تشکیل مشروط در غیاب عامل کمپلکسکننده فرعی، بزرگتر خواهد بود. ابتدا مقدار مورد نیاز از EDTA برای رسیدن به نقطه همارزی را بهصورت زیر محاسبه میکنیم.
پیش از نقطه همارزی، یون کادمیوم بهصورت مازاد وجود دارد و میتوان مقدار را از واکنشنداده، به دست آورد. برای مثال، بعد از افزودن ۵ میلیلیتر EDTA، غلظت کل یون کادمیوم برابر با مقدار زیر خواهد بود.
در این صورت مقدار برابر با ۲/۴۳ میشود.
در نقطه همارزی تمامی یونهای کادمیوم اولیه موجود بهصورت حضور دارند. بنابراین میتوان غلظت را با تفکیک این کمپلکس محاسبه کرد. برای این کار ابتدا غلظت را به دست میآوریم.
در مرحله بعد این مقدار را در رابطه ثابت تشکیل مشروط جایگذاری میکنیم و نتیجه بهصورت زیر خواهد بود.
با حل این معادله در نقطه همارزی، غلظت یون کادمیوم برابر با و برابر با ۹/۲۶ به دست میآید.
پس از نقطه همارزی، مقدار EDTA مازاد است و غلظت یون کادمیوم را از تفکیک کمپلکس به دست میآوریم. برای این کار ابتدا غلظت و EDTA واکنشنداده را محاسبه میکنیم. برای مثال بعد از افزودن ۳۰ میلیلیتر از EDTA، میتوانیم به این صورت عمل کنیم:
با جایگذاری در رابطه ثابت تفکیک مشروط میتوانیم مقدار غلظت یون کادمیوم را محاسبه کنیم.
بنابراین مقدار غلظت یون کادمیوم برابر با و برابر با ۱۵/۳۴ است.
محاسبات انجام شده را میتوان دقیقا با مقادیر متفاوت برای برابر با ۷ نیز انجام داد. با این تفاوت که مقدار ثابت تشکیل مشروط برای آن برابر با است. در جدول زیر با بهرهگیری از روش محاسباتی بالا، مقادیر در حجمهای مختلف EDTA آورده شده است.
| حجم EDTA (میلیلیتر) | مقدار در برابر ۱۰ | مقدار در برابر ۷ |
| ۰ | ۲/۳ | ۲/۳ |
| ۵ | ۲/۴۳ | ۲/۴۳ |
| ۱۰ | ۲/۶ | ۲/۶ |
| ۱۵ | ۲/۸۱ | ۲/۸۱ |
| ۲۰ | ۳/۱۵ | ۳/۱۵ |
| ۲۳ | ۳/۵۶ | ۳/۵۶ |
| ۲۵ | ۹/۲۶ | ۷/۸۳ |
| ۲۷ | ۱۴/۹۴ | ۱۲/۰۸ |
| ۳۰ | ۱۵/۳۴ | ۱۲/۴۸ |
| ۳۵ | ۱۵/۶۱ | ۱۲/۷۸ |
| ۴۰ | ۱۵/۷۶ | ۱۲/۹۵ |
| ۴۵ | ۱۵/۸۶ | ۱۳/۰۸ |
| ۵۰ | ۱۵/۹۴ | ۱۳/۱۸ |
با در دست داشتن این اعداد میتوان تیتراسیون هر کدام را تفسیر کرد. نکته قابل برداشت از این جدول اینکه در غیاب عامل کمپلکسکننده فرعی، منحنی تیتراسیون پیش از نقطه همارزی به مقدار بستگی ندارد، زیرا اعداد بهدست آمده برابر هستند. نکته دوم این است که در مقادیر بالا، در نقطه همارزی تغییرات غلظت بیشتر است.
رسم منحنی تیتراسیون کمپلکسومتری با EDTA
برای نمایش رابطه بین نقطه همارزی تیتراسیون و نقطه پایان میتوانیم از نمودار تیتراسیون استفاده کنیم. در این بخش میخواهیم نحوه رسم این منحنیها را مورد بررسی قرار دهیم. هدف این است که بتوانیم با چند محاسبه ساده به این منحنی دست پیدا کنیم. تیتراسیونی که در این بخش مورد نظر ما است مربوط به کمپلکسومتری ۵۰ میلیلیتر با مولاریته به کمک EDTA با مولاریته ۰/۰۱ و در حضور آمونیاک ۰/۰۲ مولار است. محاسبات مربوط به این تیتراسیون پیشتر مورد بررسی قرار گرفته است.
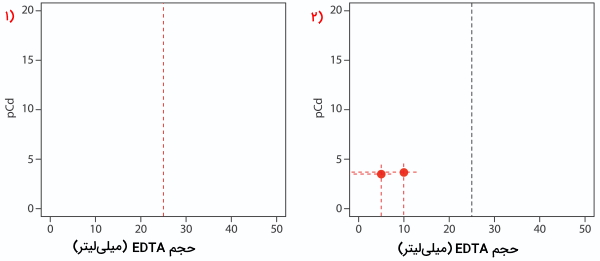
در ابتدا باید حجم مورد نیاز از تیترانت تا نقطه همارزی را بیابیم که در بخش قبلی برابر با ۲۵ میلیلیتر به دست آمد. سپس محورهای عمودی و افقی را بهصورتی رسم میکنیم که مقدار روی محور عمودی و حجم تیترانت روی محور افقی باشد. برای مشخص کردن نقطه همارزی در این منحنی، خطی عمودی از محور افقی برابر با ۲۵ میلیلیتر از تیترانت رسم میکنیم. این را میتوانید در منحنی شماره ۱ مشاهده کنید.
پیش از رسیدن به نقطه همارزی، بهصورت مازاد وجود دارد و میتوان مقدار را از یون کادمیوم واکنشنداده، به دست آورد. از آنجا که تمام این یونها بهصورت آزاد وجود ندارند و بخشی با آمونیاک تشکیل کمپلکس دادهاند، باید به حضور آمونیاک نیز توجه داشته باشیم. این محاسبات درست مانند مثال بالا انجا میشود. در منحنی شماره ۲، مقادیر EDTA اضافه شده پیش از رسیدن به نقطه همارزی در ۵ و ۱۰ میلیلیتر مشخص شدهاند.
در مرحله بعدی، نیاز داریم تا ۲ نقطه را روی منحنی بهصورتی داشته باشیم که از نقطه همارزی بالاتر باشند. در اینجا غلظت را میتوان از تفکیک کمپلکس به دست آورد. برای این کار از ثابت تفکیک مشروط شروع میکنیم.
سپس از دو طرف رابطه لگاریتم میگیریم و با بازآرایی، نتیجه بهصورت زیر خواهد بود.
توجه داشته باشید که در نقطه همارزی، محلول تیتراسیون، بافری دارای کمپلکس فلز-لیگاند است و از و غلظت به دست میآید. به همین صورت مقدار دو مختصات را برای پس از همارزی محاسبه میکنیم. این دو نقطه همانطور که در منحنی شماره ۴ مشاهده میکنید، روی منحنی، پس از خط عمودی مربوط به نقطه همارزی قرار دارند.
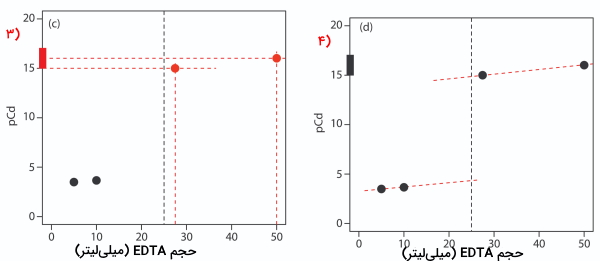
در مرحله بعد هر دو نقطه به دست آمده را با یک خط صاف به یکدیگر متصل میکنیم. سپس این دو خط را به خط عمودی که نشاندهنده نقطه همارزی است، امتداد میدهیم و در انتها، همانطور که در منحنی ۶ مشاهده میکنید، این سه خط را با رسم منحنی، یکپارچه میکنیم.
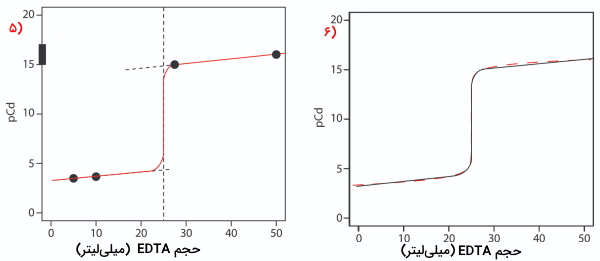
مثال رسم منحنی تیتراسیون کمپلکسومتری با EDTA
منحنی تیتراسیون را برای تیتراسیون ۵۰ میلیلیتر از با مولاریته به کمک تیترانت EDTA با مولاریته ۰/۰۱ در دو برابر با ۱۰ و ۷ رسم کنید.
پاسخ
نقطههایی که پیش از همارزی قرار دارند، فارغ از مقدار با یکدیگر برابر هستند. بهصورتی که در حجم تیترانت برابر با ۵ میلیلیتر، برابر با ۲/۴۳ و در حجم تیترانت برابر با ۱۵، مقدار برابر با ۲/۸۱ است. توجه داشته باشید که نحوه محاسبه این مقادیر در مثال مربوط به محاسبات منحنی تیتراسیون در بالا آورده شده است.
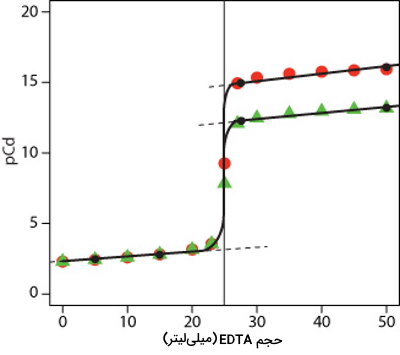
بعد از نقطه همارزی منحنی دو شاخه میشود و برای هر مقادیر متفاوت است. دو نقطه برای مقدار برابر با ۷ محاسبه شده است. نقاط مربوط به این با رنگ سبز مشخص شدهاند.
- نقطه اول: حجم تیترانت ۲۷/۵ میلیلیتر و برابر با ۱۲/۲
- نقطه دوم: حجم تیترانت ۵۰ میلیلیتر و برابر با ۱۳/۲
به همین صورت برای مقدار برابر با ۱۰ نیز دو نقطه در منحنی محاسبه شده است. نقاط مربوط به این با رنگ قرمز مشخص شدهاند.
- نقطه اول: حجم تیترانت ۲۷/۵ میلیلیتر و برابر با ۱۵
- نقطه دوم: حجم تیترانت ۵۰ میلیلیتر و برابر با ۱۶
در هر مورد با اتصال این نقاط، منحنی تیتراسیون مربوط به آن به دست میآید.
محاسبه نقطه پایان تیتراسیون کمپلکسومتری
نقطه همارزی تیتراسیون کمپلکسومتری زمانی به دست میآید که تیترانت و آنالیت به مقدار استوکیومتری برابری با یکدیگر وارد واکنش شوند. مانند تیتراسیون اسید و باز، این نقطه به کمک روشهای تجربی قابل محاسبه است. یکی از مهمترین و پرکاربردترین روشهای تشخیص پایان تیتراسیون، استفاده از شناساگرهایی است که با توجه به شرایط تغییر رنگی را تجربه میکنند.
یافتن نقطه پایان تیتراسیون کمپلکسومتری به کمک شناساگر
اکثر شناساگرهایی که برای تیتراسیون کمپلکسومتری استفاده میشوند، رنگدانههایی آلی هستند که آنها را با نام «شناساگرهای متالوکرومی» (Metallochromic Indicator) میشناسیم. ماهیت این شناساگرها به گونهای است که با یونهای فلزی، کمپلکسهای پایداری را تشکیل میدهند.
این شناساگرها که آن را با نماد میشناسیم، به محلول آنالیت اضافه میشوند و کمپلکس پایداری را با یون فلزی، بهصورت تشکیل میدهند. با افزودن تیترانت EDTA، ابتدا با یونهای فلزی آزاد، وارد واکنش میشود و سپس جایگزین این شناساگرها در ساختار میشوند. این واکنش را میتوان بهصورت زیر نشان داد.
در این حالت، در صورتی که و دارای دو رنگ متفاوت باشند، تغییر رنگ نشانی از پایان تیتراسیون است. دقت نقطه پایانی هر شناساگر به استحکام کمپلکس فلز-شناساگر نسبت به کمپلکس فلز-EDTA بستگی دارد. اگر کمپلکس فلز-شناساگر بسیار محکم و پایدار باشد، تغییر رنگ پس از نقطه همارزی اتفاق میافتد اما در صورتی که کمپلکس فلز-شناساگر بسیار ضعیف باشد، تغییر رنگ و رسیدن نقطه پایانی تیتراسیون پیش از نقطه همارزی خواهد بود.

بسیاری از شناساگرهای متالوکرومی، اسیدهای ضعیفی هستند. در نتیجه ثابت تشکیل مشروط کمپلکس فلز-شناساگر به مقدار محلول آنالیت بستگی دارد. از این مورد میتوان استفاده بهسزایی کرد، بهصورتی که شرایط واکنش کمی کنترل شود زیرا میتوان استحکام کمپلکس فلز-یون را با تنظیم مقدار تیتراسیون، تنظیم کرد. اما اسیدی بودن شناساگر معایبی نیز دارد. برای مثال رنگ شناساگری که در کمپلکس دخیل نیست، با تغییر تغییر میکند.
به تصویر زیر که مربوط به شناساگر «کالماژیت» (Calmagite) است، دقت کنید. در این نمودار این شناساگر بهصورت تابعی از و نمایش داده شده است. سه گونه و و ، فرمهای مختلف شناساگر هستند که وارد کمپلکس با فلز نشدهاند. از آنجا که رنگ کمپلکس فلز-شناساگر کالماژیت قرمز است، استفاده از آن به عنوان شناساگر متالوکرومی، بازهای از برابر با ۸/۵ تا ۱۱ را در بر میگیرد. در این بازه گونه که تشکیل کمپلکس نمیدهد، رنگی آبی از خود نشان میدهد.
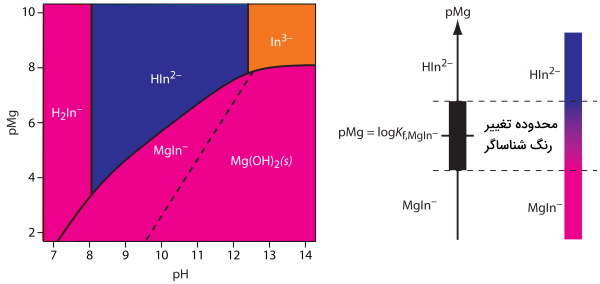
انواع شناساگر کمپلکسومتری
پیشتر در مورد شناساگرهای متالوکرومی و ویژگیهای آنها صحبت کردیم. در این بخش در جدولی تعدادی از مهمترین و کاربردیترین این شناساگرها را آوردهایم. همچنین محدوده آنها و یونهای فلزی شرکتکننده در کمپلکسومتری در ستونهای بعدی این جدول قابل مشاهده هستند.
| شناساگر | محدوده | یونهای فلزی |
| کالماژيت | ۸/۵ تا ۱۱ | باریم، کلسیم، منیزیم، روی |
| اریوکروم بلک تی | ۷/۵ تا ۱۰/۵ | باریم، کلسیم، منیزیم، روی |
| اریوکروم بلو بلک آر | ۸ تا ۱۲ | کلسیم، منیزیم، روی، مس |
| مورکسید | ۶ تا ۱۳ | کلسیم، نیکل، مس |
| پن | ۲ تا ۱۱ | کادمیوم، مس، روی |
| سالیسیلیک اسید | ۲ تا ۳ | آهن |
در صورتی که برای تیتراسیون یونی فلزی، شناساگر مناسبی وجود نداشته باشد، میتوان از روش دیگری استفاده کرد. در این روش مقادیر بسیار اندکی از یک کمپلکس یون-EDTA به محیط تیتراسیون اضافه میشود، این کمپلکس باید نسبت به آنالیت، با شناساگر، کمپلکسی قویتر و با EDTA کمپلکسی ضعیفتر تشکیل بدهد. در ادامه مثالی از این مورد را بررسی خواهیم کرد.
شناساگر کالماژیت در تیتراسیون با EDTA، نقطه پایانی ضعیفی دارد. در این صورت میتوان مقادیر بسیار اندکی از کمپلکس منیزیم-EDTA را به آنالیت اضافه کرد و شاهد نقطه پایانی بسیار واضحتری بود. دلیل این اتفاق این است که کلسیم نسبت به منیزیم با تیترانت EDTA، کمپلکس قویتری تشکیل میدهد و جایگزین آن خواهد شد. در این صورت رنگ قرمزی که مشاهده میشود ناشی از کمپلکس منیزیم با کالماژيت است. در نقطه پایانی این تیتراسیون، EDTA یون منیزیم را از کمپلکس منیزیم با کالماژیت جدا میکند و باعث به وجود آمدن رنگی آبی میشود که نشاندهنده شناساگر در حالت آزاد خود و خارج از کمپلکس است.
یافتن نقطه پایانی بدون شناساگر
در برخی از تیتراسیونهای کمپلکسومتری نمیتوان از شناساگر برای تشخیص نقطه پایان تیتراسیون بهره گرفت که این میتواند به دلیل مناسب نبودن محدوده تغییر رنگ برای یک شناساگر یا واضح نبودن این تغییر رنگ باشد. یکی از محدودیتهای استفاده از شناساگر این است که باید برای یافتن نقطه پایانی تیتراسیون، شاهد تغییر رنگ باشیم و این، کار را برای محلولهایی که خود دارای رنگ هستند، بسیار دشوار میکند.
برای مثال در تیتراسیون به کمک EDTA از آمونیاک برای تنظیم آنالیت استفاده میشود. کمپلکس رنگ بسیار شدیدی دارد و رویت رنگ شناساگر را بسیار دشوار میکند. این مورد بهخصوص در آنالیز نمونههای بالینی مانند خون و نمونههای زیست محیطی مانند آب طبیعی مشاهده میشود. در این صورت میتوان شناساگر را جایگزین کرد.
در ادامه بهصورت خلاصه این روشها را مورد بررسی قرار میدهیم.
- تیتراسیون دماسنجی: در این روش تغییر دمای آنالیت در افزودن تیترانت تحت نظر گرفته میشود.
- تیتراسیون پتانسیومتری: در این روش از الکترود یونگزین برای پایش غلظت یونهای فلزی در افزودن تیترانت، استفاده میشود.
یافتن نقطه پایانی تیتراسیون با جذب
در صورتی که حداقل یکی از گونههای موجود در تیتراسیون کمپلکسومتری جاذب تابش الکترومغناطیسی باشد، میتوان برای یافتن نقطه پایانی تیتراسیون، جذب آنالیت را در طول موج انتخابی مورد بررسی قرار داد.
برای مثال، میتوانیم نقطه پایانی تیتراسیون با EDTA و در حضور آمونیاک را با پایش جذب آنالیت در طول موجی برابر با ۷۴۵ نانومتر، تشخیص بدهیم. در این تیتراسیون، کمپلکس جذب بسیار زیادی دارد. در ابتدای این تیتراسیون، میزان جذب در بیشترین مقدار خود است. سپس با افزودن قطرهقطره از تیترانت EDTA، وقوع واکنش زیر باعث کاهش غلظت کمپلکس و در نتیجه کاهش جذب خواهد شد. پیشروی این واکنش به سمت راست است.
کاهش میزان جذب تا رسیدن به نقطه همارزی ادامه خواهد داشت و پس از آن ثابت میماند. منحنی این تیتراسیون کمپلکسومتری «منحنی تیتراسیون طیفسنجی نوری» (Spectrophotometric Titration Curve) نامیده میشود. این منحنی در تصویر زیر با شماره ۱، قابل مشاهده است. توجه داشته باشید که محور عمودی در این منحنی، نشاندهنده میزان جذب تصحیحشده است که بهصورت زیر قابل محاسبه خواهد بود.
- : میزان جذب تصحیحشده
- : میزان جذب واقعی
- : حجم تیترانت
- : حجم آنالیت
با تصحیح کردن جذب، شاهد منحنی خطی هستیم که میتوان نقطه پایان تیتراسیون را از روی آن برونیابی کرد. با توجه به نوع جذب میتوان منحنیهای مختلفی را شاهد بود، که تعدادی از آنها را در زیر آوردهایم. از روی نحوه قرارگیری خطوط هر نمودار میتوان به اطلاعاتی در مورد آن تیتراسیون دست پیدا کرد. برای مثال در منحنی شماره ۱، تنها آنالیت دارای جذب است و بعد از رسیدن به نقطه همارزی که با فلش قرمز مشخص شده است، جذب ثابت باقی میماند. در منحنی شماره ۲، شاهد افزایش جذب بعد از نقطه همارزی هستیم. در این تیتراسیون تنها تیترانت دارای جذب است.
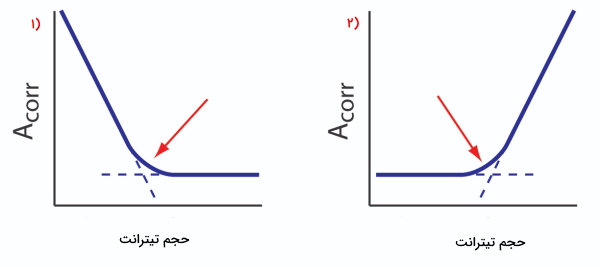
در منحنی شماره ۳، تنها محصولات واکنش تیتراسیون دارای جذب هستند. همچنین در منحنی شماره ۴، هم تیترانت و هم آنالیت دارای جذب هستند و نقطه تلاقی، نقطه همارزی است.
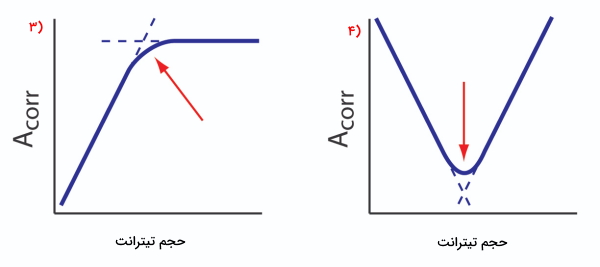
در منحنی تیتراسیون شماره ۵، هم محصولات واکنش تیتراسیون، هم آنالیت دارای جذب هستند. در نهایت منحنی شماره ۶ را داریم که در آن تنها شناساگر دارای جذب است.
مراحل انجام یک تیتراسیون کمپلکسومتری
در این بخش میخواهیم یک تیتراسیون کمپلکسومتری را مرحله به مرحله و با توجه به مطالب گفتهشده، مورد بررسی قرار دهیم. هدف از این تیتراسیون به دست آوردن میزان سختی آب در آب شهری و فاضلاب است. طبق تعریف، آب سخت دارای کاتیونهایی است که میتوانند با صابون، کمپلکسهایی نامحلول تشکیل بدهند.
همچنین رویت رسوب روی شیرهای آب، نشانهای از وجود آب سخت است.

کاتیونهای فلزی بسیاری میتوانند در سختی آب موثر باشند، با این حال دو کاتیون و مهمتر هستند و بیشتر مورد مطالعه قرار میگیرند. میزان سختی آب در تیتراسیون کمپلکسومتری با تیترانت EDTA در محیطی بافری با برابر با ۱۰ انجام میشود. در این تیتراسیون از کالماژیت به عنوان شناساگر استفاده میشود و در نهایت میزان سختی به دستآمده بر اساس میلیگرم در لیتر گزارش میشود. مراحل انجام این تیتراسیون را در ادامه مشاهده میکنید.
- حجم کمی از نمونه آب را انتخاب میکنیم، بهصورتی که برای تیتر کردن آن به کمتر از ۱۵ میلیلیتر از تیترانت نیاز باشد. در این صورت زمان انجام تیتراسیون طولانی نخواهد شد. (کمتر از ۵ دقیقه) در صورت نیاز میتوان نمونه را به کمک آب مقطر، رقیق کرد.
- مقدار محیط را به کمک محلول بافری روی ۱۰ تنظیم میکنیم. این محلول باید به مقدار بسیار کمی شامل کمپلکس منیزیم با EDTA باشد.
- ۱ تا ۲ قطره از شناساگر را به محیط تیتراسیون اضافه میکنیم.
- تیتراسیون را شروع میکنیم و تا تغییر رنگ از قرمز به آبی و رسیدن به نقطه پایان تیتراسیون ادامه میدهیم.
در زیر سه مرحله مختلف این تیتراسیون را مشاهده میکنید. پیش از انجام تیتراسیون، رنگ شناساگر به دلیل وجود کمپلکس منیزیم-شناساگر به رنگ قرمز است. سپس با افزودن قطرهقطره تیترانت و رسیدن به نقطه همارزی، رنگ بنفشی مشاهده میشود. در پایان نیز به دلیل وجود شناساگر آزاد، رنگ آبی قابل مشاهده خواهد بود.

در مورد این تیتراسیون تعدادی سوال را مورد بررسی قرار خواهیم داد.
چرا مقدار این تیتراسیون روی ۱۰ تنظیم میشود و چه مشکلی ممکن است در بالاتر ایجاد شود؟
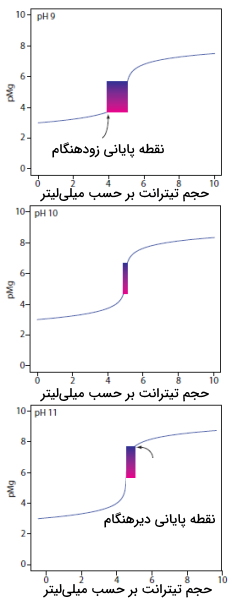
در بین کاتیونهایی که در سختی آب نقش دارند، کاتیون منیزیم، ضعیفترین کمپلکس را با EDTA تشکیل میدهد و آخرین کاتیونی است که تیتر میشود. شناساگر کالماژیت از این نظر سودمند است که نقطه پایان تیتراسیون را در پایان تیتر شدن منیزیم نشان میدهد. به دلیل ویژگی اسید و بازی شناساگر کالماژيت، محدوده که در آن شناساگر تغییر رنگ میدهد، به مقدار وابسته است.
در منحنیهای زیر تیتراسیون نمونهای ۵۰ میلیلیتری از منیزیم مولار را مشاهده میکنید. در این تیتراسیون از EDTA با مولاریته به عنوان تیترانت استفاده میشود و ۳ مقدار متفاوت برابر با ۹، ۱۰ و ۱۱ مورد بررسی قرار گرفتهاند. همانطور که در نمودارهای زیر مشاهده میکنید، در مقدار برابر با ۹، شاهد نقطه پایان زودهنگام هستیم. نقطه پایان دیرهنگام نیز در منحنی مربوط به مقدار برابر با ۱۱ مشاهده میشود.
چرا به بافر این تیتراسیون مقدار اندکی از کمپلکس منیزیم-EDTA افزوده میشود؟
نقطه پایان این تیتراسیون به کمک شناساگر کالماژیت مشخص میشود. نقطه پایانی این تیتراسیون با یون منیزیم واضح است اما تغییر رنگ آن، هنگام تیتر کردن کلسیم، نقطه پایان خوبی نیست. در این صورت اگر نمونه فاقد منیزیم به عنوان منبعی از سختی آب باشد، تشخیص نقطه پایان تیتراسیون مشکل خواهد بود و باعث ایجاد خطا و نتایج نادرست میشود. با افزودن مقدار کمی از کمپلکس منیزیم-EDTA به بافر، اطمینان حاصل میکنیم که نمونه حاوی حداقل مقدار منیزیم است. از آنجا که کمپلکس کلسیم با EDTA از منیزیم قویتر است، جایگزین آن میشود و منیزیم آزاد، میتواند با شناساگر تشکیل کمپلکس بدهد. این جایگزینی استوکیومتری را تغییر نمیدهد و غلظت کاتیونهای ایجادکننده سختی ثابت باقی میماند.
چرا بهتر است تیتراسیون بیش از ۵ دقیقه به طول نینجامد؟
زمانی که برای انجام واکنشی محدودیت زمانی پیشنهاد میشود، واکنشی جانبی وجود دارد که میتواند به وقوع بپیوندد و ایجاد تداخل کند. در این مورد واکنش تشکیل کلسیم کربنات در برابر با ۱۰ محتمل است.
انتخاب و استاندارد کردن تیترانت
اتیلن دیآمین تترا استیک اسید (EDTA) تیترانت بسیار پرکاربردی است و میتوان از آن برای آنالیز تمامی یونهای فلزی استفاده کرد، با این حال برای تیتر کردن آنیونها مناسب نیست. برای این موارد میتوان از و به عنوان تیترانت بهره برد.
محلول EDTA را میتوان از نمک دیسدیم انحلالپذیر آن با فرمول شیمیایی تهیه کرد. سپس این محلول را به کمک محلول استاندارد اولیه تیتر و استاندارد میکنیم. همچنین محلول و را میتوان به ترتیب از و ، که استاندارد ثانویه هستند، تهیه کرد. این محلولها را با استاندارد تیتر میکنند تا استاندارد شوند.

کاربرد تیتراسیون کمپلکسومتری
در طول زمان بسیاری از کاربردهای تیتراسیون کمپلکسومتری که برای اندازهگیری و کمیسازی مورد استفاده قرار میگرفتند، با روشهای تجزیهای دیگر جایگزین شدند. با این حال همچنان در برخی موارد از این روش استفاده میشود. در این بخش میخواهیم برخی از کاربردهای همچنان متدوال این روش را مورد بررسی قرار دهیم.
آنالیزهای آلی
تیتراسیون کمپلکسومتری همچنان یکی از روشهایی است که از آن برای اندازهگیری یونهایی مانند ، و در آب و فاضلاب استفاده میشود. پیش از این روش اندازهگیری سختی آب را بهطور کامل مورد بررسی قرار دادیم. میتوان علاوه بر کالماژيت از شناساگرهایی مانند مرکسید و اریو کروم بلک آر نیز برای سنجش غلظت کلسیم استفاده کرد.
سیانید را میتوان در غلظتهایی بیش از ۱ میلیگرم بر لیتر و در محیطی قلیایی شده توسط سدیم هیدروکسید، مورد مطالعه قرار داد. در این تیتراسیون از محلول به عنوان تیترانت استفاده میشود و کمپلکس به دست میآید. نقطه پایانی این تیتراسیون به کمک شناساگر «پارا-دیمتیل آمینو بنزال رودامین» (p-dimethylaminobenzalrhodamine) استفاده کرد که در حضور مازاد از زرد به نارنجی تغییر رنگ میدهد.
تیتراسیون کمپلکسومتری کلرید را میتوان با تیترانت انجام داد که طی آن محلول به وجود میآید. ابتدا نمونه را تا مقدار برابر با ۲/۳ تا ۳/۸ اسیدی میکنیم و از «دیفنیل کاربازون» (diphenylcarbazone) به عنوان شناساگر استفاده میشود. این شناساگر در حضور مقدار مازاد ، کمپلکسی رنگی تشکیل میدهد. در این تیتراسیون از شناساگر «زایلن سینول افاف» (Xylene Cyanol FF) استفاده میشود تا از اسیدی بودن محیط اطمینان حاصل کنیم. محلول ابتدایی در این تیتراسیون سبز آبی است و در نقطه تیتراسیون شاهد رنگ بنفش خواهیم بود.
نکات تکمیلی تیتراسیون کمپلکسومتری
تا اینجا با تیتراسیونهای کمپلکسومتری آشنا شدیم که در آنها یک یون فلزی با غلظت نامشخص، مورد بررسی قرار میگرفت. با این حال میتوانیم با کنترل شرایط، تیتراسیونهای پیچیدهتری را نیز با این روش انجام دهیم. میدانید که لیگاند EDTA با بیشتر یونهای فلزی کمپلکسهای قوی تشکیل میدهد اما با کنترل مقدار آنالیت میتوان نمونههایی با بیش از یک نوع یون فلزی را نیز مورد مطالعه قرار داد. این ویژگی را میتوانید در منحنی زیر مشاهده کنید.
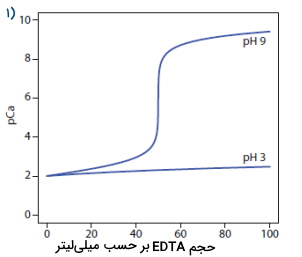
در تصویر شماره ۱، تیتراسیون در مقدار برابر با ۹ دارای شکستی واضح است زیرا ثابت تشکیل مشروط آن مقداری بزرگ و برابر با است. این مقدار ثابت تشکیل نشاندهنده این است که واکنش بین کلسیم و EDTA بهصورت کامل انجام میشود. به منحنی رسم شده در مقدار برابر با ۳ دقت کنید. در این مورد، مقدار ثابت تشکیل ۱/۲۳ و بسیار کوچک است و تنها مقدار اندکی از کلسیم با لیگاند EDTA وارد واکنش میشود.
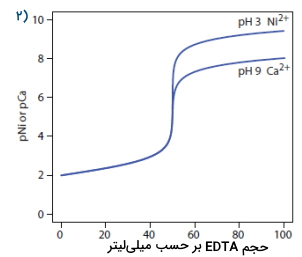
موقعیتی را تصور کنید که در آن میخواهیم مخلوطی از یونهای فلزی نیکل و کلسیم را مورد بررسی قرار دهیم. در تصویر شماره ۲، این مورد را مشاهده میکنید. هر دو این گونهها با لیگاند EDTA وارد واکنش میشوند اما ثابت تشکیل مشروط آنها با یکدیگر تفاوت بسیار زیادی دارد. با تنظیم مقدار روی ۳، میتوانیم بدون دخالت نیکل، کلسیم را تیتر کنیم. با پایان این تیتراسیون، مقدار را روی ۹ تنظیم و کلسیم را نیز تیتر میکنیم.
از تیتراسیون طیفسنجی نوری میتوان برای این مورد استفاده بهسزایی کرد. به تصویر بالا دقت کنید. در صورتی که جذب دو کمپلکس با یکدیگر تفاوت شاخصی داشته باشد، از آن برای تعیین مقادیر غلظت گونههای نامشخص بهره میبریم.
انواع تیتراسیون
تیتراسیون نامی عمومی است که به روشهایی نسبت داده میشود که از آنها برای سنجش غلظت یک گونه به کمک گونهای مشخص، استفاده میشود. این روش انواع گوناگونی دارد و در ادامه با برخی از این روشها آشنا خواهیم شد.
تیتراسیون برگشتی چیست ؟
از «تیتراسیون برگشتی» (Back Titration) برای تعیین غلظت یونهای فلزی استفاده میشود که توانایی تیتر شدن مستقیم با EDTA را ندارند. بسیاری از این یونها در محیط قلیایی، بهصورت نمک هیدروکسیدی خود تشکیل رسوب میدهند. در ادامه به بررسی این روش خواهیم پرداخت.
در این روش مقدار مازادی از محلول استاندارد EDTA به محلول آنالیت افزوده میشود. سپس این محلول به کمک یک بافر به مقدار مورد نیاز رسانده میشود و مقدار مازاد EDTA به کمک یک محلول استاندارد از یون فلزی دیگری، تیتر میشود. محلولهایی که معمولا به عنوان یون فلزی ثانویه مورد استفاده قرار میگیرند، شامل موارد زیر میشوند.
پس از تیتراسیون، نقطه پایانی به کمک شناساگری مناسب مشخص میشود. این شناساگر یون فلزی دوم را مد نظر قرار میدهد. در زیر مثالی از این واکنش را مشاهده میکنید. توجه داشته باشید که منظور از در این واکنش، تیترانت EDTA است.
در نقطه پایانی این تیتراسیون داریم:
در موارد زیر میتوان از تیتراسیون برگشتی استفاده کرد.
- تشکیل رسوب در غیاب EDTA
- واکنش بسیار کند با EDTA
- بلوکه کردن شناساگر
تیتراسیون جایگزینی
«تیتراسیون جایگزینی» (Replacement Or Substitution Titration) برای تعیین غلظت یونهای فلزی به کار میرود که با شناساگر فلز واکنش نمیدهند. (یا واکنش ناکارامدی میدهد) از این مورد میتوان به کلسیم، سرب، جیوه و آهن اشاره کرد. همچنین از این روش برای یونهای فلزی که از دیگر یونهای فلزی، کمپلکس قویتری تشکیل میدهند نیز بهره میبرند.
در این روش، یون فلزی دوم (منیزیم یا روی) جایگزین یون فلزی آنالیت میشود. معمولا تغییر رنگ یون فلزی اول واضح نیست و نمیتوان از آن برای پی بردن به نقطه پایان تیتراسیون بهره برد. در زیر واکنش این تیتراسیون را مشاهده میکنید.
مقداری از منیزیم که طی این واکنش آزاد میشود، با مقدار یون فلزی دوم برابر است. این کاتیون را میتوان به کمک محلول EDTA استاندارد تیتر کرد. در زیر مراحل مختلف این تیتراسیون را در جایگزینی با مشاهده میکنید.
مرحله جایگزینی
مراحل تیتراسیون
تیتراسیون قلیاییسنجی
وقتی محلول به محلول حاوی یونهای فلزی افزوده میشود، کمپلکس تشکیل میشود و دو اکیوالان از یون هیدرونیوم نیز، مانند واکنش زیر آزاد میشود.
بنابراین این یونهای هیدرونیوم را میتوان به کمک محلول استاندارد سدیم هیدروکسید تیتر کرد. در این تیتراسیون از شناساگرهای اسید و باز یا پتانسیومتر استفاده میشود.
تاریخچه تیتراسیون کمپلکسومتری
در سال ۱۹۴۵ شیمیدان سوئیسی، «جرالد شوارزن باخ» (Gerold Karl Schwarzenbach)، آمینو کربوکسیلیک اسیدها را به عنوان لیگاندهایی چنددندانه معرفی کرد. معروفترین و پرکاربردترین عضو این خانواده، اتیلن دیآمین تترا استیک اسید که به اختصار آن را با EDTA نمایش میدهند، کمپلکسی با نسبت ۱:۱ با بسیاری از یونهای فلزی تشکیل میدهد. این کمپلکسها اغلب بسیار قوی هستند و برای این منظور مناسب خواهند بود. معرفی لیگاندی با این ویژگیها باعث رواج تیتراسیون کمپلکسومتری به عنوان روشی کاربردی در روشهای تجزیهای شد.

مثال و حل تمرین از تیتراسیون کمپلکسومتری
تا اینجا با مفهوم تیتراسیون کمپلکسومتری و نحوه انجام آن آشنا شدیم. با این حال محاسبات مربوط به این تیتراسیون از جمله مهمترین موضوعاتی است که باید دانش انجام آنها را داشته باشیم. در این بخش تلاش میکنیم تا با حل مسائل متعدد، این توانایی را به دست بیاوریم.
مثال از تیتراسیون کمپلکسومتری
در این بخش تعدادی سوال را به همراه پاسخ تشریحی بررسی خواهیم کرد. مطالعه دقیق پاسخهای تشریحی به فراگیری توانایی حل مسائل کمک بهسزایی خواهد کرد.
مثال اول
غلظت محلول EDTA را به کمک تیتراسیون با محلول کلسیم به دست آمده از محلول استاندارد ، به دست آمده است. ابتدا ۰/۴۰۷۱ گرم از نمونه کلسیم کربنات به یک بالن ژوژه ۵۰۰ میلیلیتری منتقل و با مقدار اندکی از هیدروکلریک اسید ۶ مولار حل میشود و سپس به حجم رسانده میشود. در مرحله بعد ۵۰ میلیلیتر از این محلول به یک ارلن مایر منتقل و مقدار آن با استفاده از ۵ میلیلیتر بافر روی ۱۰ تنظیم میشود. این بافر شامل مقدار اندکی از کمپلکس منیزیم-EDTA است. بعد از افزودن مقداری از شناساگر کالماژيت، آنالیت به وسیله EDTA تیتر میشود. حجم مصرفی از تیترانت برای رسیدن به نقطه پایان تیتراسیون برابر با ۴۲/۶۳ میلیلیتر است. غلظت EDTA را به دست بیاورید.
پاسخ
غلظت محلول استاندارد اولیه کلسیم بهصورت زیر به دست میآید.
در مرحله بعد مولهای کلسیم موجود در آنالیت بهصورت زیر محاسبه میشود.
از آنجا که نسبت آنالیت و تیترانت ۱:۱ است، مولهای EDTA نیز به همین مقدار است. در مرحله پایانی مولاریته EDTA بهصورت زیر قابل محاسبه است.
مثال دوم
۱۰۰ میلیلیتر نمونه آب را برای سنجش سختی مورد بررسی قرار میگیرد. در این تیتراسیون کمپلکسومتری از ۲۳/۶۳ میلیلیتر تیترانت EDTA با مولاریته ۰/۱۰۹ استفاده میشود. سختی آب را بر حسب میلیگرم کلسیم کربنات بر لیتر گزارش دهید.
پاسخ
در مسائلی که مربوط به سختی آب است، فرض میکنیم که تنها کاتیون موجود کلسیم است، بنابراین جرم گونه در نمونه را بهصورت زیر به دست میآوریم. در این محاسبات ابتدا مول را به دست آورده و سپس تبدیل به جرم میکنیم.
با داشتن گرم کلسیم کربنات و جرم نمونه، خواهیم داشت:
مثال سوم
میخواهیم غلظت یون در ۱۰۰ میلیلیتر نمونه آب از یک سفره آب شیرین، در تیتراسیون با با مولاریته ۰/۰۵۱۶ را به دست آوریم. نمونه را اسیدی و برای شناسایی نقطه پایانی تیتراسیون از شناساگر دیفنیل کاربازون استفاده میکنیم. حجم مصرفی از تیترانت برای رسیدن به نقطه پایانی تیتراسیون برابر با ۶/۱۸ مول است. غلظت آنالیت را بر حسب میلیگرم بر لیتر محاسبه کنید.
پاسخ
واکنش بین و باعث تولید کمپلکس میشود. از روی فرمول شیمیایی میتوان متوجه شد که هر ۱ مول با ۲ مول واکنش میدهد. بنابراین برای محاسبه جرم یون کلر به شیوه زیر عمل میکنیم.
در ادامه برای محاسبه غلظت خواهیم داشت:
مثال چهارم
نمونهای ۰/۴۴۸۲ گرمی از ناخالص، به کمک ۳۹/۶۸ میلیلیتر با مولاریته ۰/۱۰۱۸ تیتر شده است. میزان خلوص این نمونه را بر حسب درصد جرمی محاسبه کنید.
پاسخ
تیتراسیون با منتهی به تولید کمپلکس فلز-لیگاندی بهصورت میشود. طبق این فرمول هر ۱ مول از با ۲ مول از وارد واکنش میشود. جرم در نمونه را میتوان به شکل زیر محاسبه کرد.
با در دست داشتن جرم آن، از رابطه زیر به درصد جرمی در نمونه پی میبریم.
$$ \mathrm{\dfrac{0.3959\;g\;NaCN}{0.4482\;g\;sample}times100=88.33%\;w/w\;NaCN} $$
درصد خلوص این نمونه ۸۸/۳۳ درصد است.
مثال پنجم
آلیاژ کرومل که شامل سه فلز نیکل، آهن و کروم است را به روش کمپلکسومتری با تیترانت EDTA تیتر کردهایم. در ابتدا ۰/۷۱۷۶ گرم از نمونه درون اسید نیتریک حل و سپس در بالن ژوژه ۲۵۰ میلیلیتری به حجم رسانده میشود. سپس ۵۰ میلیلیتر از محلول تهیهشده را جدا و به کمک ۲۶/۱۴ میلیلیتر از EDTA با مولاریته ۰/۰۵۸۳۱، با به کارگیری شناساگر مرکسید، تیتر میکنیم. آهن و کروم موجود در این نمونه را پیش از انجام تیتراسیون به کمک پیروفسفات، ماسک کردهایم. سپس ۵۰ میلیلیتر دیگر از نمونه را به کمک ۳۵/۴۳ میلیلیتر از همان EDTA و با همان شناساگر، تیتر میکنیم. در این تیتراسیون از هگزامتیل تترامین برای ماسک کردن کروم استفاده شده است. در نهایت نیز ۵۰ میلیلیتر دیگر از نمونه را به کمک ۵۰ میلیلیتر EDTA پالایش میکنیم و با ۶/۲۱ میلیلیتر از با مولاریته ۰/۰۵۸۳۱ تیتر میکنیم. با توجه به اطلاعات ارائه شده، وزن هر کدام از فلزهای موجود در نمونه این آلیاژ را پیدا کنید.
پاسخ
ابتدا باید به این نکته توجه کنیم که استوکیومتری EDTA و فلزهای این آلیاژ بهصورت ۱:۱ است و میتوان مولهای آنها را با یکدیگر برابر در نظر گرفت. این را برای هر کدام از تیتراسیونهای انجام شده، بهصورت زیر مینویسیم.
- تیتراسیون اول: تعداد مولهای نیکل= تعداد مولهای EDTA
- تیتراسیون دوم: تعداد مولهای نیکل + تعداد مولهای آهن= تعداد مولهای EDTA
- تیتراسیون سوم: تعداد مولهای نیکل + تعداد مولهای آهن + تعداد مولهای کروم + تعداد مولهای مس= تعداد مولهای EDTA
طبق روابط بالا، میتوانیم از تیتراسیون اول، تعداد مولهای نیکل را در ۵۰ میلیلیتر از آلیاژ حلشده بهدست بیاوریم. از آنجا که تعداد مولهای نیکل و EDTA در آن با یکدیگر برابر است، میتوانیم محاسبات را بهصورت زیر انجام دهیم.
با در دست داشتن تعداد مولهای نیکل، میتوانیم از تیتراسیون دوم به تعداد مولهای آن را نیز محاسبه کنیم.
از این مقدار صرف تیتر کردن نیکل شده است. با کم کردن این مقدار از مولهای به دست آمده EDTA در تیتراسیون دوم، متوجه میشویم که از EDTA صرف تیتر کردن آهن شده است و با توجه به نسبت ۱:۱ این دو، تعداد مولهای آهن نیز برابر با خواهد بود.
در نهایت نیز میتوانیم از تیتراسیون سوم برای به دست آوردن مولهای کروم استفاده کنیم.
از این مقدار صرف تیتر کردن آهن و صرف تیتر کردن نیکل و باقی برای تیتراسیون کروم و مس مصرف شده است. مولهای EDTA مصرفشده برای تیتراسیون مس نیز با توجه به مقادیر داده شده، قابل محاسبه است.
در اینصورت برای تیتر کردن کروم مول از EDTA مصرف شده است و این برابر با تعداد مولهای کروم نیز هست. در ادامه با در دست داشتن تعداد مولهای هر کدام از اجزا، میتوان درصد جرمی آنها را در این نمونه آلیاژ محاسبه کرد. این کار را بهصورت زیر انجام میدهیم.
$$ \mathrm{\dfrac{0.4472\;g\;Ni}{0.7176\;g\;sample}times100=62.32%\;w/w\;Ni}$$
$$ \mathrm{\dfrac{0.151\;g\;Fe}{0.7176\;g\;sample}times100=21.0%\;w/w\;Fe} $$
$$ \mathrm{\dfrac{0.119\;g\;Cr}{0.7176\;g\;sample}times100=16.6%\;w/w\;Fe} $$
مثال ششم
با توجه به ثابت تشکیل کمپلکسها در جدول زیر، به سوالها پاسخ دهید.
| یون فلزی | ثابت تشکیل کمپلکس با EDTA |
| منیزیم | |
| سرب | |
| باریم | |
| مس |
سوال ۱
اگر به محلولی حاوی ، مقداری از محلول حاوی کاتیون سرب افزوده شود، چه واکنشی صورت میگیرد؟
پاسخ
از آنجا که ثابت تشکیل کمپلکس سرب-EDTA از ثابت تشکیل کمپلکس منیزیم-EDTA بزرگتر است، سرب جایگزین منیزیم در کمپلکس میشود و منیزیم آزاد میشود.
سوال ۲
اگر به محلولی حاوی ، مقداری از محلول حاوی کاتیون باریم افزوده شود، چه واکنشی صورت میگیرد؟
پاسخ
هیچ واکنشی اتفاق نمیافتد زیرا ثابت تشکیل کمپلکس مس-EDTA از ثابت تشکیل کمپلکس باریم-EDTA بزرگتر است.
مثال هفتم
دو منحنی زیر مربوط به تیتراسیون یون کلسیم ۰/۰۵ مولار به کمک تیترانت EDTA با مولاریته ۰/۰۵ است. با توجه به آنها به سوالهای زیر پاسخ دهید.
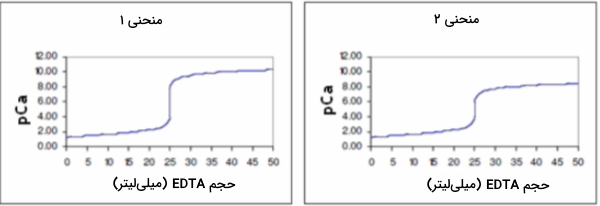
سوال ۱
کدام یک از منحنیها، نشاندهنده تیتراسیون در مقدار برابر با ۱۰ و کدام یک برابر با ۸ است؟
پاسخ
منحنی ۱ مربوط به مقدار برابر با ۱۰ است زیرا دارای شکست بزرگتری است. همچنین منحنی ۲، تیتراسیون در مقدار برابر با ۸ را نشان میدهد.
سوال ۲
چه حجمی از محلول کلسیم مورد استفاده قرار گرفته است؟
پاسخ
از آنجا که در هر دو مورد مقدار غلظت برابر است، ۲۵ میلیلیتر از محلول کلسیم استفاده شده است.
تمرین از تیتراسیون کمپلکسومتری
در این بخش، تعدادی سوال چندگزینهای را مورد بررسی قرار میدهیم. برای تصحیح محاسبات در بخش پاسخ تشریحی، میتوانید نحوه حل این تمرینها را مشاهده کنید.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
سوالات متدوال
تا اینجا با مفهوم تیتراسیون کمپلکسومتری و نحوه انجام آن آشنا شدیم. در این بخش میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن بپردازیم.
پرکاربردترین تیترانت در تیتراسیون کمپلکسومتری چیست ؟
اتیلن دیآمین تترا استیک اسید یا EDTA پرکاربردترین تیترانت مورد استفاده در تیتراسیون کمپلکسومتری است.
عوامل موثر بر ثابت تشکیل کمپلکس در تیتراسیون کمپلکسومتری چیستند ؟
مقدار pH محیط و حضور عوامل کمپلکسکننده فرعی بر ثابت تشکیل کمپلکس تاثیر میگذارند.
جمع بندی
هدف از این مطلب آشنایی با یکی از انواع روشهای تیتراسیونی، تیتراسیون کمپلکسومتری بود. در این روش، طی واکنش تیتراسیون، یک کمپلکس تشکیل میشود و از روی آن میتوان غلظت گونه نامشخص آنالیت را به دست آورد. در بیشتر موارد از EDTA با غلظت مشخص بهعنوان تیترانت کمپلکسومتری استفاده میشود. این مولکول توانایی تشکیل کمپلکس با تمامی یونهای فلزی را با نسبت ۱:۱ دارد. در ادامه با روش انجام این تیتراسیون و محاسبات مرتبط با آن بیشتر آشنا شدیم و مثالهای متعددی را مورد بررسی قرار دادیم.












