دفاع اختصاصی بدن چیست؟ – سیستم ایمنی به زبان ساده
چند دقیقه از یک روز خود در مدرسه را تصور کنید. از خواب بیدار میشوید. صبحانه میل میکنید. لباس مدرسه را میپوشید. کیف خود را برمیدارید. دکمه آسانسور را فشار میدهید و پس از بیرون آمدن از منزل سوار اتوبوس، تاکسی، مترو یا سرویس مدرسه میشوید. برای انجام همه این کارها با اجسام و محیطی در ارتباط هستید که ممکن است محل زندگی میلیونها میکرواورگانیسم باشد. اگر یکی از این میکرواورگانیسمها (باکتری، قارچ، آغازیان، انگل و ویروس) وارد بدن شما شود چه اتفاقی میافتد؟ ممکن است به انوع بیماریها مبتلا شوید. اما بدن شما یک سد قویی دفاعی برای مقابله با میکرواورگانیسمها تشکیل داده است. دفاع اختصاصی و غیر اختصاصی دو بخش از سیستم ایمنی ما است که از بدن در برابر انواع میکرواورگانیسمها دفاع میکند. در این مطلب دفاع اختصاصی و چگونگی مقابله آن با میکرواورگانیسمها را توضیح میدهیم.
- خواهید آموخت که سیستم ایمنی از دو بخش اختصاصی و غیر اختصاصی تشکیل شده است.
- میآموزید که لنفوسیتهای «B» و «T» چه نقشهایی در دفاع اختصاصی دارند.
- یاد میگیرید ساختار آنتیبادیها و عملکرد انواع مختلف ایمونوگلوبولینها چیست.
- میآموزید دفاع هومورال و سلولی چگونه علیه پاتوژنها واکنش نشان میدهند.
- خواهید توانست تفاوت ایمنی فعال و غیرفعال را توضیح دهید.
- با بیماریهای خودایمنی و اصول مقابله با آنها آشنا میشوید.
دفاع اختصاصی چیست ؟
سیستم دفاعی بدن انسان از دو مسیر اصلی برای مقابله با میکروبها و عوامل بیماریزا استفاده میکند. دفاع غیراختصاصی اولین مسیر مقابله با میکروبها است که از ورود عامل بیماریزا جلوگیری میکند. زخمی که پس از خراش روی پوست دست شما ایجاد میشود در نتیجه فعال شدن سیستم ایمنی بدن و پاسخ دفاع غیراختصاصی است. در این شرایط گلبولهای سفید به محل آسیب میرسند و از تکثیر میکروبهای جلوگیری میکنند. این زخمها پس از هر بار خراش پوستی ایجاد میشوند. اما تا به حال به این نکته توجه کردهاید که چرا تنها یکبار به بیماریهایی مثل سرخک یا آبلهمرغان مبتلا میشوید؟ پاسخ این سوال در فعالیت دفاع اختصاصی بدن است. دفاع اختصاصی بدن از سلولهایی به نام لنفوسیت تشکیل میشود که مکانیسمهای دفاعی بدن را بر اساس نوع مولکول بیماریزا در میکروبها تعیین میکنند. به همین دلیل اگر میکروب برای بار دوم وارد بدن شما شود، قبل از تکثیر و بیمار کردن شما از بین میرود.
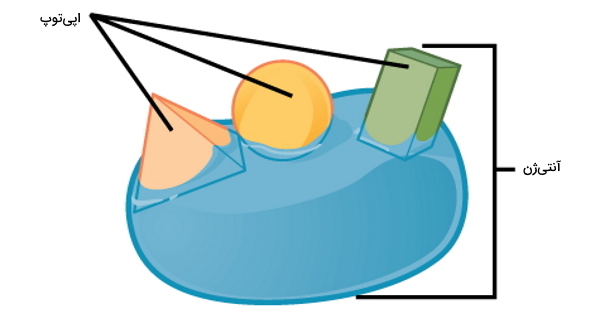
قبل از توضیح دفاع اختصاصی لازم است با بعضی اصطلاحات سیستم ایمنی آشنا شویم. هر موجود زندهای که پس از ورود به بدن شما منجر به فعال شدن و ایجاد پاسخ ایمنی و بیماری شود، پاتوژن نام دارد. باکتریهای، ویروسها و قارچها پاتوژنهایی هستند که دفاع اختصاصی بدن را فعال میکنند. مولکولهای غشایی پاتوژنها و سلولهای توموری، توکسین باکتریها، DNA یا RNA ویروسی و ذرات معلق هوا که سیستم ایمنی بدن را فعال و پاسخ ایمنی ایجاد میکنند، آنتیژن یا پادگن نام دارند. در هر آنتیژن توای خاصی از آمینواسیدها، کربوهیدراتها یا گلیکولیپیدها وجود دارد که سیستم ایمنی بدن برای شناسایی آن پادتن (آنتیبادی) تولید میکند. به این توالی اپیتوپ گفته میشود. در ادامه این مطلب انواع دفاع اختصاصی، سلولها و مکانیسمهای آن را بررسی میدهیم.
انواع دفاع اختصاصی چیست ؟
دفاع غیر اختصاصی یا اکتسابی بدن برخلاف دفاع غیراختصاصی که با مشارکت تعداد زیادی از گلبولهای سفید خون (نوتروفیل، ماستسل، بازوفیل، ائوزینوفیل و ماکروفاژ) انجام میشد، به یک گروه از سلولهای ایمنی به نام لنفوسیتهای B و لنفوسیتهای T نیاز دارد. این سلولها از تمایز سلولهای بنیادی خونساز در مغز استخوانهای پهن (شانه و لگن) تولید میشوند. اما در مسیرهای مختلفی بالغ میشوند. در سیستم ایمنی افراد سالم، این لنفوسیتها آنتیژنهای سطح سلولهای بدن را شناسایی نمیکنند. اما در بیماریهای خودایمنی و سرطانها با پاتوژن تشخیص دادن آنتیژن این سلولها پاسخ ایمنی ایجاد میکنند. بر این اساس دفاع اختصاصی بدن به دو نوع ایمنی سلولی (با مشارکت لنفوسیتهای T) و ایمنی هومورال یا محلول در خون (با مشارکت لنفوسیتهای B) تقسیم میکنیم.
دفاع اختصاصی لنفوسیت B
لنفوسیتهای B تولید شده در مغز استخوان میمانند و مراحل بالغ شدن را تکمیل میکنند. به همین دلیل به آنها سلولهای B (حرف اول استخوان در زبان انگلیسی | Bone) گفته میشود. این سلولها آنتیژنهای محلول در خون یا لنف را شناسایی و با ترشح آنتیبادی از بین رفتن آنها بهوسیله فاگوسیتها را تسهیل میکنند.
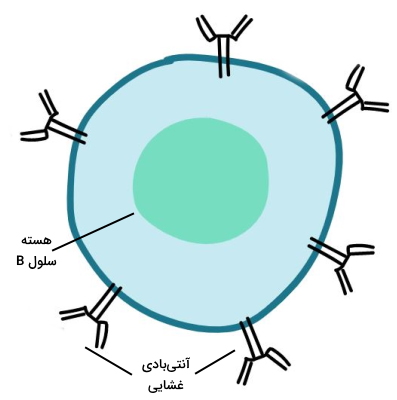
لنفوسیت B تولید شده در مغز استخوان پس از بلوغ به «سلول B اولیه» (Naive B Cell) تبدیل میشود. در غشای پلاسمایی این سلولها گیرندههای اختصاصی برای آنتیژنهای مختلف وجود دارد. این گیرندهها پروتئینهای عرض غشایی هستند که به آنها آنتیبادیهای غشایی (آنتیبادی D و M) گفته میشود. پروتئينهای عرض غشایی و به شناسایی آنتیژنها کمک میکنند. سلول B اولیه در سیستم لنفاوی با آنتیژنهای محلول برخورد کرده و فعال میشود. هر سلول B فقط به یک نوع آنتیژن پاسخ میدهد.
پس از فعال شدن سلولهای B اولیه، آنتیژن متصل شده به آنتیبادی با فرایند اندوسیتوز وارد سیتوپلاسم سلولهای B اولیه میشود و پس از تغییرات درونسلولی دوباره در غشا قرار میگیرد. این آنتیژن بهوسیله سلولهای Th2 شناسایی میشود. Th2 پس از اتصال به این آنتیژنها، سیتوکینهایی ترشح میکند که با اتصال به گیرندههای لنفوسیت B سبب فعال شدن مسیر میتوزی و تولید تعداد زیادی سلول B میشود. یکی از دو سلول ایجاد شده از این تقسیم کاملا شبیه سلول B اولیه است که به آن سلول B خاطره گفته میشود و سلول دیگر به سلول پلاسما تمایز مییابد. آنتیبادیهای سطحی در سلولهای B خاطره همان آنتیبادی است که در سطح سلولهای B اولیه وجود داشت. سلول پلاسما همان آنتیبادی سلولهای B اولیه را تولید میکند. اما این آنتیبادیها به جای اتصال در غشای پلاسمایی در فرایند اگزوسیتوز به خون ترشح میشوند.
آنتی بادی دفاع اختصاصی
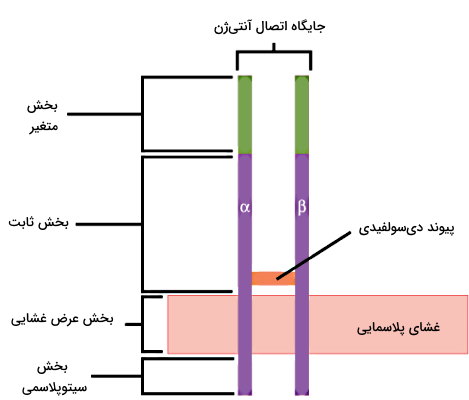
آنتیبادی، پادتن یا ایمونوگلوبولین، پروتئینی با چهار زنجیره پلیپپتیدی (دو زنجیره سبک و دو زنجیره سنگین) است. این زنجیرههای پلیپپتیدی با پیوند دیسولفیدی به هم متصل شدهاند. وزن مولکولی هر زنجیره سبک (Light Chain) حدود ۲۲ کیلودالتون و وزن مولکولی هر زنجیره سنگین (Heavy Chain) حداقل ۵۰ کیلودالتون است. در پستانداران ۵ نوع زنجیره سنگین (آلفا ، گاما ، اپسیلون ، دلتا و مو ) و دو نوع زنجیره سبک (لامبدا و کاپا ) وجود دارد.
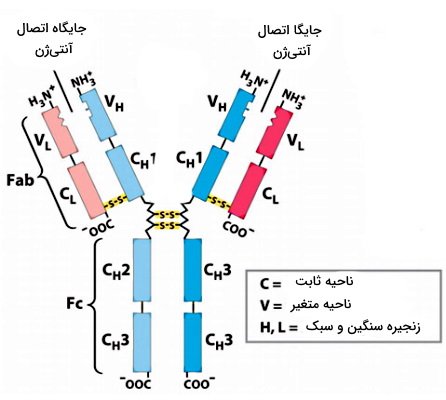
در هر زنجیره سبک و سنگین توالی ۱۰۰ تا ۱۱۰ آمینواسیدی وجود دارد که در هر آنتیبادی متفاوت است. این ناحیه که برای اتصال به آنتیژنهای مختلف اختصاصی شده، ناحیه متغیر (Variable Region) نام دارد. سایر آمینواسیدهای این دو زنجیره بین انواع مختلف پادتن تغییر نمیکند به آن ناحیه ثابت (Constant Region) گفته میشود. پنج نوع، ایزوتیپ یا کلاس از پادتنها در بدن پستانداران تولید میشود.
- ایمونوگلوبولین G: آنتیبادی G یا IgG پروتئین مونومری است که بهوسیله سلولهای پلاسما در دفاع اختصاصی اولیه و ثانویه ترشح میشود. فراوانی این آنتیبادی در سیستم ایمنی از سایر آنتیبادیها بیشتر است و با عبور از جفت، در جنین ایمنی غیرفعال ایجاد میکند. این آنتیبادی در سه فرایند اوپسونیزاسیون، خنثیسازی و رسوب آنتیژنها نقش دارد.
- اوپسونیزاسیون: ناحیه متغیر IgG به مولکولهای آنتیژن سطح باکتریها متصل میشود و اثر پروتئینهای مکمل دفاع اختصاصی بر باکتریها را افزایش میدهد.
- خنثیسازی: IgG به آنتیژنهای سطح ویروسها متصل میشود و از آلود شدن سلولهای سالم جلوگیری میکند.
- رسوب آنتیژن: اتصال IgG به آنتیژنهای محلول در خون، مخاط و مایع میانبافتی فاگوسیتوز این مولکولها بهوسیله ماکروفاژ را افزایش میدهد.
- ایمونوگلوبولین A: آنتیبادی A یا IgA دیمری است که مونومرهای آن در ناحیه Fc به هم متصل میشوند. این آنتیبادی در ترشحات بدن ازجمله عرق پوست، مخاط پوست، مجاری ادراری تناسلی و لوله گوارش، بزاق و شیر مادر وجود دارد. چهار جایگاه اتصال به آنتیژنی که در IgA قدرت این آنتیبادی در خنثیسازی باکتریها را افزایش میدهد.
- ایمونوگلوبولین M: آنتیبادی M یا IgM به دو شکل مونومر و پنتامر ترشح میشود. زیرواحدهای پروتئینی در IgM پنتامر بهوسیله پروتئین J در بخش Fc به هم متصل هستند. این آنتیبادی در پاسخ ایمنی اولیه ترشح میشود. مونومرهای این آنتیبادی با اتصال به آنتیژنهای سطحی باکتری اپسونیزاسیون را افزایش میدهند. یا در غشای سلولهای B قرار میگیرند. اما اگر خونی با گروه خونی متفاوت به شما تزریق شود، پنتامرهای IgM وارد عمل میشوند. این آنتیبادیها با اتصال به آنتیژنها سطحی گلبول قرمز اهدایی منجر به ایجاد لخته یا «آگلوتیناسیون» (Agglutination) میشوند.
- ایمونوگلوبولین E: آنتیبادی E یا IgE پروتئینی مونومر با غلظت بسیار کم در پلاسما است که در مخاط سیستم تنفسی، مجاری ادراری تناسلی و زیرمخاط رگهای خونی وجود دارد. این آنتیبادیها به گیرندههای غشایی ماستسلها متصل میشوند و در پاسخ به آلرژن و انگل نقش دارد.
- IgE پس از اتصال به آلرژنها (برای مثال گرده گل) ماستسل را فعال میکنند. ماستسل فعال شده مولکولهای شیمیایی (هیستامین، لوکوترین و پروستوگلاندین) ترشح میکند. این مولکولها با افزایش قطر و نفوذپذیری رگ منجر به ایجاد ادم و مسدود شدن مسیرهای تنفسی میشوند. به علاوه اتصال این مولکولها یه گیرندههای ماهیچههای صاف نایژه با انقباض این سلولها، کاهش قطر نایژه، افزایش مقاومت مسیر تنفسی به هوا و تنگی نفس همراه است. این پاسخ به آلرژن شوک آنافیلاکسی نام دارد.
- IgE به گیرندههای ائوزینوفیلها متصل میشو و پس از برخورد با آنتیژنهای انگلی این سلولها را فعال میکند. ائوزینوفیل فعال شده با ترشح مولکولهای شیمیایی انگل را از بین میبرد.
- ایمونوگلوبولین D: آنتیبادی D یا IgD پروتئینهای مونومری هستند که پس از تغییرات پس از ترجمه در دستگاه گلژی به غشای پلاسمایی منتقل میشوند. بخش Fc این آنتیبادیها در غشای پلاسمایی قرار میگیرد. IgD آنتیبادی ترشحی نیست.
نوترکیبی آنتی بادی
هر ژن آنتیبادی در لنفوسیتهای B از یک ناحیه «متغیر» (Variable)، یک ناحیه «تنوع» (Diverse)، یک ناحیه «اتصالی» (Joining) و یک بخش «ثابت» (Constant) تشکیل شده است. چهار ژن متفاوت در هر یک از ناحیههای V، D و J وجود دارد. در هربار نوترکیبی لنفوسیت T یکی از این ژنهای چهارگانه از هر قسمت را انتخاب و به هم متصل میکند. در نتیجه هر mRNA ایجاد شده پس از کدونهای متفاوتی تشکیل میشود که به یک آنتیبادی جدید ترجمه خواهند شد. بر اساس انتخاب تصادفی این ژنها ۱۰،۰۰۰۰ تا ۲۰،۰۰۰۰ آنتیبادی منحصر به فرد تولید میشود که به آنتیژنهای مختلف پاسخ میدهند.
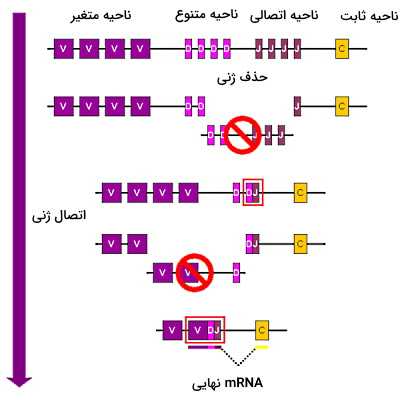
دومین مکانیسم نوترکیبی برای ایجاد آنتیبادیهای متنوع، جهش نقطهای در ژنهای ناحیه متغیر زنجیر سبک و سنگین آنتیبادی است. این جهش در سلولهای B فعال که با سرعت زیادی تقسیم، ایجاد میشود. برای این نوترکیبی در هر تقسیم حداقل یک نوکلئوتید در ناحیه متغیر با نوکلئوتید دیگر جایگزین میشود. در نتیجه لنفوسیت B در پاسخ به هر آنتیژن، آنتیبادی منحصر به فرد تولید میکند. به علاوه تمایل آنتیبادی به آنتیژن (قدرت پیوند آنتیبادی-آنتیژن) تغییر میکند. این جهش پس از نوترکیبی V(D)J ایجاد میشود و به کمک Th نیاز دارد.
سومین نوترکیبی آنتیبادی پس از برخورد اول با آنتیژن و در ناحیه ثابت ایجاد میشود این نوترکیبی با تغییر کلاس پروتئین و ایجاد یک ایزوتیپ جدید همراه است. برای مثال اگر آنتیبادی M پس از برخورد با آنتیژنهای یک نوع باکتری گرم منفی تولید شده باشد، این جهش آنتیبادی را به آنتیبادی G علیه همان باکتری تبدیل میکند. آنتیبادیهای تولید شده بهوسیله این جهش در بخشهای مختلف سیستم ایمنی مشارکت میکنند.
دفاع اختصاصی لنفوسیت T
لنفوسیتهای T تولید شده از مغز استخوان بهوسیله سیستم لنفاوی به غده تیموس (زیر استخوان جناغ و بالای قلب) منتقل میشوند. به همین دلیل به آنها سلولهای T (حرف اول تیموس | Thymus) گفته میشود. این غده در زمان کودکی فعال است و پس از آن به بافت فیبروزی و غیرفعال تبدیل میشود. در نتیجه تمام لنفوسیتهای T بدن شما قبل از بزرگسالی تولید شدهاند. لنفوسیتهای T ابتدایی بهوسیله فرایند کموتاکسی به غده تیموس منتقل میشوند. این غده مولکولهای شیمیایی (تیموزین، تیموتاکسین، تیموپوئتین و فاکتورهای تیموسی) در لنف ترشح میکند که با برهمکنش با مولکولهای غشایی لنفوسیت T نابالغ این سلول را به تیموس جذب میکنند.
مولکولهای شیمیایی ترشح شده از سلولهای تیموسی بیان و نوترکیبی ژنهای گیرنده سلولهای T را تحریک میکنند. این گیرندهها (TCRs) پس از تغییرات پس از ترجمه به وسیله وزیکولهای گلژی به غشای سلول ایمنی منتقل میشوند. «پروتئین دسته تمایزی» (Cluster of Differentiation) یا CDs گروه دیگری از پروتئینهای غشای لنوفسیت T هستند که در پاسخ به مولکولهای ترشح شده از سلولهای تیموس سنتز شده و در غشای پلاسمایی قرار میگیرند. CD4 و CD8 دو گروه اصلی این مولکولها هستند که در لنفوسیتهای تیموسی تشکیل میشوند. اگر این گیرندهها با آنتیژنهای طبیعی سلولهای تیموسی (MHCI و MHCII) برهمکنش کاملی داشته باشند، لنفوسیت تشکیل شده مسیر تکامل در تیموس را ادامه میدهد. اما اگر یکی از این مولکولها رابطه مکملی ناقصی داشته باشد، مسیر آپوپتوز در لنفوسیت فعال خواهد شد.
MHCI آنتیژن سطحی تمام سلولهای هستهدار بدن است. به همین دلیل اگر TCRs تشکیل شده در لنفوسیت تیموسی مکمل این مولکول باشد، سلول وارد آپوپتوز میشود تا از آسیب به سلولهای سالم بدن جلوگیری شود. اما رابطه مکملی آنتیژن-آنتیبادی بین این دو مولکول وجود نداشته باشد، لنفوسیت تیموسی مراحل تکامل خود را ادامه میدهد.
این سلولهای ایمنی پس از تکامل از تیموس خارج شده در قشر غدد لنفاوی، کنار رگهای طحال، مخاط سیستم تنفسی و لوله گوارش قرار میگیرند. لنفوسیتهای T سلولهای آلوده به پاتوژن و سلولهای توموری را شناسایی و پاسخ ایمنی ایجاد میکنند. به همین دلیل به دفاع اختصاصی آنها، ایمنی سلولی گفته میشود. لنفوسیتهای T از چهار مسیر مختلف در دفاع اختصاصی بدن شرکت میکنند.
- گروهی از سلولهای T در پاسخ به نوتروفیلها و ماکروفاژهای دفاع غیراختصاصی فعال میشوند و با ترشح مولکولهای سیتوکین پاتوژنها را از بین میبرند.
- گروه دوم سلولهای T با فعال کردن سلولهای B اولیه، ترشح آنتیبادی و حذف پاتوژنها را تحریک میکنند.
- گروه سوم این سلولها در پاسخ به پیام سلولهای ارائهکننده آنتیژن، سلولهای آلوده را از بین میبرند.
- گروه چهارم این سلولها پاسخ به آنتیهای خودی بدن را مهار میکنند.
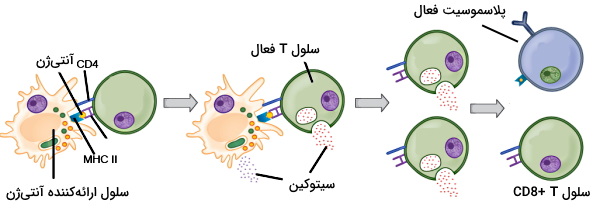
CD یکی از گلیکوپروتئينهای اختصاصی در غشای لنفوسیتهای T است که نوع رابطه لنفوسیت با سلولهای ارائهکننده آنتیژن را مشخص میکند. بر این اساس لنفوسیتهای T را به دو دسته و تقسیمبندی میکنیم. سلولهای به آنتیژنهای MHC II در غشای سلولهای ارائهکننده آنتیژن متصل میشوند. اتصال آنتیژن-گیرنده در این سلوولها منجر به تمایز لنفوسیت T اولیه به لنفوسیت T کمککننده یا Th خواهد شد. Th فعال شدن سلولهای B اولیه را تحریک میکند و با ترشح سیتوکینها وجود آنتیژن را به گلبولهای سفید بیشتر اطلاع میدهد.
Th1 و Th2 دو نوع سلول T کمککننده هستند که مسیرهای ایمنی متفاوتی را فعال میکنند. Th1 در پاسخ به ماکروفاژها فعال میشوند. بعضی باکتریها ازجمله مایکوباکتریوم توبرکلوزیس، سیستم دفاعی دارند که پس از فاگوسیتوز شدن، نه تنها در ماکروفاژ تجزیه نمیشوند، بلکه ماکروفاژ محیطی برای تکثیر آنها است. اتصال گیرنده لنفوسیتی به MHC II در سطح این ماکروفاژها با ترشح سیتوکین، فعال شدن آنزیمهای تجزیه باکتری در ماکروفاژ و از بین رفتن پاتوژن همراه است.
اتصال لنفوسیتهای به MHC I همراه آنتیژن در غشای سلولهای ارائهکننده آنتیژن یا سلولهای آلوده به ویروس، واکنشهای درونسلولی و مسیرهای تمایز به سلولهای T کشنده (Cytotoxic T Lymphocytes | CTLs) را فعال میکند. CTLها با ترشح پرفورین و گرانزیم سلول آلوده به را از بین میبرند و با ترشح سیتوکینها وجود آنتیژن را به گلبولهای سفید بیشتر اطلاع میدهد. پرفورینها در غشای پلاسمایی سلول آلوده کانالهایی ایجاد میکنند و گرانزیم، پروتئازی است که پس از ورود به سیتوپلاسم ساختارهای پروتئینی سلول را از بین میبرد.
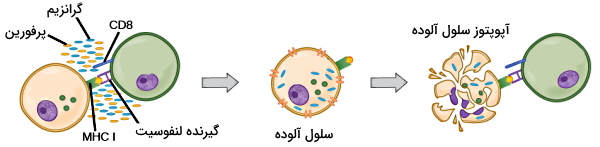
CLT علاوه بر سلولهای آلوده به ویروس، آنتیژن سطحی سلولهای توموری را شناسایی و آپوپتوز این سلولها را تحریک میکنند. یکی از تغییرات ژنتیکی سلولهای توموری تغییر ژن مولکولهای MHCI است. در این شرایط لنفوسیت T کشنده MHCI در غشای این سلولها را به عنوان آنتیژن غیرخودی میشناسد. لنفوسیتهای T از همین مکانیسم برای شناسایی MHC در پیوند عضو استفاده میکنند. در این شرایط لنفوسیت T آنتیژنهای سطحی سول اهداکننده را غیرخودی میشناسد و در برابر آن پاسخ ایمنی اجاد میکند. برای جلوگیری از این مکانیسم پس از جراحی برای افراد داروهای «مهارکننده سیستم ایمنی» (Immune Suppressor) تجویز میشود.
سلولهای T مهارکننده یا تنظیمی () از تمایز سلولهای Th و CTL در پاسخ به سیتوکینها به وجود میآیند. این سلولها تکثیر و تمایز لنفوسیتها به انواع کمککننده و کشنده پس از از بین رفتن پاتوژن جلوگیری میکنند. وجود پروتئینهای عرض غشایی CD25 و FOXP3 آنها را از ردههای سلولی کمککننده متمایز میکند. مکانیسم دقیق این سلولها برای مهار سیستم ایمنی مشخص نیست اما چند مکانیسم احتمالی برای عملکرد آنها پیشنهاد شده است.
- با ترشح سیتوکینهای مهاری ازجمله IL35، IL10 و ار فعال شدن لنفوسیتها جلوگیری میکنند.
- با سنتز و ترشح گرآنزیم B آپوپتوز سلولها T را فعال میکنند.
- با ترشح اندول آمین ۲،۳- دیاکسیژناز پیامرسانی معکوس را در سلولهای دندریتی فعال میکنند. در نتیجه پیامهای فعال شدن سلول T مهار میشود.
- افزایش غلظت IL-2 در خون با مکانیسم بازخورد منفی افزایش پاسخ ایمنی در بدن را به اطلاع میدهد و پاسخ ایمنی مهار میشود.
گیرنده لنفوسیت T
گیرندههای لنفوسیت T، پروتئینهای عرض غشایی دیمری هستند که با پیوند دیسولفیدی به هم متصل میشوند. این پروتئینها از یک بخش متغیر و یک بخش ثابت تشکیل میشوند. بخش متغیر از توالی آمینواسیدی تشکیل شده است که به دلیل جهش یا نوترکیبی ژنتیکی در سلولهای بنیادی پیشساز لنفوسیت ایجاد شده است. این بخش از گیرنده به آنتیژنها متصل میشود. بخش ثابت از سه بخش خارج غشایی، عرض غشایی و درون سیتوپلاسمایی تشکیل شده است. این بخش در حفظ ساختار گیرنده و انتقال پیام آنتیژن به مسیرهای درونسلولی نقش دارد. ایجاد تنوع در این گیرندهها با همان مکانیسمهای نوترکیبی در ژنهای آنتیبادی ایجاد میشود.
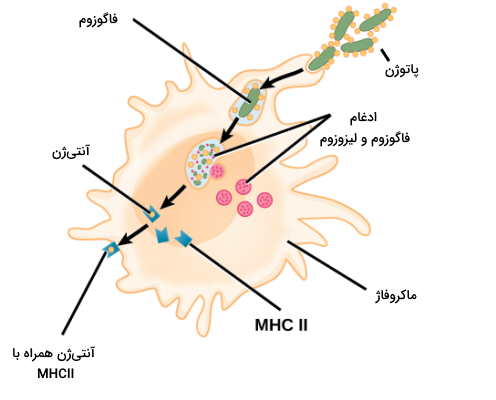
ارتباط دفاع غیر اختصاصی و اختصاصی
سلولهای ارائهکننده آنتیژن (APC) گلبولهای سفید سیستم ایمنی ذاتی یا دفاع غیراختصاصی بدن هستند که به شناسایی آنتیژن در دفاع اختصاصی کمک میکنند. سلولهای دندریتی (در پوست، لایه پوششی بینی، ریه، معده و رودهها) و ماکروفاژها، سلولهای ارائهکننده آنتیژن اصلی در سیستم ایمنی هستند. گیرندههای پروتئینی در غشای پلاسمایی این سلولها پاتوژنهای ورودی به بدن را شناسایی و فاگوسیتوز میکنند. فاگوزوم در سیتوپلاسم با لیزوزوم گلبول سفید ادغام میشود و همه ساختارهای سلولی پاتوژن به جز آنتیژنها را از بین میبرد. آنتیژنها در سلول تغییر میکنند و به شکل آنتیژنهای سطح سلولی MHC II و MHC I به غشای برمیگردند. لنفوسیتهای B و T بخش آنتیژنی MHCII را شناسایی و به آن پاسخ میدهند. در بخش قبلی توضیح دادیم که لنفوسیتهای T بدون برهمکنش با مولکولهای MHC و سلولهای ارائهکننده آنتیژن فعال نمیشوند.
سوالات متداول
در این بخش به تعدادی از سوالات متداول پیرامون دفاع اختصاصی بدن پاسخ میدهیم.
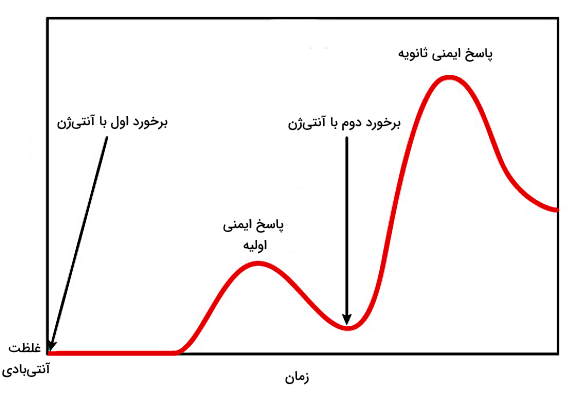
چرا پاسخ ایمنی در برخورد دوم از برخورد اول بیشتر است ؟
در برخورد اول با آنتیژن سلولهای B به دو نوع سلول پلاسما و سلول B خاطره تقسیم میشوند. سلولهای پلاسما پس از ترشح آنتیبادی و پایان عفونت با آپوپتوز از بین میشوند. سلولهای B خاطره در بدن باقی میمانند و در برخورد دوباره با همان میکروب، آنتیژنها را سریعتر و بدون نیاز به سلولهای ارائهکننده آنتیژن یا سلولهای T کمککننده شناسایی میکنند. در نتیجه بدن سریعتر به آنتیژن پاسخ میدهد. سلولهای B خاطره از پلاستوسیتها آنتیبادی بیشتری ترشح میکنند. اگر میکروب دوباره وارد بدن نشود، سلولهای خاطره پس از چند ماه یا سال از بین میشوند. به علاوه اولین آنتیبادی که برخورد با پاتوژنها تولید میشود. پس از تقسیم و تشکیل کلونی سلولهای B آنتیبادی G ترشح میشود. جایگاه اتصال به آنتیژن در IgG از IgM تمایل بیشتری به آنتیژن دارد. به همین دلیل IgG پاسخ قویتری به آنتیژن ایجاد میکند. در برخورد دوم با آنتیژن IgG بیشتری تولید میشود.
دفاع غیراختصاصی حشرات چیست ؟
حشرات موجوداتی هستند که در زیستگاههای بسیار متنوعی زندگی میکنند و در تماس با عوامل بیماریزای متنوعی قرا دارند. در سیستم ایمنی این موجودات برخلاف پستانداران دفاع اختصاصی وجود ندارد، اما دفاع غیراختصاصی آنها از سدهای فیزیکی، مولکولهای شیمیایی همولنف و سلولهایی تشکیل شده است که با از بین بردن عوامل بیماریزا از حشره محافظت میکند.
- سدفیزیکی: اولین سد فیزیکی ایمنی در حشرات دو لایه پوست خارج یو داخلی است. پوست خارجی این موجودات از یک لایه سلول پوشیده شده با چند لایه پلیمرهای متراکم و محکم کوتیکول (پلیساکارید N-استیل گلوکز آمین) تشکیل شده است. پوشش داخلی این موجودات یک لایه غشایی از جنس گلیکوپروتئین و کیتین است که از اندامهای داخلی حشره را محافظت میکند.
- سد شیمیایی: اگر باکتریها از سد فیزیکی اولیه عبور کنند، پاسخ شیمیایی بدن حشرات فعال میشود. در این پاسخ بدن با سنتز پپتیدهای ضدباکتری، فعال شدن پروفنولواکسیداز و تولید رادیکالهای آزاد باکتریهای مهاجم را از بین میبرد.
- سد سلولی: پاسخ سلولی حشرات به عوامل بیماریزا بخشی از دفاع غیراختصاصی این موجودات است و در سه مرحله تشکیل غده، تشکیل کپسول و فاگوسیتوز از بیمار شدن حشره بهوسیله پاتوژنها جلوگیری میکند. گرانولوسیتها، پلاسماتوسیتها، اسفرولوسیتها و اونوسیتوئیدها سلولهای ایمنی حشرات هستند که در همولنف (مایعی شبیه خون پستانداران برای تبادل مواد غذایی) وجود دارند.
چرا دفاع اختصاصی سریع نیست ؟
در دفاع اختصاصی سلولهای ایمنی از قبل در خون وجود دارند و مهاجرت آنها به محل عفونت و ایجاد پاسخ سریعتر انجام میشود. اما در دفاع اختصاصی سلولهای B باید در برخورد با آنتیژن فعال و تکثیر شوند تا با ترشح آنتیبادی یا سیتوکینها پاتوژن و سلولهای آلوده به پاتوژن را از بین ببرند. مرحله تکثیر و فعال شدن سبب میشود پاسخ دفاع اختصاصی در اولین برخورد با عامل بیماریزا سریع ایجاد نشود.
تفاوت دفاع اختصاصی و غیر اختصاصی چیست ؟
دفاع غیراختصاصی یا ذاتی مجموعهای واکنشهای عمومی بدن به ورود انواع مختلف پاتوژنها است. برای مثال اگر عفونت ایجاد شده در بدن شما به دلیل ورود باکتری توبرکلوزیس یا کلستریدیوم تتانی باشد، دفاع غیراختصاصی تفاوت این دو باکتری را تشخیص نمیدهد. در این شرایط بدن تنها متوجه میشود عاملی مظاهر وارد بدن شده و گلبولهای سفید به محل عفونت مهاجرت میکنند. این گلبولها با ترشح سیتوکینها و فاگسیتوز ذره خارجی، وجود عامل بیماریزا را به لنفوسیتهای دفاع غیراختصاصی خبر میدهد. اما دفاع اختصاصی تفاوت اپیتوپهای موجود در آنتیژن باکتری توبرکلوزیس و کلستریدیوم تتانی را تشخیص میدهد و دو نوع آنتیبادی کاملا متفاوت برای اتصال به این آنتیژنها ترشح میکند.
تفاوت ایمنی فعال و غیرفعال چیست ؟
ایمنی غیرفعال در شرایطی ایجاد میشود که آنتیبادی در سرم فرد وجود دارد اما بهوسیله لنفوسیتهای B خود فرد تولید نشده است. برای مثال انتقال آنتیبادی G از جفت و انتقال آنتیبادی A از شیر مادر در بدن نوزاد ایمنی غیرفعال ایجاد میکند. یا آنتیبادی که برای خنثی کردن سم عنکبوت، عقرب و مار به فرد تزریق میشود، نوع دیگری از ایمنی غیرفعال است.
ایمنی فعال در شرایطی ایجاد میشود که لنفوسیتهای بدن خود فرد آنتیبادی تولید کند. این ایمنی به دو روش طبیعی و مصنوعی ایجاد میشود. در روش طبیعی بدن بهوسیله پاتوژنها آلوده شده است و دفاع اختصاصی برای از بین بردن آن آنتیبادی ترشح میکند. در روش غیرطبیعی پاتوژن ضعیفشده، پاتوژن کشته شده یا آنتیژن پاتوژن به بدن فرد سالم تزریق میشود تا قبل از ورود پاتوژن، آنتیبادی خنثیکننده آن در بدن وجود داشته باشد. به این فرایند واکسیناسیون گفته میشود.
بیماری خود ایمنی چیست ؟
در سیتوپلاسم تمام سلولهای هستهدار بدن انسان آنتیژنهایی وجود دارد که ساختار آن منحصر به فرد است. در شریط طبیعی مکانیسمهای مهاری سیستم ایمنی از ایجاد پاسخ ایمنی علیه این آنتیژنها جلوگیری میکند. اما جهشهای ژنتیکی مختلف ممکن است با ایجاد اختلال در این تنظیم منجر به تولید و ترشح آنتیبادی علیه آنتیژنهای طبیعی بدن و تخزیب سلولهای خودی شود. این بیماری ممکن است عملکرد اندامهای مختلف ازجمله لوله گوارش، ماهیچهها و مفصل، سیستم اندوکرین بدن، پوست و سیستم عصبی را مختل کند.
- لوله گوارش: بیماری کوهن، بیماری سیلیاک (آنتیبادی علیه ترانس آمیناز بافت) و زخمهای روده ازجمله بیماریهای خودایمنی لوله گوارش هستند.
- ماهیچه و مفصل: آرتروز پسوریاتیک، آرتروز روماتوئيد (آنتیبادی علیه آنتیژن کپسول مفصل)، سندروم سوگرن، لوپوس (آنتیبادی علیه DNA و پروتئینهای هسته) و میاستنی گراویس (آنتیبادی علیه گیرنده استیل کولین در سیناپس عصب-عضله) انواع بیماریهای خودایمنی در مفاصل و ماهیچهها هستند.
- سیستم اندوکرین: بیماری گریوز (آنتیبادی علیه گیرنده TSH)، هاشیماتو (آنتیبادی علیه گیرنده TSH) و آدیسان ازجمله بیماریهای خودایمنی غدد اندوکرین بدن هستند.
- پوست: التهاب ماهیچه زیر پوست یا درماتومیوزیس و پسوریازیس بیماریهای خودایمنی هستند که در پوست ایجاد میشوند.
- سیستم عصبی: التهاب مزمن نورونها (CIDP)، سندروم گیلیان-بار و مالتیپلاسکلروزیس (MS) از بیماریهای خودایمنی سیستم عصبی هستند.
- سایر اندامها: دیابت نوع I (آنتیبادی علیه سلولهای بتا)، التهاب رگها و «کمخونی کشنده» (Pernicious Anemia) دیگر بیماریهای خودایمنی هستند که زندگی طبیعی فرد را مختل میکنند.
راه مقابله با بیماری خودایمنی چیست ؟
درمان مشخص و کامل برای بیماریهای خودایمنی وجود ندارد. اما بهوسیله داروهای ضدالتهاب، کوتیکواستروئیدها، مسکن، داروهای مهار سیستم ایمنی و فیزیوتراپی میتوان از پیشرفت این بیماریها جلوگیری کرد.












