گرما و تغییر حالت ماده | به زبان ساده
برای اینکه یک مایع را تبخیر کنیم، باید به آن گرما بدهیم تا انرژی جنبشی آن افزایش پیدا کند و دمای آن به نقطه جوش برسد. با رسیدن به نقطه جوش، در حقیقت به نقطهای میرسیم که حالت ماده از مایع به بخار تبدیل میشود. برای وقوع این اتفاق، گرمای بیشتری را باید فراهم کنیم تا انرژی مناسب برای جدا شدن مولکولها و تبدیل آنها به فاز گازی تامین شود. در این مطلب قصد داریم تا به طور دقیق اما با زبانی ساده به بیان موضوع گرما و تغییر حالت ماده بپردازیم.


همانند نقطه جوش، نقطه ذوب یک ماده نیز به طور مستقیم به قدرت نیروهای جاذبه بین مولکولها بستگی خواهد داشت. نقطه ذوب پایین، به موادی اختصاص دارد که نیروهای جاذبه آنها بسیار ضعیف باشند که از میان آنها میتوان به گاز هیدروژن اشاره کرد که نقطه ذوب آن در حدود درجه سانتیگراد است. به طور مشابه، نقطه ذوب بالا نیز به موادی اختصاص دارد که نیروهای جاذبه آنها بسیار قوی باشند و کربن با نقطه ذوب بالای 3500 درجه سانتیگراد را میتوان از جمله این مواد ذکر کرد.
نمودارهای مربوط به گرما و تغییر حالت ماده
اضافه کردن حرارت و بررسی گرما و تغییر حالت ماده در قبل، بعد و زمان تغییر فاز را میتوان به کمک نمودارهای گرمایی بررسی کرد. در نمودار گرمایی تصویر زیر، نمونهای از آب در دمای درجه سانتیگراد و فشار ۱ اتمسفر، به طور پیوسته حرارت میبیند.
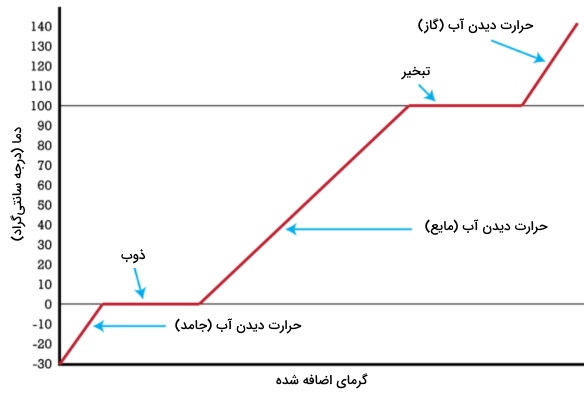
بین دماهای تا صفر درجه سانتیگراد، تمامی گرمای داده شد به صورت انرژی جنبشی جذب و سبب افزایش دمای جامد میشود. به هنگام رسیدن به نقطه ذوب، با وجود اینکه به همان میزان قبل، همچنان به آب گرما میدهیم، اما دما تغییری نمیکند. در این زمان، تمامی گرمای داده شده صرف تامین انرژی مورد نیاز برای ذوب کردن جامد میشود. این انرژی را به عنوان گرمای ذوب میشناسیم. در طول مدت زمانی که این خط، افقی است، یک ناظر میتواند تبدیل شدن جامد به مایع یا ذوب یخ را مشاهده کند.
در این حالت، یک ظرف شامل آب و یخ داریم که دمای آن برابر با صفر درجه است. به بیان دیگر، دمای یخ و دمای آب، هر دو برابر با صفر درجه سانتیگراد خواهند بود. اگر به ظرف، گرمای بیشتری بدهیم، سرعت ذوب افزایش پیدا میکند اما هیچ افزایش دمایی نداریم تا اینکه تمامی جامد به مایع تبدیل شود. با سرد کردن مایع نیز، همان روند نمودار اما این بار به عکس انجام خواهد شد. با سرد شدن، همان خط افقی را شاهد هستیم و پیش از پایین رفتن دوباره دما، گرمای ذوب، حذف میشود.
لازم به ذکر است در زمان بررسی گرما و تغییر حالت ماده به هنگامی که کل آب در حالت مایع قرار داشته باشد، گرما دوباره به شکل انرژی جنبشی جذب میشود. بین دماهای صفر تا ۱۰۰ درجه سانتیگراد، گرمای داده شده، سبب افزایش دما خواهد شد. زمانی که به نقطه جوش میرسیم، دوباره هیچ افزایش دمایی نداریم. حتی اگر گرمای بیشتری هم اضافه کنیم، بازهم افزایش دما نخواهیم داشت و در نمودار، به طور مجدد یک خط افقی ایجاد میشود. تمامی گرمایی که در طول این زمان به نمونه (آب) دادهایم، موجب افزایش انرژی خواهد شد.
این انرژی موسوم به «گرمای تبخیر» (Heat of Vaporization) است و به منظور جداکردن مولکولهای مایع و تبدیل آنها به مولکولهای گازی مورد استفاده قرار میگیرد. در مدت زمانی که این خط صاف (افقی) وجود دارد، یک ناظر میتواند تبدیل آب به گاز را مشاهده کند اما در هر دو حالت، آب در دمای ۱۰۰ درجه سانتیگراد قرار دارد. با افزایش حرارت، تنها سبب سریعتر جوشیدن آب میشویم اما دما هیچگاه به بالای ۱۰۰ درجه سانتیگراد نمیرسد.
زمانی که کل آب وارد فاز بخار شود، افزایش حرارت سبب افزایش انرژی جنبشی و دمای گاز خواهد شد. هنگامی که این گاز را سرد کنیم، بازهم از نمودار بالایی (در حالت برگشت) تبعیت میکند. در حقیقت، به هنگام سرد شدن، همان خط افقی مشاهده میشود.

گرمای ویژه
در بررسی گرما و تغییر حالت ماده نیاز داریم تا برخی دادههای ترمودینامیکی را داشته باشیم. دادههای ترمودینامیکی شامل نقطه ذوب و جوش، گرمای ذوب و گرمای تبخیر همگی برای تمامی عناصر و هزاران ترکیب مختلف، در کتب مرجع نوشته شدهاند.
یکی از این دادههای ترمودینامیکی پرکاربرد، «گرمای ویژه» (Specific Heat) است که آنرا با نماد نشان میدهند. گرمای ویژه یک ماده، به مقدار گرمای مورد نیاز برای افزایش دمای ۱ گرم از ماده به میزان ۱ درجه سانتیگراد است. این مقدار برای آب، برابر با است.
مثال گرمای ویژه
چه میزان گرما نیاز داریم تا دمای ۲۵ گرم آب را از ۱۵ درجه به ۵۵ درجه سانتیگراد افزایش دهیم.
به کمک رابطه زیر، این میزان از حرارت را محاسبه میکنیم:
نقطه ذوب و انجماد
در زمان بررسی گرما و تغییر حالت ماده باید با مفهوم نقطه ذوب نیز آشنا شویم. جامدها مانند مایعات دارای فشار بخار هستند. این فشار بخار با افزایش دما، افزایش پیدا میکند. در دمای ۱۰۰ درجه سانتیگراد، فشار بخار آب مایع برابر با ۷۶۰ میلیمتر جیوه است. با کاهش دما به صفر درجه سانتیگراد، به طور غیرخطی، فشار بخار تا 4/6 میلیمتر جیوه کاهش مییابد.
فشار بخار یک جامد به طور کالی بسیار پایین است زیرا نیروهای جاذبه در جامدات، قوی هستند. به طور مثال، در دمای ، فشار بخار یخ، برابر با 0/00025 میلیمتر جیوه ذکر میشود. به هنگام حرارت دادن یخ، فشار بخار آن افزایش مییابد. در دمای صفر درجه، فشار بخار یخ، 4/6 میلیمتر جیوه خواهد بود که این عدد، همان فشار بخار آب در دمای صفر درجه سانتیگراد هم هست.
در حقیقت، برای تمامی مواد، حالتهای جامد و مایع در نقطه ذوب، دارای یک نقطه فشار بخار هستند. نقطه ذوب یک جامد را در بررسی گرما و تغییر حالت ماده به صورت دمایی تعریف میکنند که در آن دما، فشار بخارهای جامد و مایع، یکسان باشند. بنابراین، نقطه ذوب یک جامد و نقطه انجماد یک مایع، هر دو با یکدیگر برابر هستند.
گرمای ذوب
مطلب دیگری که باید در خصوص گرما و تغییر حالت ماده مورد بررسی قرار دهیم، گرمای ذوب است. ذوب که در حقیقت، تغییر فاز از جامد به مایع نام دارد، شامل شباهتهای بسیاری با تبخیر است. یک جامد، پیش از آنکه مولکولهای آن به فاز مایع وارد شوند، باید به نقطه ذوب خود برسد. مولکولها در فاز مایع اما نسبت به جامدات، فاصله بیشتری از یکدیگر دارند.
از آنجایی که مولکولها، یکدیگر را جذب میکنند، افزایش فاصله بین آنها نیازمند انجام کار است. کار انجام شده به هنگام جدا کردن مولکولها به صورت انرژی پتانسیل در فاز مایع ذخیره میشود.
این فرآیند، همانند فرآیندی است که در آن، گرمای تبخیر، باید به مولکولهای مایع داده شود تا آنها را به فاز گاز تبدیل کند. در خصوص ذوب، انرژی پتانسیل، موسوم به «گرمای ذوب» (Heat of Fusion) است. گرمای ذوب برای آب، مقداری برابر با ۳۳۴ ژول بر گرم دارد.

مثال گرمای ذوب
چه میزان گرما باید به ۲۵ گرم یخ در دمای صفر درجه سانتیگراد داده شود تا آنرا به آب در همین دما تبدیل کنیم.
برای حل این سوال باید تغییرات آنتالپی ذوب را در جرم ماده مورد نظر، ضرب کنیم. بنابراین، خواهیم داشت:
گرمای تبخیر
گرمای تبخیر، مبحث دیگری در بررسی گرما و تغییر حالت ماده را شامل میشود. تفاوت بین فاز مایع و گاز یک ماده در حقیقت، اختلاف بین فاصله مولکولهای آن ماده از یکدیگر است. از آنجایی که مولکولها یکدیگر را جذب میکنند و در فاز گاز، فاصله بیشتری نسبت به فاز مایع دارند، مولکولها در فاز گاز شامل انرژی پتانسیل بیشتری نسبت به فاز مایع هستند.
زمانی که یک ماده، از فاز مایع به فاز گاز تبدیل شود، برای جدا کردن مولکولها از یکدیگر باید بر روی آنها کار انجام شود. کار انجام شده برای جدایش مولکولها به صورت انرژی پتانسیل در ساختار مولکولی آنها ذخیره میشود. اگر مولکولها این فرصت را داشته باشند تا در اثر میعان، به طور مجدد به فاز مایع برسند، این انرژی پتانسیل، آزاد میشود. مقدار این انرژی، به طور دقیق برابر با مقدار مورد نیاز برای جدایش مولکولها است. به این انرژی پتانسیل ذخیره شده در مولکولهای فاز گاز، «گرمای تبخیر» (Heat of Vaporization) میگویند.
گرمای تبخیر برای آب برابر با 540 کالری بر گرم یا در دمای نقطه جوش نرمال است. به دلیل قدرت جاذبههای قطبی نگهدارنده مولکولهای آب مایع، این ماده گرمای تبخیر بالایی دارد.
از نمونههای دیگر مولکولهای قطبی میتوان آمونیاک را با فرمول و همچنین اتانول را با فرمول نام برد که به ترتیب، گرمای تبخیری برابر با و دارند.
مثال گرمای تبخیر
در نقطه جوش آمونیاک، چه مقدار گرما (بر حسب کیلوژول) باید به ۱۰۰ گرم از این ماده بدهیم تا آنرا تبخیر کنیم؟
برای حل این سوال نیز باید جرم آنرا در ضرب کنیم.
نقطه جوش آمونیاک برابر با است. لازم به ذکر است که تمامی انرژی موجود در گرمای تبخیر، توسط ماده به عنوان انرژی پتانسیل جذب میشود و هیچ تبدیلی به انرژی جنبشی نخواهیم داشت و به همین دلیل، تغییر دما نخواهیم داشت.
برای فهم این مطلب، مثال دیگری میزنیم. به نظر شما کدامیک سوختگی شدیدتری ایجاد میکنند؟ سوختگی ناشی از آب ۱۰۰ درجه سانتیگراد یا بخار آب ۱۰۰ درجه سانتیگراد؟
در نگاه اول، گویی هر دو به یک میزان سوختگی ایجاد میکنند اما بخار آب، انرژی حرارتی بسیار بیشتری را نسبت به آب مایع، بر روی پوست آزاد میکند که این مقدار از انرژی، برابر با گرمای تبخیر است. در حقیقت، پیش از آنکه این بخار، به آب ۱۰۰ درجه سانتیگراد تبدیل شود، سبب سوختن پوست میشود و در نتیجه، سوختگی بیشتری را ایجاد میکند.
مثال دوم گرمای تبخیر
چه میزان گرما نیاز داریم تا دمای ۲۵ گرم آب را از دمای ۲۵ درجه (در حالت مایع) به دمای ۱۰۰ درجه سانتیگراد (در حالت گاز) تبدیل کنیم.
برای حل این سوال، در ابتدا میزان گرمای مورد نیاز برای رسیدن به دمای ۱۰۰ درجه سانتیگراد در حالت مایع را محاسبه میکنیم:
در ادامه، مقدار گرمای مورد نیاز برای تبدیل مایع به بخار، محاسبه خواهد شد:
در انتها نیز مقدار این دو عدد را با یکدیگر جمع میکنیم تا به پاسخ سوال برسیم:

جمعبندی
در پایان به طور خلاصه مطالب مربوط به گرما و تغییر حالت ماده را بیان میکنیم:
- در نمودارهای مربوط به حرارت دادن و سرد کردن، تغییر دما همراه با تغییر در انرژی جنبشی است درحالیکه اگر هیچ تغییر دمایی نداشته باشیم، این تغییر به صورت تغییر انرژی پتانسیل خواهد بود.
- به مقدار گرمای مورد نیاز برای افزایش دمای ۱ گرم از یک ماده به میزان ۱ درجه سانتیگراد، گرمای ویژه آن ماده میگویند.
- مقدار گرمای مورد نیاز برای تبخیر یک واحد جرمی از یک مایع در دمای ثابت، گرمای تبخیر آن مایع نام دارد.
- به انرژی آزاد شده به هنگام میعان یک گاز و تبدیل آن به مایع، «گرمای میعان» (Heat of Condensation) میگویند. البته در برخی منابع، این عبارات به صورت گرمای نهان (تبخیر یا میعان) نیز تعریف میشوند.
- جامدات زمانی ذوب میشوند که فشار بخار جامد با فشار بخار مایع برابر شود. برای این ذوب شدن، باید توسط جامد، گرما جذب شود که این جذب گرما حتی ممکن است سبب تغییر دما نشود. به مقدار گرمای جذب شده به ازای واحد جرم، گرمای ذوب میگویند.
- نیروهای جاذبه قویتر بین ذرات در جامد، سبب میشود تا نقطه جوش و گرمای ذوب بالاتری داشته باشیم.
فیلم آموزش آثار گرما در ترمودینامیک مهندسی شیمی
آنچه که در این مطلب و در خصوص گرما و تغییر حالت ماده بیان کردیم، وابسته به بخش مهمی از ترمودینامیک مهندسی شیمی است. از اینرو، «فرادرس» اقدام به انتشار فیلم آموزش آثار گرما در ترمودینامیک مهندسی شیمی در قالب آموزشی ۸۴ دقیقهای کرده است.
این آموزش در ۷ فصل تدوین شده است که در فصل اول و دوم، آثار گرمایی محسوس و گرمای نهان مواد خالص مطرح میشود. در فصول ۳، ۴ و ۵ به ترتیب گرمای استاندارد واکنش، گرمای استاندارد تشکیل و گرمای استاندارد سوختن مرور خواهد شد. در فصول آخر نیز وابستگی دمایی و آثار حرارتی واکنشهای صنعتی، مورد بحث قرار میگیرد.
آزمون گرما و تغییر حالت ماده
۱. وقتی گرما به یک ماده اضافه میشود و ماده تغییر فاز میدهد، چه اثری بر انرژی جنبشی مولکولهای آن مشاهده میشود؟
انرژی جنبشی مولکولها هنگام عبور از نقطه جوش کاهش مییابد.
در طول تغییر فاز، انرژی جنبشی مولکولها ثابت میماند.
انرژی جنبشی مولکولها فقط در نقطه ذوب افزایش مییابد.
افزودن گرما فقط انرژی جنبشی را در هر دما زیاد میکند.
وقتی ماده در حال تغییر فاز مانند ذوب یا تبخیر است، با وجود اضافه شدن گرما، انرژی جنبشی مولکولها ثابت باقی میماند و گرما صرف تغییر حالت و افزایش انرژی پتانسیل میشود. صرفا در نقاطی مانند نقطه ذوب یا جوش، گرمای اضافهشده منجر به افزایش فاصله مولکولی و تغییر فاز میشود و نه افزایش انرژی جنبشی.
۲. کدام گزینه ارتباط نیروهای بین مولکولی با نقطه ذوب و جوش مواد را بهتر توضیح میدهد؟
مواد با نیروهای بین مولکولی قوی معمولا نقطه جوش و ذوب پایینی دارند.
نیروهای ضعیف بین مولکولی باعث افزایش نقطه ذوب میشوند.
نیروهای بین مولکولی فقط بر نقطه جوش اثر دارند و ارتباطی با نقطه ذوب ندارند.
هرچه نیروهای بین مولکولی قویتر باشند، نقطه ذوب و جوش بالاتر خواهد بود.
پیوندها یا نیروهای قویتر بین مولکولها در یک ماده سبب مقاومت بیشتر برای تغییر فاز میشود، بنابراین برای ذوب یا جوش چنین موادی باید انرژی بیشتری وارد کرد. به همین دلیل «هرچه نیروهای بین مولکولی قویتر باشند، نقطه ذوب و جوش بالاتر خواهد بود» درست است. عبارت «نیروهای ضعیف بین مولکولی باعث افزایش نقطه ذوب میشوند» نادرست است، چون این نیروها باعث کاهش نقطه ذوب میشوند. جمله «نیروهای بین مولکولی فقط بر نقطه جوش اثر دارند و ارتباطی با نقطه ذوب ندارند» صحیح نیست، زیرا هر دو نقطه ذوب و جوش به این نیروها بستگی دارند. عبارت «مواد با نیروهای بین مولکولی قوی معمولا نقطه جوش و ذوب پایینی دارند» برخلاف توضیح علمی است.
۳. برای محاسبه مقدار گرما جهت افزایش دمای ۵۰ گرم آب از ۲۰ درجه به ۸۰ درجه سانتیگراد، با توجه به فرمول Q = mCΔT، چه روشی درست است؟
جمع کردن جرم و گرمای ویژه و اختلاف دما
ضرب کردن جرم، گرمای ویژه و اختلاف دما با هم
ضرب کردن گرمای ویژه در اختلاف دما سپس تقسیم بر جرم
جمع کردن جرم با اختلاف دما و ضرب بر گرمای ویژه
در این حالت باید مقدار گرما با ضرب کردن جرم آب، عدد گرمای ویژه و اختلاف دما (ΔT) محاسبه شود، یعنی همان روش «ضرب کردن جرم، گرمای ویژه و اختلاف دما با هم».
۴. در نمودار گرمایی یک ماده خالص، در بخشهای افقی (پلاتوها) چه تغییری در انرژی جنبشی و انرژی پتانسیل ماده رخ میدهد؟
انرژی جنبشی و پتانسیل هر دو ثابت میمانند.
انرژی جنبشی و انرژی پتانسیل هر دو افزایش مییابند.
انرژی جنبشی ثابت میماند و انرژی پتانسیل افزایش مییابد.
انرژی جنبشی افزایش مییابد و انرژی پتانسیل ثابت میماند.
در بخشهای افقی نمودار گرمایی (پلاتوها)، دمای ماده ثابت میماند، بنابراین انرژی جنبشی مولکولها تغییر نمیکند. اما گرمای افزوده باعث افزایش انرژی پتانسیل میشود تا تغییر فاز انجام شود، مثلا ذوب یا تبخیر رخ دهد.
۵. کدام گزینه تعریف دقیق گرمای ویژه را بیان میکند و تفاوت آن با گرمای ذوب و گرمای تبخیر چیست؟
گرمای ویژه، انرژی مربوط به تبخیر کامل یک مایع است.
گرمای ویژه، انرژی لازم برای تغییر حالت جامد به مایع یا مایع به گاز است.
گرمای ویژه، انرژی لازم برای افزایش دمای یک گرم ماده به اندازه یک درجه سانتیگراد است.
گرمای ویژه، انرژی مورد نیاز برای ذوب کامل یک جامد است.
گرمای ویژه دقیقا همین مفهوم را دارد و به تغییر دما اشاره میکند، نه تغییر حالت.
۶. در نقطه ذوب یک ماده، چه رابطهای بین فشار بخار جامد و فشار بخار مایع برقرار است و این موضوع چه نقشی در تغییر فاز دارد؟
در نقطه ذوب، فشار بخار جامد کمتر از مایع است و موجب ذوب نمیشود.
در نقطه ذوب، فشار بخار جامد بیشتر از مایع است و ماده منجمد میماند.
در نقطه ذوب، هیچ ارتباطی بین فشار بخار جامد و مایع وجود ندارد.
در نقطه ذوب، فشار بخار جامد و مایع برابر است و تغییر فاز رخ میدهد.
در نقطه ذوب، «فشار بخار جامد و مایع برابر است» و این وضعیت موجب شروع تغییر فاز جامد به مایع میشود. اگر فشار بخار جامد کمتر باشد، شرایط برای ذوب مهیا نمیشود. اگر فشار بخار جامد بیشتر از مایع باشد، امکان انجماد وجود خواهد داشت. نبود رابطه بین فشار بخارها نادرست است، زیرا همین برابری فشارها اساس تعریف نقطه ذوب است.












عالیییییی