نوکلئوفیل چیست و چه فرقی با الکتروفیل دارد؟ – به زبان ساده
نوکلئوفیل در علم شیمی گونهای الکتروندهنده است که از این ویژگی برای تشکیل پیوند شیمیایی جدید بهره میبرد. این ترکیبات چگالی الکترون بالای خود را در اختیار گونههای الکتروفیل قرار میدهند و کمبود الکترون آنها را به این روش جبران میکنند. در بسیاری از واکنشهای شیمیایی این حمله نوکلئوفیل به الکتروفیل است که باعث پیشروی و وقوع آن میشود. به همین دلیل مطالعه این دسته از ترکیبات از اهمیت بسیار بالایی برخوردار است. به عبارتی برای مطالعه بسیاری از واکنشهای شیمیایی و تحلیل مکانیسم آنها، آشنایی با این مفهوم مورد نیاز و ضروری است.
- یاد میگیرید نوکلئوفیل و الکتروفیل را بهصورت کاربردی توضیح دهید.
- میآموزید چه تفاوتهایی بین نوکلئوفیل، باز و الکتروفیل وجود دارد.
- انواع نوکلئوفیلها در شیمی آلی و معدنی و قدرت هر یک را بررسی میکنید.
- با معیارهای تشخیص نوکلئوفیل و الکتروفیل در واکنشها آشنا میشوید.
- مکانیسم حمله نوکلئوفیلی را در واکنشهای «SN1» و «SN2» بررسی میکنید.
- یاد میگیرید اجزای اصلی واکنش جانشینی نوکلئوفیلی را در ساختار آن مشخص کنید.


در این مطلب مجله فرادرس ابتدا میخواهیم بدانیم نوکلئوفیل چیست و چه تفاوتهایی با الکتروفیل دارد. سپس تلاش میکنیم انواع نوکلئوفیل را بشناسیم و با ویژگیهای آنها آشنا شویم. به علاوه مروری خواهیم داشت به عواملی که بر قدرت گونه نوکلئوفیل اثرگذار هستند. در ادامه نحوه تشخیص الکتروفیل و نوکلئوفیل را در واکنشهای شیمیایی مورد بررسی قرار میدهیم. در نهایت نیز با مرور تعدادی مثال و تمرین به درک خود از این مفهوم عمق میبخشیم.
نوکلئوفیل چیست؟
«نوکلئوفیل» یا «هستهدوست» (Nucleophile) اتم یا گروه عاملی دارای زوجالکترون است که توانایی به اشتراک گذاشتن آن را دارد و به همین روش پیوندی کووالانسی به وجود میآورد. در بیشتر مواقع برای نمایش یک نوکلئوفیل در واکنشهای شیمیایی از استفاده میشود. این زوجالکترون بهطور معمول بهصورت زوجالکترون ناپیوندی است.
این تعریف را میتوان برای بازها در شیمی نیز به کار برد. بنابراین بازها میتوانند نوکلئوفیل باشند و نوکلئوفیلها نیز میتوانند نقش باز را ایفا کنند. با این حال این دو، تفاوتهایی نیز دارند که در ادامه به آنها خواهیم پرداخت.
تفاوت باز و نوکلئوفیل
«باز لوری برونستد» (Bronsted Lowry Base) از یک زوجالکترون ناپیوندی برای برقراری پیوند با یک پروتون اسیدی بهره میگیرد. نوکلئوفیل بهطور معمول زوجالکترون خود را در اختیار اتمی قرار میدهد که غنی از الکترون نیست. برای مثال میتوان از عنصر کربن نام برد.
همچنین طبق تعریف، نوکلئوفیلها باز لوییس نیز هستند و در حالتی که زوجالکترون خود را در اختیار پروتون قرار دهند، باز لوری برونستد نامیده میشوند. در تصویر زیر ساختار ۵ نوکلئوفیل را مشاهده میکند که همگی زوجالکترونی دارند و میتوانند آن را در اختیار قرار دهند. این ترکیبات باز لوییس نیز هستند.
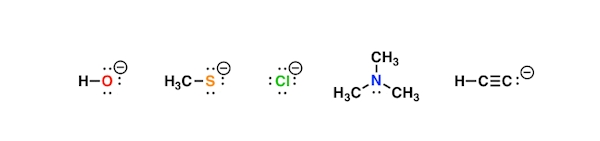
در فهرست زیر به تعدادی از مهمترین تفاوتهای این دو مفهوم بهصورت مختصر اشاره کردهایم.
- نوکلئوفیلها به هر اتمی به جز هیدروژن حمله میکنند و میتوان از این بین به کربن اشاره کرد. بازها زوجالکترون خود را در اختیار هیدروژن قرار میدهند.
- حمله نوکلئوفیلها برگشتناپذیر است در حالی که بازها تاثیری تعادلی دارند. این تعادل به مقدار ثابت تعادل اسید و تعادل موجود بین اسید و باز بستگی دارد.
- نوکلئوفیلی مفهومی سینتیکی، اما بازی بودن مفهومی مربوط به ترمودینامیک است.
همچنین میتوانید در تصویر زیر تفاوت عملکرد یک گروه آمینی به عنوان باز و به عنوان نوکلئوفیل را مشاهده کنید. توجه داشته باشید که محصول این دو واکنش نیز با یکدیگر تفاوتهای عمدهای دارند.
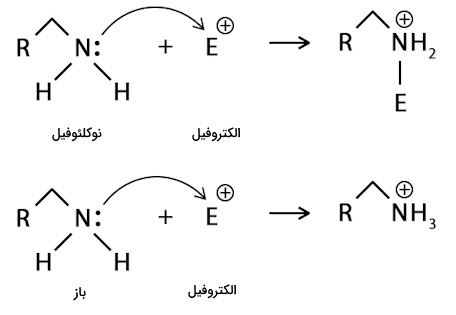
مثال نوکلئوفیل
برای درک بهتر مثالی را مورد بررسی قرار میدهیم. یون هیدروکسید زوجالکترونی را در اختیار اتمی الکتروفیل قرار میدهد و پیوندی کووالانسی تشکیل میشود، در این حالت طبق تعریف میتوانیم آن را یک نوکلئوفیل بدانیم. در تصویر زیر نحوه تشکیل این پیوند و انتقال زوجالکترون را مشاهده میکنید. در این واکنش یون هیدروکسید نوکلئوفیلی است که به کربن مجاور عنصر کلر حمله میکند و با خارج کردن آن یک ساختار الکلی را به همراه پتاسیم کلرید به وجود میآورد.
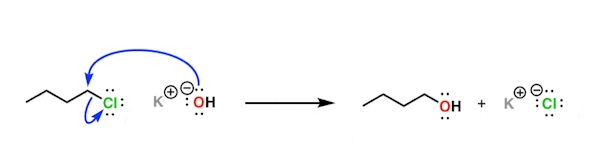
همچنین یون هیدروکسید را میتوان باز نیز دانست زیرا در این فرآیند زوجالکترونی را در اختیار پروتون اسیدی قرار میدهد و پیوند کووالانسی تشکیل میشود. این را میتوانید در تصویر زیر مشاهده کنید که در آن یون هیدروکسید از ساختار سدیم هیدروکسید به هیدروکلریک اسید منتقل میشود و دو محصول آب و سدیم کلرید را به وجود میآورد.
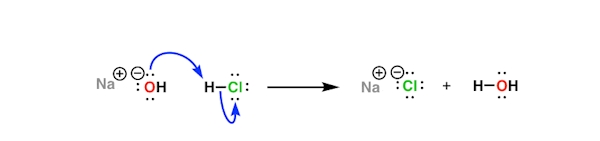
بنابراین میتوان اینطور جمعبندی کرد که بازها زیرشاخهای از خانواده نوکلئوفیلها هستند. در صورتی که الکتروفیل مورد حمله نوکلئوفیل، پروتون باشد، آن را باز مینامیم.
انواع نوکلئوفیل
در این بخش میخواهیم با تعدادی از نوکلئوفیلهای پرتکرار آشنا شویم. از جمله اتمهای نوکلئوفیل میتوان به اکسیژن، نیتروژن و گوگرد اشاره کرد. همچنین ترکیباتی مانند آب، یون هیدروکسید، الکلها، فنولها، آمینها، تیولها و در برخی موارد کربوکسیلاتها از رایجترین نوکلئوفیلها هستند.
در مولکولهای غیرزیستی، به نوکلئوفیلهای هالیدی مانند ، ، و و آنیون آزید برمیخوریم. اتم کربن نیز میتواند در مواردی نقش نوکلئوفیل را بازی کند، برای مثال میتوان به یون انولات اشاره کرد. همچنین کربن موجود در یون سیانید نیز اتمی نوکلئوفیل به شمار میرود. در تصویر زیر این دو نوکلئوفیل را مشاهده میکنید.
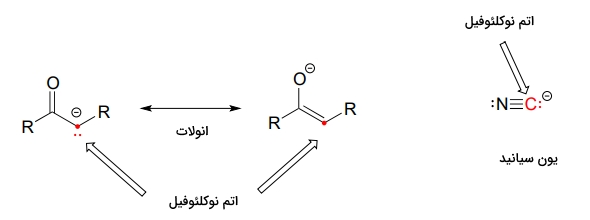
در زیر فهرستی از متدوالترین نوکلئوفیلها را آوردهایم.
- آنیونهای ساده: این دسته از نوکلئوفیلها میتوانند زوجالکترونی ناپیوندی در اختیار بگذارند. از این دسته میتوان به ، ، و اشاره کرد.
- گونههای آنیونی: این ترکیبات نیز میتوانند با در اختیار قرار دادن زوجالکترون ناپیوندی نقش نوکلئوفیل را ایفا کنند. گونههای ، ، و مثالهایی از این دسته هستند.
- مولکولهایی با زوجالکترون مازاد: از ترکیبات این دسته میتوان به ، و اشاره کرد.
- سیستمهای غنی از الکترون پای: بنزن با فرمول شیمیایی ، اتیلن با فرمول شیمیایی و اتین با فرمول شیمیایی به این دسته تعلق دارند.
با توجه به انواع نوکلئوفیلهای موجود، در جدول زیر به برخی از آنها با در نظر گرفتن قدرتشان اشاره کردهایم.
| نوع نوکلئوفیل | مثالها |
| خیلی خوب | و |
| خوب | و |
| معمولی | و |
| ضعیف | و |
| خیلی ضعیف |
الکتروفیل چیست؟
«الکتروفیل» یا «الکتروندوست» (Electrophile) ترکیبی است که با دریافت زوجالکترون، پیوند کووالانسی جدیدی تشکیل میدهد. همانطور که میدانید این بسیار نزدیک به مفهوم اسید در شیمی است، بهصورتی که اگر اتم دریافتکننده زوجالکترون، هیدروژن باشد، الکتروفیل همان اسید است. در تصویر زیر تعدادی ساختار را مشاهده میکنید که مثالهایی از اسید لوییس هستند.
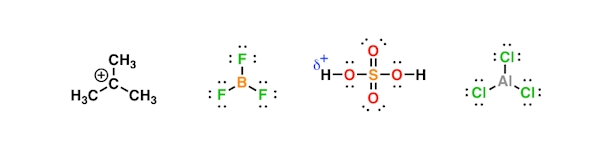
مشابه آنچه در مورد رابطه نوکلئوفیل و باز گفتیم، یک الکتروفیل نیز میتواند اسید باشد. در واقع تمامی اسیدها الکتروفیل هستند اما تمام الکتروفیلها اسید نیستند.
واکنشهای نوکلئوفیلی
مطالعه واکنشهایی که نوکلئوفیلها انجام میدهند اهمیت بسیاری دارد زیرا بسیاری از واکنشها بین یک الکتروفیل و یک نوکلئوفیل انجام میشود که در آن انتقال زوجالکترون و تشکیل پیوند کووالانسی جدید در میان است. این واکنشها با حمله یک نوکلئوفیل به الکتروفیل آغاز میشوند.
یک نوکلئوفیل بهطور معمول، زوجالکترون خود را در اختیار یک الکتروفیل قرار میدهد که مانند کربن، غنی از الکترون نیست. زمانی که از هستهدوستی صحبت میکنیم، وجه سینتیکی آن را در نظر داریم و پرسش این است که سرعت واکنش آن با الکتروفیل چقدر است. به دو واکنش موجود در تصویر زیر توجه کنید.
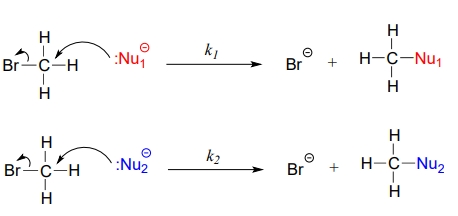
در صورتی که در واکنش اول از در واکنش دوم قویتر باشد، واکنش را با سرعت بیشتری پیش میبرد و ثابت سرعت واکنش اول از ثابت سرعت واکنش دوم بزرگتر خواهد بود. این را میتوان بهصورت زیر نمایش داد.
حمله نوکلئوفیلی چیست؟
نوکلئوفیلها با ترکیبات شیمیایی دیگر درگیر واکنشهای شیمیایی افزایشی و جانشینی میشود. به فرآيندی که در آن نوکلئوفیل با واکنشدهنده دیگر برهمکنش میدهد، «حمله نوکلئوفیلی» (Nucleophilic Attack) گفته میشود.
در صورتی که واکنش از نوع «واکنش افزایشی نوکلئوفیلی» (Nucleophilic Addition Reaction) باشد، نوکلئوفیل به نقطهای از واکنشدهنده دیگر اضافه میشود که دارای کمبود الکترون است. در واکنش «واکنش جانشینی نوکلئوفیلی» (Nucleophilic Substitution Reaction) گروهی عاملی از واکنشدهنده دیگر با حمله نوکلئوفیلی جایگزین میشود. این گروه عاملی را به نام «گروه ترککننده» (Leaving Group) میشناسیم. دو نوع واکنش جانشینی نوکلئوفیلی با نامهای و وجود دارد.
واکنش جانشینی نوکلئوفیلی
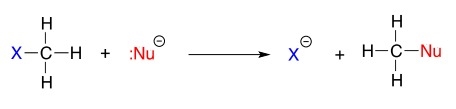
در این نوع واکنش، قدرت یا واکنشپذیری نوکلئوفیل از اهمیت بالایی برخوردار است که از آن با عنوان «هستهدوستی» (Nucleophilicity) نام برده میشود. هستهدوستی در واقع توانایی نوکلئوفیلها در دادن زوجالکترون ناپیوندی خود به مرکز مثبت مورد حمله است. در یک واکنش جانشینی، نوکلئوفیلی که هستهدوستی بالاتری داشته باشد، جایگزین نوکلئوفیل ضعیفتر میشود. این واکنش را بهصورت کلی میتوان به شکل زیر نشان داد.
در ادامه میخواهیم بدانیم هر کدام از اجزای این واکنش نشاندهنده چه چیزی هستند.
- : گروه آلکیلی
- : گروه ترککننده با نوکلئوفیلی کمتر
- : نوکلئوفیل بهتر
مثال واکنش جانشینی نوکلئوفیلی
میخواهیم مثالی از این نوع واکنش را بررسی کنیم. در این واکنش دو واکنشدهنده متیل برمید و سدیم هیدروکسید حضور دارند. واکنش این دو منجر به محصول اصلی متانول و محصول جانبی یون برم میشود. این واکنش را در زیر مشاهده میکنید.
در این واکنش یون هیدروکسید نوکلئوفیل است و یون برم نیز نقش گروه ترککننده را بازی میکند. این یون با حمله نوکلئوفیلی از آلکیل جدا میشود و محصول به دست میآيد.
عوامل موثر بر نوکلئوفیل
در این بخش میخواهیم به بررسی عواملی بپردازیم که بر میزان و قدرت نوکلئوفیل بودن یک اتم یا گروه تاثیرگذار هستند.
پروتوندهی
میزان پروتوندهی یک گروه شیمیایی، تاثیر بسیار زیادی بر هستهدوستی آن دارد. برای مثال یون هیدروکسید با بار منفی، از مولکول آب، نوکلئوفیل و باز بسیار قویتری است. در عمل اگر این دو ترکیب بخواهند وارد واکنش نوکلئوفیلی بهصورت شوند، واکنش هیدروکسید با کلرومتان با شدت بسیار بیشتری صورت میگیرد.
به همین صورت، آنیون تیولات از تیول خنثی نوکلئوفیل قویتری است و آمین خنثی نیز نوکلئوفیل به حساب میآيد. این در حالی است که کاتیون آمونیوم، نوکلئوفیل نیست.
روند نوکلئوفیلی
برای نوکلئوفیلها نیز میتوان مانند بازها، روندی را در جدول تناوبی عناصر در نظر گرفت، به این صورت که با حرکت در ردیف دوم جدول تناوبی، روند نوکلئوفیلی مانند روند بازی خواهد بود. برای مثال به دو مقایسه زیر توجه کنید.
همچنین در یک ستون جدول تناوبی، با حرکت از بالا به پایین، از قدرت بازی بودن آنها کاسته میشود. یونهای تیولات از یونهای آلکوکسید قدرت بازی کمتری دارند و یون برمید نیز از یون کلرید کمتر بازی است. خود یون برمید نیز از یون فلوئورید قدرت بازی کمتری دارد.
روند تغییر قدرت نوکلئوفیلی کمی پیچیدهتر از روند قدرت بازی است و بستگی به حلال واکنش دارد. در تصویر زیر میتوانید حالت کلی و عمومی انجام یک واکنش به روش را مشاهده کنید.
در مکانیسم بالا، یک یون هالید مانند فلوئورید، کلرید، برمید و یدید است. نیز نشاندهنده یک گروه ترککننده است. در صورتی که این واکنش در حلال پروتیک انجام شود، در حضور یدید بسیار سریع و در حضور فلوئورید با سرعت کمتری پیشرفت میکند. این تفاوت سرعت، نشاندهنده تفاوت در قدرت نوکلئوفیلها است. توجه داشته باشید که حلال پروتیک، حلالی است که در آن یک اتم هیدروژن به اتمی مانند نیتروژن یا اکسیژن متصل باشد. آب، متانول و اتانول نمونهای از حلالهای پروتیک هستند.
روند تغییر قدرت بازی و قدرت نوکلئوفیلی در هالوژنها و در حضور حلالهای پروتیکی مانند آب را در تصویر زیر مشاهده میکنید.
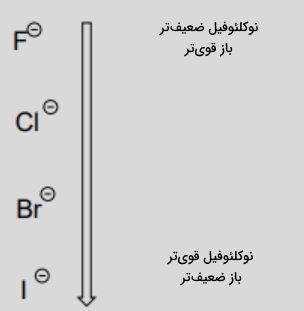
مولکولهای حلال پروتیک برهمکنش غیرکووالانسی قوی با گونههای نوکلئوفیل غنی از الکترون ایجاد میکنند و ساختاری مانند قفس از پیوندهای هیدروژنی ایجاد میکند که در تصویر زیر آن را مشاهده میکنید.
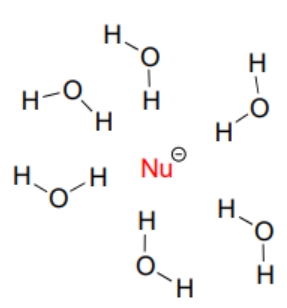
نوکلئوفیل تنها در صورتی میتواند در واکنش حمله کند که بر این پیوندهای هیدروژنی غلبه کند. بازی ضعیف مانند ید با پروتونهای حلال برهمکنش ضعیفی دارد و میتواند آن را به سادگی کنار بزند. به علاوه از آنجا که الکترونهای ظرفیت یون ید در فاصله زیادی از هسته قرار دارند، ابر الکترونی قطبی است و چگالی الکترون میتواند از هسته فاصله بگیرد و به سمت الکتروفیل حرکت کند.
آنیون کوچکتری مانند فلوئورید که قدرت بازی بالاتری نیز دارد، توسط برهمکنش قوی با مولکولهای حلال، پوشیده میشود. ابر الکترونی فلوئور کوچکتر است و نسبت به یدید قطبیت پایینتری دارد. در حلال آب، یون بزرگتر یدید نسبت به یون فلوئورید، نوکلئوفیل قویتری به شمار میرود.
اثر رزونانسی روی نوکلئوفیل
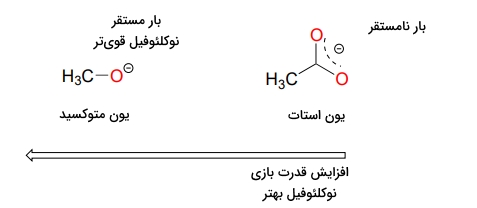
برای مقایسه قدرت نوکلئوفیلی نوکلئوفیلهای مختلف «اثر رزونانس» (Resonance Effect) را باید در نظر داشت. در صورتی که زوجالکترون ناپیوندی روی هترواتم توسط روزنانس نامستقر شود، بهصورت ذاتی از واکنشپذیری کمتری برخوردار است و نوکلئوفیل ضعیفتری به شمار میآيد. برای مثال یون آلکوکسید نسبت به گروه کربوکسیلات، نوکلئوفیل بهتری است و قدرت بازی بیشتری دارد. توجه داشته باشید که در هر دو گونه اتم نوکلئوفیل، اکسیژن با بار منفی است. در آلکوکسید، بار منفی روی اکسیژن مستقر است در حالی که در کربوکسیلات، بار منفی به دلیل رزونانس روی دو اتم اکسیژن وجود دارد. این مفهوم را میتوانید در تصویر زیر مشاهده کنید.
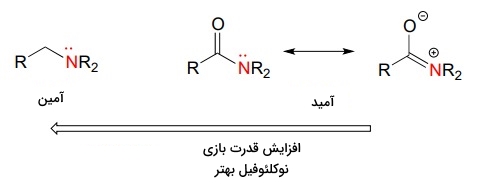
در این مورد مثال دیگری را بررسی میکنیم. اتم نیتروژن آمیدی از اتم نیتروژن آمینی قدرت نوکلئوفیلی کمتری دارد زیرا گروه عاملی کربونیل در آمید باعث ایجاد رزونانس زوجالکترون ناپیوندی نیتروژن میشود. این رزونانس در تصویر زیر قابل مشاهده است.
اثر فضایی روی نوکلئوفیل
برای بررسی و مطالعه نوکلئوفیلی در یک مولکول، «ممانعت فضایی» (Steric Hinderance) یکی از مهمترین عواملی است که باید آن را در نظر داشت. برای مثال متانول نسبت به ترشیو بوتانول، نوکلئوفیل بهتری به حساب میآید. گروههای متیل حجیم روی الکل نوع سوم، به میزان زیادی مسیر حمله اکسیژن نوکلئوفیل را مسدود میکنند و از این طریق باعث کند شدن واکنش میشوند. در تصویر زیر میتوانید این اثرات فضایی را مشاهده کنید.
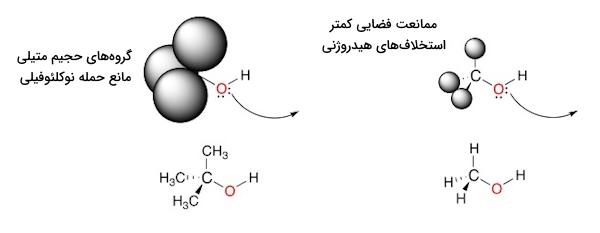
توجه داشته باشید که اثرات نوکلئوفیل تنها زمانی موضوعیت دارد که واکنش از نوع باشد.
توانایی ترک کردن گروه ترککننده
در واکنش جانشینی نوکلئوفیلی، علاوه بر میزان هستهدوستی، توانایی ترک کردن گروهترککننده نیز از اهمیت بالایی برخوردار است زیرا حتما باید ابتدا گروه ترککننده مولکول را ترک کند تا نوکلئوفیل تاثیر خود را بگذارد. هرچه قدرت ترککنندگی بالاتر باشد، واکنش نیز با سرعت بیشتری انجام میشود. بهطور کلی میتوان اینطور گفت که هرچه بازی ضعیفتر باشد، ترککننده بهتری خواهد بود، برای مثال به روند زیر توجه کنید.
مکانیسم
یکی از مکانیسمهایی که واکنشهای جانشینی هستهدوستی توسط آن انجام میشوند، مکانیسم نام دارد. در این بخش میخواهیم با این مکانیسم آشنا شویم تا درک بهتری از نحوه انجام آن داشته باشیم. این واکنش از مرتبه ۲ است و میتوان ثابت سرعت آن را بهصورت زیر نوشت.
بنابراین با توجه به قانون سرعت واکنش شیمیایی، متوجه میشویم که سرعت واکنشی که با مکانیسم انجام میشود، به هر دو واکنشدهنده آن بستگی دارد. در این صورت قابل درک است که هم قدرت نوکلئوفیل، هم ترککنندگی گروه ترککننده از عوامل موثر بر سرعت واکنش شیمیایی باشند.
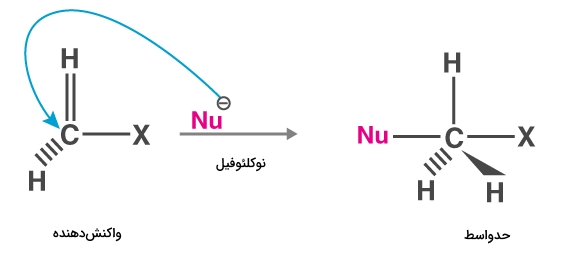
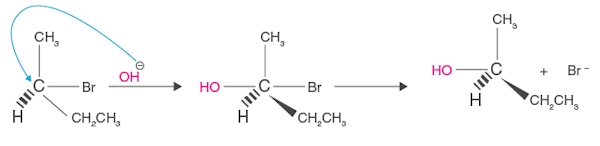
در ادامه میخواهیم با بررسی یک مثال نحوه انجام این واکنش را با مکانیسم آن مورد بررسی قرار دهیم. در این واکنش نوکلئوفیلی با متیل هالید وارد واکنش میشود. واکنش کلی را به شکل زیر نمایش میدهیم.
این واکنش در یک مرحله انجام میشود و حد واسطی دارد که آن را در تصویر زیر مشاهده میکنید.
سپس گروه ترککننده جدا میشود و محصول مانند تصویر زیر به دست میآيد.
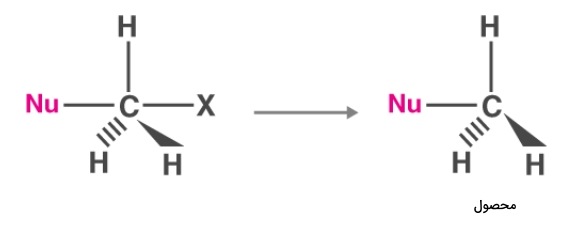
در این واکنش، حمله از پشت صورت میگیرد تا از ایجاد دافعه جلوگیری شود. در حد واسط این واکنش، پیوند بین کربن و گروه ترککننده در حال شکسته شدن و پیوند بین کربن و نوکلئوفیل جدید در حال تشکیل شدن است. این دو بهصورت همزمان رخ میدهند. از آنجا که حمله از پشت انجام میشود، محصول این واکنش دارای «پیکربندی معکوس» (Inverted Configuration) نسبت به واکنشدهنده اولیه است. بنابراین واکنش جانشینی نوکلئوفیلی همیشه با وارونگی پیکربندی همراه است.
در مواردی انجام واکنش با این مکانیسم بسیار مشکل خواهد بود. مثالی از این مورد واکنش نوکلئوفیل و ترشیو بوتیل کلرید است. در این مولکول به دلیل تعداد بالای استخلافهای حجیم، حمله به کربن و بیرون راندن گروه ترککننده مشکل خواهد بود. به همین دلیل این واکنش صورت نمیگیرد. این را میتوانید در تصویر زیر مشاهده کنید.
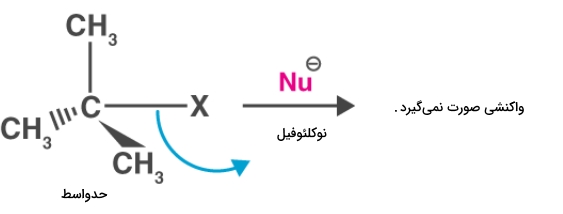
واکنشدهندههایی که مانند این مولکول حجیم و شلوغ باشند در واکنش با مکانیسم از خود واکنشپذیری پایینی نشان میدهند. هالیدهای نوع اول واکنشپذیرتر از هالیدهای نوع دوم و آن هم واکنشپذیرتر از هالیدهای نوع سوم است.
سرعت واکنش جانشینی نوکلئوفیلی در صورتی که در حلالهای قطبی آپروتیک مانند «دیمتیل فرمامید» و «دیمتیل سولفوکسید» انجام شود، شاهد افزایشی خواهد بود. برای مثال به واکنش زیر در حضور نوکلئوفیل هیدروکسید توجه کنید.
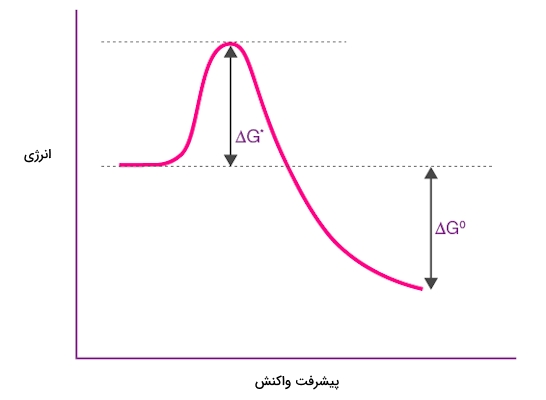
حدواسط مکانیسم
در حدواسط مکانیسم اتم کربن و اتمهای دیگر متصل به آن آرایشی تخت دارند. همانطور که در نمودار زیر مشاهده میکنید، سطح انرژی حدواسط بسیار بالاتر از سطح انرژی محصول است.
مکانیسم
مکانیسم دیگری نیز برای واکنش جانشینی نوکلئوفیلی وجود دارد که آن را با نام میشناسیم. در سرعت این واکنش، قدرت نوکلئوفیل تاثیری ندارد و میتوان معادله سرعت آن را بهصورت زیر نمایش داد که در آن منظور از واکنشدهنده دارای گروه ترککننده است.
بنابراین میتوان اینطور جمعبندی کرد که در این واکنش تنها توانایی ترککنندگی گروه ترککننده مهم و موثر است و مقدار و نوع نوکلئوفیل روی سرعت بیاثر است. مکانیسم این واکنش شامل تولید کربوکاتیون است که آن را در زیر مشاهده میکنید. این واکنش در دو مرحله صورت میگیرد.
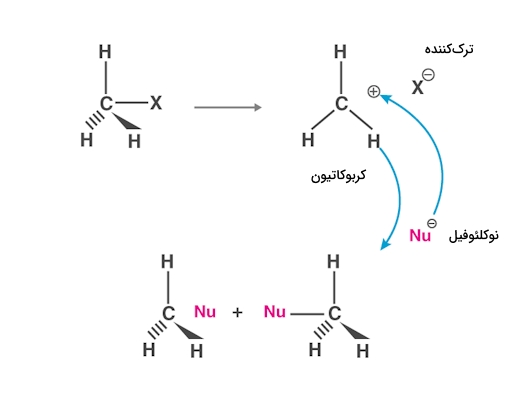
میخواهیم بدانیم در هر بخش از این واکنش چه مراحلی طی میشود. در مرحله اول پیوند بین کربن و گروه ترککننده شکسته میشود و کربوکاتیون به وجود میآید، سپس نوکلئوفیل به این کربوکاتیون حمله میکند. در واکنشی چند مرحلهای مثل این مورد، سرعت واکنش توسط کندترین مرحله کنترل میشود.
در این مورد تشکیل کربوکاتیون مرحله کندتری است و به همین دلیل سرعت حمله نوکلئوفیل برای تشکیل محصول تاثیری بر سرعت واکنش نخواهد داشت. از طرفی در این مکانیسم برخلاف مکانیسم که پیش از این به آن پرداختیم، نوکلئوفیل میتواند از دو سمت به کربوکاتیون حمله کند و به همین دلیل محصولی که به دست میدهد، «مخلوط راسمیک» (Racemic Mixture) است.
در این مورد سرعت واکنش به پایداری کربوکاتیون به وجود آمده بستگی دارد. همانطور که میدانید کربوکاتیون نوع ۳ از کربوکاتیون نوع ۲ و آن هم از کربوکاتیون نوع ۱ پایداری بیشتری دارد. همچنین به دلیل افزایش یونیزاسیون کربوکاتیون، واکنش در حضور حلال قطبی پروتیک با سرعت بیشتری انجام میشود.
تشخیص نوکلئوفیل و الکتروفیل
پیشتر در مورد تفاوتهای موجود بین نوکلئوفیل و الکتروفیل صحبت کردیم. در این بخش میخواهیم به نکاتی بپردازیم که میتوان توسط آنها، این گونهها را راحتتر تشخیص داد. ابتدا به تصویر زیر توجه کنید.
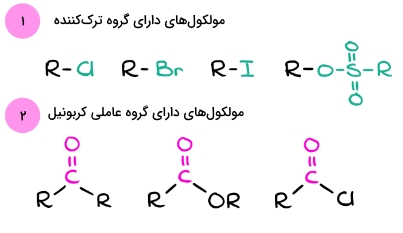
همانطور که در تصویر بالا مشاهده میکنید بسیاری از الکتروفیلها دارای گروههای ترککننده خوب مانند هالیدها و سولفونات استرها هستند. همچنین مشتقات گروه عاملی کربونیل مانند کتون، آلدهید و کربوکسیلیک اسیدها نیز الکتروفیل به شمار میروند. در تصویر زیر میتوانید نوکلئوفیلها را مشاهده کنید.
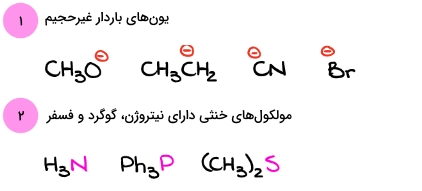
دو دسته مهم و پرتکرار از نوکلئوفیلها را آوردهایم. توجه داشته باشید که تعداد نوکلئوفیلها و الکتروفیلها بسیار زیاد است و داشتن دستهبندی کاملی از آنها دشوار خواهد بود. یکی از راههای موثر این است که هر گونه را در واکنش مورد نظر خود مورد بررسی قرار دهیم و با توجه به اطلاعاتی که در دست داریم، به نوکلئوفیل یا الکتروفیل بودن آن پی ببریم. در ادامه این مورد را مشاهده میکنید.
تشخیص نوکلئوفیل و الکتروفیل در واکنش
تا اینجا با نوکلئوفیل و الکتروفیل آشنا شدیم و ویژگیهای آنها را مورد بررسی قرار دادیم. حال میخواهیم بدانیم این دو اگر در کنار یکدیگر در واکنشی شیمیایی حضور داشته باشند، چگونه قابل تشخیص هستند. برای پی بردن به این مورد تعدادی مثال را تحت شرایط متفاوت بررسی میکنیم.
محصولات و مکانیسم واکنش معلوم
اولین حالتی که میخواهیم بررسی کنیم، حالتی است که در آن هم محصولات، هم مکانیسم واکنش در دست است. برای مثال به واکنش زیر توجه کنید. در این مورد تشخیص الکتروفیل و نوکلئوفیل بسیار ساده است و تنها نیاز داریم که مسیر حرکت الکترون از گونهای به گونه دیگر را دنبال کنیم.
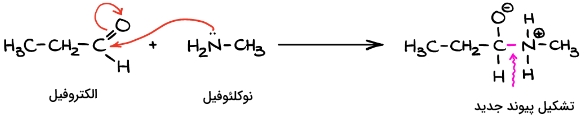
در این واکنش، مولکول سمت چپ که آلدهید است، گیرنده الکترون از مولکول آمین در سمت راست است. به این صورت که الکترون از آمین به آلدهید منتقل میشود. بنابراین میتوان آمین را نوکلئوفیل و آلدهید را الکتروفیل دانست. پیشتر گفتیم که نوکلئوفیل گونهای است که با در اختیار قرار دادن زوجالکترون خود باعث تشکیل پیوند جدیدی میشود که در این مورد در محصول، با رنگ صورتی مشخص شده است. الکترون مورد نیاز برای تشکیل این پیوند از نیتروژن آمینی تامین شده است.
محصولات معلوم و مکانیسم واکنش نامعلوم
در دومین مورد، محصول واکنش را در دست داریم اما نمیدانیم این محصول توسط چه مکانیسمی تولید میشود. از آنجا که مکامیسم واکنش نامعلوم است، باید خودمان در مورد مسیر حرکت الکترون از گونهای به گونه دیگر جمعبندی کنیم. برای این کار ابتدا باید بدانیم در محصولات چه پیوندی تشکیل و در واکنشدهندهها چه پیوندهایی تخریب شده است. به واکنش زیر توجه کنید.

با توجه به ساختار محصول متوجه میشویم که در آن پیوند جدیدی بین کربن و اکسیژن تشکیل شده است. همچنین باید پیوند بین برم و نیز از بین برود زیرا در سمت راست، برم به صورت گونهای مجزا حضور دارد. گفتههای بالا را میتوانید در تصویر زیر مشاهده کنید. این مدل کمک میکند تا درک بهتری نسبت به شرایط واکنش پیدا کنیم.
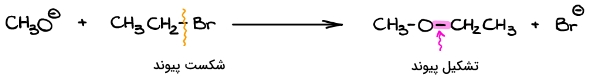
در مرحله بعد باید جریان الکترون را در واکنش مشخص کنیم. از آنجا که با شکست پیوند برم، گونهای با بار منفی به جا مانده است، میتوان تصور کرد که به دلیل داشتن چگالی الکترون، نقش نوکلئوفیل را ایفا کند. در حالت کلی اگر واکنشی بین یک گونه با بار منفی و گونهای خنثی داشته باشیم، گونه با بار منفی نوکلئوفیل واکنش است.
همچنین اگر واکنشی بین یک گونه خنثی و گونهای با بار مثبت انجام شود، از آنجا که چگالی الکترون در گونه خنثی به نسبت بیشتر است، همان نوکلئوفیل خواهد بود. بنابراین در این واکنش اکسيژن منفی نوکلئوفیل است و به کربن متصل به برم حمله میکند.
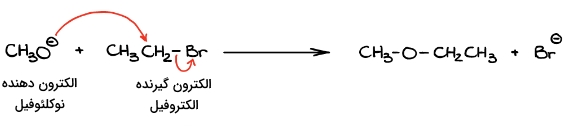
از آنجا که میدانیم در محصول پیوندی بین اکسیژن و کربن تشکیل میشود، فرض ما در مورد نوکلئوفیل و الکتروفیل صحیح است زیرا همین انتقال الکترون از نوکلئوفیل به الکتروفیل است که باعث تشکیل پیوند شیمیایی جدید میشود.
محصولات و مکانیسم واکنش نامعلوم
این مورد از موارد دیگر دشوارتر است زیرا در آن تنها واکنشدهندهها در دست است و اطلاعی از مکانیسم و محصولات نداریم. اولین کاری که باید انجام دهیم پیدا کردن نقاطی با چگالی الکترون بالا یا دارای زوجالکترون و پیدا کردن نقاطی با چگالی الکترون پایین یا دارای بار مثبت است. پیدا کردن زوجالکترون به نسبت ساده است.
برای این کار ابتدا موقعیت اتم مورد نظر را در جدول تناوبی عناصر مییابیم و سپس تعداد الکترونهای مورد نیاز آن برای رسیدن به قاعده اکتت را محاسبه میکنیم. توجه داشته باشید که در برخی موارد جایگاه زوجالکترونهای غیرپیوندی اتمها از پیش تعیین شده است. همانطور که در تصویر زیر مشاهده میکنید دو احتمال برای نوکلئوفیل و یک احتمال برای الکتروفیل وجود دارد.
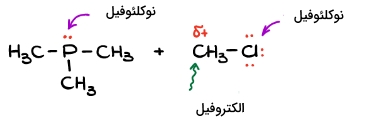
برای پیدا کردن بار جزئی نیاز داریم تا اختلاف الکترونگاتیوی بین دو عنصر را بدانیم. با این حال نمیتوان مقدار الکترونگاتیوی را برای تمامی عناصر به یاد داشت. برای این کار به تصویر زیر توجه کنید. در این تصویر عنصرهای پرتکرار در مولکولهای آلی، آورده شدهاند.
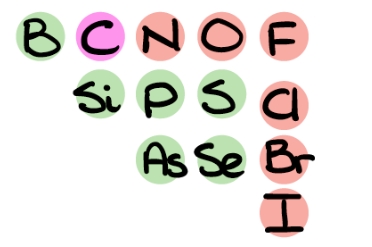
عنصرهایی که با رنگ قرمز مشخص شدهاند، توانایی قطبی کردن کربن را دارند و در صورت مشاهده آنها میتوان بار جزئی مثبت را به کربن اختصاص داد. از طرفی عنصرهایی که آنها را به رنگ سبز مشاهده میکنید، باعث به وجود آمدن تغییر چندانی در چگالی الکترونی کربن نمیشوند.
بنابراین میتوان اینطور جمعبندی کرد که در صورت مشاهده پیوند کربن با هر یک از عنصرهای نیتروژن، اکسيژن، فلوئور، کلر و برم به آن بار جزئی مثبت را نسبت میدهیم، تنها در این صورت است که میتوان در مورد الکتروفیلها و نوکلئوفیلهای احتمالی موجود در هر واکنش به نتیجهای رسید.
نکته مهم دیگری که باید در این مورد در نظر داشته باشید این است که در صورت وجود نوکلئوفیل و الکتروفیل در مجاورت هم در یک مولکول، تنها یکی از آنها را باید به شمار آورد. در این مورد از آنجا که مولکول سمت چپ به عنوان نوکلئوفیل مشخص شده است، مولکول سمت راست را الکتروفیل مینامیم.
با شناسایی این دو گونه، مسیر حرکت الکترون را از نوکلئوفیل به الکتروفیل در نظر میگیریم تا به محصول مورد نظر برسیم. جریان الکترون را در تصویر زیر با رنگ قرمز نشان دادهایم.
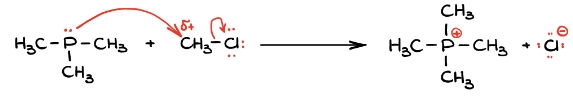
در تصویر بالا، فلشی از اتم فسفر به کربن رسیم میکنیم تا نشاندهنده مسیر انتقال الکترون از نوکلئوفیل به الکتروفیل باشد. در صورتی که این اتم کربن، الکترونهای جدید را بپذیرد در ساختار خود، بیش از اندازه الکترون خواهد داشت، بنابراین باید تعدادی از آنها را با شکستن یکی از پیوندهای خود از دست بدهد. بهطور کلی همیشه پیوندی شکسته میشود که حاوی گروه ترککننده بهتری باشد. گروه ترککننده خوب، گونهای است که میتواند در شکستن پیوند، بار منفی را روی خود بپذیرد یا خنثی باقی بماند.
در این مورد میتوان هم یکی از پیوندهای هیدروژنی، هم پیوند کلر با کربن را شکست. با مقایسه این دو متوجه میشویم که کلر ترککننده بسیار بهتری است زیرا یون پایدارتری را به وجود میآورد.
مثال و حل تمرین
حال که میدانیم نوکلئوفیل چیست و چگونه قابل تشخیص است، میخواهیم به بررسی تعدادی مثال به همراه پاسخ تشریحی بپردازیم. در ادامه نیز برای تکمیل درک خود از این مفهوم، تعدادی تمرین چندگزینهای را مورد بررسی قرار میدهیم.
مثال
در این بخش به مرور تعدادی مثال میپردازیم و در هر مورد پاسخ تشریحی را نیز به همراه آن میآوریم.
مثال اول
یون هیدروکسید در واکنش زیر نوکلئوفیل است یا الکتروفیل؟
پاسخ
یون هیدروکسید در این واکنش یک نوکلئوفیل است زیرا طبق تعریف، نوکلئوفیلها گونهای غنی از الکترون است که زوجالکترون خود را در اختیار گونه دارای کمبود الکترون قرار میدهد.
مثال دوم
کدام یک از گونههای زیر بیشترین قدرت نوکلئوفیلی را دارد؟
، ، ،
پاسخ
این گونهها با اینکه از یکدیگر متفاوت هستند، به یک گروه جدول تناوبی تعلق دارند، بنابراین روند نوکلئوفیلی آنها را میتوان با روند بازی آنها مقایسه کرد. در این بین قویترین نوکلئوفیل است. روند کاهش قدرت نوکلئوفیلی در این ترکیبات را میتوان بهصورن زیر نمایش داد.
مثال سوم
آیا نوکلئوفیل خوبی به شمار میرود؟
پاسخ
نوکلئوفیل خوبی است زیرا گوگرد الکترونگاتیوی پایینی دارد و مولکول میتواند به راحتی قطبیده شود بهصورتی که تیولها نوکلئوفیلهای بسیار خوبی هستند.
مثال چهارم
خانواده الکلها نوکلئوفیل هستند یا الکتروفیل؟
پاسخ
الکلها هم نوکلئوفیل و هم الکتروفیل هستند. اتم اکسیژن در الکل غنی از الکترون است و این باعث میشود تا نوکلئوفیل خوبی به حساب بیاید. همچنین الکل میتواند پروتونه شود و نقش الکتروفیل را ایفا کند.
مثال پنجم
بر چه اساسی میتوان در مورد قدرت نوکلئوفیلها اظهار نظر کرد؟
پاسخ
هرچه نوکلئوفیلی توانایی بیشتری در دهندگی الکترون داشته باشد، بهتر و قویتر است. هرچه الکترونهای نوکلئوفیل در دسترستر باشد، بهتر است و میتواند راحتتر تشکیل پیوند دهد. به همین دلیل نوکلئوفیلهایی که روی خود بار منفی دارند بسیار خوب هستند. به همین صورت نوکلئوفیلی که الکترون خود را راحت در اختیار قرار ندهد، نوکلئوفیل ضعیفی به شمار میرود.
مثال ششم
کدام یک از ترکیبات زیر نوکلئوفیل بهتری است؟
یا
پاسخ
گونههایی که چگالی الکترونی بیشتری دارند، نوکلئوفیل بهتری نیز به شمار میروند، به همین دلیل آنیون نسبت به خنثی، نوکلئوفیل قویتر و بهتری است.
مثال هفتم
آیا واکنش جانشینی با مکانیسم باعث تغییر در شیمی فضایی میشود؟
پاسخ
بله زیرا در این نوع مکانیسم، حمله همیشه از سمت پشت مولکول است و تغییری در شیمی فضایی محصول ایجاد میکند.
مثال هشتم
چرا واکنش جانشینی نوکلئوفیلی با مکانیسم در حلالهای قطبی پروتیک با سرعت بسیار کمتری انجام میشود؟
پاسخ
واکنش جانشینی نوکلئوفیلی در حلالهای قطبی پروتیک با سرعت بسیار کمتری انجام میشود زیرا حلالپوشی نوکلئوفیلها توسط حلالهای قطبی پروتیک انجام میشود و مانع از شرکت آن در حمله نوکلئوفیلی میشود. به همین دلیل نیز پیشنهاد میشود در این واکنش از حلال قطبی آپروتیک استفاده شود.
مثال نهم
چرا هالوآلکانهای نوع سوم در واکنش جانشینی نوکلئوفیلی با مکانیسم شرکت نمیکند؟
پاسخ
هالوآلکانهای نوع سوم مولکولهای حجیمی هستند و نمیتوانند در واکنش با مکانیسم شرکت کنند. در واقع حضور گروههای حجیم آلکیلی در اطراف کربن مرکزی مانع از حمله نوکلئوفیلی میشود. به همین دلیل سرعت تشکیل محصول در هالوآلکان نوع اول بیشتر از هالوآلکان نوع دوم و آن هم بیشتر از هالوآلکان نوع سوم است.
حل تمرین
در این بخش میخواهیم به بررسی تعدادی تمرین چندگزینهای پیرامون نوکلئوفیلها بپردازیم.
تمرین اول
تمرین دوم
تمرین سوم
تمرین چهارم
تمرین پنجم
تمرین ششم
تمرین هفتم
تمرین هشتم
تمرین نهم
تمرین دهم
تمرین یازدهم
تمرین دوازدهم
تمرین سیزدهم
تمرین چهاردهم
سوالات متداول
حال که میدانیم نوکلئوفیل چیست و چگونه قابل تشخیص است، میخواهیم به برخی از مهمترین و پرتکرارترین سوالات پیرامون آن پاسخ دهیم.
تفاوت باز و نوکلئوفیل چیست؟
بازها خانوادهای از ترکیبات هستند که زیرشاخه نوکلئوفیلها به شمار میروند. در صورتی که الکتروفیل مورد حمله یک نوکلئوفیل، پرتون باشد، آن را باز مینامیم. بنابراین تمامی بازها نوکلئوفیل هستند اما هر نوکلئوفیلی باز نیست.
آیا استون نوکلئوفیل خوبی به حساب میآید؟
خیر، استون نوکلئوفیل ضعیفی است.
چرا آلدهیدها نسبت به کتونها واکنشپذیری بیشتری در برابر نوکلئوفیلها دارند؟
زیرا فاقد ممانعت فضایی هستند که در کتونها وجود دارد و باعث کاهش واکنشپذیری میشود.
مهمترین تفاوت الکتروفیل و نوکلئوفیل چیست؟
الکتروفیلها گونههای پذیرنده الکترون هستند در حالی که نوکلئوفیلها الکتروندهنده به شمار میآیند.
الکتروفیل چیست؟
الکتروفیل گونهای با بار مثبت یا خنثی است که کمبود الکترون دارد و به همین دلیل پذیرنده آن است.
چه زمانی نوکلئوفیلی باز است؟
اگر نوکلئوفیلی به هیدروژن حمله کند، باز است.
قدرت نوکلئوفیل در کدام یک از مکانیسمهای واکنش جانشینی نوکلئوفیلی تاثیر دارد؟
قدرت نوکلئوفیلی تنها در واکنش جانشینی نوکلئوفیلی با مکانیسم تاثیر میگذارد.
جمعبندی
هدف از این مطلب مجله فرادرس بررسی دستهبندی بسیار مهمی از ترکیبات در شیمی، با عنوان نوکلئوفیلها بود. نوکلئوفیلها ترکیباتی هستند که یک زوجالکترون ناپیوندی روی خود دارند و با اشتراکگذاری آن با مولکول دیگر، پیوندی کووالانسی تشکیل میدهند. گونه دیگر الکتروفیل نامیده میشود و طبق تعریف کمبود الکترون دارد و با پذیرش الکترون از نوکلئوفیل این کمبود را جبران میکنند.
در ادامه به بررسی انواع شرایط مختلف روی قدرت نوکلئوفیلها و رابطه آنها با ترکیبات بازی پرداختیم. در نهایت نیز برای عمیق بخشیدن به درک خود از این مفهوم، تعدادی مثال به همراه پاسخ تشریحی و تعدادی تمرین چندگزینهای را مورد بررسی قرار دادیم.












