فرمول های شیمی یازدهم در یک نگاه
کتاب شیمی یازدهم یکی از مهمترین کتب علم شیمی دبیرستان است. در این کتاب به موضوعات مهمی از جمله شیمی خوراکیها و پوشاک پرداخته شده و بسیار کاربردی است. همچنین فرمول های شیمی یازدهم از مهمترین فرمولها در مسائل کنکور هستند. در پایههای مختلف دبیرستان تنها در این مطالب به شیمی آلی و هیدروکربنها پرداخته شده است. به همین دلیل یادگیری عمیق فرمول های شیمی یازدهم بسیار حائز اهمیت است. در این مطلب از مجله فرادرس به بررسی فرمول های شیمی یازدهم میپردازیم و نکات مهم آنها مانند نامگذاری هیدروکربنها و مباحث ترمودینامیکی و سینتیکی واکنشهای شیمیایی را بررسی میکنیم.
- یاد میگیرید فرمولهای کلیدی شیمی یازدهم را در حل مسائل بهکار ببرید.
- یاد خواهید گرفت بازده درصدی، درصد خلوص و پارامترهای اساسی را محاسبه کنید.
- میآموزید هیدروکربنها را نامگذاری کرده و ایزومرها را تشخیص دهید.
- خواهید توانست مفاهیم آنتالپی، ظرفیت گرمایی و قانون هس را تحلیل کنید.
- با روشهای تعیین سرعت واکنش و عوامل تأثیرگذار بر آن آشنا میشوید.
- شیوه استفاده از منابع ویدیویی برای یادگیری عمیق شیمی یازدهم را میآموزید.


در ابتدای این مطلب به توضیح و بررسی فرمول های شیمی یازدهم فصل اول می پردازیم که شامل مباحثی مانند درصد خلوص مواد، بازده درصدی و نامگذاری هیدروکربنها است. در ادامه به سراغ فصل دوم این کتاب رفته و مباحث مهم ترمودینامیکی مانند آنتالپی واکنش و ظرفیت گرمایی را بررسی میکنیم و سپس به قانون هس و سرعت واکنشها میپردازیم. در نهایت فرمول های شیمی یازدهم فصل سوم را نام برده و به مهمترین مباحث مربوط به شیمی آلی مانند گروههای عاملی و پلیمرها می پردازیم. با مطالعه این مطلب تا انتها، این فرمولها و مسائل مربوط به آنها را بیاموزید.
فرمولهای شیمی یازدهم فصل اول
در جدول زیر فرمول های شیمی یازدهم فصل اول ارائه شده است. پس از نگاهی کلی به این فرمولها، به بررسی مباحث مهم مربوط به آنها میپردازیم.
| مبحث مطرح شده | فرمول |
| شعاع اتمی | نصف فاصله بین هستههای دو اتم یکسان |
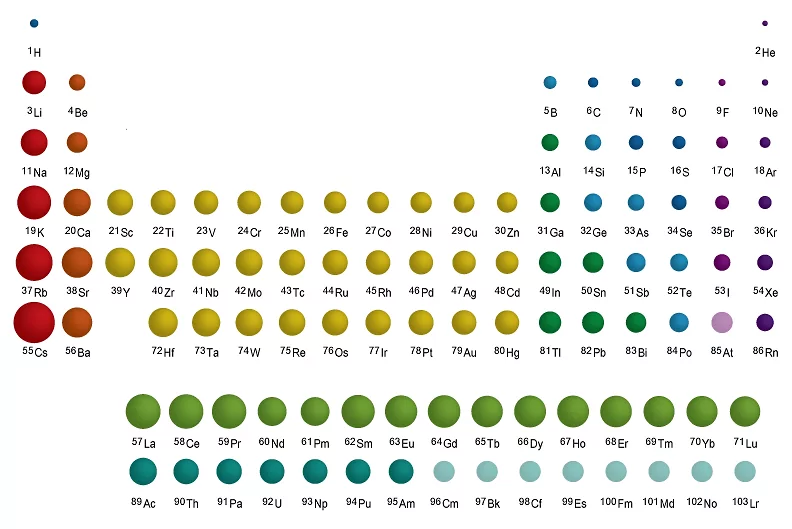
| روند تغییر شعاع اتمی در جدول تناوبی | در هر گروه از بالا به پایین افزایش، در هر دوره از چپ به راست کاهش |
| واکنش آهن (II) کلرید و سدیم هیدروکسید | |
| واکنش آهن (III) کلرید و سدیم هیدروکسید | |
| واکنش آهن و هیدروکلریک اسید و سدیم هیدروکسید |
|
| واکنش مس (II) سولفات و میخ آهنی | |
| واکنش اکسید آهن و سدیم فلزی | |
| واکنش اکسید آهن و مس فلزی | |
| واکنش اکسید آهن و کربن | |
| واکنش سدیم اکسید و کربن | واکنش نمیدهد. |
| واکنش اکسید آهن (III) و عنصر کربن | |
| معادله درصد خلوص | درصد خلوص ماده = جرم ماده خالص تقسیم بر جرم کل نمونه × ۱۰۰ |
| معادله بازده درصدی | بازده واکنش = بازده عملی تقسیم بر بازده نظری × ۱۰۰ |
| واکنش بیهوازی تخمیر گلوکز | |
| واگنش فلز آهن و هیدروکلریک اسید | |
| واکنش ترمیت | |
| واکنش آهن (III) اکسید و کربن مونوکسید | |
| ارایش الکترونی اتم کربن | |
| نام گذاری آلکآنها | شاخه فرعی به صورت آلکیل + نام آلکان راست زنجیر |
| واکنش تولید کلسیم سولفیت | |
| واکنش آلومینیوم با سولفات مس (II) | |
| واکنش سیلیسیم دی اکسید و کربن | |
| واکنش تیتانیوم (IV) کلرید و منیزیم | |
| واکنش آهن (III) اکسید و تیتانیوم | |
| واکنش آهن (III) اکسید و منیزیم | |
| واکنش تهیه مس از سنگ معدن آن | |
| واکنش تبدیل هگزان به هگزن |
شعاع اتمی
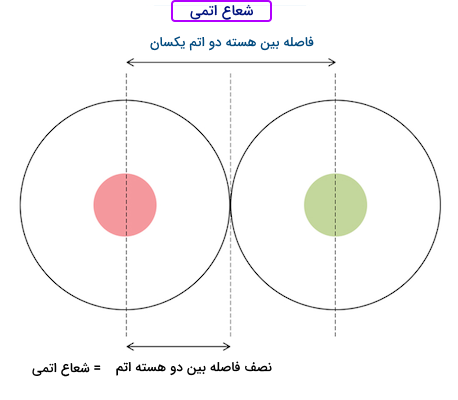
شعاع اتمی یک اتم میزان فاصله هسته آن تا خارجیترین الکترون آن اتم است. اتم از سه ذره کوچکتر نوترون، پروتون و الکترون ساخته شده است. پروتونها و نوترونها هسته اتم ها را تشکیل میدهند و الکترونها در فضای ابری کوچکی اطراف هسته اتم قرار گرفتهاند. شعاع اتمی مانند شعاع یک دایره در نظر گرفته میشود. هسته اتم در وسط دایره و مدار خارجیترین الکترون اتم، شعاع دایره را تشکیل میدهند.
شعاع اتمی کووالانسی برای مولکولهایی درنظر گرفته میشود که از اتمهای یکسان تشکیل شدهاند و پیوند کووالانسی دارند. در این مولکولها شعاع اتمی برابر با نصف فاصله بین دو هسته اتم در نظر گرفته میشود. تصویر زیر شعاع اتمی را نمایش میدهد.
روند تغییر شعاع اتمی در جدول تناوبی به این شکل است که شعاع اتمی در هر گروه از بالا به پایین افزایش یافته و در هر ردیف از چپ به راست کاهش مییابد. تصویر زیر این روند تغییر شعاع اتمی در جدول تناوبی را نمایش میدهد.
درصد خلوص مواد
درصد خلوص مواد یکی از مهمترین پارامترهایی است که در فرمول های شیمی یازدهم بیان میشود. این پارامتر نسبت میزان ماده خالص را در کل نمونه نمایش میدهد. از تقسیم مقدار جرم ماده خالص بر جرم کل نمونه و ضرب آن در ۱۰۰، درصد خلوص ماده به دست میآید.
درصد خلوص ماده = جرم ماده خالص تقسیم بر جرم کل نمونه × ۱۰۰
مثال درصد خلوص
اگر در یک نمونه ۱۰ گرمی، ۸ گرم ماده خالص وجود داشته باشد و باقی آن ناخالصی باشد، میزان درصد خلوص ماده را محاسبه کنید.
پاسخ
مقدار درصد خلوص ماده نسبت ماده خالص به کل نمونه را نشان میدهد. پس درصد خلوص این ماده برابر با ۸ گرم بر ۱۰ گرم یعنی ۸۰ درصد است.
بازده درصدی
بازده درصدی مشخص میکند برای مقدار مشخصی از مواد واکنش دهنده، چه میزان فراورده تولید خواهد شد. به این پارامتر بازده نظری گفته میشود. بازده عملی با انجام گرفتنن واکنش و مقایسه میزان فراورده و واکنشدهنده محاسبه میشود. فرمول محاسبه بازده واکنش به شکل زیر است.
بازده واکنش = بازده عملی تقسیم بر بازده نظری × ۱۰۰
بازده واکنش صددرصدی بدین معنا است که هیچ مادهای طی واکنش از دست نرفته است. بازده واکنش ۰ درصدی بدین معناست که هیچ فراوردهای تولید نشده است. به دلایل مختلفی مقادیری از واکنشدهندهها یا فراوردهها طی واکنش ممکن است از سیستم واکنش خارج شوند و بازده واکنش کمتر از ۱۰۰ درصد باشد. از این موارد می توان به موارد زیر اشاره کرد.
-
- از دست رفتن مواد طی فرایندهای صاف کردن
- از دست رفتن مواد با تبخیر شدن آنها
- از دست دادن مواد طی جابهجا کردن مایعات
- واکنش ندادن تمامی مقادیر واکنش دهندهها و باقی ماندن آنها به شکل اولیه
مثال بازده درصدی
معادله واکنش تجزیه منیزیم کربنات مقدار ۱۵ گرم از منیزیم اکسید را طی واکنش زیر تولید میکند.
مقدار بازده نظری این واکنش ۱۹ گرم است. بازده واکنش کلی را برای تولید منیزیم اکسید محاسبه کنید.
پاسخ
مقدار ۱۵ گرم داده شده در صورت واکنش، میزان بازده عملی را مشخص میکند. با جایگذاری مقادیر بازده عمل و نظری در فرمول محاسبه بازده واکنش، مقدار آن به دست میآید.
نامگذاری هیدروکربنها
در یادگیری فرمول های شیمی یازدهم با نامگذاری هیدروکربنهای آلی آشنا میشوید. هیدروکربنها ترکیباتی هستند که تنها از عناصر کربن و هیدروژن تشکیل شدهاند. اتمهای کربن از ۴ الکترون ظرفیت تشکیل شدهاند. این خاصیت به آنها توانایی تشکیل پیوندها متفاوتی را میدهد.
یک اتم کربن میتواند با یک، دو، سه یا چهار اتم دیگر پیوند داشته باشد و بدین ترتیب پیوندهای یک، دو و سهگانه تشکیل دهد. هیدروکربنها به سه دسته کلی تقسیم میشوند.
- هیدروکربنهای آلیفاتیک، زنجیرههای کربنی مستقیم را تشکیل میدهند.
- هیدوکربنهای آلیسیلیک ، حلقههای کربنی تشکیل میدهند.
- هیدروکربنهای آروماتیک شامل حلقه بنزنی هستند.
هیدروکربنهای آلیفاتیک بسته به پیوندهای بین کربنهای زنجیره اصلی به سه دسته تقسیم میشوند. این سه دسته در ادامه نوشته شده است.
- الکآنها تنها پیوندهای یگانه بین اتمهای کربن زنجیره اصلی دارند.
- آلکنها حداقل یک پیوند دوگانه بین اتمهای کربن زنجیره اصلی دارند.
- الکینها حداقل یک پیوند سهگانه بین اتمهای کربن زنجیره اصلی هیدروکربنی دارند.
هیدروکربنهای بسیار متعدد و متفاوتی در دنیا وجود دارند به همین دلیل سیستم آیوپاک برای نامگذاری آنها روشی واحد را ارائه کرده است. نامگذاری هیدروکربنها در فرمول های شیمی یازدهم به روش آیوپاک شامل چند مرحله ساده است که در ادامه نام برده میشود.
- اولین مرحله نامگذاری به طول طولانیترین زنجیره کربن در مولکول بستگی دارد.
- انتهای نام هیدروکربن بسته به تعداد پیوند های بین کربنها نامگذاری میشود.
-
- اگر تنها پیوندهای یگانه در زنجیره وجود داشته باشد، انتهای نام پسوند «ان» میگیرد.
- اگر پیوند یا پیوندهای دوگانه در زنجیره اصلی داشته باشیم، انتهای نام هیدروکربن پسوند «-ِن» میگیرد.
- اگر پیوند سهگانه در زنجیره اصلی داشته باشیم، انتهای نام هیدروکربن، پسوند «ین» میگیرد.
- گروههای عاملی (شاخههای متصل به زنجیره اصلی) بسته به طول آنها و تعداد آنها نامگذاری میشوند.
- گروههای عاملی بسته به موقعیت آنها با شماره کربنی که به آن متصل هستند مشخص میشوند.
- شمارهگذاری اتمهای کربن از سمتی که به اولین گروه عاملی نزدیکتر باشد انجام میگیرد. برای مثال اگر از یک طرف گروه عاملی روی اتم شماره ۳ و از سمت دیگر روی اتم شماره ۵ قرار داشته باشد، سمتی که اتم شماره ۳ شامل گروه عاملی باشد جهت صحیح شمارهگذاری اتمهای کربن است.
در ادامه برای درک بهتر این سیستم نامگذاری جداولی شامل نکات مهم نامگذاری هیدروکربنها ارائه شده است.
جدول نامگذاری بر اساس تعداد کربنها
نامگذاری هیدروکربنها به تعداد اتمهای کربن وابسته است. تعداد کربنهای موجود در زنجیره اصلی و گروههای عاملی، نامگذاری آن ها را تغییر میدهد. در جدول زیر این شیوه مشخص شده است.
| تعداد اتم کربن | پیشوند برای نام زنجیره اصلی | گروه عاملی |
| ۱ | مِت- | متیل |
| ۲ | اِت- | اتیل |
| ۳ | پروپ- | پروپیل |
| ۴ | بوت- | بوتیل |
| ۵ | پِنت- | پنتیل |
| ۶ | هِگز- | هگزیل |
| ۷ | هِپت- | هپتیل |
| ۸ | اُکت- | اکتیل |
| ۹ | نون- | نونیل |
| ۱۰ | دِک- | دسیل |
جدول نامگذاری بر اساس نوع پیوندها
نامگذاری زنجیره اصلی بر اساس نوع پیوندهای یک، دو یا سهگانه اتمهای کربن زنجیره اصلی متفاوت خواهد بود. این روند نامگذاری در جدول زیر مشخص شده است.
| نوع هیدروکربن | بالاترین نوع پیوند | پیشوند-پسوند |
| آلکان | یگانه | -ان |
| آلکن | دوگانه | -ِن |
| آلکین | سهگانه | -ین |
| سیکلوآلکان | یگانه | سیکلو-ان |
| سیکلوآلکن | دوگانه | سیکلو-ِن |
| سیکلوالکین | سهگانه | سیکلو-ین |
همچنین تعداد گروههای عاملی تکرار شونده در ساختار هیدروکربن با توجه به تعداد آنها در نامگذاری هیدروکربن مشخص میشود. این شیوه نام گذاری به شکل زیر است.
- یک واحد تکرار شونده : نام هیدروکربن تغییری نمیکند
- دو واحد تکرار شونده: دی -
- سه واحد تکرار شونده: تری -
- چهارواحد تکرار شونده: تترا -
مثال نامگذاری هیدروکربنها
در تصاویر زیر هیدروکربنهای رسم شده را با روش آیوپاک نامگذاری کنید.
پاسخ
طبق مراحلی که در قسمت قبل ارائه شد برای نامگذاری ترکیبات هیدروکربنی، باید با توجه به تعداد کربنهای زنجیره اصلی (بلندترین زنجیره)، تعداد گروههای عاملی، مکان گروههای عاملی و نوع پیوند بین کربنی زنجیره اصلی، ترکیبات را نامگذاری کنیم. در عکسهای زیر به ترتیب این مراحل توضیح داده شده و نام ترکیبات مشخص شدهاند.
در تصویر بالا طولانیترین زنجیره از ۸ اتم کربن تشکیل شده است که همه پیوندهای بین آنها از نوع یگانه هستند و شاخه گروه عاملی به هیچکدام از اتمها متصل نیست. نام این ترکیب اکتان است.
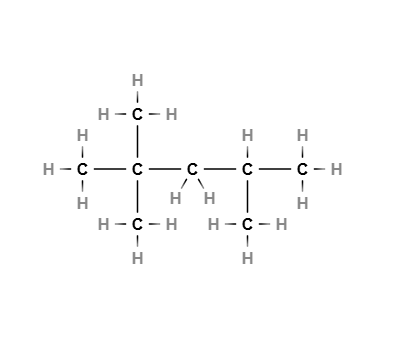
در تصویر بالا بلندترین زنجیره ۵ اتم کربن با پیوندهای یگانه دارد و ۳ گروه عاملی متیل روی اتمهای کربن ۲ و ۴ قرار دارد. نام این ترکیب ۴،۲،۲- تری متیل پنتان است.
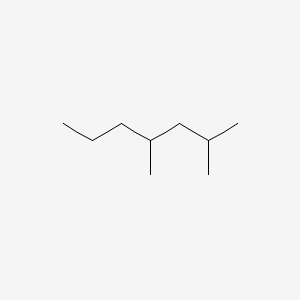
در تصویر بالا بلندترین زنجیر از ۷ اتم کربن با پیوندهای یگانه تشکیل شده است. دو گروه عاملی متیل به اتمهای شماره ۲ و ۴ متصل هستند. نام این ترکیب ۴،۲- دی متیل هپتان است.
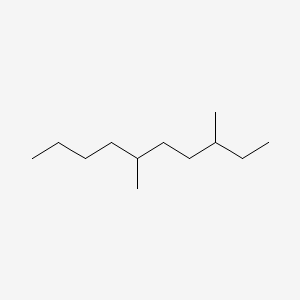
در تصویر بالا بلندترین زنجیر از ۱۰ اتم کربن با پیوندهای یگانه تشکیل شده است. دو گروه عاملی متیل روی اتمهای شماره ۳ و ۶ قرار گرفته است. نام این ترکیب ۶،۳- دی متیل دکان است.
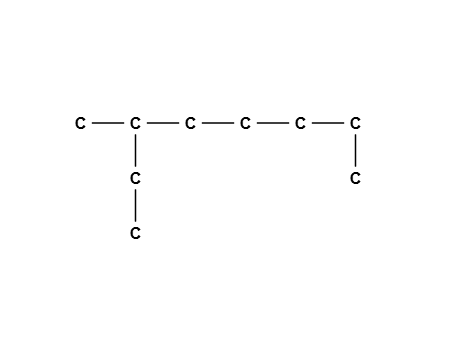
در ترکیب بالا بلندترین زنجیره کربنی شامل ۸ اتم کربن با پیوند یگانه است و یک گروه متیل روی کربن شماره ۳ قرار گرفته است. نام این ترکیب ۳- متیل اکتان است.
توجه داشته باشید که اگر زنجیره اصلی را زنجیره افقی با ۷ اتم کربن در نظر بگیریم، نام ترکیب به ۲ اتیل هپتان تغییر میکند. هردو این نامها صحیح است اما روش قراردادی ارائه شده در فرمول های شیمی یازدهم بیان میکند که زنجیره با بیشترین تعداد کربن به عنوان زنجیره اصلی برای نامگذاری درنظر گرفته شود.
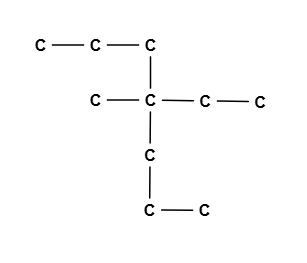
در تصویر بالا بلندترین زنجیره کربنی آن زنجیری است که شامل ۷ اتم کربن است. در این زنجیر یک گروه اتیل و متیل روی اتم کربن شماره ۴ قرار دارد. بدین ترتیب نام این ترکیب ۴ اتیل، ۴ متیل- هپتان است.
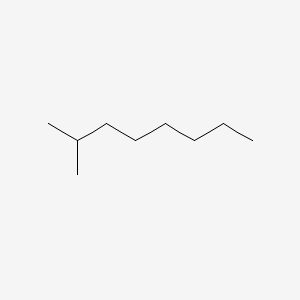
در تصویر بالا طولانیترین زنجیره از ۸ اتم کربن تشکیل شده است و یک گروه متیل روی کربن شماره ۲ قرار دارد. بدین ترتیب نام این ترکیب ۲-متیل اکتان است.
در ادامه برای یادگیری بهتر نام گذاری آلکانها، به مثالها و تمرینهای زیر دقت کنید.
مثال ۱
با توجه به قوانین آیوپاک برای نام گذاری هیدروکربن ها، نام ترکیب زیر را بیابید.
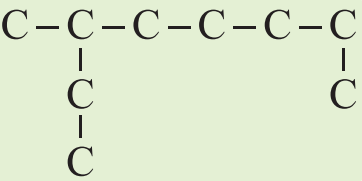
پاسخ
نام این ترکیب «۳- متیل اوکتان» است. برای نامگذاری ترکیب، ابتدا باید بلندترین زنجیره هیدروکربنی را تشخیص داده، تعداد کربنهای آن را شمرده و شمارهگذاری کنیم.

زنجیره اصلی این ماده دارای ۸ کربن با پیوندهای یگانه است پس نام «اکتان» میگیرد. همچنین، تنها یک گروه متیل روی کربن شماره ۳ قرار دارد. توجه داشته باشید، شمارهگذاری کربنها را همواره باید از سمتی انجام دهیم که به گروههای عاملی نزدیکتر باشد. پس نام صحیح این ترکیب، «۳- متیل اوکتان» است.
اگر شمارهگذاری کربن ها را از سمت دیگر انجام میدادیم، نام ترکیب ۶-متیل اوکتان میشود که در نهایت همین ترکیب شیمیایی را نتیجه میدهد اما هماهنگ با قوانین نامگذاری آیوپاک و صحیح نیست.
مثال ۲
با توجه به قوانین آیوپاک برای نام گذاری هیدروکربن ها، نام ترکیب زیر را بیابید.
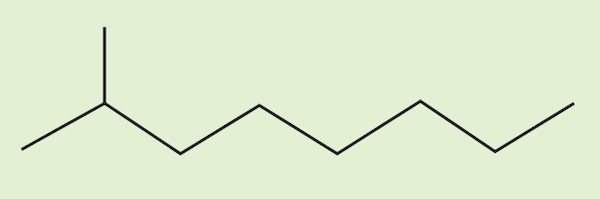
پاسخ
نام این ترکیب «۳- متیل اوکتان» است. برای نامگذاری ترکیب، ابتدا باید بلندترین زنجیره هیدروکربنی را تشخیص داده، تعداد کربنهای آن را شمرده و شمارهگذاری کنیم.
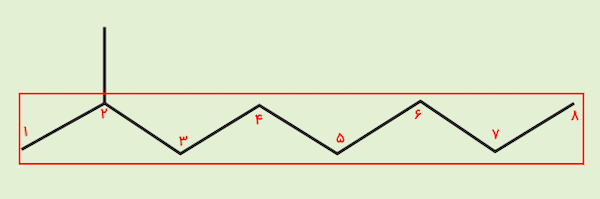
در این نوع نمایش هیدروکربنها، هر سر خط شامل یک اتم کربن است. زنجیره اصلی این هیدروکربن شامل ۸ کربن است و یک گروه متیل روی کربن شماره ۲ این ماده قرار دارد و تمامی پیوندها از نوع یگانه هستند. پس نام این ترکیب، «۳- متیل اوکتان» است.
برای تمرین بیشتر روش نام گذاری هیدروکربن ها با پیوند یگانه، تمرینات زیر را حل کنید.
تمرین ۱
تمرین ۲
تمرین ۳
تمرین ۴
یادگیری فرمول های شیمی یازدهم با فرادرس
شیمی یازدهم یکی از مهمترین کتب شیمی دبیرستان در آمادگی برای امتحان نهایی و کنکور است. برای یادگیری فرمول های شیمی یازدهم باید با مباحثی مانند بررسی جدول تناوبی، شعاع اتمی و هیدروکربنها را بیاموزید. همچنین آشنایی با مسائل مهم ترمودینامیکی مانند فرایندهای گرماده و گرماگیر و آنتالپی واکنشها حائز اهمیت است. مباحث شیمی آلی مانند واکنشهای استری شدن و گروههای عاملی تنها در این پایه آموزش داده میشوند و یادگیری آنها یکی از چالشهای دانشآموزان دبیرستان است. پیشنهاد میکنیم برای یادگیری این مباحث به مجموعه فیلم آموزش پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث میپردازند.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، می توانید به آموزشهای بیشتری در زمینه فرمول های شیمی یازدهم دسترسی داشته باشید.
فرمول های شیمی یازدهم فصل دوم
در ادامه فرمول های فصل دوم شیمی دهم در جدولی ارائه شده و سپس نکات مهم مربوط به آن ها بررسی خواهد شد.
| مبحث مطرح شده | فرمول |
| میزان انرژی جنبشی جرم m با تندی v | |
| نماد دما بر حسب سلسیوس | |
| نماد دما بر حسب کلوین | |
| تغییر دما | |
| نماد و یکای گرما | Q و ژول(J) |
| تبدیل واحد کالری و ژول | |
| واکنش هیدروژن و کلر | |
| واکنش گرماده تولید امونیاک از نیتروژن و هیدروژن | |
| واکنش گرماده تولید امونیاک از هیدرازین و هیدروژن | |
| فرمول انرژی گرمایی | |
| واکنش اکسایش گلوکز | |
| تولید گاز هیدروژن کلرید | |
| واکنش سوختن گرافیت | |
| واکنش سوختن الماس | |
| واکنش تولید بخار آب | |
| واکنش فتوسنتز | |
| فرمول آنتالپی واکنش | Hواکنشدهندهها -Hفراوردهها
مجموع آنتالپی پیوند فراوردهها-مجموع آنتالپی پیوند واکنشدهندهها= |
| واکنش تصعید کربن دی اکسید | |
| واکنش سوختن متان | |
| واکنش تفکیک دی نیتروژن تترا اکسید | |
| واکنش انجماد آب | |
| واکنش تفکیک گاز هیدروژن | |
| واکنش تفکیک متان | |
| واکنس تولید هیدرازین | |
| واکنش تبدیل متان به اتان | |
| واکنش سوختن پروپان | |
| واکنش سوختن ۱-بوتن | |
| واکنش سوختن کامل اتان | |
| واکنش سوختن کامل اتانول | |
| واکنش کلسیم کربنات با هیدروکلریک اسید | |
| واکنش تولید گاز گوگرد تری اکسید | |
| واکنش تبدیل مالتوز به گلوکز | |
| سرعت واکنش | |
| واکنش تفکیک کلسیم کلرید در آب | |
| واکنش تفکیک آمونیوم نیترات در آب | |
| واکنش سوختن چربی شتر | |
| واکنش کاهش اکسید آهن (II) |
آنتالپی واکنش
میزان انرژی شیمیایی که در یک واکنش شیمیایی مصرف یا تولید میشود، آنتالپی واکنش نام دارد. درک انرژی تولید یا مصرف شده در واکنشهای شیمیایی بسیار حائز اهمیت است. واکنشهای گرماگیر واکنشهایی هستند که برای انجام شدن نیاز به دریافت انرژی به صورات گرما را دارند. واکنشهای گرماده واکنشهایی هستند که طی انجام شدن انرژی را به صورت گرما آزاد میکنند. انرژی گرمایی آزاد شده یا دریافت شده در واکنشهای شیمیایی مربوط به پیوندهای واکنشدهندهها و فراوردهها است.
شکستن پیوند بین اتمها یا مولکول های مواد واکنش دهنده به انرژی نیاز دارد و این انرژی به فرم گرما میتواند به واکنش داده شود. گاهی این میزان انرژی مورد نیاز به حدی کم است که نیازی نیست برای انجام شدن واکنش به آن گرما بدهیم و واکنش در دمای اتاق انجام میشود.
تشکیل پیوند های جدید بین اتمها یا مولکول های مواد فراورده باعث آزاد شدن انرژی میشود. اگر فراوردهها از واکنشدهندهها پایدارتر باشند یعنی انرژی گرمایی زیادی توسط فراوردهها آزاد شود، واکنش گرماگیر است. اگر واکنشدهندهها از فراوردهها پایدارتر باشند و انرژی زیادی برای انجام شدن واکنش نیاز باشد، واکنش گرماگیر است.
میزان آنتالپی واکنش با تفاضل آنتالپی فراوردهها و واکنشدهندهها برابر است. فرمول این محاسبه به شکل زیر است.
H واکنشدهندهها - H فراوردهها

آنتالپی پیوند
یکی از پارامترهای فرمول های شیمی یازدهم، آنتالپی پیوند است. آنتالپی پیوند میزان انرژی حرارتی است که صرف شکستن پیوند بین اتمهای یک ماده میشود. در یک واکنش شیمیایی میزان آنتالپی کلی واکنش را میتوان از تفاضل مجموع آنتالپی پیوند فراوردهها و واکنش دهندهها به دست آورد. فرمول این محاسبات به شکل زیر است.
مجموع آنتالپی پیوند فراوردهها - مجموع آنتالپی پیوند واکنشدهندهها =
پیشنهاد میکنیم برای درک بهتر این فرمول و مفهوم آن، مطلب جمع بندی فصل دوم شیمی یازدهم را مطالعه کنید.
مثال اول آنتالپی واکنش
برای درک بهتر مفهوم آنتالپی واکنش در فرمول های شیمی یازدهم، به مثالهای زیر توجه کنید.
با توجه به آنتالپی پیوند N-H میزان آنتالپی واکنش زیر را محاسبه کنید.
میزان آنتالپی پیود N-H برابر با ۳۹۱ کیلوژول بر مول است.
ترکیب دو پیوند نیتروژن - هیدروژن و سه پیوند N-H دارد. میزان آنتالپی واکنش به صورت زیر به دست میآید.
مجموع آنتالپی پیوند فراوردهها - مجموع آنتالپی پیوند واکنشدهندهها =
میزان آنتالپی پیوند واکنشدهندهها تنها شامل پیوندهای است زیرا هیدروژن به صورت تک اتمی در واکنش شرکت کرده و انرژی پیوند ندارد.
مجموع آنتالپی پیوند واکنشدهندهها = ۲×۳۹۱ = ۷۸۲ کیلوژول بر مول
میزان آنتالپی پیوند فراوردهها شامل پیوندهای آمونیاک است.
مجموع آنتالپی پیوند فراوردهها = ۳×۳۹۱ = ۱۱۷۳ کیلوژول بر مول
میزان آنتالپی کلی واکنش از تفاضل این دو مقدار به دست میآید.
مثال دوم آنتالپی واکنش
با توجه به آنتالپی پیوند O-H میزان آنتالپی واکنش زیر را محاسبه کنید.
میزان آنتالپی پیوند O-H برابر با ۴۶۳ کیلوژول بر مول است.
ترکیب $$\text{H}_2\text{O}\$$
مجموع آنتالپی پیوند فراوردهها-مجموع آنتالپی پیوند واکنشدهندهها=
میزان آنتالپی پیوند واکنشدهندهها تنها شامل پیوندهای $$\text{H}_2\text{O}\$$
مجموع آنتالپی پیوند واکنشدهندهها = ۲×۴۶۳= ۹۲۶ کیلوژول بر مول
و همانطور که بیان شد میزان آنتالپی فراوردهها برابر با صفر است. میزان آنتالپی کل واکنش از تفاضل این دو مقدار به دست میآید.
در مطلب زیر از مجله فرادرس به توضیح و بررسی آنتالپی واکنشها و مثالهای آن پرداختهایم.
ظرفیت گرمایی
مواد مختلف پاسخهای متفاوتی به انرژی گرمایی میدهند. مقدار انرژی حرارتی لازم برای افزایش دمای یک ماده به اندازه یک درجه سلسیوس (سانتیگراد)، میزان ظرفیت گرمایی آن است. برای مثل اگر یک صندلی فلزی را برای ساعتها در معرض آفتاب مستقیم قرار دهیم، بسیار داغ و سوزان میشود. اما اگر همان مقدار آب را در برابر آفتاب قرار دهیم، به آن اندازه گرم نمیشود. این بدان معنا است که میزان ظرفیت گرمایی آب بسیار بالاتر از آهن ست و میتواند گرمای بیشتری را جذب کند. از این ویژگی آب باعث شده از این ماده در بسیاری از فرایندها به عنوان سرد کننده استفاده شود زیرا گرمای محیط را به خوبی جذب می کند بی آنکه خود تغییر دمای زیادی را تجربه کند.
گرمای ویژه
میزان انرژی حرارتی مورد نیاز برای افزایش دمای یک گرم از یک ماده به اندازه ۱ درجه سلسیوس، میزان گرمای ویژه آن است. در مثال ارائه شده در قسمت قبل، میزان گرمای ویژه آب برابر با ۴٫۱۸ ژول بر گرم درجه سانتیگراد و میزان گرمای ویژه آهن برابر با ۰٫۴۵ ژول بر گرم درجه سانتیگراد است. یعنی برای افزایش دمای ۱ کیلوگرم به اندازه ۱ درجه سانتیگراد باید میزان ۴۲۰۰ ژول به آن انرژی بدهیم. پارامتر گرمای ویژه مواد را با نشان میدهند. علامت p نشان دهنده فشار ثابت در اندازهگیری گرمای ویژه مواد است.
انرژی گرمایی
یکی دیگر از فرمول های شیمی یازدهم، فرمول انرژی گرمایی است. میزان انرژی حرارتی که در صورت تغییر دمای یک سیستم آزاد یا دریافت میشود با عنوان انرژی گرمایی شناخته میشود. این پارامتر به وسیله فرمول زیر محاسبه میشود.
در ادامه پارامترهای این معادله را بررسی خواهیم کرد.
- «Q» در رابطه بالا نشاندهنده میزان انرژی حرارتی آزاد شده یا جذب شده یک سیستم یا فرایند است.
- «m» در این فرمول نماد جرم ماده است و بر حسب کیلوگرم اندازهگیری میشود.
- «c» میزان گرمای ویژه ماده است که میزان انرژی حرارتی لازم برای افزایش دمای ۱ گرم از ماده به اندازه ۱ درجه سلسیوس است. این پارامتر در این فرمول بر حسب ژول بر کیلوگرم درجه سانتیگراد محاسبه میشود.
- «» میزان تغییر دمایی است که اتفاق افتاده است و بر حسب درجه سلسیوس به دست میآید.
در نهایت میزان انرژی حرارتی آزاد شده یا جذب شده بر حسب ژول (J) به دست میآید.

مثال اول انرژی گرمایی
برای درک بهتر مفهوم انرژی گرمایی به مثالهای زیر توجه کنید.
اگر یک تکه ۲ کیلوگرمی از فلز آهن را از دمای ۳۰۰ درجه سانتیگراد تا ۲۰ درجه سانتیگراد سرد کنیم، چه میزان انرژی گرمایی آزاد میشود؟ ()
پاسخ
میزان انرژی حرارتی آزاد شده از طریق فرمول زیر به دست میآید.
مثال دوم انرژی گرمایی
یک تکه آهن ۳٫۵ کیلویی از دمای اولیه ۲۰ درجه سانتیگراد به اندازه ۲۰۰۰۰ ژول حرارت دیده است. دمای نهایی آن را محاسبه کنید. ()
پاسخ
برای محاسبه میزان تفاوت دمای به وجود امده، از فرمول محاسبه انرژی گرمایی استفاده میکنیم.
حال که میزان اختلاف دما را به دست آوردهایم، میتوانیم میزان دمای نهایی را به دست آوریم. میزان اختلاف دما برابر با میزان دمای نهایی منهای دمای اولیه است.
گروههای عاملی
تا به اینجا با برخی از فرمول های شیمی یازدهم آشنا شدید. مبحث گروههای عاملی مبحثی است که در شیمی آلی و هیدروکربنها بیان میشود. گروه عاملی یک گروه از اتمها است که به عنوان گروه استخلافی به دستهای از مولکولهای متصل میشوند و هیدروکربنهای شاخهدار را تشکیل میدهند. این قسمتهای مولکولها، مسئول واکنشهای شیمیایی هستند که مولکول اصلی در آنها شرکت میکند. صرف نظر از مولکول اصلی که گروههای عاملی به آنها متصل میشوند، گروههای عاملی مشخص در واکنشها مانند یکدیگر عمل میکنند.
گروههای عاملی نقشی اساسی در تعیین خواص مواد آلی دارند. تعدادی از گروههای عاملی در تصویر زیر مشخص شدهاند.
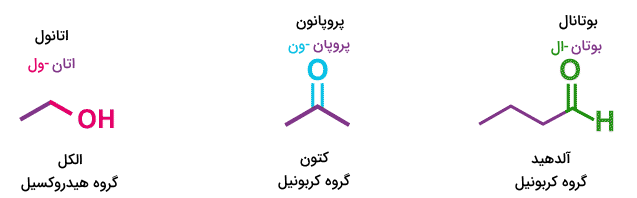
گروههای عاملی متفاوتی بر اساس نوع اتمها و پیوندهای بین آنها وجود دارد. در فرمول های شیمی یازدهم تنها سه گروه عاملی کربونیل، هیدروکسیل و کربوکسیل بیان شدهاند.
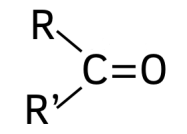
گروه عاملی کربونیل
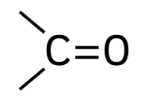
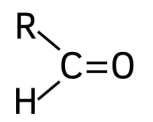
گروه عاملی کربونیل از کربنی که با یک پیوند دوگانه به یک اتم اکسیژن متصل شده است تشکیل میشود. این گروه عاملی بسته به اینکه اتم کربن در دو پیوند دیگر خود به چه اتمهایی متصل شده است متفاوت است. اگر اتم کربن با یک پیوند به یک اتم هیدروژن متصل شده باشد، گروه عاملی آلدهید را تشکیل میدهد. نامگذاری آلدهیدها بدین صورت است که نام هیدروکربن نوشته شده و انتهای آن پسوند «-ال» میگیرد. برای مثال بوتانال و پروپانال ترکیبات آلدهیدی هستند.
اگر کربن گروه عاملی کربونیل به دوگروه متفاوت هیدروکربنی متصل باشد، گروه عاملی کتون را تشکیل میدهد. نامگذاری ترکیبات کتون به این صورت است که نام هیدروکربن اصلی نوشته میشود و انتهای آن پسوند «-ون» میگیرد. برای مثال پروپانون و بوتانون ترکیبات کتونی هستند.
گروه عاملی هیدروکسیل
این گروه عاملی از اتصال اتم کربن به گروه مولکولی «-OH» تشکیل میشود. این اتصال با یک پیوند یگانه شکل میگیرد و میتواند گروه عاملی الکلی را تشکیل بدهد که در آن اتم کربونیل به اتمهای کربن دیگر متصل است. نامگذاری ترکیبات حاوی گروه هیدروکسیل به این صورت است که انتهای نام هیدروکربن اصلی پسوند «-ول» میگیرد. برای مثال اتانول و پروپانول مولکولهای الکلی هستند.
گروه عاملی کربوکسیل (کربوکسیلیک اسید)
در این گروه عاملی اتم کربن با پیوندی دوگانه به یک اتم اکسیژن و با یک پیوند یگانه به مولکول «-OH» متصل است. مواد آلی دارای گروه کربوکسیل مقداری خاصیل اسیدی میگیرند به همین دلیل به آنها کربوکسیلیک اسید گفته میشود. این ترکیبات با گرفتن پسوند «-وییک اسید» شناخته میشوند. هرچند بسیاری از کربوکسیلیک اسیدها نامهای رایج دیگری نیز دارند. برای مثال اتانوییک اسید یک کربوکسیلیک اسید است که بیشتر با نام استیک اسید شناخته میشود.
جدول گروههای عاملی
در ادامه جدولی ار نامها و ترکیبات گروههای عاملی مختلف به همراه شیوه نامگذاری آنها ارائه شده است.
| نام گروه عاملی | ترکیب گروه عاملی | شیوه نامگذاری |
| کربونیل |
| --- |
| آلدهید |
| پسوند «-ال» |
| کتون |
| پسوند «-ون» |
| هیدروکسیل |
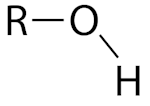 | پسوند «-ول» |
| اتر |
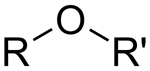 | پسوند «-اتر» |
| کربوکسیل (کربوکسیلیک اسید) |
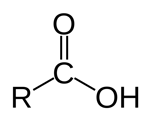 | پسوند «-یک سید» |
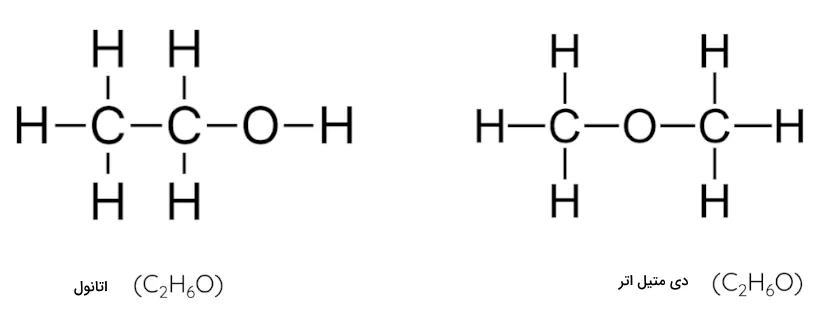
ایزومرها
دانشمندان به مولکولهایی که شامل اتمهای یکسان هستند اما ساختار شیمیایی آنها متفاوت است ایزومر میگویند. یک نوع از ایزومرها که در شیمی آلی برای مولکولهای هیدروکربنی بیان میشود، ایزومرهای ساختاری هستند. در این ایزومرها، گروه مولکولی متصل به زنجیره هیدروکربنی میتواند در موقعیتهای مختلفی قرار بگیرد. ایزومرها فرمول شیمیایی یکسان اما فرمول ساختاری متفاوتی دارند و این باعث میشود دستهای از ویژگیهای فیزیکی و شیمیایی این مواد متفاوت باشد. برای مثال به شکل زیر توجه کنید.
در دو تصویر بالا دو ایزومر ساختاری را مشاهده میکنید که یک فرمول شیمیایی دارند. هر دو از دو اتم کربن، شش اتم هیدروژن و یک اتم اکسیژن تشکیل شدهاند اما ترتیب قرارگیری این اتمها در ساختار این مواد متفاوت است.
قانون هس
قانون هس از مهمترین فرمول های شیمی یازدهم است. قانون هس بیان میکند که تغییر آنتالپی برای یک واکنش شیمیایی مستقل از مسیر انجام شدن واکنش است. این تعریف از قانون هس به این معنی است که تغییر آنتالپی کلی یک واکنش برابر با جمع آنتالپی مراحل مختلف واکنش رسیدن از واکنش دهنده به فراورده است.
برای یادگیری بیشتر در مورد قوانین و نسائل ترمودینامیک میتوانید فیلم آموزشی ترمودینامیک ۱ فرادرس که لینک آن در ادامه آورده شده ست را مشاهده کنید.
در محاسبه آنتالپی واکنشها با استفاده از قانون هس باید مراحل مختلف واکنش را به شیوهای تنظیم کرد که تعداد مولهای واکنشدهندهها و فراوردهها برابر با تعداد مول های واکنشدهندهها و فراوردههای واکنش اصلی شود. این محاسبات با یک مثال در ادامه توضیح داده شدهاند.
مثال اول قانون هس
میزان آنتالپی واکنش زیر را با استفاده از آنتالپی واکنشهای واسطه داده شده تعیین کنید.
پاسخ
برای به دست آوردن آنتالپی کلی این واکنش باید واکنشهای داده شده را به گونه ای تنظیم کنیم که واکنش کلی خواسته شده را نتیجه دهند.
در حل اینگونه مسائل باید به نکات زیر توجه داشته باشیم.
- اگر واکنش ضریب خاصی میگیرد، مقدار آنتالپی واکنش نیز باید در همان ضریب، ضرب شود.
- اگر واکنش به شکل برعکس (فراورده به واکنشدهنده) نوشته میشود، علامت آنتالپی آن باید تغییر کند.
با توجه به معادلات بالا، تنها کافیست معادله واکنش دوم در عدد ۲ ضرب شود و دو واکنش با یکدیگر جمع شوند. در نتیجه خواهیم داشت:
در نهایت، معادله واکنش کلی از جمع این دو واکنش به دست میآید و مقدار آنتالپی آن از جمع آنتالپی این واکنشها محاسبه میشود.

مثال دوم قانون هس
واکنش زیر را درنظر بگیرید.
میزان آنتالپی این واکنش را با استفاده از آنتالپی سه واکنش زیر محاسبه کنید.
پاسخ
برای پاسخ به این سوال باید واکنشها را طوری تنظیم کنیم که برایند آنها واکنش اصلی را نتیجه دهد. برای شروع واکنشدهنده اول «CIF» را در نظر میگیریم. با توجه به واکنشهای داده شده متوجه میشویم که این واکنش دهنده در واکنش دوم شرکت میکند و ضریب ۲ گرفته است. پس این واکنش باید ضریب ۱/۲ بگیرد.
سپس سراغ واکنشدهنده دوم میرویم. در واکنش اول به عنوان فراورده وجود دارد. پس این واکنش باید برعکس شده و ضریب ۱/۲ بگیرد. توجه داشته باشید که هنگام عکس نوشتن واکنشها باید علامت آنتالپی آنها را هم تغییر دهیم. پس خواهیم داشت:
در نهایت فراورده واکنش را بررسی میکنیم که به عنوان واکنشدهنده در واکنش سوم شرکت کرده است. پس کافی است این واکنش را به جهت عکس نوشته و علامت آنتالپی آن را تغییر دهیم.
در مرحله آخر تمامی واکنشها را نوشته و بررسی میکنیم برایند آن ها حتما واکنشدهندهها و فراوردههای واکنش اصلی را نتیجه دهد.
سرعت واکنش ها
از دیگر فرمول های شیمی یازدهم، سرعت واکنش است. سرعت واکنشهای شیمیایی بررسی روند تولید فراوردهها یا مصرف واکنشدهندههای واکنش است. در واقع سرعت واکنش برابر با سرعت مصرف واکنش دهندهها یا سرعت تولید فراوردهها است. برای انجام هر واکنش شیمیایی نیاز است تا اجزای واکنش دهندهها با یکدیگر ترکیب شوند و انرژی کافی برای این ترکیب شدن را داشته باشند. این ترکیب شدن واکنشدهندهها در اثر برخورد ذرات آنها اتفاق میافتد. برخوردی که به تولید فرایندهها بیانجامد، برخورد موثر نام دارد. حداقل انرژی لازم برای انجام یک برخورد موثر و تولید فراوردهها، انرژی فعالسازی نام دارد و برای هر واکنش مقدار آن متفاوت است.
روشهای مختلفی برای اندازهگیری سرعت واکنشهای شیمیایی وجود دارد. یکی از آنها بررسی زمان مصرف تعداد مولهای واکنشدهندهها یا تولید فراوردهها است. سرعت متوسط واکنشهای شیمیایی برابر با اندازهگیری تعداد مول واکنشدهنده مصرف شده در زمان مشخص یا تعداد مول فراورده تولید شده در یک زمان مشخص است. فرمول محاسبه سرعت متوسط واکنشهای شیمیایی به شکل زیر به دست میآید.
در معادله بالا عبارت «Reactant» نشاندهنده واکنشدهنده و عبارت «Product» نشاندهنده فراورده است. علامت منفی پس از سرعت واکنشدهندهها به دلیل مصرف شدن آنها است. در واقع تعداد مولهای واکنشدهنده، طی انجام واکنش کاهش مییابد و تعداد مول فراوردهها طی انجام واکنش افزایش مییابد.
برای درک بهتر مفهوم سرعت و روش محاسبه آن به مثالهای بعد توجه کنید.

مثال اول سرعت متوسط
در واکنش کلسیم کربنات و اسید هیدروکلریک، رابطه بین سرعت متوسط مصرف این دو ماده را محاسبه کنید.
پاسخ
واکنش موازنه شده این دو ماده به شکل زیر است.
با توجه به ضرایب استوکیومتری این مواد، رابطه سرعت متوسط آنها به شکل زیر است.
مثال دوم سرعت متوسط
واکنش تولید گاز گوگرد تری اکسید را در نظر بگیرید.
اگر سرعت متوسط گاز اکسیژن برابر با ۰٫۰۱ مول بر ثانیه باشد، سرعت مصرف گوگرد دی اکسید تولید گوگرد تری اکسید را بر حسب مول بر دقیقه محاسبه کنید.
پاسخ
سرعت متوسط این واکنش به روش زیر محاسبه میشود.
با توجه به نسبتهای استوکیومتری میتوان مقدار سرعت گوگرد دی اکسید و گوگرد تری اکسید را بر حسب مول بر ثانیه به دست آورد و سپس آن را به مول بر دقیقه تبدیل کرد.
سرعت بر حسب غلظت
به دست آوردن سرعت واکنش از مهمترین فرمول های شیمی یازدهم است. یکی دیگر از روشهای اندازه گیری سرعت واکنشهای شیمیایی بررسی روند تغییر غلظت واکنشدهندهها و فراوردهها در مدت زمانی مشخص است. غلظت واکنشدهندهها طی انجام واکنش، کاهش یافته و غلظت فراوردهها افزایش مییابد. برای مثال در واکنش کلی سرعت واکنش از طریق زیر محاسبه میشود.
مثال اول محاسبه سرعت بر حسب غلظت
با توجه به معادله واکنش زیر، فرمول محاسبه سرعت را بر حسب غلظت واکنشدهندهها و فراوردهها بنویسید.
پاسخ
اندازهگیری غلظت بر حسب تغییرات غلظت مواد در واکنش بالا از طریق معادله زیر به دست میآید.
مثال دوم محاسبه سرعت بر حسب غلظت
معادله واکنش زیر را درنظر بگیرید.
پاسخ
برای پاسخ به این سوال کافی است موارد معلوم در صورت سوال را در معادله سرعت جایگذاری کرد.
اگر طی زمان ۳۰۰ تا ۷۲۰ ثانیه این واکنش میزان غلظت گوگرد دی اکسید از ۰٫۰۲۷۰ به ۰٫۰۱۹۴ مول بر لیتر تغییر کرده باشد، میزان سرعت واکنش را محاسبه کنید.
فرمولهای شیمی یازدهم فصل سوم
در ادامه فرمول های شیمی یازدهم فصل سوم در جدولی ارائه شده است. پس از بررسی این فرمولها به توضیح نکات مهم این مباحث میپردازیم.
واکنش پلیمری شدن
پلیمری شدن (پلیمریزاسیون) به فرایندی گفته میشود که طی آن مولکولهای بسیار کوچک (مونومر) با یکدیگر پیوند شیمیایی تشکیل داده و به یکدیگر متصل میشوند تا مولکولهای درشتتر (پلیمر) را تولید کنند. پلیمرها در واقع زنجیرهای طولانی از مونومرهای به هم متصل هستند. این مواد نقطه ذوب و نقطه جوش بسیار بالایی دارند و ویژگیهای خاص هریک از آنها باعث شده در بسیاری از موارد مانند تولید پلاستیک، ظروف و پارچه استفاده شوند.
پلیمری شدن اتن
یکی از واکنشهای پایه پلیمری شدن، واکنش تولید پلی اتن از اتن است که در شکل زیر نمایش داده شده است.
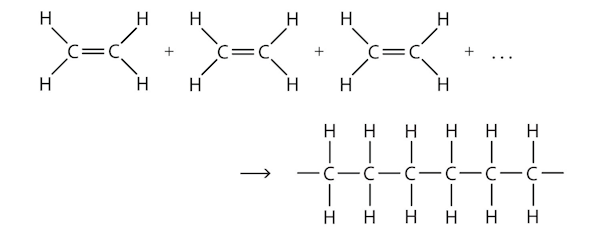
به این نوع واکنش پلیمری شدن که مونومرها به یکدیگر متصل میشوند، واکنش پلیمریزاسیون افزایشی گفته میشود. وجود دو پیوند انتهایی باز در ساختار پلیمر بالا نشاندهنده این است که این مولکول از هر دوجهت تعداد بسیار زیادی از ساختار مونومر را دارد. تمامی اتمهای مولکول مونومر در ساختار پلیمر تکرار شدهاند به همین علت واکنش پلیمری شدن را به روش زیر نیز میتوان نشان داد.
این واکنش تحت فشار و دمای بالا انجام میشود. در این واکنش پیوند سیرنشده بین دو کربن (پیوند دوگانه) شکسته شده و دو الکترون ظرفیت به اتمهای کربن میدهد و این دواکترون میتوانند با سایر مولکول های مونومر پیوند تشکیل داده و پلیمر را تولید کنند.
استرها و پلی استرها
استرها دستهای از گروههای عاملی هستند که در آنها اتم کربن با یک پیوند دوگانه به یک اتم اکسیژن و با یک پیوند یگانه به یک اکسیژن متصل شده است. استرها نوعی از ترکیبات شیمیایی هستند که از ترکیب یک اسید (آلی یا معدنی) که حداقل یک گروه هیدروکسیل دارد به دست میآیند. در این ترکیبات گروه هیدروکسید با یک اکسیژن جایگزین میشود. به بیان دیگر استرها از ترکیب اسیدهای آلی با الکلها به دست میآیند. فرم کلی این گروه عاملی به شکل زیر است.
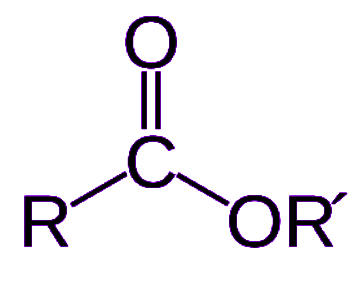
استرها معمولا ترکیباتی با بوی مطبوع هستند و مسئولیت انتشار بوی برخی از میوهها بر عهده استرها است. این ترکیبات در صنایع غذایی و تولید عطر کاربردهای گستردهای دارند. پلیاسترها دستهای از مواد پلیمری هستند که گروه عاملی استر در ساختار شیمیایی آنها وجود دارد. پلی استرها نیز مانند استرها از ترکیب اسیدهای آلی و الکلها تشکیل میشوند. مطابق واکنش تولید استرها از کربوکسیلیک اسیدها و الکلها، استرها نیز میتوانند به یکدیگر متصل شوند زیرا این ترکیبات یک گروه هیدروکسیل (-OH) و یک پیوند دوگانه متصل به اکسیژن دارند. در تصویر زیر روش اتصال استرها و تولید پلیاستر را مشاهده میکنید.
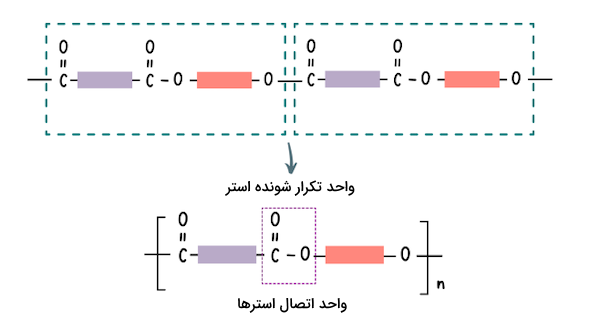
الکلها و کربوکسیلیک اسیدها
الکلها مولکولهایی هستند که شامل گروه عاملی هیدروکسیل (-OH) هستند. فرم کلی مولکولهای کربن به شکل است. نام تمامی الکلها به «-ُل» ختم میشود. نام و ساختار برخی از الکلهای راست زنجیر در جدول زیر ارائه شده است.
| نام | ساختار مولکولی | شکل ساختاری |
| متانول |
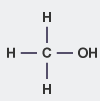 | |
| اتانول |
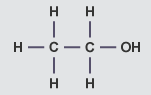 | |
| پروپانول |
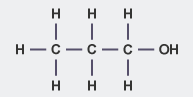 | |
| بوتانول |
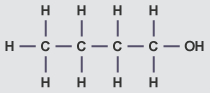 |
همانطور که مشاهده کردید تمامی این مواد یک مولکول (-OH) در ساختار خود دارند. این مواد نقشی مهم در استری کردن کربوکسیلیک اسیدها دارند.
کربوکسیلیک اسیدها موادی هستند که شامل یک گروه کربوکسیل با فرم (-COOH) هستند. نام گذاری این ترکیبات به شکل پسوند «-وییک اسید» است. برای مثال شکل زیر ساختار پروپانوییک اسید را نشان میدهد.
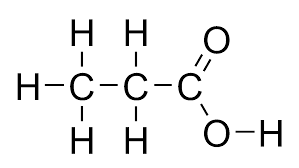
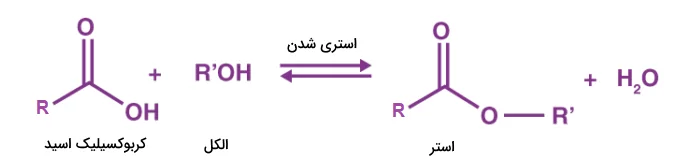
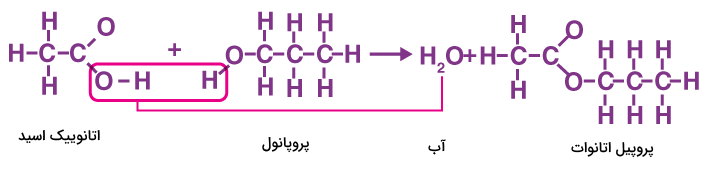
استری شدن فرایندی است که طی آن یک اسید آلی با یک الکل ترکیب میشود و یک مولکول استر و آب را تشکیل میدهد. فرم کلی واکنش استری شدن به شکل زیر است.
هنگامی که یک الکل با کربوکسیلیک اسید در حضور سولفوریک اسید واکنش میدهد، مادهای با بوی شیرین تولید میشود. این ماده با نام استر شناخته میشود. این فرایند شامل پنج مرحله کلی است. در مرحله اول پیوند دوگانه کربوکسیلیک اسید شکسته شده و اکسیژن آن با یک هیدروژن سولفوریک اسید پیوند میدهد. سپس اکسیژن الکل نیز به کربن کربوکسیلیک اسید حمله کرده و با آن واکنش میهد. در نهایت مولکول آب و هیدروژن دریافت شده از اسید سولفوریک از ترکیب ساخته شده جدا شده و استر باقی میماند.
در شکل زیر واکنش تولید پروپیل اتانوات از واکنش اتانوییک اسید و پروپانول نشان داده شده است.
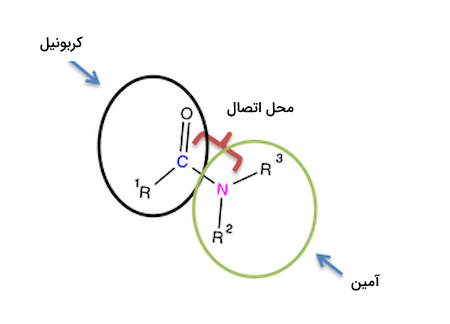
آمیدها و پلی آمیدها
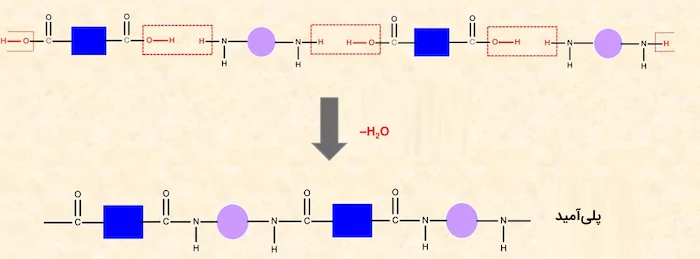
آمیدها نوعی از گروههای عاملی هستند که یک گروه کربونیل و یک اتم نیتروژن دارند. ساختار گروه عاملی آمید به شکل (-CON-) است. این ترکیبات از واکنش ترکیبات آمین (R-N-R) و کربوکسیلیک اسیدها به وجود میآید. شکل زیر نشاندهنده ساختار آمید است.
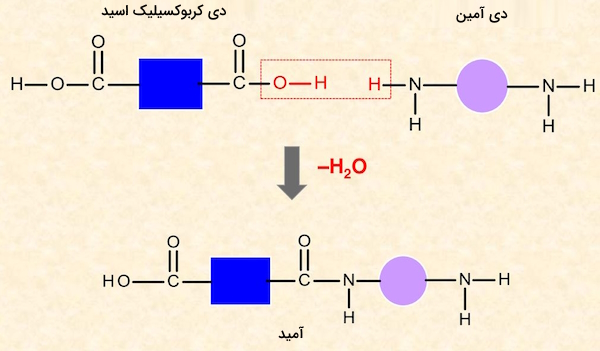
آمیدها از ترکیب دی کربوکسیلیک اسیدها و دی آمینها نیز میتوانند تشکیل شوند. این ترکیبات نیز مانند استرها عمل میکنند و طی ادامه واکنش تولید آمیدها، پلی آمیدها تشکیل میشوند. در تصویر زیر روش تولید آمید از کربوکسیلیک اسید و آمین را مشاهده میکنید.
ار ترکیب این آمیدها، پلی آمیدها تولید میشوند. در تصویر زیر روش تولید پلیآمید را مشاهده میکنید.
تجزیه پلیمرها
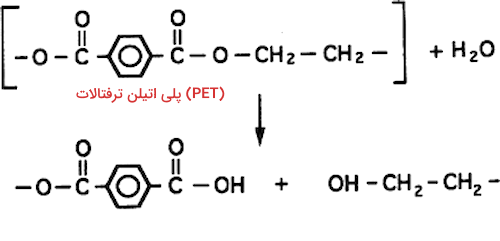
اکثر پلیمرهای تولید شده توسط انسانها، مواد بسیار پایداری هستند که به راحتی تجزیه نمیشوند. این مواد برای محیط زیست و نسلهای آینده آسیب زننده هستند. برای مثال کیسههای پلاستیکی نوعی از پلیمرها هستند که تجزیه آنها سالها طول میکشد و رها شدن آنها در طبیعت یکی از مهمترین مشکلات زیست محیطی را به وجود آورده است. برخی از پلیمرها در حضور آب دچار فرایند آبکافت میشوند. فرایند آبکافت پلیمرها فرایندی است که طی آن پیوندهای کووالانسی مونومرهای تکرار شونده شکسته شده و پلیمر میتواند به ساختارهای کوچکتری شکسته شود.
در تصویر زیر واکنش تجزیه پلی اتیلن ترفتالات را مشاهده میکنید.
به پلیمرهایی که در طبیعت توسط میکروارگانیسمها تجزیه میشوند، پلیمرهای زیست تخریب پذیر گفته میشود.
یادگیری شیمی عمومی با فرادرس
علم شیمی یکی از پرکاربردترین و مهم ترین علومی است که در پایههای مختلف دوره متوسطه و در برخی از رشتههای دانشگاهی ارائه میشود. واکنشهای شیمیایی پدیدههایی هستند که در زندگی روزمره انسان نقش مهمی دارند. این علم به مواردی مانند خواص ماده، انواع واکنشهای شیمیایی، دلایل تغییر مواد و ... میپردازد. همچنین این علم در بسیاری از صنایع و علوم مختلف دیگر مانند صنایع غذایی، دارویی، پزشکی، محیط زیست و ... کاربرد دارد. پیشنهاد میکنیم برای مطالعه بیشتر در زمینه شیمی و زیرشاخههای آن مانند شیمی آلی و تجزیه، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این موارد میپردازد.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دسترسی داشته باشید.
- فیلم آموزش شیمی عمومی جامع و با مفاهیم کلیدی
- فیلم آموزش آزمایشگاه شیمی عمومی به زبان ساده
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله
جدول نشانه های پلیمرها
در مطالعه فرمول های شیمی یازدهم، با پلیمرها آشنا شدید. پلیمرهای مصرفی انسانها یکی از بزرگترین آسیبها را به محیط زیست وارد میکنند. به همین منظور این پلیمرها در دسته بندیهایی با علامتهای مشخص قرار گرفتهاند تا برای ورود به چرخه بازیافت راحتتر جداسازی شوند. در ادامه این مطلب از مجله فرادرس جدول این پلیمرها و علامتهایشان را به همراه کاربرد این مواد مشاهده میکنید.
| نام پلیمر | نشانه پلیمر | کاربرد |
| پلی اتیلن ترفتالات |
 | بطریهای پلاستیکی سخت، بطریهای آب معدنی، بطریهای روغن |
| پلی اتن سنگین |
 | بطریهای شیر و شویندهها |
| پلی وینیل کلرید |
 | سینیهای پلاستیکی، پلاستیکهای ضربهگیر، لولههای اتصال ساختمانی |
| پلی اتن سبک |
 | کیسههای پلاستیکی، کیفهای خرید، کارتنهای شیر و آبمیوه، لیوانهای یکبار مصرف |
| پلی پروپن |
 | پلاستیکهای استفاده شده در وسایل خانه، کیفها، اسباب بازیها، قسمتهایی از بدنه ماشین، ظروف غذای مقاوم به حرارت |
| پلی استیرن |
 | پلاستیک استفاده شده در یخچال، برخی از زیور آلات، ظروف یکبار مصرف تخریبپذیر، کلاه ایمنی |
| سایر پلیمرها |
 | سایر پلاستیکها مانند پلیلاکتیکها، نایلون، فایبرگلاس، گالنهای آب معدنی، عینکهای آفتابی |