عناصر واسطه و خصوصیات آنها – از صفر تا صد
واژه عناصر واسطه (فلزات واسطه) دارای سه معنی متفاوت است که در ادامه به آنها میپردازیم.


در تعریف آیوپاک، عناصر واسطه، به عناصری که اوربیتال فرعی d آنها به صورت جزئی پر شده باشد یا از طریق آرایش اوربیتالی ناقص، به صورت کاتیون وجود داشته باشند، عناصر واسطه میگویند. بسیاری از دانشمندان، عناصر واسطه را به عنوان هر عنصر از بلوک d جدول تناوبی میشناسند. این عناصر شامل گروههای ۳ تا ۱۲ در جدول هستند. عناصر بلوک f شامل لانتانیدها و اکتینیدها نیز در طبقهبندی عناصر (فلزات) واسطه قرار میگیرند که نام «فلزات واسطه داخلی» (Inner Transition Metals) را بر آنها نهادهاند.
دو دانشمند به نامهای «کوتون» (Cotton) و «ویکینسون» (Wikinson)، تعریف آیوپاک را به کمک مشخص کردن نوع عناصر، گسترش دادند. علاوه بر عناصر گروه ۴ تا ۱۱، اسکاندیم و «ایتریم» (Yttrium) را اضافه کردند. شیمیدان انگلیسی چارلز باری، اولین بار از واژه «واسطه» (Transition) در متون خود استفاده کرد.
فلزات واسطه در میان فلزات قلیایی خاکی و عناصر گروه بور قرار گرفتهاند. لازم به ذکر است در این مقاله، عبارات «فلزات واسطه» و «عناصر واسطه» به جای یکدیگر استفاده میشوند.
آرایش الکترونی عناصر واسطه
نحوه آرایش الکترونی عناصر بلوک d به صورت زیر قابل توصیف است:
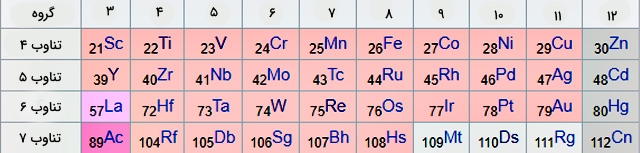
اولین سری از این عناصر در تناوب چهارم حضور دارند که بعد از از گروه ۲ شروع میشوند. اسکاندیم، اولین عنصر گروه ۳ با عدد اتمی و آرایش الکترونی است. با حرکت از سمت چپ به سمت راست جدول، الکترونها به اوربیتال فرعی d اضافه میشوند تا آن را تکمیل کنند.
اولین عنصر از گروه 11 یعنی مس، دارای آرایش الکترونی متفاوتی نسبت به بقیه است. این نوع از آرایش الکترونی سبب پایدرای بیشتر اوربیتالها خواهد شد. آرایش الکترونی فلزات واسطه در تصویر زیر آورده شده است:
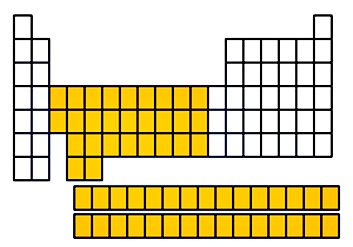
طبقهبندی فلزات واسطه
در بلوک d، اتمهای هر عنصر بین 1 تا 10 الکترون در لایه d خود دارند. عناصر گروه ۴ تا ۱۱ به طور کلی با نام فلزات واسطه شناخته میشوند که کمپلکسهای متنوع و رنگی، به همراه خواص کاتالیستی و با اعداد اکسایش مختلف تشکیل میدهند. اسکاندیم (Sc) و ایتریم (Y) نیز به عنوان فلزات واسطه شاخته میشوند. برای لانتانیدها و اکتینیدها و همچنین گروه ۱۲، تعاریف مختلفی ارائه شده است و برخلاف گروههای دیگر به طور کل در طبقهبندی عناصر واسطه قرار نمیگیرند.
روی، کادمیوم و جیوه معمولا جزو فلزات واسطه به حساب نمیآیند چراکه زیرلایه d آنها با آرایش الکترونی ( [گاز نجیب]) کاملا پر شده است. تحت شرایطی خاص، این عناصر به عنوان «فلزات پس واسطه» (Post-Transition Metals) شناخته میشوند.
با توجه به اینکه عناصر «مایتنریم» (Meitnerium)، «دارمستادتیم» (Darmstadtium) و «رونتگنیوم» (Roentgenium) در بلوک d قرار دارند، انتظار میرود رفتاری نزدیک به عناصر سبکتر و مشابه خود مانند ایریدیم و پلاتین و طلا داشته باشند، اما این خواص هنوز به صورت آزمایشگاهی به اثبات نرسیدهاند.
خواص عناصر واسطه
خواصی که این عناصر را از دیگر عناصر جدول تناوبی متمایز میکنند به سبب نحوه پر شدن اوربیتال d در آنها است که موارد زیر را شامل میشوند:
- تشکیل ترکیباتی رنگی به دلیل انتقال الکترونی
- تشکیل ترکیباتی با اعداد اکسایش متفاوت: این امر به دلیل اختلاف انرژی پایین در حالات مختلف عدد اکسایش است.
- تشکیل بسیاری از ترکیبات پارامغناطیسی به دلیل حضور الکترونهای جفت نشده
بیشتر فلزات واسطه در پیوند با لیگاندها موجب تشکیل کمپلکسهای فلزی بسیاری میشوند. همچنین، این فلزات خواص دیگری نیز دارند که از آن جمله میتوان به واکنشپذیری کمتر و سختی بیشتر آنها نسبت به فلزات قلیایی خاکی اشاره کرد. برخی از عناصر واسطه مانند آهن، روی و کرم، برای سلامتی بدن ضروری هستند.
در مقابل، برخی دیگر از عناصر همچون کادمیوم و جیوه آثار زیانباری بر سلامتی انسان دارند. بیشتر فلزات واسطه به رنگ نقره آبی یا نقرهای حضور دارند و تعداد کمی از آنها رنگی هستند.

ترکیبات رنگی
علت رنگی بودن برخی ترکیبات در فلزات واسطه را باید در «حالت گذار الکترونی» (Electronic Transitions) جستجو کرد که شامل دو اصل اساسی است:
انتقال بار
حالت گذار «انتقال بار» (Charge Transfer) به این معنی است که ممکن است در مواردی یک الکترون از یک اوربیتال لیگاند به یک اوربیتال فلزی جهش کند و سبب بروز حالت «انتقال بار لیگاند به فلز» (Ligand-to-Metal Charge Transfer) شود. این پدیده را به طور خلاصه با حروف نشان میدهند و زمانی که یک فلز، عدد اکسایش بالایی داشته باشد، به راحتی صورت میگیرد. به طور مثال رنگ یونهای «کرومات» ، «دی کرومات» و «پرمنگنات» ناشی از حالت گذار LMCT است. در مثالی دیگر از LMCT میتوان به رنگ قرمز «جیوه یدید» (Mercuric Iodid) با فرمول اشاره کرد.

حالت گذار اوربیتالهای d
«حالت گذار d-d» به حالت انتقال (جهش) الکترون از یک اوربیتال d به اوربیتال دیگر میگویند. در کمپلکسهای فلزات واسطه، همه اوربیتالهای d انرژی یکسانی ندارند. با استفاده از «نظریه میدان بلور» (Crystal Field Theory)، الگوی شکافتگی (Pattern of the Splitting) اوربیتالهای d محاسبه میشود. میزان تفکیک آنها به نوع فلز، عدد اکسایش و طبیعت لیگاند وابسته است. مقادیر و سطوح این انرژیهای تفکیک، در «نمودارهای تانابه سوگانو» (Tanabe–Sugano Diagrams) به خوبی نمایش داده میشوند. به طور کلی، حالت گذار LMCT رنگهای شدیدتری نسبت به حالت گذار اوربیتالهای d بدست میدهد.
عدد اکسایش
یکی از شاخصههای عناصر واسطه، عدد اکسایش متفاوت در آنها است. به طور مثال، ترکیبات وانادیوم، عدد اکسایشی بین ، همچون و ، مانند دارند.
بیشترین عدد اکسایش در ردیف اول فلزات واسطه با تعداد الکترونهای والانس (ظرفیت) برابری میکند. این عدد برای تیتانیوم، و تا منگنز، ادامه مییابد. در ردیف دوم، بیشترین عدد اکسایش مربوط به روتنیوم با عدد و در ردیف سوم مربوط به ایریدیوم با عدد خواهد بود. در ترکیباتی مانند و عنصرها با یکدیگر پیوند کووالانسی میدهند.
پایینترین عدد اکسایش مربوط به کمپلکسهای فلزی کربونیل مانند با عدد اکسایش صفر و با عدد اکسایش است. ترکیبات یونی معمولا با عدد اکسایش و تشکیل میشوند که در محلولهای آبی به وسیله ۶ مولکول آب با چینش هشت وجهی، هیدراته میشوند.
مغناطیس
ترکیبات عناصر واسطه زمانی که دارای الکترون جفت نشده باشند به عنوان پارامغناطیس شناخته میشوند. برخی ترکیبات را نیز در دسته دیامغناطیس قرار میدهند. این ترکیبات شامل کمپلکسهای و هستند.

خواص کاتالیستی
عناصر واسطه و ترکیبات آنها بر اساس فعالیتهای کاتالیستی همگن و ناهمگن نیز شناخته میشوند. این خاصیت به دلیل وجود اعداد اکسایش مختلف و تشکیل کمپلکس در این دسته از عناصر است. وانادیوم (V) اکسید و نیکل را به عنوان نمونههایی از آنها میتوان نام برد. کاتالیزورهای سطح جامد، شامل تشکیل پیوندهایی بین مولکولهای واکنشدهنده و اتمها سطح کاتالیزور هستند. این امر سبب افزایش غلظت واکنشدهنده در سطح کاتالیزور و تضعیف پیوندهای مولکولهای واکنشدهنده و در نتیجه کاهش انرژی فعالسازی میشود.
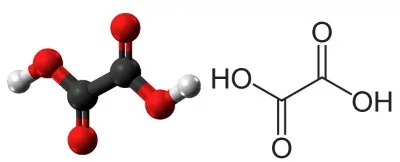
یک نوع جالب از فرآیند کاتالیستی در فلزات واسطه زمانی است که فرآوردههای واکنش، خود سبب افزایش سرعت واکنش و در حقیقت «خود کاتالیزی» (Autocatalysis) میشوند. از نمونههای آن میتوان به واکنش اگزالیک اسید و پرمنگنات پتاسیم در یک محیط اسیدی اشاره کرد. در این تیتراسیون، آنالیت، اگزالیک اسید و تیترانت، پرمنگنات پتاسیم است.
$$$M n O_{4}^{-}+8 H^{+}+5 e^{-} \rightarrow M n^{2+}+4 H_{2} O$$
با تولید مقدار کمی ، این یون با وارد واکنش میشود و تشکیل میدهد که میتواند با برای تولید دوباره یون وارد واکنش شود.
خواص فیزیکی
همانطور که از نام آنها پیدا است، تمامی فلزات واسطه هادی خوب الکتریسیته هستند. به طور کلی، عناصر دسته d، چگالی، نقطه ذوب و جوش بالایی دارند. این خاصیت به دلیل پیوند فلزی و جذب الکترونهای زیرلایه d است که سبب چسبندگی مولکولها و افزایش تعداد الکترونهای اشتراکی است. با این وجود، فلزات گروه ۱۲ به دلیل زیر لایه پر شده d، نقطه جوش و ذوب بسیار پایینتری از دیگر فلزات واسطه دارند. به طور مثال، جیوه با نقطه ذوب در دمای اتاق به حالت مایع قرار دارد.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- فلزات قلیایی — به زبان ساده
- الکترونگاتیوی — از صفر تا صد
^^
آزمون عناصر واسطه
۱. مطابق تعریف IUPAC، کدام ویژگی آرایش الکترونی باعث میشود یک عنصر در جدول تناوبی به عنوان عنصر واسطه شناخته شود؟
داشتن کامل زیرلایه d پرشده در حالت پایه
قرار گرفتن در بلوک f جدول تناوبی
حضور الکترون جفتنشده در اوربیتال s
وجود زیرلایه d به طور جزئی پر شده در آرایش الکترونی
طبق تعریف IUPAC، عنصر واسطه عنصری است که زیرلایه d آن به طور جزئی پر شده یا در حالت یونی آرایش اوربیتالی ناقصی داشته باشد. ویژگی «وجود زیرلایه d به طور جزئی پر شده» عامل اصلی شناسایی عناصر واسطه است. ویژگی «داشتن کامل زیرلایه d پرشده در حالت پایه»، مانند آنچه در گروه ۱۲ دیده میشود، این عناصر را از گروه واسطهها جدا میکند.
۲. چرا عناصر گروه ۱۲ (مانند روی، کادمیوم و جیوه) معمولا در طبقهبندی فلزات واسطه قرار نمیگیرند و به عنوان «فلزات پسواسطه» معرفی میشوند؟
چون عدد اکسایش آنها همیشه منفی است.
چون در جدول تناوبی پایینتر از واسطهها قرار دارند.
به خاطر پر بودن کامل زیرلایه d در آرایش الکترونی آنها
زیرا این عناصر نقطه ذوب بسیار پایینی دارند.
دلیل معرفی عناصر گروه ۱۲ به عنوان «فلزات پسواسطه» این است که زیرلایه d آنها در آرایش الکترونی کاملا پر شده است و برخلاف سایر عناصر واسطه، حالتهای اکسایش رایجتر و ویژگیهای شیمیایی معمول فلزات واسطه را ندارند. به همین دلیل، آنها در بیشتر تقسیمبندیها خارج از گروه فلزات واسطه قرار داده میشوند.
۳. اگر ترکیب یونی یک فلز واسطه خاصیت پارامغناطیس داشته باشد، چه چیزی میتوان درباره آرایش الکترونی آن عنصر نتیجه گرفت؟
در آرایش الکترونی آن، اوربیتال d کاملا پر است.
تمام الکترونهای آن در اوربیتال s قرار دارند.
در آرایش الکترونی آن، اوربیتال d به طور کامل خالی است.
آرایش الکترونی آن دارای الکترون جفت نشده در اوربیتال d است.
وقتی ترکیب یونی یک فلز واسطه رفتار پارامغناطیس نشان میدهد، به این معناست که آرایش الکترونی آن دارای الکترون جفتنشده در اوربیتال d است. حالت «اوربیتال d کاملا پر» یا «کاملا خالی» منجر به دیامغناطیس میشود و نه پارامغناطیس.
۴. در بررسی دو محلول رنگی از ترکیبات فلزات واسطه، مشاهده میشود یکی از آنها شدت رنگ بیشتری دارد. براساس نظریه انتقال بار و گذار d-d، کدام عامل مهمترین نقش را در ایجاد این تفاوت ایفا میکند؟
عدد اکسایش پایینتر در ترکیب کمرنگتر
وجود انتقال بار در ساختار ترکیب با رنگ شدیدتر
افزایش تعداد الکترونهای d در فلز واسطه
وجود لیگاندهای مختلف در هر دو محلول
عامل «وجود انتقال بار در ساختار ترکیب با رنگ شدیدتر» باعث میشود شدت رنگ آن محلول نسبت به ترکیبی که تنها رخداد گذار d-d دارد بیشتر باشد. انتقال بار بین لیگاند و فلز معمولا رنگ بسیار قویتری ایجاد میکند، در حالیکه گذار d-d رنگی ملایمتر به وجود میآورد. «وجود لیگاندهای مختلف» صرفا روی نوع و رنگ اثر دارد اما لزوما شدت رنگ را تعیین نمیکند. «عدد اکسایش پایینتر» بیشتر روی موقعیت انرژی و رنگ اثر میگذارد تا شدت رنگ. «افزایش تعداد الکترونهای d» هم بر رنگ و خواص مغناطیسی موثر است، اما عامل اصلی تفاوت شدت رنگ، نوع مکانسیم گذار یا انتقال بار است.













سلام یک سوال دارم.
چرا گروپ های عناصر واسطه به ترتیب نیست؟؟ یعنی چرا عناصر واسطه از 3B شروع شده چرا از یک 1B شروع نشده ؟؟
با سلام؛
این شیوه نامگذاری فلزات واسطه ب دلیل آرایش الکترونی آنها و تعداد الکترونهای ظرفیت این عناصر است. در واقع تعداد الکترونهای ظرفیت این عناصر (با شروع از اتم اسکاندیوم در گروه 3B) از ۳ عدد شروع شده و تا ۱۲ عدد (گروه 12B) افزایش مییابد.
با تشکر از همراهی شما با مجله فرادرس
سلام وقت بخیر من برای نوشتن پایان نامم بخشی از این مطالب رو میخوام استفاده کنم و رفرنس بدم، رفرنس این سایت چجوریه؟ ممنون میشم راهنمایی بفرمایید.
سلام وقتتون بخیر علت رنگی پرمنگنات رو میتونیم بابت انتقالات d به d بگیم؟ ممنون
با سلام؛
برای استفاده از مطالب مجله فرادرس میتونید به شرایط استفاده در انتهای صفحه یا این لینک مراجعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام . ظرفیت فلز های واسطه گروه ۳ تا ۱۲ تناوب ۴ به اعداد رومی چند هست هرکدومشون
سلام و روز شما بهخیر؛
تعداد الکترونهای لایه ظرفیت عنصرهای موجود در گروه ۳ تا ۱۲ تناوب ۴ جدول تناوبی عناصر، به ترتیب زیر هستند:
اسکاندیم= ۳ عدد، تیتانیوم= ۴ عدد، وانادیم= ۵ عدد، کروم= ۶ عدد، منگنز= ۷ عدد، آهن= ۸ عدد، کبالت= ۹ عدد، نیکل= ۱۰ عدد، مس= ۱ عدد، روی= ۲ عدد.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
سلام و عرض خسته نباشید
اقا ی سوال
همه عناصر وقتی به حالت یونی (گاز نجیب بعد و قبل خود)میرسند ارایش اکوانتومی انها چگونه خواهد بود مثلا اهن وقتی به آهن دوبار مثبت تبدیل میشه از لایه ظرفیت s 2 تا کنده میشه ولی در sc وقتی میخواهد به یون 3 بار مثبت برسد از لایه s و d هر چه هست کنه میشه .
چطوره برا عناصر دیگه من گیرم ؟؟؟!
لطفا جواب رو برام ایمیل کنید
با سلام؛
از توجه شما بسیار سپاسگزاریم. همه اتمها زمانی که میخواهند به یون تبدیل شوند از لایههای آخر خود الکترون از دست میدهند، این موضوع برای عناصر واسطه هم صدق میکند اما تا حدودی متفاوت است. در عناصر واسطه ابتدا لایه S و بعد از آن لایه d پر میشود بنابراین طبق توضیح بالا انتظار داریم آخرین لایهای که از الکترون پر میشود (لایه d) الکترونهای خود را از دست بدهد، اما به این دلیل که لایه S در مقایسه با لایه d راحتتر الکترون از دست میدهد بنابراین ابتدا لایه S الکترون و بعد از آن لایه d الکترون از دست میدهد تا به آرایش پایدار برسد. برای این موضوع باید نسبت به آرایش الکترونی عناصر تسلط داشته باشید، بنابراین برای درک بهتر این موضوع پیشنهاد میکنیم مطالب «اوربیتال و آرایش الکترونی — به زبان ساده» و «یون چیست؟ — به زبان ساده» را مطالعه کنید.
با تشکر
سلام، کدام عناصر واسطه به آرایش نجیب میرسد؟!
سلام، اسکاندیم با کاتیون +3 به آرایش گاز نجیب قبل خودش یعنی آرگون میرسه
عناصر با توجه به الکترونی که در لایههای اخر خود دارند برای رسیدن به حالت پایدار می توانند با گرفتن یا از دست دادن الکترون به ارایش گاز نجیب برسند. در برخی عناصر از دست دادن الکترون با ناپایداری آن عنصر همراه است و به طور طبیعی انجام نمی شود. عناصر واسطه، فلز هستند و به طور معمول فلزها میل به از دست دادن الکترون برای رسیدن به ارایش گاز نجیب پیش از خود دارند.
سلام میشه چند ظرفیتی ها را بگید ظرفیتها یشان هم بگید مثل تیتانیوم و وانادیوم که چند ظرفیتی هستند دو ساعته کل اینترنت سرچ کردم پیدا نکردم//
با سلام؛
برای آشنایی با اتمهای چندظرفیتی پیشنهاد میکنیم مطلب «یون چیست؟ — به زبان ساده (+ دانلود فیلم آموزش رایگان)» را مطالعه کنید که بخشی مجزا برای اتمهای چندظرفیتی در نظر گرفته شده است.
با تشکر
سلام میشه چند ظرفیتی ها را بگید ظرفیتها یشان هم بگید مثل تیتانیوم و وانادیوم که چند ظرفیتی هستند دو ساعته کل اینترنت سرچ کردم پیدا نکردم
عناصر گروه 9 به چی ختم میشوند
سلام شبتون بخیر
چگونه با استفاده از آرایش الکترونی شماره گروه عناصر واسطه را تشخیص دهیم؟
مثل بقیه عناصر اگر به sختم بشه توان s/اگر به pختم شود توان p+12/اگر به dختم شود توان dوsقبل از خودش؟ البته استثنا بودن مس و کروم منظورم نیس
سلام، ببین برا عناصری که عدد اتمی بیشتر از 18 دارن یه راه راحت هست، اون عنصرو بین گاز نجیب قبل و بعدش بزار، (دوره و عدد اتمی گاز های نجیبو که حفظن دیگه همه) بعد عنصر مورد نظر با گاز نجیب بعدیش هم دورست، و اگه عدد اتمی عنصر مورد نظر رو از عدد اتمی گاز نجیب قبلیش کم کنی شماره گروه عنصر مورد نظر بدست میاد.
با سلام؛
برای اینکه از روی آرایش الکترونی به شماره گروه و دوره عناصر دستپیدا کنیم فرمول مشخصی وجود ندارد و تمامی راههایی که ارائه میشوند همگی بر اساس مفاهیم اصلی در جدول تناوبی همچون عدد اتمی و چینش عناصر در دستههای مختلف ارائه شدهاند. به طور مثال آرایش الکترونی آهن را به صورت زیر در نظر بگیرید:
1 s22 s22p63 s23p64 s23 d6
عدد ۴ نشاندهنده بیشترین عدد کوانتومی اصلی است و بنابراین این عنصر به دوره چهارم اختصاص دارد. همچنین، با توجه به این آرایش درمییابیم که این عنصر به عناصر دسته d مرتبط میشود. در لایه آخر نیز، ۶ الکترون وجود دارد و بنابراین ششمین عنصر دسته d در دوره چهارم خواهد بود.
برای آشنایی با نحوه حفظ کردن جدول تناوبی میتوانید مطلب «روشهای کاربردی حفظ کردن جدول تناوبی — به زبان ساده» را مطالعه کنید.
با تشکر
سلام خسته نباشید
میخواستم بدونم چند عدد متفاوت برای تعداد الکترون های ظرفیتی دوره 4 جدول تناوبی وجود دارد؟ چجوری باید حلش کنم؟
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزازیم. برای درک بهتر این موضوع بهتر است عناصر را در قالب گروههای مختلف جدول تناوبی بررسی کنید چراکه که در تناوب چهارم، فلزات قلیایی، قلیایی خاکی، عناصر واسطه و سایر عناصر مربوط به طرف راست جدول تناوبی یعنی هالوژنها و … وجود دارند. همچنین، در بیشتر موارد، اطلاع از عدد اکسایش در فلزات واسطه و چندظرفیتی بودن آنها در حل مشکل، کارساز است. برای آشنایی با گروههای جدول تناوبی، مطلب «گروه های جدول تناوبی (+ PDF و عکس فارسی)» را مطالعه کنید.
با تشکر
سلام خسته نباشید خدا قوت
آرایش الکترون نقطه ای عناصر واسطه به چه صورتیه
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزازیم. آرایش الکتروننقطهای معمولا در مولکولها و یونها کاربرد دارد که برای یادگیری آن میتوانید مطلب «ساختار لوویس و نحوه رسم آن — به زبان ساده (+ دانلود فیلم آموزش گام به گام)» را مطالعه کنید.
با تشکر