اسید چیست؟ – به زبان ساده
اسید به مادهای شیمیایی میگویند که یون هیدروژن یا پروتون بدهد یا الکترون جذب کند. بسیاری از اسیدها در ساختار شیمیایی خود با اتم هیدروژنی پیوند دارند که در اثر تفکیک در آب، کاتیون و آنیون آزاد میکند. هر قدر غلظت یون هیدروژن تولیدی بیشتر باشد، محلول، دارای خاصیت اسیدی بیشتر و pH پایینتری خواهد بود. در این مطلب از مجله فرادرس میآموزیم اسید چیست، چه خواصی دارد و چگونه میتوان آن را تشخیص داد.
- میآموزید اسید چیست و چه ویژگیهایی دارد.
- نظریههای مختلف موجود برای تعریف اسید را میشناسید.
- میتوانید مقدار pH و ثابت تفکیک اسید را برای اسیدها محاسبه کنید.
- تفاوت اسید قوی و اسید ضعیف را میآموزید.
- با روش نام گذاری اسیدهای مختلف آشنا میشوید.
- تفاوتهای اصلی بین اسید و باز را میشناسید.


اسید چیست؟
اسیدها مواد شیمیایی هستند که مقدار اسیدیته یا pH آن ها کمتر از عدد ۷ باشد. این مواد طعمی ترشمزه و سوزاننده دارند. برای این مواد تعاریف متفاوتی ارائه شده و کلیترین و آخرین تعریف این مواد، این ماد را به عنوان مادهای معرفی کرده که توانایی دریافت الکترون و تشکیل پیوند را داشته باشد. اسیدها میتوانند از نوع ضعیف (مانند اسید استیک) یا قوی (اسید نیتریک) باشند.
به تصویر زیر نگاه کنید. از حالت چهره کودک میتوان دریافت که آنچه میخورد، مزهای ترش دارد. کلمه «اسید» (Acid) ریشهای لاتین به معنای «ترش» دارد. به هنگام واکنش اسیدها و بازها، نمک و آب حاصل میشود. در زندگی روزمره، با بسیاری از موادی سروکار داریم که دانشمندان شیمی نام اسید را برای آنها انتخاب کردهاند. آب پرتقال و گریپفروت حاوی سیتریک اسید هستند و زمانی که شیر، مزهای ترش پیدا میکند، لاکتیک اسید خواهد داشت.

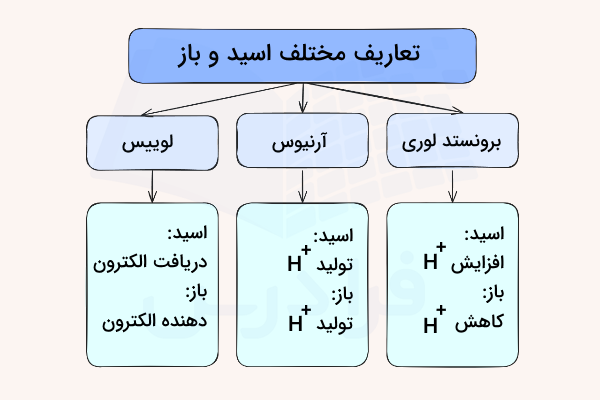
نظریه اسیدها
دانشمندان تعاریف مختلفی را برای این مواد ذکر کردهاند. این تعریفها به صورت زیر طبقهبندی میشوند:
- اسید آرنیوس
- اسید «برونستد-لوری» (Brønsted-Lowry)
- اسید لوییس
زمانی که شخصی واژه اسید را بکار میبرد به طور معمول به اسید آرنیوس یا برونستد-لوری اشاره دارد. اسید لوییس را به طور معمول، همان اسید لوییس مینامند. در ادامه، هریک از تعریفها را مورد بررسی قرار میدهیم.
برای یادگیری اسید و خواص و کاربردهای آن پیشنهاد میکنیم فیلم آموزش رایگان اسید در فرادرس را تماشا کنید.
اسید آرنیوس
تعریف آرنیوس از واکنش اسید-باز سبب توسعه نظریه هیدروژنی اسیدها شد و از آن برای تعریف جدید اسیدها و بازها استفاده میکنند. تلاشهای آرنیوس در این زمینه سبب شد تا جایزه نوبل شیمی را در سال ۱۹۰۳ کسب کند.
طبق تعریف، اسید آرنیوس به مادهای میگویند که در اثر تفکیک در آب، یون هیدروژن آزاد کند. به بیان دیگر، در محلولهای آبی، این ماده، غلظت یونهای را افزایش میدهد. این پروتوندهی به آب، سبب تشکیل یون هیدرونیوم میشود.
اسید برونستد لوری
طبق تعریف برونستد-لوری، اسید به مادهای میگویند که بتواند پروتون بدهد. این تعریف، محدودیت کمتری ایجاد میکند چراکه سایر حلالها به غیر از آب نیز در این تعریف دخیل هستند. به طور کلی، هر ترکیبی که بتواند پروتون از دست بدهد، اسید نام دارد. در این تعریف، آمینها و الکلها نیز جای میگیرند. تعریف برونستد-لوری، متداولترین تعریفی است که در خصوص این مواد بکار برده میشود.
اسید لوییس
اسید لوییس به ترکیبی میگویند که بتواند با دریافت یک جفت الکترون، پیوند کووالانسی تشکیل دهد. طبق این تعریف، برخی از موادی که شامل هیدروژن نیستند هم به عنوان اسید شناخته میشوند. از جمله این مواد میتوان به آلومینیوم تریکلرید با فرمول و بور تریفلوئورید با فرمول اشاره کرد.
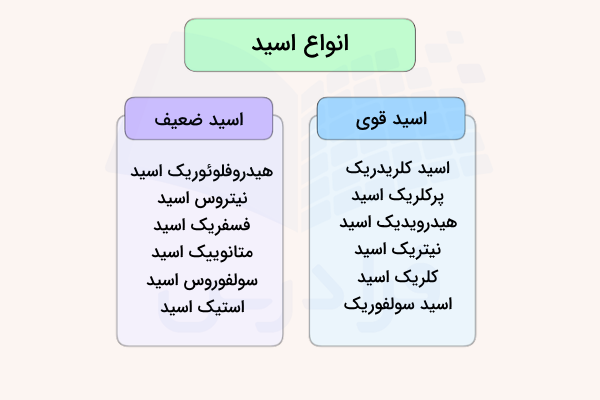
اسیدهای قوی و ضعیف
قدرت اسیدها متناسب با میزان تفکیک شدن آن در آب و تولید یون است. توجه داشته باشید که این مفهوم را با غلظت این مواد اشتباه نگیرید چراکه غلظت اسیدها بیانگر مقدار ماده حلشده از آنها در آب ذکر میشود. میتوان محلولی غلیظ از اسیدی ضعیف داشت یا اینکه محلولی رقیق از اسیدی قوی داشته باشیم. در ادامه به بررسی مفهوم اسیدهای قوی و ضعیف خواهیم پرداخت.
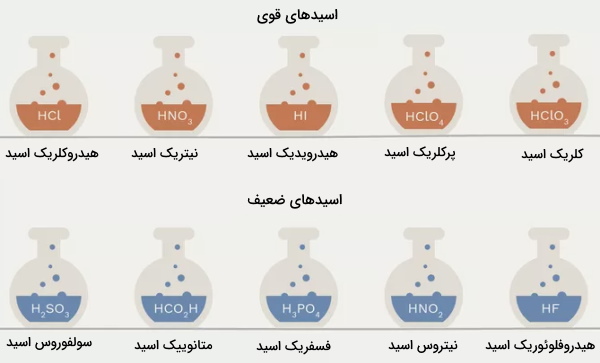
اسیدهای قوی
اسید قوی به اسیدی میگویند که در حدود ۱۰۰ درصد آن در محلول، تفکیک شود. طبق تعریف برونستد-لوری، زمانی که اسیدی در آب حل میشود، یون هیدروژن به مولکول آب منتقل میشود و یونهای مثبت و منفی، بسته به نوع اسید مورد استفاده، تشکیل میشوند. معادله واکنش کلی به صورت زیر خواهد بود.
همانطور که در رابطه بالا نشان داده شده است، واکنش بالا، واکنشی برگشتپذیر است اما در برخی موارد، این مواد به خوبی در آب تفکیک میشوند که میتوان این واکنش را یکطرفه در نظر گرفت. به طور مثال، به هنگام انحلال هیدروژن کلرید در آب و تولید ، واکنش را میتوان به صورت یکطرفه و به شکل زیر نوشت:
در هر لحظه، حدود ۱۰۰ درصد هیدروژن کلرید به یون هیدرونیوم و کلر تبدیل میشود. هیدروژن کلرید را به عنوان نوعی اسید قوی میشناسند. به بیان دیگر، اسید قوی به اسیدی میگویند که در حدود ۱۰۰ درصد آن در محلول، تفکیک شود. اسیدهایی همچون سولفوریک اسید و نیتریک اسید را نیز به عنوان اسیدهای قوی طبقهبندی میکنند. واکنش تفکیک اسیدها در بالا را میتوان به صورت خلاصهشده و به صورت زیر نوشت:
معادله بالا نشان میدهد که هیدروژن کلرید با تفکیک در آب به یونهای هیدروژن و کلر تبدیل میشود. در حقیقت، زمانی که در این معادله را بکار میبریم، منظورمان همان است.

pH اسید و باز و کاغذ لیتموس
برای اینکه بتوان به خاصیت اسیدی یا بازی یک ماده، عددی نسبت داد از مقیاسی به نام «pH» بهره میگیریم. این مقیاس، معمولترین روشی است که میتوان به قدرت اسیدی و بازی یک ماده پی برد. مقیاس pH بین صفر تا ۱۴ تغییر میکند که کمترین عدد، بیشترین خاصیت اسیدی و بیشترین عدد، بیشتری خاصیت بازی را نشان میدهد.
راه دیگر برای شناسایی اسید و باز، بهرهگیری از شناساگرهای اسید و باز از جمله کاغذ لیتموس است. رنگ کاغذ لیتموس در محلولهای اسیدی به رنگ قرمز و در محلولهای بازی به رنگ آبی تبدیل میشود.
تعریف pH
pH معیاری برای اندازهگیری غلظت یون هیدروژن در یک محلول است. اسیدهای قوی همچون هیدروکلریک اسید که در آزمایشگاههای شیمی مورد استفاده قرار میگیرند، pH بین ۰ تا ۱ دارند. به شکل ریاضی، pH را به صورت منفی لگاریتم پایه ۱۰ غلظت مولار یون هیدروژن و به شکل زیر تعریف میکنند:
اسیدهای ضعیف
اسید ضعیف به ماده ای میگویند که به هنگام انحلال در آب، به طور کامل تفکیک نمیشود. استیک اسید (اتانوییک اسید) از جمله اسیدهای ضعیف به شمار میآید.
این ماده به هنگام واکنش با آب، به یون هیدروژن و اتانوات تفکیک میشود. این یونها به سادگی در واکنش با یکدیگر به طور مجدد آب و اسید تولید میکنند که واکنش آن در زیر آورده شده است.
در هر لحظه تنها ۱ درصد از مولکولهای اسید به یون تبدیل میشوند و مابقی به صورت مولکولهای اتانوییک اسید باقی میمانند. بیشتر اسیدهای آلی از جمله اسیدهای ضعیف به شمار میآیند. هیدروژن فلوئورید نیز از جمله اسیدهای معدنی ضعیف به شمار میآید که در آزمایشگاههای شیمی، استفاده زیادی از آن میشود.
مقایسه قدرت اسیدهای ضعیف
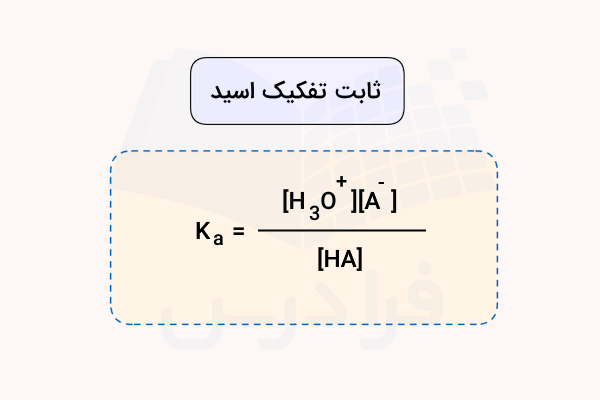
برای سنجش قدرت تفکیک اسیدهای ضعیف میتوان رابطه ثابت تعادل را برای واکنش تفکیک آنها نوشت. هرقدر مقدار ثابت تعادل، کمتر باشد، تعادل به طرف چپ میل میکند. به طور مثال، واکنش تفکیک زیر را در نظر بگیرید:
برای نوشتن ثابت تعادل، ممکن است رابطه زیر را در نظر بگیریم که با توضیحاتی همراه است:
اما اگر با دقت به رابطه بالا نگاه کنیم، این رابطه به طور کامل برای واکنش بالا صحیح نیست. در مخرج کسر، عبارتی برای غلظت آب در نظر گرفته شده است. در هر یک لیتر از محلول، در حدود ۵۵ مول آب وجود دارد. اگر اسیدی ضعیف با غلظت ۱ مولار داشته باشید و تنها ۱ درصد از آن با آب وارد واکنش شود، تعداد مولهای آب به 0/01 کاهش پیدا میکنند. به عبارت سادهتر، اگر اسیدی ضعیف داشته باشیم، غلظت آب تقریبا ثابت است.
با در نظر گرفتن این غلظت ثابت، ثابت تعادل را برای واکنش بالا به صورت زیر مینویسیم:
اگر شکل سادهتر واکنش تفکیک را در نظر بگیریم، رابطه ثابت تعادل یا به عبارت دیگر، ثابت تفکیک اسیدها به صورت زیر خواهد بود:
مثال تفکیک اسیدهای ضعیف
رابطه تفکیک اسیدها به صورت زیر است. رابطه ثابت تعادل و ثابت تفکیک را در واکنش زیر و شکل ساده آن بنویسید.
پاسخ
رابطه ثابت تعادل به صورت زیر خواهد بود:
اگر از شکل سادهتر تفکیک استفاده کنیم، به واکنش زیر میرسیم:
و رابطه ثابت تعادل نیز به صورت زیر خواهد بود:
تعریف pKa
همانند pH، میتوان رابطهای ریاضی را برای تعریف کرد تا مقیاس بهتری بدست آید. این رابطه به صورت زیر تعریف میشود:
با توجه به رابطه بالا درمییابیم که هرچه اسیدی ضعیفتر داشته باشیم، مقدار بزرگتر خواهد بود و برعکس.

کاربرد اسیدها
در ادامه، برخی از کاربرد این مواد را بررسی میکنیم. سرکه، استیک اسیدی رقیق است که کاربردهای زیادی در زندگی روزمره ما دارد و در انواع ترشیها و غذاها از آن استفاده میشود. همانطور که در ابتدای متن هم گفته شد، آب لیمو و پرتقال حاوی سیتریک اسید هستند که از جمله کربوکسیلیک اسیدها به شمار میآید.
در بسیاری از باتریها از جمله باتری خودروها از سولفوریک اسید استفاده میشود. علاوه بر این، در تولید صنعتی مواد منفجره، رنگها، جوهر و کودهای شیمیایی از این ماده بهره میگیرند. همچنین ماده اصلی در نوشابههای گازدار، فسفریک اسید است.
نام گذاری اسیدها
برای نامگذاری این مواد از آنیون آنها (آنیون متصل به هیدروژن) استفاده میشود. در اسیدهای دوتایی (باینری)، یک یون به هیدروژن متصل شده است. برای نامگذاری این نوع از مواد از پیشوند «هیدرو» و پسوند «یک» در انتهای آن استفاده میشود. به طور مثال، نام «»، هیدرویدیک اسید خواهد بود.
در ترکیبات اسیدی پیچیدهتر که شامل یک اتم اکسیژن بیشتر هستند، به جای پسوند «یک» از پسوند «ات» بهره میگیرند. همچنین، ترکیبات چنداتمی که یک اتم اکسیژن کمتر دارند، از پسنود «وس» و ترکیباتی با دو اتم اکسیژن کمتر از پیشوند «هیپو» و پسوند «وس» استفاده میشود. برای درک بهتر نامگذاری این مواد میتوانید به جدول زیر نگاه کنید که آنیون و نام ترکیبات حاصل، نوشته شده است.

نوشتن فرمول شیمیایی اسیدها
همچون سایر ترکیبات، این مواد نیز به لحاظ الکتریکی خنثی هستند و بنابراین، بار الکتریکی در بخش آنیون باید با بار الکتریکی یون برابر باشد. روش دیگر برای نوشتن فرمول شیمیایی این مواد، روش ضربدری است که در تصویر مشاهده میکنید که برای نوشتن مورد استفاده قرار گرفته است.
سوالات متداول در خصوص اسیدها و بازها
در ادامه، به برخی از سوالات مهم پیرامون اسیدها و بازها میپردازیم.
چه چیزی سبب اسیدی یا بازی شدن یک ماده می شود؟
اسیدها به فرآوردههایی شامل یونهای هیدروژن میگویند که محلول آنها، تعداد یون هیدروژن بیشتری نسبت به یون هیدروکسید دارند. به همین شکل نیز اگر غلظت هیدروکسید بیشتر باشد، محلولی بازی خواهیم داشت.
اسید چیست و چه خواصی دارد؟
این مواد ترکیباتی یونی هستند که به هنگام انحلال در آب، یون هیدروژن تولید میکنند و مزهای ترش دارند. این مواد، بسیار خورنده هستند و به هنگام انحلال در آب، توانایی هدایت جریان الکتریکی را دارند و در اثر واکنش با فلزات، گاز هیدروژن آزاد میکنند. برای شناسایی محلولهای اسیدی میتوان از شناساگرهای این مواد مانند کاغذ لیتموس استفاده کرد. کاربرد دیگر این شناساگرها در آزمایشهای تیتراسیون است.
تفاوت اصلی بین اسیدها و بازها در چه چیزی است؟
اسیدها و بازها هردو خورنده هستند اما تفاوت اصلی این مواد را باید در مقیاس pH ذکر کرد. همانطور که در متن نیز توضیح داده شده، هر مادهای با pH بین ۰-۷، اسید و بین ۷-۱۴، باز است.
اسیدها چه نقشی در بدن انسان دارند؟
این مواد نقشی اساسی را در بدن انسان ایفا میکنند. وجود هیدروکلریک اسید در معده سبب شکستن مولکولهای پیچیده غذا و هضم آن میشود. همچنین، آمینو اسیدها برای ترمیم بافت بدن مورد نیاز هستند.
چند نمونه از اسیدها را نام ببرید؟
از جمله این مواد میتوان به ترکیبات زیر اشاره کرد:














چرا درصد خلوص اسیدهای غلیظ نامحدود است؟
سلام ممنون از شما ،ایا میشه گفت که NaClهنگامی که در اب حل میشود چون Naیک بار مثبت هست و طبق تعریف اسید که فرمودید یک پروتون ازاد میکند پس NaClیک اسید است
باتشکر
سلام و روز شما بهخیر؛
خیر، NaCl اسید نیست زیرا همانطور که گفتید در آب تفکیک میشود و یون سدیم با فرمول شیمیایی Na+ را ایجاد میکند که دارای یک بار مثبت است. توجه داشته باشید که طبق تعریف اسید برونستد لوری، اسید مادهای است که توانایی آزاد کردن پروتون را داشته باشد و پروتون را نمیتوان با بار مثبت حاصل از تفکیک یونهای دیگر برابر در نظر گرفت.
خوشحالیم که با مجله فرادرس همراه هستید.
سلام و وقت شما بخیر.
با تشکر از مقاله عالی شما خیلی خوب و مفید بود.
اما سوالی که برام پیش اومده
اصلا مواد اسیدی چرا تمایل دارن هیدروژن شون رو از دست بدن؟
با سلام؛
از شما بابت مطالعه این مطلب و همراهی با مجله فرادرس سپاسگزاریم. مواد اسیدی در محلولهای آبی تمایل به از دست دادن هیدروژن یا پروتون را دارند که این موضوع به دو دلیل اتفاق میافتد.
دلیل اول: آب ترکیبی است که از دو اتم اکسیژن و هیدروژن تشکیل شده و اکسیژن الکترونخواهی بسیار بالایی داشته و به همین دلیل تمایل به جذب الکترون دارد. از طرفی هیدروژن که از الکترون محروم شده با اتم اکسیژن مولکول همسایه پیوند برقرار میکند (پیوند OH). بنابراین بار اکسیژن، منفی و هیدروژن بار مثبت بسیار ضعیفی خواهد داشت. به همین دلیل ضعیف بودن هیدروژن برای جبران کمبود بار مثبت تمایل بسیار زیادی دارد که از مولکولهای حاوی هیدروژن، هیدروژن را برای ایجاد یون هیدرونیوم به سمت خود جذب کند.
دلیل دوم: برای ذکر این دلیل هیدروکلریک اسید را در نظر بگیرید که از هیدروژن و کلر تشکیل شده است. در این اسید بسیار قوی اتم کلر الکترونخواهی بسیار بالایی دارد و پیوند میان هیدروژن و کلر ضعیف بوده به همین دلیل کلر به شدت متمایل است که هیدروژن را در اختیار مولکولهای آب بدهد تا اتم کلر برای دریافت الکترون به صورت یون کلر در محلول حضور داشته باشد.
بنابراین بر اساس این دو دلیل مولکول آب تمایل بسیار زیادی به دریافت هیدروژن (برای تبدیل به یون هیدرونیوم) و کلر در هیدروکلریک اسید (یا هر اسید دیگری) تمایل به رهایی از هیدروژن دارد پس هیدروژن در آب آزاد میشود. همچنین برای یادگیری بهتر این موضوع مطالعه مطلب «قدرت اسید و ثابت تفکیک اسید — از صفر تا صد» پیشنهاد میشود.
با تشکر.