عنصر چیست؟ – تعریف و مثال به زبان ساده
یک عنصر شیمیایی، مادهای است که نمیتوان آن را با واکنشهای شیمیایی به اجزای سادهتر تقسیم کرد. اگر نگاهی به جدول تناوبی عناصر بیاندازیم متوجه میشویم که در آن، تعداد 118 عنصر شیمیایی وجود دارند، اما جالب است بدانید که از این تعداد، ۲۰ درصد آن در طبیعت وجود ندارد و به طور مصنوعی در آزمایشگاه ساخته شدهاند.


از میان انواع عناصر شناخته شده، تعداد ۱۱ عنصر در حالت عادی به صورت گاز قرار دارند. این یازده عنصر عبارتند از: هیدروژن، نیتروژن، اکسیژن، فلوئور، کلر و شش گاز نجیب. برم و جیوه به حالت مایع قرار دارند. البته سزیم و گالیوم در دمای اتاق یا کمی بیشتر از آن ذوب میشوند. بقیه عناصر نیز جامد هستند. عنصرها میتوانند با یکدیگر درآمیزند و ترکیبات شیمیایی را تشکیل دهند. تعداد ترکیبات شناخته شده محدود است و هر روز به آنها اضافه میشود.
زمانی که تعداد دو یا بیشتر از عناصر با یکدیگر تشکیل یک ترکیب را دهند، ماده حاصل به طور کامل با اجزای سازنده خود تفاوت خواهد داشت. عناصر گازی هیدروژن و اکسیژن را در نظر بگیرید. این دو عنصر که خواص مختلفی دارند با یکدیگر ترکیب میشوند تا مولکول آب را بسازند که ویژگیهایی متفاوت از اجزای سازنده خود دارند.
علاوه بر موارد گفته شده، برای آشنایی با دستهبندیهای مختلف عنصرها میتوانید مطلب «عنصرها به چند دسته تقسیم می شوند — تقسیم بندی عناصر + مثال» را مطالعه کنید.
عنصرها و مخلوطها
آب را نمیتوان یک عنصر دانست چراکه به دو عنصر اکسیژن و هیدروژن تقسیم میشود اما اکسیژن و هیدروژن دو عنصر مختلف هستند زیرا با واکنشهای شیمیایی به عناصر دیگر قابل تقسیم نخواهند بود. مواد مختلفی که در طبیعت وجود دارند، شامل مخلوطی از ترکیبات هستند. آب دریا را در نظر بگیرید که مخلوطی از آب و ترکیبات بسیار دیگر است که از میان آنها میتوان به نمک (سدیم کلرید) اشاره کرد.
«مخلوطها» (Mixtures) با «ترکیبات» (Compounds) تفاوت دارند چراکه مخلوطها را میتوان به کمک فرآیندهای فیزیکی از یکدیگر جدا کرد. به طور مثال برای جداسازی آب از دیگر اجزا در مخلوط آب دریا، کافی است تا آن را تبخیر کنید.

تاریخچه مفهوم عنصر
فلاسفه یونانی اعتقاد داشتند که تمامی مواد از یک عنصر اصلی ساخته شدهاند. تالس، آناکسیمنس و هیراکلیتوس هر کدام اعتقاد داشتند که تمامی مواد از یک عنصر اساسی تشکیل شدهاند. تالس این عنصر را آب دانست، آناکسیمنس هوا را پیشنهاد داد و هیراکلیتوس به آتش اشاره داشت. امپیدوکلس، فیلسوف و شاعر یونانی بیان کرد که تمامی مواد از چهار عنصر اصلی هوا، زمین (خاک)، آتش و آب ساخته شدهاند. ارسطو با این نظر موافق بود و اعتقاد داشت که این چهار عنصر، حمل کننده خواص بنیادی هستند به طوریکه خشکی و حرارت با آتش، رطوبت و گرما با هوا، رطوبت و سرما با آب و همچنین سرما و خشکی با خاک همراهاند. در نگاه این فیلسوفان، سایر مواد، ترکیباتی از این عناصر و خواص آنها بیانگر عناصر سازنده آنها بودند.

عنصر در گذشته و حال
مفهوم یونانی یک عنصر که در حدود 2000 سال رواج داشت، تنها با یکی از تعاریف جدید از عنصر مشترک است که بیان میکند عنصرها دارای خواص مشخصی هستند. در زمانهای گذشته و در قرون وسطا که کیمیاگران، دانش بیشتری در خصوص فرآیندهای شیمیایی را پیدا کردند، مفهوم عناصر بنیادی در پاسخ دادن به سوالات این کیمیاگران ناتوان بود. خصوصیات بنیادی دیگری برای توضیح تغییرات شیمیایی ارائه شد و در نتیجه آن، گوگرد به عنوان نمایندهای برای قابلیت سوختن، جیوه به عنوان فرار و سیال بودن و نمک به عنوان عنصر ضد سوختن معرفی و بنابراین، گوگرد، جیوه و نمک نیز منعکس کننده طبیعت مواد شناخته شدند.
در سال 1661 رابرت بویل به طبیعت بنیادی یک عنصر شیمیایی پی برد. او اظهار داشت که چهار عنصر بنیادی نمیتوانند عناصر شیمیایی حقیقی باشند زیرا این عناصر توانایی ترکیب شدن با یکدیگر را برای تشکیل ماده جدید ندارند و نمیتوان این عناصر را از مواد مختلف استخراج کرد. بویل بر طبیعت فیزیکی مواد تاکیید داشت و آنها را به ترکیبات جدیدی که ساخته شده بودند مرتبط ساخت.

در سال 1789، آنتوان لاوازیه، شیمیدان فرانسوی، اولین فهرست از مواد بنیادی را به چاپ رساند. این مواد بر اساس تعریف بویل ارائه شده بودند. فهرست لاوازیه به کمک مطالعات کمی واکنشهای تجزیه و ترکیب بدست آمده بود. از آنجایی که این دانشمند نتوانست آزمایشاتی را ارائه دهد که بتوان برخی از مواد را تجزیه یا اینکه آنها را به کمک برخی عناصر شناخته شده تولید کرد، نامهای «آهک» (Lime)، «آلومینا» (Alumina) و «سیلیکا» (Silica) را بر روی آنها قرار داد که امروزه جزو ترکیبات بسیار پایدار شناخته میشوند. لاوازیه تاثیر عناصر بنیادی یونانی را با اضافه کردن مفاهیم نور و گرما حفظ کرد.
موادی همچون طلا، نقره، مس، آهن، سرب و قلع را از گذشته میشناسیم زیرا به شکلهای خالص در طبیعت یافت میشوند. شانزده عنصر دیگر در نیمه دوم قرن هجدم کشف شدند. این کشفها حاصل درک بهتر جداسازی عناصر از ترکیبات بود.

طبیعت اتمی عنصرها
موازی با توسعه مفهوم عناصر، ماهیت مواد نیز درک شد. در طول تاریخ، مواد را به صورت پیوسته و ناپیوسته در نظر میگرفتند. ماده پیوسته را به عنوان مادهای همگن در نظر داشتند که بدون محدودیت میشد آن را تقسیم کرد و هر بخش فارغ از اندازه خود، خواصی مشابه را ارائه میکرد. این در واقع نگاهی بود که ارسطو به هنگام بیان عناصر بنیادی داشت.
در مقابل، ماده ناپیوسته را جزئی در نظر میگیرند که تا یک نقطه مشخصی امکان تقسیم داشته باشد. این نقطه مشخص را تقسیم شدن اتم نامیدند. بر اساس این مفهوم، که به نظریه اتمی معروف است، تقسیم اتمها ما را به خواصی کاملا متفاوت میرساند. نظریه اتمی را معمولا به فیلسوف یونانی، «دماکریتوس» (Democritus) نسبت میدهند. او اعتقاد داشت که تمامی مواد از اتمهای چهار عنصر خاک (زمین)، هوا، آتش و آب ساخته شدهاند اما مفهوم ماده پیوسته ارسطو بر این اعتقاد غالب بود تا اینکه یافتههای آزمایشگاهی در قرن شانزدهم سبب بازگشت به نظریه اتمی شد. دو یافته آزمایشگاهی دلیل حمایت از نظریه اتمی بود:
- رفتار دقیق گازها
- ارتباط وزنی مشاهده شده در واکنشهای شیمیایی
شیمیدان انگلیسی، جان دالتون اولین کسی بود که توانست این یافتههای آزمایشگاهی را به صورت یک قانون تجربی با فرض حضور اتمها و با خواص مشخص توضیح دهد. در آن زمان، قدرت ترکیب شیمیایی (والانس) و جرمهای اتمی نسبی از موضوعات مورد بحث روز بودند. علاوه بر این، در سال 1969، اتمهای اورانیوم و توریم به کمک میکروسکوپ الکترونی مشاهده شدند.

عنصر مولکولی چیست؟
حال که با مفهوم عنصر آشنا شدهاید، ممکن است این سوال برای شما و بسیاری از دانشآموزان پیش بیاید که عنصر مولکولی چیست. در حقیقت، به مولکولهایی با حداقل دو اتم یکسان، عنصر مولکولی میگویند.
به طور مثال، مولکولهایی مثل و را میتوان نمونههایی از عنصر مولکولی نام برد. برای آشنایی بیشتر با عنصر مولکولی، مطالعه مطلب زیر پیشنهاد میشود.
ساختار اتم
اتمهای عناصر خود شامل ساختاری پیچیده و شامل ذرات بنیادی با نامهای پروتون، نوترون و الکترون هستند. یافتههای آزمایشگاهی نشان میدهند که در یک اتم، هسته توسط ابری از الکترون احاطه شده است. این هسته شامل نوترونها و پروتونها خواهد بود. وزن و بار الکتریکی، خواص بنیادی این «ذرات زیراتمی» (Subatomic Particles) را شامل میشود. الکترونها دارای بار منفی و پروتونها دارای بار مثبت و در این میان نوترونها به لحاظ بار الکتریکی خنثی هستند.
شعاع یک اتم در حدود ده هزار بار بزرگتر از هسته آن است. نوترونها و پروتونها در مجموع، وزنی برابر با یک «واحد جرم اتمی» (Atomic Mass Unit) دارند درحالیکه وزن الکترونها این مقدار است. بدلیل وجود نوترونها و پروتونها در هسته، کل جرم اتم در این ناحیه متمرکز شده است. تعداد پروتونها در هسته را «عدد اتمی» (Atomic Number) و تعداد کل پروتونها و نوترونها را «عدد جرمی» (Mass Number) میگویند. از آنجایی که اتم از لحاظ الکتریکی خنثی است، عدد اتمی نه تنها تعداد پروتونها (بارهای مثبت) را در هسته بیان میکند بلکه تعداد الکترونها (بارهای منفی) را نیز در خارج از فضای هسته ذکر میکند.
خواص شیمیایی عناصر به طور مستقیم با آرایش الکترونهای آن در اتم مرتبط است. در نتیجه به کمک اعداد اتمی میتوان عنصرها را از یکدیگر جدا کرد. در تعریف دیگری از عنصر میتوان بیان کرد که یک عنصر، مادهای است که تمام اتمهای آن دارای عدد اتمی یکسان باشند.
ایزوتوپها
آزمایشات دقیق بر روی نمونههای بسیاری از عناصر خالص نشان میدهد که تمامی اتمها حتی اگر عدد اتمی یکسانی داشته باشند، دارای وزن اتمی یکسانی نیستند. این شرایط تنها زمانی پیش میآید که اتمها در هسته خود تعداد نوترون متفاوتی داشته باشند. به این اتمها که عدد اتمی یکسان اما وزن اتمی متفاوتی دارند، «ایزوتوپ» (Isotope) میگویند.
تعداد ایزوتوپهایی که یک عنصر دارد ممکن است یک یا بیش از ده ایزوتوپ باشد. بیشتر عناصر حداقل دو ایزوتوپ دارند. وزن اتمی یک عنصر را به کمک نمونهای با توزیع طبیعی از ایزوتوپهای آن اندازهگیری میکنند. در نتیجه، وزن اتمی، نمایانگر متوسط وزن ایزوتوپهای اتم سازنده آن نمونه است. به تازگی با استفاده از روشهای «طیفسنجی جرمی» (Mass Spectrometric)، توزیع و وزن ایزوتوپهای یک نمونه طبیعی را اندازهگیری میکنند.

فراوانترین عنصرها
هیدروژن، هلیوم و اکسیژن از جمله فراوانترین عناصر در زمین هستند. ۷۵ درصد از این فراوانی متعلق به هیدروژن است و ۲۳ درصد آن به هلیوم تعلق دارد. از ۲ درصد باقیمانده، یک درصد به اکسیژن اختصاص دارد و سایر عناصر یک درصد باقیمانده را تشکیل میدهند. البته در پوسته زمین، فراوانترین عناصر شامل اکسیژن، سیلیکون و آلومینیوم به ترتیب با 47، ۲۸ و ۸ درصد فراوانی است.
هسته اتمها
در تعریفی دیگر باید به این نکته اشاره کنیم که برخی از عناصر را میتوان از طریق یک سری واکنشها موسوم به واکنشهای هستهای، به عناصر دیگری با عدد اتمی کوچکتر تقسیم کرد. به این دسته از فرآیندها «شکافت هستهای» (Nuclear Fission) میگویند. شکافت هستهای موجب تولید بمبهای هستهای بود که قدرتی برابر با هزاران تن بمب TNT دارند. البته به کمک این فرآیند میتوان در راکتورهای هستهای، برق تولید کرد.
در برخی موارد، عناصر با یکدیگر ترکیب میشوند تا عنصری با عدد اتمی بزرگتر بسازند. به این فرآیند، «همجوشی هستهای» (Nuclear fusion) میگویند. معمولترین نوع همجوشی هستهای مربوط به تبدیل هیدروژن به هلیوم است. این حالت در مرکز خورشید و دیگر ستارگان اتفاق میافتد. همجوشی هستهای انرژی بیشتری در مقایسه با شکافت هستهای تولید میکند. این فرآیند نیز موجب تولید بمبهای هیدروژنی بود که قدرتی معادل ۲۰ میلیون تن بمب TNT دارند.

خلوص شیمیایی و خلوص ایزوتوپی
شیمیدانها و دانشمندان هستهای تعاریف متفاوتی از «عنصر خالص» (Pure Element) دارند. در شیمی، یک عنصر خالص به مادهای اطلاق میشود که اتمهای آن همگی دارای عدد اتمی یکسان یا تعداد پروتون یکسان باشند. در صورتیکه دانشمندان هستهای، عنصری را خالص مینامند که تنها یک ایزوتوپ پایدار داشته باشد.
به طور مثال اگر یک سیم مسی خلوصی برابر با 99/99 درصد داشته باشد، به این معنی است که 99/99 درصد از اتمهای آن از مس تشکیل شدهاند. البته این سیم مسی به لحاظ ایزوتوپی خالص نیست چراکه به طور معمول، مس شامل دو ایزوتوپ است.
آلوتروپها
اتمهای عناصر میتواند به طرق مختلف با یکدیگر پیوند تشکیل دهند. این امر سبب میشود تا ماده حاصل دارای ساختار شیمیایی متفاوتی باشد. به این مواد که آنها را با نام آلوتروپ میشناسند، دارای خواص فیزیکی متفاوتی با یکدیگر هستند. به طور مثال، الماس و گرافیت هر دو از آلوتروپهای کربن به شمار میآیند.
خواص عنصرها
عنصرها را برای بیان خواص آنها میتوان در دستهبندیهای مختلفی قرار داد. این کار سبب میشود تا بتوانیم در خصوص مواردی همچون خواص فیزیکی و شیمیایی آنها به بحث بپردازیم.
خواص عمومی
برای بیان خواص مختلف عنصرها، باید آنها را دستهبندی کنیم. یکی از این دستهها «فلزات» (Metalls) هستند. فلزات رسانایی خوبی دارند اما در مقابل، «نافلزات» (non-Metalls) از این خاصیت بیبهرهاند. گروه کوچکی با نام «شبه فلزات» (Metalloids) وجود دارد که عناصر آن خواصی بینابین فلزات و نافلزات دارند و معمولا به عنوان «نیمه رسانا» (Semiconductor) شناخته میشوند.
از دستهبندیهای دقیقتری نیز برای توصیف عنصرها استفاده میشود که معمولا آنها را با رنگبندیهای مختلف در جدول تناوبی عناصر نشان میدهند. این دستهبندی، گروههای مختلفی را شامل میشود که در زیر آورده شدهاند:
- فلزات قلیایی
- فلزات قلیایی خاکی
- هالوژنها
- عناصر (فلزات) واسطه
- فلزات پسواسطه
- شبهفلزات
- «نافلزات فعال» (Reactive non-Metals)
- گازهای نجیب
- لانتانیدها و اکتینیدها
حالت مواد
ویژگی دیگر برای بیان خواص عناصر، حالت مواد است که به جامد، مایع و گاز تقسیم میشوند برای بیان آنها از شرایط استاندارد (STP) کمک میگیریم. همانطور که در ابتدای مطلب نیز بیان شد، بیشتر عنصرها در دمای معمول و فشار اتمسفری به صورت جامد حضور دارند. برم و جیوه در دمای صفر درجه سانتیگراد مایع و سزیم و گالیم در این دما جامد هستند. البته سزیم و گالیم در دمای بیش از 28 درجه سانتیگراد ذوب خواهند شد.

نقطه ذوب و جوش
نقطه ذوب و جوش معمولا به صورت درجه سلسیوس و در فشار یک اتمسفر ذکر میشوند. با وجود اینکه این نقاط برای بیشتر عنصرها شناختهشده هستند اما نقطه ذوب و جوش برای برخی از عنصرهای رادیواکتیو، هنوز مشخص نشده است. به دلیل اینکه هلیوم در فشار اتمسفری و حتی دمای صفر مطلق به حالت مایع قرار دارد، در متون علمی تنها برای آن نقطه ذوب در نظر میگیرند و فاقد نقطه جوش است.
چگالی
چگالی عنصرها را نیز در شرایط استاندارد و به شکل «گرم بر سانتیمتر مکعب» بیان میکنند. زمانی که یک عنصر، آلوتروپهایی با چگالیهای مختلف داشته باشد، از یک آلوتروپ به عنوان نماینده استفاده میکنند. البته در برخی موارد - مانند عنصر کربن - چگالیهای هر آلوتروپ را نیز به طور جداگانه مورد استفاده قرار میدهند.
نمادهای شیمیایی
قبل از اینکه شیمی به یک علم تبدیل شود، کیمیاگران نمادهایی محرمانه و سری را برای فلزات و ترکیبات معمول طراحی کرده بودند.
در این نمادها هیچ اثری از آمیختن دو اتم برای تشکیل یک ترکیب وجود نداشت. با پیشرفتهایی که جان دالتون در خصوص نظریه اتمی ماده پیدا کرده بود، نمادهای خود را برای عناصر پیشنهاد کرد که در تصویر زیر آمدهاند:

روشی که امروزه برای نامگذاری عنصرها از آن استفاده میشود توسط «برزیلیوس» (Berzelius) ابداع شد. در این روش، نمادهای شیمایی شامل الفبای لاتین میشوند و تمامی افراد با زبانهای مختلف از این نمادها استفاده میکنند.
نمادهای شیمیایی دیگر
علاوه بر نمادهایی که برای نمایش عنصرها استفاده میشوند، از نمادهای دیگری نیز در معادلات شیمیایی استفاده میشود که در جدول زیر آورده شدهاند
| نماد | توضیح |
| برای نمایش یک گروه متغیر (معمولا هالوژن) | |
| رادیکال | |
| حرارت | |
| نمادی کلی و همچنین نماد عنصر «ایتریوم» (Yttrium) | |
| برای نمایش یک گروه متغیر | |
| برای نمایش گروه الکتروندوست (الکتروفیل) در شیمی آلی | |
| برای نمایش گروه هستهدوست (نوکلئوفیل) در شیمی آلی | |
| برای نمایش لیگاند در شیمی معدنی | |
| فلزات | |
| لانتانیدها | |
| اکتینیدها | |
| در قدیم برای نمایش گازهای نجیب استفاده میشد. امروزه نماد عنصر رونتگنیم است. |
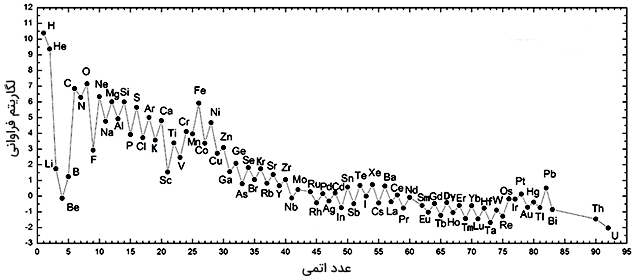
فراوانی عناصر
در تصویر زیر میتوانید فراوانی عناصر را در منظومه شمسی مشاهده کنید:
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- یون چیست؟ — به زبان ساده
- جرم مولی — به زبان ساده
^^













عالی بود
سلام عالی بود
عالی بود ممنون
بی نظیر بود مطالب تون واقعا مفید هست خیلی خیلی خیلی ممنون?
با سلام
خوشحالیم که مطالعه این مطلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
خیلی عالی بود مـمـنون از مطالب مفیدتون
عالی بود ولی کمی سریع