اتر چیست؟ – به زبان ساده
اترها دستهای از ترکیبات آلی هستند که در آنها، اکسیژن در بین دو گروه آلکیل قرار گرفته است و فرمول عمومی به صورت دارند. از اتر در رنگها، عطرها، روغن، موم و سایر موارد صنعتی استفاده میشود. به اترها، آلکوکسی آلکان نیز میگویند. اگر در گروههای آلکیلی متصل به اتم اکسیژن، هیچ گروه «آریل» (Aryl) متصل نباشد، به آنها اتر آلیفاتیکی میگویند.


پیوندها در اتر
پیوندهای اتر، زاویه و طول پیوندی به ترتیب در حدود 110 درجه و 140 پیکومتر دارند. از آنجایی که اکسیژن، الکترونگاتیوی بیشتری نسبت به کربن دارد، هیدروژن موجود در اتر خاصیت اسیدی بیشتری از هیدروکربنهای ساده دارد. البته این خاصیت اسیدی، نسبت به کتونها و آلدهیدها بسیار کمتر است.
نامگذاری اترها
همانطور که گفته شد، اترها ترکیباتی هستند که دو گروه آلکیل یا آریل متصل به اکسیژن دارند. گروه عاملی اتر، مشخصه خاصی در نامگذاری آیوپاک ندارد و معمولا نامگذاری آنها به کمک اجزای آلکیل انجام میشود. با استفاده از جدول زیر، میتوان به نامگذاری اترها پرداخت:
| نام | گروه آلکیل | نام | گروه آلکوکسی |
| متیل | متوکسی | ||
| اتیل | اتوکسی | ||
| ایزوپروپیل | ایزوپروپوکسی | ||
| ترت-بوتیل (ترشیو بوتیل) | ترت-بوتوکسی | ||
| فنیل | فنوکسی |
هر گروه آلکیلی در اطراف اکسیژن را به طور جداگانه شمارهگذاری میکنیم. اولویت با نزدیکترین اتم کربن به اکسیژن است. بخش آلکوکسی (بخش کوتاهتر) بر اساس گروه آلکیل متناظر خود، نام «اوکسی» میگیرد. به طور مثال، مولکول را با نام ۱-پرپوکسیپنتان میشناسند.
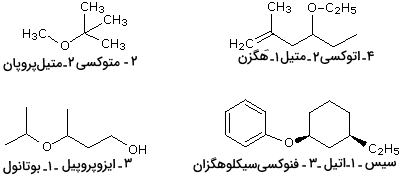
اترهای ساده را بر اساس گروه آلکیل متصل به اکسیژن و به ترتیب الفبا نامگذاری میکنند که بعد از آن، عبارت «اتر» آورده میشود. به مثالهای تصویر زیر نگاه کنید تا با نامگذاری اترها آشنا شوید. بسیاری از اترهای ساده، از نظر فضایی، متقارن و در آنها، گروههای آلکیلی، یکسان هستند. به این نوع از اترها «دیآلکیل اتر» (Dialkyl Ether) میگویند.
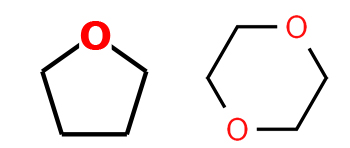
اتر حلقوی
در اترهای حلقوی (هتروسیلکها)، یک یا چند اتم اکسیژن با کربن جایگزین میشوند. برای نامگذاری این ترکیبات، شمارهگذاری را از اتم اکسیژن آغاز میکنیم. این نوع از ترکیبات را اکساسیکلوآلکان میگویند و پیشوند «اکسا» بیانگر جانشینی کربن توسط اکسیژن در داخله حلقه کربنی است.
در صورتیکه الکل داشته باشیم، شمارهگذاری را از طرفی آغاز میکنیم که به الکل نزدیکتر است. اما در صورت وجود هالیدها، شمارهگذاری گروه اتری اولویت دارد. در شرایطی که الکل و هالید داریم، اولویت با شمارهگذاری از سمت الکل است.
پلیاترها
پلیاترها ترکیباتی با بیش از یک گروه اتری هستند که در دندانپزشکی کاربردهای فراوانی دارند. از پلیاترهای کوچک میتوان به «اتر تاجی» (Crown Ether) اشاره کرد. به عبارت دیگر، پلیاترها، پلیمرهایی هستند که در زنجیره اصلی خود دارای گروه عاملی اتر باشند.
مقایسه خواص فیزیکی الکل و اتر
در مولکولهای اتر نمیتوان هیدروژن متصل به اکسیژن پیدا کرد. در حقیقت، این نوع از ترکیبات، فاقد گروه OH هستند. در نتیجه، هیچ پیوند هیدروژنی بین مولکولهای اتر وجود ندارد. به همین دلیل، با جرم مولی برابر، اترها نقطه جوش پایینتری در مقایسه با الکلها دارند اما نقطه جوش این مواد، با آلکانها تقریبا برابر است.
| فرمول ساختاری تراکمی | نام | جرم مولی | نقطه جوش (درجه سانتیگراد) |
| پروپان | |||
| دیمتیل اتر | |||
| اتیل الکل | |||
| پنتان | |||
| دیاتیل اتر | |||
| بوتیل الکل |
البته اترها اکسیژنی دارند که با مولکولهای آب پیوند هیدروژنی میدهد. در نتیجه، میزان انحلالپذیری اتر در آب، به همان میزان الکلها است. به طور مثال، دیمتیل اتر و متانول، هردو فرمول مولکولی دارند و به طور کامل در آب حلالپذیر هستند درحالیکه دیاتیل اتر و ۱-بوتانول با فرمول به میزان کم در آب حل میشوند.
واکنشها در اتر
اترها ترکیبات به نسبت پایداری هستند که با بازها، فلزات فعال، عوامل اکسنده و کاهنده و اسیدهای رقیق واکنش نمیدهند و به طور معمول، واکنشپذیری پایینی دارند اما واکنشپذیری آنها بیشتر از آلکان است. واکنشهای مهم اترها در زیر آورده شدهاند:
شکافت اتر
با وجود اینکه اترها در مقابل هیدرولیز مقاوم هستند، اما پیوندهای قطبی آنها توسط اسیدهای معدنی همچون هیدرو برمیک اسید و هیدرو یدیک اسید شکسته خواهند شد. هیدروژن کلرید نیز به آهستگی موجب شکافت اترها میشود. در واکنشهای «شکافت اتر» (Ether Cleavage)، به طور معمول، متیل هالید به تولید میرسد:
برخی از اترها با موادی همچون «تریبرمید بور» به سرعت در واکنش شکافت شرکت میکنند و آلکیل برمید تولید میکنند. لازم به ذکر است که معمولترین واکنش در اترها، شکست پیوند $$$C-O$$
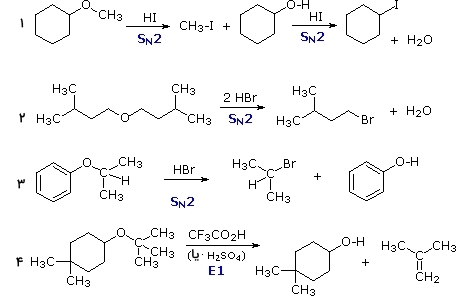
در تصویر بالا، دو واکنش اول توسط دو مرحله مکانسیم صورت میگیرد که در آن، آنیون ید یا برم با الکل مرحله اول جایگزین میشود. در مرحله بعد، آین آنیونها اسید مزدوج الکل را به یک آلکیلهالید تبدیل میکنند.
گروه آلکیل مثال سوم، توسط مکانسیم شکافته میشود و انجام مکانیسم امکانپذیر نیست. فنولی که در این واکنش به تولید میرسد، در واکنش دیگری شرکت نمیکند زیرا مکانسیمهایی که در بالا آورده شدهاند، در حلقههای آروماتیکی انجام نمیشوند. مثال آخر، شکافت اتر را با یک اسید قوی نشان میدهد. به طور معمول، اسیدهایی که بازهای مزدوج ضعیف هستهدوست دارند برای این واکنش انتخاب میشود.
تکشیل پراکسید
اترهایی که اکسیژن آنها با گروههای آلکیل نوع اول و دوم پیوند دارند، در حضور اکسیژن و در واکنشهایی موسوم به تشکیل پراکسید شرکت میکنند. در این نوع از واکنشها باید جوانب ایمنی رعایت شوند چراکه پراکسیدها در اثر ضربه یا حرارت، به صورت انفجاری تجزیه خواهند شد.
در حقیقت، زمانی که اترها در محیطی شامل اکسیژن نگهداری شوند، پراکسیدهای انفجاری همچون دیاتیل اتر پراکسید، تولید میکنند. سرعت این واکنشها با نور، کاتالیزورهای فلزی و آلدهیدها افزایش مییابند. بهتر است که به هنگام نگهداری اترها، شرایط تشکیل پراکسید را برای آنها فراهم نکنیم. علاوه بر این، توصیه میشود زمانی که از اتر به عنوان حلال استفاده میکنیم، برای خشک کردن محلول از تقطیر استفاده نکنیم زیرا پراکسیدهای تشکیل شده، فراریت کمتری نسبت به اترها دارند و در نتیجه، با انجام تقطیر، غلظت پراکسیدها بیشتر میشوند.
حضور پراکسید در نمونههای کهنه از اترها را میتوان با مخلوط کردن آنها با محلول و اضافه کردن پتاسیم تیوسیانات با فرمول تشخیص داد. رنگ قرمز حاصل، نشان از حضور پراکسید دارد.
واکنش اپوکسیدها
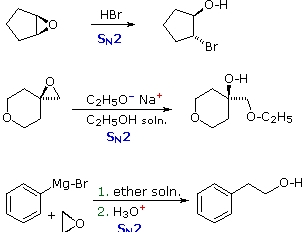
اپوکسیدها که به «اکسیران» (Oxirane) نیز معروف هستند، نوعی از اترهای حلقوی سهعضوی هستند که به سادگی از طریق واکنش با پروکسی اسیدها تولید میشوند. به دلیل وجود «کرنش زاویهای» (Angle Strain) زیاد در حلقههای کوچک، شکست پیوند در واکنشهای کاتالیز شده اسید و باز، نسبت به اترهای حلقوی بزرگتر، سادهتر انجام میشود. برخی واکنشهای اپوکسیدها در تصویر زیر آورده شده است:
سنتز اترها
اترها را میتوان از روشهای مختلفی به تولید رساند. به طور کلی، اترهای آلکیلی سادهتر از اترهای آریلی به تولید میرسند که معمولا برای انجام واکنش، به کاتالیزور نیاز دارند. سنتز اترها از گذشته جزو مسائل مورد علاقه بین شیمیدانها به شمار میآمد به گونهای که سنتز دیاتیل اتر به کمک واکنش بین اتانول و سولفوریک اسید، از قرن سیزدهم شناخته شده است.
آبگیری از الکلها
آبگیری از الکلها طبق واکنش زیر، موجب تولید اترها میشود که واکنش آن در دمای بالا به صورت زیر خواهد بود:
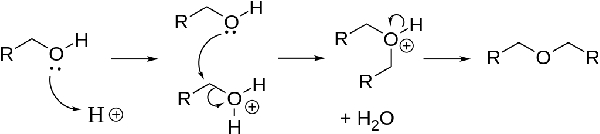
این فرآیند که به صورت واکنش مستقیم جانشینی هستهدوست انجام میشود، به دمایی در حدود 125 درجه سانتیگراد نیاز دارد. این واکنش به طور معمول توسط اسیدی به نام سولفوریک اسید کاتالیز میشود. آبگیری از الکلها برای تولید اترهای متقارن کاربرد دارد. از طریق همین روش میتوان دیاتیل اتر را از اتانول بدست آورد.
سنتز ویلیامسون
«سنتز اتر ویلیامسون» (Williamson Ether Synthesis) سادهترین و شاید سریعترین راه برای تولید اتر به شمار میآید. واکنشهای سنتز ویلیامسون شامل آلکوکسیدی هستند که با هالوآلکان نوع اول یا سولفانات استر واکنش میدهد. آلکوکسیدها به صورت باز مزدوج یک الکل وجود دارند که به صورت گروه آلکیل متصل به اکسیژن تعریف میشوند و معمولا آنها را به صورت نشان میدهند.

در واکنش بالا، گروه مناسب شامل یونهای ید، برم و سولفانات است. البته این روش برای آریلهالیدها همچون بروموبنزن مناسب نیست اما بهترین نتایج را با هالیدهای نوع اول دارد.
اضافه کردن الکلها به آلکنها
اضافه کردن الکلها به آلکنها، موجب تولید اتر خواهد شد. البته برای انجام چنین واکنشهایی به کاتالیزورهای اسیدی نیاز داریم و معمولا از تریفلوئورو استات با فرمول استفاده میشود:
کاربردهای اتر
از معروفترین اترها، دیاتیل اتر است که در مواقعی به طور ساده به آن، اتر هم میگویند. فرمول دیاتیل اتر به صورت است. در گذشته از این ماده به عنوان داروی بیهوشی استفاده میشد و امروزه کاربردهای فراوانی دارد.
دیاتیل اتر را میتوان از طریق بوی شیرینی که دارد شناسایی کرد. در بسیاری از آزمایشگاهها، از دیاتیل اتر به عنوان حلال استفاده میشود. با توجه به اینکه این ماده ناقطبی است، سایر مواد ناقطبی را در خود حل میکند و با آب و مواد قطبی، امتزاجناپذیر است. در نتیجه، دیاتیل اتر حلال مناسبی برای چربیها، روغنها، عطرها و سایر مواد ناقطبی به شمار میآید. پیشنهاد میکنیم برای درک بهتر این گروه عاملی و نکات آن، مطلب جمع بندی فصل دوم شیمی یازدهم را مطالعه کنید.
دیمتیل اتر
از جمله دیگر اترهای معروف، دیمتیل اتر با فرمول شیمیایی است. دیمتیل اتر، هیدروکربنی با دو گروه متیل متصل به اکسیژن را تشکیل میدهد. این گاز بیرنگ، خواص متعددی دارد و معمولا به عنوان حلال آلی مورد استفاده قرار میگیرد. همچنین، دانشمندان در حال مطالعه بر روی این ماده به عنوان جایگزینی برای دیزل (گازوئیل) هستند زیرا مادهای غیر سمی است که عدد ستان بیشتری نسبت به گازوئیل دارد. عدد ستان بالاتر به این معنی است که سوخت، کاملتر از گازوئیل میسوزد و آلایندگی کمتری دارد.
از دیگر مزایای استفاده از دیمتیل اتر به عنوان سوخت میتوان گفت که این ماده، گوگرد و ترکیبات آروماتیک آزاد نمیکند. واکنش سوختن دیمتیل اتر به صورت زیر است:
انرژی
البته چنین واکنشهایی تنها به لحاظ نظری قابل انجام هستند. در حقیقت، شرایط ایدهآل برای احتراق کامل وجود ندارد که از عوامل آن میتوان به خطای انسانی، اختلاط نامناسب مواد در محفظه احتراق و نبود اکسیژن کافی اشاره کرد. با اینحال، واکنش سوختن دیمتیل اتر، بازده بالایی دارد.
آنیسول
آنیسول یا متوکسی بنزن، اتری با فرمول و مایعی غیر سمی با نقطه جوش بسیار بالا در حدود 315 درجه سانتیگراد است. آنیسول بویی تند و شیرین همچون بوی رازیانه دارد که آن را برای استفاده در عطرها مناسب میکند. البته کاربردهایی در داروسازی هم از این ماده دیده شده است. در طبیعت، آنیسول در فرومونهای حشرات یافت میشود. به همین دلیل، بسیاری از گیاهان برای جذب حشرات، از خود آنیسول آزاد میکنند.
پلیاتیلن گلایکول
«پلیاتیلن گلایکول» (PEG)، ترکیب آلی با زنجیره طویل و فرمول ساختاری است. با توجه به متغیر در فرمول، این مولکول با طولهای مختلف وجود دارد.
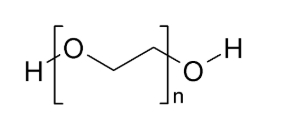
کاربردهای PEG با تغییر طول آن، تغییر میکنند. PEG با طول مولکولی کم را میتوان در کرمهای پوست، روانکنندهها، ملینها و مواد معلق در خمیردندان مشاهده کرد. مولکولهای بزرگتر PEG، به عنوان مواد مورد نیاز در رنگها، کروماتوگرافی گازی و بستهبندی غذاها مورد استفاده قرار میگیرند. بسیاری از خصوصیات ذکرشده، به این بستگی دارد که PEG بتواند با آب و حلالهای آلی پیوند تشکیل دهد.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:












