آلکن ها – از صفر تا صد
ترکیبات آلی که در آنها پیوندهای چندگانه کربن-کربن وجود دارد، تعداد اتم هیدروژن کمتری نسبت به آلکانها دارند. به همین دلیل، به چنین ترکیباتی، غیراشباع میگویند. در این بخش به طور کامل به گروهی از این هیدروکربنهای غیراشباع موسوم به آلکن ها میپردازیم. یک آلکن باید حداقل شامل یک پیوند دوگانه کربن-کربن باشد. در بحث اوربیتالهای مولکولی به یاد داریم که یک پیوند دوگانه شامل یک پیوند کربن-کربن از نوع سیگما و یک پیوند پای است که از همپوشانی اوربیتالهای بوجود میآید. همچنین، میدانیم که اتم کربن در یک پیوند سیگما در آلکن، به صورت هیبرید شده است که به طور کامل در بحث هیبریداسیون آنرا توضیح دادیم.


آلکن ها و سیکلوآلکنها (آلکنهای حلقوی) به وفور در طبیعت یافت میشوند. همچنین، این هیدروکربنها نقش بیولوژیکی بسیاری دارند و در چربیها، روغنها، ویتامینها و هورمونها یافت میشوند. سادهترین هورمون را میتوان در اتن پیدا کرد که در مقادیر کمی توسط میوهها تولید و موجب رسیدن آنها میشود. به همین دلیل، در صنایع غذایی، برای حمل و نقل سادهتر میوهها، قبل از رسیدن، آنها را میچینند و در انبارها به کمک اتن، این میوهها از رنگ سبز خود خارج میشوند.
ساختار و پیوند آلکن ها
سادهترین آلکن، اتیلن با فرمول است که آیوپاک، نام اتن را برای آن انتخاب کرده است. ساختار اتن را در تصویر زیر مشاهده میکنید.
زاویه پیوندی در آلکنها به طور معمول در حدود 120 درجه است به طوریکه زاویه پیوندی در اتن و پروپان به ترتیب 121/7 و 124/8 ذکر میشود و در تصویر زیر میتوان این زوایا را مشاهده کرد.
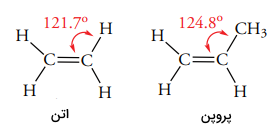
ساختار اوربیتالهای مولکولی اتن را نیز در تصویر زیر مشاهده میکنید. یک اوربیتال هیبرید شده در اتان دارای 33 درصد خاصیت s است درحالیکه اوربیتال هیبرید شده، ۲۵ درصد خاصیت s دارد. هر قدر درصد خاصیت s در یک اوربیتال افزایش پیدا کند، الکترونها در فاصله کمتری از هسته قرار میگیرند. این افزایش خاصیت، تاثیر مهمی در طول و انرژی پیوند اتن دارد که در ادامه به آن خواهیم پرداخت.

انرژی و طول پیوند
طول پیوند بین یک اتم کربن و اتم دیگری که اوربیتال هیبرید شده داشته باشد نسبت به اتمی با اوربیتال هیبرید شده کوتاهتر است. به طور مثال، میتوانید به طول پیوند در پیوند کربن-هیدروژن بین پروپان و پروپن توجه کنید.
انرژی پیوند اتن و اتان نیز به ترتیب برابر با و و طول پیوند کربن-کربن در اتن و اتان نیز به ترتیب 133 و 154 پیکومتر است.
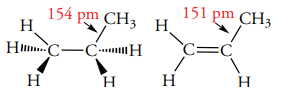
دلیل طول پیوند کوتاهتر در اتن، وجود اوربیتال هیبرید شده ذکر میشود. این کاهش طول پیوند را که در تصویر بالا برابر با 3 پیکومتر است، میتوان برای طول پیوند در اتن نیز پیشبینی کرد و به عدد 148 پیکومتر رسید اما طول پیوند حقیقی از این مقدار نیز کمتر و برابر با 133 پیکومتر است. در نتیجه، اصلیترین دلیل این کاهش طول را میتوان در افزایش تعداد پیوندهای متصل به اتم کربن ذکر کرد.
انرژی پیوند دوگانه کربن-کربن در اتن برابر با و این مقدار برای پیوند یگانه کربن-کربن در اتان، برابر با است. چطور میتوان انرژی پیوند را به پیوندهای سیگما و پای نسبت داد؟ در حقیقت، انرژی پیوند سیگما در اتن باید به نوعی بیشتر از این انرژی در اتان باشد چراکه هر دو اتم کربن در اتن به صورت هیبرید شده هستند. در جدول زیر، طول و قدرت پیوند را در آلکانها و آلکن ها مشاهده میکنید.
| پیوند | طول پیوند (پیکومتر) | قدرت پیوند |
| 154 | 347 | |
| 133 | 610 | |
| 151 | 121 | |
| 109 | 422 | |
| 107 | 452 |
طبقهبندی آلکان ها
گروههای آلکیلی که با اتم کربن هیبرید شده در آلکن ها پیوند دارند، بر پایداری پیوند دوگانه موثر هستند. واکنشپذیری آلکن ها همچنین به تعداد گروههای آلکیل متصل به اتم کربن نیز بستگی دارد. به همین دلیل، میتوان آلکن ها را بر اساس تعداد گروههای آلکیل متصل به واحد طبقهبندی کرد. به این ویژگی، درجه استخلاف (درجه جانشینی) میگویند. این درجات به صورت زیر تعریف میشوند:
- تک استخلافی: آلکنی که تنها یک گروه آلکیل متصل به اتم کربن با پیوند دوگانه دارد. مثال:
- دو استخلافی: دو گروه آلکیل متصل به پیوند دوگانه کربن کربن دارند. مثال: یا
- سه استخلافی: سه گروه آلکیل متصل به پیوند دوگانه کربن کربن دارند. مثال:
- چهار استخلافی: چهار گروه آلکیل متصل به پیوند دوگانه کربن کربن دارند. مثال:
خوب است بدانید به آلکنی که پیوند دوگانه آن در انتهای زنجیر کربنی واقع شده باشد، «آلکن ترمینال» (Terminal Alkene) میگویند.
مثال
ترکیب زیر، یک تیو اتر غیراشباع است. درجه استخلاف این ترکیب را مشخص کنید.

این ترکیب شامل یک ترمینال با پیوند دوگانه است. به اتم کربن ترمینال در این مولکول، دو اتم هیدروژن اتصال دارد. اتم کربن دیگر در پیوند دوگانه، به دو گروه متصل است. در نتیجه، این ترکیب را میتوان از نوع دو استخلافی دانست.
عدد غیر اشباع
در مقایسه با آلکانها، آلکن ها بواسطه پیوند دوگانه، دو اتم هیدروژن کمتر دارند. فرمول عمولی یک آلکن به صورت نوشته میشود. همچنین در خصوص آلکانها به یاد داریم که هر حلقه، موجب کم شدن دو اتم هیدروژن خواهد بود. بنابراین، فرمول مولکولی یک ترکیب آلی، به ما در خصوص ترکیب تعداد پیوندهای پای و حلقهها اطلاعات مناسبی میدهد.
این اطلاعات را به کمک «عدد غیراشباع» (Unsaturation Number) بدست میآوریم. این عدد با مجموع تعداد حلقهها و پیوندهای پای برابر است. برای محاسبه عدد غیراشباع، به شکل زیر عمل میکنیم:
- تعداد اتمهای هیدروژن و کربن را در آلکن محاسبه کنید.
- برای بدست آوردن درجه غیراشباع یا عدد غیراشباع، عبارت حاصل را طبق رابطه زیر، بر دو تقسیم کنید.
عدد غیراشباع
عدد اشباع برای مولکولهای شامل اتمهایی به غیر از هیدروژن نیز قابل محاسبه است. از آنجایی که هالوژنها، اتمهایی تکظرفیتی هستند، میتوان آنها را به عنوان جایگزینی برای اتمهای هیدروژن در نظر گرفت. در حقیقت، به هنگام محاسبات، میتوان تعداد اتمهای هالوژن را نیز در محاسبه تعداد اتمهای هیدروژن بکار برد و به آن اضافه کرد. به طور مثال، برای محاسبه عدد غیراشباع مولکول 3-برمو-1-پروپن با فرمول ، به سادگی میتوان یک هیدروژن را با برم جایگزین کرد و محاسبات را انجام داد.

عدد غیراشباع
عدد غیر اشباع در ترکیبات شامل اکسیژن
عدد غیراشباع را برای ترکیبات شامل اکسیژن دوظرفیتی نیز میتوان به کار برد. در حقیقت، اتمهای اکسیژن در محاسبات درجه غیراشباع شرکت نمیکنند زیرا میتوان بدون تغییر در تعداد پیوندهای هیدروژن، آنها را از مولکول حذف کرد. به طور مثال، زمانی که به طور ذهنی، اتم اکسیژن را از دیمتیل اتر حذف کنیم، یک پیوند کربن-کربن ایجاد خواهند شد که نمایانگر مولکول اتان خواهد بود و هیچ تغییری هم در تعداد اتمهای هیدروژن بوجود نمیآید. به طور مشابه، میتوانیم با حذف اتم اکسیژن در اتانول، به مولکول اتان برسیم. در نتیجه، دیمتیل اتر و اتانول، هر دو دارای عدد غیراشباع مساوی هستند.

رابطه کلی برای محاسبه عدد غیر اشباع
برای محاسبه درجه یا عدد غیر اشباع میتوان از رابطه کلی زیر نیز کمک گرفت. در این رابطه، عنصر هیدروژن هم در نظر گرفته شده است.
در رابطه بالا، تعداد هالوژن و تعداد نیتروژن است.
مثال
مولکولی آلی شامل 15 اتم کربن است. این مولکول ۲ حلقه و ۲ پیوند دوگانه دارد. فرمول مولکولی این ترکیب را بدست آورید.
اگر 15 اتم کربن داشته باشیم، تعداد اتمهای هیدروژن برای یک ترکیب اشباع، برابر با 32 خواهد بود. هر حلقه و هر پیوند دوگانه، تعداد دو اتم هیدروژن را از ترکیب کم میکند. بنابراین تعداد اتمهای هیدروژن برابر با 24 خواهد بود. فرمول مولکولی نیز است.
نامگذاری آلکن ها
همچون آلکانها، گروههای مختلفی نیز از آلکن ها مشتق میشوند. سه نوع از معمولترین این گروهها با نامهای «وینیل» (Vinyl)، «آلیل» (Allyl) و ایزوپروپنیل است.

قوانین آیوپاک در نامگذاری آلکنها
قوانین آیوپاک برای نامگذاری آلکن ها شبیه به قوانین آن برای آلکانها است با این تفاوت که محل پیوند دوگانه و آرایش فضایی گروههای جانشین (استخلافی) اطراف پیوند دوگانه هم باید مشخص شوند. قوانین نامگذاری آلکن ها به شرح زیر است:
قانون اول: طولانیترین زنجیر کربنی شامل پیوند دوگانه را پیدا کنید. این زنجیر کربنی، نقش آلکن والد را دارد. به طور مثال، در تصویر زیر، زنجیر اصلی شامل ۸ اتم کربن و بنابراین یک اوکتن است.
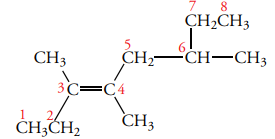
قانون دوم: شمارهگذاری از سمتی آغاز میشود که به پیوند دوگانه نزدیکتر باشد.

قانون سوم: با توجه به شمارهگذاری قبل، محل و نام سایر گروههای آلکیل جانشین را تعیین میکنیم. شمارهها به صورت پیشوند آلکن والد آورده میشوند. به طور مثال، نام مولکول زیر، ۲و۳ دیمتیل - ۲ پنتن است.

قانون چهارم: اگر آلکن مورد نظر به صورت ایزومر E یا Z وجود داشت، نوع ایزومر را در پرانتز و به همراه خط تیره در ابتدای نام آلکن قرار میدهیم. نام مولکول زیر، (E)-3-متیل-3-هگزن است.
قانون پنجم: اگر بیش از یک پیوند دوگانه در آلکن وجود داشت، تمامی این پیوندها به همراه شماره آنها باید در نام مولکول آورده و هرکدام از این شمارهها نیز به کمک حرف «و» یا «,» انگلیسی باید از یکدیگر جدا شوند.
مثال:
: ۲و۴-اکتادین
: ۱و۵-دکادین
قانون ششم: آلکنهای حلقوی را با شمارهگذاری حلقه مشخص میکنیم. شمارهگذاری باید از سمتی آغاز شود که کمترین عدد به گروه استخلافی برسد.
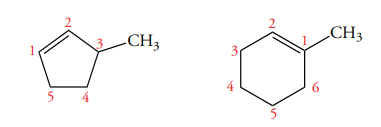
قانون هفتم: ترکیباتی که در آنها، پیوند دوگانه کربن-کربن بین حلقه کربنی و گروه جانشین قرار گرفته باشد، با عبارت «-ایلیدن» (-ylidene) نامگذاری میشوند. البته، در نامگذاری شامل گروه ، به جای استفاده از متیلیدن از متیلن استفاده میکنیم.

خواص فیزیکی آلکن ها
در ادامه، خواص مختلفی از آلکن ها از جمله چگالی، قطبیت و نقطه جوش آلکان ها را مورد بررسی قرار خواهیم داد.
چگالی آلکن ها
خواص فیزیکی سریهای همولوگ در آلکن ها همانند آلکانها است. چگالی آلکنها در بازه قرار دارد. این مواد به صورت ناقطبی یا با قطبیت بسیار کم دیده میشوند. به همین دلیل، آلکنها در آب نامحلول هستند اما در حلالهای آلی همچون هگزان، انحلالپذیری خوبی دارند.
نقطه جوش آلکن ها
آلکنهایی که کمتر از 5 اتم کربن داشته باشند، در دمای اتاق به شکل گاز قرار دارند. همانند آلکانها، نقطه جوش آلکن ها با افزایش تعداد اتمهای کربن و با توجه به افزایش نیروهای لاندن، افزایش مییابد. علاوه بر این، آلکنهای شاخهدار، نسبت به آلکنهای راستزنجیر، نقطه جوش پایینتری دارند. آلکنهای شاخهدار ساختار فشردهتری دارند و به همین دلیل، نیروهای بین مولکولی کمتری از جمله نیروهای لاندن را تجربه میکنند.
نقطه جوش در ایزومرها
با توجه به اینکه ایزومرهای هندسی، قطبیتهای متفاوتی دارند، نقطه جوش آنها نیز با یکدیگر متفاوت است. به طور مثال، ایزومرهای سیس و ترانس 1و2- دیکلرو اتان به ترتیب دارای نقطه جوش 60 و 47 درجه سانتیگراد هستند. گشتاورهای دو پیوند در ایزومر ترانس، یکدیگر را خنثی میکنند به همین دلیل، این ایزومر، هیچ گشتاور دوقطبی خالصی ندارد. در مقابل، ایزومر سیس دارای گشتاور دوقطبی است چراکه گشتاورهای دو پیوند ، یکدیگر را تقویت میکنند. بنابراین، ایزومر سیس به صورت قطبی است و نقطه جوش بالاتری دارد.

پایداری آلکن ها
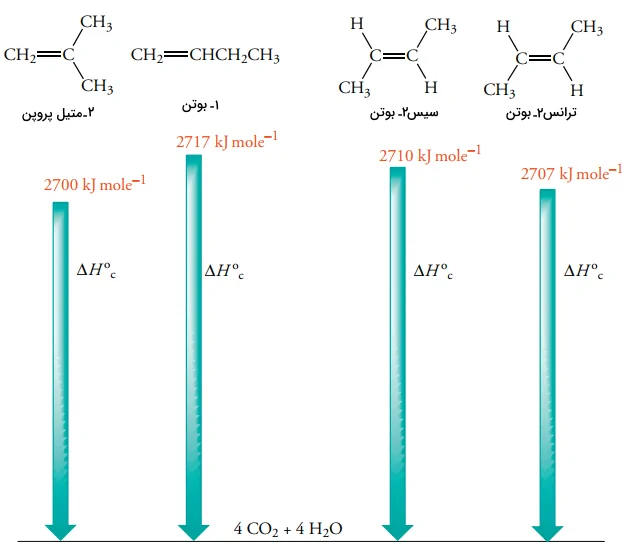
واکنشهای سوختن در آلکنها به لحاظ اقتصادی، واکنشهای سودمندی نیستند. اما میتوانیم به کمک گرمای سوختن، پایداری آلکنهای ایزومری و سیکلو آلکنها را آنالیز کنیم چراکه این مواد در اثر سوختن، هرکدام تعداد مول برابر از و تولید میکنند. تصویر زیر، مقایسهای بین گرمای سوختن آلکنها با فرمول را نشان میدهد. توجه داشته باشید که هرقدر یک ترکیب، پایدارتر باشد، گرمای کمتری در اثر سوختن تولید میکند.
همانطور که پیشتر نیز بیان شد، آلکانهای شاخهدار، پایدارتر از ایزومرهای راستزنجیر خود هستند. به طور مثال، ۲-متیل پروپان، پایدارتر از بوتان است. البته، ویژگی اساسی که سبب میشود یک آلکن، پایداری بیشتری از ایزومر خود داشته باشد، به درجه استخلاف آن مربوط میشود. به طور مثال، ۱-بوتن که آلکنی تکاستخلافی به شمار میآید، پایداری کمتری نسبت به آلکنهای دو استخلافی سیس و ترانس ۲-بوتن دارد. اتم کربن هیبرید شده، موجب توزیع چگالی الکترونی به سمت اتم کربن هیبرید شده در آلکن میشود. همین تاثیر، دلیل پایداری پیوند دوگانه است. دو گروه آلکیل در ایزومرهای سیس و ترانس ۲-بوتن، چگالی الکترونی بیشتری را از طریق دو پیوند نسبت به یک گروه آلکیل در ۱-بوتن به پیوند دوگانه توزیع میکنند. البته، ۲-متیل پروپن نیز به صورت دو استخلافی است اما شاخهدار بودن آن، پایداری بیشتری را نسبت به ایزومرهای سیس و ترانس ۲-بوتن بدست میدهد.
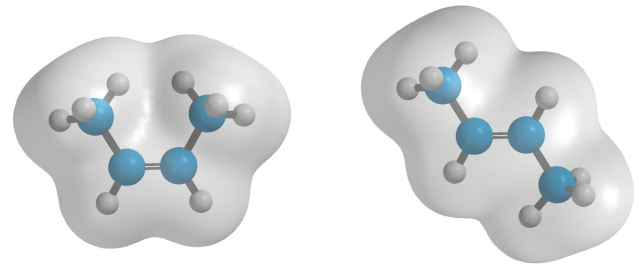
اما این سوال پیش میآید که چه چیز موجب تفاوت پایداری در ایزومرهای سیس و ترانس ۲-بوتن شده است. زمانی که پایداری بسیاری از آلکنهای آسیلیک (غیرحلقوی) را بررسی میکنیم، متوجه میشویم که آلکنهای ترانس، پایداری بیشتری نسبت به نوع سیس دارند. این اختلاف انرژی به دلیل اثری موسوم به «اثر فضایی» (Steric Effect) است. در یک آلکن سیس، دو گروه آلکیل به اندازهای به یکدیگر نزدیک هستند که دافعه واندروالس ایجاد شود. هرقدر اندازه گروههای آلکیل بزرگتر شود، تفاوت پایداری ایزومرهای سیس و ترانس نیز بیشتر خواهد شد.
واکنشها در آلکن
آلکنها ترکیبات به نسبت پایداری هستند اما واکنشپذیری آنها از آلکانها بیشتر است. بیشتر واکنشها در آلکن ها شامل واکنشهای افزایشی به پیوند پای و تشکیل پیوند یگانه میشوند. آلکن ها بیشتر به عنوان ماده خام در صنایع پتروشیمی مورد استفاده قرار میگیرند چراکه میتوانند در بسیاری از واکنشها بویژه در واکنشهای پلیمریزاسیون و «آلکیلاسیون» (Alkylation) شرکت کنند.
واکنشهای افزایشی
همانطور که گفته شد، آلکن ها در بسیاری از واکنشهای افزایشی شرکت میکنند. بیشتر این واکنشها شامل مکانسیمهای افزایشی الکتروندوست هستند که در ادامه، برخی از واکنشها را مورد بررسی قرار میدهیم.
هیدروژناسیون
هیدروژناسیون (هیدروژنه کردن) آلکن ها موجب تولید آلکانهای متناظر با آنها میشود. این واکنشها تحت فشار و همچنین دمای 200 درجه سانتیگراد و در حضور کاتالیزورهای فلزی انجام میشوند. پایه برخی از کاتالیزورهای صنعتی، عنصرهای پلاتین، روی یا پالادیم هستند. در سنتزهای آزمایشگاهی از آلیاژ نیکل و آلومینیوم موسوم به نیکل اسفنجی یا «رینی نیکل» (Raney Nickel) استفاده میشود. سادهترین مثال این واکنش، هیدروژناسیون اتیلن برای تولید اتان است:
آب دهی
این نوع از واکنشها که به واکنشهای آبدهی، آبپوشی و «هیدراسیون» (Hydration) شناخته میشوند، شامل افزایش آب به پیوند دوگانه آلکن ها هستند. این امر سبب تولید الکلها خواهد شد. برای افزایش سرعت واکنش در چنین فرآیندهایی، میتوان از اسیدهای همچون سولفوریک اسید، به عنوان کاتالیزگر کمک گرفت. واکنش زیر جهت تولید صنعتی اتانول مورد استفاده قرار میگیرد:
هالوژناسیون
فرآیند هالوژندهی یا هالوژناسیون شامل افزایش هالیدهای هیدروژن همچون یا برای تولید هالوآلکانها است. نمونهای از این واکنش را در زیر مشاهده میکنید:
اگر دو اتم کربن در پیوند دوگانه، به تعداد متفاوتی اتم هیدروژن متصل شده باشند، هالوژن به اتم کربن با تعداد کمتر هیدروژن جذب خواهد شد. این الگو موسوم به «قانون مارکونیکوف» (Markovnikov's rule) است.
تشکیل هالوهیدرین
آلکنها در واکنش با آب و هالوژنها، در یک واکنش افزایشی، تشکیل هالوهیدرین میدهند که مثالی از این واکنش را در زیر مشاهده میکنید:
اکسیداسیون
اکسید کردن آلکنها به کمک بسیاری از عوامل اکسنده امکانپذیر است. در حضور اکسیژن، این مواد با تولید شعله، دیاکسید کربن و آب، واکنش خود را تکمیل میکنند. اکسیداسیون کاتالیستی با اکسیژن یا واکنش با پروکسی اسیدها سبب تولید اپوکسیدها میشود. واکنش با اوزون در فرآیند اوزونکافت، موجب شکست پیوند دوگانه و تولید دو آلدهید یا کتون خواهد شد. همچنین، واکنش با در محیطی اسیدی و گرم، تولید کتونها یا کربوکسیلیک اسیدها را به همراه دارد.
پلیمریزاسیون
پلیمریزاسیون آلکنها واکنشی است که در طی آن، پلیمرهایی با ارزش اقتصادی و صنعتی بالا به تولید میرسند. از نمونه این پلیمرها میتوان به پلیاتیلن و پلیپروپیلن اشاره کرد. پلیمرهای حاصل از مونومرهای آلکن را با نام «پلی اولفین» (Polyolefins) یا پلی آلکن میشناسند. فرآیند پلیمریزاسیون آلکنها میتواند به کمک یک رادیکال آزاد یا یک مکانیسم یونی انجام شود که در اینصورت، پیوند دوگانه به یک پیوند یگانه تبدیل خواهد شد تا سایر مونومرها به یکدیگر اتصال پیدا کنند.
تشکیل کمپلکس فلزی
آلکن ها نقش لیگاند را در کمپلکس فلزات واسطه دارند. دو کربن مرکزی از طریق اوربیتالهای و ، به فلزات متصل میشوند. از مونو اولفینها و دی اولفینها به طور معمول به عنوان لیگاند در کمپلکسهای پایدار استفاده میشود. حتی در مواقعی، اتیلن به عنوان لیگاند مورد استفاده قرار میگیرد. علاوه بر این، کمپلکسهای فلز-آلکن، به صورت مواد واسط در بسیاری از واکنشهای کاتالیز شده با فلز همچون هیدروژناسیون، پلیمریزاسیون و هیدروفرمیلاسیون حضور دارند.
سنتز آلکان ها
در ادامه به بیان برخی از روشهای مختلف در سنتز آلکن ها خواهیم پرداخت.
روشهای صنعتی
آلکن ها از طریق روش کراکینگ هیدروکربنها تولید میشوند. مواد خامی که در این خصوص استفاده میشوند شامل میعانات گازی هستند. آلکانها در دماهای بالا و در حضور کاتالیزور زئولیت، مخلوطی شامل آلکنهای آلیفاتیک و آلکانهایی با جرم مولی سبکتر تولید میکنند. این مخلوط تولیدی به کمک تقطیر جز به جز جداسازی میشود. این روش به طور معمول در تولید آلکنهای سبک (تا 6 اتم کربن) کاربرد دارد.

واکنشهای حذفی
یکی از روشهای اساسی در سنتز آلکنها در آزمایشگاه، استفاده از فرآیندهای حذفی در آلکیل هالیدها، الکلها و ترکیبات مشابه است. نمونهای از این واکنشها را در تصویر زیر مشاهده میکنید:

همچنین، به کمک آبگیری از الکلها میتوان آلکنها را سنتز کرد. به طور مثال، آبگیری اتانول، موجب تولید اتن خواهد شد.
سنتز از طریق ترکیبات کربونیل
روش مهم دیگری که برای سنتز آلکنها مورد استفاده قرار میگیرد شامل ایجاد یک پیوند دوگانه کربن-کربن جدید بوسیله جفت کردن یک ترکیب کربونیل همچون آلدهید یا کتون است.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرم افزارهای مهندسی شیمی
- آموزش شیمی آلی ۳
- حجم مولی — به زبان ساده
- اصل لوشاتلیه — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^













سلام چرا خصلت اسیدی الکن ها از الکان ها بیشتر هست؟؟؟
اقا دستتون طلا ما انقد مک موری خوندیم و نفهمیدیم که دیگه داشتیم به خودمون شک می کردیم
خدا قوت
سلام خوب هستید یک سوال از خدمتتون داشتم من برای مبحث آلکن ها و یک روش ازمایشگاهی برای سنتز سیکلو پنتن مطلب لازم دارم شما فکر میکنید مطالب شما مناسب من هست؟؟؟؟؟
ممنون از مطالبتون.
ببخشید از اکسایش سیکلو پنتن با اوزون چی بدست میاد؟
با سلام؛
به طور کلی، آلکنها در فرآیند اوزونکافت به آلدهید، الکل، کتون و کربوکسیلیک اسیدها تبدیل میشوند که این موضوع به طور کامل در مطلب «اوزون — از صفر تا صد» توضح داده شده است. سیکلوپنتن نیز مانند سایر آلکنها با اوزون واکنش میدهد و اوزون به پیوند دوگانه کربن-کربن اضافه میشود. این فرآورده حتی در دماهای پایین ناپایدار است. اوزونکافت سیکلوپنتن به طور معمول گلوتارآلدهید بدست میدهد.
با تشکر از همراهی شما با مجله فرادرس
سلام چرا قبل از نام زنجیر اصلی شماره ی پیوند دوگانه رو میذاریم (مثل ۲و۳-دی متیل-۲-پنتن) ولی برای ۲-متیل پروپن اینکار رو نکرده؟
ممنون میشم جواب بدید
با سلام؛
از توجه شما بسیار سپاسگزاریم. نام آیوپاک برای ۲-متیل پروپن را باید به صورت ۲-متیلپروپ-۱-ان نوشت که هم در منابع فارسی و هم در منابع انگلیسی به دلیل شکل سادهتر نوشتاری و تلفظ آسانتر، از ۲-متیل پروپن یا ایزوبوتن استفاده میکنند.
با تشکر از همراهی شما با مجله فرادرس
تو بخش قانون ششم
سیکلو هگزن نباید باشه.
با سلام؛
از توجه شما بسیار سپاسگزاریم. موارد گفته شده بازبینی و اصلاح شدند.
با تشکر
: اکتا-۲و۴-دین
فک کنم جابجا نوشتید
ممنون از سایت عالیتون
ممنون از سایت خوبتون
مطالب بسیار شیرین و کامل بیان شده
سپاس