pH چیست؟ – به زبان ساده
در متون و بسیاری از مطالعات شیمی، از واژه pH برای بیان خاصیت اسیدی یا بازی بودن یک محلول آبی یا سایر محلولهای مایع استفاده میکنند. همچنین، استفاده از این واژه به طور گسترده در بیولوژی و کشاورزی نیز کاربرد دارد. به عبارت دیگر، pH یک محلول، میزان غلظت یون هیدروژن محلول در آن است که توسط مقیاسی تحت این عنوان بیان میشود. در این مطلب یاد میگیریم که pH چیست و نحوه محاسبه آن را با مثالهای مختلف بیان میکنیم.


pH چیست؟
واژه pH به معنای «پتانسیل یون هیدروژن» (Potential of Hydrogen Ion) است. این مفهوم در سال ۱۹۰۹ توسط بیوشیمیست دانمارکی، «سورن سورنسن» (Soren Sorensen) ارائه شد. او بیان کرد که pH در حقیقت، لگاریتم منفی غلظت یونهای هیدروژن است. اگر این تعریف را برای غلظت یون هیدرونیوم بنویسیم خواهیم داشت:
همچنین به طور مشابه میتوان عبارت pOH را تعریف کرد که رابطه آن به صورت زیر خواهد بود. این معادله از غلظت یون هیدروکسید به جای غلظت هیدرونیوم استفاده میکند.

مرتبط کردن pH و pOH
میتوان از معادلهای برای مرتبط کردن غلظتهای یونهای هیدرونیوم و هیدروکسید استفاده کرد. این واکنش از معادله تعادلی یونیزه شدن خود به خودی آب مشتق میشود. این معادله، هر سه رابطه pH، pOH و را به یکدیگر مرتبط میکند. اگر از معادله یونیزه شده خود به خودی آب، لگاریتم منفی بگیریم، میتوان به معادله مورد نظر دست پیدا کرد:
حال به کمک استفاده از خواص لگاریتم به معادله زیر خواهیم رسید:
همانطور که اشاره شد، مقیاس pH به صورت لگاریتمی بیان میشود. این بدان معنی است که افزایش یا کاهش هر عدد صحیح از این مقیاس برابر با تغییرات ده برابری غلظت است. به طور مثال، اگر محلولی برابر با ۳ باشد، این محلول ده برابر اسیدیتر از محلولی با برابر با 4 خواهد بود.
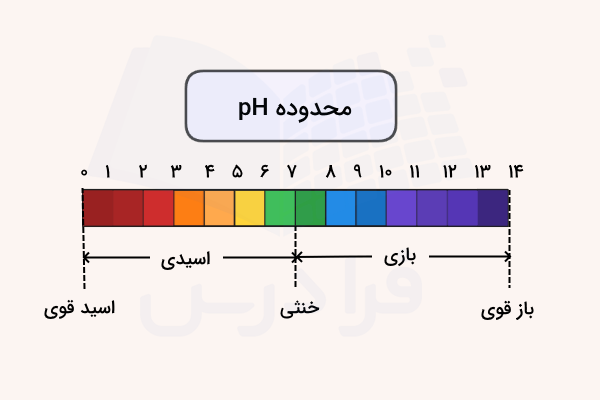
اسید و بازهای قوی
در یک محلول آبی از اسید و باز قوی، میزان یونیزه شدن (تفکیک یونی) آب بسیار کم است و در نتیجه تفکیک یونی آب، غلظتهای کمی از یونهای هیدرونیوم و هیدروکسید بدست میدهد. به هنگام محاسبات غلظتهای یون هیدرونیوم در محلول آبی یک اسید قوی، باید این نکته را در نظر بگیریم که این اسید، منبع اصلی یون هیدرونیوم است.
به طور مشابه برای باز هم میتوان ذکر کرد که یک محلول آبی باز قوی، منبع اصلی یون هیدروکسید خواهد بود. از این خاصیت تا زمانی میتوان استفاده کرد که اسید و بازهای قوی به صورت رقیق حضور نداشته باشند.

اسید و بازهای ضعیف
اسیدهای ضعیف به صورت جزئی در محلولهای آبی تفکیک میشوند و به حالت تعادل میرسند. در نتیجه میزان تفکیک این اسیدها را میتوانیم با ثابت تعادل بیان کرد:
در رابطه بالا:
- : غلظت یون هیدرونیوم
- : غلظت باز مزدوج
- : غلظت اسید ضعیف
به طور مشابه، بازهای ضعیف نیز با تفکیک جزئی در محلولهای آبی به حالت تعادل دست پیدا میکنند. در نتیجه معادله ثابت تعادل به صورت زیر خواهد بود:
که در رابطه بالا:
- : غلظت یون هیدروکسید
- : غلظت اسید مزدوج
- : غلظت باز ضعیف
مثال
محلولی با غلظت ۰٫۰۵۵ مولار از داریم. pH محلول را حساب کنید؟
با توجه به این که یک اسید قوی است، برای محاسبه خواهیم داشت:
برای اسیدها و بازهای ضعیف نیز از روابط اسیدها و بازهای ضعیف استفاده کنید.
دامنه موثر مقیاس pH
به طور معمول، مقیاس pH را از ۰ - ۱۴ یا از ۱ - ۱۴ ذکر میکنند که هیچکدام صحیح نیست. دامنه pH محدود به هیچ مرزی نمیشود زیرا با توجه به تعاریفی که انجام شد، این مقیاس تنها بیان کننده غلظت است. به طور مثال، در ، غلظت یون هیدرونیوم برابر یک مولار و در ، غلظت یون هیدروکسید برابر یک مولار خواهد بود.
به طور معمول غلظت یون هیدرونیوم در آب، مقادیری بین و اختیار میکند. به همین دلیل است که مقادیر pH در این بازه قرار میگیرند اما از آنجایی که غلظت این یونها میتوانند از یک مولار نیز بیشتر باشند، در نتیجه ممکن است مقادیری خارج از بازه ۰ - ۱۴ را در این خصوص داشته باشیم. بنابراین، مقیاس pH دارای حد بالا یا پایین نیست.

- اگر ، محلول بازی خواهیم داشت. در نتیجه، غلظت یون هیدروکسید بیشتر از یون هیدرونیوم خواهد بود.
- در ، ماده یا محلول مورد نظر خنثی است به این معنی که غلظت یونهای هیدروکسید و هیدرونیوم با یکدیگر برابراند.
- اگر ، محلول اسیدی خواهد بود یعنی غلظت یون هیدرونیوم بیش از یون هیدروکسید خواهد بود.
بیان دقیقتر pH
در سال 1909، سورنسن مقالهای را در خصوص اثرات یونهای بر فعالیت آنزیمها به چاپ رساند. در این مقاله بود که او عبارت pH را معرفی و رابطه آن را بیان کرد. در سال 1924، سورنسن متوجه شد که pH یک محلول، تابعی از «فعالیت» (Activity) یا اکتیویته یون است و با غلظت ارتباطی ندارد.
در نتیجه، او مقاله دومی را به چاپ رساند که تعریفی جدیدتر ارائه میداد. بر اساس این تعریف، pH یک محلول از رابطه زیر بدست میآید:
در این رابطه، بر فعالیت (غلظت موثر) یون هیدرونیوم تاکید دارد. فعالیت (اکتیویته) یک یون، تابعی از متغیرهای بسیاری است که غلظت، یکی از آنها به شمار میآید. در حقیقت، کتابهایی شیمی از تعریفی استفاده میکنند که در حدود ۵۰ سال پیش منسوخ شده است.
به دلیل دشواری اندازهگیری دقیق فعالیت در بیشتر محلولها، اتحادیه بینالمللی شیمی محض و کاربردی (آیوپاک) و موسسه بینالمللی استانداردسازی (NBS)، میزان pH را به صورت مقدار خوانده شده در pHسنج تعریف میکنند که در برابر محلولهای بافر، استانداردسازی شدهاند. در نتیجه، از رابطه زیر برای محاسبه pH محلولها استفاده میشود:
در رابطه بالا:
- : ثابت گازهای ایدهآل
- : ثابت فارادی
- : دمای مطلق (بر حسب کلوین)
- : پتانسیل استاندارد الکترود
- : پتانسیل الکترود که از رابطه نرنست بدست میآید.
تعریف قدیمی pH برای محلولهای خیلی رقیق و خالصی کاربرد دارد که در آن یونهای تنها تحت تاثیر مولکولهای حلال قرار گرفتهاند. به هنگام اندازهگیری pH، برابر تعداد مول در هر لیتر محلول است. این تعریف در خصوص محلولهای رقیق صدق میکند. در غلظتهای بسیار بالا، همچون محلول ۱۰ مولار از هیدروکلریک اسید، بخش قابل توجهی از یونها به صورت جفتهای خنثی حضور خواهند داشت. در نتیجه این امر، تعداد یونهای در دسترس، موسوم به «غلظت موثر» (Effective Concentration) کاهش مییابند. در حقیقت، غلظتهای موثر یونهای هیدروکسید و هیدرونیوم، میزان pH و pOH را تعیین میکنند.

برای محلولهایی که غلظت یونها در آن کمتر از ۰٫۱ مولار باشد، رابطه قدیمی pH در آنها صدق میکند و میتوان از آن برای بیان pH استفاده کرد که تقریبی از رابطه اصلی خواهد بود. رابطه اصلی بر مبانی فعالیت ذکر میشود. در نتیجه برای محلولهای رقیق خواهیم داشت:
فعالیت یک یون معیاری برای اندازه گیری غلظت موثر آن است که معمولا به غلظت محلول و یک ضریب با نام «ضریب فعالیت» مرتبط میشود:
محاسبه ضریب اکتیویته نیازمند فهم دانشی در خصوص برهمکنش ذرات باردار در محلولهای غلیظ است که در «نظریه دبای-هوکل» (Debye-Hückel Theory) به آن پرداخته شده است. در بیشتر محلولها میزان pH اندازهگیری شده به روش آزمایشگاهی تفاوت کمی با رابطه دارد اما هر اندازه که غلظت محلول بیشتر شود، این اختلاف نیز بیشتر خواهد شد. جدول زیر، مقایسهای بین غلظت آزمایشگاهی و غلظت اندازهگیری شده با فرمول را در دمای ۲۵ درجه سانتیگراد نشان میدهد.
| غلظت HCl (مولار) | pH اندازهگیری شده با رابطه | pH اندازهگیری شده با روش آزمایشگاهی | انحراف نسبی |
| 0/00050 | 3/30 | 3/31 | 0/3٪ |
| 0/0100 | 2 | 2/04 | 1/9٪ |
| 0/1 | 1 | 1/10 | 9٪ |
| 0/4 | 0/39 | 0/52 | 25٪ |
| 7/6 | 0/88- | 1/85- | 52٪ |
یونیزه شدن خود به خودی آب (خود یونش آب)
آب به دلیل اینکه هم به عنوان باز و هم به عنوان اسید عمل میکند، همواره به صورت مولکولهای وجود ندارد. در حقیقت دو مولکول آب در واکنش با یکدیگر، یونهای هیدرونیوم و هیدروکسید تولید میکنند:
به این پدیده، یونیزه شدن خود به خودی (خودیونش) آب میگویند. غلظت «یون هیدرونیوم» و «یون هیدروکسید» در آب خالص با یکدیگر برابرند چراکه نسبتهای استوکیومتری آنها با هم برابر است. مولاریته یونهای هیدرونیوم و هیدروکسید نیز در دمای ۲۵ درجه سانتیگراد، هر دو مقداری برابر با دارند. در نتیجه میتوان یک ثابت تعادل برای یونیزه شدن آب در نظر گرفت. این ثابت تعادل از رابطه زیر بدست میآید:
مقدار عددی بالا با دما متغیر خواهد بود و در نتیجه محاسبات را برای دمای اتاق در نظر گرفتهاند. البته این نکته را هم به یاد داشته باشید که در واکنشهای شیمی و متون علمی، از عبارات و به جای یکدیگر برای مشخص کردن یون هیدرونیوم استفاده میکنند. در نتیجه معادله واکنش تعادلی آب به شکل زیر خواهد بود:
اگر اسید یا به آب اضافه کنیم، این واکنش تعادلی به سمت چپ میل میکند و غلظت یون در آن کاهش پیدا میکند.
اگر یک باز یا به آب اضافه شود نیز واکنش به سمت چپ میل میکند اما اینبار غلظت یون هیدرونیوم کاهش مییابد که این دو پدیده را با اصل لوشاتلیه نیز میتوان توجیح کرد.

وابستگی pH به دما در محلولها
pH «محلولهای بافر» (Buffer Solution) را میتوان با «تقریب هندرسون–هاسلباخ» (Henderson-Hasselbalch Approximation) و از رابطه زیر محاسبه کنیم:
در رابطه بالا، ، ثابت تعادل برای واکنش تفکیک اسید است:
برای محاسبه ثابت تعادل و همچنین «ثابت تفکیک اسید» خواهیم داشت:
میدانیم ثابت تعادل، تابعی از دما است چراکه با انرژی آزاد گیبس توسط رابطه زیر مرتبط میشود. در این رابطه از تبدیل به استفاده کردهایم:
در نتیجه خواهیم داشت:
علاوه بر این، را میتوان از رابطه زیر محاسبه کرد که در این رابطه ، آنتالپی و آنتروپی است:
با ترکیب این معادلات، به رابطهای برای ثابت تفکیک اسید خواهیم رسید:
در رابطه بالا اگر واکنش گرماگیر باشد یعنی ، هرقدر دما بالاتر رود، ثابت کوچکتر خواهد شد و در نتیجه افزایش پیدا خواهد کرد. این بدان معنی است که این واکنش در جهت تفکیک بیشتر پیشخواهد رفت و موجب افزایش و کاهش pH خواهد شد. اگر واکنش گرماده باشد و ، عکس این حالت اتفاق میافتد.
نکات و مثالهای کاربردی
پی اچ خنثی دقیقا برابر با ۷ نیست اما تقریب مناسبی برای این حالت است. حالت خنثی، به شرایطی میگویند که در آن، غلظت یون هیدروکسید و هیدرونیوم برابر باشند:
در بالا اشاره شد که رابطه یونش خودبهخودی آب به صورت زیر است:
با در نظر گرفتن این دو رابطه خواهیم داشت:
یا
مقدار عبارت بالا به طور تقریبی برابر با ۱۴ است که به قدرت یونی و دما بستگی دارد. آب خالص و محلول در آب خالص، هردو خنثی هستند زیرا تفکیک آب (یونش خودبهخودی آب) تعداد برابری از یونها را بدست میدهد. البته پی اچ محلول NaCl خنثی با پی اچ آب خالص کمی تفاوت دارد چراکه فعالیت هیدروژن و یونهای هیدروکسید به قدرت یونی وابسته است. بنابراین، با قدرت یونی تغییر میکند.
اگر آب خالص را در مجاورت هوا قرار دهیم، مقداری اسیدی خواهد شد. دلیل این امر آن است که آب با جذب دیاکسید کربن موجود در هوا، به آرامی به بیکربنات و یون هیدروژن تبدیل میشود. به عبارت بهتر، محصول این واکنش، کربنیک اسید است.
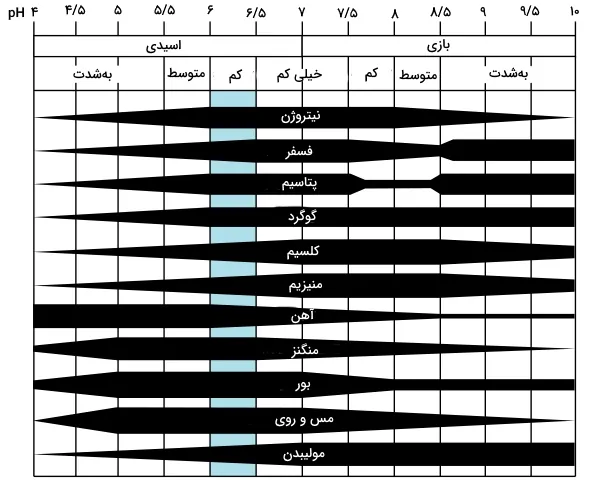
pH در خاک
دپارتمان کشاورزی خدمات حفاظت از منابع طبیعی آمریکا (United States Department of Agriculture NRCS)، میزان pH در خاک را به صورت جدول زیر طبقهبندی کرده است. همچنین در تصویر زیر مشاهده میکنید که چطور عناصر مغذی خاک، بسته به نوع تغییرات pH، تغییر میکنند.
| نام | دامنه تغییرات pH |
| فرا اسیدی | |
| به شدت اسیدی | |
| اسیدی بسیار قوی | |
| اسیدی قوی | |
| اسیدی ملایم | |
| اندکی اسیدی | |
| خنثی | |
| اندکی بازی | |
| بازی ملایم | |
| بازی قوی | |
| بازی بسیار قوی |
pH در طبیعت
گیاهانی وجود دارند که رنگ آنها وابسته به پی اچ محیط است و از این خاصیت آنها میتوان به عنوان شناساگر استفاده کرد. از جمله این گیاهان میتوان به کلم قرمز و گل ختمی اشاره کرد. آب مرکبات خاصیت اسیدی دارد چراکه حاوی سیتریک اسید است. بسیاری از کربوکسیلیک اسیدهای دیگر در موجودات زنده یافت میشوند. به طور مثال، در اثر فعالیت عضلات بدن، اسید لاکتیک به تولید میرسد. همچنین، عملکرد هموگلوبینها در خون متاثر از pH است.
آب دریا
پی اچ در آب دریا، دامنهای بین 7/5 تا 8/4 دارد. این مقیاس، نقش مهمی را در چرخه کربن ایفا میکند. اندازهگیری پی اچ آب به دلیل خواص شیمیایی آب دریا کمی پیچیده و سبب شده است تا مقادیر مختلفی را برای آن در نظر بگیرند.
مثال محاسبه pH
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید.
مثال ۱
pH محلول ۰٫۰۰۲ مولار را محاسبه کنید.
پاسخ
معادله pH را برای محاسبه مینویسیم و بر اساس آن معادله را حل میکنیم:
مثال ۲
pH محلول ۰٫۰۰۰۰۵ مولار را محاسبه کنید.
پاسخ
معادله را برای pOH مینویسیم:
شناساگرهای اسید و باز
شناساگرهای اسید و باز را به مقدار کمی به محلول مورد نظر اضافه میکنند تا خاصیت اسیدی یا بازی بودن محلول به کمک رنگ حاصل، مشخص شود. بنابراین، شناساگرهای اسید و باز نوعی معرف برای یونهای هیدرونیوم یا هیدروژن هستند. به طور معمول، شناساگرها سبب تغییر رنگ محلول بر اساس pH میشوند.
به طور معمول از شناساگرها در تیتراسیون و بیولوژی بهره میگیرند. البته برای واکنشهایی که نیاز به سنجش دقیق دارند از pHسنج استفاده میکنند. استفاده از شناساگرهای معمول، زمانی کاربرد دارد که نیاز به یک اطلاعات کلی از خاصیت اسید و باز باشد. میتوان از جدول زیر برای بررسی رنگ شناساگرها استفاده کرد.
لازم به ذکر است که شناساگرهای اسید و باز، مقدار دقیق pH را تعیین نمیکنند بلکه یه بازه برای آن مشخص میکنند. به طور مثال، فنول قرمز در پی اچ بین 6/8 تا 8/4 به رنگ نارنجی است. البته این بازه تا حدی به غلظت شناساگر و دمای محلول بستگی دارد. تغییر رنگ شناساگر در در محدودهای موسوم به «گذار» (Transition) رخ میدهد. به طور مثال، متیل قرمز بین محدوده پی اچ 2/9 تا 4 از رنگ قرمز به رنگ زرد میرسد. به بیان سادهتر، رنگ شناساگر قبل از این بازه، قرمزرنگ و بعد از این ناحیه (پی اچ برابر با 4) زردرنگ خواهد بود.
| شناساگر | رنگ در pH پایین | حد پایین گذار | حد بالای گذار | رنگ در pH بالا |
| متیل بنفش | زرد | 0 | 2 | آبی - بنفش |
| مالاشیت گرین (مالاشیت سبز) | زرد | 0 | 2 | سبز |
| مالاشیت گرین (ناحیه گذار دوم) | سبز | 11/6 | 14 | بیرنگ |
| تیمول بلو (تیمول آبی) | قرمز | 1/2 | 2/8 | زرد |
| تیمول بلو (ناحیه گذار دوم) | زرد | 8 | 9/6 | آبی |
| متیل زرد | قرمز | 2/9 | 4 | زرد |
| متیل اورانژ | قرمز | 3/1 | 4/4 | زرد |
| متیل قرمز | قرمز | 4/4 | 6/2 | زرد |
| فنول قرمز | زرد | 6/4 | 8 | قرمز |
| فنول فتالئین | نارنجی-قرمز | کمتر از 0 | 8/3 | بیرنگ |
| فنول فتالئین (ناحیه گذار دوم) | بیرنگ | 8/3 | 10 | صورتی-بنفش |
| آلیزارین زرد R | زرد | 10/2 | 12 | قرمز |
شناساگرهای طبیعی
بسیاری از گیاهان حاوی ترکیبات «آنتوسیانین» (Anthocyanin) هستند. رنگ این ترکیبات بسته به pH محیط تغییر میکند و در محلولهای اسیدی و بازی به ترتیب به رنگ قرمز و آبی تغییر رنگ میدهند. این ترکیبات را میتوان به کمک آب، از بخشهای مختلف گیاهان استخراج کرد. گیاهان حاوی آنتوسیانین عبارتند از:
- کلم قرمز
- گلبرگهای گلهای شمعدانی، شقایق و رز
- بلوبری و انگور سیاه
- ریواس
لیتموس یک معرف طبیعی pH است که از گذشته توسط شیمیدانها مورد استفاده قرار میگرفت. همچنین، رنگ گل «ادریسی» (Hydrangea Macrophylla) بر اساس خاصیت اسیدی و بازی خاک تغییر میکند. در خاکهای اسیدی، واکنشهای شیمیایی اتفاق میافتند که آلومینیوم را در دسترس گیاه قرار میدهند که سبب رنگ آبی گیاه میشوند. در خاکهای قلیایی (بازی)، چنین واکنشهایی انجام نمیشوند و در نتیجه رنگ گیاه به سبب نبود آلومینیوم، صورتیرنگ خواهد بود. در جدول زیر، تغییرات رنگی برخی از این شناساگرها آورده شده است:
| شناساگر | رنگ در pH پایین | رنگ در pH بالا |
| گل ادریسی | آبی | صورتی مایل به بنفش |
| آنتوسیانین | قرمز | آبی |
| لیتموس | قرمز | آبی |
آزمایش لیتموس
کاغذ لیتموس که آن را با نام کاغذ تورنسل نیز میشناسند، یک شناساگر طبیعی و یک نوع کاغذ pH است. این کاغذ که با مخلوط کردن ۱۰ - ۱۵ رنگ طبیعی بدست میآید و همانطور که گفته شد، در محلولهای اسیدی به رنگ قرمز و در محلولهای خنثی بنفشرنگ است. برای انجام آزمایش لیتموس کافی است تا چند قطره از محلول را روی نوار کوچکی از کاغذ لیتموس بریزیم یا اینکه کاغذ لیتموس را به داخل محلول وارد کنیم. البته راه بهتر این است که کاغذ لیتموس را داخل یک محلول شیمیایی قرار ندهیم چراکه ممکن است سبب آلودگی نمونه شود.
آزمایش لیتموس یک راه مطمئن برای تشخیص اسیدی یا بازی بودن محلولهای مختلف است. در ابتدا، کاغذ لیتموس به رنگ آبی یا قرمز دیده میشود. اگر کاغذ را در لیتموس را در محلول تغییری رنگی از خود نشان نداد، بسته به رنگ اولیه آبی یا قرمز، این نکته را بیان میکند که محلول، بازی یا اسیدی است.
محدودیتهای آزمایش لیتموس
از آزمایش لیتموس به عنوان فرآیندی ساده و سریع یاد میشود اما این آزمایش محدودیتهایی نیز دارد. در ابتدا باید خاطرنشان کرد که کاغذ لیتموس، مقادیر دقیق از pH را بدست نمیدهد. علاوه بر این، کاغذ لیتموس ممکن است به دلیل برخی واکنشها نیز تغییر رنگ دهد. به طور مثال، کاغذ لیتموس آبی در گاز کلر سفیدرنگ میشود. این تغییر رنگ به خاصیت رنگبری یونهای هیپوکلریت با فرمول است.
جایگزینهای کاغذ لیتموس
کاغذ لیتموس یک شناساگر معمول در محلولهای اسید و باز به شمار میآید. البته میتوان از شناساگرهای دیگری هم استفاده کرد که رنگهای متنوعتری در بازههای مختلف پی اچ بدست میدهند. به طور مثال، کلم قرمز در قرمزرنگ است و در pH خنثی به رنگ آبی دیده میشود. همچنین این ماده در به رنگ سبز مایل به زرد خواهد بود.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش آشنایی با کاتالیست ها (Catalysis)
- نظریه برخورد — به زبان ساده
- آلوتروپ — از صفر تا صد
^^













میخواستم در توضیح و حل این سوال راهنمایی بشم: H2O+به روی OH- مساوی با۰/۱۶ مولار است ph چقدره
با سلام ضمن تشکر از مطالب بسیار ارزشمند شما
اگر ما یک تانک ماهی با ۲۵۰۰ لیتر آب داشته باشیم و pH آن ۸/۲ باشد چقدر از یک محلولی با pH.=۴/۴ باید به این تانک اضافه کنیم تا pH آن برابر ۶/۸ شود؟
با عرض سبام خدمت شما
دست شما درد نکند همیشه موفق باشید
سلام استاد از کلم قرمز برای اسیدی کردن خاک میشه استفاده کرد ، با چه درصدی ؟ ممنون از مطالب ارزشمندتون
با سلام؛
از کلم قرمز همانطور که در متن اشاره شد میتوان به عنوان شناساگر طبیعی استفاده کرد. پیشنهاد میکنیم مطلب «شناساگر اسید و باز چیست؟ | به زبان ساده» را نیز در این رابطه مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس