کربوکسیلیک اسید – به زبان ساده
کربوکسیلیک اسید، ترکیبی در شیمی آلی و شامل گروه کربوکسیل است. فرمول کلی کربوکسیلیک اسید را به صورت نشان میدهند که در آن ، بیانگر گروه کربنی است. از نمونههای مهم کربوکسیلیک اسیدها، آمینو اسیدها و استیک اسید را میتوان نام برد. در فرآیند «از دست دادن پروتون» (Deprotonation)، کربوکسیلیک اسید سبب تشکیل آنیون کربوکسیلات میشود. در این مطلب از مجله فرادرس میآموزیم کربوکسیلیک اسید چیست، چه خواصی دارد و کاربردهای آن کدام است.
- تعریف کربوکسیلیک اسید و فرمول عمومی آن را میآموزید.
- خواص فیزیکی کربوکسیلیک اسید مثل حلالیت در آب را یاد میگیرید.
- با خاصیت اسیدی بودن کربوکسیلیک اسیدها و قدرت آنها آشنا میشوید.
- روشهای صنعتی و آزمایشگاهی سنتز کربوکسیلیک اسید را درک میکنید.
- با کاربردهای کربوکسیلیک اسیدها در زندگی روزمره و صنعت آشنا میشوید.
- واکنشها و ترکیبهای شناسایی این مواد را میآموزید.


کربوکسیلیک اسید چیست؟
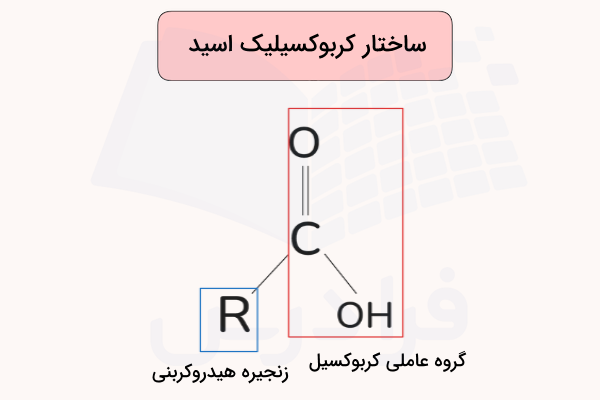
کربوکسیلیک اسیدها ترکیباتی آلی هستند که دارای گروه عاملی COOH (کربوکسیل) هستند. این گروه باعث میشود این ترکیبات خاصیت اسیدی داشته باشند و در واکنشهای شیمیایی مختلف شرکت کنند. این گروه از ترکیب یک گروه کربونیل (C=O) و یک گروه هیدروکسیل (–OH) تشکیل شده است. فرمول عمومی این ترکیبات بهصورت R–COOH است، که در آن R میتواند یک گروه آلکیل، آریل یا حتی هیدروژن باشد.
ترکیب گروه کربونیل و هیدروکسیل، ویژگی خاصی به این ترکیبات میدهد. کربوکسیلیک اسیدها در آب یونیزه شده و یون هیدروژن آزاد میکنند، که نشاندهنده خاصیت اسیدی آنهاست. این ترکیبات در واکنشهایی مانند استریفیکاسیون، آمیداسیون، هیدرولیز و اکسیداسیون شرکت میکنند. به همین دلیل از آنها در موارد بسیاری مانند داروسازی، آرایش بهداشتی و صنعت استفاده میشود.
خواص فیزیکی کربوکسیلیک اسیدها
کربوکسیلیک اسیدها ترکیباتی قطبی هستند که بواسطه داشتن «گروه عاملی کربونیل» ، پذیرنده پیوند هیدروژنی و به دلیل وجود «گروه هیدروکسیل» دهنده پیوند هیدروژنی به حساب میآیند. ترکیب گروه هیدروکسیل و کربونیل سبب تشکیل گروه عاملی کربوکسیل میشود. کربوکسیلیک اسیدها با تعداد کربن ۱ تا ۵، در آب محلولاند.
خواص فیزیکی و شیمیایی عمومی کربوکسیلیک اسیدها به شرح زیر است.
- نقطه جوش بالا
- بوی ترش
- اسید ضعیف
- شناسایی با NMR
- تشکیل دیمر
- ترکیب قطبی
هرقدر طول زنجیره کربنی افزایش پیدا کند، به علت افزایش خاصیت «آبگریزی» (Hydrophobic) زنجیر آلکیل، محلولپذیری آن در آب کاهش مییابد.
البته افزایش طول زنجیر کربنی سبب بهتر حل شدن آنها در حلالهای ناقطبی نظیر الکلها و اترها میشود. محلول آبی سدیم هیدروکسید در واکنش با کربوکسیلیک اسید - حتی با طول زنجیر کربنی بلند - نمکهای محلول در آب سدیم را تشکیل میدهد. به طور مثال، «هپتانوئیک اسید» حلالپذیری بسیار کمی در آب دارد (در حدود )، اما نمک سدیم آن به خوبی در آب حل میشود:
نقطه جوش
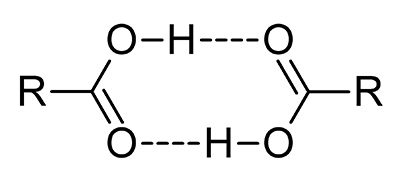
کربوکسیلیک اسیدها نسبت به آب، نقطه جوش بالاتری دارند. این امر به علت سطح بیشتر مولکولها و تمایل آنها برای تشکیل «دیمر» (Dimmer) از طریق پیوند هیدروژنی است. در حقیقت برای تبخیر شدن، باید پیوندهای دیمری شکسته شوند یا اینکه آرایش دیمری به طور کامل تبخیر شود که این امر سبب افزایش چشمگیر آنتالپی تبخیر خواهد بود.
خاصیت اسیدی کربوکسیلیک اسید
کربوکسیلیک اسیدها به این دلیل که دهنده پروتون هستند، در دستهبندی اسیدهای برونستد-لوری قرار میگیرند و بیشترین نوع از اسیدهای آلی را تشکیل میدهند. کربوکسیلیک اسیدها در طبقهبندی اسیدهای ضعیف جای میگیرند، به این معنی که به صورت جزئی در آب به یونهای و تبدیل میشوند. به طور مثال، در محلول 1 مولار استیک اسید، تنها از اسید قابل تفکیک است. ترکیبات گیرنده الکترون مانند اسیدهای قویتری بدست میدهند در حالی که ترکیبات دهنده الکترون مانند به اسیدهای ضعیف منتج میشوند.
بو
کربوکسیلیک اسیدها به طور معمول بویی ترش دارند. استرِ کربوکسیلیک اسیدها بویی خوش دارند و در عطرها از آنها بهره میگیرند.
شناسایی
این ترکیبات به خوبی توسط «اسپکتروسکوپی اشعه فروسرخ» (Infrared Spectroscopy) شناسایی میشوند. همچنین با استفاده از روش اسپکترومتری NMR، هیدروژن متصل به هیدروکسیل در دامنه قابل مشاهده است.

کاربردهای کربوکسیلیک اسید
بسیاری از این ترکیبات در مقیاسهای صنعتی به تولید میرسند. همچنین در طبیعت نیز به وفور یافت میشوند به این صورت که استرِ اسیدهای چرب از اجزای اصلی لیپیدها و همینطور پلیآمید «آمینو کربوکسیلیک اسیدها» (Aminocarboxylic Acids)، از اجزای اصلی پروتئینها هستند.
کربوکسیلیک اسیدها در تولید پلیمرها، داروسازی، حلالها و افزودنیهای غذا بکار میروند. اسیدهایی که به طور صنعتی کاربرد دارند در جدول زیر آورده شدهاند.
| نام اسید | کاربرد |
| استیک اسید | از اجزای اصلی در سرکه |
| اکرلیک و متاکرلیک اسید | ماده اولیه در تولید پلیمرها و چسبها |
| آدیپیک اسید | در تهیه پلیمرها |
| سیتریک اسید | طعمدهنده و نگهدارنده در غذاها و نوشیدنیها |
| اسیدهای چرب | تهیه گریسها و صابونها |
| مالئیک اسید | پلیمرها |
| پروپیونیک اسید | مواد نگهدارنده |
| ترفتالیک اسید | پلیمرها |
| اتیلن دی آمین تترا استیک اسید | عامل کلات کننده |
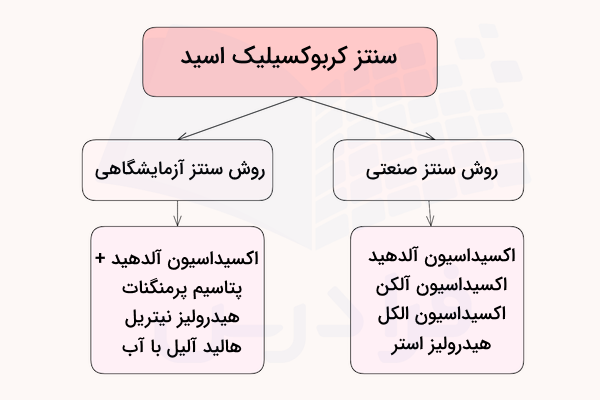
سنتز کربوکسیلیک اسید به روش صنعتی
به طور کلی روشهای تولید کربوکسیلیک اسیدها به صورت صنعتی با روشهای تولید آزمایشگاهی آنها تفاوت دارند چراکه نیازمند تجیهزات ویژهای هستند. روشهای سنتز این ترکیبات در زیر آورده شدهاند:
-
- کربونیلاسیون الکلها با استفاده از فرآیند کاتیوا (Cativa Process) در تولید استیک اسید
- اکسیداسیون آلدهیدها با هوا در حضور کاتالیزورهای کبالت و منگنز
- اکسیداسیون هیدروکربنها با استفاده از هوا: لازم به ذکر است که این روش برای آلکانهای ساده مقرون به صرفه است اما کاربرد ندارد. گروههای آلکیل در یک حلقه بنزنی، فارغ از طول زنجیر کربنی، اکسید و تبدیل به کربوکسیلیک اسید میشوند. از نمونههای این اسیدها میتوان به بنزوییک اسید اشاره کرد که از تولوئن بدست میآید.
- اکسیداسیون اتن در حضور کاتالیزور «سیلیکو تنگستیک اسید» (Silicotungstic Acid):
$$$\mathrm{C}_{2} \mathrm{H}_{4}+\mathrm{O}_{2} \rightarrow \mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}$$
- «کربونیلاسیون» (Carbonylation) به همراه اضافه کردن آب. این روش بیشتر در مورد آلکنها کاربرد دارد مانند تبدیل ایزوبوتیلن به «پیوالیک اسید» (Pivalic Acid):
البته این واکنش به یک کاتالیزور مانند «هیدروژن فلوراید» نیاز دارد.
- استفاده از روش هیدروکربوکسیلاسیون، شامل اضافه کردن همزمان آب و :
- هیدرولیز تریگلیسیریدها که از گیاهان یا روغن حیوانات بدست آمدهاند. البته این نوع از روشهای سنتز کربوکسیلیک اسیدها با زنجیر کربنی بلند، عموما در صابونسازی کاربرد دارند.
- تخمیر اتانول: از این روش برای تولید سرکه استفاده میکنند.
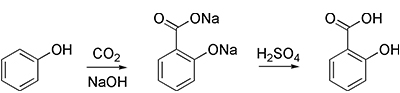
- با استفاده از «واکنش اشمیت-کلبه» (Kolbe–Schmitt Reaction)، میتوان به سالیسیلیک اسید، ماده اولیه در تولید آسپیرین دست یافت:
سنتز آزمایشگاهی کربوکسیلیک اسیدها
روشهای تهیه و تولید مواد برای واکنشها در مقیاس کوچک که به منظور تحقیق یا تولید مواد شیمیایی با کیفیت انجام میشوند، معمولا با هزینههای زیادی همراه است. روشهای سنتز آزمایشگاهی کربوکسیلیک اسید را میتوانید در زیر مشاهده کنید:
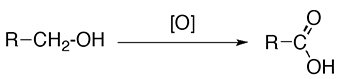
- اکسیداسیون الکلهای نوع اول یا آلدهیدها با اکسندههای قوی نظیر پتاسیم دیکرومات، «واکنشگر جونز» (Jones Reagent)، پتاسیم پر منگنات یا «پتاسیم کلریت» این واکنشگرها با نماد در تصویر زیر نشان داده شدهاند:
- هیدرولیز نیتریلها، استرها یا آمیدها با کاتالیزورهای اسیدی یا بازی
- «کربوناسیون» (Carbonation) واکنشگر گرینیارد و واکنشگر اورگانولیتیوم
- کاتالیز بازی «آریل کتونها» (Aryl Ketones)
دیگر واکنش های سنتز کربوکسیلیک اسید
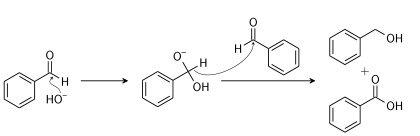
واکنشهای دیگری نیز وجود دارند که به تولید کربوکسیلیک اسید منجر میشوند اما معمولا در شرایط خاص و دانشگاهی مورد استفاده قرار میگیرند. نمونهای از آنها شامل «تسهیم نامنتاسب» (Disproportionation) یک آلدهید در «واکنش کانیزارو» (Cannizzaro Reaction) است:
واکنش های کربوکسیلیک اسید
بیشتر واکنشها شامل تبدیل کربوکسیلیک اسید به استرها، آمیدها، نمکهای کربوکسیلات، اسید کلریدها و الکلها هستند. کربوکسیلیک اسیدها در واکنش با بازها، نمکهای کربوکسیلات میدهند که در آنها هیدروژن گروه هیدروکسیل با یک کاتیون فلزی جایگزین میشود. به عنوان مثال، استیک اسید موجود در سرکه با سدیم بیکربنات (جوش شیرین) واکنش و تشکیل سدیم اَستات، کربن دیاکسید و آب میدهد:
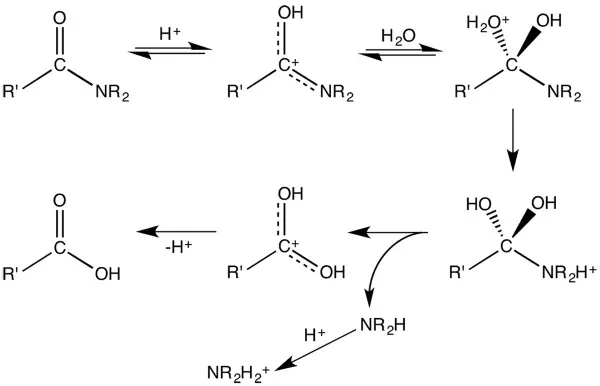
همچنین واکنش کربوکسیلیک اسیدها با الکلها، تولید استر میکند. این فرآیند به وفور در تولید پلیاسترها بکار میرود. به همین شکل، کربوکسیلیک اسیدها به آمیدها نیز تبدیل میشوند اما این تبدیل معمولا به طور مستقیم با واکنش کربوکسیلیک اسید و آمین اتفاق نمیافتد.
گروههای هیدروکسیل در کربوکسیلیک اسیدها میتوانند با اتم کلر جایگزین شوند. در این شرایط، استفاده از «تیونیل کلراید» سبب تولید «آسیل کلریدها» (Acyl Chlorides) با فرمول عمومی میشود. در طبیعت، کربوکسیلیک اسیدها به «تیواسترها» (Thioestes) تبدیل میشوند.
اکسایش و کاهش
همانند استرها، بیشتر کربوکسیلیک اسیدها در واکنشهای کاهشی به الکلها تبدیل میشوند. این واکنشها شامل هیدروژناسیون، استفاده از هیدریدها یا روشهای انتقال آلکیلی است.
رادیکال کربوکسیل
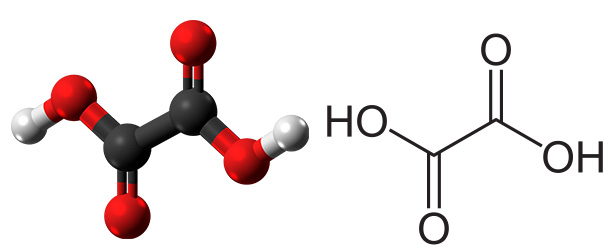
رادیکال کربوکسیل با ساختار تنها در مقادیر کمی وجود دارد. ثابت تفکیک اسید برای این رادیکال با استفاده از «اسپکتروسکوپی رزونانس پارامغناطیس الکترون» (Electron Paramagnetic Resonance Spectroscopy) اندازهگیری میشود. لازم به ذکر است گروههای کربوکسیل تمایل به دیمر شدن و تشکیل اگزالیک اسید دارند.
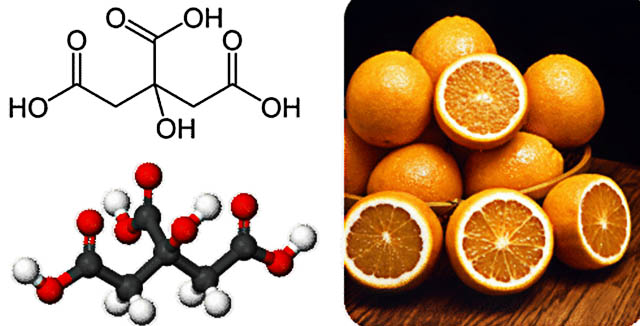
کربوکسیلیک اسید در زندگی روزمره
در زندگی روزمره، با شکلهای مختلفی از کربوکسیلیک اسیدها سر و کار داریم. جدول زیر، تعدادی از کربوکسیلیک اسیدهای بدون زنجیر به همراه کاربرد و محل حضور آنها آورده شده است:
| تعداد اتم کربن | نام عمومی | نام آیوپاک | فرمول شیمیایی | کاربرد یا محل حضور |
| 1 | کربنیک اسید | کربنیک اسید | خون و بافت | |
| 1 | فرمیک اسید | متانوئیک اسید | مورچه و نیش حشرات | |
| 2 | استیک اسید | اتانوئیک اسید | سرکه | |
| 3 | پروپیونیک اسید | پروپانوئیک اسید | مواد نگهدارنده، شیر، کره، پنیر | |
| 4 | باتریک اسید | بوتانوئیک اسید | کره | |
| 5 | والریک اسید | پنتانوئیک اسید | سنبل الطیب | |
| 6 | کاپروییک اسید | هگزانوئیک اسید | چربی حیوانی (چربی بز) | |
| 7 | انانتیک اسید | هپتانوئیک اسید | پیچک | |
| 8 | کاپریلیک اسید | اوکتانوئیک اسید | نارگیل | |
| 9 | پلارگونیک اسید | نونانوئیک اسید | گیاه پلارگونیوم (شمعدانی) |
اعضای کوچکتر کربوکسیلیک اسیدهای آلیفاتیکی معمولا بیرنگ، فرار به همراه بوی شدید هستند. سرکههای خانگی در حقیقت محلول ۵ درصد استیک اسید (اتانوییک اسید) هستند.
کربوکسیلیک اسیدهای بزرگتر، جامداتی با نقطه ذوب پایین هستند. همچنین این مواد بویی خوش دارند که همگی به صورت کریستالهایی جامد وجود دارند. بسیاری از این مواد به طور طبیعی در حیوانات و گیاهان یافت میشوند. مرکبات همچون لیمو و پرتقال شامل سیتریک اسید هستند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- تیتراسیون — به زبان ساده
^^













سلام
هپتانوئیک اسید c7h14o2 است که به اشتباه c17 نوشته اید
لطفاً اصلاح کنید
با سلام؛
متن، بازبینی و اصلاح شده است.
با تشکر از همراهی شما با مجله فرادرس
سیکلو هگزا لامین کربواکسیلات چطور تولید میشود
نتیجه واکنش آن با آب واکسیژن بطور جداگانه یا باهم چیست