درمان هپاتیت | آزمایش، تشخیص، پیشگیری و کنترل
هپاتیت یک بیماری التهابی در کبد است که عوامل مختلفی دارد. در مطلب «هپاتیت چیست؟ | تعریف، انواع، علل و علائم» مفصل به تعریف، انواع، علل و علائم این بیماری پرداختیم و در این مقاله روشهای تشخیص، پیشگیری، کنترل و درمان هپاتیت را توضیح دادهایم.

تشخیص هپاتیت چگونه انجام میشود؟
تشخیص هپاتیت براساس برخی یا همه موارد زیر انجام میشود:
- علائم و نشانههای فرد
- سابقه پزشکی
- سابقه مصرف مواد مخدر تزریقی
- فعالیت جنسی محافظت نشده
- آزمایش خون
- تصویربرداری از کبد
- نمونهبرداری از کبد
به طور کلی، برای هپاتیت ویروسی و سایر علل حاد هپاتیت، آزمایش خون و تصویر بالینی فرد برای تشخیص کافی هستند. برای سایر علل هپاتیت به ویژه علل مزمن، آزمایش خون ممکن است مفید نباشد. در این حالت، نمونهبرداری از کبد استاندارد طلایی برای تعیین تشخیص است. تجزیه و تحلیل هیستوپاتولوژیک میتواند میزان دقیق و الگوی التهاب و فیبروز را نشان دهد. با اینحال، نمونهبرداری از کبد معمولاً آزمایش تشخیصی اولیه نیست زیرا تهاجمی است و با خطر کم اما قابل توجه خونریزی همراه است که در افراد آسیب دیده کبدی و سیروز افزایش مییابد.
آزمایش خون شامل آنزیمهای کبد، سرولوژی (به عنوان مثال برای آنتیبادیها)، آزمایش اسید نوکلئیک (به عنوان مثال برای DNA/RNA ویروس هپاتیت)، شیمی خون و شمارش کامل سلولهای خونی است. الگوهای مشخص ناهنجاریهای آنزیم کبدی میتوانند به دلایل یا مراحل خاصی از هپاتیت مربوط باشند.
از جمله حساسترین و پرکاربردترین آنزیمهای کبدی، آمینوترانسفرازها شامل آسپارتات آمینوترانسفراز (AST یا SGOT) و آلانین آمینوترانسفراز (ALT یاSGPT) هستند. این آنزیمها معمولا در سلولهای کبدی و به میزان کمتری نسبت به سلولهای عضلانی وجود دارند. در آسیبهای کبدی میزان تولید و ترشح این آنزیمها در خون افزایش پیدا میکند. به طور کلی، AST و ALT در بیشتر موارد هپاتیت، بدون توجه به اینکه فرد علائمی از خود نشان میدهد یا نه، افزایش مییابند. با این حال، درجه ارتفاع (یعنی سطح صدها در مقابل هزاران)، غلبه AST در مقابل ALT و نسبت بین AST و ALT آموزنده تشخیص است.
سونوگرافی، CT و MRI میتوانند استئاتوز یا تغییرات میزان چربی بافت کبدی و ندولار بودن سطح کبد را که نشاندهنده سیروز است، شناسایی کنند. CT اسکن و به ویژه MRI میتوانند سطح بالاتری از جزئیات ساختارهایی مانند عروق و تومورهای داخل کبد را را ارائه دهند. بر خلاف استاتوز و سیروز، هیچ نوع تصویربرداری قادر به تشخیص التهاب کبد (به عنوان مثال هپاتیت) یا فیبروز کبدی نیست. نمونهبرداری از کبد تنها آزمایش تشخیصی قطعی است که میتواند التهاب و فیبروز کبد را ارزیابی کند.
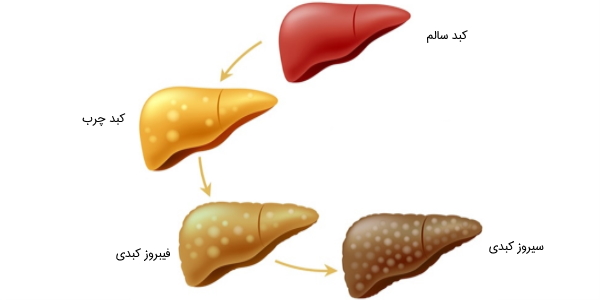
فیبروز کبد چیست؟
«فیبروز کبد» (Liver Fibrosis) یکی از انواع آسیبهای کبدی است که در آن بافت کبد دچار التهاب، زخم و اِسکار میشود و در بسیاری از موارد قابل بهبود خواهد بود. فیبروز در صورت پیشرفت و مزمن شدن باعث ایجاد «سیروز کبد» (Liver Cirrhosis) میشود که به معنای مردن بافت سلولی کبد است.
افتراق هپاتیت غیر الکلی از الکلی
بارزترین عامل تمایز بین استئوهپاتیت الکلی (ASH) و استئوهپاتیت غیر الکلی (NASH) سابقه مصرف یا سو مصرف الکل است. بنابراین در بیمارانی که الکل مصرف نمیکردهاند یا مصرف کمی داشتهاند، تشخیص هپاتیت الکلی بعید است. با این حال در کسانی که از الکل استفاده میکنند، تشخیص ممکن است هپاتیت الکلی یا غیر الکلی باشد، به خصوص اگر چاقی همزمان، دیابت و سندرم متابولیک وجود داشته باشند. در این حالت هپاتیت الکلی و غیر الکلی را میتوان با الگوی ناهنجاریهای آنزیم کبدی از یکدیگر تشخیص داد.
در استئوهپاتیت الکلی AST>ALT است با نسبت AST:ALT>2:1 در حالی که در استئاتوهپاتیت غیر الکلی ALT>AST است با نسبت ALT:AST> 1/5:1 مشاهده میشود. نکته قابل توجه اینکه، بیوپسی کبد، یافتههای یکسانی را در بیماران مبتلا به ASH و NASH و به طور خاص، وجود نفوذ پلی مورفونوکلئر، نکروز سلولهای کبدی و آپوپتوز یا مرگ سلولی به شکل تخریب، اجسام مالوری و فیبروز اطراف وریدها و سینوسها نشان میدهد.
تشخیص انواع هپاتیت ویروسی
هدف از غربالگری هپاتیت ویروسی، شناسایی افراد آلوده به این بیماری، حتی قبل از بروز علائم و افزایش ترانس آمیناز است. این امکان برای درمان زودهنگام فراهم میشود، که میتواند از پیشرفت بیماری جلوگیری کند و احتمال انتقال به دیگران را نیز کاهش دهد.
هپاتیت ویروسی در درجه اول از طریق آزمایش خون، برای تعیین سطح آنتیژنهای ویروسی (مانند سطح هپاتیت B یا آنتیژن هستهای)، آنتیبادیهای ضد ویروسی (مانند آنتیبادی سطح ضد هپاتیت B یا آنتیبادی ضد هپاتیت A) یا DNA ویروسی تشخیص داده میشود. در عفونت زودرس (یعنی در عرض 1 هفته) آنتیبادی IgM در خون یافت میشود. در عفونت دیررس و پس از بهبودی، آنتیبادیهای IgG وجود دارند و تا سالها در بدن باقی میمانند. بنابراین هنگامی که یک بیمار از نظر آنتیبادی IgG مثبت اما از نظر آنتیبادی IgM منفی است، از طریق ویروس قبلی یا بهبودی یا واکسیناسیون در مقابل ویروس مصون خواهد بود.
تشخیص هپاتیت آ
هپاتیت A باعث بیماری حادی میشود که به بیماری مزمن کبدی تبدیل نمیشود. بنابراین، نقش غربالگری ارزیابی وضعیت ایمنی در افرادی است که در معرض خطر ابتلا به ویروس هستند و همچنین در افرادی که بیماری کبدی شناخته شده دارند و برای آنها عفونت هپاتیت A میتواند منجر به نارسایی کبدی شود. افرادی در این گروهها که از قبل ایمنی ندارند میتوانند واکسن هپاتیت A دریافت کنند.
- افرادی که در معرض خطر و نیاز به غربالگری هستند عبارتند از:
- افرادی که بهداشت ضعیفی دارند.
- افرادی که به آب تمیز دسترسی ندارند.
- افرادی که از نزدیک با فرد مبتلا به هپاتیت A در تماس هستند.
- افرادی که از داروهای غیرقانونی استفاده میکنند.
- افرادی که به منطقهای با هپاتیت آندمیک A سفر میکنند.
- وجود IgG ضد هپاتیت A در خون، نشانگر عفونت قبلی با ویروس یا واکسیناسیون قبلی است.
تشخیص هپاتیت ب
سازمانهایCDC ،WHO ،USPSTF و ACOG، غربالگری روتین هپاتیت B را برای افراد در معرض خطر شامل موارد زیر، توصیه میکنند:
- در کشورهایی متولد شدهاند که شیوع هپاتیت B زیاد است (به عنوان 2 ≥ از جمعیت تعریف میشود)، حتی اگر واکسینه نشده باشند. در ایالات متحده متولد شدهاند که والدین آنها از کشورهایی هستند که شیوع هپاتیت B بسیار زیاد است (8 ≥ از جمعیت تعریف می شود) و واکسینه نشدهاند.
- HIV مثبت
- مصرفکنندگان تزریقی مواد مخدر
- مبتلا به بیماریهای خود ایمنی
- افراد تحت شیمیدرمانی
درمان سرکوب کننده سیستم ایمنی یا سیتوتوکسیک: در اثر این داروها، آنزیمهای کبدی افزایش مییابند که علت مشخصی ندارد. غربالگری شامل یک آزمایش خون است که آنتیژن سطح هپاتیت HBsAg) B) را تشخیص میدهد. اگر HBsAg وجود داشته باشد، آزمایش دوم معمولاً روی همان نمونه خون، برای بررسی وجود آنتیبادی مربوط به آنتیژن هسته هپاتیت ب (Anti-HBcAg) انجام میشود. میتواند بین عفونت حاد و مزمن تمایز قائل شود. افرادی که در معرض خطر هستند و آزمایش خون آنها برای HBsAg منفی است، میتوانند واکسن هپاتیت B را دریافت کنند.
تشخیص هپاتیت سی
سازمانهای CDC ،WHO ،USPSTF ،AASLD و ACOG غربالگری افراد در معرض خطر ابتلا به عفونت هپاتیت C را توصیه میکنند. این جمعیتها شامل افرادی میشود که:
- مصرفکنندگان مواد مخدر داخل وریدی
- مصرفکنندگان مواد مخدر داخل بینی
- افراد HIV مثبت
- سابقه همودیالیز طولانی مدت
- انجام خالکوبی
- دریافتکنندگان فرآوردههای خونی
- دریافت کنندگان پیوند عضو
در افرادی که در گروههایی که ریسک بالایی برای در معرض قرار گرفتن در معرض ویروس و ابتلا به هپاتیت را دارند، غربالگری باید دورهای و منظم انجام شود، اگرچه تحقیقات فاصله بهینه غربالگری را تعیین نکردهاند. غربالگری یک آزمایش خون است که میزان آنتیبادی ضد ویروس هپاتیت C را اندازهگیری میکند. اگر آنتیبادی ضد ویروس هپاتیت C وجود داشته باشد، آزمایش تأیید تشخیص RNA هپاتیت مزمن را نشان میدهد.
پیشگیری از هپاتیت
روشهای مراقبتی و سبک زندگی سالم و در نظر گرفتن شرایطیکه در ادامه ذکر کردهایم، راههای پیشگیری از هپاتیت هستند. علاوه بر این راههای پیشگیری عمومی، زدن واکسنهای موجود که هر چند سال یکبار نیاز به تکرار دارند برای پیشگیری نقش بسیار موثری خواهند داشت.
واکسن هپاتیت آ
CDC واکسن هپاتیت A را برای همه کودکان بالای یک سال و همچنین برای کسانی که قبلا ایمنسازی نکردهاند و در معرض خطر ابتلا به این بیماری هستند توصیه میکند. برای کودکان 12 ماه به بالا، واکسیناسیون به صورت شلیک به عضله در دو دوز با فاصله 18 ماه انجام میشود و باید قبل از 24 ماهگی شروع شود. مقدار مصرف برای بزرگسالان بسته به نوع واکسن کمی متفاوت است. اگر این واکسن فقط برای هپاتیت A باشد، بسته به تولید کننده، دو دوز با فاصله 18-18 ماه داده میشود. اگر واکسن هپاتیت A و هپاتیت B ترکیبی باشد، ممکن است تا 4 دوز لازم باشد.
واکسن هپاتیت ب
CDC واکسیناسیون معمول همه کودکان زیر 19 سال با واکسن هپاتیت B را توصیه میکند. آنها همچنین آن را برای کسانی که تمایل دارند یا در معرض خطر بالایی هستند، توصیه میکنند. اولین دوز واکسیناسیون علیه هپاتیت B، قبل از ترخیص نوزاد از بیمارستان انجام و به صورت عضلانی تزریق میشود. دو دوز بعدی نیز قبل از 18 ماهگی کودک تزریق خواهند شد.
برای نوزادانی که از مادری ناقل یا مبتلا به هپاتیت B متولد میشوند، اولین دوز واکسن و طی 12 ساعت پس از تولد، گلوبولین ایمنی هپاتیت نیز باید تجویز شود. این نوزادان باید حداقل در اولین سال زندگی به طور منظم از نظر عفونت آزمایش شوند. همچنین یک فرمول ترکیبی وجود دارد که شامل هر دو واکسن هپاتیت A و B است.
در حال حاضر هیچ واکسنی برای هپاتیت C یا E. در آمریکا در دسترس نیست. در سال 2015، گروهی در چین مقالهای در مورد تولید واکسن هپاتیت E منتشر کردند. از مارس 2016، دولت ایالات متحده در حال استخدام شرکتکنندگان برای آزمایش فاز IV واکسن هپاتیت E بود.
پیشگیری از هپاتیت آ
از آنجا که هپاتیت A در وهله اول از طریق دهان و مدفوع منتقل میشود، اصلیترین عامل پیشگیری به غیر از واکسیناسیون، رعایت بهداشت، دسترسی به آب تمیز و استفاده صحیح از فاضلاب است.
پیشگیری از هپاتیت بی و سی
از آنجا که هپاتیت B و C از طریق خون و مایعات متعدد بدن منتقل میشوند، پیشگیری با هدف غربالگری خون قبل از تزریق انجام میشود. روشهای پیشگیری از هپاتیت B و C عبارتند از:
- پرهیز از مصرف داروهای تزریقی
- سوزن بیخطر
- روشهای تیز در محیطهای مراقبتهای بهداشتی
- اقدامات جنسی ایمن
پیشگیری از هپاتیت دی
ویروس هپاتیت D مستلزم ابتلای فرد به ویروس هپاتیت B است، بنابراین اقدامات پیشگیری باید محدود کردن شیوع هپاتیت B باشد. در افرادی که به عفونت هپاتیت B مزمن مبتلا هستند و در معرض خطر فوق عفونت با ویروس هپاتیت D هستند، راهکارهای پیشگیری همان روش هپاتیت B است.
پیشگیری از هپاتیت ای
هپاتیت E در درجه اول از طریق دهان و مدفوع منتشر میشود اما ممکن است توسط خون و از مادر به جنین نیز منتقل شود. تکیهگاه اصلی در پیشگیری از هپاتیت E مشابه هپاتیت A است (رعایت بهداشت و آب تمیز).
درمان هپاتیت
درمان هپاتیت با توجه به نوع آن، حاد و مزمن بودن و شدت و فاز بیماری متفاوت است و به طور کلی موارد زیر را شامل میشود:
- فعالیت: بسیاری از افراد مبتلا به هپاتیت استراحت در رختخواب را ترجیح می دهند، اگرچه لازم نیست هنگام بهبودی تمام فعالیت های بدنی متوقف شوند.
- رژیم غذایی: رژیم غذایی با کالری بالا توصیه میشود. بسیاری از افراد دچار حالت تهوع میشوند و بعداً نمیتوانند غذا را در روز تحمل کنند، بنابراین ممکن است قسمت عمدهای از مصرف غذا به اوایل روز متمرکز شود. اگر بیماران نتوانند غذا بخورند و پس از مصرف دچار تهوع و استفراغ شوند، در مرحله حاد بیماری، ممکن است به تغذیه وریدی نیاز داشته باشند.
- داروها: افراد مبتلا به هپاتیت باید از مصرف داروهایی که توسط کبد متابولیزه میشوند خودداری کنند. گلوکوکورتیکوئیدها به عنوان گزینه درمانی برای هپاتیت حاد ویروسی توصیه نمیشوند و حتی ممکن است آسیبهایی مانند ایجاد هپاتیت مزمن ایجاد کنند.
- موارد احتیاط: اقدامات احتیاطی جهانی باید رعایت شود. به جز در موارد هپاتیت A و E که دارای بیاختیاری مدفوع هستند و در موارد هپاتیت B و C که خونریزی کنترل نشده دارند، جداسازی معمولاً لازم نیست.
درمان هپاتیت A
هپاتیت A معمولاً به حالت مزمن پیش نمیرود و بهندرت به بستری شدن در بیمارستان نیاز دارد. درمان حمایتی است و شامل اقداماتی مانند تأمین آب بدن از طریق ورید و حفظ تغذیه کافی است. به ندرت افراد مبتلا به ویروس هپاتیت A میتوانند به سرعت دچار نارسایی کبدی شوند، نارسایی کامل کبدی نامیده میشود، به ویژه افراد مسن و کسانی که قبلاً بیماری کبدی خصوصا هپاتیت C داشتند. عوامل خطر مرگ و میر شامل سن و ابتلا به هپاتیت C مزمن است. در این موارد، ممکن است درمان حمایتی تهاجمیتر و پیوند کبد لازم باشد.
درمان هپاتیت B
هپاتیت B حاد در 95-99٪ بیماران سالم، بهبود مییابد و عارضه طولانی مدت ندارد.سن و شرایط زمینهای میتواند منجر به بیماری طولانیتر و شدیدتری شوند. بیماران خاصی بستری در بیمارستان هستند، به ویژه کسانی که علائم بالینی شاملم وارد زیر دارند:
- آسیت
- ادم محیطی
- انسفالوپاتی کبدی
- علائم آزمایشگاهی افت قند خون
- مدت زمان طولانی پروترومبین
- آلبومین
- سرم پایین
- بیلی روبین بسیار بالای سرم
در این موارد حاد نادر و شدید، بیماران با درمان ضد ویروسی با موفقیت درمان شدهاند، مشابه موارد هپاتیت B با آنالوگهای نوکلئوزیدی مانند «انتکاویر» (entecavir) یا «تنوفوویر» (tenofovir) درمان میشوند. از آنجا که اطلاعات آزمایش بالینی کم است و داروهای مورد استفاده برای درمان مستعد ایجاد مقاومت هستند.
از آنجا که دادههای کارآزمایی بالینی کم است و داروهای مورد استفاده برای درمان مستعد ایجاد مقاومت هستند، کارشناسان توصیه میکنند برای موارد حاد شدید، خفیف تا متوسط، درمان را رزرو کنند. مدیریت هپاتیت B مزمن با هدف کنترل همانندسازی ویروسی انجام میشود که با پیشرفت بیماری ارتباط دارد. هفت دارو در ایالات متحده تایید شده است.
درمان هپاتیت حاد
بیماران سالم، 95-99٪ بهبود مییابند و هیچ اثر طولانی مدت ندارند و درمان ضد ویروسی تضمین نمیشود. سن و شرایط میتوانند منجر به بیماری طولانیتر و شدیدتری شوند. در مورد بیماران خاص بستری در بیمارستان به ویژه کسانی که علائم بالینی زیر را دارند، درمان ضد ویروسی، با آنالوگهای نوکلئوزیدی مانند «انتکاویر» (entecavir) یا «تنوفوویر» (tenofovir) (مشابه آنچه در موارد هپاتیت مزمن B استفاده میشود) موفقیت آمیز بوده است:
- آسیت
- ورم محیطی
- انسفالوپاتی کبدی
- افرادی با علائم هیپوگلیسمی
- مشکل انعقاد خون
- آلبومین پایین
- بیلی روبین بالا در سرم
از آنجا که دادههای کارآزمایی بالینی در مورد این درمان کم است و داروهای مورد استفاده مستعد ایجاد مقاومت هستند، کارشناسان توصیه میکنند که درمان برای موارد حاد و مزمن استفاده شود. مدیریت هپاتیت B مزمن با هدف کنترل همانندسازی ویروسی انجام میشود و با پیشرفت بیماری ارتباط دارد. به این منظور هفت دارو در آمریکا تایید شدهاند:
- اینترفرون آلفای تزریقی
- اینترفرون پگیله (PEG IFN)
- لامیوودین
- Entecavir
- تنوفوویر
اینترفرون آلفای تزریقی
اولین درمانی است که برای هپاتیت مزمن B تأیید شده است. این عوارض جانبی متعددی دارد که بیشتر آنها با از بین بردن درمان برگشتپذیر هستند، اما با درمانهای جدیدتر برای این موارد جایگزین شده است. این شامل اینترفرون طولانی مدت متصل به پلیاتیلنگلیکول (اینترفرون پگیله) و آنالوگهای نوکلئوزید خوراکی است.
اینترفرون پگیله (PEG IFN)
فقط یکبار در هفته به صورت تزریق زیرجلدی تجویز میشود و هم راحتتر و هم موثرتر از اینترفرون استاندارد است. اگرچه مانند بسیاری از داروهای ضد ویروس خوراکی، مقاومت ایجاد نمیکند، اما تحمل نسبت به آن کم است و نیاز به نظارت دقیق دارد. تخمین زده میشود هزینه اینترفرون پگیله سالانه 18000 دلار در ایالات متحده باشد، در حالی که این هزینه برای داروهای خوراکی 2500-8،700 دلار است.
دوره درمانی این دارو 48 هفته است در حالی که در درمان با ضد ویروسهای خوراکی، که برای بیشتر بیماران نیاز به درمان نامحدود وجود دارد(حداقل 1 سال). اینترفرون پگیله در بیمارانی که میزان فعالیت ویروسی بالایی دارند موثر نیست و نمیتواند در بیمارانی با سیستم ایمنی سرکوب شده یا مبتلا به سیروز استفاده شود.
لامیوودین
اولین آنالوگ خوراکی نوکلئوزیدی خوراکی بود. در حالی که موثر و قوی است، لامیوودین با درمانهای جدیدتر و قویتر در دنیای غرب جایگزین شده است و دیگر به عنوان درمان خط اول توصیه نمی شود. با این حال، هنوز هم در مناطقی مورد استفاده قرار میگیرد که نمایندگان جدید یا تصویب نشدهاند یا بسیار هزینهبر هستند. به طور کلی، دوره درمان حداقل یک سال با حداقل شش ماه درمان تلفیقی است.
براساس پاسخ ویروسی، ممکن است نیاز به درمان طولانیتری باشد و بیماران خاصی به درمان طولانی مدت نامحدود نیاز دارند. با توجه به پاسخ قوی کمتر در بیماران آسیایی، توصیه میشود که درمان تلفیقی حداقل به یک سال افزایش یابد همه بیماران باید از نظر فعالسازی مجدد ویروس کنترل شوند، در صورت شناسایی، نیاز به شروع مجدد درمان است. لامیوودین به طور کلی بیخطر بوده و به خوبی تحمل میشود.
در بسیاری از بیماران مقاومت دارویی ایجاد میشود که با طولانی شدن مدت درمان ارتباط دارد. اگر این اتفاق بیفتد، یک ضد ویروس به درمان اضافه خواهد شد. لامیوودین به عنوان یک درمان منفرد در بیمارانی که از طریق HIV آلوده شدهاند منع مصرف دارد، زیرا به سرعت ایجاد مقاومت میکند اما میتواند به عنوان بخشی از رژیم درمانی چند دارویی استفاده شود. آدفوویر دیپیوکسیل، آنالوگ نوکلئوتیدی، برای مکمل لامیوودین در بیمارانی که مقاومت ایجاد می کنند، استفاده شده است، اما دیگر به عنوان درمان خط اول توصیه نمی شود.
انتاکاویر
داروی «انتاکاویر» (Entecavir) ایمن است، به خوبی تحمل می شود، در معرض مقاومت کمتری است و قوی ترین داروی ضد ویروس هپاتیت B موجود است. بنابراین یک انتخاب خط اول درمان است. این دارو برای بیماران مقاوم در برابر لامیوودین یا به عنوان مونوتراپی در بیمارانی که HIV مثبت دارند توصیه نمی شود. تلبیودین موثر است اما به عنوان درمان خط اول توصیه نمیشود. در مقایسه با entecavir، هم قدرت کمتری دارد و هم مستعد مقاومت است.
تنوفوویر
یک آنالوگ نوکلئوتیدی و یک داروی ضد ویروسی است که برای درمان عفونت HIV نیز استفاده میشود. ترجیح داده میشود آدفوویر در بیماران مقاوم به لامیوودین و به عنوان درمان اولیه باشد زیرا قدرت بیشتر و احتمال مقاومت کمتری دارد. درمانهای خط اول که در حال حاضر استفاده میشوند شامل PEG IFN ،entecavir و tenofovir، هستند که با نظر و تجویز پزشک نوع آن انتخاب میشود.
شروع درمان براساس توصیههای صادر شده توسط انجمن آمریکایی مطالعه بیماریهای کبد (AASLD) و اتحادیه اروپا برای مطالعه کبد (EASL) انجام میشود و براساس سطح ویروسی قابل تشخیص است، وضعیت مثبت یا منفی HBeAg، سطح ALT و در موارد خاص سابقه خانوادگی HCC و بیوپسی کبد.
در بیماران مبتلا به سیروز بهبود یافته، درمان بدون توجه به وضعیت HBeAg یا سطح ALT توصیه میشود، اما توصیهها در مورد سطح HBV DNA متفاوت است. AASLD توصیه میکند که در سطح DNA قابل تشخیص و بالاتر از 2x103 IU / میلیلیتر درمان شود. EASL و WHO توصیه میکنند که در چه مواردی سطح HBV DNA قابل تشخیص است.
پیوند کبد
در بیماران مبتلا به سیروز جبران نشده، در صورت تشخیص HBV DNA، درمان و ارزیابی پیوند کبد در همه موارد توصیه میشود. در حال حاضر، درمان چند دارویی در درمان HBV مزمن توصیه نمیشود زیرا در طولانی مدت موثرتر از درمان فردی با entecavir یا tenofovir نیست.
درمان هپاتیت C
انجمن آمریکایی برای مطالعه بیماریهای کبد و انجمن بیماریهای عفونی آمریکا (AASLD-IDSA) درمان ضد ویروسی را برای همه بیماران مبتلا به عفونت مزمن هپاتیت C توصیه میکنند به جز در افرادی که دارای شرایط پزشکی مزمن هستند. پس از دستیابی به آن، تداوم ویروس هپاتیت C یک قاعده است و در نتیجه باعث ایجاد هپاتیت مزمن میشود.
هدف از درمان پیشگیری از سرطان هپاتوسلولار (HCC) بهترین راه برای کاهش خطر طولانی مدت HCC دستیابی به پاسخ ویروسی پایدار (SVR) است. SVR به عنوان بار ویروسی غیرقابل شناسایی در 12 هفته پس از اتمام درمان تعریف میشود و نشاندهنده بهبود است. داروهای ضد ویروس غیرمستقیم شامل اینترفرون پگیله (PEG IFN) و ریباویرین (RBV) هستند که به طور ترکیبی اساساً درمان اساسی HCV بودهاند.
مدت زمان و پاسخ به این درمانها بر اساس ژنوتیپ متفاوت است. این عوامل ضعیف تحمل میشوند اما هنوز هم در بعضی از مناطق فقیرنشین استفاده میشود. در کشورهای با منابع بالا، آنها توسط عوامل ضد ویروسی که مستقیماً در سال 2011 ظاهر شدند، جایگزین شدهاند.
این عوامل پروتئینهای مسئول تکثیر ویروس را هدف قرار میدهند و شامل سه کلاس زیر هستند:
- مهارکنندههای پروتئاز NS3/4A، از جمله تلپراویر، بوپسرویر، سیمپراویر
- مهارکنندههای NS5A، از جمله لدیپاسویر، داکلاتاسویر
- مهارکنندههای پلیمراز NS5B، از جمله sofosbuvir ،dasabuvir
این داروها در ترکیبات مختلف، گاهی اوقات همراه با ریباویرین، براساس ژنوتیپ بیمار، به عنوان ژنوتیپ 1-6 مشخص میشوند. ژنوتیپ 1 (GT1)، که شایعترین ژنوتیپ در ایالات متحده و سراسر جهان است، هم اکنون با یک رژیم ضد ویروسی با عملکرد مستقیم قابل درمان است. درمان خط اول برای GT1 ترکیبی از سوفوسبوویر و لدیپاسویر (SOF/LDV) به مدت 12 هفته برای اکثر بیماران، از جمله مبتلایان به فیبروز پیشرفته یا سیروز است.
برخی از بیماران مبتلا به بیماری زودرس فقط به 8 هفته درمان نیاز دارند در حالی که کسانی که فیبروز پیشرفته یا سیروز دارند و به درمان قبلی پاسخ نداده اند به 24 هفته نیاز دارند. هزینه همچنان عامل اصلی محدود کننده دسترسی به این داروها به ویژه در کشورهای با منابع کم است. هزینه رژیم 12 هفته ای GT1 (SOF / LDV) 94500 دلار آمریکا برآورد شده است.
درمان هپاتیت دی
درمان هپاتیت D دشوار است و درمان موثری برای آن وجود ندارد. ثابت شده است که اینترفرون آلفا به صورت موقت، در مهار فعالیت ویروس هپاتیت D موثر است.
درمان هپاتیت ای
مشابه هپاتیت A، درمان هپاتیت E نیز شامل استراحت، تغذیه مناسب و مصرف مایعات فراوان است. بستری شدن در بیمارستان ممکن است برای موارد خاص شدید یا برای زنان باردار مورد نیاز باشد.
درمان هپاتیت الکلی
خط اول درمان هپاتیت الکلی، درمان اعتیاد به الکل و قطع مصرف آن است. برای کسانی که به طور کامل از الکل خودداری میکنند، برگشت بیماری کبد و طول عمر بیشتر امکانپذیر است. نشان داده شده که بیماران در هر مرحله از بیماری، با جلوگیری از افزایش آسیب کبدی سود میبرند. علاوه بر مراجعه به رواندرمانی و سایر برنامههای درمانی، درمان باید شامل ارزیابی و درمان تغذیهای و روانی اجتماعی باشد.
همچنین بیماران باید از نظر علائم و نشانههای مرتبط، مانند تجمع مایع، انسفالوپاتی کبدی و عفونت بهطور مناسب درمان شوند. هپاتیت الکلی شدید، پیش آگهی ضعیفی دارد و به همین دلیل به سختی قابل درمان خواهد بود. بدون هیچ درمانی، ۲۰ الی ۵۰ درصد از بیماران ممکن است در طی یک ماه بمیرند، اما شواهد نشان میدهند که درمان ممکن است عمر را بیش از یک ماه افزایش دهد.
گزینههای درمانی موجود شامل موارد زیر هستند:
- پنتوکسی فیلین (PTX): یک مهارکننده غیر اختصاصی TNF
- کورتیکواستروئیدها: مانند پردنیزون یا پردنیزولون (CS)
- کورتیکواستروئیدها با N-استیل سیستئین (CS با NAC)
- کورتیکواستروئیدها با پنتوکسی فیلین (CS با PTX)
دادهها نشان میدهند که CS به تنهایی یا CS همراه با NAC، در کاهش مرگ و میر کوتاه مدت بسیار موثر هستند. متأسفانه مصرف کورتیکواستروئیدها در برخی از بیماران منع مصرف دارد، مانند کسانی که خونریزی فعال دستگاه گوارش، عفونت، نارسایی کلیه یا پانکراتیت دارند. در این موارد ممکن است به صورت موردی، PTX به جای CS در نظر گرفته شود.
برخی شواهد نشان میدهند استفاده از PTX بهتر از عدم درمان است و اثرات آن میتوانند با CS درمانی قابل مقایسه باشند، در حالی که سایر دادهها هیچ سندی در مورد مزیت دارونما نشان نمیدهند. متأسفانه، در حال حاضر هیچ درمان دارویی وجود ندارد که خطر مرگ این بیماران را در طولانی مدت، در 3-12 ماهگی و بیشتر، کاهش دهد.
شواهد کمی نشان میدهند که عصاره گیاه خار مریم ممکن است باعث زنده ماندن در بیمار الکلی کبدی و بهبود برخی از آزمایشهای کبدی (بیلیروبین سرم و GGT) بدون ایجاد عوارض جانبی شود، اما بدون مطالعه بیشتر نمیتوان مصرف آن را توصیه یا منع کرد.