انواع عنصر چیست؟ – راهنمای کامل + ساختار به زبان ساده
شناخت اجزای سازنده مواد ازجمله انواع عنصر، در شیمی یکی از مباحث مهم به شمار میرود و باید توجه ویژهای به آن داشت تا بتوان مباحث دیگر شیمی را درک کرد. عنصر شیمیایی یا همان عنصر، یک ماده خالص است که نمیتوان آن را به بخشهای کوچکتر و سادهتری تبدیل کرد. در جدول تناوبی یا دورهای ۱۱۸ عنصر وجود دارد که از میان آنها ۹۲ عنصر در طبیعت وجود دارند و ۲۶ عنصر دیگر در آزمایشگاه بهطور مصنوعی ساخته میشوند. در این مطلب با بررسی انواع عنصر یاد میگیریم که انواع عنصر چیست و با ویژگیها و خواص مربوط به آنها آشنا خواهیم شد.
- یاد میگیرید عنصر، اتم و مولکول چه تفاوتی با هم دارند.
- دستهبندی فلزات، نافلزات و شبهفلزات را خواهید آموخت.
- خواهید آموخت اطلاعات هر خانه از جدول تناوبی چه معنایی دارد.
- میآموزید ایزوتوپها چه نقشی در ویژگیهای عنصر دارند.
- با نقش ستارگان و ابرنواخترها در پیدایش عناصر آشنا میشوید.
- ویژگی شاخص عناصر مهم مثل هالوژنها و گازهای نجیب را یاد میگیرید.


عنصر چیست ؟
عنصر شکل خالصی از ماده است که تنها از یک نوع اتم تشکیل شده است. به عبارتی نمیتوان عنصر را با استفاده از واکنشهای شیمیایی به اجزای کوچکتری تقسیم یا به مواد دیگری تبدیل کرد. بنابراین مجموعهای از این اتمهای مشابه در کنار هم یک ماده خالص یا همان عنصر را تشکیل میدهند. به عنوان مثال در تصویر زیر عناصر مس، کربن و هلیوم آورده شده است که هر کدام به ترتیب تنها از اتمهای مس، کربن و هلیوم تشکیل شدهاند.
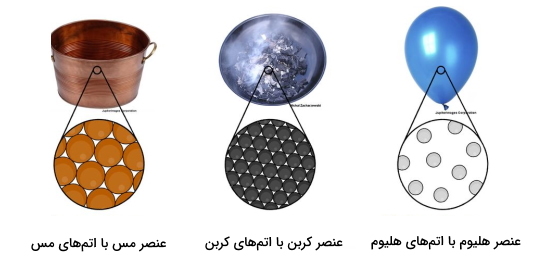
تعریف اتم و عنصر و مولکول
از آنجا که ممکن است بسیاری از افراد در شناخت و درک اتم، عنصر و مولکول دچار مشکل شوند در این قسمت هریک از این مفاهیم و ویژگیهای آنها بررسی شده است تا بتوان راحتتر مفهوم اتم، عنصر و مولکول را درک کرد.
تفاوت اتم و عنصر
همانطور که در قسمت فوق توضیح داده شد عنصر ماده خالصی است که از یک نوع اتم تشکیل شده است. کوچکترین و اصلی ترین جزء سازنده یک ماده، اتم نام دارد که از کنار هم قرار گرفتن اتمهای مشابه عنصر به وجود میآید.
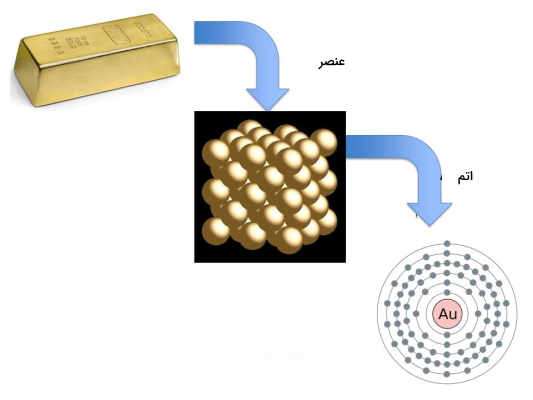
اتمها خود از ذرات ریزتری تشکیل میشوند که این ذرات عبارتند از:
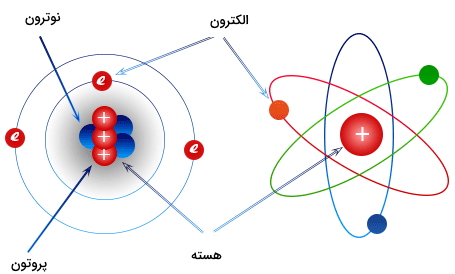
- الکترون ( Electron | e) : الکترون ذرهای با بار منفی است که در اطراف هسته قرار میگیرد.
- پروتون ( Proton | p) : پروتون نیز ذرهای با بار مثبت است که در درون هسته قرار گرفته که به آن نیروی هستهای قوی از جانب هسته اتم به آن وارد میشود.
- نوترون ( Neutron | n) : نوترون نیز ذرهای از اتم است که در درون هسته قرار دارد و خنثی است.
در تصویر زیر ساختار اتم نشان داده شده است. همانطور که مشخص است اوربیتالها (مدارهایی که در تصویر به صورت خطوط رنگی سبز، آبی و قرمز مشخص شده است) محلی برای توزیع احتمالی الکترونها هستند که به دور هسته حرکت میکنند. همچنین هسته در مرکز اتم قرار دارد که در درون آن پروتون و نوترون قرار گرفته است.
اندازه اتمها به قدری کوچک است که با چشم غیرمسلح نمیتوان آنها را دید. به عنوان مثال اگر ورق نازک آلومیونیومی به ضخامت تار مو برش داده شود در آن ۲۰۰ هزار اتم میتواند جای بگیرد.
در جدول زیر به طور خلاصه تعریف و توصیف عنصر و اتم فهرست شده است که درک مفهوم این دو عبارت را سادهتر میکند.
| عنصر | اتم |
| عنصر شیمایی از یک نوع اتم با خواص فیزیکی و شیمیایی یکسان تشکیل شده است. | کوچکترین و اصلیترین واحد سازنده مواد است . |
| تعداد پروتونها و نوترونهای یک عنصر شیمیایی با هم برابرند. در صورتی که تعداد آنها با هم برابر نباشد ایزوتوپهای یک عنصر نامیده میشوند. | تعداد پروتونها و نوترونهای یکم اتم میتواند برابر یا مختلف باشد. |
| جدول تناوبی طبقهبندی انواع عنصر شیمیایی را نشان میدهد. | جدول تناوبی طبقهبندی اتمهای مختلف را نشان میدهد. |
| تعداد پروتون در هسته اتم عنصر اکسیژن برابر ۸ است. | اتم اکسیژن در هسته خود ۸ پروتون دارد. |
عنصر و مولکول
مولکولها از ایجاد پیوند شیمیایی میان دو یا چند اتم یکسان مانند یا ترکیبی از اتمهای مختلف مانند تشکیل شدهاند. به حالت اولی عنصر مولکولی یا مولکول و به حالت دومی ترکیب میگویند. مولکولها بار الکتریکی ندارند و به عبارتی خنثی هستند. در مولکول، اتمها توسط پیوندهای کووالانسی به هم متصل هستند.
اندازه مولکولها به تعداد اتمهای متصل به هم وابسته است. به گونهای که برخی مولکولها مانند هموگلوبین اندازه بسیار بزرگی دارند. درحالیکه اندازه برخی مولکولها مانند مولکول دواتمی هیدروژن بسیار کوچک است.

در جدول زیر تفاوت عنصر و مولکول به صورت خلاصه فهرست شده است.
| عنصر | مولکول |
| عنصرها شکل خالصی از مواد هستند و توسط واکنش شیمیایی نمیتوانند به اجزای سادهتری تقسیم شوند. | مولکولها از طریق ایجاد پیوند شیمیایی بین دو یا تعداد بیشتری از اتمهای یکسان یا مختلف بهوجود میآیند. |
| عنصر تنها از یک نوع اتم تشکیل میشود. | مولکول شامل دو یا تعداد بیشتری از عناصر یکسان یا مختلف است. |
| هیدروژن، نیتروژن، اکسیژن، سدیم، مس و غیره ازجمله مثالهایی برای عنصر هستند. | کربن دیاکسید، آب، اسید نیتریک و غیره نمونههایی از مولکولهای ترکیبی هستند. |
| نوع پیوند شیمایی عنصر بسته به نوع پایداری و موقعیت الکترونها میتواند متغیر باشد. | معمولا پیوند شیمایی در مولکولها از نوع کوالانسی است. |
انواع عنصر ها کدامند ؟
در طبقهبندی انواع عنصر ها در جدول تناوبی، عناصر به سه دسته کلی زیر تقسیم میشوند:
- فلزات: فلزات در جدول تناوبی شامل فلزات قلیایی، قلیایی خاکی، فلزات واسطه و فلزات پسواسطه هستند.
- نافلزات:نافلزات شامل هیدروژن، کربن، نیتروژن، اکسیژن، گوگرد، فسفر، سلنیوم و همینطور گروه هالوژنها و گازهای نجیب هستند.
- شبهفلزات: عناصر بور، سیلیسیوم، ژرمانیوم، آرسنیک، تلوریوم و آنتیموان همگی جزء شبهفلزات به شمار میروند.
ساختار و ویژگی انواع عنصر ها
در این بخش با بررسی ساختار فلزات قلیایی، قلیایی خاکی، فلزات واسطه، شبهفلزات، و نافلزات به طور کامل یاد میگیرید انواع عنصر چیست و با ویژگیهای هرکدام از این گروه جدول تناوبی آشنا خواهید شد.
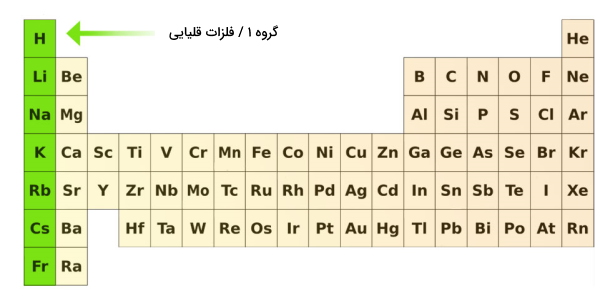
فلزات قلیایی
گروه ۱ جدول تناوبی متعلق به فلزات قلیایی است که آرایش الکترونی آنها به ختم میشود به همین دلیل این عناصر به همراه هیدروژن و هلیوم در دسته عناصر S قرار میگیرند. دلیل نامگذاری فلزات قلیایی به این دلیل است که هیدروکسید و اکسیدهای آنها در طبیعت خاصیت قلیایی دارند. زمانی که این فلزات برای تبدیل شدن به یون، الکترون از دست میدهند به تبدیل میشوند. این فلزات بسیار واکنشپذیر هستند. به عنوان مثال فلز سدیم را اغلب در نفت یا پارافین نگهداری میکنند زیرا در غیر این صورت سدیم سریع با اکسیژن واکنش میدهد و میسوزد.
به همین خاطر این عناصر در طبیعت به صورت آزاد یافت نمیشوند و اغلب به صورت ترکیب با سایر عناصر وجود دارند. به عنوان مثال منبع اصلی ، سدیم کلرید است که به صورت نمکهای محلول در آب دریا یا رسوب وجود دارد و از آبهای دریا استخراج میشود. این فلزات در مقایسه با سایر فلزات تفاوتهایی دارند که ازجمله آنها میتوان به نرم بودن، نقطه ذوب و نقطه جوش پایین اشاره کرد. چگالی یا همان دانسیته این فلزات نیز پایین است به گونهای که دانسیته سدیم، پتاسیم و لیتیوم از دانسیته آب هم پایینتر است.
فلزات قلیایی خاکی
در جدول تناوبی، گروه ۲ متعلق به فلزات قلیایی خاکی است که آرایش الکترونی آنها در لایه ظرفیت به ختم میشود بنابراین این دسته از فلزات نیز در دسته S قرار میگیرند. این گروه از فلزات با از دست دادن الکترون به یون تبدیل میشوند. نامگذاری فلزات قلیایی خاکی به این دلیل است که همانند گروه قبلی هیدروکسید و اکسیدهای آنها در طبیعت قلیایی هستند و از طرفی اکسید این فلزات به صورت فراوان در پوسته زمین یافت میشوند. به طوری که کلسیم و منیزیم به ترتیب پنجمین و هشتمین عنصر از لحاظ فراوانی در پوسته زمین به شمار میروند. این فلزات نیز واکنشپذیر هستند اما واکنشپذیری آنها در مقایسه با فلزات قلیایی کمتر است. فلزات قلیایی خاکی چگالتر و سختتر هستند و دمای ذوب بالایی دارند. سطح درخشانی دارند و رنگ آنها سفید یا نقرهای است.
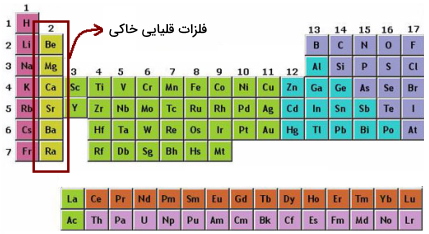
توجه کنید که در جدول فوق جای دو عنصر لانتانیوم (La) و اکتینیوم (Ac) خالی است و در کنار عناصر لانتانیدها و آکتنیدها قرار گرفتهاند. این جدول بسیار رایج است اما حالت صحیحتر آن این است که این دو عنصر در دورههای ۶ و ۷ قرار بگیرند و بقیه عناصر گروه لانتانید و آکتنید برای حفظ خواص در پایین جدول قرار بگیرند. به این دلیل نمیتوان این دو عنصر را در قسمت لانتانیدها و آکتنیدها قرار داد زیرا که واژه لانتانید و آکتنید به ترتیب به معنای «شبیه لانتانیوم» و «شبیه آکتینیوم» است بنابراین منطقی نیست که این دو عنصر را یک لانتانید و آکتنید دانست. اما در هر صورت، استفاده از هر دو جدول، کاربرد دارد.
فلزات واسطه دسته d
ساختار الکترونی فلزات واسطه به ختم میشود به همین دلیل به فلزات واسطه فلزات یا عناصر دسته d میگویند. در این دسته از فلزات زیرلایههای d در حال پر شدن است. این فلزات بر اساس اصل آفبا برای تبدیل شدن به یون، ابتدا الکترونهای لایه s را از دست میهند. گروه ۳ تا ۱2 در جدول تناوبی متعلق به فلزات واسطه است بنابراین میتوان گفت که بخش بزرگی از جدول تناوبی به این دسته از فلزات اختصاص دارد.
البته برخی، فلزات گروه ۱۲ را فلزات «پسواسطه» (Post-transition metals) مینامند که متعلق به دسته عناصر p هستند. هرچند برخی از شیمیدانها آنها را همچنان جزء فلزات واسطه یا فلزات پایه میدانند و در جدول تناوبی گروه ۱۲ جزء فلزات واسطه دسته d قرار دارند البته در برخی جدولها مانند تصویر زیر اینگونه نیست. جدول زیر فقط نقشه خانههای مربوط به فلزات را نشان داده است. همانطور که در تصویر مشاهده میشود عناصر گروه ۱۲ از جمله روی، کادمیوم و جیوه جزء همان فلزات پسواسطه به شمار میروند.
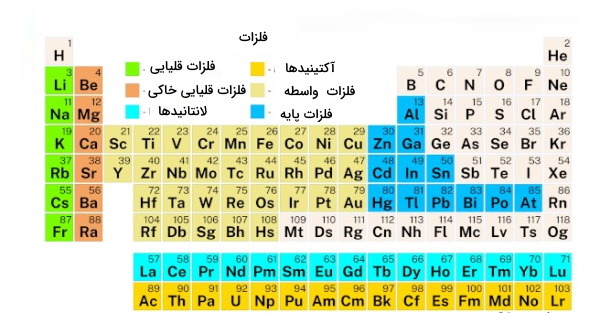
فلزات پسواسطه از جمله آلومینیوم و گالیوم در گروه ۱۳ تا ۱۶ پراکنده شدهاند. دلیل این امر آن است که فلزات گروه ۱۲ ازجمله روی (Zn)، کادمیوم (Cd) و جیوه (Hg) نسبت به فلزات واسطه دمای ذوب و جوش پایینتری دارند و نرمتر هستند و بیشتر به خصوصیات فلزات پایه یا همان فلزات پسواسطه شباهت دارند. جالب است که بدانید همه فلزات به صورت جامد هستند در حالیکه جیوه مایع است.

فلزات واسطه همانند فلزات اصلی - فلزات قلیایی، قلیایی خاکی و فلزات پس واسطه - انعطافپذیری خوبی دارند، چکشخوارند و رسانای خوبی برای جریان الکتریکی و گرما هستند. ترکیبات فلزات واسطه اغلب در آب محلول هستند و ترکیبات رنگی تشکیل میدهند. تمامی عناصر واسطه سختی، نقطه ذوب و نقطه جوش بالایی دارند. علیرغم شباهتهایی میان فلزات واسطه و فلزات اصلی تفاوتهایی نیز میان آنها وجود دارد که ازجمله آنها میتوان به سه مورد زیر اشاره کرد:
- الکترونگاتیوی فلزات واسطه یا واسطه نسبت به فلزات اصلی بالاتر است به همین دلیل تمایل بیشتری برای تشکیل پیوندهای کووالانسی از خود نشان می دهند.
- شکل ترکیبات فلزات واسطه و فلزات اصلی با هم نیز تفاوت دارند به عنوان مثال فلزات اصلی تمایل به تشکیل ترکیبات نمکی مانند و و دارند که در این ترکیبات یونهای منفی به مقداری است که با یونهای مثبت تشکیل ترکیبی خنثی بدهند. فلزات واسطه نیز همین ترکیبات را مانند تشکیل میدهند اما در این ترکیبات احتمال ایجاد کمپلکسهایی مانند یونهای بیشتر است که در این حالت تعداد بیشتری از یونهای منفی وجود دارد.
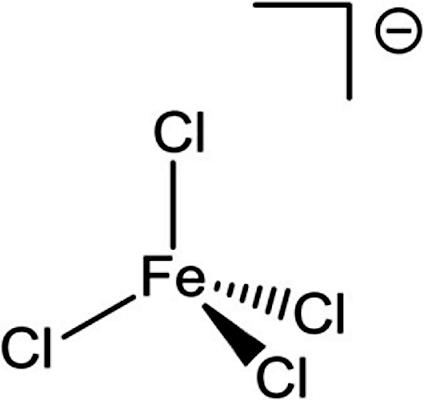
ساختار کمپلکس تترا کلرو فرات - سومین تفاوت، مربوط به ترکیبات فلزات واسطه به هنگام واکنش با مولکولهای خنثی مانند آب یا آمونیا است. به عنوان مثال نمک یونهای فلزات اصلی مانند زمانی که در آب حل میشوند تشکیل یونهای محلول در آب میدهند که با تبخیر آب دوباره میتوان مواد اولیه یعنی نمک طعام را بدست آورد. در حالی که نمک یونهای فلزات واسطه رفتار کاملا متفاوتی را از خود نشان میدهند. به عنوان مثال زمانی که ترکیب بنفشرنگ کرومیوم (III) کلرید در محلول آمونیا حل میشود ترکیب زردرنگی با فرمول شیمیایی به وجود میآید که با تبخیر آمونیا این ترکیب میتواند جدا شود و پایداری خود را همچنان حفظ کند.
در واکنشهای زیر واکنش اولی و دومی به ترتیب مربوط به سدیم کلرید نمک فلز اصلی و کرومیوم (III) کلرید در محلول آمونیا است.
فلزات واسطه دسته f
فلزات واسطه دسته f که آن را به دلیل پر شدن زیر لایههای F فلزات واسطه داخلی نیز مینامند شامل آکتینیدها و لانتانیدها هستند. این عناصر باید در دوره های ۶ و ۷ جدول تناوبی قرار بگیرند اما از آنجا که روند قانون تناوبی به هم زده میشود به دلیل حفظ خواص در پایین جدول تناوبی و در ادامه عناصر لانتانیوم و اکتینیوم قرار میگیرند. ازجمله ویژگیهای این دسته از فلزات میتوان به نقطه ذوب و نقطه جوش بالا، عدد اکسایش متفاوت اشاره کرد. به طور کلی ویژگی این فلزات شباهت زیادی به فلزات واسطه دسته d دارند.

ویژگی های لانتانیدها
ازجمله ویژگیهای انواع عنصر در لانتانیدها میتوان به موارد زیر اشاره کرد:
- لانتانیدها فلزاتی نرم با رنگ سفید یا نقرهای هستند.
- رنگ لانتانیدها اغلب کدر است و در معرض هوا که قرار میگیرند از شفافیت آنها کاسته میشود.
- نقطه ذوب آنها از ۱۰۰۰ تا ۱۲۰۰ کلوین است به جز عنصر ساماریم که نقطه ذوب آن ۱۶۲۳ کلوین است.
- لانتانیدها برای جریان الکتریکی و گرما رساناهای خوبی به شمار میروند.
- به جز عنصر پرومتیم سایر عناصر دیگر لانتانیدها در طبیعت خاصیت رادیواکتیوی ندارند.
- شعاع اتمی و یونی از عنصر لانتانیوم تا لوتتیم کاهش پیدا میکند که به این پدیده «انقباض لانتانیدی» (Lanthanide Contraction) میگویند.
ویژگی های آکتینیدها
ازجمله ویژگیهای انواع عنصر در آکتینیدها میتوان به موارد زیر اشاره کرد:
- رنگ آکتینیدها نقرهای است.
- این دسته از عناصر طبیعت رادیواکتیوی دارند.
- این فلزات واکنشپذیری بالایی دارند که با ریزتر شدن آکتنیدها و تبدیل به حالت پودری واکنشپذیری افزایش پیدا میکند زیرا سطح تماس آنها بیشتر میشود.
- شعاع اتمی و یونی از عنصر آکتینیوم تا لارنسیم کاهش پیدا میکند که به این پدیده «انقباض آکتینیدی« یا (Actinoid Contraction) میگویند.
- عدد اکسایش این عناصر اغلب است. با این حال عناصری که در نیمه اول آکتینیدها قرار دارند معمولا عددهای اکسایش بالاتری را از خود نشان میدهند.
شبه فلزات
شبهفلزات عناصری هستند که در دسته P قرار میگیرند یعنی آرایش الکترونی آن ها به زیرلایه p ختم میشود. ظاهر این عناصر مانند فلزات است اما همانند نافلزات برخورد میکنند به همین دلیل به آنها شبهفلز میگویند. این عناصر کوچکترین بخش جدول تناوبی را به خود اختصاص میدهند. همانطور که در شکل زیر مشخص است شبهفلزات شامل ۶ عنصر بور، سیلیسیم، ژرمانیوم، آرسنیک، آنتیموان، تلوریم هستند.
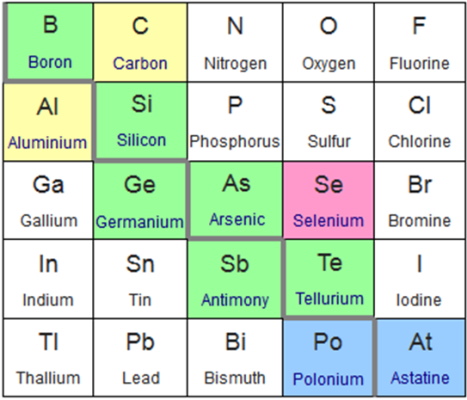
ازجمله ویژگیهای مهم شبهفلزات میتوان به موارد زیر اشاره کرد:
- شبهفلزات در دمای اتاق جامد هستند.
- شبهفلزات همانند فلزات ظاهری درخشان دارند.
- از لحاظ فیزیکی شکننده هستند و لحاظ شیمیایی همانند نافلزات رفتار میکنند و به راحتی آنیون تشکیل میدهند. به همین خاطر حالتهای اکسیداسیون مختلفی دارند و پیوند کووالانسی تشکیل میدهند.
- این عناصر رسانایی الکتریکی متوسط رو به بالایی دارند.
- شبهفلزات همانند فلزات و نیمههادیها دارای ساختار الکترونیکی هستند.
- شبهفلزات اکسیدهای اسیدی ضعیف یا آمفوتری را تشکیل میدهند.
- این عناصر قادر به تشکیل آلیاژهای فلزی هستند.
- انرژی یونش و الکترونگاتیوی آنها چیزی مابین فلزات و نافلزات است.
نافلزات
نافلزات شامل عناصر کربن،نیتروژن، اکسیژن، فسفر، گوگرد، سلنیوم، هالوژنها و گازهای نجیب هستند. به این عناصر به جز گازهای نجیب عناصر واکنشی میگویند. معمولا نافلزات نسبت به فلزات ساختار بازتری دارند البته اگر از حالت مایع یا گاز به حالت جامد تبدیل شوند در این صورت دیگر ساختار آنها باز نخواهد بود. اغلب نافلزات تمایل به اشتراک گذاری الکترون و و دریافت الکترون دارند. رساناهای ضعیفی برای گرما و جریان الکتریکی هستند، انرژی یونش و الکترونگاتیویته آنها نسبتا بالاست، نقطه ذوب و جوش پایینی دارند و در طبیعت به صورت آزاد یافت میشوند.
هالوژن ها
در جدول تناوبی گروه ۱۷ متعلق به هالوژنهاست که نافلز هستند. هالوژن یک کلمه یونانی است که از ریشه «hal» به معنای نمک مشتق گرفته شده است زیرا هالوژنها نمکساز هستند. هالوژنها به شدت سمیاند و بوی نامطبوعی دارند. این عناصر با از دست دادن یک الکترون به آرایش الکترونی پایدار میرسند (به عنوان مثال ).
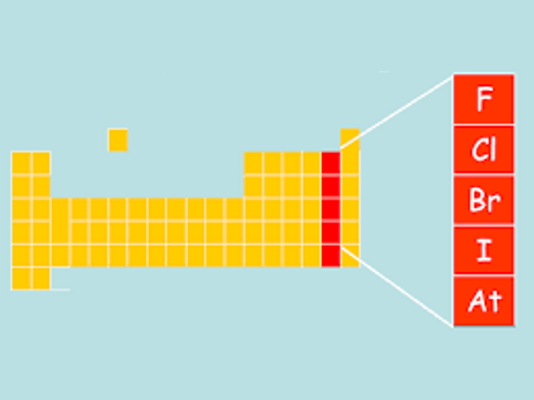
اعضای خانواده هالوژن عبارتند از :
- فلوئور (F): در دمای اتاق گازی شکل و رنگ آن زرد است.
- کلر (Cl): مانند فلوئور در دمای اتاق گازی شکل و رنگ آن متمایل به سبز است.
- برم (Br): در دمای اتاق مایع قرمزرنگ تیره است.
- ید (I): در دمای اتاق جامد سیاهرنگ است که با حرارت دیدن به بخار ارغوانی رنگ تبدیل میشود.
- آستاتین (At): مانند ید در دمای اتاق حالت جامد دارد و خاصیت رادیواکتیوی دارد.

گازهای نجیب
آخرین گروه از جدول تناوبی یعنی گروه ۱۸ متعلق به گازهای نجیب است. به این گازها، گازهای خنثی یا گازهای بیاثر میگویند. دلیل این امر آن است که آرایش الکترونی لایه ظرفیت آنها به جز هلیوم به صورت است یعنی در لایه ظرفیت خود ۸ الکترون دارند. بنابراین آرایش الکترونی گازهای نجیب پایدار است. به همین خاطر آنها واکنشپذیر نیستند و به راحتی تشکیل مولکول نمیدهند. گازهای بیاثر اغلب به صورت گاز تکاتمی هستند و در دما و فشار استاندارد میتوان آنها را به وجود آورد. این عناصر به جز هلیوم (عناصر دسته S) در عناصر دسته P قرار میگیرند. به طور کلی گازهای گروه ۱۸ شامل عناصر زیر هستند:
- هلیوم (He)
- نئون (Ne)
- آرگون (Ar)
- کریپتون (Kr)
- زنون (Xe)
- رادون (Rn)
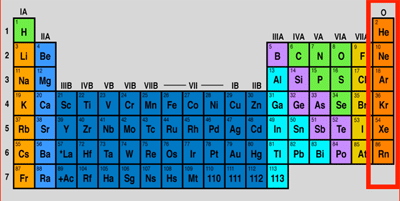
تفاوت فلز و نافلز و شبه فلز در یک نگاه
در جدول زیر به طور خلاصه ویژگیهای فلزات، شبهفلزات و نافلزات گردآوری شده است تا به خوبی با مفهوم و ویژگیهای انواع عنصر ها آشنا شوید.
| مشخصات ↓ | فلزات | نافلزات | شبهفلزات |
| ظاهر | براق - چکشخوار | کدر - شکننده | براق - شکننده |
| رسانایی حرارتی | بالا | کم | متوسط |
| هدایت الکتریکی | بالا | کم به جز کربن | متغیر |
| انرژی یونش | کم | بالا | متوسط |
| نقطه ذوب | بالا | پایین | متوسط رو به بالا |
| مثال | آهن، مس، روی | کربن، نیتروژن، کلر | بور، سیلیسیوم، ژرمانیوم |
طبقه بندی انواع عنصر
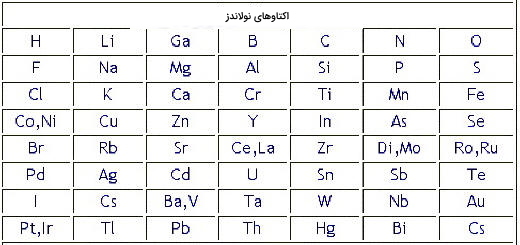
طبقهبندی انواع عنصرها تاریخچه طولانی دارد و میتوان گفت تاریخچه جدول تناوبی عنصرها به سال ۱۸6۴ برمیگردد که «جان نولاندز» (John Alexander Reina Newlands) شیمیدان بریتانیایی برای اولین بار قانون هشتتایی یا اکتاو را معرفی کرد زیرا متوجه شده بود که هر ۸ عنصر ویژگیهای شیمیایی یکسانی دارند. او براساس جرم اتمی میانگین، عنصرها را در هشت گروه مرتب کرد. اما یکی از مشکلات عمده و اساسی جدول نولاندز این بود که برای سایر عناصری که تا آن زمان کشف نشده بودند جای خالی در نظر نگرفت. تصویر زیر مربوط به چیدمان عناصر بر اساس قانون اکتاو نولاندز است.
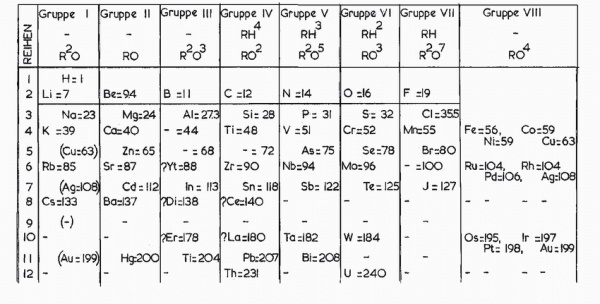
در سال ۱۸۶۹ شیمیدان روسی به نام «دیمیتری مندلیف» (Dmitri Ivanovich Mendeleev) عناصر را براساس افزایش جرم اتمی آنها طبقهبندی کرد اما این بار مندلیف برای عناصر کشف نشده جای خالی در نظر گرفت و آنها را نیز نامگذاری کرد. به عنوان مثال جای خالی یک از عناصر را اکا آلومونیوم نامگذاری کرد یعنی عنصری که خواصی مشابه با آلومینیوم دارد. پس از کشف این عنصر نام آن را ژرمانیوم گذاشتند.
در سال ۱۹۱۳ فیزیکدان انگلیسی به نام «هنری موزلی» یا (Henry Gwyn Jeffreys Moseley) زمانی که با استفاده از اشعه ایکس طول موج عناصر را اندازهگیری میکرد موفق به کشف مفهوم عدد اتمی شد و پیشنهاد داد که جدول مندلیف براساس افزایش عدد اتمی اصلاح شود. بنابراین امروزه عناصر شیمیایی در جدول تناوبی براساس افزایش عدد اتمی در آن طبقهبندی شدهاند.
جدول تناوبی که به نام جدول مندلیف نیز شناخته میشود که این جدول در طول این سالها تغییراتی کرده که در تصویر زیر نمونهای از جدول تناوبی آورده شده است.
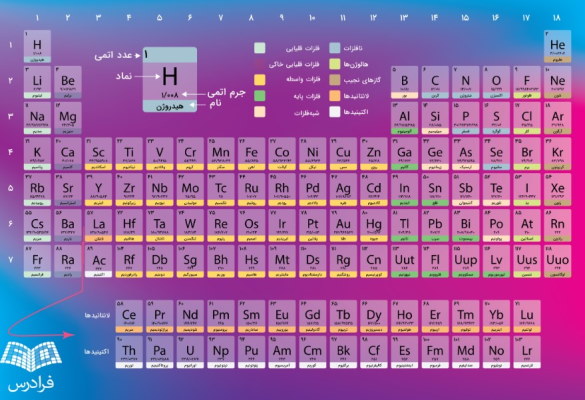
جدول تناوبی
جدول تناوبی دارای ۱۸ گروه (ستون) و ۷ ردیف (دوره) است که عناصر موجود در هر گروه خواص شیمیایی یکسانی دارند. بنابراین عنصرهای موجود در هر دوره خواص شیمیایی متفاوتی دارند. به عنوان مثال در تصویر زیر همانطور که مشخص است عنصر پالادیوم (Pd) در گروه ۱۰ و دوره ۵ وجود دارد.
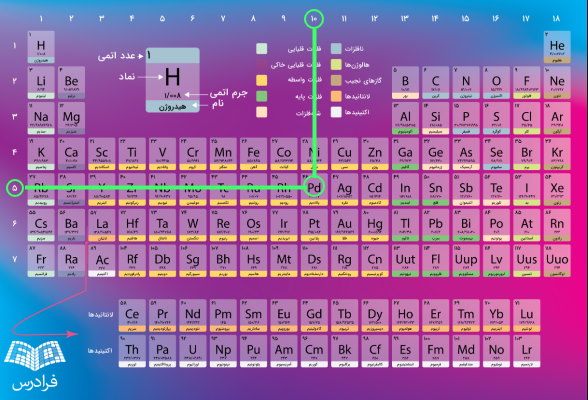
به طور کلی امروزه جدول تناوبی دارای ۱۱۸ عنصر است که از عنصر هیدروژن یعنی سبکترین عنصر شروع و به عنصر شماره ۱۱۸ یعنی اوگانسون (Og) ختم میشود. هر خانه از جدول متعلق به عنصر معینی است که شامل برخی اطلاعات شیمیایی ازجمله موارد زیر است.
- نماد شیمیایی
- عدد اتمی
- نام عنصر
- جرم اتمی
این اطلاعات در تصویر زیر نشان داده شده است.
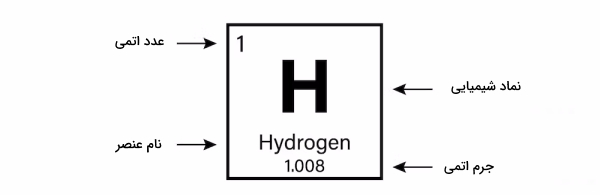
۱. نماد شیمیایی
نماد شیمیایی شامل یک یا دو حرف اول نام انگلیسی عنصر است که همیشه حرف اول با حروف بزرگ نوشته میشود و اگر نماد شیمیایی عنصر شامل دو حرف باشد حرف دوم به صورت کوچک نوشته میشود. به عنوان مثال نماد شیمیایی «O» برای اکسیژن، «Zn» برای روی و «Fe» برای آهن است.
۲. عدد اتمی
به تعداد پروتونهای هسته یک اتم عدد اتمی میگویند و آن را با نماد Z نشان میدهند. برای اتمهایی که خنثی هستند عدد اتمی همان تعداد الکترون هم میتواند باشد زیرا در این حالت تعداد پروتون و الکترون با هم برابر هستند. در صورتی که اتم باردار باشد یا به عبارتی به صورت یون باشد تعداد الکترون در این حالت برابر اختلاف عدد اتمی و بار الکتریکی یون خواهد بود.
با توجه به تصویر پایین و توضیحات فوق عدد اتمی سدیم برابر ۱۱ است. این بدان معناست که اتم سدیم دارای ۱۱ پروتون و ۱۱ الکترون است.

۳. نام عنصر
در قسمت زیرین نماد شیمیایی هر عنصر نامل کامل آن به صورت انگلیسی نوشته شده است.
۴. جرم اتمی
از آنجا که اتمها بسیار ریز هستند نمیتوان به طور دقیق و مستقیم جرم آنها را اندازهگیری کرد. به همین دلیل شیمیدانها برای تعیین جرم اتمها، مقیاس جرم نسبی را استفاده میکنند که یکای جرم اتمی برابر amu و مقدار آن اتم است. همچنین برای توصیف جرم مولی از واحد جرم اتمی استفاده میشود.
نحوه پیدایش انواع عنصرها
جهان هستی ۱۴ میلیارد سال پیش بر اثر پدیدهای به نام انفجار بزرگ یا همان بیگ بنگ بهوجود آمد که در اثر این پدیده عنصرهای سبکی مانند هیدروژن و هلیم و مقدار ناچیزی لیتیوم و برلیوم شکل گرفتند. با کاهش دمای غبار کیهانی و گازهای تشکیل شده از رخداد انفجار بزرگ، ستارهها متولد شدند که از مجموعه ستارهها با هم کهشکشانها بهوجود آمدند. عناصر دیگر موجود در طبیعت در اثر واکنشهای هستهای میان این ستارگان و انفجارهای ستارهای بزرگ به نام ابرنواختر پدید آمدند. مرگ ستارهها با انفجاری بزرگ همراه است که این انفجار سبب میشود عنصرهای تشکیلدهنده آنها در فضا پراکنده شود.
واکنشهای هستهای که در این ستارهها ازجمله خورشید رخ میدهد واکنشهایی است که عنصرهای سنگینتر از عنصرهای سبکتر بهوجود میآیند. جالب است که بدانید دما و اندازه هر ستاره تعیین کننده نوع عنصرها در آن ستاره است. هرچه دمای ستاره بیشتر باشد عنصرهایی که در آن وجود خواهند داشت و در نتیجه بعد از انفجار پخش خواهند شد عنصرهای سنگینتری هستند. به عبارتی میتوان ستارهها منشأ تولید انواع عنصر در طبیعت هستند.

اولین عنصر کشف شده توسط بشر
امروزه در جدول تناوبی ۱۱۸ انواع عنصر وجود دارد که با اختلاف عنصرهایی که در بالا به آنها اشاره شد سایر عناصر یعنی ۲۶ عنصر دیگر ساخته دست بشر هستند و به صورت مصنوعی در آزمایشگاه به وجود میآیند. اولین عنصر ساخت بشر عنصر تکنسیم بود که انقلابی را در شیمی به وجود آورد. این عنصر اولین عنصری بود که در واکنشگاه یا همان راکتور هستهای ساخته شد و امروزه از آن در تصویربرداری پزشکی کاربرد بسیاری دارد.
ایزوتوپ چیست ؟
بررسیها نشان داده است که اتمهای سازنده بعضی از عناصر معین مانند منیزیم جرم یکسانی ندارند و همه اتمهای یک عنصر پایدار نیستند. به عنوان مثال عنصر منیزیم مخلوطی از سه هممکان یا ایزوتوپ است. درواقع ایزوتوپهای یک عنصر عدد اتمی برابری دارند اما عدد جرمیآنها با هم متفاوت است.
از آنجا که عدد جرمی برابر با مجموع پروتون و نوترون است و به دلیل ثابت بودن عدد اتمی اتمهای سازنده یک عنصر میتوان گفت که ایزوتوپها در تعداد نوترون با هم تفاوت دارند. از آنجا که خواص شیمیایی هر عنصر به عدد اتمی بستگی دارد. بنابراین میتوان نتیجه گرفت که ایزوتوپهای یک عنصر خواص شیمیایی یکسانی دارند اما در برخی خواص فیزیکی وابسته به جرم مانند چگالی با هم متفاوت هستند. پایداری یک ایزوتوپ توسط نیمه عمر آن مشخص میشود.
درصد فراوانی انواع عنصر ها در طبیعت
در طبیعت ایزوتوپهای یک عنصر با نسبتهای یکسانی وجود ندارند یعنی درصد فراوانی آنها متفاوت است. محاسبه در صد فراوانی برابر است با حاصل تقسیم تعداد اتمهای یک ایزوتوپ بر تعداد کل اتمها. به عنوان مثال عنصر کلر را در نظر بگیرید که دارای دو ایزوتوپ و است. نسبت این دو ایزوتوپ به هم برابر ۳:۱ است. به این عبارت که به ازای هر ذره سه ذره وجود دارد. یعنی تعداد کل ذرات برابر ۴ است بنابراین درصد فراوانی این دو ایزوتوپ به ترتیب برابر ۲۵ و ۷۵ درصد است.
سوالات متداول در رابطه با انواع عنصر چیست ؟
در این قسمت به سوالات مرتبط با انواع عنصر پاسخ داده شده است.
عنصر چیست ؟
به اجزای سازنده مواد که همگی از یک نوع اتم تشکیل شدهاند و نمیتوانند طی واکنشهای شیمایی به اجزای سادهتری تبدیل شوند عنصر میگویند.
عنصر مولکولی چیست ؟
در صورتی که مولکول از ترکیب دو یا چند اتم مشابه مانند مولکول دو اتمی هیدروژن تشکیل شده باشد به آن عنصر، عنصر مولکولی میگویند.
طبقه بندی انواع عنصر
انواع عنصرها طبق افزایش عدد اتمی در جدول تناوبی طبقه بندی شدهاند که بر اساس آرایش الکترونی به دستههای s، p، d و f تقسیمبندی میشوند.
انواع عنصرها در جدول تناوبی کدامند ؟
عنصرها در جدول تناوبی به سه نوع فلز، نافلز و شبهفلزات تقسیم میشوند. خود فلزات به فلزات اصلی (قلیایی، قلیایی خاکی و پس واسطه) و فلزات واسطه (فلزات واسطه d و فلزات واسطه f) تقسیم میشوند. همچنین نافلزات شامل عناصر کربن،نیتروژن، اکسیژن، فسفر، گوگرد، سلنیوم، هالوژنها و گازهای نجیب هستند. شبهفلزات نیز شامل ۶ عنصر بور، سیلیسیم، ژرمانیوم، آرسنیک، آنتیموان، تلریوم است.













سلام ببخشید یه جایی رو گیج شدم عنصر مولکول رو تشکیل میده یا مولکول عنصر و یا اینکه اینا اصن جدا از همن؟