طیف نشری خطی چیست؟ – کاربردها + فهرست کامل – به زبان ساده
طیف نشری خطی (Emission Line Spectrum) که «طیف اتمی» (Atomic Spectrum) نیز نامیده میشود، خطوطی از طیف نشری است که با عبور پرتوهای نوری گازِ ملتهب از منشور مشخص میشوند. طیف نشری خطی برای عناصر مانند اثر انگشت یک ویژگی منحصربهفرد است. از این ویژٰگی برای آنالیز مواد و شناسایی عناصر استفاده میشود. در این مطلب با مشاهده فهرست کامل طیف نشری خطی عناصر در جدول تناوبی، بیشتر با این مفهوم آشنا می شوید.


طیف نشری خطی چیست؟
وقتی ماده در فاز گازی باشد و به آن انرژی داده شود، با عبور نورهای ساطع شده از منشور، طیف نشری خطی مشاهده میشود. این طیف، نتیجه انتقال الکترونهای اتم آن ماده از سطحی با انرژی بالاتر به سطحهایی با انرژی کمتر است که کاهش سطح انرژی به شکل نور صورت میگیرد. هیچ طیفی نشری خطی دو عنصر مشابه هم نیست. هر عنصر طیف نشری خطی مخصوص به خود را دارد که از این ویژگی برای شناسایی عناصر استفاده میشود. برخی عناصر مانند هلیوم، تالیم و سزیم با روشهای طیفسنجی شناسایی و کشف شدند.
ویلیام ولاستون با منشور رنگینکمان را مشاهده کرد و متوجه خطهایی تیره در آن شد. «فراونهوفر» (Fraunhofer) با گسترش و مشاهده دقیقتر جزئیات رنگینکمان هزاران خط تیره در آن یافت که بعداً به نام «خطوط فراونهوفر» (Fraunhofer Lines) شناخته شدند.


«فراونهوفر» (Fraunhofer) با گسترش و مشاهده دقیقتر جزئیات رنگینکمان هزاران خط تیره در آن یافت که بعداً به نام «خطوط فراونهوفر» (Fraunhofer Lines) شناخته شدند.
برای یادگیری طیف نشری خطی و شکل و پهنا و انواع آن، پیشنهاد میکنیم فیل آموزش رایگان طیف نشری خطی و کاربرد آن در فیزیک و شیمی در فرادرس را تماشا کنید که لینک آن را در کادر زیر آوردهایم.
سری بالمر
«گوستاو کیرشهف» (Gustav Kirchhoff) و «رابرت بونزن» (Robert Bunsen) با قرار دادن مواد شیمیایی گوناگونی روی شعله، خطوط ویژهای برای هر ماده مشاهده کردند که برخی از آنها مطابق با خطوط فراونهوفر بودند.
با گرم کردن گاز هیدروژن و عبور نور تولید شده از منشور خطوط زیر مشاهده میشوند که به سری بالمر شهرت دارند.

اگر از نمونه گاز هیدروژن سرد، نوری مانند نور خورشید عبور داد شود، خطوط سیاه رنگی که به دست میآید در موقعیت سری بالمر هستند، به این خطوط طیف جذبی میگویند.
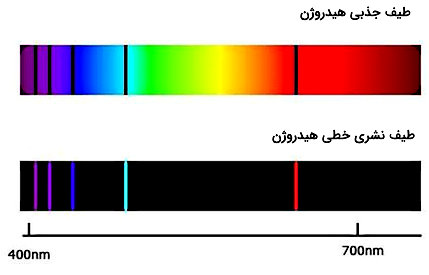
تفاوت این دو مشاهده نشان میدهد که گاز ملتهب خطوط نشری و گاز سرد خطوط جذبی را ایجاد میکنند، در حقیقت خطوطی که هنگام داغ بودن گاز منتشر میشوند، هنگامی که همان گاز در دمای پایینی قرار دارد جذب شده و به شکل خطهایی سیاه در طیف نشری ظاهر میشوند.
برای توضیح خطوط موجود در رنگینکمان نیز میتوان توضیح داد که وقتی نور خورشید از گازهای موجود در جو عبور میکند، پرتوهایی از نور خورشید با طول موجهای معینی پراکنده میشوند و خطوط موجود در رنگینکمان را به وجود میآورند. از این ویژگی که مانند اثر انگشت عناصر شیمیایی است برای شناسایی ترکیبات در فاصلههای بسیار دور مانند دیگر ستارگان استفاده میکنند.
طیف نشری خطی عناصر چگونه تشکیل میشود ؟
با حرارت دادن اجسام، طیف پیوستهای از آن تابش میشود. اما زمانیکه تنها عنصری گرم شود، طیف مشاهده شده از آن متفاوت خواهد بود. وقتی که ولتاژ بالایی بر لوله تخلیه حاویِ گاز هیدروژن با فشار کم اعمال شود، نور قرمزرنگی از آن ساطع خواهد شد. با عبور این نور از منشور به جای طیفی پیوسته از طول موجها، خطوطی با طول موجهای مشخصی مشاهده میشود که به این خطوط، «طیف نشری خطی» (Line Spectrum) گفته میشود.

با تجزیه نور ساطع شده از اتمهای هیدروژن چهار خط نشری با رنگهای بنفش، آبی، سبز و قرمز دیده میشوند. قرمز دیده شدن نور تابشی از گاز هیدروژن به این دلیل است که از بین چهار خط هیدروژن، فوتونهای بیشتری در طول موج ۶۵۶ نانومتر در حال نشر هستند و بهطور مشابه برای طیف خطی سدیم، رنگ زرد دیده میشود.

مشاهده خطوط نشری که فیزیک کلاسیک از توضیح آن ناتوان بود تا حدی با استفاده از معادله پلانک () توضیح داده شد که سطحهای انرژی اتم هیدروژن کوانتیده است و تنها مقادیر مشخصی از انرژی دارد، در غیر این صورت باید خطهایی پیوسته مشاهده میشد. یوهان یاکوب بالمر برای خطوط نشری هیدروژن در ناحیه مرئی رابطهای به دست آورد و آن را به صورت زیر تعریف کرد که در آن است.
پس از او، یوهانس ریدبرگ با گسترش این معادله، رابطه کلی زیر را ارائه کرد که در آن و اعدادی طبیعی بوده و است.
- ، ثابت ریدبرگ:
معادله ریدبرگ علاوه بر محاسبه طول موج خطوط مرئی طیف نشری هیدروژن، سریهای دیگری از خطوط هیدروژن را در ناحیه فرابنفش () و فروسرخ () پیشبینی کرد.
مدل اتمی بور
نیلز بور در نظریه اتمی خود با فرض اینکه الکترون تنها در فضایی ویژه به نام اوربیتال میتواند حضور داشته باشد، طیف نشری هیدروژن را توضیح داد. در این مدل اتمی، الکترون تنها در سطوح انرژی مشخصی قرار گرفته و به دور هسته چرخش میکند.
بور انرژی یک الکترون در مداری معین را به صورت زیر تعریف کرد:
- : ۱، ۲، ۳، ۴، ...
- : ثابت پلانک
- : سرعت نور
- : ثابت ریدبرگ
در معادله بور، ، ثابت ریدبرگ، ، ثابت پلانک و سرعت نور است. n، عددی مثبت و صحیح است که به هر مدار هیدروژن داده شد و عددِ نزدیکترین مدار به هسته است. مربوط به سطحی میشود که اتم یونیزه شده، و الکترون خارج از انرژی جاذبه هسته قرار میگیرد، در این سطح انرژی موثر هسته روی الکترون صفر است. در سطحی که شعاع مدار برابر با است، اتم به شکل یونهای منفی (الکترون) و مثبت (هسته) تفکیک شده است.
در شکل زیر که مدل بور برای اتم هیدروژن نشان داده شده است، با افزایش ، فاصله مدار افزایش و انرژی مدار کاهش پیدا میکند.
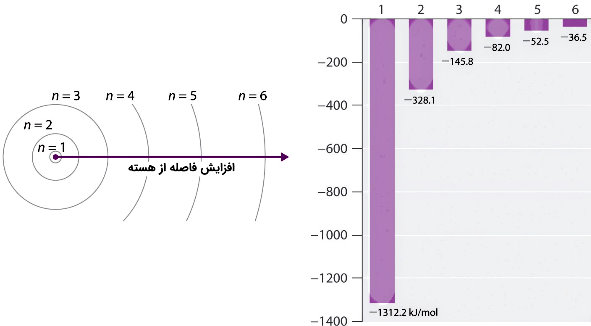
علامت منفی در معادله نشان میدهد، زمانی که الکترون و هسته فاصله کمتری از یکدیگر دارند نسبت به زمانی که فاصله زیاد است، پیوند قویتری بین آنها وجود دارد یا انرژی پتانسیل کمتر است. هرچه مقدار n کاهش یابد، شعاع مدار نیز کمتر میشود و با انرژی بین هسته و الکترون منفیتر شده و برای یونش اتم به انرژی بیشتری نیاز است.
وقتی مدار کمترین انرژی ممکن را دارد و پایدارترین حالت عنصر است که به آن «حالت پایه» (Ground State) گفته میشود. با دور شدن الکترون و افزایش شعاع مدار، عنصر ناپایدارتر و انرژی پتانسیل افزایش پیدا میکند. برای هیدروژن حضور الکترون در هر مداری با حالتی ناپایدار یا «حالت برانگیخته» (Excited State) است و الکترون در این سطحها نسبت به حالت پایه انرژی بیشتری دارد.
بازگشت الکترون در حالت برانگیخته به حالت پایدارتر و پایه با نشر فوتون و از دست دادن انرژی همراه است که این وضعیت در شکل زیر برای سطحهای گوناگون نشان داده شده است.

تفاوت انرژی بین دو سطح حالت از معادله محاسبه میشود. در این معادله سطحی است که الکترون به آن منتقل شده و سطحی است که الکترون در حالت ناپایدارتر است. با جایگذاری در معادله بور روابط زیر به دست میآید.
یعنی انتقال از سطحی با انرژی بیشتر به سطحی با انرژی کمتر صورت گرفته است. با جایگذاری رابطه زیر به دست میآید.
و با حذف از دو طرف معادله، رابطه زیر حاصل میشود.
تنها تفاوت این رابطه با معادله ریدبرگ که به صورت تجربی به دست آمده بود علامت منفی در ان است. علامت منفی در این رابطه نشان دهنده این است که با انتقال الکترون از سطحی با انرژی بیشتر به سطحی پایدارتر که انرژی کمتری دارد، انرژی آزاد میشود و سیستم با کاهش انرژی همراه است. بور با استفاده از ثابتهایی مانند بار و جرم الکترون و ثابت پلانک مقدار را نیز محاسبه کرد و مقدار را به دست آورد که با ثابت ریدبرگ برابر است.
با مقایسه طول موجهای به دست آمده از طیف نشری و اختلاف انرژی سطوح در هیدروژن، این مفهوم قابل درک میشود. در سری بالمر الکترون از حالتهایی با انرژی بالاتر به سطح دوم منتقل میشود و در ناحیه مرئی طیف نشری خطی آن مشاهده میشود. در واقع مقدار انرژی که اتمهای هیدروژن هنگام تخلیه الکتریکی جذب میکنند با نشر فوتون همان مقدار انرژی را آزاد میکنند تا به حالت پیش بازگردند.
انتقالهای الکترون در سطحهای ناپایدار به ترتیب زیر است.
- انتقال به : خط نشری در ۶۵۶ نانومتر (قرمز)
- انتقال به: خط نشری در ۴۸۶ نانومتر (سبز)
- انتقال به : خط نشری در ۴۳۴ نانومتر (آبی)
- انتقال به : خط نشری در ۴۱۰ نانومتر (بنفش)
تعداد اتمها در هر سطح ناپایدار یا برانگیخته میزان شدت تابش هر خط را مشخص میکند. در دمای لوله تخلیه حاوی گاز هیدروژن با فشار کم، بیشترین اتمها در سطح سوم هستند و شدت انتقال از به با رنگ قرمز در طیف نشری خطی از سایر انتقالها بیشتر است. انتقال از سایر سطوح برانگیخته به حالتهای پایدارتر در شکل زیر نشان داده شدهاست.

به جز سری بالمر که در ناحیه مرئی قرار میگیرد، انرژی آزاد شده در سایر انتقالها در دیگر نواحی تابش الکترومغناطیسی رخ میدهد. سری خطوط لیمان در ناحیه فرابنفش و سری پاشن، براکت و فوند در ناحیه فروسرخ تابش دارند.
مثال: مقدار برای انتقال الکترون از سطح ۴ به ۳ را محاسبه کنید.
پاسخ: در اینجا برای به دست آوردن از رابطه زیر استفاده میشود.
که در آن و است. برای انتقال به خواهیم داشت.
مدل بور تنها طیف نشری گونههایی شبیه به هیدروژن مانند که تنها یک الکترون دارند را توضیح میدهد و برای سایر عناصر پاسخی ندارد.
کاربرد طیف نشری خطی چیست ؟
این ویژگی اتمها در دو روش طیفسنجی زیر برای تعیین کمی و همچنین غلظت یک عنصر خاص در نمونه کاربرد دارد که از «قانون بیر-لامبرت» (Beer-Lambert law) برای ارتباط جذب و غلظتِ آنالیت مورد نظر استفاده میشود.
- «طیفبینی جذب اتمی» (Atomic Absorption Spectroscopy | AAS)
- «طیفبینی نشر اتمی» (Atomic Emission Spectroscopy | AES)
از این روشها در پژوهشهای «داروشناسی» (Pharmacology)، بیوفیزیک، باستانشناسی و سمشناسی بهره میگیرند. طیفبینی جذب اتمی در زمینههای گوناگون شیمی مانند آنالیز بالینی فلزات در مایعات و آنالیز کمی و کیفی در بافتهای زیستی بدن کاربرد دارد.

این خطوط به دما و چگالی مواد نیز وابسته است. در اخترشناسی با استفاده از دانش اخترشیمی برای تعیین شرایط فیزیکی ستارگان و اجرام آسمانی از این ویژگی استفاده میکنند. میزان انرژی فوتونهای گسیل شده نیز به نوع و شرایط ماده بستگی دارد.
فهرست طیف نشری خطی عناصر
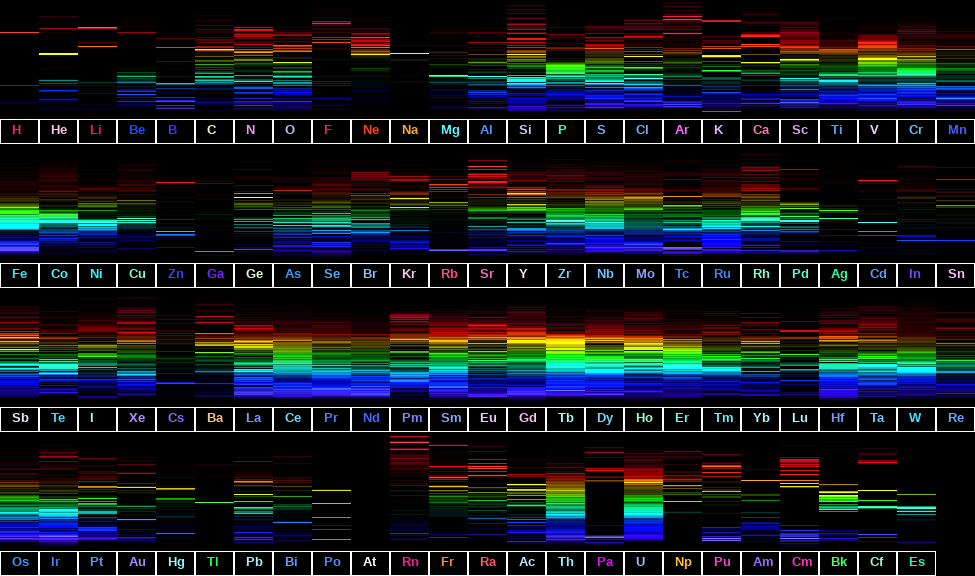
در زیر طیف نشری خطی عناصر در جدول تناوبی فهرست شده است. باید توجه داشته باشید که برخی از عناصر تابشهایی خارج از ناحیه مرئی دارند و قابل مشاهده نیستند.
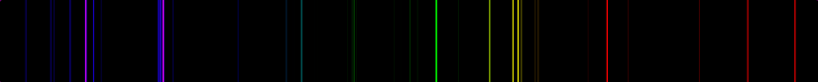
طیف نشری خطی جیوه
جیوه با 80 الکترون در گروه ۱2 جدول تناوبی قرار دارد.
طیف نشری خطی سدیم
سدیم با ۱۱ الکترون در گروه ۱ جدول تناوبی قرار دارد.

طیف نشری خطی هلیم
هلیوم با ۲ الکترون در گروه ۱۸ جدول تناوبی قرار دارد.

طیف نشری خطی نئون
نئون با 10 الکترون در گروه ۱8 جدول تناوبی قرار دارد.

طیف نشری خطی عناصر هم گروه
طیف نشری برخی از گروه عناصر از جمله گازهای نجیب (گروه ۱۸)، هالوژنها (گروه ۱۷) و فلزهای قلیایی (گروه ۱) در زیر آورده شده است.
گازهای نجیب
گاز نجیبهای نجیب در گروه ۱۸ جدول تناوبی قرار دارند و شامل عناصر هلیوم ، نئون ، آرگون ، کریپتون ، زنون و رادون میشوند. این عناصر واکنشپذیری بسیار کمی دارند.

هالوژنها
گروه ۱۷ جدول تناوبی با نام هالوژنها شناخته میشوند و شامل عناصر فلوئور ، کلر ، برم ، ید و استاتین هستند. واکنش هالوژن با فلزات منجر به تولید نمکهای مختلف میشود. طیف استاتین ناحیه فرابنفش است.
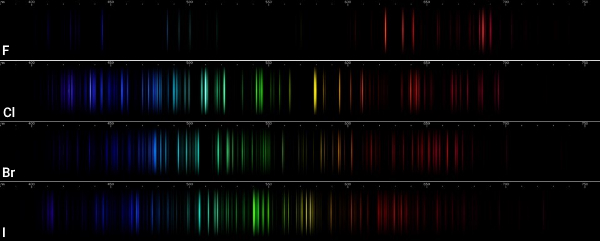
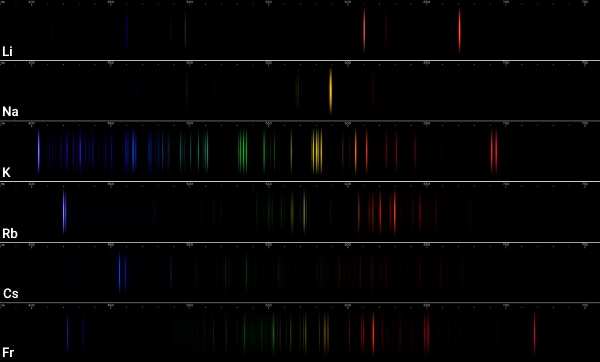
فلزهای قلیایی
فلزات قلیایی در گروه ۱ جدول تناوبی قرار دارند و شامل عنصرهای لیتیم ، سدیم ، پتاسیم ، روبیدیم ، سزیم ، و فرانسیم میشوند. فلزات قلیایی عناصری بسیار واکنشپذیر و درخشانی هستند که به صورت آزاد در طبیعت یافت نمیشوند.
سوالات متداول
به برخی از پرسشهای رایج در مورد این مطلب در زیر پاسخ داده شده است.
طیف نشری خطی چگونه ایجاد میشود؟
وقتی به بخار عناصر یا ترکیبات شیمیایی انرژی داده میشود و آن را ملتهب میسازد، نوری از خود ساطع میکنند. با عبور این نور از منشور، نور تجزیه میشود و طیف نشری خطی آن عنصر تشکیل میشود.
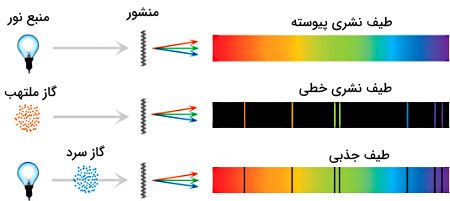
تفاوت طیف نشری و جذبی چیست؟
- وقتی پرتو منبع نور توسط منشور تجزیه شود، طیف نشری تشکیل میشود.
- اگر عنصر یا ترکیب با گرفتن انرژی در حالت بخار بسیار داغ شود و از خود نور ساطع کند و آن نور توسط منشور تجزیه شود، طیف تشکیل شده به صورت نشری خطی خواهد بود.
- اگر پرتو نور از بخار سرد عنصر یا ترکیب عبور داده شده و سپس توسط منشور تجزیه شود، قسمتی از پرتو نور توسط اتمهای عنصر جذب میشود و به شکل خطوطی سیاهرنگ در طیف نمایش داده میشوند. در این حالت طیف جذبی تشکیل میشود.
دلیل اهمیت طیف های نشری چیست؟
به دلیل منحصر بودن طیف نشری برای هر عنصر، از این ویژگی میتوان برای شناسایی عناصر استفاده کرد.
چرا طیف نشری خطی هر عنصر متفاوت است ؟
طیف نشری خطی نتیجه انتقال الکترونهای برانگیخته عناصر به سطحهای پایدارتر است و چون هر عنصر ساختار الکترونی متفاوتی دارد، پس طیف نشری خطی متفاوتی هم ایجاد میکنند.
فهرست طیف نوری عناصر
در زیر فهرست خطوط طیف نوری عناصر به ترتیب عدد اتمی آورده شده است. این خطوط در ناحیه مرئي در گستره ۴۰۰–۷۰۰ نانومتر هستند. طیف نوری، خطوط روشن روی طیف پیوسته عناصر هستند.
| طیف نوری عناصر | ||
|---|---|---|
| Z | عنصر | خط طیف نوری |
| ۱ | هیدروژن |
|
| ۲ | هلیوم |
|
| ۳ | لیتیم |
|
| ۴ | بریلیم |
|
| ۵ | بور |
|
| ۶ | کربن |
|
| ۷ | نیتروژن |
|
| ۸ | اکسیژن |
|
| ۹ | فلوئور |
|
| ۱۰ | نئون |
|
| ۱۱ | سدیم |
|
| ۱۲ | منیزیم |
|
| ۱۳ | آلومینیم |
|
| ۱۴ | سیلیسیم |
|
| ۱۵ | فسفر |
|
| ۱۶ | گوگرد |
|
| ۱۷ | کلر |
|
| ۱۸ | آرگون |
|
| ۱۹ | پتاسیم |
|
| ۲۰ | کلسیم |
|
| ۲۱ | اسکاندیم |
|
| ۲۲ | تیتانیم |
|
| ۲۳ | وانادیم |
|
| ۲۴ | کروم |
|
| ۲۵ | منگنز |
|
| ۲۶ | آهن |
|
| ۲۷ | کبالت |
|
| ۲۸ | نیکل |
|
| ۲۹ | مس |
|
| ۳۰ | روی |
|
| ۳۱ | گالیم |
|
| ۳۲ | ژرمانیم |
|
| ۳۳ | آرسنیک |
|
| ۳۴ | سلنیم |
|
| ۳۵ | برم |
|
| ۳۶ | کریپتون |
|
| ۳۷ | روبیدیم |
|
| ۳۸ | استرانسیم |
|
| ۳۹ | ایتریم |
|
| ۴۰ | زیرکونیم |
|
| ۴۱ | نیوبیم |
|
| ۴۲ | مولیبدن |
|
| ۴۳ | تکنسیم |
|
| ۴۴ | روتنیم |
|
| ۴۵ | رودیم |
|
| ۴۶ | پالادیم |
|
| ۴۷ | نقره |
|
| ۴۸ | کادمیم |
|
| ۴۹ | ایندیم |
|
| ۵۰ | قلع |
|
| ۵۱ | آنتیموان |
|
| ۵۲ | تلوریم |
|
| ۵۳ | ید |
|
| ۵۴ | زنون |
|
| ۵۵ | سزیم |
|
| ۵۶ | باریم |
|
| ۵۷ | لانتان |
|
| ۵۸ | سریم |
|
| ۵۹ | پرازئودیمیم |
|
| ۶۰ | نئودیمیم |
|
| ۶۱ | پرومتیم |
|
| ۶۲ | ساماریم |
|
| ۶۳ | یوروپیم |
|
| ۶۴ | گادولینیم |
|
| ۶۵ | تربیم |
|
| ۶۶ | دیسپروزیم |
|
| ۶۷ | هولمیم |
|
| ۶۸ | اربیوم |
|
| ۶۹ | تولیم |
|
| ۷۰ | ایتربیم |
|
| ۷۱ | لوتتیم |
|
| ۷۲ | هافنیم |
|
| ۷۳ | تانتالم |
|
| ۷۴ | تنگستن |
|
| ۷۵ | رنیم |
|
| ۷۶ | اسمیم |
|
| ۷۷ | ایریدیم |
|
| ۷۸ | پلاتین |
|
| ۸۹ | طلا |
|
| ۸۰ | جیوه | - |
| ۸۱ | تالیم |
|
| ۸۲ | سرب |
|
| ۸۳ | بیسموت |
|
| ۸۴ | پولونیم |
|
| ۸۵ | استاتین | - |
| ۸۶ | رادون |
|
| ۸۷ | فرانسیم | - |
| ۸۸ | رادیم |
|
| ۸۹ | اکتینیم |
|
| ۹۰ | توریم |
|
| ۹۱ | پروتاکتینیم |
|
| ۹۲ | اورانیم |
|
| ۹۳ | نپتونیم |
|
| ۹۴ | پلوتونیم |
|
| ۹۵ | امریسیم |
|
| ۹۶ | کوریم |
|
| ۹۷ | برکلیم |
|
| ۹۸ | کالیفرنیم |
|
| ۹۹ | اینشتینیم |
|













































































































سلام چرا تو کتاب گفته که عنصر باید گاز باشه برای داد و ستد انرژی
با سلام؛
در مواد جامد و مایع تفاوت بین سطوح مختلف انرژی بسیار کوچک است زیرا ابرهای الکترونی چندین اتم در یک فضای بسیار نزدیک به یکدیگر قرار گرفتهاند. این نزدیک بودن سطوح انرژی باعث میشود خطوط نشری حاصل از آنها قابل تشخیص و تمییز نباشند.
در مورد گازها، اتمها به اندازهای از یکدیگر فاصله دارند که برهمکنش بین اتمهای مختلف به حداقل میرسد و این پدیده باعث میشود سطوح انرژی به اندازه کافی از هم فاصله داشته باشند و برای هر تک اتم، طیف نشری با خطوط واضح به دست میآید.
با تشکر از همراهی شما با مجله فرادرس
با سلام ممنون بابت اطلاعات مفید آیا بین نشر و طیف نشری خطی یک عنصر تفاوت وجود دارد ؟ به عبارتی با ادراک بنده نشر شامل تمام پرتوهای گسیل شده منجمله مریی و غیر مریی هست و طیف نشری خطی یک عنصر فقط محدوده مریی را شامل میشود. آیا این تصور درست هست ؟