انحلال پذیری مواد در شیمی – از صفر تا صد
انحلالپذیری به مقدار حداکثر ماده حلشوندهای گفته میشود که در شرایطی خاص در مقدار مشخصی حلال حل میشود. انحلالپذیری یکی از مفاهیم مهم در تهیه محلولها و بررسی واکنشهای شیمیایی است. در این مطلب از مجله فرادرس میآموزیم انحلال پذیری چیست، با چه عواملی تغییر میکند و انواع محلول کدامند.
- میآموزید انحلالپذیری چیست و چگونه تعیین میشود.
- با اثر دما بر انحلالپذیری مایعات، جامدات و گازها آشنا میشوید.
- تاثیر تغییرات فشار را بر مقدار انحلالپذیری گازها بررسی میکنید.
- با مفاهیم سرعت انحلالپذیری و قطبیت در انحلالپذیری آشنا میشوید.
- کاربردهای مختلف مفهوم انحلالپذیری را میآموزید.
- با مفاهیم محلول جامد و انحلال ناهمسان آشنا میشوید.


انحلال پذیری چیست؟
«انحلال پذیری» (Solubility) یک حلشونده در یک حلال خاص را به صورت حداکثر غلظت حلشونده تحت شرایط مشخص تعریف میکنند که در این حالت، فرآیند انحلال به صورت تعادلی است. برای مثال، تصور کنید مقدار کمی از نمک را در لیوانی پر از آب بریزید و آن را تا حل شدن کامل نمک هم بزنید و این کار را تکرار کنید.
میتوانید عمل همزدن را تا زمانی که غلظت نمک در محلول به حداکثر خود برسد انجام دهید. در حقیقت برای حل شدن نمک در آب، محدودیتی وجود دارد. این محدودیت به قدرت نیروهای جاذبه میان مواد وابسته است. با حل کردن نمک در آب و همزدن بیشتر، هیچ نمک اضافی در آب حل نخواهد شد. غلظت نمک محلول را در این حالت با عبارتی موسوم به انحلال پذیری میشناسند.
با مراجعه به مثال انحلال نمک در آب، خواهیم داشت:
انواع محلول
بنابر مقدار انحلالپذیری مواد میتوان محلولهای اشباع، سیر نشده و فوق اشباع تولید کرد. همچنین، محلولها را میتوان به دو دسته رقیق و غلیظ نیز تقسیم کرد. در ادامه هر یک از این موارد را بررسی میکنیم.
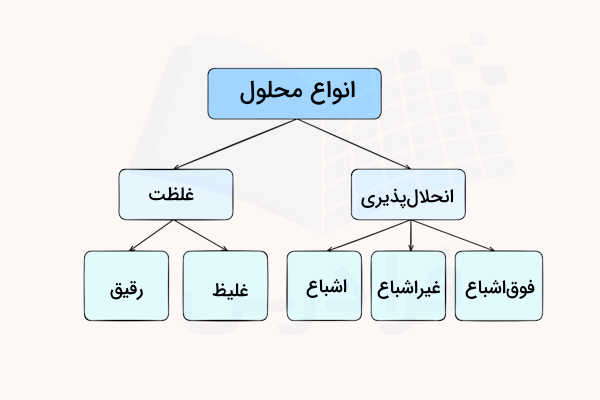
محلول رقیق و غلیظ
زمانی که غلظت ماده حلشونده در محلول بسیار کم باشد، محلول مورد نظر را «رقیق» (Dilute) مینامند و در مقابل، محلولی که غلظت حلشونده در آن زیاد باشد، محلول «غلیظ» (Concentrated) نام دارد.
محلول اشباع، غیر اشباع و فوق اشباع
زمانی که غلظت یک حلشونده در محلول با انحلال پذیری آن برابر باشد، محلول را «اشباع» (Saturated) مینامند. اگر غلظت حلشونده، کمتر از میزان انحلالپذیری آن باشد، به محلول حاصل، «غیراشباع» (Unsaturated) میگویند. لازم به ذکر است که از واژههای سیرشده و سیرنشده نیز برای بیان محلولهای اشباع و غیراشباع استفاده میشود.
در برخی موارد، آمادهسازی محلولها به گونهای است که مقدار ماده حلشونده، بیش از میزان انحلال پذیری آن است. به این نوع از محلولها «فوق اشباع» (Supersaturated) میگویند. از این خاصیت در نوشابههای گازدار استفاده میکنند. گاز دیاکسید کربن به حالت فوق اشباع قرار دارد که بعد از گذشتن زمان، غلظت آن در بطری به حال تعادل میرسد.
انحلال پذیری و تعادل شیمیایی
اگر به محلولی که از نمک اشباع شده است، دوباره نمک اضافه کنیم، خواهیم دید که ذرات نمک در پایین ظرف تهنشین میشوند و هیچ انحلالی صورت نمیگیرد. اگر بخواهیم این حالت را دقیقتر توصیف کنیم باید بگوییم که در حقیقت، با توجه به معادله واکنش، این نمک در آب حل میشود و همزمان، نمک حل شده با توجه به واکنش تعادلی بالا، در کف ظرف رسوب میکند.
به این سیستم که در آن، واکنشها به صورت دوطرفه، همزمان و با سرعت یکسان اتفاق میافتند، سیستم در حال تعادل میگویند که به تبع آن، نمکهایی که به طور همزمان حل میشوند و رسوب میکنند، مقدار برابری دارند. در حقیقت، انحلال و رسوب نمک به طور همزمان اتفاق میافتد. گواهی بر این مدعا، تعداد و اندازه بلورهای نمک حلنشده است که در طول زمان تغییر میکند اما جرم کلی آن ثابت است. برای توضیح این نوع از واکنشهای تعادلی میتوان از اصل لوشاتلیه کمک گرفت که از طریق آن، عوامل موثر بر انحلال پذیری مواد را میتوان تجزیه و تحلیل کرد.
تاثیر برهمکنش مواد بر حلشوندگی
ساختار شیمیایی حلشونده و حلال، نوع نیروهای جاذبه در محلول را تعیین میکند و همین امر، عامل مهمی است که به کمک آن، انحلال پذیری مواد مشخص میشود. به طور مثال، تحت شرایط یکسان، انحلالپذیری اکسیژن در آب، سه برابر بیشتر از هلیوم است. درحالیکه که انحلال پذیری اکسیژن در مقابل کلرومتان با فرمول ، بسیار ناچیز و در حدود ۱۰۰ برابر کمتر ذکر میشود.
همانطور که گفته شد، رابطه بین حلشونده و حلال در تعیین حلشوندگی یک محلول بسیار موثر است. هرقدر برهمکنشهای بین حلال و حلشونده شدیدتر باشند، میزان انحلالپذیری بیشتر خواهد بود. درحقیقت، حلشوندههای قطبی به خوبی در حلالهای قطبی حل میشوند و به همین صورت، حلالهای ناقطبی، مواد ناقطبی را در خود حل میکنند. به عنوان یک قانون کلی میتوان گفت: شبیه، شبیه را در خود حل میکند.

اثر یون مشترک
اگر به یک ترکیب یونی، نمکی اضافه کنیم که یون موجود در آن با یون ترکیب مشترک باشد، انحلال پذیری حلشونده کاهش پیدا میکند. به این اثر، اثر یون مشترک گفته میشود. تصور کنید که ترکیب کلسیم سولفات با فرمول را به آب اضافه کنیم. معادله تفکیک یونی آن به صورت زیر خواهد بود:
کلسیم سولفات انحلالپذیری کمی در آب دارد و در محلول، بیشتر به شکل جامد دیده میشود. حال در نظر بگیرید که به این محلول، اضافه کنیم که معادله تفکیک آن به صورت زیر خواهد بود:
بین این دو ماده محلول، یون سولفات مشترک است و همانطور که دیدیم، یون سولفات از قبل در آب حلشده است. با اضافه کردن مجدد یون سولفات، یک تغییر (تنش) در سیستم ایجاد میشود که با توجه به اصل لوشاتلیه، سیستم در جهت مقابله با این تنش عمل میکند و در نتیجه، انحلال پذیری یون سولفات باز هم کمتر میشود. به این پدیده، «اثر یون مشترک» (Common-ion Effect) میگویند.
تاثیر دما بر انحلال پذیری
اثر دما بر انحلال پذیری جامدات، مایعات و گازها تاثیر متفاوتی دارد. البته در نهایت، این تاثیرات را میتوان تنها در گازها و جامدات تعیین کرد. افزایش دما در واکنشهای گرماگیر، موجب افزایش حلشوندگی جامدات میشود. افزایش دما در واکنشهای گرماده، موجب کاهش حلشوندگی جامدات خواهد شد.
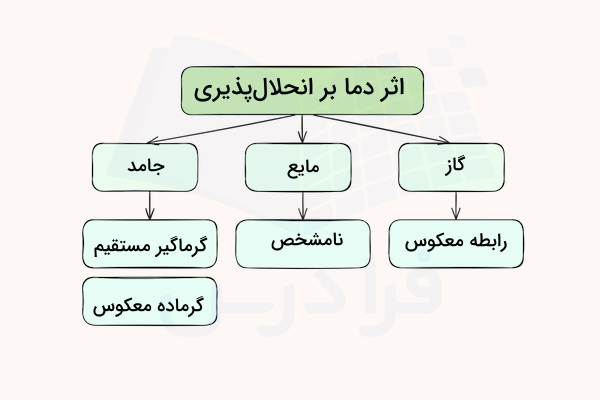
در مایعات، هیچ روند مشخصی برای تاثیر دما بر انحلال پذیری مشخص نشده است.
اثر دما بر انحلال پذیری جامدات
تاثیر دما بر انحلال پذیری جامدات، به گرماده یا گرماگیر بودن واکنش وابسته است. با استفاده از اصل لوشاتلیه میتوان این تاثیرات را بیان کرد:
واکنشی گرماگیر را در نظر بگیرید. افزایش دما موجب ایجاد تنش و تغییر در واکنشدهندهها خواهد شد و در نتیجه، سیستم در جهت مقابله با آن تغییر میکند و بنابراین، پیشرفت واکنش به سمت تولید فرآورده خواهد بود. با پیشرفت واکنش به سمت راست (تولید فرآورده) و ایجاد تعادل جدید، جامدات بیشتری در حلال حل خواهند شد و در نتیجه، افزایش دما در واکنشهای گرماگیر، موجب افزایش حلشوندگی جامدات میشود.
اگر واکنش، گرماده باشد، با افزایش دما، بر طبق اصل لوشاتلیه، سیستم برای مقابله با افزایش دمای ایجاد شده، واکنش را به سمت واکنشدهندهها پیش میبرد که در نتیجه آن، جامدات کمتری در حلال، حل خواهند شد. بنابراین، افزایش دما در واکنشهای گرماده، موجب کاهش حلشوندگی جامدات خواهد شد.
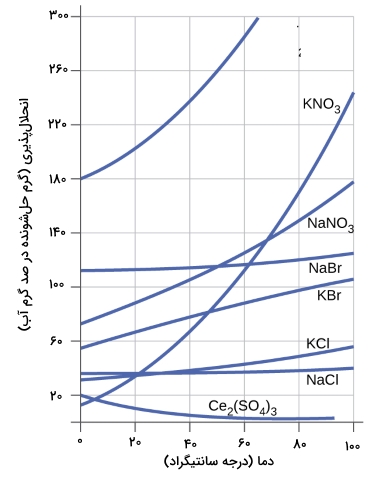
در جدول زیر، وابستگی انحلال پذیری به دما برای انحلال تعدادی از جامدهای غیرآلی (معدنی) در آب نشان داده شده است. مشاهده این جدول، یک روند کلی را نشان میدهد که با افزایش دما، حلشوندگی افزایش مییابد. البته این روند برای همه مواد صدق نمیکند.
از خاصیت انحلال پذیری جامدات در ساخت بستههای گرمکننده بهره میگیرند. تصویر زیر، یکی از این بستهها را نشان میدهد. زمانی که یک شوک مانند تکان یا ضربه به این بسته وارد شود، سدیم استات در محلول فوق اشباع رسوب و گرما آزاد میکند.

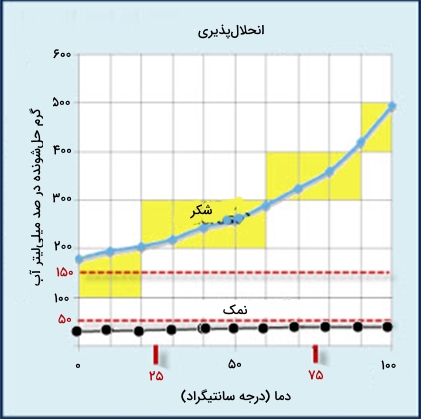
انحلال پذیری نمک در آب
با توجه به نمودار بالا میتوان دریافت که انحلال پذیری نمک در آب، با افزایش یا کاهش دما، تغییر چندانی نمیکند.
انحلال پذیری شکر در آب
با توجه به نمودار زیر، انحلال پذیری شکر در آب با افزایش دما، افزایش مییابد.
مایعات
در خصوص مایعات، هیچ روند مشخصی برای تاثیر دما بر انحلال پذیری این مواد تعریف نشده است.
گازها
به منظور فهم هرچه بهتر تاثیر دما بر حلالپذیری گازها، باید این نکته را مد نظر قرار دهیم که دما، معیاری از متوسط انرژی جنبشی است. با افزایش دما، انرژی جنبشی (سینتیک) افزایش مییابد. هر قدر انرژی جنبشی بیشتر باشد، حرکت مولکولی ذرات گاز نیز بیشتر خواهد بود. در نتیجه، ذرات گاز محلول در مایع، تمایل بیشتری برای خروج از آن دارند و ذرات نامحلول نیز کمتر در مایع حل خواهند شد. به همین صورت، کاهش دما و کاهش انرژی جنبشی نیز، نتیجهای عکس دارد. در نتیجه، انحلال پذیری گازها با افزایش دما، کاهش و با کاهش دما، افزایش مییابد.
به طور مجدد با بررسی اصل لوشاتلیه، فهم بهتری از این موضوع پیدا خواهیم کرد. ابتدا باید به این نکته توجه کنید که فرآیند انحلال گاز در مایع به طور معمول گرماده است. در نتیجه، با توجه به توضیحات قبل میتوان دریافت که افزایش دما موجب ایجاد تنش در بخش فرآوردهها میشود و بر طبق این اصل، پیشرفت واکنش به سمت تولید واکنشدهندهها خواهد بود که در نتیجه این امر، حلشوندگی گاز کاهش پیدا میکند.
به طور عکس، کاهش دما سبب ایجاد تنش در بخش واکنشدهندها می شود چراکه با توجه به گرماده بودن واکنش، حرارت در بخش فرآوردهها قرار دارد. بر طبق اصل لوشاتلیه، سیستم جهت مقابله با این کاهش دما، واکنش را به طرف تولید فرآوردهها پیش خواهد برد. در نتیجه، کاهش دما موجب افزایش انحلالپذیری گازها میشود. ارتباط حلشوندگی گازها با دما، علت اصلی آلودگی آبها به شمار میآید. در نمودار زیر، میزان حلشوندگی گازها در آب، در برابر تغییرات دما نشان داده شده است:
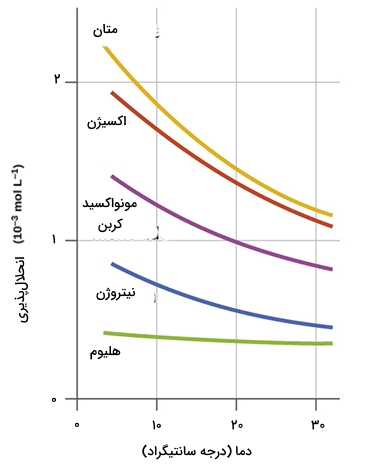
زمانی که دمای یک رودخانه، دریاچه یا جریانهای آبی به طور ناگهانی افزایش پیدا کند، میزان انحلال پذیری اکسیژن در آب کاهش پیدا میکند. این افزایش دما ممکن است به دلیل تخلیه آبهای گرم حاصل از فرآیندهای صنعتی رخ دهد. کاهش اکسیژن محلول در آب، خطرات بسیاری را برای موجودات زنده خواهد داشت که در برخی شرایط، موجب کشته شدن دستهجمعی ماهیها میشود.
تاثیر فشار بر انحلال پذیری گازها
تغییرات فشار، تنها بر انحلال پذیری گازها تاثیر دارد و این تغییر برای جامدات و مایعات بسیار ناچیز و قابل صرفنظر کردن است. تاثیر فشار بر انحلال گازها در مایعات را میتوان از طریق ترکیب «قانون هنری» (Henry's Law) و اصل لوشاتلیه بیان کرد. قانون هنری بیان میکند که در دمای ثابت، انحلال پذیری گازها بر اساس فشار جزئی آنها تغییر میکند که رابطه آن به صورت زیر است:
در رابطه بالا:
- : فشار جزئی گاز بالای مایع
- : ثابت قانون هنری
- : غلظت گاز در مایع
با نگاهی دقیقتر به رابطه بالا متوجه خواهیم شد که بر اساس قانون هنری، با کاهش فشار جزئی، غلظت گاز در مایع و به تبع آن انحلال پذیری نیز کاهش پیدا میکند. در نتیجه، مفاهیم اصل لوشاتلیه و قانون هنری به پیشبینی تاثیرات فشار بر حلالپذیری گازها کمک بسیاری خواهند کرد.
سیستمی را در نظر بگیرید که گاز به طور جزئی در مایع حل شده باشد. افزایش فشار موجب افزایش فشار جزئی میشود زیرا گاز در حال فشرده شدن است. افزایش فشار جزئی این معنی را میدهد که ذرات بیشتری از گاز، وارد مایع خواهند شد که بر طبق اصل لوشاتلیه، این افزایش حلشوندگی به جهت مقابله با افزایش فشار جزئی صورت میگیرد. به عکس، یک کاهش فشار برابر با افزایش ذرات در فاز گاز میشود.
مثال ۱
واکنش گرماده زیر را در نظر بگیرید:
چه اتفاقی برای انحلالپذیری دیاکسید کربن خواهد افتاد اگر:
- دما افزایش پیدا کند؟
- فشار و دما افزایش پیدا کنند؟
- فشار افزایش اما دما کاهش پیدا کند؟
- فشار افزایش پیدا کند؟
پاسخ
- با توجه به اینکه واکنش، گرماده است، افزایش دما موجب کاهش حلشوندگی میشود.
- تغییرات حلشوندگی با اطلاعات داده شده قابل پیشبینین نیست چراکه افزایش فشار، افزاش حلشوندگی را به همراه دارد و افزایش دما سبب کاهش انحلالپذیری گاز خواهد بود.
- با افزایش فشار و دما در این واکنش، انحلال پذیری افزایش پیدا میکند.
- افزایش فشار سبب میشود تا ذرات بیشتری از گاز وارد مایع شوند تا بر طبق اصل لوشاتلیه، فشار جزئی کاهش پیدا کند. در نتیجه انحلالپذیری افزایش مییابد.
مثال ۲
شغل یک شخص در رابطه با خالصسازی ترکیبات نقره و استخراج این فلزِ با ارزش است. در این شغل، صرفهجویی حرف اول را میزند. روزی او یک بشکه حاوی محلول اشباع نقره کلرید پیدا میکند. این شخص در حال حاضر یک بطری آب، یک شیشه نمک و یک شیشه سرکه همراه خود دارد. اگر او راهی پیدا کند که انحلالپذیری نقره کلرید را کاهش بدهد، میتواند در استخراج این فلز نقش مهمی داشته باشد؟ به نظر شما کدامیک از مواد را به این محلول اضافه کند تا رسوب نقره کلرید بیشتری بدست آورد؟
پاسخ
این شخص باید به محلول، نمک اضافه کند. بر اساس اثر یون مشترک، یونهای اضافی ، موجب کاهش انحلال پذیری نقره کلرید و به تبع آن افزایش مقدار نقره کلرید جامد خواهند بود.
مثال ۳
اگر شما شخصی بودید که یک کارخانه نوشابه گازدار داشتید، چه راهی را برای افزایش گاز موجود در نوشابههای کارخانه خود پیشنهاد میکردید؟
پاسخ
بهترین راه برای افزایش میزان گاز دیاکسید کربن در نوشابهها، افزایش فشار و کاهش دما است.

مثال ۴
شخصی برای افزایش حلشوندگی یک جامد در آب، شروع به هم زدن آن میکند. این کار چقدر به افزایش حلشوندگی کمک خواهد کرد؟
پاسخ
همزدن، تنها در سرعتِ به تعادل رسیدن یک سیستم اثرگذار است و تاثیری بر میزان حلشوندگی نخواهد داشت.
سرعت انحلال پذیری
انحلال، یک فرآیند خود به خودی نیست. سرعت «حلالپذیری» (Solubilization)، به برهمکنش نیروها و سطح ماده بستگی دارد. سرعتی که یک جامد ممکن است انحلال پیدا کند به عوامل مختلفی اعم از «بلورینگی» (Crystallinity) یا آمورف بودن، اندازه بلور (سطح بلور) و وجود «چند ریختی» (Polymorphism) بستگی دارد.
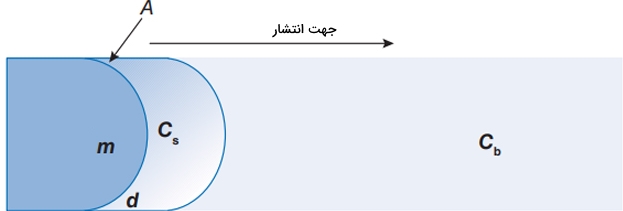
بررسی این عوامل کاربردهای عملی بسیاری دارد که از نمونههای آن میتوان به طراحی روشهایی کنترلشده برای «دارورسانی» (Drug Delivery) اشاره کرد. سرعت انحلال را میتوان به کمک «رابطه نویز-ویتنی» (Noyes–Whitney Equation) بیان کرد که به صورت زیر نوشته میشود:
در رابطه بالا:
- : جرم ماده حلشده
- : زمان
- : مساحت مرز بین حلشونده و حلال
- : ضریب انتشار
- : ضخامت لایه مرزی بین حلال و سطح ماده حلشونده
- : غلظت جرمی ماده در سطح
- : غلظت جرمی ماده در «توده» (Bulk) حلال
برای انحلالی که با «انتشار» (Diffusion)، محدود شده باشد، با انحلال پذیری ماده برابر است. سرعت انحلال در سیستمهای مختلف با یکدیگر تفاوت دارند. به طور معمول و بر اساس رابطه نویز-ویتنی، سرعت پایین انحلال با انحلال پذیری کم همراه است و مواد با انحلال پذیری زیاد، سرعت انحلال بالایی نیز دارند.
انحلالپذیری از نگاه مولکولی
انحلالپذیری تحت شرایط «تعادل پویا» (Dynamic Equilibrium) اتفاق میافتد که بدان معنی است که انحلالپذیری، نتیجه فرآیندهای همزمان و متضاد «انحلال» (Dissolution) و «رسوب» (Phase Joining) است. در حقیقت، تعادل در انحلالپذیری زمانی اتفاق میافتد که این دو فرآیند به طور همزمان و با سرعت ثابت انجام شوند.
واژه انحلالپذیری همچنین در مواردی استفاده میشود که حلشونده طی فرآیندی موسوم به «حلال کافت» (Solovolysis) تغییر پیدا میکند. به طور مثال، بسیاری از فلزات و اکسیدهای آنها در هیدروکلریک اسید حلالپذیراند، درحالیکه محلولهای اسیدی به طور برگشتناپذیری جامدات را در خود حل میکنند. همچنین بسیاری از جامدات یونی در حلالهای قطبی حل میشوند، اما این فرآیندها برگشتپذیر هستند. در مواردی که حلشونده را نتوان از طریق تبخیر، مجددا بدست آورد، فرآیند مورد نظر را حلالکافت مینامند. مفهوم ترمودینامیکی انحلالپذیری را نمیتوان بهراحتی در خصوص حلالکافت نیز بکار برد.
در زمان انحلال یک حلشونده، ذرات مختلفی در محلول تشکیل خواهند شد. به طور مثال، سوسپانسیون فروس هیدروکسید با فرمول ، میتواند علاوه بر ذرات مختلف، شامل ترکیباتی به صورت زیر نیز باشد:
علاوه بر این، حلالپذیری فروس هیدروکسید و همچنین ترکیبات ذرات محلول به pH بستگی دارد. به طور کلی، انحلالپذیری در فاز یک حلال را تنها میتوان به حلشوندهای خاص نسبت داد که به لحاظ ترمودینامیکی پایدار باشد و این مقدار انحلالپذیری، شامل همه ذرات محلول میشود.
قطبیت در انحلالپذیری
همانطور که در ابتدای نوشته نیز گفته شد، جهت پیشبینی حلشوندگی مواد میتوان از عبارت «شبیه، شبیه را در خود حل میکند» (Like Dissolves Like) استفاده کرد. این عبارت بیان میکند که یک حلشونده در حلالی به خوبی حل میشود که ساختار شیمیایی مشابهی با آن داشته باشد. در حقیقت، این یک قانون سرانگشتی برای پیشبینی حلشوندگی است. ظرفیت کلی انحلال یک حلال، به طور مستقیم به قطبیت آن بستگی دارد.
به طور مثال، یک حلشونده به شدت قطبی همچون اوره با فرمول به شدت در آب حلالپذیر است چراکه آب یک ترکیب قطبی به شمار میآید اما همین ترکیب در متانول، انحلالپذیری کمی دارد و در بنزن حل نمیشود. در مقابل، نفتالین، یک ترکیب ناقطبی و در آب نامحلول است.
به بیان سادهتر، کافی است ترکیبات یونی ماند سدیم کلرید را در نظر بگیریم. این ترکیب یونی، به راحتی در حلالهای به شدت قطبی همچون آب، حلالپذیر است. شوری آب دریا را میتوان به عنوان شاهدی بر این مدعا در نظر گرفت چراکه دریاها از دورههای اولیه زمینشناسی، نمکهای مختلف را در خود حل کردهاند.
انحلال پذیری را میتوان از طریق انرژی آزاد گیبس، به دما، آنتروپی و آنتالپی مرتبط کرد. شیمیدانها از اختلاف انحلالپذیری مواد مختلف استفاده میکنند تا ترکیبات مختلف را خالصسازی کنند. روشی که در این کار انجام میشود موسوم به «استخراج مایع-مایع» (Liquid-Liquid Extraction) است. از این روش در فرآوری سوختهای هستهای و سنتز مواد دارویی استفاده میشود.
کاربردهای انحلال پذیری
انحلالپذیری از مسائل پایهای در بسیاری از زمینههای علمی و عملی است که از فرآوری سنگهای معدن تا پزشکی و انتقال مواد آلاینده کاربرد دارد. انحلالپذیری را معمولا به عنوان یکی از مشخصههای ماده در نظر می گیرند. به عبارت دیگر، از انحلالپذیری برای توصیف یک ماده، قطبیت آن، تشخیص آن از سایر مواد و راهنمایی برای کاربردهای آن ماده استفاده میشود.
انحلالپذیری مواد به هنگام جداسازی مخلوطها از یکدیگر نیز کاربرد دارد. به طور مثال، مخلوط یک نمک - مانند سدیم کلرید - و سیلیس را میتوان به کمک انحلال نمک در آب و فیلتراسیون سیلیس حلنشده، از یکدیگر جدا کرد. سنتز مواد شیمیایی با مقیاسهای متفاوت از میلیگرم در آزمایشگاه تا هزاران کیلوگرم در مصارف صنعتی، همگی از انحلالپذیری نسبی فرآورده مورد نظر و دیگر فرآوردهها همچون «محصولات فرعی» (by-product) برای جداسازی بهره میگیرند.
از کاربردهای انحلالپذیری میتوان به سنتز بنزوییک اسید از «فنیلمنیزیم برمید» و یخ خشک اشاره کرد. بنزوییک اسید در حلالهای آلی همچون دیکلرو متان یا دیاتیل اتر، حلالپذیر است که به هنگام تکان دادن آن در «قیف جداکننده» (Seperatory Funnel)، به خوبی در ماده آلی حل میشود. فرآوردههای دیگر واکنش شامل منیزیم برمید، به صورت محلول باقی میمانند که حاکی از آن است که جداسازی بر اساس حلشوندگی صورت گرفته است.
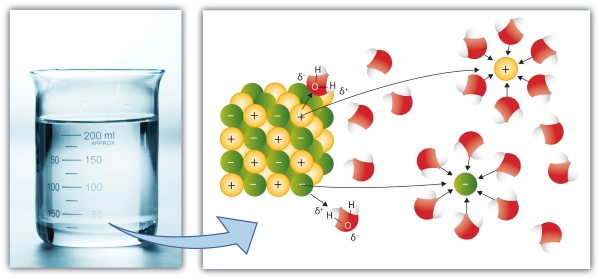
انحلالپذیری ترکیبات یونی در آب
برخی از ترکیبات یونی همچون نمکها، به دلیل جاذبه بین بارهای مثبت و منفی، در آب حل میشوند. به طور مثال، یون مثبتی همچون ، ذرات اکسیژن با بار منفی را در مولکول آب جذب میکند. به همین شکل، بارهای منفی نمک، شامل یون ، سبب جذب هیدروژنها با بار مثبت میشوند.
البته به این نکته توجه داشته باشید که اکسیژن به صورت جزئی بار منفی دارد و دلیل آن، الکترونگاتیوی بیشتر نسبت به هیدروژن است. واکنش تفکیک یونی ترکیب نقرهکلرید در زیر آورده شده است:
البته محدودیتهایی برای میزان نمک حلشده در حجم مشخصی از آب وجود دارد. این مقدار، موسوم به «حاصلضرب انحلالپذیری» (Solubility Product) است که آن را با نشان میدهند. این مقدار به نوع ترکیبات نمک، دما و اثر یون مشترک بستگی دارد. رابطه حاصلضرب انحلالپذیری به همراه واکنش مربوطه در زیر آورده شده است:
دقت کنید که در رابطه بالا، ، پیشبینی نشده است. در حقیقت، به هنگام محاسبه این مقدار، جامدات لحاظ نمیشوند چراکه غلظت آنها تغییر نمیکند یا اگر تغییری هم صورت بگیرد بسیار ناچیز است. در نتیجه، ، بیانگر حداکثر میزانی است که یک جامد میتواند در حلال، حل شود.
مثال
رابطه حاصلضرب انحلالپذیری را برای ترکیب بنویسید.
حل
واکنش تعادلی این ترکیب به صورت زیر خواهد بود:
بنابراین، رابطه حاصلضرب انحلال را میتوان به صورت زیر نوشت:
مثال
اگر میزان برای واکنش زیر، برابر با باشد. مقدار قابل انحلال در یک لیتر آب را حساب کنید.
حل
رابطه حاصلضرب انحلال برای واکنش بالا به صورت زیر خواهد بود:
همچنین در غیاب دیگر نمکهای کلرید یا نقره، خواهیم داشت:
در نتیجه:
بنابراین، یک لیتر آب میتواند مول را در دمای اتاق در خود حل کند. در مقایسه با انواع دیگر نمکها، ، انحلالپذیری کمی در آب دارد. در مقابل، در نمک طعام (سدیم کلرید)، مقدار بیشتر و به تبع آن انحلالپذیری آن در آب نیز بیشتر است.
محلول جامد چیست؟
از واژه محلول جامد به طور معمول در علم مهندسی مواد استفاده میشود که به مقدار یک عنصر آلیاژی قابل انحلال در فلزات پایه مربوط است. در این محلولها، خط یا خطوطی با نام «خط انحلالپذیری» (Solubility Line) در دیاگرام فازی وجود دارد که محدودیت اضافه کردن حلشونده را نشان میدهند. به عبارت دیگر، این خط میزان حداکثر مقدار ذرهای را نشان میدهد که میتوان آن را به یک ماده دیگر اضافه کرد و آن ماده همچنان به صورت محلول جامد باقی بماند. در ساختار بلوری یک جامد، عنصر حلشونده میتواند در داخل شبکه بلوری جای بگیرد یا اینکه فضای خالی بین عناصر در شبکه بلور را اختیار کند که به ترتیب با نامهای آلیاژهای جانشینی و درونشبکهای شناخته میشوند.
انحلال ناهمسان
بسیاری از مواد به صورت «همسان» (Congruently) انحلال پیدا میکنند. انحلال همسان بدین معنی است که ترکیب جامد و ماده حلشده، هر دو به لحاظ استوکیومتری برابر هستند. البته احتمال دارد که برخی مواد به صورت «ناهمسان» (Incongruently) انحلال پیدا کنند. به طور مثال، انحلال کانی آلبیت با فرمول سبب تشکیل «ژیبسیت» میشود:
در این شرایط، انحلالپذیری آلبیت به «نسبت جامد به حلال» (Solid to Solvent Ratio) بستگی دارد. این نوع از انحلالپذیری، اهمیت خاصی در زمینشناسی دارد چراکه در تشکیل سنگهای دگرگونی بسیار پرکاربرد است.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- ساختار لوویس — به زبان ساده
- شکل مولکول — به زبان ساده
^^













سلام خیلی خوب بود متشکرم
در یک لیتر آب خالص با دمای محیط چقدر نمک طعام حل میشه؟
در مقایسه با محلول آب قند ، کدام یک غلظت بیشتری دارند؟آب نمک یا آب قند؟
با سلام:
در دمای اتاق (۲۵ درجه سانتی گراد) حدود ۳۶۰ گرم سدیم کلرید (نمک) در یک لیتر آب حل میشود. در یک لیتر آب در این دما حدود ۲۰۰۰ گرم شکر (ساکارز) حل میشود. در این شرایط، مقدار غلظت محلول آب و شکر بسیار بیشتر از آب و نمک خواهد بود.
با تشکر از همراهی شما با مجله فرادرس.
با سلام و سپاس از مطالب زیبا و آموزنده
جامع و کامل ?