صابون چیست؟ – از صفر تا صد
صابون به عنوان واژهای برای نمک اسیدهای چرب یا محصولات آرایشی - بهداشتی بکار میرود. از صابونها در نقش «مواد فعال در سطح» (Surfactant) برای امولسیون کردن روغنها نیز بهره میگیرند. این عمل باعث میشود تا روغنها به کمک آب جابجا شوند. صابونها در کاتالیزورها، روانکارها و مواد افزایش دهنده ویسکوزیته کاربرد دارند. در این مطلب از مجله فرادرس با ساختار صابون، انواع صابونها و روش تولید صابون آشنا میشویم.
- میآموزید صابون چیست و از چه موادی تشکیل میشود.
- با انواع مختلف صابون آشنا میشوید.
- ساختار صابون و روش عملکرد آن در محلولها را یاد میگیرید.
- با مشکلات صابون مانند رسوب اسید چرب آشنا میشوید.
- میآموزید چگونه مشکلات صابون در مواد دترجنت رفع شده است.
- با تولید صابون آرایشی و فرایند صابونی شدن آشنا میشوید.


صابون چیست؟
صابون نوعی ماده پاککننده است که ساختار آن از نمک یک اسید چرب یا سایر اسیدهای کربوکسیلیک تشکیل شده است. صابون معمولا از ترکیب چربیها و و روغن (مانند چربی حیوانی یا گیاهی) با یک باز (مانند سدیم هیدروکسید) تولید میشود.
این ماده برای مصارف پاک کنندگی، روانکنندگی و کاربردهای دیگر استفاده میشود. در مصارف خانگی از صابون برای شست و شو و پاککردن لکههای چربی استفاده میشود. در مصارف صنعتی، از صابون به عنوان غلیظکننده، تولید برخی از روانکنندهها، تولید امولسیفایر و کاتالیروز استفاده میشود.
انواع صابون ها
صابونها انواع مختلفی مانند صابون آرایشی، صابون فلزی و صابون غیرآرایشی را دارند. از آنجایی که صابونها همگی نمک اسیدهای چرب هستند، فرمول عمومی آنها به صورت است که در آن یک گروه آلکیل، فلز، و بار کاتیون محسوب میشود. در طبقهبندی صابونها، از نقش به عنوان کاتیون مورد استفاده قرار میگیرد.
اگر M شامل فلزات قلیایی سدیم یا پتاسیم باشد، صابون، آرایشی است و برای شستشوی دست و صورت کاربرد. زمانی که به جای M، عنصر لیتیوم را قرار دهیم، محصول به عنوان صابون لیتیومی شناخته میشود که در تولید گریسهای با کیفیت نقش اساسی دارد. در صورتیکه M شامل کاتیونهای فلزات قلیایی خاکی منیزیم و کلسیم باشد، به آنها «صابونهای فلزی» (Metallic Soap) میگویند.

در ادامه انواع مختلف صابون را معرفی میکنیم.
صابونهای غیر آرایشی
صابونهای غیر آرایشی مواردی هستند که برای استفاده روی پوست تولید نمیشوند. موارد اصلی استفاده از این صابونها در صنعت است. صابونها اجزای اصلی بیشتر گریسها و مواد افزایش دهنده ویسکوزیته را تشکیل میدهند. گریسها امولسیون صابونهای کلسیم و لیتیوم هستند. از صابونهای فلزی دیگر همچون آلومینیوم، سدیم و مخلوطی از آنها نیز استفاده میشود. این صابونها در افزایش گرانروی روغنها نیز کاربرد دارند.
در دوران باستان، روان کنندهها با اضافه کردن آهک به روغن زیتون تولید میشدند. صابونهای فلزی همچنین در فرمولاسیون رنگ روغنهای جدید برای بهبود رئولوژی این رنگها بکار میروند.
صابونهای فلزی
صابونهای فلزی صابونهایی هستند که در ساختار آنها از نمک اسید چرب فلزات سنگین استفاده میشود. در تهیه بیشتر صابونهای فلزات سنگین از خنثیسازی اسیدهای چرب خالص استفاده میشود. برای مثال، واکنش زیر، روش تولید صابونی با ساختار نمک بازی کلسیم را نمایش میدهد.
$$$2 \mathrm{RCO}_{2} \mathrm{H}+\mathrm{CaO} \rightarrow\left(\mathrm{RCO}_{2}\right)_{2} \mathrm{Ca}+\mathrm{H}_{2} \mathrm{O}$$
در صنعت پلاستیک سازی، صابونهای فلزی در تولید محصولات PVC، فرآوری پلاستیکها و محصولات پلیمری شامل پلیآمیدها، پلیاتیلنها، پلیپروپیلن و ... کاربرد دارند. پیشنهاد میکنیم برای آشنایی بیشتر با این دسته صابون ها، مطلب خود را بیازمایید شیمی دوازدهم با جواب را مطالعه کنید.
صابونهای آرایشی
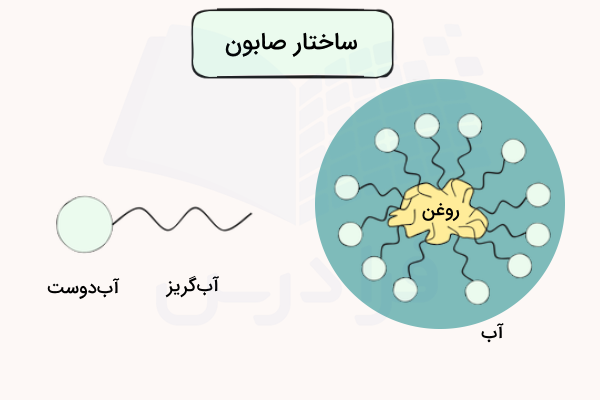
صابونهای آرایشی صابونهایی هستند که برای استفاده روی پوست و لباس و مصارف خانگی تولید میشوند. صابونهایی که به منظور شستشو و پاک کردن دست و صورت استفاده میشوند شامل دو قسمت آب دوست و آب گریز (آمفیپاتیک) هستند. ذرات و مولکولهای روغن و چربی که در آب نامحلول هستند، با بخش آبگریز این صابونها همراه میشوند و بخش آب دوست صابونها شکلهای کروی را در اطراف این ذرات تشکیل میدهند.
به بیان دقیقتر، بخش آب دوست صابون در آب و بخش آبگریز در آلودگیها حل میشود. در مرحله بعد، بخش آبدوست صابون، مولکولهای آبگریز را آبپوشی میکند که در اینصورت با وجود مقدار کافی آب، آلودگیها از بین میروند.

ساختار صابون
صابون ساختاری دو قسمتی دارد که از یک قسمت آبدوست و یک قسمت آبگریز تشکیل شده است. کربوکسیلیک اسیدهایی که دارای زنجیر کربنی بیش از ۸ اتم کربن باشند، از خود خاصیت آبدوست و آبگریز بروز میدهند. خاصیت اول به دلیل حضور پیوند و خاصیت دوم به دلیل حضور آلکیل است. این شاخصه با عنوان «دوگانهدوست» (Amphiphilic) شناخته میشود. اسیدهای چرب با بیش از ده اتم کربن، تقریبا در آب محلولناپذیر هستند و به دلیل چگالی کمتر، هنگام اختلاط با آب، روی آن شناور میشوند.
بر خلاف پارافینها و دیگر آلکانها که در آب به صورت تودهای حالت میگیرند، این اسیدهای چرب در سطح آب به طور یکنواخت پخش میشوند. این امر در نهایت سبب میشود که بخش قطبی مولکول که شامل کربوکسیل است با آب پیوند هیدروژنی دهد و یک لایه مولکلولی را در سطح آب پدید آورد. در مقابل، زنجیرهای هیدروکربنی، در کنار یکدیگر و به دور از آب قرار میگیرند. موادی که به این صورت در سطح آب جمع میشوند و خواص سطحی آب را تغییر میدهند، با عنوان «مواد فعال در سطح» (Surfactants) شناخته میشوند. سورفکتانتها به طور گسترده در روشهای ازدیاد برداشت و استخراج نفت خام کاربرد دارند.
حل شوندگی در آب
نمک فلزات قلیایی اسیدهای چرب، حلالپذیری بیشتری نسبت به خود اسیدها دارند. همچنین، خاصین دوگانه دوست این مواد سبب شده تا به عنوان سورفکتانتهایی قوی شناخته شوند. از اصلیترین نمونههای این نوع از ترکیبات میتوان به صابونها و «مواد شوینده» (Detergent) اشاره کرد. این مواد دارای موکولهایی شامل زنجیر هیدروکربنی با سرِ ناقطبی و همچنین سر قطبی - عموما یونی - هستند. علت استفاده از این مواد به عنوان پاک کننده، خاصیت سورفکتانت بودن آنها است که موجب کاهش «کشش سطحی» (Surface Tension) میشود. این امر عامل نفوذ بر روی مواد و «تَر» (Wet) شدن سطوح آنها است.
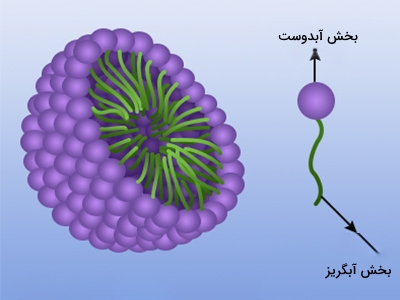
حل شدن مقدار کمی از سورفکتانت در آب کافی است تا سبب پخش شدن مولکلولهای آن در آب شود. با افزایش غلظت این مواد در آب، تغییرات مشهودی به چشم میآید. بخش انتهایی این مواد، درشتمولکولهایی با نام «میسل» (Micelles) را با یکدیگر تشکیل میدهند. با این کار، بخش آبدوست مولکول در مرکز قرار میگیرد و تخریب پیوندهای هیدروژنی آب به حداقل میرسد و سر قطبی مولکول نیز در اطراف افزایش پیدا میکند. این میسلها معمولا به شکل کروی هستند اما در شکلهای استوانهای و شاخهدار نیز ممکن است تشکیل شوند.
مشکلات صابون
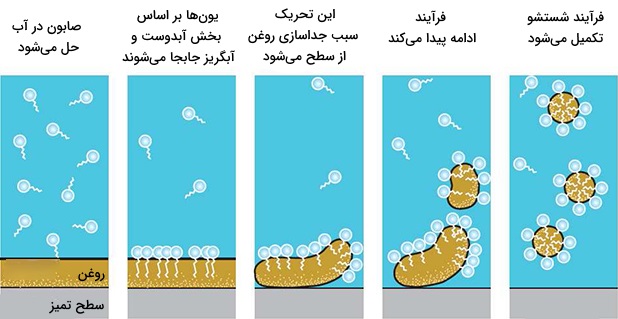
البته صابونها مشکلاتی نیز دارند. یکی از این مشکلات، خاصیت اسیدی ضعیف اسیدهای چرب است که معمولا دارای برابر با ۴٫۹ هستند. محلول صابونهای قلیایی با pH در حدود ۹، خاصیتی بازی دارند. اگر pH محلول صابون توسط آلودگی با اسید، کاهش پیدا کند، اسیدهای چربی که در آب نامحلول هستند به صورت رسوب در میآیند. مشکل دیگر، وجود آب سخت یا در واقع حضور نمکهای کلسیم و منیزیم در آب است. حضور این کاتیونهای دو ظرفیتی سبب افزایش میسلها و تجمع آنها به صورت رسوب میشود.
رفع مشکلات و توسعه صابونها
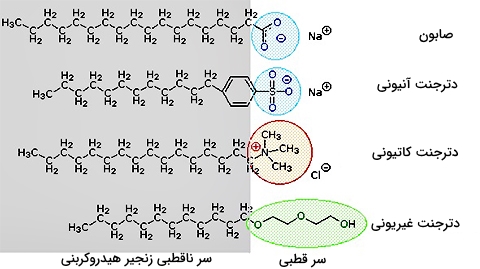
این مشکلات با توسعه مواد شوینده موسوم به «دترجنت» (Detergents) برطرف شد. با استفاده از اسیدهای قوی در بخش قطبی مولکول، محلول حاصل از این مواد، در مقابل تغییرات pH مقاومتر است. علاوه بر این، بکارگیری عامل سولفونات در دترجنتهایی آنیونی سبب حل مشکل میسلها در آب میشود. انواع مختلف دیگری از این ترکیبات دوگانه دوست توسعه پیدا کردند که در تصویر زیر نشان داده شدهاند. از دترجنتهای کاتیونی در جرمگیرها و میکروبکشها استفاده میشود. البته از قابلیت تغییر pH سطحی در این مواد، برای تولید نرمکنندههای مو و لباس بهره میگیرند.
تولید صابونهای آرایشی
ساخت صابون از گذشته تقریبا ثابت باقی مانده است. در روم باستان با ترکیب کردن آب باران، خاکستر زغال و چربی حیوانات ساخت صابون انجام میگرفت. البته تولید صابون شامل مراحل سخت و زمانبر بود. در ابتدا چربی باید ذوب و پس از آن محلول خاکستر به آن اضافه میشد. از آنجایی که آب و روغن در یکدیگر حل نمیشوند، این مخلوط را به طور منظم و با حرارت ثابت هم میزدند تا چربیها حالت ذوب شده خود را از دست ندهند. با این کار یک واکنش تقریبا آرام بین چربیها و هیدروکسید اتقاق میافتاد. زمانی که چربی و آب به طور کامل در یکدیگر حل میشد، به مخلوط زمان میدادند تا سرد شود. به هنگام سرد شدن، یک نمک مانند سدیم کلرید برای جداسازی صابون از آب اضافی، به مخلوط اضافه میکردند. با این کار، صابون به سمت بالا حرکت میکرد و با جداسازی آن، طی چندین ماه، واکنش صابون تکمیل میشد.
تولید صابونها مستلزم بکارگیری روش «صابونسازی» (Saponification) از تریگلیسیریدها است. تریگلیسیریدها از چربیهای حیوانی یا گیاهی تشکیل شدهاند. یک محلول قلیایی که به طور معمول شامل سدیم هیدروکسید است سبب هیدرولیز تریگلیسیرید به نمک اسیدهای چرب میشود. این واکنش با تولید گلیسیرین همراه است که در مواردی به عنوان نرمکننده از آن بهره میگیرند و این ماده را از صابون خارج نمیکنند.

فلزات قلیایی استفاده شده در فرآیند، نوع صابون تولیدی را تعیین میکنند. صابونهای سدیم که از سدیم هیدروکسید بدست آمدهاند، به صورت جامد هستند در حالی که صابونهای پتاسیم که در تولید آنها از پتاسیم هیدروکسید استفاده شده است، نرمتر از صابونهای قبلی و در بیشتر موارد به حالت مایع قرار دارند. در گذشته، برای تهیه پتاسیم هیدروکسید از خاکستر درختانی همچون سرخس استفاده میشد. صابونهای لیتیومی نیز که در ساخت گریس از آنها استفاده میشود در رده صابونهای سخت قرار میگیرند.
جهت تولید صابونهای آرایشی، تریگیلیسیرید از نارگیل، زیتون و روغن پالم استخراج میشود. نوع اسید چرب استفاده شده در تولید صابونها بر میزان خاصیت آنها تاثیرگذار خواهد بود. به عنوان مثال، صابون تولیدی از دانههای روغنی، صابونی نرم و ملایم است. اگرچه استفاده از روغن زیتون در تولید صابونها به علت ملایمت مثال زدنی آن، بیشتر مورد استفاده قرار میگیرد. این نوع محصول تولیدی به نام صابون کاستیل نیز معروف است. البته واژه کاستیل در مواردی به مخلوطی از روغنها هم اطلاق میشود که درصد بیشتری از آنها شامل روغن زیتون هستند.

صابونی شدن و رنگ روغن
صابونی شدن، تنها در ساخت لوازم آرایشی رخ نمیدهد بلکه این پدیده در نقاشیهای رنگ روغن قدیمی، سبب تخریب آنها میشود. رنگهای روغن را به همراه مکملهای رنگی بکار میبرند تا بعد از استفاده، زودتر خشک شوند. این مکملها با نام «مدیوم رنگ روغن» شناخته میشوند. نمک فلزات سنگین نیز به عنوان مولکولهای رنگی در تولید رنگ روغنها کاربرد دارند. از نمونههای این مولکلولهای رنگی میتوان به رنگهای سفید با سرب و روی اشاره کرد که فرمول مولکولی آنها به ترتیب و است.

اگر این فلزات با اسیدهای چرب موجود در مدیوم رنگ روغن وارد واکنش شوند، صابونهای فلزی در لایههای رنگی تابلوها تشکیل میشوند. این صابونها به مرور میتوانند به خارج از سطح بوم نقاشی راه پیدا کنند.

اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی آلی 1
- گزارش کار آزمایشگاه — اصول نگارش
- کشش سطحی — به زبان ساده
^^













سلام
چرا بعضی از صابونهای دست ساز نوچ و روغنی میشوند و آیا راه حلی وجود دارد؟
ممنون
سلام عرض ادب من میخوام یک صابون جامد رو رنده کنم و بصورت مایع استفاده کنم ولی بعداز مدتی که بااب قاطی کردم دوباره یه حالت سفت میگیره یک سوال چه ماده ای باید به این محلول صابون رنده شده بااب اضافه کنم که عین مایع دستشویی نرم بشه؟ خیلی مهمه برام ممنون میشم جواب بدین
سلام. وقت بخیر
علت لیز بودن صابون چیه؟
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. برای بیان ساده این مطلب میتوان به کاهش اصطکاک در اثر ایجاد کف و همچنین کاهش سطح تماس اشاره کرد به گونهای که در اثر کف کردن صابون، سطح تماس بین پوست کاهش پیدا میکند. همچنین، این موضوع را از نگاه میکروسکوپی و کشش سطحی نیز میتوان بررسی کرد.
با تشکر