پلی پپتید چیست؟ – در زیست و به زبان ساده
پلی پپتید پلیمری زیستی است که از ۵۰ تا چندصد زیرواحد آمینواسیدی تشکیل شده است. این پلیمرها در موجودات پروکاریوتی و یوکاریوتی با استفاده از ماشین مولکولی ریبوزوم ساخته میشوند. اما میتوان با روشهای شیمیایی در آزمایشگاه این پلیمر را تولید و در صنایع دارویی و آرایشی-بهداشتی استفاده کرد. در این مطلب توضیح میدهیم پلی پپتید چیست و چه تفاوتی با پروتئینها دارد.
پلی پپتید چیست ؟
پلی پپتید پلیمری زیستی است که از کنار هم قرار گرفتن تعداد کمی زیرواحد آمینواسیدها بهوسیله پیوند پپتیدی تشکیل میشود. این پلیمرها بر اساس تعداد زیرواحد در شش گروه قرار میگیرند.
- دیپپتیدی: پپتید دو آمینواسیدی
- تریپپتید: پپتید سه آمینواسیدی
- تتراپپتید: پپتید چهار آمینواسیدی
- اولیگوپپتید: پپتیدهایی با کمتر از ۵۰ آمینواسید
- پلیپپتیدها: زنجیره پپتیدی با بیش از ۵۰ آمینواسید
- پروتئین: یک یا چند زنجیره پلیپپتیدی
آمینواسید چیست ؟
آلفا آمینواسیدها مولکولهای آلی هستند که از یک کربن کایرال، گروه عاملی کربوکسیل و گروه عاملی آمین تشکیل میشوند. ۲۰ آمینواسید استاندارد وجود دارد که با آرایشهای متفاوت در ساختار تمام پلیپپتیدها و پروتئینها شرکت میکنند.
پیوند پپتیدی چیست ؟
پیوند پپتیدی یا آمیدی نوعی پیوند کووالانسی است که با آزاد شدن یک مولکول آب بین گروه آمین و کربوکسیل آمینواسیدها تشکیل میشود. پیوندهای پپتیدی اصلیترین برهمکنش بین مولکولی در تشکیل پپتید، پلی پپتید و پروتئینها هستند.
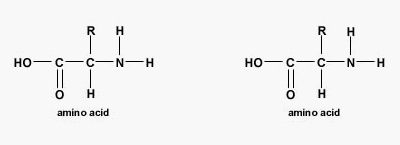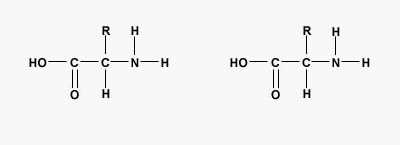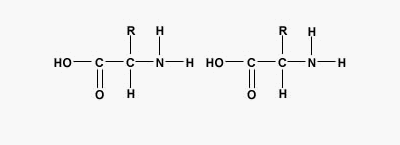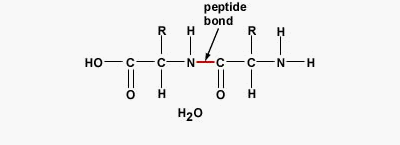
تفاوت پروتئين و پلی پپتید چیست ؟
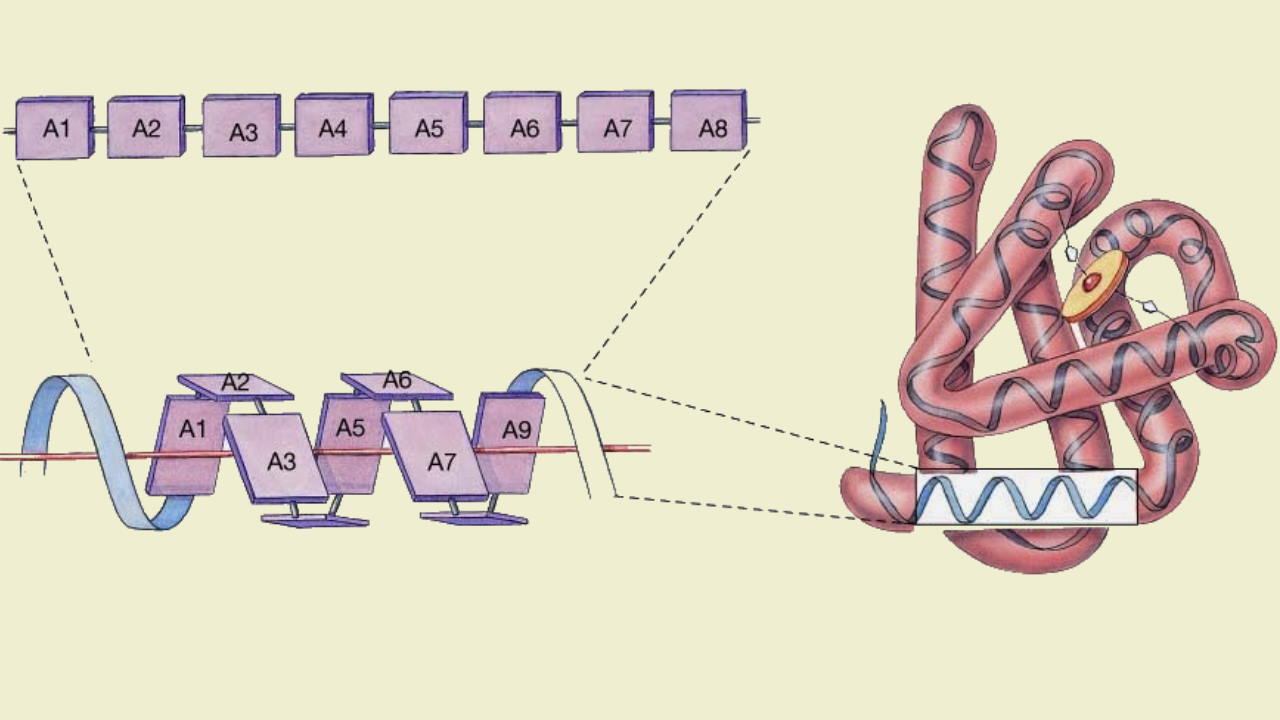
در بررسی پپتید چیست اولین پرسشی که به ذهن میرسد این است که چه تفاوتی بین پلیپپتید و پروتئین وجود دارد. پلیپپتید و پروتئین هر دو درشتمولکولهای زیستی هستند که از کنار هم قرار آمینواسیدها به وجود میآیند. تفاوت اصلی این دو پلیمر در وزن مولکولی و تعداد زنجیره آنها است. اگر بخواهیم دقیقتر بررسی کنیم، تشکیل زنجیره پلیپپتیدی یکی از مراحل تشکیل پروتئین است. پروتئینها معمولا بیش از یک زنجیره پلیپپتیدی دارند یا تعداد آمینواسیدهایی که در تشکیل آنها شرکت میکنند بسیار بیشتر است. این دو پلیمر تفاوتهای ساختاری و عملکردی دارند.
- تفاوت ساختار: پلیپپتید ساختار خطی و غیرمنشعبی است که تنها پیوند پپتیدی در تشکیل آن شرکت میکند. اما پروتئین ساختاری پیچیده است که از یک یا زنجیره پلیپپتیدی تشکیل میشود و علاوهبر پیوند پپتیدی، پیوندهای هیدروژنی، یونی و واندروالس در ایجاد آن نقش دارند. پروتئينها در چهار سطح ساختاری اول، دوم، سوم و چهارم وجود دارند.
- تفاوت عملکرد: عملکرد اصلی پلیپپتید شرکت در تشکیل پروتئینها است. این پلیمر ساختار سهبعدی برای اتصال به لیگاندها و انجام واکنشها یا برهمکنشهای زیستی ندارد. اما پروتئینها پلیمرهای زیستی پیچیدهای هستند که با کنفورماسیونهای مختلف به دیگر مولکولها متصل میشوند. تقریبا تمام فعالیتهای بیوشیمیایی و فیزیولوژیکی یوکاریوتها وابسته به ساختار سهبعدی پروتئين است.
ترجمه پلی پپتید
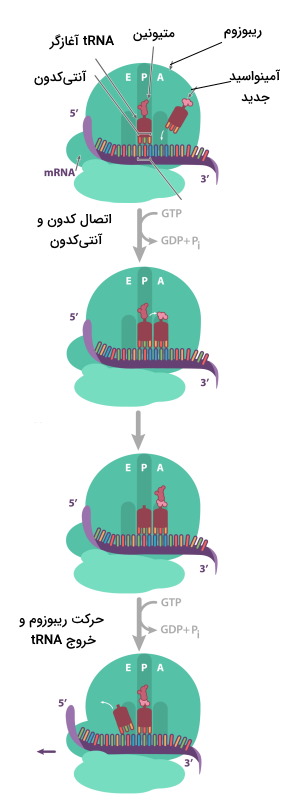
پلیپپتیدهای بدن موجودات زنده، در فرایند ترجمه و به کمک ریبوزومها ساخته میشوند. در این فرایند کدونهای سهبازی mRNA به توالی آمینواسیدها در زنجیره پلیپپتیدی تبدیل خواهند شد. ترجمه یک فرایند سهمرحلهای در پروکاریوتها و یوکاریوتها است که به دلیل تفاوت سیستمهای مولکولی این سلولها، تفاوتهایی با هم دارد. آغاز (Initiation)، طویل شدن زنجیره (Elongation) و خاتمه سه مرحله فرایند ترجمه هستند.
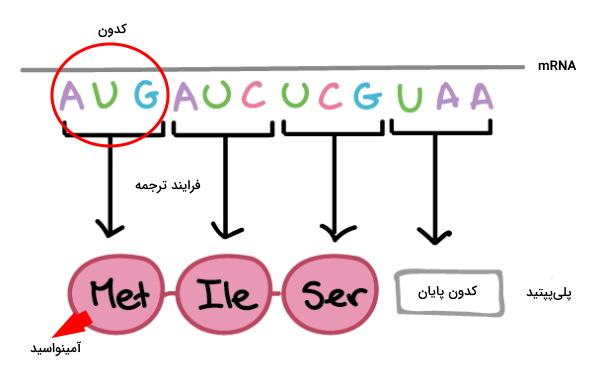
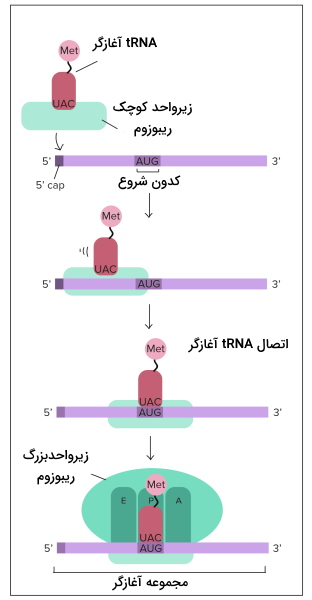
شروع ترجمه
در مرحله شروع دو زیرواحد ریبوزم، mRNA و اولین tRNA کنار هم قرار میگیرند و فرایند ترجمه آغاز میشود. متیونین اولین آمینواسیدی است که ابتدای همه زنجیرههای پلیپپتیدی در یوکاریوتها قرار دارد. این مرحله در سلول یوکاریوت و پروکاریوت تفاوتهایی دارد.
شروع ترجمه در یوکاریوت
برای شروع ترجمه در یوکاریوتها tRNA-متیونین با شناسایی پوشش GTP در انتهای $$5^prime mRNA$$ ($$5^prime GTP \cap$$) به زیرواحد کوچک ریبوزوم متصل میشود. سپس tRNA-متیونین-ریبوزم برای پیدا کردن کدون آغاز که معمولا AUG است، در طول mRNA حرکت میکند. tRNA متصل به متیونین، tRNA آغازگر نام دارد. سه باز tRNA آغازاگر (UAC | آنتیکدون) مکمل کدون شروع mRNA است. با حرکت ریبوزوم روی mRNA، tRNA کدون مکمل خود را پیدا میکند و پیوند هیدروژنی بین جفتبازها تشکیل میشود.
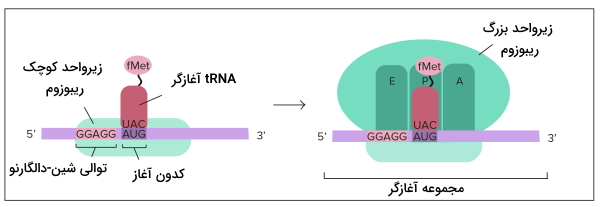
شروع ترجمه در پروکاریوت
در پروکاریوتها کنار کدون آغاز توالی از بازها (توالی شین-دالگارنو | Shine-Dalgarno Sequences) به متیونین-tRNA کمک میکند کدون آغاز را شناسایی کند. متیونین آغازگر پروکاریوتها برخلاف یوکاریوتها به فرمالدهید متصل است. به این نکته توجه کنید که ژنهای پروکاریوتی معمولا در مجموعه اُپرون کنار هم قرار دارند و یک mRNA ممکن است از رونویسی چند ژن ایجاد شده باشد بنابراین توالی شین-دالگارنو با مشخص کردن کدون آغاز هر ژن کار ریبوزم را تسهیل میکند.
طویل شدن زنجیره پلی پپتیدی
در این مرحله، زیرواحد بزرگ ریبوزوم سه جایگاه دارد (E-P-A) که هر کدام tRNA متفاوتی را میپذیرند. جایگاه A، مخصوص ورود آمینواسید (Amino acid)، جایگاه P، مخصوص زنجیره پلیپپتیدی (Polypeptide) و جایگاه E، مخصوص خروج آمینواسید (Exit) است. متیونین-tRNA آغازگر تنها آمینواسیدی است که وارد جایگاه P (جایگاه میانی) میشود. قرار گرفتن tRNA و آمینواسید جدید در جایگاه A شرایط را برای تشکیل پیوند پپتیدی فراهم میکند. متیونین گروه آمین لازم (انتهای N) برای پیوند و آمینواسید جدید گروه کربوکسیل لازم (انتهای C) برای تشکیل پیوند را فراهم میکند. پس از تشکیل پیوند پپتیدی، ریبوزوم به اندازه یک دون (سه باز) در طول mRNA حرکت میکند. در این حالت tRNA آغازگر وارد جایگایگاه E و tRNA-دیپپتید وارد جایگاه P و جایگاه A آماده پذیرش آمینواسید جدید میشود. این فرایند ممکن است تنها چند بار برای تشکیل زنجیره پپتیدی کوتاه یا چندین هزار بار برای تشکیل زنجیره پلیپپتیدی بسیار بلند مثل «تیتین» (Titin | زنجیره پپتیدی ۳۳۰۰۰ آمینواسیدی ماهیچه) انجام شود. در فرایند ترجمه از انرژی نوکلوئید GTP برای تشکیل پیوند پپتیدی استفاده میشود.
پایان ترجمه پلی پپتید
تشکیل پیوند پپتیدی مثل هر فرایند زیستی دیگر نیاز به یک پایان یا خاتمه دارد. ترجمه زمانی تمام میشود که یکی از کدونهای UAA، UAG یا UGA در جایگاه A قرار میگیرد. برای این کدونها هیچ آمینواسیدی وجود ندارد و «فاکتورهای رهایش» (Release Factors) پروتئینهایی هستند که این کدونها را شناسایی میکنند. فاکتورهای رهایش با تغییر کنفورماسیون آنزیمهای پپتیدیل ترانسفراز که در مرکز زیرواحد بزرگ ریبوزوم قرار دارد، منجر به هیدرولیز پیوند آمینواسید با tRNA میشوند.
تغییرات پس از ترجمه پلی پپتید
تغییرات ساختاری و شیمیایی حین ترجمه و پس از آن برای بسیاری از پلیپپتیدها انجام میشود. تغییرات ساختاری شامل تشکیل ساختارهای سطح اول، دوم، سوم (تشکیل پروتئین عملکردی) و چهارم (پروتئینهای چند زیرواحدی) میشود. تغییرات ساختاری معمولا غیرقابل برگشت هستند و در سح سوم و چهارم ساختار عملکردی پروتسین را تعیین میکنند. تغییرات شیمیایی ممکن است به شکل بازگشتپذیر مثل فسفوریلاسیون آنزیمی پروتسين در انتقال پیام هورمون یا غیربرگشتوذیر مثل گروه یوبیکوئیتینین باشد که نشانهای برای حذف پروتسین است.
تغییرات ساختاری
پس از تشکیل زنجیره پلیپپتیدی برهمکنش بین زنجیره جامبی آمینواسیدها منجر به ایجاد ساختارهای مختلف در این پلیمر میشود. که در این بخش انواع آن را توضیح میدهیم. ساختار اول زنجیره پلیپپتیدی، ساختار ساده و خطی است که از کنار هم قرار گرفتن آمینواسیدها ایجاد میشود. تشکیل ساختارهای دوم اولین تغییرات ساختاری زنجیره پلیپپتیدی است. این ساختارها دو نوع اصلی دارند و بین بخشهای مختلف یک زنجیره تشکیل میشوند.
ساختار هلیکس آلفا
در این ساختارها زنجیره جانبی یک آمینواسید با زنجیره جانبی چهارمین آمینواسید کناری پیوندهیدروژنی تشکیل میدهد و در ساختار پیچ ایجاد میکند. آلفا کراتین موجود در ناخن و موی انسان، یکی از پروتئینهایی است که مارپیچهای هلکیس فراوانی در ساختار دوم آن ایجاد شده است.
ساختارهای بتا
این ساختارها به شکل صفحات بتا یا بشکه بتا در زنجیره پلیپپتیدی و پروتئین تشکیل میشوند.
- بتا شیت: صفحات بتا از کنار هم قرار گرفتن دو بخش از زنجیره پلیپپتیدی یا دو زنجیره متفاوت ایجاد میشوند. پیوند هیدروژنی نیروی اصلی بین مولکولی در ایجاد این ساختار است. این ساختارها به دو دسته موازی (انتهای C و N دو زنجیره کنار هم) و غیرموازی (انتهای C یک زنجیره روبروی انتهای N زنجیره دیگر) تقسیم میشوند. زنجیره جانبی آمینواسیدهای روبهروی هم برای ایجاد کمترین برهمکنش در دو جهت مخالف قرار میگیرند.
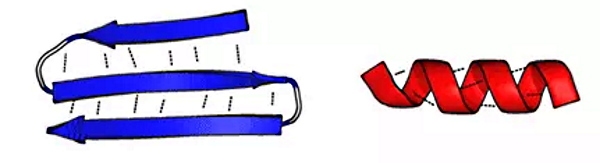
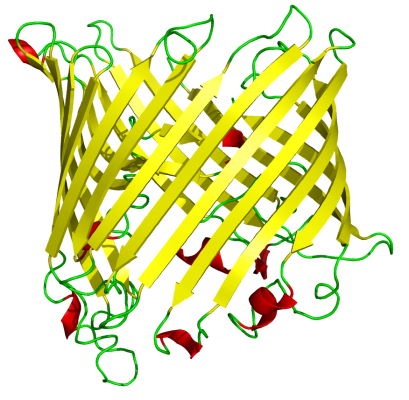
صفحه بتای غیرموازی (چپ) و هلیکس آلفا (راست) - بشکه بتا: این ساختار فراوانی کمتری نسبت به صفحات بتا و آلفا هلیکس دارد. در این ساختار صفحات بتای غیرموازی با مارپیچهایی به هم متصل میشوند و ابتدا و انتهای زنجیره پلیپپتیدی با پیوند هیدروژنی برهمکنش میکنند. این ساختار بیشتر در پروتئینهای غشایی ایجاد میشود.
ساختار سوم در پلیپپتید وجود ندارد. این مرحله از تغییرات پس از ترجمه برای تشکیل پروتئینهای عملکردی انجام میشود. پیوندهای هیدروژنی، آبگریز، واندوالس، دیسولفیدی ($$-S-S-$$) و یونی بین زنجیره جانبی آمینواسیدی در تغییر کنفورماسیون زنجیره پلیپپتید و تشکیل ساختار سهبعدی پروتئين در این سطح نقش اصلی را دارند.
- پیوند آبگریز: این پیوند بین زنجیره جانبی غیرقطبی آمینواسیدها به وجود میآید. تشکیل این پیوند سبب کنار هم قرار گرفتن زنجیرههای جانبی غیرقطبی در کنار هم و جدا شدن آنها از زنجیرههای قطبی میشود.
- پیوند هیدروژنی: به طور کلی پیوند هیدروژنی بین اتم الکترونگاتیو و هیدروژن برقرار میشود و ضعیفتر از پیوند کوولانسی و یونی اما قویتر از برهمکنش واندرولس است. این پیوند بین اتمهای N و O موجود در آمینواسیدها و H برقرار میشود.
- پیوند یونی: زنجیره جانبی بعضی آمینواسیدها ازجمله آسپارتیک اسید و آرژینین بار منفی و مثبت دارد. پیوند یونی ایجاد شده بین این گروهها در تشکیل ساختار سوم پروتئین نقش مهی ایفا میکند.
- برهمکنش واندروالس: برهمکنشهای واندروالس، نیروی بین مولکولی ضعیفی است که بین مولکولهای نزدیک هم تشکیل میشود. زنجیره جانبی بعضی از آمینواسیدها با برقراری برهمکنش واندوالس به تشکیل ساختار سهبعدی پروتئین کمک میکنند.
- پیوند دیسولفیدی: پیوند دیسولفیدی یکی از انواع پیوند کووالانسی است و بین زنجیره جانبی آمینواسیدهای سیستئین تشکیل میشود. این پیوند در حفظ ساختار سوم و پایداری پروتئین نقش اصلی دارد.
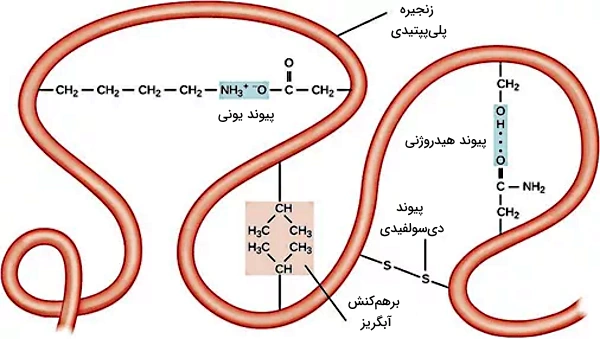
انواع برهمکنشهایی که در تشکیل ساختار پروتئين نقش دارند.
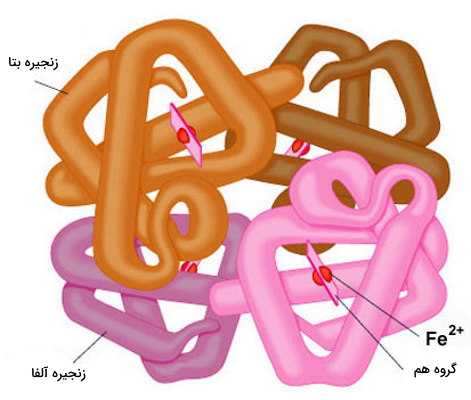
ساختار چهارم زنجیره پپتیدی
ساختار چهارم برای پروتئينهای چندزیرواحدی تعریف میشود. این ساختار در پروتئینهایی تشکیل میشود که بیش از یک زنجیره پپتیدی یا به بیانی دیگر بیش از یک زیرواحد دارند. پیوند هیدروژنی و برهمکنش واندوالس نیروهای بین مولکولی اصلی برای کنار هم قرار گرفتن دو رنجیره پلیپپتیدی و تشکیل ساختار چهارم هستند. تغییر کنفورماسیون این پروتئینها، عملکرد آنها را تغییر میدهد. هموگلوبین یکی از شناخته شدهترین پروتئینهایی است که ساختار چهارم دارد. این پروتئین از چهار زیرواحد تشکیل میشود که اتصال اکسیژن به یکی از آنها و تغییر کنفورماسیون سایر زیرواحدها، تمایل مولکول به اکسیژن را تغییر میدهد.
تغییرات شیمیایی
تغییرات شیمیایی پس از ترجمه، مجموعهای از فرایندها هستند که با حذف بخشی از زنجیره پلیپپتیدی (تغییرات برگشتناپذیر) یا اضافه شدن گروههای عاملی (تغییرات برگشتپذیر) متیل ($$-CH_3$$)، آستیل ($$−C(=O)−CH_3 $$)، فسفوریل ($$ −PO_3H_2$$)، گلیکوزیل (زنجیره کربوهیدراتی) یا اضافه شدن آمینواسید جدید، ویژگیهای شیمیایی زنجیره پپتیدی را تغییر میدهند. این تغییرات نقش مهمی در ساختار و عملکرد پروتئینها ایفا میکنند. فعال و غیرفعال شدن بسیاری ار آنزیمها وابسته به تغییرات شیمیایی برگشتپذیر است.
- فسفوریلاسیون: فسفوریلاسیون یکی از تغییرات برگشتپذیر پس از ترجمه است که در پروکاریوتها و یوکاریوتها وجود دارد. فسفات لازم برای انجام این فرایند از نوکلئیوتیدها تامین و به هیدروکسیل زنجیره جانبی آمینواسیدهای سرین، تروئونین یا تیروزین متصل میشوند. اتصال و جدا شدن این گروه عاملی به پروتئین برعهده آنزیمهای کیناز و فسفوریلاز است. بار منفی فسفات سبب میشود برهمکنش آمینواسیدها و در نتیجه کنفورماسیون پروتئين تغییر کند.
- آستیلاسیون: اضافه شدن گروه استیل به آمینواسیدها، یکی دیگر از فرایندهای پس از ترجمه است. برای مثال استیله و دِاستیله شدن پروتئینهای هیستون در تنظیم بیان ژنها و پایداری مولکول DNA بسیار اهمیت دارد. اضافه شدن گروه استیل به این پروتئینها سبب کاهش بار مثبت آنها و در نتیجه کاهش برهمکنش آنها DNA منفی میشود. در این حالت فشردگی DNA کاهش و رونویسی ژنها افزایش مییابد.
- هیدروکسیلاسیون: اضافه شدن گروه هیدروکسیل به آمینواسیدها منجر به تغییر بخشهای آبگریز یا چربیدوست پروتئين به ترکیبات آبدوست میشود.
- متیلاسیون: اضافه شدن گروههای متیل به لیزین (یک یا دو گروه) یا آرژینین (یک تا سه گروه) بهوسیله آنزیمهای متیلترانسفراز منجر به تغییر ویژگیهای شیمیایی پیوند پپتیدی و تغییر ساختار پروتئین میشود. متیلاسیون هیستونها یکی دیگر از تغییرات پس از ترجمه است که در تنظیم رونویسی نقش دارد.
- گلیکوزیلاسیون: اضافه شدن گروههای قندی به آمینواسیدهای به نیتروژن زنجیره جانبی آرژینین (اتصال N) یا اکسیژن زنجیره جانبی سرین و تروئونین (اتصال O)، ساختارهای عملکردی جدید در آنها به وجود میآورد.
- اضافه شدن AMP: اضافه شدن مونو آدنو فسفات (AMP) به زنجیره جانبی آمینواسیدها یکی از تغییرات برگشتپذیر زنجیره پلیپپتیدی است. در این فرایند بین گروههای OH زنجیره جانبی و فسفات پیوند کوالانسی فسفودیاستر تشکیل میشود.
- اضافه شدن لیپید: اضافه شدن گروههای لیپیدی به زنجیره پلیپپتید، دسته جدید از پروتئینها به نام لیپوپروتئینها را به وجود میآورد. این فرایند به چند دسته تقسیم میشود.
- اضافه شدن N-مریستیک اسید به آمینواسید گلایسین
- اضافه شدن پالمیتوئیکاسید به آمینواسید سیستئین
- اضافه شدن لنگر گلیکوفسفاتیدیل اینوزیتول (GPI) به پروتئين
- اضافه شدن یوبیکوئیتینین: در این فرایند یک یا زنجیرهای از پروتئینهای یوبیکوئیتین به پلیپپتید اضافه میشود. این فرایند نشانهای برای پروتئولیز بخشی از زنجیره پپتیدی یا تجزیه کامل و پروتئین انجام میشود.
- پروتئولیز: این فرایند پیوند پپتیدی بین دو آمینواسید را میشکند و بخش کوچک یا چند آمینواسید از زنجیره پلیپپتیدی جدا میکند. برای مثال جدا کردن متیونین انتهای N یکی از تغییرات پس از ترجمه است که پروتئین را فعال میکند.
- دآمیناسیون: جدا شدن آمین آمینواسید آسپارژین را به آسپارتیکاسید یا ایزوآسپارتیکاسید و گلوتامین را به گلوتامیکاسید یا پروگلوتامیکاسید تغییر میدهد. این تغییرات منجر به تغییر بار زنجیره جانبی آمینواسید و ساختار، پایداری و عملکرد پروتئین میشوند.
سنتز شیمیایی پلی پپتید
سنتز شیمیایی پپتیدها امکان استفاده از این مولکولهای زیستی پرکاربرد در صنایع داروسازی و آرایشی-بهداشتی را فراهم میکند. در قسمتهای قبل توضیح دادیم که اساس تشکیل زنجیره پلیپپتیدی تشکیل پیوند پپتیدی بین آمینواسیدها است و برای تشکیل این پیوند نیاز به گروه عاملی کربوکسیل و آمین وجود دارد. برای افزایش کارایی روشهای شیمیایی سنتز پلیپپتید و جلوگیری از واکنشهای غیردلخواه بین گروههای کربوکسیل، آمین و زنجیره جانبی آمینواسید، مولکولهایی شیمیایی برای محافظت از این ساختارها استفاده میشوند.
- گروه محافظ آمین: تترابوتوکسی کربونیل (Boc) و فلوئورنیل متوکسی کربونیل (Fmoc) دو ترکیب محافظتکننده از انتهای N زنجیره پلیپپتیدی هستند.
- گروه محافظ کربوکسیل: استفاده از گروههای محافظ انتهای C بستگی به نوع روش سنتز انتخابی دارد. این گروههای برای محافظت انتهای C اولین آمینواسید در سنتز مایع استفاده میشود. اما در سنتز فاز جامد به دلیل اینکه اتصال آمینواسید به سطح رزینی نیازی به محافظت از انتهای کربوکسیل نیست.
- گروه محافظ زنجیره جانبی: به دلیل تنوع ساختار زنجیره جانبی در آمینواسیدها، گروههای شیمیایی متفاوتی برای محافظت از آنها استفاده میشود که همه بر پایه بنزن یا تترابوتیل هستند. این گروهها تا انتهای سنتز پلیپپتید به زنجیره جانبی متصل میمانند.
برای تشکیل زنجیره پلیپپتیدی پس از اضافه شدن گروههای محافظتکننده نیاز به فعال شدن کربوکسیل، اسیدآمینه دوم بهوسیله کاربودیآمیدهایی مثل دیسیکلوهگزیل کاربودیآمید (DCC) یا دی ایزوپروپیل کاربودیآمید (DIC) است. این «عوامل جفتکننده» (Coupling Reagents) ترکیب آسیلی حد واسطی به وجود میآورند که به وسیله حمله نوکلئوفیلی آمین آزاد در آمینواسید اول جایگزین و پیوند پپتیدی تشکیل میشود. پس از چند بار تکرار این چرخه و سنتز پلیپپتید دلخواه گروههای محافظتکننده استفاده از هیدروژن فلورید (HF)، هیدروژن برومید (HBr) یا تریفلوئورومتان سولفوریک اسید (TFMSA) از زنجیره حذف میشوند. 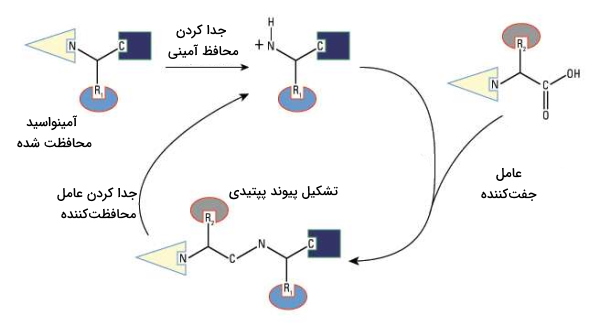
نقش پلی پپتیدها در موجودات زنده
پلیپپتیدها بهطور طبیعی در بدن موجودات زنده از پروکاروتهای بسیار ساده تا پستاندران بسیار پیچیده و برای اهداف دارویی و تحقیقاتی در آزمایشگاه تولید میشوند. سم بسیاری از مارها پپتیدهایی است که تنها از یک زنجیره پلیپپتیدی تشکیل شده است. برای مثال NDP پلیپپتیدی با ۳۸ آمینواسید و مهارکننده آنزیم تغییردهنده آنژیوتانسین است. ورود این پلیپپتید به بدن با مهار تبدیل آنژیوتانسین I به II منجر به انقباض رگهای خونی و افزایش فشار خون میشود. به این پپتیدها به دلیل تکزنجیری بودن و تعداد کم آمنیواسیدهای ساختار پروتئین گفته نمیشود.
پلی پپتید پانکراسی
گلوکاگون زنجیره پلیپپتیدی با ۲۹ آمینواسید است که در سلولهای آلفای پانکراس تولید و با کاهش غلظت گلوکز خون ترشح میشود. اتصال این هورمون به رسپتورهای غشای پلاسمایی سلولهای کبد، واکنشهای تجزیه گلیکوژن به گلوکز را فعال میکند. همچنین، سلولهای F در جزایر لانگرهانس پانکراس، پلیپپتیدهای ۳۶ آمینواسیدی ترشح میکنند که ترشح هورمونهای پانکراسی ازجمله گلوکاگون را تنظیم میکند.
پلی پپتید وازواکتیو روده ای
پلی پپتید وازو اکتیو رودهای (VIP) یک زنجیره پلیپپتیدی ۲۸ آمینواسیدی است. این «هورمون عصبی» (Neurohormone) نقش مهمی در تنظیم هومئوستازی لوله گوارش دارد. پلی پپتید وازو اکتیو رودهای، با تنظیم انقباض ماهیچههای صاف دیواره رگ، جریان خون دستگاه گوارش را تنظیم میکند. این هورمون به وسیله نورونهای زیرمخاط دیواره لوله گوارش ترشح میشود.
پلی پپتید مهاری معده چیست ؟
پلی پپتید مهاری معده (GIP) یکی از هورمونهای تنظیمی سیستم گوارش است که در سلولهای K مخاط دئودئوم و ژژنوم روده کوچک تولید میشود و جریان خون آن را به سلولهای بتای پانکراس منتقل میکند. اتصال این هورمون به گیرنده سطح غشایی خود، ترشح انسولین را تحریک میکند. از ترجمه mRNA پلیپپتید مهاری معده یک زنجیره پلیپپتیدی ۱۵۳ آمینواسیدی سنتز میشود که پس از حذف ۱۱ آمینواسید در فرایندهای پس از ترجمه به پلیپپتید فعال (۴۲ آمینواسیدی) تبدیل خواهد شد. افزایش فشار اسمزی دئودئوم یا افزایش غلظت گلوکز در این بخش از لوله گوارش ترشح پلی پپتید مهاری معده را تحریک میکند.
کاربرد پلی پپتیدهای صنعتی
از آنجایی که پروتئينها و پلیپپتیدها تقریبا در تمام فرایندهای زیستی به شکل عملکردی یا ساختاری نقش دارند، گزینه بسیار مناسبی برای درمان بسیاری از بیماریها یا بهینهسازی عملکردهای زیستی هستند. در نتیجه سنتز پلیپپتیدها در آزمایشگاه یکی از روشهایی است که برای بررسی برهمکنشهای پروتئينی یا تولید داروها استفاده میشود. همچنین از پلیپپتیدهای سنتزی در صنایع آرایشی بهداشتی کاربرد دارند. برای مثال پلیپپتید سنتزی انسان ۱، ۹ و ۱۱ (Synthetic Human (sh) Polypeptide) پلیمرهای «زیست تقلیدی» (Biomimetic) هستند که در کرمهای جوانساز پوست از آنها به کار میروند. پلیپپتیدهای مهارکننده گروهی دیگر از پپتیدهای سنتزی برای کنترل مسیرهای القای سرطان هستند.
جمعبندی
پلی پپتیدها پلیمرهای زیستی هستند که از کنار هم قرار گرفتن آمینواسیدها به وسیله پیوند پپتیدی تشکیل میشوند. زنجیره پلیپپتیدی، پروتئینی است که ساختار سوم و چهارم در آن تشکیل نشده است. در این مطلب ساختارهای مختلف پلیپپتید، تفاوت آن با پروتئين و تفاوت تشکیل زنجیره پلیپپتیدی در یوکاریوتها و پروکاریوتها را بررسی کردیم.










مطالب خیلی مفید و کامل بودن…واقعا عالی بودن،ممنونم ازتون!
درود بر شما
آیا پلی پپتید در رویش مجدد موها نقش داره؟
سلام امکانش هست منابعی را که در نوشتن این مطلب استفاده کرده اید بیان بفرمایید. ممنونم
با سلام؛
منابع تمامی مطالب مجله فرادرس، در صورتیکه ترجمه باشند، در انتهای مطلب و پیش از نام نویسنده آورده شده است.
با تشکر از همراهی شما با مجله فرادرس