فلزات قلیایی و خصوصیات آنها — به زبان ساده

فلزات قلیایی شامل عناصر لیتیوم، روبیدیم، سدیم، پتاسیم، سزیم و فرانسیم است. این عناصر به همراه هیدروژن، گروه 1 و بلوک s جدول تناوبی عناصر را تشکیل میدهند. همه فلزات قلیایی در اوربیتال s خود یک الکترون برای اشتراکگذاری دارند. این نوع از آرایش الکترونی سبب شده تا این فلزات در بسیاری از خواص به یکدیگر شبیه و بهترین نمونه برای نمایش روندهای تناوبی عناصر در جدول تناوبی باشند. فلزات قلیایی با نام «خانواده لیتیوم» نیز شناخته میشوند. فلزات قلیایی همگی براق، نرم و در شرایط استاندارد بسیار واکنشپذیر هستند و به راحتی الکترون خود را از دست میدهند و به کاتیون با بار $$+1$$ تبدیل میشوند.
در بین فلزات قلیایی، سدیم بیشترین فراوانی را دارد. بعد از آنها به ترتیب پتاسیم، لیتیوم، روبیدیم، سزیم و فرانسیم است. فرانسیم در طبیعت به دلیل ماهیت رادیواکتیوی آن بسیار کمیاب است. آزمایشهایی برای ساخت «آنیوننیم» (ununennium) که احتمال میرود عضو بعدی خانواده فلزات قلیایی باشد انجام شده که همگی با شکست مواجه شده است. فلزات قلیایی کاربردهای متفاوتی دارند که از آنجمله میتوان به روبیدیم و سزیم در ساخت ساعتهای اتمی اشاره کرد. از ترکیبات سدیم، در نمک و همچنین در ساخت لامپهای بخار سدیم استفاده میشود. لیتیم به عنوان دارو در روانپزشکی و آند در باتریهای لیتیومی کاربرد دارد. سدیم و پتاسیم اثرات مخرب و مفید در بدن و نقش الکترولیت را میان واکنشهای بیولوژیکی دارند.
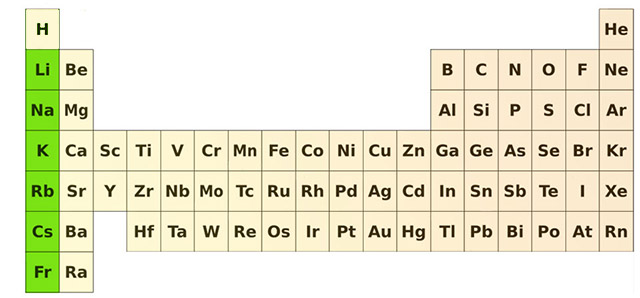
خواص فیزیکی و شیمیایی فلزات قلیایی
خواص فیزیکی و شیمیایی فلزات قلیایی، به سادگی با بررسی آرایش الکترونی $$n s^{1}$$ در لایه آخر و پیوندهای ضعیف فلزی بیان میشود. این عناصر، فلزاتی نرم با نقطه جوش، نقطه ذوب و چگالی پایین هستند. آنتالپی ذوب، تبخیر و تصعید هم در این فلزات همانند دیگر خواص پایین است. آزاد شدن الکترون از فلزات قلیایی علت رنگ شعله در این عناصر است. شعاع اتمی، هدایت الکتریکی و گرمایی در این عناصر به دلیل آرایش الکترونی بسیار زیاد و در روندهای تناوبی قابل بررسی است.
پنج عنصر اول این دسته از فلزات به خوبی شناخته شدهاند؛ اما عنصر سزیم به دلیل رادیواکتیو بودن، جزو عناصر ناشناخته است و تنها احتمال میرود که خواصی مشابه سزیم داشته باشد. فلزات قلیایی به شدت واکنشپذیراند و به صورت عنصر خالص در طبیعت یافت نمیشوند و به همین علت در نفت و پارافین نگهداری میشوند. این عناصر با هالوژنها به شدت واکنش و تشکیل هالیدهای فلزی سفیدرنگ میدهند. همچنین در واکنش با آب تشکیل هیدروکسید قلیایی میدهند که در حمل نقل آنها باید مسايل ایمنی را در نظر گرفت.

روندهای تناوبی فلزات قلیایی
اگر در فلزات قلیایی از بالا به پایین حرکت کنیم شعاع اتمی، و واکنشپذیری افزایش و الکترونگاتیوی، نقطه جوش، نقطه ذوب، گرمای تبخیر، آنتالپی ذوب و تبخیر کاهش مییابد. در حالت کلی، چگالی عناصر از بالا به پایین افزایش پیدا میکند (البته سدیم از پتاسیم چگالتر است). از جمله خواصی که یک روند معمول را از خود نشان نمیدهد مقدار غیرعادی و بسیار پایین «پتانسیل کاهش» (Reduction Potentials) است. این امر به این دلیل که یون لیتیوم در فاز گاز، انرژی آبپوشی بالایی دارد اتفاق میافتد که سبب تغییرات شدید آنتروپی میشود. فلزات قلیایی پایدار (به غیر از سدیم) رنگ نقرهای دارند. درخشندگی این عناصر به سرعت به دلیل اکسیدشدن از بین میرود. شدت واکنش در فلزات قلیایی سنگینتر بیشتر است. به طور مثال، واکنش انفجاری آب با سزیم بسیار بیشتر از همان مقدار از جرم مولی پتاسیم با آب است.
انرژی یونش اول
به انرژی لازم برای خارج کردن سستترین الکترون یک عنصر یا مولکول از یک مول اتم یا مولکول در حالت گاز و تبدیل آن به یون با بار $$+1$$ انرژی یونش اول گویند. بار هسته، میزان پوشش الکترونهای لایههای داخلی و فاصله سستترین الکترون از هسته بر انرژی یونش اول تاثیر دارد.
با توجه به این که خارجیترین الکترون در تمام فلزات قلیایی سبب ایجاد بار $$+1$$ میشود، تنها عاملی که بر روی انرژی یونش اول تاثیرگذار است، فاصله خارجیترین الکترون از هسته است. همچنین این فاصله از بالا به پایین در گروه افزایش پیدا میکند و در نتیجه خارجیترین الکترون تاثیر کمتری از هسته میگیرد که سبب کاهش انرژی یونش اول از بالا به پایین میشود. این روند تا فرانسیم ادامه دارد اما در فرانسیم به دلیل پایداری بیشتر و فشرده شدن اوربیتال $$7s$$، الکترون لایه آخر به هسته نزدیکتر و در نتیجه انرژی یونش اول در فرانسیوم نسبت به سزیم بیشتر میشود. انرژی یونش دوم در فلزات قلیایی بسیار بیشتر از انرژی یونش اول است؛ زیرا سستترین الکترون بعد از الکترون جدا شده، مربوط به یک اوربیتال فرعی با تعداد الکترون کامل است که جدا کردن این الکترون نیاز به انرژی زیادی دارد.

واکنشپذیری
واکنشپذیری تمامی فلزات قلیایی از بالا به پایین افزایش پیدا میکند. از آنجایی که انرژی یونش اول، از بالا به پایین کاهش پیدا میکند، حذف الکترون در لایه آخر با انجام واکنش شیمیایی بسیار سادهتر، و در نتیجه واکنشپذیری از بالا به پایین رو به افزایش است.
لیتیوم
عنصر لیتیوم نسبت به دیگر فلزات قلیایی خواص متفاوتی دارد. کاتیونهای کوچک این عنصر، با قطبی کردن آنیونها به ترکیبات خود خاصیت کووالانسی بیشتری میدهند. این فلز به دلیل شعاع اتمی مشابه با منیزیم، دارای «ارتباط قطری» (Diagonal Relationship) با منیزیم است. به طور مثال، لیتیوم تشکیل نیترید پایدار میدهد که این خاصیت در میان تمام فلزات قلیایی خاکی معمول است. علاوه بر این، تنها لیتیوم و منیزیم ترکیبات «آلی-فلزی» (Organometallilc) مانند $$LiMe$$ و $$MgMe_2$$ تشکیل میدهند.
لیتیوم فلوراید تنها هالید فلزی نامحلول در آب و همچنین لیتیوم هیدروکسید تنها هیدروکسید هالیدی است که جاذب آب نیست. با افزایش شعاع اتمی از بالا به پایین، قدرت پیوندهای فلزی بین اتمها کاهش مییابد که نتیجه آن کاهش انرژی فعالسازی و افزایش واکنشپذیری در این دسته از عناصر است.
الکترونگاتیوی
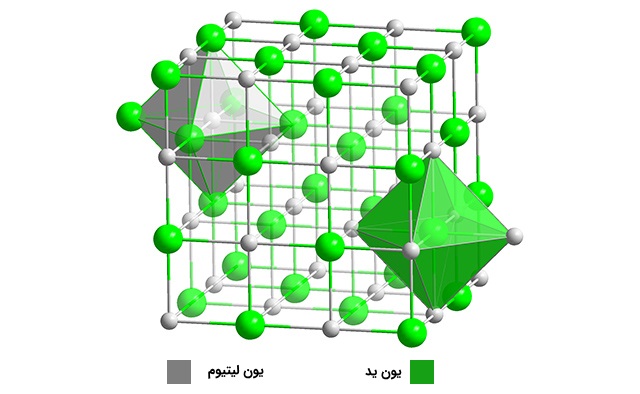
تمایل یک اتم یا گروه عاملی برای جذب الکترون به سمت خود را الکترونگاتیوی میگویند. الکترونگاتیوی فلزات قلیایی با شعاع اتمی بیشتر از بالا به پایین، به دلیل کاهش قدرت پیوندها در جذب الکترونها کاهش پیدا میکند. لازم به ذکر است که عنصر فرانسیم از این قاعده پیروی نمیکند. برخی از ترکیبات لیتیوم به دلیل الکترونگاتیوی بالا در این عنصر، خاصیت کووالانسی دارند. به طور مثال، «لیتیوم یدید» ($$LiI$$)، در حلالهای آلی حل میشود که این ویژگی مختص ترکیبات کووالانسی است.
فرانسیم
این عنصر نیز به دلیل جرم اتمی بالا، رفتار متفاوتی از خود نشان میدهد. این جرم بالا سبب حرکت الکترونها در سرعتهای بسیار بالا تا کسری از سرعت نور میشود که اثر نسبیت را مشخصتر میکند. الکترونگاتیوی و انرژی یونش بیشتری در مقایسه با سزیم برای فرانسیوم پیشبینی شده و همچنین شعاع اتمی آن هم بسیار کوچک پیشبینی شده است. این یعنی فرانسیم باید بیشترین واکنشپذیری را بین این دسته از فلزات داشته باشد؛ اما برخلاف پیشبینیها سزیم واکنشپذیرترین عنصر در میان فلزات قلیایی است.

ترکیبات
فلزات قلیایی ترکیبات مختلفی را با آنیونهای معمول تشکیل میدهند که از آنها میتوان به هیدروکسیدها، ترکیبات نیمهفلزی، ترکیبات با گروه 13 و 14، نیتریدها، اکسیدها، هالیدها و بسیاری ترکیبات دیگر اشاره کرد.
هیدروکسیدها
تمامی فلزات قلیایی به شدت و به صورت انفجاری با آب واکنش میدهد و سبب تولید یک محلول «بازی قلیایی هیدروکسید» (basic alkali metal hydroxide) به همراه گاز هیدروژن میشوند. شدت این واکنش از بالا به پایین در گروه افزایش پیدا میکند. لیتیوم به صورت کفمانند و سدیم و پتاسیم با تولید شعله واکنش میدهند. روبیدیم و سزیم با حل شدن در آب به سرعت گاز هیدروژن آزاد میکنند که شدت آن به قدری است که میتواند سبب خرد شدن شیشههای آزمایش شود.
زمانی که یک فلز قلیایی در آب انداخته شود، واکنشی دو مرحلهای را انجام میدهد که نتیجه آن یک فرآیند انفجاری است. در مرحله اول، فلز با آب واکنش میدهد و با شکستن پیوندهای هیدروژنی سبب تولید گاز هیدروژن میشود. این مرحله برای فلزات با واکنشپذیری بیشتر، سریعتر اتفاق میافتد. در مرحله دوم، گرمای آزاد شده از مرحله اول در مواردی گاز هیدروژن آزاد شده را شعلهور میکند. در حقیقت شعله مشاهده شده در بالای ظرف آب، حاصل واکنش مرحله دوم است. این نوع از هیدروکسیدها، شناختهشدهترین نوع از هیدروکسیدهای بازی است.

ترکیبات نیمه فلزی
فلزات قلیایی ترکیبات نیمه فلزی بسیاری با یکدیگر و عناصر گروههای 2 تا ۱۳ جدول تناوبی تشکیل میدهند که میتوان به «ملغمه شدن» (Amalgam) سدیم با جیوه اشاره کرد. برخی از این ترکیبات خاصیت یونی دارند و با طلا تشکیل آلیاژ میدهند. آلیاژ «سدیمپتاسیم» $$(NaK)$$، به دلیل مایع بودن در دمای اتاق بسیار سودمند و البته در برابر آب و هوا بسیار واکنشپذیر است. همچنین در ترکیب این فلزات، آلیاژی با 41 درصد سزیم، 47 درصد سدیم و 12 درصد پتاسیم، با نقطه ذوب $$-78C^{\circ}$$ بدست میآید که پایین ترین نقطه ذوب را در میان تمامی فلزات و آلیاژها دارد.
ترکیبات نیمهفلزی با عناصر سنگینتر گروه 13 مانند آلومینیوم، گالیوم، ایندیم و تالیوم، هادی ضعیف الکتریسیته یا نیمههادی هستند. لیتیوم و سدیم با کربن در گروه 14 واکنش و تشکیل «استیلیدها» (Acetylides) را مانند $$Li_2C_2$$ و $$Na_2C_2$$ میدهند. البته دو ترکیب ذکر شده در واکنش فلزات با استیلن هم تولید میشوند. پتاسیم، روبیدیم و سزیم با گرافیت وارد واکنش میشوند و ترکیباتی با هدایت الکتریکی 200 بار بیشتر از گرافیت تولید میکنند.
فلزات قلیایی در واکنش با عناصر سنگینتر گروه کربن مانند سیلیکون، ژرمانیوم، قلع و سرب، موادی یونی با ساختار ویژهای مانند سیلیسیدها با فرمول عمومی $$Mi_4Si_4$$ تشکیل میدهند که در این فرمول M نشانهای برای عناصر پتاسیم، روبیدیم و سزیم است. در این میان، لیتیوم، تنها فلزی است که در شرایط استاندارد با نیتروژن، واکنش و نیتریدها را تشکیل میدهد.

کاربردها
لیتیوم، سدیم و پتاسیم بر خلاف روبیدیم و سزیم که بیشتر در مقالات دانشگاهی استفاده میشوند، کاربردهای بسیار دارند. از لیتیوم در تولید باتریهای لیتیوم-یونی و از لیتیوم اکسید در فرآوری سیلیکا استفاده میشود. از نمکهای سدیمِ اسیدهای چرب در صابونها و از سدیم خالص در تولید لامپهای بخار سدیم استفاده میشود. پتاسیم در کودهای شیمیایی، کنترل pH در محلولها و ساخت ماسکهای تنفسی بکار میرود. همانطور که اشاره شد، روبیدیم و سزیم در تولید ساعتهای بسیار دقیق اتمی کاربرد دارند. از عنصر روبیدیم همچنین در گل حفاری به منظور حفاری و استخراج نفت خام استفاده میشود. عنصر فرانسیم کاربرد فراوانی ندارد و استفاده از آن در آزمایشهای «اسپکتروسکوپی» (Spectroscopy) رواج دارد.
در پایان اگر مطالب گفته شده در بالا برای شما مفید بوده است، آموزشهای زیر به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش رسم چند بعدی ساختار شیمیایی با ChemOffice (کم آفیس)
- تعریف واکنش شیمیایی — به زبان ساده
- تیتراسیون — به زبان ساده
^^










