طیف نشری چیست؟ – تشکیل + کاربرد – به زبان ساده
«طیف نشری» (Emission Spectrum) به پرتوهای نور گسیل شده به دلیل انتقال الکترون از سطح با انرژی بالاتر به سطح با انرژی پایینتر گفته میشود که طول موج و «بسامد یا فرکانس» (Frequency) مشخصی دارند. طیف نشری شامل طیف نشری پیوسته و طیف نشری خطی میشود. طیف نشری خطی برای هر ماده منحصر به فرد است و از آن برای شناسایی و آنالیز مواد استفاده میکنند. با مطالعه این مطلب درک میکنیم که طیف نشری چیست و چه کاربردهایی دارد.
طیف نشری چیست ؟
انتقال الکترون از سطح انرژی بالاتر یا مدارهای دورتر از هسته اتم به سطح انرژی پایینتر یا مدارهای نزدیکتر به هسته با از دست دادن انرژی همراه است. این انرژی به شکل نور یا فوتونهایی با فرکانس و طول موجهایی مشخص است که به آنها طیف نشری گفته میشود.
نخستین بار نیوتن با تجزیه نور خورشید نشان داد که این نور از اجزا مختلفی تشکیل شده و در صورت به هم پیوستن این اجزا، دوباره نور سفید ایجاد میشود. وقتی مادهای انرژی بگیرد یا به آن انرژی داده شود طیف نشری را میتوان مشاهده کرد. انرژی میتواند به شکل انرژی گرمایی یا تخلیه الکتریکی با ولتاژ بالا باشد.

طیف نشری خطی چگونه ایجاد میشود ؟
برهمکنش تابشهای الکترومغناطیسی با اتمها و مولکولهای ماده باعث جذب انرژی توسط برخی از الکترونها میشود. الکترونها با جذب این انرژی به سطوح انرژی بالاتری منتقل میشوند و پایداری خود را از دست میدهند. برای به دست آوردن پایداری و بازگشت به حالت قبل، الکترونها انرژی از دست میدهند و به سطح قبل یا سطحهایی با انرژی کمتر منتقل میشوند. این انرژی که به شکل امواج الکترومغناطیسی است، برخی در ناحیه مریی قرار دارند که توسط چشم به شکل نور دیده میشوند. تلاشها برای توضیح مفهوم طیف نشر اتمی موجب به وجود آمدن مکانیک کوانتومی شد.
آهن گداخته شده در دماهای مختلف رنگهای متفاوتی تابش میکند و با توجه به نوع رنگی که دارد میتوان میزان حرارت آن را حدس زد. رنگ سفید بالاترین دما و رنگ قرمز دمایی بین ۸۰۰ تا ۹۰۰ درجه سلسیوس دارد. همین درخشش قابل مشاهده بخشی از طیف نشری آهن است که در ناحیه مرئیِ «امواج الکترومغناطیس» (Electromagnetic Radiation | EMR) قرار دارد و توسط چشم دیده میشود و گرمای آهن نشان دهنده تابش «فروسرخ» (Infrared) است.

انواع طیف نشری
طیف نشری یا طیف گسیلی اتمها با توجه به فاز ماده مورد نظر به دو شکل پیوسته و خطی وجود دارد. برای طیف نشری خطی ماده باید در فاز گازی باشد.
طیف نشری پیوسته
وقتی تمام طول موجهای نور مرئی در طیف نمایش داده شود و رنگها از آبی تا قرمز در هم ادغام شده باشد، طیف نشری از نوع طیف نشری پیوسته است. نور خورشید و نور تابیده شده از فلز گداخته شده نوعی از طیف نشری پیوسته هستند.

طیف نشری خطی
وقتی تنها خطوطی از طیف نشری مشخص یا نشان داده شود، طیف نشری از نوع طیف نشری خطی است که طول موجهای مشخصی را نشان میدهد و به آن طیف اتمی نیز میگویند. وقتی ماده در فاز گازی باشد و به آن انرژی داده شود طیف نشری خطی قابل مشاهده است. طیف نشری خطی برای عناصر مانند اثر انگشت یک ویژگی منحصر به فرد است و هیچ طیفی نشری خطی دو عنصر مشابه هم نیست. دانشمندان سالها از این ویژگی بدون اینکه منشا آن مشخص باشد برای آنالیز و شناسایی اتمها و مواد شیمیایی ناشناخته استفاده میکردند.

تفاوت طیف نشری و جذبی
در طیف جذبی، پرتوهای نورِ منبعی داغ با چگالی زیاد از نمونه گازی عبور داده میشود. در این فرایند برخی از پرتوهای نور توسط نمونه جذب میشود. با عبور نور حاصل از منشور، اجزا جذب شده در طیف پیوسته به شکل خطوطی سیاه رنگ در میآیند. در شکل زیر تفاوت طیف نشری و جذبی نشان داده شده است.
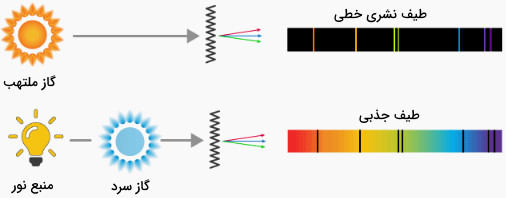
از روش طیف جذبی در طیفسنجی جذبی استفاده میشود. در جدول زیر برخی از روشهای جذبی فهرست شدهاست.
| نوع تابش الکترومغناطیس | نوع طیفسنجی |
|---|---|
| پرتو ایکس | طیفسنجی جذبی پرتو ایکس (XAS) |
| مرئی و فرابنفش | طیفسنجی مرئی-فرابنفش (UV–Vis) |
| فروسرخ | طیفسنجی فروسرخ (IR) |
| مایکروویو | طیفسنجی مایکروویو |
| موج رادیویی | تشدید پارامغناطیسی الکترون (EPR) |
| طیفسنجی تشدید مغناطیسی هستهای (NMR) |
طیف نشری هیدروژن
نخستین بار نیلز بور طیف نشری هیدروژن را شرح داد. در مدل اتمی بور توضیح داده شده بود که الکترون تنها میتواند در سطوح انرژی مشخصی قرار گرفته و به دور هسته چرخش کند و انرژی الکترون به شکل «کوانتیده» (Quantized) است. الکترون هرچه از هسته دورتر باشد انرژی بیشتری دارد و برای جدا کردن الکترونهای نزدیکتر به هسته به میزان انرژی بیشتری نیاز است. در این مدل دلیل تابش نور اتمهای هیدروژن پرانرژی به انتقال الکترونهای پرانرژیتر در مدار یا مدارهای بالاتر به مدار پایینتر و کاهش انرژی آن نسبت داده شد.
شکل زیر چیدمانی تجربی را برای مطالعه طیف نشری نشان میدهد. در این سیستم نمونه به شکل گاز در لوله تخلیه که از دو سمت به دو الکترود وصل است قرار میگیرد. با برقراری جریان الکتریکی و حرکت الکترونها از الکترود منفی به الکترود مثبت با نمونه برخورد دارند که موجب تابش نور توسط اتمهای گاز میشود. سپس نور با عبور از شکاف و برخورد با منشور تجزیه میشود. پرتو نور یک بار هنگام ورود به منشور از محیط رقیق (هوا) به محیط غلیظ (منشور) و یک بار هنگام خروج از آن شکسته میشود. اجزا با توجه به طول موجی که دارند در خطوط مشخصی قرار میگیرند که به آن خطوط طیفی میگویند.
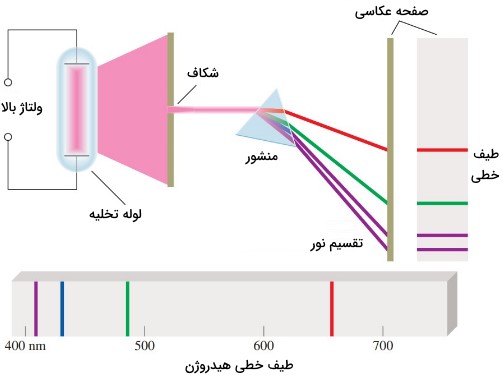
طیف به دست آمده از تجزیه نور، طیفی از رنگهای قرمز تا بنفش را شامل میشود. هر چه طور موج رنگ کمتر باشد، آن رنگ انحراف بیشتری دارد و رنگهایی با طول موج بیشتر، انحراف کمتری دارند. در طیف نشری خطی هیدروژن همراه با طول موجهای آن، رنگ قرمز با انحراف کمتر، طول موج بیشتر و رنگ بنفش با انحراف بیشتر، طول موج کمتری دارد.
مقدار انرژی یک الکترون در اتم هیدروژن با استفاده از معادله زیر نشان داده شد که در آن «ثابت ریدبرگ» (Rydberg Constant) برای اتم هیدروژن و عدد کوانتومی اصلی است.
- ثابت ریدبرگ برای هیدروژن : ژول
- : ۱، ۲، ۳، ۴، ....
علامت منفی در معادله، قراردادی بوده و به این معنی است که الکترونی که در اتم به دور هسته میچرخد انرژی کمتری از الکترون آزاد دارد. انرژیِ الکترون آزاد برابر با صفر در نظر گرفته شده که اگر باشد با معادله نیز مطابقت دارد.
هرچه الکترون به هسته نزدیک تر شود یعنی کاهش پیدا کند، مقدار نیز با علامت منفی افزایش پیدا میکند. وقتی باشد مقدار بزرگترین اندازه و الکترون کمترین میزان انرژی یا پایدارترین حالت خود را دارد. حالت پایه، پایینترین حالت انرژی در سیستم است. به سطحهایی که است، سطح یا حالت برانگیخته گفته میشود. در حالت برانگیخته سطح انرژی بالاتر از حالت پایه است.
الکترون در اتم با جذب انرژی از سطحی که انرژی کمتری دارد که با کمتر مشخص میشود به سطح بالاتر با انرژی بیشتر منتقل میشود. عکس این فرایند نیز زمانی است که الکترون از سطح با انرژی بالاتر به سطح با انرژی کمتر منتقل میشود و به صورت نور و فوتون انرژی آزاد میکند.
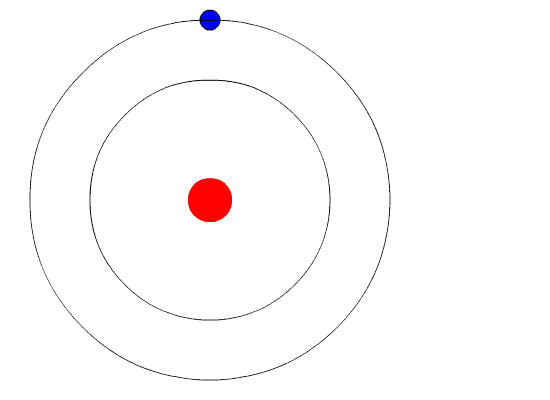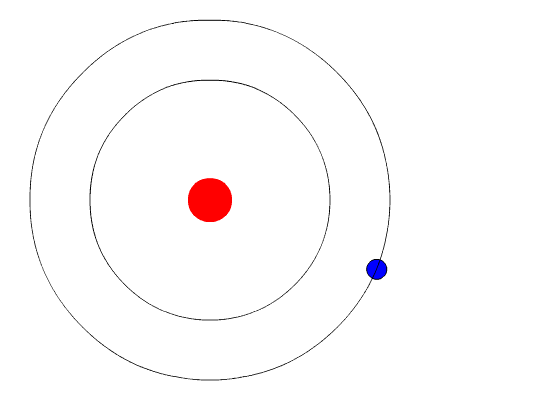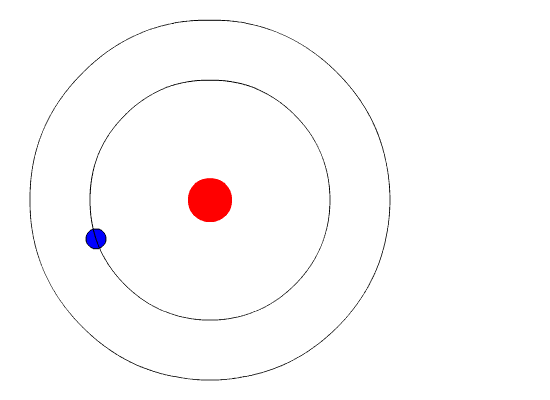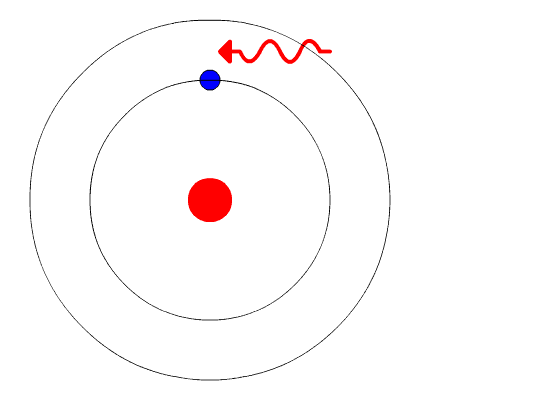
حرکت الکترون بین سطوح مانند حرکت توپی روی پله است. توپ برای پایین آمدن نیازی به انرژی ندارد و در مقابل برای بالا رفتن باید انرژی مصرف شود، افزون بر این توپ میتواند روی هر سطحی از پلهها باشد ولی نمیتواند بین پلهها قرار گیرد. مقدار انرژی مورد نیاز یا آزاد شده به فاصله بین سطحهای شروع و پایین انتقال بستگی دارد.
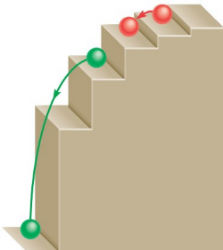
در فرایند تابش نور در هیدروژن فرض میشود که در ابتدا الکترون در حالت برانگیخته و در سطحی با انرژی بالاتر است. این سطح با عدد کوانتومی اصلی و مقدار انرژی آن با مشخص میشود. با نشر فوتون و از دست دادن انرژی، الکترون به سطحی با انرژی کمتر منتقل میشود. این سطح با عدد کوانتومی اصلی و مقدار انرژی آن با مشخص میشود. این سطح میتواند حالت پایه یا حالت برانگیخته با انرژی کمتر باشد.
به این ترتیب میتوان برای هر سطح مقدار انرژی را از معادله بالا به دست آورد. تفاوت انرژی دو سطح از معادله محاسبه میشود و مقدار و به صورت زیر به دست میآید.
و
با جایگذاری در معادله مقدار به صورت زیر به دست میآید.
فوتون نشر شده با فرکانس انرژی خواهد داشت. بنابراین برابر است با:
نشر نور یعنی است؛ در نتیجه مقدار داخل پرانتز منفی و نیز منفی است که یعنی انرژی از دست داده شده و الکترون از سطحی با انرژی بالاتر به سطحی با انرژی کمتر منتقل شده است. با جذب انرژی، است و مقدار داخل پرانتز و مثبت هستند.
خطوط طیفی هیدروژن
در طیف نشری، هر انتقال از الکترون، خط مشخصی دارد و سطوح انرژی که با نقاط شروع و پایان یک خط مشخص میشود با خط دیگر متفاوت است. میزان روشنی و تاری هر خط در طیف نشری خطی به تعداد فوتونهای گسیل شده با فرکانس و طول موج یکسان بستگی دارد.
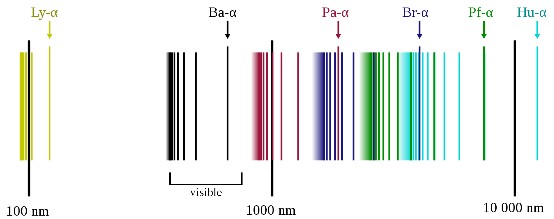
همه انتقالهایی که الکترون هیدروژن ممکن است داشته باشد با مطالعه تعداد زیادی از اتمهای این عنصر به دست آمده که نتایج آن در جدول زیر قرار داده شده است. طیف نشری هیدروژن طول موجهایی از فروسرخ تا فرابنفش را شامل میشود و خطوط بر اساس نام کاشف آنها نامگذاری شدهاند. از سری ششم به بعد نامگذاری وجود ندارد.
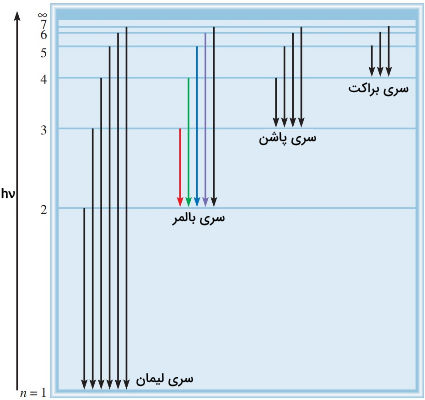
بالمبر در ابتدا بر اساس نتایج تجربی فرمول زیر را برای خطوط طیفی هیدروژن پیشنهاد داد.
سری بالمبر تنها سری از خطوط طیفی هیدروژن در ناحیه مرئي است. سپس ریدبرگ، فرمولی کلی برای محاسبه خطوط طیفی هیدروژن به دست آورد. این فرمول به صورت زیر ارائه شد.
سریها هیدروژن به ترتیب زیر هستند.
- «سری لیمان» (Lyman Series): مقدار n = ۱ است و خطوط در ناحیه فرابنفش قرار دارند.
- «سری بالمر» (Balmer Series): مقدار n = ۲ است و خطوط در ناحیه فرابنفش و مرئی قرار دارند.
- «سری پاشن» (Paschen Series): مقدار n = ۳ است و خطوط در ناحیه فروسرخ قرار دارند.
- «سری براکت» (Brackett Series): مقدار n = ۴ است.
- «سری فوند» (Pfund Series): مقدار n = ۵ است.
- «سری هامفریز» (Humphreys Series): مقدار n =۶ است.
کاربردهای طیف نشری
از طیف نشری برای آنالیز آلیاژها، تعین میزان برخی عناصر در بدن مانند میزان کلسیم، مس و روی در خون، وجود روی در بافت پانکراس و تعیین میزان عناصر موجود در نفت خام استفاده میشود.
برخی از روش های آنالیز مواد که بر پایه طیف نشری بنا شدهاند عبارتند از:
- طیفسنجی نشری
- طیفسنجی نشر اتمی
- «طیفبینی انتشار اتمی پلاسمای جفتشده القایی» (Inductively Coupled Plasma Atomic Emission Spectroscopy | ICP-AES)
- «طیفبینی فوتوالکترون پرتو ایکس» (X-ray Photoelectron Spectroscopy | XPS)
- «طیفبینی فروشکست القایی لیزری» (Laser-induced Breakdown Spectroscopy | LIBS)
- «طیفبینی فلورسانس» (Fluorescence Spectroscopy)
طیف سنجی نشری
«طیفسنجی نشری» (Emission Spectrometry) از روشهای طیفسنجی در شیمی است که پرتوهای تابش شده از اتمها و مولکولها را هنگام انتقال به سطوح با انرژی پایینتر را با توجه به طول موجی که دارند مورد مطالعه و بررسی قرار میدهد. همه پرتوهای نور تابش شده هنگام انتقال در ناحیه مرئی نیستند و برخی از این پرتوها در نواحی فرابنفش و فروسرخ هستند.
با گرم کردن عناصر و ترکیبات مختلف توسط شعله یا قوس الکتریکی، موجب درخشان شدن و ساطع شدن نور از آنها میشود. با تجزیه این نور و آنالیز آن توسط دستگاه طیفسنج طیفی خطی است. «طیفبین» (Spectroscope) یا «طیفسنج» (Spectrometer) ابزاری است که برای جداسازی اجزا نور بر اساس طول موجهای آن استفاده میشود. منحصر بودن این خطوط طیفی نشان دهنده این است که از هر عنصر تنها انرژی مشخصی میتواند تابش شود.
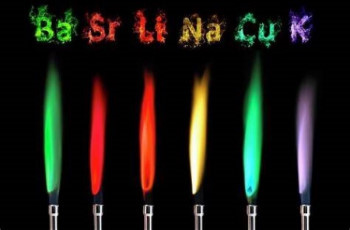
از این ویژگی برای شناسایی و تعیین ترکیبات یک ماده استفاده میشود. با استفاده از طیفسنجی نجومی و آنالیز نور دریافتی از ستارگان ماهیت آنها را مشخص میکنند. همچنین با استفاده از طول موجهای مشخصی که هر عنصر، عناصر موجود در یک ترکیب را میتوان شناسایی کرد.
طیف سنجی نشر اتمی
«طیفسنجی نشر اتمی» (Atomic Emission Spectroscopy | AES) با توجه به شدت نور شعله برای تعیین مقدار عناصر در نمونه استفاده میکنند. طول موج طیف هویت عنصر و شدت نور، میزان یا مقدار یک عنصر در ترکیب را نشان میدهد. نمونه به شکل گاز روی شعله اسپری میشود یا بهطور مستقیم با استفاده از سیمی از جنس پلاتین داخل شعله قرار میگیرد. با گرم شدن حلال، پیوندهای مولکولی ترکیب شکسته شده و اتمها به صورت آزاد در میآیند و با گرفتن گرمای بیشتر، برانگیخته میشوند.
سوالات متداول
در زیر به برخی از رایجترین پرسشها در زمینه طیف نشری پاسخ داده شده است.
امواج الکترومغناطیس چگونه تولید میشود؟
امواج الکترومغناطیسی از میدانهای الکتریکی و مغناطیسی تشکیل شدهاند. امواج رادیویی، ریزموج، فروسرخ، نور، فرابنفش، پرتو ایکس و پرتوهای گاما بخشی از طیف الکترومغناطیسی هستند.
طیف سنجی جذبی چیست؟
طیفسنجی یکی از روشهای مطالعه برهمکنش امواج الکترومغناطیسی با ماده است که یکی از کاربردهای آن شناسایی مواد است. در طیف سنجی جذبی، بخشی از طیف الکترومغناطیسی توسط نمونه جذب میشود.
کوتاه ترین طول موج رشته بالمر کدام است؟
در سری بالمر بیشترین طول موج با ۶۵۶٫۳ مربوط به رنگ قرمز و کمترین طول موج در ناحیه مرئی مربوط به رنگ بنفش با طول ۴۱۰٫۲ نانومتر است.












سلام ممنون از توضیحات عالیتون. فقط اینکه میزان اشعه الکترومغناطیسی و یا حرارت که برای برانگیخته کردن یک اتم استفاده میشه به چه صورته؟ یعنی اگر دما رو افزایش یا کاهش بدیم اتم های دیگری که در دمای قبلی نشر انجام ندادن. نشر می کنن؟
با سلام،
افزایش دما یکی از سادهترین روشها برای برانگیختگی اتم است. افزایش دما سبب افزایش انرژی جنبشی اتمها و برخورد آنها به یکدیگر میشود. بنابراین، الکترونهای اتم برانگیخته خواهند شد. الکترون در حالت برانگیخته پایدار نیست، بنابراین با تابش انرژی به شکل امواج الکترومغناطیسی، به حالت اولیه خود برمیگردد. همچنین، با تابش امواج الکترومغناطیسی به اتم، الکترونهای آن را میتوانیم برانگیخته کنیم. اینکه الکترون از تراز اولیه خود به چه ترازی برانگیخته شود، به انرژی جذب شده توسط آن بستگی خواهد داشت. به عنوان مثال، ممکن است اتمی مثل کلر با انرژی E برانگیخته شود، اما فلور با این انرژی برانگیخته نخواهد شد و برای برانگیختگی آن به انرژی بسیار بیشتری نیاز است.
با تشکر از همراهی شما با مجله فرادرس
دهمم عالی بود 😍😍😍😍