باز در شیمی چیست؟ – به زبان ساده
در مطالب پیشین «مجله فرادرس» در خصوص اسیدها و بازها و همچنین مفهوم اسید صحبت کردیم، در ادامه قصد داریم به مفهوم «باز» (Base) در شیمی اشاره و تعاریف مختلف آنرا بیان کنیم. مشابه تعریف اسیدها، برای بازها نیز باز آرنیوس، برونستد و لوییس ارائه میشود. تمام این تعریفها بیان میکنند که بازها موادی هستد که با اسیدها وارد واکنش میشوند.
- میآموزید باز در شیمی چیست و چه خواصی دارد.
- با نعاریف مختلف باز مانند تعریف لوری برونستد و آرنیوس آشنا میشوید.
- میتوانید انواع مختلف باز را با توجه به ساختار و معادله تفکیک آنها تشخیص دهید.
- با خاصیت بازی مواد در ترکیبات غیرهیدروکسید آشنا میشوید.
- یاد میگیرید چگونه برخی از بازها به عنوان کاتالیزور در فرآیندها عمل میکنند.
- با کاربردها و اسیدیته بازها به شکل کامل آشنا میشوید.


باز چیست؟
باز به موادی گفته میشود که مقدار pH آنها بین عدد ۷ تا ۱۴ است. این مواد طعمی تلخ و حالتی لیز و صابونی دارند. این مواد معمولا میتوانند در آب یون هیدروکسید آزاد کرده یا الکترون آزاد کنند. این مواد، رنگ کاغذ لیتموس را از قرمز به آبی تغییر میدهند و یکی از مهم ترین مواد در صنعت تولید شونیده، صابون و مواد بهداشتی هستند.
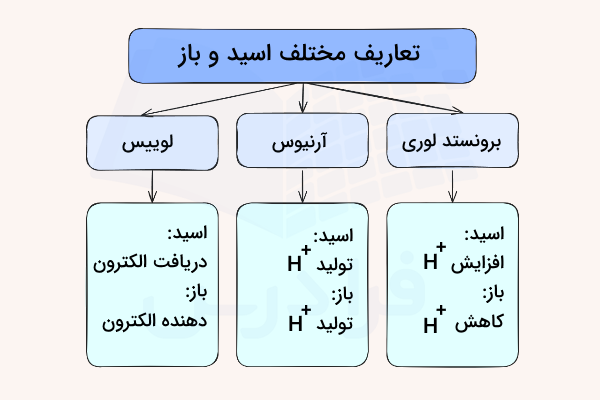
تعاریف مختلفی برای بازها اراسه شده است که از جمله آنها میتوان به تعریف برونستد لوری، لوییس و آرنیوس اشاره کرد. این موارد در ادامه معرفی خواهد شد.
تعریف باز آرنیوس
نظریه آرنیوس در سال ۱۸۸۴ بیان کرد که بازها ترکیباتی هستد که در اثر تفکیک در محلولهای آبی، یون هیدروکسید آزاد میکنند. این یونها با یونهای هیدروژن حاصل از تفکیک اسیدها واکنش میدهند که در اثر این واکنش اسید-باز، آب و نمک به تولید میرسند. بنابراین، طبق این تعریف، بازها هیدروکسید فلزی مانند سدیم هیدروکسید یا کلسیم هیدروکسید به شمار میآیند.
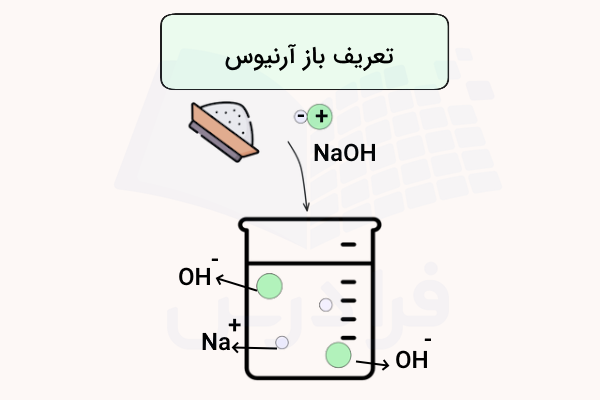
این محلولهای هیدروکسید همچنین خواص مشخص دیگری نیز دارند که از میان آنها میتوان به لزج بودن و مزه تلخ آنها اشاره کرد. همچنین، رنگ این مواد در برابر شناساگرهای اسید و باز مانند کاغذ لیتموس، تغییر میکند.
در آب، با تغییر تعادل خودیونش آب، بازها محلولهایی بدست میدهند که اکتیویته یون هیدروژن در آنها کمتر از آب خالص است به این معنی که pH آب در شرایط استاندارد، مقداری بالاتر از ۷ دارد. اکسیدهای فلزی، هیدروکسیدها و آلکوکسیدها همگی بازی هستند. علاوه بر این، باز مزدوج اسیدهای ضعیف، بازهایی قوی به شمار میآیند.
اسیدها و بازها مواد شیمیایی متضاد یکدیگر به شمار میآیند زیرا اسید سبب افزایش غلظت یون هیدرونیوم و باز سبب کاهش آن میشود. به واکنش بین محلولهای آبی اسید و باز، «واکنش خنثی شدن» (Neutralization Reaction) میگویند که در اثر این واکنش، فرآوردههای آب و نمک تولید میشوند.
تعریف باز برونستد لوری
نظریهای جامعتر در خصوص اسید و باز، نظریه برونستد-لوری است که در سال ۱۹۲۳ ارائه شد. این نظریه بیان میکند که باز مادهای است که میتواند پذیرنده کاتیونهای هیدروژن یا پروتون باشد. این مورد شامل هیدروکسیدهای آبی نیز میشود چراکه در اثر واکنش با ، آب تولید میکند. به همین دلیل میتوان گفت بازهای آرنیوس نیز جزئی از بازهای برونستد به شمار میآیند.
علاوه بر این، بازهای برونستد دیگری نیز وجود دارند که پروتون میپذیرند که از جمله آنها میتوان به محلول آبی آمونیاک یا مشتقات آلی آن (آمینها) اشاره کرد. این بازها یون هیدروکسید ندارند اما با آب، واکنش و غلظت یون هیدروکسید را افزایش میدهند. همچنین برخی از حلالهای غیرآبی حاوی بازهای برونستد هستند که با پروتونهای آبپوشی شده واکنش میدهند. به طور مثال، در آمونیاک مایع، یون ، ذرهای بازی به شمار میآید که از ذره اسیدی در این حلال یعنی کاتیون آمونیوم ، پروتون جذب میکند.

تعریف باز لوییس
«گیلبرت لوییس» (G. N. Lewis) دریافت که آب، آمونیاک و سایر بازها میتوانند با پروتون، به دلیل وجود الکترون ناپیوندی بازها، پیوند تشکیل دهند. در نظریه لوییس، باز به یک دهنده دهنده الکترون میگویند که میتواند یک جفت الکترون را با یک پذیرنده الکترون (اسید لوییس) به اشتراک بگذارد.
نظریه لوییس، عمومیت بیشتری نسبت به مدل برونستد-لوری دارد چراکه مدل اسید لوییس لزوما یک پروتون نیست بلکه میتواند مولکول یا یون دیگری با اوربیتال خالی باشد که توانایی پذیرش جفتالکترون را دارد.
واکنش بازها
در ادامه، واکنش بازها را در قالب خنثی کردن اسیدها و واکنش بین آب و باز بررسی میکنیم. این واکنشها بسیار کاربردی هستند و پایه انجام بسیاری از فرآیندها در آزمایشگاه شیمی و فرآیندهای صنعتی مختلف هستند. پیشنهاد می کنیم برای آشنایی بیشتر با این کاربردها، فیلم آموزش کاربرد بازها در زندگی روزمره و صنایع مختلف فرادرس که لینک ان در ادامه آورده شده است را مشاهده کنید.
واکنش بین آب و باز
واکنش زیر، واکنش کلی بین یک باز و آب برای تولید اسید مزدوج و باز مزدوج را نشان میدهد.
ثابت تعادل برای واکنش بالا را نیز میتوان به صورت زیر نوشت:
خنثی کردن اسیدها
هم در آب و هم در الکلها، بازها به سرعت با اسیدها واکنش میدهند و یکدیگر را خنثی میکنند. باز قوی سدیم هیدروکسید به هنگام انحلال در آب، به یونهای سدیم و هیدروکسید طبق واکنش زیر، تفکیک میشود:
به طور مشابه نیز، آب و هیدروژن کلرید با یکدیگر واکنش میدهند و یونهای کلرید و هیدرونیوم تولید میشود:
زمانی که این دو محلول با یکدیگر مخلوط شوند، یونهای هیدرونیوم و هیدروکسید با یکدیگر ترکیب خواهند شد تا مولکول آب تولید شود.
اگر مقادیر موازی از سدیم هیدروکسید و هیدروکلریک اسید با یکدیگر مخلوط شوند، اسید و باز به طور کامل یکدیگر را خنثی میکنند در نتیجه آن، تشکیل نمک طعام رخ میدهد. از بازهای ضعیف مانند جوش شیرین و سفیده تخم مرغ برای خنثی کردن اثر قطرات اسیدی استفاده میشود. خنثیسازی اسید با بازهای قوی مانند سدیم هیدروکسید یا پتاسیم هیدروکسید میتواند سبب بروز واکنشهای شدید گرماده شود و باز در این حالت به تنهایی میتواند به اندازه اسید خطرناک باشد.
خاصیت بازی در ترکیبات غیر هیدروکسید
همانطور که پیشتر هم گفته شد، بازها ترکیباتی هستند که مقادیری از اسید را خنثی میکنند. سدیم کربنات و آمونیاک هر دو از جمله بازها به شمار میآیند.
با وجود اینکه هیچیک از این مواد، شامل گروه نیستند اما هردو یون هیدروژن را به هنگام انحلال در حلال پروتونی همچون آب، میپذیرند که واکنش این مواد در زیر آورده شده است.
به کمک معادلات بالا میتوان میزان خاصیت اسیدی یا همان pH را برای بازها در محلولهای آبی بدست آورد. بازها همچنین به طور مستقیم به عنوان دهنده جفتالکترون عمل میکنند که واکنش آن در زیر آورده شده است:
بازها را علاوه بر این به صورت مولکولهایی تعریف میکنند که توانایی پذیریش یک جفتالکترون پیوند را از طریق ورود به لایه ظرفیت اتم دیگر داشته باشند. تعداد محدودی از عناصر وجود دارند که شامل اتمهایی با خاصیت بازی باشند. نیتروژن، اکسیژن و کربن از جمله این عناصر هستند. همچنین، فلوئور و گازهای نجیب نیز چنین توانایی را از خود نشان میدهند. این مورد در ترکیباتی همچون بوتیل لیتیوم، آلکوکسیدها و آمیدهای فلزی همچون سدیم آمید رخ میدهد.
بازهای کربن، نیتروژن و اکسیژن که پایداری رزونانسی ندارند به طور معمول، بازهایی بسیار قوی یا «ابر باز» (Superbase) هستند که در محلولهای آبی به دلیل خاصیت اسیدی آب، حضور ندارند. پایداری رزونانسی، بازهای ضعیف همچون کربوکسیلاتها را بوجود میآورد. به طور مثال، سدیم استات یک باز ضعیف به شمار میآید.

انواع بازها
در ادامه، به بررسی انواع مختلف باز در شیمی خواهیم پرداخت. پیشنهاد میکنمی برای درک بهتر خواص بازها و تفاوت آن ها با اسیدها و روش تشخیص این مواد، مطلب روش تشخیص اسید و باز مجله فرادرس را مطالعه کنید.
بازهای قوی
یک باز قوی به ترکیبی شیمیایی میگویند که بتواند یک پروتون را در یک واکنش اسید-باز، از یک مولکول اسید حتی اسید بسیار ضعیف (مانند آب) جدا کند. از نمونههای بازهای قوی میتوان به فلزات قلیایی و قلیایی خاکی اشاره کرد. به دلیل انحلالپذیری پایین در برخی از بازها همچون هیدروکسیدهای فلزات قلیایی، زمانی که به ضریب انحلالپذیری نیازی نداشته باشیم، از این نوع بازها بهره میگیریم.
بسیاری از ضداسیدها، سوسپانسیونی از هیدروکسید فلزی مانند آلومینیوم هیدروکسید و منیزیم هیدروکسید هستند. این ترکیبات، انحلالپذیری پایینی دارند و میتوانند از افزایش غلظت یون هیدروکسید جلوگیری کنند تا به بافت های دهان، مری و معده آسیب وارد نشود. با ادامه واکنش و انحلال این مواد، اسید معده با هیدروکسید تولیدی از سوپانسیون واکنش میدهند.
بازهای قوی همچنین در آب به طور کامل هیدرولیز و سبب ایجاد «اثر همتراز کنندگی» (Leveling Effect) میشود. در این فرآیند، مولکولهای آب با باز قوی ترکیب میشوند و به دلیل خاصیت آمفوتری آب، یک یون هیدروکسید آزاد خواهد شد. اسیدهای بسیار قوی، گروههای با خاصیت اسیدی بسیار ضعیف را در غیاب آب، دپروتونه (پروتونزدایی) میکنند. در جدول زیر، نام و فرمول شیمیایی چندین باز قوی نوشته شده است. کاتیون این بازهای قوی در گروههای اول و دوم از جدول تناوبی یعنی فلزات قلیایی و قلیایی خاکی یافت میشوند.
| نام باز | فرمول شیمیایی |
| لیتیوم هیدروکسید | |
| سدیم هیدورکسید | |
| پتاسیم هیدروکسیدها | |
| روبیدیم هیدروکسید | |
| سزیم هیدروکسید | |
| منیزیم هیدروکسید | |
| کلسیم هیدروکسید | |
| استرانسیوم هیدروکسید | |
| باریم هیدروکسید | |
| تترامتیل آمونیوم هیدروکسید | |
| گوانیدین |
ابر بازها
نمکهای کربانیونها، آمیدها و هیدریدهای گروه ۱، به دلیل ضعیف بودن اسیدهای مزدوج خود، بازهایی بسیار قوی به شمار میآیند. به طور معمول، این بازها را از طریق اضافه کردن فلزات قلیایی خاصل به اسید مزدوج بدست میآورند. به این مواد، ابر باز میگویند و به دلیل اینکه بازهایی قویتر از یون هیدروکسید هستند، نمیتوان آنها را در محلولهای آبی نگهداری کرد. به طور مثال، یون اتوکسید (باز مزدوج اتانول)، در حضور آب، وارد واکنش زیر میشود.
در جدول زیر، نمونههایی از ابر بازها آورده شدهاند:
| نام ابر باز | فرمول شیمیایی |
| بوتیل لیتیوم | |
| لیتیم دیایزوپروپیلآمید | |
| لیتیم دیاتیلآمید | |
| سدیم آمید | |
| سدیم هیدرید | |
| لیتیوم بیس (تری متیل سیلیل) آمید |
توجه داشته باشید که قویترین ابربازها را تنها در فاز گازی سنتز کردهاند. ترکیبات زیر به ترتیب، قویترین بازهای سنتز شده به شمار میآیند.
- اورتو دیآنیون دیاتینیلبنزن
- دی دیآنیون دیاتینیلبنزن
- پارا دیآنیون دیاتینیلبنزن
قبل از شناسایی ایزومرهای دیآنیون دیاتینیلبنزن، لیتیوم مونواکسید آنیون با فرمول به عنوان قویترین ابر باز شناخته شده بود.
بازهای ضعیف
باز ضعیف به بازی میگویند که در محلولهای آبی به خوبی تفکیک نمیشود یا اینکه پروتوندهی در آن به طول کامل صورت نمیگیرد. از جمله مثالهای باز ضعیف میتوان به تفکیک آمونیاک اشاره کرد که واکنش آن پیشتر آورده شد. ثابت تعادل برای این واکنش در دمای ۲۵ درجه سانتیگراد برابر با است.

بازهای جامد
بسته به توانایی سطح جامد برای تشکیل باز مزدوج با جذب الکتریکی یک اسید، قدرت باز را میتوان تعیین کرد. برای بیان میزان بازِ موجود در سطح یک کاتالیزور بازی، از تعداد محلهای بازی به ازای یک واحد سطح جامد استفاده میکنند. دانشمندان، روشهایی را برای اندازهگیری این مقدار، توسعه دادهاند که یکی از این روشها تیتراسیون با بنزوییک اسید و استفاده از جذب سطحی گاز اسیدی است. در روش دیگر، یک جامد با قدرت بازی کافی، یک شناساگر اسیدی را جذب میکند و سبب میشود تا رنگ شناساگر به رنگ باز مزدوج تغییر کند که به طور معمول از نیتریک اکسید استفاده میشود. در نهایت، مقدار محلهای بازی با استفاده از مقدار دیاکسید کربن جذب شده محاسبه میشود.
بازهایی به عنوان کاتالیزور
مواد بازی را میتوان به عنوان کاتالیزورهای ناهمگن نامحلول در واکنشهای شیمیایی استفاده کرد. از جمله این کاتالیزورها میتوان به اکسیدهای منیزیم، کلسیم و باریم اشاره کرد. بسیاری از فلزات واسطه، کاتالیزورهای خوبی به شمار میآیند و بسیاری از آنها، موادی بازی را تشکیل میدهند. در واکنشهای بسیاری همچون هیدروژناسیون، مهاجرت پیوند دوگانه و همچنین واکنش مایکل از باز به عنوان کاتالیزور بهره میگیرند.
کاربرد بازها
در طول این آموزش، کاربردهای زیادی را برای بازها ذکر کردیم اما در ادامه اشارهای کوتاه به برخی دیگر از کاربردهای باز خواهیم داشت.
- از سدیم هیدروکسید در تولید صابون، کاغذ و فیبرهای سنتزی استفاده میشود.
- کلسیم هیدروکسید در تولید پودر سفید کننده کاربرد دارد.
- دیاکسید گوگرد حاصل از کارخانجات و نیروگاههای تولیدی، به کمک کلسیم هیدروکسید پاکسازی میشوند.
- از سدیم کربنات برای رفع سختی آب بهره میگیرند.
- سدیم بیکربنات (سدیم هیدروژن کربنات) به عنوان جوش شیرین در شیرینیپزی و همچنین به عنوان ضد اسید و خاموشکنندههای آتش مورد استفاده قرار میگیرد.
- برای پاک کردن لکههای چربی از روی لباسها از آمونیوم هیدروکسید کمک میگیرند.
اسیدیته بازها
به تعداد یونهای هیدروکسید تفکیکپذیر در یک مولکول باز، اسیدیته باز میگویند. بر اساس اسیدیته بازها، آنها را میتوان به سه نوع بازهای مونواسیدی (تکظرفیتی)، دیاسیدی (دوظرفیتی) و تریاسیدی تقسیم کرد.
- بازهای مونو اسیدی: زمانی که یک مولکول باز از طریق تفکیک کامل، یک یون هیدروکسید تولید کند، به آن «باز مونواسیدی» (Monoacidic Base) میگویند. از نمونههای این بازها میتوان به سدیم هیدروکسید، پتاسیم هیدروکسید، نقره هیدروکسید و آمونیوم هیدروکسید اشاره کرد.
- بازهای دی اسیدی: هنگامی که یک مولکول باز، از طریق تفکیک کامل، دو یون هیدروکسید تولید کند، «باز دیاسیدی» (Diacidic Base) خواهیم داشت. باریم هیدروکسید، منیزیم هیدروکسید، کلسیم هیدروکسید، آهن (II) هیدروکسید و مس (II) هیدروکسید از جمله این نوع از بازها به شمار میآیند.
- بازهای تری اسیدی: به طور مشابه نیز زمانی که سه یون هیدروکسید از طریق تفکیک کامل یک مولکول بازی به تولید برسند، «باز تریاسیدی» (Triacidic Base) خواهیم داشت. از جمله این نوع بازها میتوان به آلومینیوم هیدروکسید و فروس هیدروکسید اشاره کرد.












