روشهای جداسازی مواد در شیمی – از صفر تا صد
در شیمی میتوان به کمک روشهای جداسازی مواد، یک آنالیت یا دیگر ترکیبات شیمیایی را از یکدیگر جدا کرد. البته این کار زمانی انجام میشود که مواد، حداقل در یکی از خواص فیزیکی یا شیمیایی، اختلاف زیادی داشته باشند. در حقیقت، یکی از مهمترین فعالیتهای شیمیدانها، شامل جداسازی مواد و خالصسازی ترکیبات شیمیایی است. به طور مثال، «استخراج» (Extraction) یکی از روشهای پرکاربرد برای جداسازی ترکیباتی همچون و از یکدیگر به شمار میآید که این دو ترکیب، قطبیتهای متفاوتی دارند.


این ترکیبات را به کمک مخلوطی از حلالهای قطبی مانند آب و حلالهای ناقطبی همچون از یکدیگر جدا میکنند. ترکیبات در و در آب حل میشوند. جدول زیر، فهرستی از روشهای جداسازی مواد را بر اساس خواص فیزیکی یا شیمیایی نشان میدهد. در شیمی، به مادهای که بخواهیم جداسازی و بررسی روی آن انجام دهیم، «آنالیت» (Analyte) میگویند. همچنین، جزء دیگری که باید از آنالیت جدا شود، موسوم به «تداخلکننده» (Interferent) است.
| اساس جداسازی مواد | روش جداسازی مواد |
| اندازه | فیلتراسیون |
| دیالیز | |
| کروماتوگرافی اندازه طردی | |
| جرم یا چگالی | سانتریفیوژ |
| «پوشش» (Masking) | تشکیل کمپلکس |
| تغییر در حالت فیزیکی | تقطیر |
| تصعید | |
| تبلور مجدد | |
| تغییر در حالت شیمیایی | رسوب |
| رسوبدهی الکتریکی | |
| تبخیر | |
| تقسیمبندی بین فازها | استخراج |
| کروماتوگرافی |
جداسازی بر اساس اندازه
از جمله روشهای جداسازی مواد میتوان به جداسازی بر اساس اندازه اشاره کرد. «اندازه» (Size)، سادهترین خاصیت فیزیکی است که میتوان برای این منظور از آن بهره گرفت. برای دستیابی به این روش، از یک محیط متخلخل استفاده میکنیم که فقط یک جزء مانند آنالیت توانایی عبور از میان آن را دارد. از جمله نمونههای جداسازی مواد بر اساس اندازه میتوان به «فیلتراسیون» (Filteration)، «دیالیز» (Dialysis) و «اندازه طردی» (Size Exclusion) اشاره کرد.
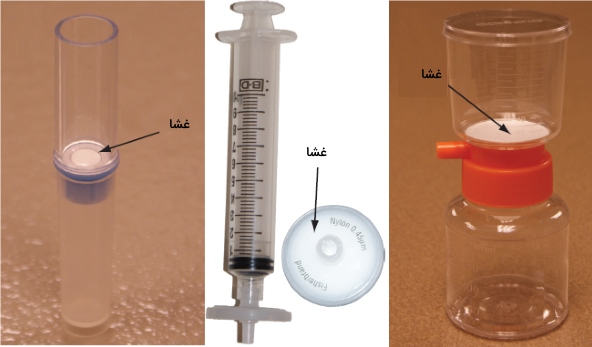
در فیلتراسیون، اجزا را به کمک یک فیلتر از یکدیگر جدا میکنیم. مادهای که از فیلتر عبور میکند، «فیلترات» نام دارد و مادهای که در پشت فیلتر جمع میشود موسوم به کیک فیلتر است. در مواردی، به کیک فیلتر، «پسآب» (Retantate) نیز میگویند. فیلتراسیون ثقلی و خلاء از جمله نمونههای این نوع از روشهای جداسازی مواد هستند. در مواردی که محلول، شامل ذرات بسیار ریزی باشد، از «فیلترهای غشایی» (Membrane Filters) استفاده میشود. تصویر زیر، سه نوع مختلف از فیلترهای غشایی را نشان میدهد.
دیالیز
دیالیز، یکی دیگر از روشهای جداسازی مواد بر اساس اندازه است. در این روش، از یک غشای دیالیزی ساخته شده از سلولوز استفاده میکنند که این غشا به شکل لوله، کاسِت یا کیسه وجود دارد. در تصویر زیر میتوانید نمونهای از کاست دیالیز را ببینید. نمونه به داخل غشای دیالیزی تزریق میشود. این غشا از اطراف کاملا عایق شده است. این کاست را داخل ظرفی پر شده از یک محلول قرار میدهند که محلول مورد نظر، ترکیب شیمیایی متفاوتی از نمونه دارد.
اگر غلظت ذرات در دو طرف غشا متفاوت باشند، یک گرادیان غلظتی ایجاد و باعث میشود که نیرومحرکهای برای «نفوذ» (Diffusion) از طریق غشا فراهم شود. در این حالت، ذرات کوچکتر، از غشار عبور میکنند و ذرات بزرگتر در طرف دیگر باقی میمانند. از دیالیز به طور معمول برای خالصسازی پروتئینها، هورمونها و آنزیمها استفاده میشود. در زمان دیالیز کلیههای انسان، با عبور دادن خون از یک غشای دیالیزی، فرآوردههای حاصل از سوخت و ساز بدن همچون اوره، اسید اوریک و «کراتینین» (Creatinine) را از خون حذف میکنند.

کروماتوگرافی اندازه طردی
سومین نمونه از روشهای جداسازی مواد بر اساس اندازه، روش اندازه طردی است که در آن از یک ستون حاوی «ریزمهرههای» (Beads) پلیآکریل آمیدی استفاده میشود. اندازه حفرات را با استفاده از درجه «اتصال عرضی» (Cross-linking) کنترل میکنند. هرقدر اتصال عرضی ریزمهرهها بیشتر باشد، اندازه حفرات کوچکتر خواهد بود. نمونه مورد نظر را در مسیر جریان یک حلال قرار میدهند که با دبی جریان ثابتی به ستون کروماتوگرافی پمپ میشود. ذراتی که اندازه آنها از حفرات بزرگتر باشند، با همان سرعت حلال، از داخل ستون عبور میکنند. همچنین ذرات کوچکتر، زمان بیشتری را برای عبور از میان حفرات نیاز دارند. از کروماتوگرافی اندازه طردی به طور گسترده در تحلیل پلیمرها و همچنین جداسازی پروتئینها استفاده میشود.
جداسازی مواد بر اساس جرم یا چگالی
اگر دو ترکیبی که میخواهیم از یکدیگر جدا کنیم، در جرم یا چگالی با یکدیگر تفاوت داشته باشند، از سانتریفیوژ استفاده میکنیم. نمونه را در داخل لوله سانتریفیوژ قرار میدهند و این لوله با سرعت زاویهای زیادی چرخش میکند. ذرات نمونه، بر اثر نیروی گریز از مرکزی که به آنها اعمال میشود، به انتهای لوله سانتریفیوژ کشیده میشوند. ذراتی که نیروی گریز از مرکز بیشتری را حس میکنند، سریعتر در انتهای ظرف تهنشین خواهند شد.
اگر دو ذره مختلف، چگالی یکسانی داشته باشند، جداسازی آنها بر اساس جرم خواهد بود به گونهای که ذره سنگینتر، دارای سرعت تهنشینی بیشتری است. اگر دو ذره، جرمهای یکسانی داشته باشند، جداسازی مواد بر اساس چگالی صورت میگیرد و بر این اساس، ذرهای با بیشترین چگالی، سرعت تهنشینی بیشتری دارد.
سانتریفیوژ، از جمله مهمترین روشهای جداسازی مواد در بیوشیمی به شمار میآید. در جدول زیر، شرایط مختلف برای جداسازی مواد یک ترکیب سلولی خاص آورده شده است. به طور مثال میتوانیم «لیزوزومها» (Lysosomes) را از دیگر ترکیبات سلولی جدا کنیم برای این کار نیاز به انجام چندین مرحله «سانتریفیوژ افتراقی» (Differential Centrifugation) داریم.
| نام جزء | نیروی سانتریفیوژ | زمان (دقیقه) |
| «سلول یوکاریوت» (Eukaryotic Cell) | 1000 | 5 |
| هسته و غشای سلولی | 4000 | 10 |
| میتوکندری، سلول باکتریایی | 15000 | 20 |
| لیزوزومها، غشای باکتریایی | 30000 | 30 |
| ریبوزومها | 100000 | 180 |
روش جداسازی چربی از شیر
برای جداسازی چربی از شیر نیز از روش سانتریفیوژ استفاده میشود که با چرخش روتور و اعمال نیروی گریز از مرکز، چربی از شیر جدا خواهد شد.
جداسازی مواد بر اساس واکنشهای تشکیل کمپلکس
یکی از روشهایی که به طور گسترده در جداسازی مورد استفاده قرار میگیرد، بهمپیوستگی یک ذره در داخل یک کمپلکس و جداسازی آن از ذره دیگر است. جدول زیر، یونها و مولکولهای مختلفی را به منظور تشکیل کمپلکس و عمل «پوشانندگی» (Masking) نشان میدهد:
| عامل پوشاننده | عنصری که یونهای آن پوشیده میشوند |
| «تارترات» (Tartrate) | |
| اگزالات | |
| تیوگلایکولیک اسید |
مثال
فرض کنید که بخواهیم به تحلیل آلومینیوم در حضور آهن بپردازیم. کدامیک از یونها یا مولکولهای بالا برای تشکیل کمپلکس با آهن مناسب است؟
یک ماده پوشاننده مناسب، مادهای است که بتواند با ماده مورد نظر تشکیل کمپلکس دهد. به طور مثال، اگزالات برای این کار مناسب نیست چراکه هم با آلومینیوم و هم با آهن تشکیل کمپلکس میدهد. اما تیوگلیکولیک اسید گزینه مناسبی است زیرا با آهن تشکیل کمپلکس میدهد. یونهای دیگری همچون سیانید، تیوسیانات و تیوسولفات نیز گزینههای مناسبی هستند.
مثال
نشان دهید که برای جداسازی از کمپلس نیکل با EDTA، سیانید با فرمول گزینه مناسبی است.
واکنشهای مربوطه و همچنین «ثابتهای تشکیل» (Formation Constants)، در زیر آورده شدهاند. در واکنشهای زیر، عبارت ، نشاندهنده EDTA است.
سیانید را میتوان یک عامل کمپلکسکننده مناسب دانست چراکه ثابت تشکیل برای از کمپلکس Ni-EDTA، مقدار بیشتری دارد. اگر ثابت تعادل را برای واکنشی بنویسیم که در آن EDTA، عامل پوشاننده را جابجا میکند خواهیم داشت:
عددی که بدست میآید بسیار کوچک است که بیان میکند کمپلکس در حضور EDTA تقریبا خنثی است. در نتیجه تاثیر عامل کمپلکسکننده را میتوان به کمک مقایسه ثابتهای تعادل آنها تعیین کرد.
جداسازی مواد بر اساس تغییر حالت
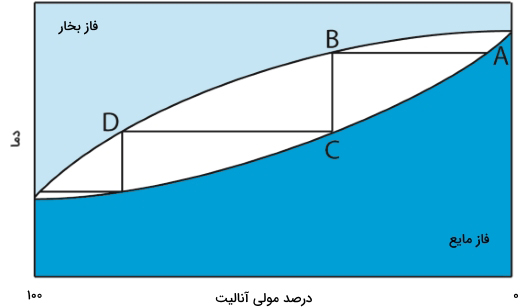
زمانی که دو مادهای که میخواهیم از یکدیگر جدا کنیم، مایع و در یکدیگر «امتزاجپذیر» (Miscible) باشند، میتوان به کمک تقطیر این دو ماده را از یکدیگر جدا کرد، البته باید نقطه جوش این دو ماده با یکدیگر اختلاف زیادی داشته باشند. تصویر زیر، پیشرفت یک فرآیند تقطیر را به صورت نمودار دما در برابر ترکیب فاز بخار و مایع مخلوط نشان میدهد. در این حالت، دو ماده آنالیت و تداخلکننده در مخلوط حضور دارند. در مخلوط اولیه (نقطه A)، مقداری بیشتری تداخلکننده داریم.
زمانی که محلول را به نقطه جوش خود میرسانیم، فاز بخار با فاز مایع در آنالیت به تعادل میرسند که این حالت در نقطه B نشان داده شده است. خطی که نقطه A را به B وصل میکند، این تعادل بخاری را نشان میدهد. با کاهش دما و میعان فاز بخار، فاز مایعی در نقطه C خواهیم داشت که ترکیب یکسانی با فاز بخار - نقطه B - دارد. فاز مایع در نقطه C، نقطه جوش پایینتری از مخلوط اصلی دارد و با فاز بخار در نقطه D در تعادل است. فرآیند تکرارشونده تبخیر و میعان سبب میشود تا به تدریج آنالیت و تداخلکننده از یکدیگر جدا شوند.
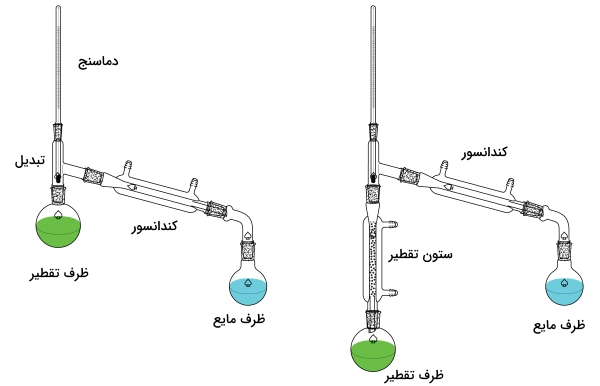
نمونهای از تنظیم دستگاههای آزمایش برای تقطیر در شکل زیر دیده میشود. دستگاهی که در سمت چپ تصویر قرار دارد، تقطیر مناسبی را بدست نمیدهد و تنها برای جداسازی آنالیت و تداخلکننده فرار از غیرفرار مناسب است یا اینکه این مواد بمنظور دستیابی به تقطیر مناسب، باید اختلاف نقطه جوشی بیش از 150 درجه سانتیگراد داشته باشند.
به کمک تقطیر جزءبهجزء که در تصویر سمت راست آمده است، جداسازی بهتری خواهیم داشت. اگر ستون تقطیر را به کمک موادی با سطح بیشتر، همچون سیم ظرفشویی یا ریزمهره پر کنیم، شرایط بهتری را برای انجام فرآیندهای تکرارشونده تبخیر و میعان ایجاد کردهایم که در نهایت بر انجام یک تقطیر کامل تاثیرگذار است.
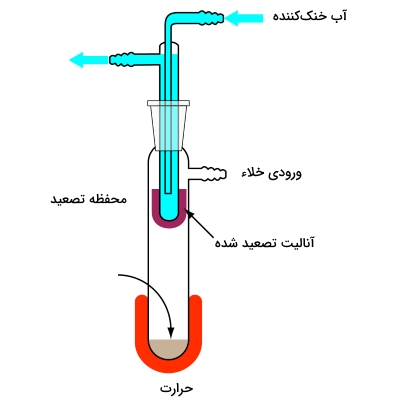
زمانی که نمونه مورد نظر، جامد باشد، به کمک تصعید میتوانیم دو ماده را از یکدیگر جدا کنیم. نمونه را در دما و فشاری پایینتر از «نقطه سهگانه» (Triple-point) آنالیت حرارت میدهیم. در نتیجه، نمونه جامد، بدون ورود به فاز مایع، تبخیر میشود. میعان بخار، آنالیت خالص را بدست میدهد. از کاربردهای این نوع از روشهای جداسازی مواد میتوان به تصعید آمینواسیدها از فسیلها و رسوبات اشاره کرد.
علاوه بر تصعید، «تبلور مجدد» (Recrystallization)، روش دیگری است که میتوان به کمک آن به خالصسازی یک جامد پرداخت. حلالی انتخاب میشود که انحلالپذیری آنالیت در آن به هنگام گرم و سرد بودن به ترتیب، زیاد و کم باشد. به طور عکس، تداخلکننده نیز باید انحلالپذیری کمی در حلال گرم داشته باشد. بعد از حرارت دادن بخشی از حلال در یک ارلن، مقدار کمی از نمونه را تا زمانی به ارلن اضافه میکنند که ذرات نامحلول قابل رویت باشند. دوباره حلال گرم را به ارلن اضافه میکنند تا موجب حلشدن ذرات نامحلول شود.
این فرآیند اضافه کردن نمونه و حلال تا زمانی ادامه مییابد که تمامی نمونه به داخل ارلن وارد شود. اگر ناخالصی هم در ارلن وجود داشته باشد، میتوان آن را به کمک فیلتراسیون جدا کرد. به محلول فرصت میدهند تا به آرامی سرد شود. با این کار، بلورهایی بزرگ و خالص رشد پیدا میکنند. بعد از این مرحله، محلول را در یک حمام یخ سرد میکنند تا با انحلال مجدد مواد مواجه نشوند. نمونه خالص را به کمک فیلتراسیون جدا میکنند و برای حذف ذرات قابل انحلال، آنرا شستشو میدهند. در نهایت، نمونه را خشک میکنند تا اثری از حلال باقی نماند. در صورت لزوم، میتوان با فرآیندهای اضافی تبلور مجدد، نمونه را بازهم تحت خالصسازی قرار داد.
روش جداسازی الکل از آب
برای جداسازی الکل از آب، از تقطیر جز به جز بهره میگیرند.
تغییر در حالت شیمیایی
تقطیر، تصعید و تبلور مجدد، همگی نوعی تغییر فیزیکی هستند. به عبارت دیگر، تمامی این فرآیندها از یک تغییر در حالت فیزیکی به عنوان ابزاری برای جداسازی مواد استفاده میکنند. واکنشپذیری شیمیایی و انجام تغییرات شیمیایی نیز میتواند یک راهکار مناسب برای جداسازی مواد باشد. به طور مثال، میتوانیم برای جداسازی ، آن را با برای تشکیل وارد واکنش کنیم. از آنجایی که ترکیب حاصل، فرار است، میتوان آن را به کمک تقطیر، از نمونه حذف کرد.
همچنین، در صورتیکه بخواهیم این فرآورده فرار را جمعآوری کنیم، میتوانیم از تقطیر استفاده کنیم. به طور مثال، برای جداسازی از یک نمونه، کافی است محلول را قلیایی (بازی) و به تبدیل کنیم. سپس به کمک تقطیر، آمونیاک را از نمونه جداسازی میکنیم. جدول زیر، مثالهای دیگری را برای جداسازی یونهای معدنی ارائه میدهد.
| آنالیت | واکنش | ماده جداشونده |
واکنشی دیگر برای جداسازی مواد، رسوب است. دو نمونه مهم از استفاده از رسوب، انحلالپذیری اکسیدهای فلزی و هیدروکسیدها بر اساس pH و همچنین انحلالپذیری سولفیدهای فلزی است.
در جداسازی مواد بر اساس انحلالپذیری وابسته به pH اکسیدها و هیدروکسیدها، به طور معمول از اسیدها و بازهای قوی یا محلول بافر بهره میگیرند. بسیاری از اکسیدهای فلزی و هیدروکسیدها در غلیظ، انحلالپذیراند. البته برخی از اکسیدها هستند که حتی در شرایط شدیدتر نیز نامحلول باقی میمانند. در تعیین مقدار در آلیاژ برنج، برای پیشگیری از تداخل میتوان نمونه را در یک اسید قوی حل کرد و به کمک فیلتراسیون، رسوب جامد را از آن جدا کرد.
بیشتر فلزات در حضور غلیظ، تشکیل رسوب هیدروکسید میدهند. البته برخی فلزات، هیدروکسیدهای آمفوتری و در نهایت طی واکنشهایی، «کمپلکس هیدروکسیدی» (Hydroxo-Complexes) را تشکیل میدهند. در نتیجه، این دسته از کمپلکسها، رسوب نمیکنند. به طور مثال، و به دلیل تشکیل کمپلکسهای محلول و ، در محلول غلیظ رسوب نمیکنند.
در نتیجه، انحلالپذیری در محلول غلیظ سدیم هیدروکسید، سبب میشود تا بتوان آلومینویم را از نمونههای ناخالص سنگ معدن بوکسیت استخراج کرد. در این روش، بعد از خرد کردن ، آن را در محلول غلیظ سدیم هیدروکسید قرار میدهند که موجب انحلال و تشکیل میشود. سایر اکسیدها مانند و در سنگ معدن به صورت نامحلول باقی میمانند. بعد از عمل فیلتراسیون، آلومینیوم را از آن بدست میآورند.
مقدار pH محلول بافر با برابر با 9/26، برای رسوب دادن بیشتر فلزات به صورت هیدروکسید کفایت میکند. البته فلزات قلیایی و قلیاییخاکی، در این pH رسوب نخواهند کرد. علاوه بر این، یونهای فلزی که با کمپلکسهای محلول تشکیل میدهند نیز، تحت این شرایط رسوب نخواهند کرد. این یونهای فلزی در پایین آورده شدهاند:
استفاده از یون از گذشته در جداسازی یونهای فلزی کاربرد داشته است. از سولفید به دو دلیل برای جداسازی یونهای فلزی استفاده میشود:
- بیشتر یونهای فلزی، به غیر از فلزات قلیایی و قلیاییخاکی، سولفیدهای نامحلول تولید میکنند.
- سولفیدهای فلزی تغییرات زیادی را در انحلالپذیری از خود نشان میدهند. از آنجایی که انحلالپذیری و غلظت به pH وابسته است، انحلالپذیری فلزات در محلول را میتوان با تنظیم pH کنترل کرد. به طور مثال، در یک روش گراویمتری، در سه مرحله، از سولفید برای جداسازی ، و استفاده میشود.
جداسازی مواد بر اساس تقسیمبندی بین فازها
از مهمترین روش های جداسازی مواد، تقسیمبندی انتخابی آنالیت یا تداخلکننده بین دو فاز امتزاجناپذیر است. اگر یک فاز حاوی حلشونده S را در تماس با فاز دومی قرار دهیم، حلشونده، در یک واکنش تعادلی، خود را بین دو فاز تقسیم میکند.
ثابت تعادل برای واکنش بالا به صورت زیر خواهد بود:
به این ثابت تعادل، «ضریب تقسیم» (Partition Coefficient) میگویند. اگر میزان ، خیلی بزرگ باشد، حلشونده از فاز ۱ به فاز ۲ حرکت خواهد کرد. به عکس، اگر ضریب تقسیم، عدد کوچکی باشد، حلشونده در فاز ۱ باقی میماند.
استخراج بین دو فاز
به فرآیند حرکت یک ذره از یک فاز به فاز دیگر، «استخراج» (Extraction) میگویند. این روش در زمانی کاربرد دارد که تنها یکی از اجزا، ضریب تقسیم مناسبی داشته باشد. بسیاری از روش های جداسازی بر مبنای استخراج انجام میشوند که شامل موارد زیر هستند:
- «استخراج مایع-مایع» (Liquid-liquid Extractions)
- «استخراج مایع-جامد» (Liquid-Solid Extractions)
- استخراج جامد-مایع
- استخراج گاز-جامد
استخراج مایع-مایع
استخراج مایع-مایع به کمک یک قیف استخراج انجام میشود. بعد از قرار دادن دو مایع در قیف استخراج، بمنظور افزایش سطح بین دو فاز، آنرا خوب تکان میدهیم. زمانی که استخراج به طور کامل انجام شود، به دو مایع فرصت میدهیم تا به طور کامل از یکدیگر جدا شوند. در نهایت به کمک یک شیر در پایین قیف استخراج، میتوانیم دو فاز را از یکدیگر جدا کنیم.
استخراج فاز جامد
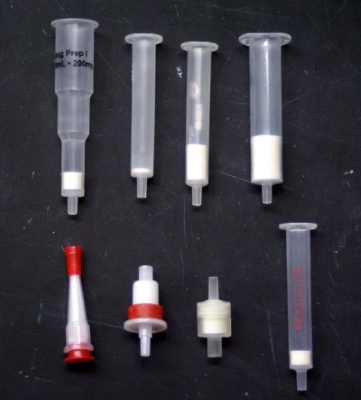
در استخراج فاز جامد، نمونه را از داخل یک کارتریج حاوی یک جاذب عبور میدهیم. نمونههایی از این کارتریجها در تصویر زیر آورده شدهاند. انتخاب نوع جاذب بر اساس نوع ماده مورد نظر انجام میشود. به طور مثال، فرض کنید که برای جداسازی آرامبخشهای «سکوباریتال» (Secobarbital) و «فنوباریتال» (Phenobarbital) از یک نمونه سرم، از جاذب جامدی استفاده میکنیم.
قبل از اضافه کردن نمونه به کارتیج، آنرا با متانول شستشو میدهیم. سپس ۵۰۰ میکرولیتر از سرم را به داخل کارتریج وارد میکنیم. ششتشوی کارتریج با آب مقطر باعث میشود که مواد تداخلکننده از کارتریج خارج شوند. در نهایت به کمک ۵۰۰ میکرولیتر از استون، آرامبخشها را خارج میکنیم. در مقایسه با استخراج مایع-مایع، این روش، سادهتر و سریعتر است و همچنین به حلال کمتری نیاز دارد.
استخراج پیوسته
در مواردی که سایر اجزای نمونه، ضریب تقسیم پایینی داشته باشند و آنالیت هم ضریب تقسیم مناسبی نداشته باشد، باز هم میتوان از استخراج استفاده کرد با این تفاوت که باید بیش از یک بار عمل استخراج را انجام داد. در این روش، به طور پیوسته، فاز استخراجشونده را از نمونه عبور میدهیم تا به میزان کمی مورد نظر برسیم.
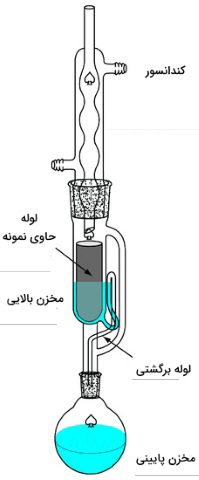
استخراج پیوسته یک فاز جامد به کمک «دستگاه استخراج سوکسله» (Soxhlet Extractor) انجام میگیرد. حلال استخراجکننده را در داخل مخزن پایینی قرار میدهند و آن را تا نقطه جوش گرم میکنند. با تبخیر شدن، حلال در طول لوله و از سمت راست دستگاه، به طرف بالا حرکت میکند و به «کندانسور» (Condenser) میرسد و به دوباره مایع میشود. سپس، حلال از میان نمونه عبور میکند. نمونه، از قبل داخل مخزن بالایی و در یک فیلتر سلولوزی متخلخل قرار داده شده است. زمانی که حلال در مخزن بالایی، به بخش بالایی «لوله برگشتی» (Return Tube) میرسد، حلال و آنالیت استخراج شده، به مخزن پایینی تخلیه میشوند. با گذشت زمان، غلظت آنالیت در مخزن پایینی افزایش پیدا میکند.
استخراج به کمک مایکروویو
«استخراج به کمک مایکروویو» (Microwave Assisted Extractions)، جایگزین روش استخراج سوکسله شده است. بعد از قرار دادن نمونه و حلال در یک محفظه عایق، یک آون مایکروویو برای گرمکردن مخلوط مورد استفاده قرار میگیرد. به کمک محفظه عایق، عمل استخراج، در دما و فشار بالاتری صورت میگیرد که این امر موجب کاهش زمان مورد نیاز برای انجام فرآیند میشود. این درحالیستکه استخراج به روش سوکسله، محدود به نقطه جوش حلال است. به طور مثال، زمانی که از استون به عنوان حلال استفاده میکنیم، در استخراج سوکسله، دما به ۵۶ درجه سانتیگراد محدود میشود اما به کمک روش مایکروویو میتوان به دمای ۱۵۰ درجه سانتیگراد نیز دست یافت.
استخراج مایع-گاز
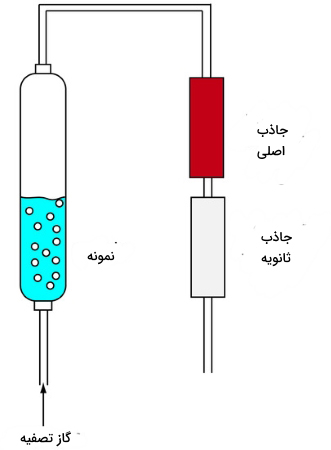
«ترکیبات آلی فرار» (Volatile Organic Compounds) که به VOCs معروف هستند را به کمک استخراج مایع-گاز، میتوان از نمونه جدا کرد. همانطور که در تصویر زیر نشان داده شده است، یک گاز نجیب (بیاثر) مانند هلیوم، موسوم به «گاز تصفیه» (Purge Gas)، از داخل نمونه عبور داده میشود. با گذر این گاز، VOCها در جاذب اصلی بهدام میافتند. از یک جاذب ثانویه نیز بهره میگیرند. زمانی که ظرفیت جاذب اصلی تمام شود، جاذب دوم مورد استفاده قرار میگیرد.
زمانی که فرآیند استخراج به اتمام برسد، ترکیبات آلی فرار را جداسازی میکنند. برای این کار، لوله را به سرعت گرم میکنند و همزمان، با جریان سریع، گاز هلیوم را نیز تزریق میکنند. این روش را با نام «تصفیه و بهدام افتادگی» (Purge and Trap) نیز میشناسند.
استخراج به کمک سیالات فوق بحرانی
استخراج پیوسته را به کمک «سیالات فوق بحرانی» (Supercritical Fluids) هم میتوان انجام داد. اگر مادهای را بالاتر از دما و فشار بحرانی آن حرارت دهیم، یک سیال فوق بحرانی تشکیل میشود که خواصی بینابین مایع و گاز دارد. یک سیال فوق بحرانی، حلال بهتری نسبت به گاز و برای استخراج، واکنشگر (ریجنت) بهتری است. علاوه بر این، یک سیال فوق بحرانی، ویسکوزیته کمتری نسبت به یک مایع دارد. همین امر سبب میشود تا بتوان این ماده را سادهتر به داخل یک نمونه وارد کرد. یکی از روشهای استخراج با سیال فوق بحرانی، تعین مقدار نفت در خاک، رسوبات و مرداب به کمک کربن دیاکسید فوق بحرانی است.
جداسازی مواد به کمک کروماتوگرافی
در روش استخراج، نمونه در یک فاز قرار دارد و اجزا را در فاز دیگری استخراج میکنیم. در روشی دیگر، میتوانیم نمونه را که در یک فاز قرار دارد، از روی مادهای ساکن عبور دهیم. فاز اول را «فاز متحرک» (Mobile Phase) و فاز دوم را «فاز ساکن» (Stationary Phase) میگویند. نمونه را به داخل یک فاز متحرک تزریق میکنیم و اجزای نمونه، در فازهای متحرک و ساکن تقسیمبندی میشوند. اجزایی که ضریب تقسیم بزرگتری دارند، به فاز ساکن منتقل میشوند و زمان بیشتری طول میکشد تا از داخل سیستم عبور کنند.
روشی که در بالا به آن اشاره شد، اساس تمامی روشهای کروماتوگرافی است. به کمک کروماتوگرافی میتوان هر دو ماده آنالیت و تداخلکننده را از یکدیگر جدا کرد. علاوه بر این، کروماتوگرافی ابزاری است که به کمک آن میتوان بررسیهای کمی و کیفی بر روی آنالیت انجام داد.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش نرمافزار Aspen HYSYS Dynamics برای شبیهسازی دینامیکی فرآیندهای شیمیایی
- پلیمریزاسیون — به زبان ساده
- حجم مولی — به زبان ساده
^^













سلام من میخوام ترکیب درصد مخلوطی از سه حلال که شامل متانول، بوتیل استات و تولوئن هستند را به دست بیارم ممکنه راهنماییم کنید با چه روشی این کار امکان پذیر هست؟ و اگر نیست با چه روش دستگاهی میشه این کار و کرد؟
با سلام؛
برای جداسازی و تشخیص میزان درصد هریک از اجزای همچین مخلوطی میتوانید از روشهای کروماتوگرافی یا کروماتوگرافی گازی استفاده کرده و از روی جرم هر ماده جدا شده نسبت به جرم کلی ماده، درصد اجزای آن را به دست آورید.
همچنین می توانید با استفاده از چگالی هریک از مواد و چگالی کلی مخلوط، میزان درصد هریک را با معادلات ریاضی به دست آورید که روش دقیقی نخواهد بود.
با تشکر از همراهی شما با مجله فرادرس
سلام من میخوام گرد سفید اب را جدا کنم و نیاز به گرد اب دارم چطوری میتونم این کار را کنم که گرد دور بشر یا سطح جمع نشه یک جا متمرکز کنم
بسیار عالی
سلام
ممنون ازمطلب مفیدشما
من یه سوال دارم محلولی که براثرترکیب آب ودودومونوبه رنگ زردتغییررنگ داده(محلول)چگونه می توان عملیات جداسازی انجدم دادوبه رنگ شفاف درآورد،ممنون میشم پاسخ بدین
با تزریق گاز هیدروژن کلرید
آیا مواد روغنی می توهن به کمکHPLC می توان از یک دیگر جدا کرد؟
عاااالی.مرسی???