تشخیص واکنش گرماده و گرماگیر – به زبان ساده + مثال
واکنشهای شیمیایی همواره با نوعی از مصرف یا آزادسازی انرژی همراه هستند. انواع واکنشهای شیمیایی از لحاظ نوع مصرف انرژی میتوانند گرماگیر یا گرماده باشند. برای تشخیص واکنش گرماده و گرماگیر باید به این نکته توجه کنیم که واکنشهای گرماگیر از محیط اطراف خود انرژی را به فرم گرما دریافت میکنند و واکنشهای گرماده (گرمازا)، انرژی را به صورت گرما به محیط اطراف خود میتابند. واکنشهای گرماده و گرماگیر، انرژی را به عنوان یکی از فراوردهها یا واکنشدهندههای واکنش به همراه دارند. واکنشهای گرماگیر، به انرژی گرمایی احتیاج دارند پس حرارت واکنشدهنده است و واکنشهای گرماده، انرژی گرمایی را آزاد میکنند پس حرارت فراورده است. در این مطلب از مجله فرادرس به بررسی این دو نوع واکنش و روش تشخیص آنها میپردازیم.
- چطور واکنش گرماده و واکنش گرماگیر را تشخیص دهید.
- تعریف واکنشهای گرماده و گرماگیر را درک میکنید.
- تشخیص این واکنشها را با استفاده از نمودارهای انرژی یاد میگیرید.
- مفهوم آنتالپی، آنتروپی و انرژی آزاد گیبس را میشناسید.
- تفاوت واکنشهای گرماده و گرماگیر را با توجه به ثابت تعادل بررسی میکنید.
- با مثالهای مختلف واکنشهای گرماده و گرماگیر آشنا میشوید.


در ادامه این مطلب با چگونگی تشخیص واکنشهای گرماده و گرماگیر آشنا میشویم. پس از آن به صورت جداگانه به تعریف واکنش گرماده و گرماگیر میپردازیم. انواع مختلفی از روشها برای تشخیص این نوع واکنشها استفاده میشود. این روشها را پس از تعریف واکنشها بررسی میکنیم. همچنین برخی از مباحث ترمودینامیک در تعریف واکنشهای گرماده و گرماگیر و تشخیص آنها تاثیرگذار هستند. پس به تعریف مطالبی مانند آنتالپی، آنتروپی، انرژی آزاد گیبس و ثابت تعادل میپردازیم و توضیح میدهیم چگونه میتوان با استفاده از این تعاریف واکنشهای گرماده و واکنشهای گرماگیر را از یکدیگر تشخیص داد. در انتهای مطلب به بررسی مثالهایی از هرکدام از این واکنشها میپردازیم. با دنبالکردن این مطلب تا انتها با توضیح کامل این مفاهیم پرکاربرد و مثالهای آن آشنا شوید.
چگونگی تشخیص واکنش گرماده و گرماگیر
تشخیص واکنشهای گرماگیر و گرماده میتواند به چند طریق کلی بررسی شود که در ادامه این مطلب به آنها میپردازیم. این روشها به شرح زیر است:
- تشخیص از روی واکنش
- تشخیص از روی نمودارهای انرژی
- تشخیص واکنش گرماده و گرماگیر از روی تعریف آنتالپی
- تشخیص از روی تعریف آنتروپی
- تشخیص از روی انرژی آزاد گیبس
- تشخیص از روی ثابت تعادل
تعریف واکنش گرماگیر
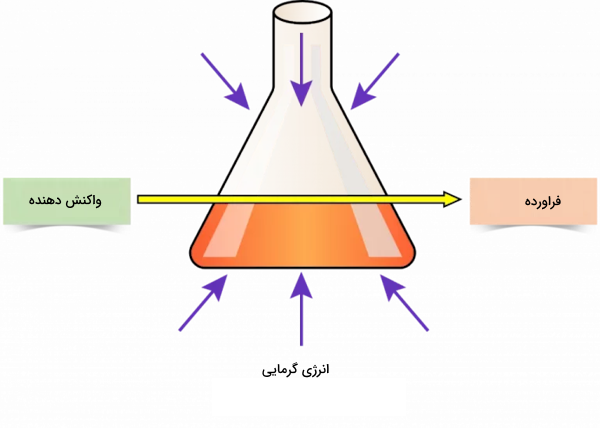
در قسمت قبل اشاره شد برای تشخیص واکنش گرماده و گرماگیر چه روشهایی وجود دارد. حال میخواهیم به اختصار تعاریفی از هرکدام از این دو نوع واکنش ارائه دهیم. در این دسته از واکنشها، گرما توسط واکنشدهندهها جذب می شود. سطح انرژی فراوردهها نسبت به واکنشدهندهها پایینتر است و واکنش برای انجام گرفتن نیاز به انرژی اولیه (انرژی فعالسازی) دارد. نام دیگر واکنشهای گرماگیر واکنشهای اندوترمیک است. در این کلمه که ریشه یونانی دارد اندو به معنای جذب و ترمیک به معنای حرارت است.
سطح انرژی پیوند واکنشدهندهها در واکنشهای گرماگیر بالاتر از فراوردهها است. به همین علت است که برای شکستن پیوند بین مولکولهای واکنشدهندهها به انرژی اولیه احتیاج داریم. گرما در این دسته از واکنشها توسط خود واکنش دریافت و جذب میشود و در نتیجه دمای محیط کاهش مییابد.
تعریف واکنش گرماده
واکنشهای گرماده (گرمازا) فرایندهایی هستند که در آنها انرژی به فرمهایی از گرما یا نور آزاد میشود. این واکنشها عکس فرایندهای گرماگیر هستند. به همان مقدار که انرژی توسط واکنش آزاد میشود، محیط اطراف واکنش نیز توسط این انرژی گرم میشود. در این واکنشها انرژی کلی فراوردهها بسیار کمتر از انرژی واکنشدهندههاست. این بدین معناست که انرژی کمتری برای شکستن پیوندهای واکنشدهندهها مورد نیاز است. نام دیگر واکنشهای گرماده اگزوترمیک است. در این کلمه که ریشه یونانی دارد اگزو به معنای آزاد کردن و ترمیک به معنای حرارت است.
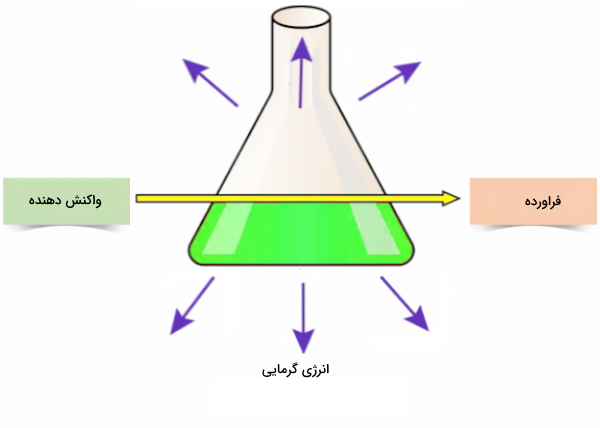
برای مثال هنگامی که گاز متان میسوزد، گرما آزاد میشود. آزاد شدن گرما، واکنش را گرماده میکند. به طور دقیقتر، سوختن یک مول متان حدود ۴.۸۹۰ کیلوژول انرژی آزاد میکند. این آزادسازی انرژی به دو طریق میتواند در فرایند واکنش نشان داده شود.
در روش اول برای تشخیص واکنش گرماده و گرماگیر میتوان میزان گرمای آزادشده را به عنوان فراورده واکنش در سمت راست واکنش نوشت و در روش دوم می توان میزان آنتالپی واکنش ( واکنش) را با یک علامت منفی در کنارش به صورت جداگانه مشخص کرد.
چگونگی تشخیص واکنش گرماده و گرماگیر از روی واکنش
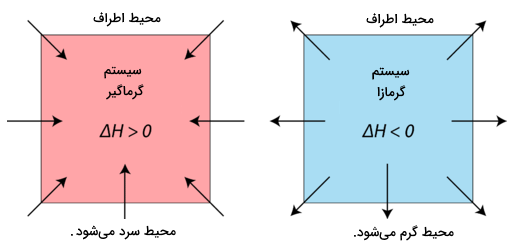
همانگونه که توضیح دادهشد، همواره نوعی از تغییر انرژی همراه واکنشهای شیمیایی اتفاق میافتد. برای تشخیص واکنش گرماده و گرماگیر کافی است به معادله واکنش نگاه کنیم. اگر گرما () در سمت چپ واکنش جذب شده باشد واکنش گرماگیر و اگر گرما در سمت راست واکنش آزاد شده باشد واکنش گرماده است. در مورد واکنشهای گرماگیر، سیستم واکنش گرما را از محیط اطراف خود دریافت میکند و دمای اطراف آن کاهش مییابد (سرد میشود). اگر واکنش گرماده باشد، حرارت توسط سیستم آزاد شده و محیط اطراف واکنش گرم میشود. به این دلیل که محیط اطراف از سیستم گرما میگیرد، دمای محیط افزایش مییابد. این تغییر انرژی درواقع همان تفاوت انرژی بین انرژی واکنشدهندهها و فراوردهها است که در فرایندهای ترمودینامیکی با متغیری به نام آنتالپی () اندازهگیری میشود. این انرژی میتواند فرمهایی از گرما، نور یا الکتریسیته باشد.
هرمادهای مقداری مشخص انرژی دارد که به عنوان انرژی پتانسیل ماده که به نام انرژی شیمیایی نیز شناخته میشود در آن ذخیره میشود. واکنشهای شیمیایی برای انجام گرفتن نیاز دارند که پیوند شیمیایی بین مواد واکنشدهنده شکسته شوند و پیوندهای جدیدی تشکیل شود و فراوردهها به وجود بیایند. شکستن پیوندها انرژی میگیرد و ساختن پیوندهای جدید انرژی آزاد میکند. این دو نوع انرژی با یکدیگر متفاوت هستند. برای شکستن پیوند بین واکنشدهندهها مقداری انرژی اولیه به نام انرژی فعالسازی نیاز است. در نتیجه به طور کلی در واکنش شیمیایی یا انرژی آزاد میشود یا انرژی جذب می شود و این موضوع بستگی به سطح انرژی فراوردهها و واکنشدهندهها دارد.

مثال تشخیص واکنش گرماده و گرماگیر از روی واکنش
در مثال های زیر مشاهده میکنید هنگامی که انرژی گرمایی در سمت چپ معادله نوشته شده است واکنش گرماگیر و هنگامی که در سمت راست معادله نوشته شده است، واکنش گرماده است.
۱. واکنش تجزیه کلسیم کربنات گرماگیر است.
۲. واکنش سوختن متان گرماده است.

۳. واکنش تشکیل نیتروژن مونوکسید گرماگیر است.
۴. واکنش تشکیل هیدروژن فلوئورید گرماده است.
۵. مشخص کنید از بین واکنشهای زیر کدام واکنش گرماده و کدام واکنش گرماگیر است.
توضیح این مثال به شرح زیر است.
در گزینه اول به دلیل اینکه مقدار انرژی مشخص شده ۲۱۳ کیلو کالری، سمت فراوردههای واکنش نوشته شده است، انرژی توسط واکنش آزاد شده است پس واکنش گرماده است.
در گزینه دوم به دلیل اینکه انرژی مشخص شده، ۴۵ کیلو کالری توسط واکنش مصرف شده است، پس این واکنش گرماگیر است.
یادگیری شیمی عمومی با فرادرس
واکنشهای گرماده و گرماگیر و تشخیص آنها از مباحث پایهای ترمودینامیک هستند که در مباحث شیمی عمومی مورد بررسی قرار میگیرند. برای شناخت و تشخیص واکنش گرماده و گرماگیر ابتدا باید با مفهوم ساختار اتم، مولکول، چگونگی برهمکنش آنها و پیوندهای بین اتمی و بین مولکولی آشنا شویم. سپس قوانین ترمودینامیک و کار مکانیکی سیستم، آنتالپی، قانون هس()، ترموشیمی، آنتروپی، قانون دوم ترمودینامیک، قانون سوم ترمودینامیک و غیره را فرابگیریم. پیشنهاد میکنیم از فیلمهای آموزشی حوزه شیمی فرادرس بهره ببرید که با زبانی ساده ولی کاربردی این مطالب را توضیح میدهند. در فهرست زیر به چند مورد از این آموزشها اشاره کردهایم.
همچنین با مراجعه به صفحههای زیر میتوانید به آموزشهای بیشتری دسترسی داشته باشید.
- فیلم آموزش علوم تجربی پایه هشتم بخش شیمی
- فیلم آموزش شیمی دبیرستان کنکور
- فیلم آموزش موازنه انرژی و مواد
- فیلم آموزش حل مساله شیمی فیزیک
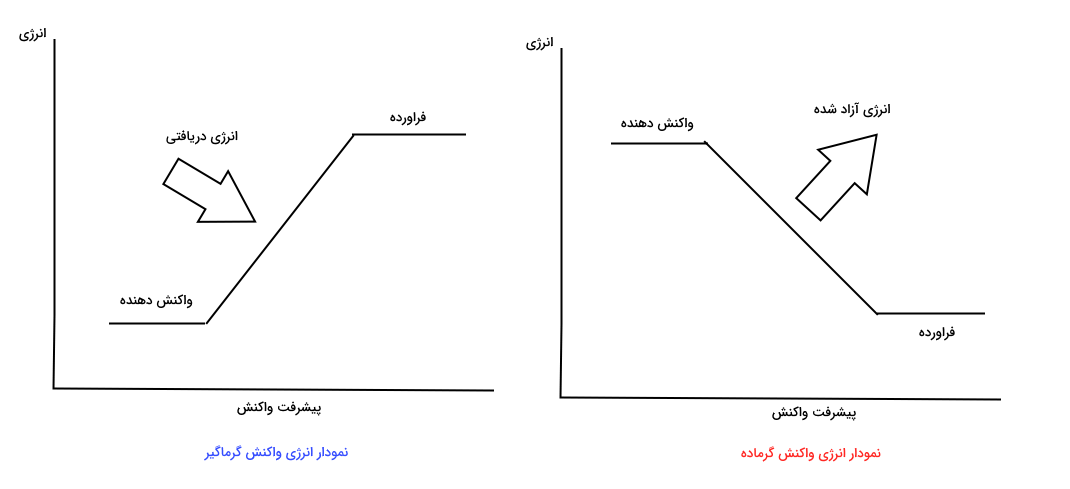
چگونگی تشخیص واکنش گرماده و گرماگیر از روی نمودارهای انرژی
در مبحث قبلی آموختیم که تشخیص واکنش گرماده و گرماگیر به وسیله فرمول معادله واکنش چگونه است. واکنشهای گرماده و گرماگیر می توانند به صورت دیداری به شکل نمودارهای انرژی نیز مشخص شوند. در دو تصویر زیر نمودار انرژی کلی واکنشهای گرماده و گرماگیر را در برابر طول زمان انجام واکنش مشاهده میکنید. در واکنشهای گرماگیر واکنشدهندهها سطح انرژی پیوند بالاتری نسبت به فراوردهها دارند. به بیان دیگر پیوندهای قویتری دارند. بنابراین این واکنشها به انرژی فعالسازی بیشتری برای آغاز واکنش احتیاج دارند.
در واکنشهای گرماده پیوندهای بین مولکولی فراوردهها نسبت به پیوندهای بین مولکولی واکنشدهندهها قویتر است. به بیان دیگر انرژی فراوردهها از انرژی واکنشدهندهها بیشتر است. انرژی آزاد شده در این فرایندها معمولا به صورت گرما آزاد می شود.
جدول مقایسه واکنشهای گرماده و گرماگیر
در خلاصه مطالب عنوان شده، در جدول زیر به طور کلی ویژگیهایی برای مقایسه و تشخیص واکنش گرماده و گرماگیر ارائه شده است.
| واکنشهای گرماگیر | واکنشهای گرماده |
| گرما توسط واکنشدهندهها جذب می شود. | انرژی به فرم گرما، الکتریسیته، نور یا ترکیبی از اینها همراه فراوردهها آزاد میشود. |
| مثبت است. | منفی است. |
| پیوندهای شکسته شدهی واکنشدهندهها قویتر از پیوندهای شکل گرفته فراوردهها هستند. | پیوندهای شکل گرفته فراوردهها قویتر از پیوندهای شکسته شده واکنشدهندهها هستند. |
| سطح انرژی واکنشدهندهها پایین تر از فراوردههاست. | سطح انرژی فراوردهها پایینتر از واکنشدهندههاست. |
| گرما از محیط اطراف جذب میشود. در نهایت محیط اطراف سرد میشود. | گرما توسط سیستم به محیط اطراف دفع می شود در نتیجه محیط اطراف واکنش گرم میشود. |
| نمودار انرژی آن بالا رونده است. | نموردار انرژی آن پایین رونده است. |
تعریف آنتالپی
در مباحث پیش اشاره کردیم که یکی از روشهای تشخیص انرژی صرف شده در واکنش و تشخیص گرماگیر یا گرماده بودن آن آنتالپی نام دارد. حال به این میپردازیم که آنتالپی چیست. آنتالپی، جمع انرژی داخلی سیستم با حاصل ضرب فشار آن در حجم آن است. تعریف دیگر آنتالپی اندازه گیری انرژی یا گرما در سیستم ترمودینامیکی است. آنتالپی یکی از اساسیترین مفاهیم پایهای ترمودینامیک است. علامت مشخصکننده آنتالپی حرف انگلیسی است. به بیان دیگر آنتالپی، کل انرژی گرمایی یک سیستم ترمودینامیکی است. در ادامه مفصلتر درباره این پارامتر صحبت خواهیم کرد.
اشاره شد که آنتالپی کل انرژی گرمایی سیستم است که برابر با جمع انرژی درونی سیستم است که به انرژی بر اساس فشار و حجم آن میانجامد. تفاوت آنتالپی و انرژی درونی با توجه به فرمول آنتالپی قابل توجیه است. بنابراین فرمول کلی محاسبه آنتالپی در سیستم به روش زیر است که در آن آنتالپی سیستم، انرژی داخلی سیستم، فشار و حجم است.
انرژی داخلی سیستم به دلیل حرکت مولکولها بهوجود میآید. در واقع آنتالپی یک پارامتر نسبی است که با ثابت نگه داشتن فشار، تغییرات آن طی زمان انجام واکنش اندازهگیری میشود. تغییرات آنتالپی () نشان دهنده حرارت جذب شده یا دفع شده طی واکنش است.
مثالهایی از واکنش گرماگیر بر اساس تعریف آنتالپی
هنگامی که یک مول از ماده کلسیم کربنات به ۱ مول کلسیم اکسید و ۱ مول کربن دی اکسید تجزیه میشود، ۸.۱۷۷ کیلوژول گرما جذب میکند. گرما به صورت آنتالپی مثبت نوشته میشود، به دلیل اینکه این گرما توسط سیستم جذب شده است.
برای واکنش گرماگیر مثبت است.

چگونگی تشخیص واکنش گرماده و گرماگیر از روی تعریف آنتالپی
در واکنشهای گرماده آنتالپی با رها شدن انرژی گرمایی طی واکنش کاهش مییابد در نتیجه واکنشهای گرماده منفی است. در واکنشهای گرماگیر به این دلیل که سیستم انرژی جذب میکند آنتالپی سیستم افزایش مییابد . به بیان دیگر تغییرات آنتالپی میزانی از حرارت جابهجا شده در طول واکنش را اندازهگیری میکند و از روی علامت آن میتوان فهمید که واکنش گرماده یا گرماگیر است.
تعریف آنتروپی
همانطور که اشاره شد بررسی آنتروپی نیز یکی دیگر از راههای تشخیص واکنشهای گرماگیر و گرماده است. آنتروپی اندازهگیری میزان بینظمی یا تصادفی بودن در سیستم است. در واقع آنتروپی یکی از اساسیترین مفاهیم پایه ترمودینامیک و فیزیک است. آنتروپی تعداد شکلهای سه بعدی ممکن برای اتمها یا مولکولهای موجود در سیستم ترمودینامیکی را در مقیاس میکروسکوپی مشخص میکند. آنتروپی همراستا با قانون دوم ترمودینامیک است. بدین صورت که همراه با گذر زمان آنتالپی سیستم افزایش مییابد تا به حد بیشتر بینظمی برسد یا تعادل (از لحاظ حرکت ذرات) پیدا کند. این قانون بیان میکند که سیستمهای طبیعی غیرقابل بازگشت هستند و همواره به سمت آنتروپی بیشتر میل میکنند. از آنجا که حرارت باعث افزایش سرعت حرکت و ارتعاش مولکولها و اتمها میشود، آنتروپی در سیستمهای واکنشهای شیمیایی برابر با انرژی حرارتی سیستم است.
چگونگی تشخیص واکنش گرماده و گرماگیر از روی تعریف آنتروپی
در واکنشهای گرماده، به این دلیل که همراه با انجام واکنش گرما آزاد میشود، آنتروپی به طور کلی افزایش مییابد. زیرا افزایش حرارت در سیستم باعث افزایش حرکت مولکولها و در نتیجه افزایش بینظمی میشود. اما در واکنشهای گرماگیر به دلیل اینکه واکنش گرما جذب میکند، بی نظمی سیستم کاهش یافته و آنتروپی کاهش مییابد. هرچند بر اساس اصول کلی آنتروپی که بیان میکند آنتروپی جهان در حال افزایش است، آنتروپی سیستم و محیط اطراف آن به طور کلی به بینظمی بیشتر میل میکند.

انرژی آزاد گیبس
انرژی آزاد گیبس نیز یک راه برای تشخیص میزان گرمای آزاد شده یا جذب شده در واکنشها (گرمای واکنش) است. این پارامتر آنتالپی و آنتروپی را در واکنشها به یکدیگر مرتبط میکند. بدین صورت که با استفاده از انرژی ازاد گیبس میتوان به خودبهخودی بودن واکنش پیبرد. انرژی ازاد گیبس در سیستم با آنتالپی دمای و آنتروپی به روش زیر به دست میآید:
انرژی ازاد گیبس نیز مانند آنتالپی کمیت نسبی است که با ثابت نگه داشتن فشار سنجیده میشود. با تغییر منفی در انرژی آزاد گیبس فرایند خود به خود اتفاق می افتد و مثبت نشان می دهد که واکنش به صورت خودبهخود اتفاق نمیافتد.
چگونگی تشخیص واکنش گرماده و گرماگیر از روی انرژی آزاد گیبس
در واکنشهای گرماده آزاد شدن انرژی ( منفی ) به کمتر شدن انرژی آزاد گیبس میانجامد که نشان دهنده خودبهخودی بودن انجام واکنش است. به عبارت دیگر همانگونه که اشاره شد واکنشهای گرماده برای آغاز شدن احتیاج به انرژی اولیه ندارند. اما در واکنشهای گرماگیر با وجود اینکه سیستم گرما میگیرد و مثبت است تغییرات بینظمی میتواند این تغییر را جبران کند. اگر تغییرات آنتروپی به اندازهای زیاد باشد که را منفی کند، واکنش به صورت خودبهخود در دمای بالا اتفاق میافتد.
ثابت تعادل
یکی از راههای تشخیص واکنشهای گرماگیر و گرماده بررسی ثابت تعادل است. در اینجا به توضیح تعریف این پارامتر و فرمول آن میپردازیم. ثابت تعادل واکنش میزان فراوانی فراوردهها به واکنشدهندهها را در حالت تعادل واکنش مشخص میکند. این پارامتر با استفاده از انرژی ازاد گیبس و با فرمول زیر بهدست میآید.
در این معادله ثابت گاز است و دما است.
چگونگی تشخیص واکنش گرماده و گرماگیر از روی ثابت تعادل
در واکنشهای گرماده کاهش انرژی آزاد گیبس منفی در دمای ثابت معمولا باعث بالا رفتن ثابت تعادل میشود که نشان دهندهی فراوانی بیشتر فراوردهها به واکنشدهندهها در این واکنشهاست. اما در واکنشهای گرماگیر مثبت باعث کوچکتر شدن ثابت تعادل و نشان دهنده فراوانی کمتر فراورهها نسبت به واکنشدهندهها است.
نمونههایی از واکنش گرماگیر
تا اینجا تعاریف دقیقی از پارامترهای ترمودینامیکی برای کمک به تشخیص واکنش گرماده و گرماگیر ارائه دادیم. حال میخواهیم چند نمونه مثال از واکنشهای گرماده و گرماگیر را بررسی کنیم.
۱. فتوسنتز
فتوسنتز که یکی از واکنشهای حیاتی برای بقای محیط زیست است واکنش گرماگیر است. در این فرایند، گیاهان از خورشید انرژی اولیه آغاز فرایند را دریافت میکنند و در حضور کربن دی اکسید و آب، گلوکز و اکسیژن تولید میکنند.

۲. فرایند پخت غذاها
در فرایند پخت غذاها، انرژی به شکل گرما توسط مواد دریافت می شود تا فرایند پختن شکل بگیرد.
۳. ذوب شدن یخ
یک قطعه یخ برای فرایند ذوب شدن نیاز به دریافت انرژی گرمایی دارد.

۴. تبخیر آب
تبخیر فرایندی است که در آن ماده از فرم مایع به فرم گاز تبدیل میشود. برای انجام این فرایند عموما به حرارت نیاز است. برای مثال، آب در دمای ۱۰۰ درجه سانتی گراد شروع به تبخیر شدن میکند. پس این فرایند یک واکنش گرماگیر است.
۵. فرایند الکترولیز
الکترولیز فرایندی است که در آن یک ترکیب مولکولی به یونهای سازندهاش شکسته میشود. انرژی اولیه برای این فرایند که عموما الکتریسیته است، باید برای فراوردهها تامین شود پس این دسته از واکنشها نیز به دلیل بالاتر بودن سطح انرژی فراوردهها جزو واکنشهای گرماگیر دسته بندی می شوند.
۶. تولید کربن دی سولفید
کربن به همراه گوگرد گرما داده شده و کربن دی سولفید تولید میشود. به دلیل جذب گرما توسط این فرایند، یک واکنش گرماگیر است.
۷. تولید نیتریک اکسید
نیتروژن و اکسیژن در دمای ۳۰۰۰ درجه سانتی گراد با یکدیگر نیتریک اکسید را تولید میکنند.
۸. دیگر مثالهای واکنشهای گرماگیر
پختن نان، تصعید یخ خشک، بسیاری از فرایندهای انحلال مانند حل شدن شکر در آب، حل شدن قرص جوشان در آب، ذوب شدن نمکهای جامد، کرکینگ آلکانها و . . . همگی مثالهایی از واکنشهایی هستند که برای انجام شدن نیاز به حرارت دارند. اثر دما بر انحلالپذیری مواد در مقالهای از مجله فرادرس بررسی شده است. برای مطالعه بیشتر روی لینک زیر کلیک کنید.

نمونههایی از واکنشهای گرمازا
در ادامه چند نمونه از مثالهایی از واکنشهای گرماده را در دنیای واقعی و در شیمی بررسی میکنیم.
۱. واکنشهای سوختن
واکنش سوختن واکنشی است که طی آن یک ماده با سرعت و شدت با اکسیژن واکنش داده و نور و گرما تولید میکند. تمامی واکنشهای سوختن گرماده هستند.
برای مثال واکنش سوختن چوب مقادیر زیادی انرژی به صورت نور و گرما آزاد میکند. این انرژی در محیط اطراف این واکنش (سوختن چوب) احساس میشود.

۲. واکنش سوختن متان
واکنش سوختن متان مقادیری گرما و نور آزاد میکند و گرماده است.
۳. مثال دیگری از این نوع واکنش، فرایند شکستن قند ساده (گلوکز) است.
۴. واکنش خنثی شدن
واکنشهای خنثی شدن فرایندهایی هستند که در آنها یک اسید و یک باز با یکدیگر واکنش میدهند. این واکنشها نسبتا گرمازا هستند. برای مثال در واکنش اسید کلریدریک و سدیم هیدروکسید، به ازای هر مولکول نمک تولید شده، ۲.۵۷ کیلوژول انرژی آزاد میشود.
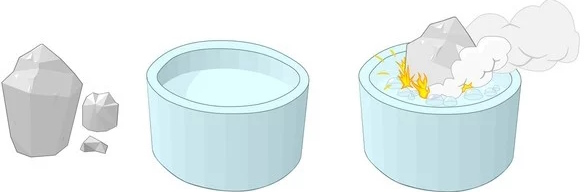
۵. واکنش فلزات قلیایی با آب
فلزات قلیایی برای مثال سدیم با آب به شدت واکنش میدهند. این واکنش اگر با اب گرم انجام شود به شدت انفجاری است.
در تصویر زیر واکنش فلز سدیم با آب را مشاهده میکنید. فرمول معادله این واکنش به فرم زیر است.
۶. تولید یخ داغ
یخ داغ مادهای است که از جامد کردن محلول فوق سرد سدیم استات به دست می آید. محصول نهایی این واکنش ظاهری شبیه یخ آب را دارد با این تفاوت که دمای یخ تولید شده بسیار بالاست. این ماده برای گرم کردن مواد شیمیایی به کار می رود.

۷. انفجار نیتروگلیرسرین
نیتروگلیسرین یکی از موادی است که انفجاری در دمای بسیار بالا دارد. این ماده هنگام انفجار مقادیر بسیار زیادی انرژی آزاد میکند. دمای انفجار این ماده چیزی حدود ۵۰۰۰ درجه سانتی گراد است.
۸. شکافت هسته ای اورانیوم ۲۳۵
شکافت هستهای فرایندی است که در آن هستهی یک اتم به دو هستهی کوچکتر شکافته میشود.
فرایند شکافت هسته اورانیوم ۲۳۵ چیزی حدود ۵.۲ میلیون برابر سوختن زغال سنگ انرژی آزاد میکند. اگر یک فرایند شکافت در یک مرتبه دو نوترون تولید کند، این دو نوترون نیز میتوانند دو فرایند شکافت دیگر را آغاز کنند. این زنجیره میتواند به همین ترتیب تکرار شود. به این زنجیره فرایندها، زنجیره واکنشهای هستهای میگویند.
۹. تولید دی اکسید کربن از سوختن کربن
تولید دی اکسید کربن از سوختن کربن واکنشی است با تولید مقادیری گرما و نور و بشدت گرماده است.
۱۰. واکنش تولید آب
از واکنش هیدروژن و اکسیژن، آب تولید شده و این واکنش مقادیری گرما و نور آزاد میکند و گرماده است.
۱۱. تولید آمونیاک
از واکنش نیتروژن و هیدروژن در حضور کاتالیست آهن در دمای ۵۰۰ درجه سانتی گراد آمونیاک تولید میشود. این واکنش مقادیری گرما و نور آزاد میکند و گرماده است و خود گرما را به عنوان فراورده آزاد میکند.
برای یادگیری بیشتر درباره مبحث کاتالیست و کاتالیزورها در شیمی علوم هشتم، میتوانید فیلم آموزش علوم تجربی بخش شیمی پایه هشتم را با کلیک روی لینک زیر مشاهده کنید.
۱۲. واکنش تولید کلسیم هیدروکسید
از واکنش آب و کلسیم اکسید، کلسیم هیدروکسید تولید میشود. این واکنش مقادیری گرما و نور آزاد میکند و گرماده است.
۱۳. واکنش روشن شدن دستبندهای نئونی
این واکنش مقادیری نور را به همراه گاز نئون آزاد میکند و گرماده است.

۱۴. تنفس
در فرایند تنفس، انسانها اکسیژن را مصرف کرده و کربن دی اکسید را آزاد میکنند. واکنش شیمایی این فرایند به شکل زیر است:
این فرایند یکی از مهم ترین فرایندهای گرمادهی است که انسانها در زندگی روزمره با آن سروکار دارند.
۱۵. سوختن شمع
سوختن شمع نیز یک واکنش گرماده است. شمع وکس پارافینی است که از هیدروکربنها ساخته شده است. هنگامی که شمع میسوزد با اکسیژن هوا واکنش میدهد و پیوندهای هیدروکربنی شکسته میشوند. این شکستن پیوندها مقادیر زیادی انرژی آزاد میکند. به همین دلیل است که سوختن شمع باعث ایجاد گرما میشود.
از دیگر مثالهای واکنش های گرماده میتوان به فرایند تولید برف، سوختن منابع سوختی، واکنش ترمیت، انجماد، تغلیظ و تصعید نام برد.
مثالهایی دیگر برای تشخیص واکنش گرماده و گرماگیر
در ادامه چند مثال دیگر برای آشنایی بیشتر و تشخیص واکنش گرماده و گرماگیر در این مقاله از مجله فرادرس آورده شده است.
واکنش های زیر برای انجام شدن نیاز به انرژی حرارتی دارند و گرماگیر هستند.
- انحلال آمونیوم کلرید در آب
- انحلال آمونیوم نیترات در آب
- تولید نیتریک اکسید
- واکنش کریستال باریم هیدروکساید اکتاهیدرات با آمونیوم کلراید خشک
- واکنش تیونیل کلراید با کبالت II سولفات هپتاهیدرات
- واکنش اتانوییک اسید و سدیم کربنات
واکنش های زیر طی انجام شدن انرژی حرارتی آزاد میکنند و گرمازا هستند.
- خشک کردن نمکهای آبدار
- ایجاد کاتیون از اتم در فاز گازی
- جداسازی اتمهای مولکول گاز
- جداسازی جفتهای یونی
- روشن کردن کبریت : قسمت مشتعل شوندهی چوب کبریت از موادی مانند فسفر و سولفور تشکیل شدهاست و هنگام سوختن آن بین این مواد و اکسیژن هوا واکنش صورت میگیرد. این فرایند انرژی را به صورت حرارت و آتش و نور آزاد میکند.
علاوه بر مثالهایی که به آنها اشاره شد، با مشاهده محیط اطراف خود همراه میتوانید شماری از واکنشهای گرماده و گرماگیر را مشاهده کنید. تشخیص واکنشهای گرماده و گرماگیر علاوه بر کمک به زندگی روزمره ( برای مثال روشن کردن آتش برای گرم کردن غذا یا محیط) میتواند کمک شایانی به محققان در شناسایی و انجام واکنشهای شیمیایی کند.