واکنش گرماده و گرماگیر | به زبان ساده
برخی از واکنشهای شیمیایی، انرژی واکنش را به شکلهای مختلفی همچون گرما، نور یا صدا آزاد میکنند. واکنش گرماده نامی است که برای این نوع از واکنشهای شیمیایی ذکر میکنند. واکنش گرماده ممکن است به طور خود به خودی روی دهد و سبب افزایش بینظمی یا آنتروپی سیستم شود. در اثر این اتفاق، علامت تغییرات آنتالپی، منفی خواهد بود و همچنین، انرژی آزاد شده نیز با علامت منفی نشان داده میشود. توجه داشته باشید که آزاد شدن گرما در یک واکنش گرماده میتواند به صورت انفجاری هم باشد. در این آموزش به بررسی واکنش گرماده و گرماگیر در شیمی خواهیم پرداخت.


واکنشهای دیگری نیز وجود دارند که برای پیشروی، باید انرژی جذب کنند. به این نوع از واکنشها، واکنش گرماگیر میگویند. به طور معمول، واکنش گرماگیر نمیتواند به طور خودبهخودی انجام بگیرد بلکه باید بر روی سیستم کار انجام شود تا این نوع از واکنشها پیشروی کنند. البته زمانی که تغییرات آنتالپی و آنتروپی به گونهای باشند که انرژی آزاد گیبس به صورت منفی داشته باشیم، این واکنشها نیز به شکل خودبهخودی روی میدهند. زمانی که یک واکنش گرماگیر، انرژی جذب میکند، افت دمایی در طول واکنش روی میدهد. واکنشهای گرماگیر را با افزایش آنتالپی (تغییرات آنتالپی مثبت) و علامت مثبت انرژی، شناسایی میکنند. در این مطلب از مجله فرادرس در مورد واکنشهای گرماده و گرماگیر به زبان ساده صحبت میکنیم.
مثال های واکنش گرماده و گرماگیر
در ادامه، مثالهایی را برای واکنش گرماده و گرماگیر ارائه میکنیم.
فتوسنتز، از جمله نمونههای واکنش گرماگیر است. در این فرآیند، گیاهان از انرژی خورشید برای تبدیل دیاکسید کربن و آب به گلوکز و اکسیژن استفاده میکنند. این واکنش به ازای هر کیلوگرم گلوکز تولیدی، به انرژی نیاز دارد. شکل ساده واکنش فتوسنتز را به صورت زیر نشان میدهیم:
+ نور خورشید
از نمونههای دیگر واکنش گرماگیر میتوان به موارد زیر اشاره کرد:
- حل شدن آمونیوم کلرید در آب
- کراکینگ آلکانها
- تبخیر آب
- ذوب یخ

مثال واکنش گرماده
از نمونههای واکنش گرماده میتوان به واکنش سدیم و کلر و تشکیل نمک طعام اشاره کرد. به ازای هر مول نمک تولیدی، ۴۱۱ کیلوژول انرژی تولید میشود. سایر مثالهای واکنش گرماده در زیر آورده شدهاند.
- واکنش ترمیت (ترمایت)
- واکنش خنثی شدن
- بیشتر واکنشهای پلیمریزاسیون
- سوختن
- شکافت هستهای
- خوردگی فلزات (مثل زنگ زدن آهن)
- حل اسید در آب
بسیاری از واکنشهای گرماده و گرماگیر شامل مواد شیمیایی سمی هستند و همچنین، در اثر این واکنشها گرمای زیادی آزاد یا جذب میشود. از نمونههای یک واکنش گرماده سریع میتوان به حل کردن پودر ماشین لباسشویی به کمک کمی آب بر روی دست اشاره کرد. از جمله واکنشهای گرماگیر نیز میتوان حل پتاسیم کلرید در آب را مثال زد.
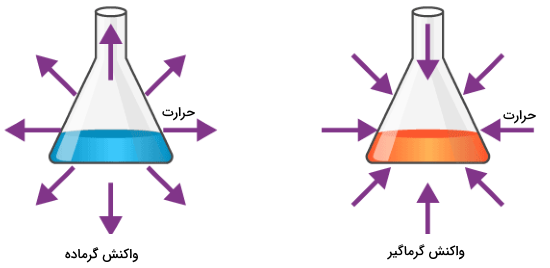
تفاوت واکنش گرماده و گرماگیر
به بیان ساده، واکنشهای گرماگیر از محیط انرژی (به شکل گرما) جذب میکنند. در مقابل، واکنش گرماده انرژی را در محیط آزاد میکند.
در جدول زیر، مقایسهای کلی بین واکنشهای گرماده و گرماگیر انجام شده است.
| واکنش گرماگیر | واکنش گرماده |
| گرما جذب میشود. | گرما آزاد میشود. |
| برای شروع واکنش، باید به آن انرژی داد. | واکنش به طور خودبهخودی روی میدهد. |
| افزایش آنتالپی خواهیم داشت. | کاهش آنتالپی خواهیم داشت. |
تشخیص واکنش گرماده و گرماگیر
به هنگام وقوع یک واکنش گرماده، دمای سیستم افزایش پیدا میکند. در حقیقت، حرارت ایجاد شده در محیط آزاد میشود که نتیجه آن، مقدار منفی گرمای واکنش است. به طور مشابه، یک واکنش گرماگیر با کاهش دمای یک سیستم همراه است. در نهایت، در واکنش گرماگیر، گرمای واکنش، علامت مثبت خواهد داشت.
واکنشهای گرماده و گرماگیر سبب تغییر در سطح انرژی میشوند و بنابراین، تغییرات آنتالپی خواهیم داشت. توجه داشته باشید که توسط سیستم تعیین میشود و محیط، نقشی ندارد. سیستمی که در محیط، گرما (حرارت) آزاد کند، دارای منفی خواهد بود چراکه آنتالپی فرآوردهها کمتر از آنتالپی واکنشدهندهها در سیستم است. واکنشهای زیر را در نظر بگیرید:
آنتالپی واکنشهای بالا، کمتر از صفر است و بنابراین، واکنش گرماده به شمار میآیند. سیستمی از واکنشدهندهها که در یک واکنش گرماگیر، گرما را از محیط جذب میکنند، تغییرات آنتالپی مثبت خواهند داشت. ۲ واکنش زیر، گرماگیر هستند.
ثابت تعادل
ثابت تعادل، رابطه بین غلظت مواد شیمیایی در یک واکنش تحت تعادل شیمیایی را توصیف میکند. طبق اصل لوشاتلیه، اگر تنشی به سیستم وارد شود مانند تغییر دما، فشار یا غلظت، سیستم در جهت مقابله با این تنش، تغییر خواهد کرد تا دوباره به شرایط تعادل برسد. برای واکنش گرماده و گرماگیر، این تنش به صورت تغییر دما رخ میدهد. جهت این نوع از واکنشها را میتوان به کمک ثابت تعادل، بررسی کرد. واکنش زیر را در نظر بگیرید:
ثابت تعادل واکنش بالا، از طریق رابطه زیر بدست میآید:
[A] و ...، غلظت مواد و a و ...، ضرایب استوکیومتری واکنش هستند. در جدول زیر، نحوه پیشبینی جهت پیشرفت واکنش گرماده و گرماگیر به کمک ثابت تعادل آورده شده است.
| واکنش گرماده | واکنش گرماگیر |
| اگر با افزایش دما، کاهش پیدا کنید، واکنش به طرف چپ، پیشروی خواهد کرد. | اگر با افزایش دما، افزایش پیدا کند، واکنش به طرف راست پیشروی خواهد کرد. |
| اگر با کاهش دما، افزایش پیدا کنید، واکنش به طرف راست پیشروی میکند. | اگر با کاهش دما، کاهش پیدا کند، واکنش به طرف چپ پیشروی میکند. |
مثال واکنش هابر
فرض کنید که واکنش زیر در حالت تعادل قرار داشته باشد. غلظت برابر با ۲ مولار و ، برابر با ۴ مولار است. مقدار ثابت تعادل را برای واکنش تولید آمونیاک با غلظت ۳ مولار یا همان فرآیند هابر، بدست آورید.
به کمک ضرایب استوکیومتری واکنش بالا و همچنین رابطه ثابت تعادل، مقدار ثابت تعادل را برای این واکنش محاسبه خواهیم کرد:
معرفی فیلم آموزش علوم تجربی پایه هشتم
با توجه به نیاز دانشآموزان برای دسترسی آنلاین به مباحث درسی، «فرادرس» اقدام به انتشار فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی در قالب آموزشی ۵ ساعته کرده که در ۶ درس تدوین شده است. در درس سوم از این آموزش، واکنشهای گرماگیر و گرماده توضیح داده میشوند. لازم به ذکر است که تمامی دروس، بر اساس فصلبندی کتاب درسی، تدریس خواهند شد به این صورت که در درس یکم، با مخلوطها و انواع روشهای جداسازی مواد آشنا میشویم.
درس دوم و سوم، به بررسی تغییرهای شیمیایی در خدمت زندگی میپردازد و درس چهارم و تا ششم نیز به مبحث اتمها، مدلهای اتمی، یونها، کاتیون و آنیون و ... میپردازد.
آزمون واکنش گرماده و گرماگیر
۱. علامت ΔH نشاندهنده چه چیزی در واکنش گرماده یا گرماگیر است؟
در واکنش گرماده ΔH مثبت و نشاندهنده جذب انرژی است.
در واکنش گرماده ΔH منفی و به معنای آزادسازی انرژی است.
در هر دو نوع واکنش علامت ΔH یکسان باقی میماند.
علامت ΔH تنها در فرایند تعادلی معنا دارد.
علامت ΔH در واکنش گرماده منفی است و به این معناست که انرژی به شکل گرما به محیط آزاد میشود. این ویژگی واکنشهای گرماده را از واکنشهای گرماگیر متمایز میکند، زیرا در واکنش گرماگیر علامت ΔH مثبت است و بیانگر جذب انرژی میباشد.
۲. بر اساس اصل لوشاتلیه، افزایش دما چه اثری بر جهت تعادل واکنش گرماگیر دارد؟
افزایش دما باعث توقف واکنش به طور کامل میشود.
افزایش دما تاثیری بر تعادل واکنش گرماگیر ندارد.
افزایش دما تعادل را به سمت واکنش رفت (محصولات) جابهجا میکند.
افزایش دما تعادل را به سمت واکنش برگشت (واکنشدهندهها) جابهجا میکند.
در واکنش گرماگیر، مطابق اصل لوشاتلیه، اگر دما افزایش یابد، تعادل به سمت محصولها یعنی جهت رفت حرکت میکند، چون سیستم گرمای اضافی را مصرف میکند. برخلاف این حالت، برای واکنش گرماده افزایش دما تعادل را به سمت برگشت میبرد. بنابراین گزاره «افزایش دما تعادل را به سمت واکنش رفت (محصولات) جابهجا میکند» صحیح است و سایر عبارات مانند بیاثر بودن دما یا توقف کامل واکنش مطابق توضیحهای ارائهشده نیستند.
۳. اگر پس از انجام یک واکنش شیمیایی، دمای محیط کاهش یابد و مقدار مثبت گزارش شود، این واکنش جزو کدام دسته قرار میگیرد و ملاک چنین طبقهبندی چیست؟
واکنش گرماده است زیرا گرما آزاد میکند و ΔH منفی دارد.
واکنش تعادلی است چون دما و انرژی آزاد و جذب میشوند.
واکنش گرماگیر است چون انرژی جذب میشود و مثبت است.
واکنش خودبهخودی است چون دما کاهش مییابد و آنتروپی افزایش پیدا میکند.
در واکنشی که دمای محیط کاهش مییابد و مقدار مثبت است، واکنش «گرماگیر» است، زیرا در این وضعیت سیستم از محیط انرژی (گرما) جذب میکند. ملاک این تشخیص آن است که واکنشهای گرماگیر با جذب انرژی باعث افت دمای محیط میشوند و علامت نیز در این واکنشها مثبت است. عبارت «گرما آزاد میکند و ΔH منفی دارد» مربوط به واکنش گرماده است که دما را افزایش میدهد. «افزایش آنتروپی» بدون توجه به جذب گرما معیار قطعی این تشخیص نیست و «تعادلی بودن» به تنهایی به نوع جذب یا آزادسازی انرژی اشاره نمیکند.













سلام خسته نباشید از کجا میتونیم تشخیص بدیم یک واکنش تعادلی گرماگیر است یا گرماده؟
با سلام
مهندس عزیز میکس آب مقطر و اسید سولفوریک را در حجم بالا با دانسیته مشخص با در دمای پایین و بسرعت باید آماده کنیم ممنون میشم راهنمایی کنید
با سلام؛
برای پاسخ به این سؤال میتوانید مطلب «تهیه محلول ها در آزمایشگاه شیمی | به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام مهندس جان .درموردثابت تشکیل آمونیاک در مسئله اخیر توضیحی در مورد عدد۳برای آمونیاک در صورت آورده نشده.درصورتیکه در استوکیومتری واکنش اگردو مول برای نیتروژن درنظر بگیریم آنگاه باید با۶مول هیدوژن واکنش بدهد و۴مول آمونیاک تولید میکند.ممنون میشم پاسخ بدید
با سلام؛
از بازخورد شما بسیار سپاسگزاریم. غلظت آمونیاک تولیدی برابر با ۳ مولار بود که به صورت سوال اضافه شد.
با تشکر از همراهی شما با مجله فرادرس
سلام چطوری میتونیم تشخیص بدیمدما واکنشی که انرژی ازاد شده ذکر نشده
سلام
لطفا متن را اصلاح نمایید چه کسی گفته واکنش گرماگیر الزاما غیر خود به خودی است؟
انحلال بسیاری جامدات گرماگیر و اتفاقا خودبه خودی است به جهت افزایش انتروپی
با سلام؛
از توجه شما سپاسگزاریم. توضیحاتی در رابطه با انرژی آزاد گیبس به متن اضافه شد.
از همراهی شما با مجله فرادرس سپاسگزاریم.